Dysport 500 U Enjeksiyonluk Çözelti İçin Toz İçeren Flakon Kısa Ürün BilgisiKas İskelet Sistemi » Kas Gevşeticiler » Periferik Etkili Kas Gevşeticiler » Diğer İlaçlar » Botulinum Toksini KISA URUN BILGISIDYSPORT ENJEKSIYONLUK ÇÖZELTI IçIn TOZ İÇEREN FLAKONClostridium botulinumtip-A toksin-hemaglutinin kompleksi1 BEŞERI TIBBI ÜRÜNÜN ADIDysport Enjeksiyonluk çözelti için toz içeren flakon2 KALITATIF VE KANTİTATIF BILEŞIMEtkin maddeClostridium botulinumtip A toksin-hemaglutinin kompleksi 500 Ipsen Ünitesi*Yardımcı maddelerİnsan albumin çözeltisi................................................125 mcg Laktoz....................................................................2.5 mg *Bir Ipsen Ünitesi, farelerdeki medyan letal peritoneal doz olarak tanımlanır. 3 FARMASÖTIK FORMEnjeksiyonluk çözelti için toz içeren flakon4 KLINIK ÖZELLIKLER4.1 Terapötik EndikasyonlarDysport; İnme sonrası yetişkin hastalarda kol spastisitesi, İki yaş ve üzeri pediyatrik serebral palsy hastalarında spastisiteden dolayı dinamik equinus ayak deformitesi, Yetişkinlerde spazmodik tortikolis Yetişkinlerde blefarospazm, Yetişkinlerde hemifasiyel spazm, Yetişkinlerde aksiller hiperhidroz, tedavilerinde endikedir. 4.2 Pozoloji ve Uygulama ŞekliDysport üniteleri Dysport'a spesifiktir ve uygulama dozları diğer botulinum toksin tip A preperatlarnın dozlarından farklıdır.Eğitim:Dysport uygun eğitim almış doktorlar tarafından uygulanmalıdır.Kauçuk tıpanın merkezi kısmı olan septumun delinmesi öncesi, hemen alkolle temizlenmelidir. Steril 23 yada 25 G'lik iğne veya lateral canthus uygulama endikasyonlarında 30 G veya glabellar uygulamaları için 29-30 G'lik iğne kullanılmalıdır. İnme sonrası yetişkinlerde kol spastisitesiPozoloji/ Uygulama sıklığı ve süresi:
Önerilen doz, şu 5 kas arası dağıtılmak üzere 1000 ünitedir: flexor digitorum profundus (FDP), flexor digitorum superficialis (FDS), flexor carpi ulnaris (FCU), flexor carpi radialis (FCR) and biceps brachii (BB). |
BB |
FDP |
FDS |
FCU |
FCR |
Total |
|
300-400 |
150 |
150-250 |
150 |
150 |
1000 |
Çocuklarlarda kol spastisitesi:
Çocuklarda kol spastisitesinde Dysport kullanımının güvenlik ve etkinliği belirlenmemiştir.Uygulama şekli:
Dysport mililitrede 500 Ünite içeren bir çözelti elde etmek üzere 1.0 ml sodyum klorür enjeksiyonu B.P. (% 0.9) ile sulandırılmalıdır. Dysport kol spastisitesi tedavisinde yukarıdaki detayları verilen beş kas içine intramüsküler enjeksiyonla uygulanmalıdır.Pediyatrik serebralpalsi spastisitesiPozoloji/ Uygulama sıklığı ve süresi:
Başlangıç önerilen doz, her iki baldır kasına bölünmüş dozlar olarak verilen 20 Ünite/ kg vücut ağırlığıdır. Eğer sadece bir baldır etkilenmişse, 10 ünite/ kg vücut ağırlığı dozu kullanılmalıdır. Eğer başlangıç dozu hedef kaslarda aşırı zayıflığa neden oluyorsa, hedef kaslar çok ufak veya diğer kas gruplarına da birlikte enjeksiyon gerektiriyorsa, bu başlangıç dozunun düşürülmesi düşünülmelidir. Başlangıç dozuna verilen yanıtın değerlendirmesini takiben, daha sonraki tedavi her iki bacak arasında bölünen 10 ünite/kg veya 30 ünite/kg aralığında titre edilebilir. Uygulama başlıca gastrocnemius kasına hedeflenmeli ancak, soleus ve tibialis posterior kaslarına da enjeksiyon düşünülmelidir. Uygulanan maksimum doz 1000 ünite/ hasta'yı aşmamalıdır.
Elektromiyografi kullanımı (EMG) rutin klinik pratikte uygulanmaz ama, en aktif kasların teşhisine yardımcı olabilir.
Klinik iyileşme enjeksiyondan sonraki iki hafta içinde gözlenebilir. Enjeksiyonlar 12 haftadan daha sık olarak uygulanmamalı, ancak yanıtın devamı için yaklaşık olarak her 16 haftada bir tekrarlanmalıdır.
Uygulama şekli:
Serebral palsy spastisitesi tedavi edilirken, Dysport mililitrede 500 Ünite içeren bir çözelti elde etmek için 1.0 ml sodyum klorür enjeksiyonu B.P. ile (% 0.9) sulandırılmalıdır. Pediyatrik serebral palsy spastisitesi tedavi edildiğinde Dysport her iki baldır kaslarına intramüsküler enjeksiyonla uygulanmalıdır.
Spazmodik tortikolis
Pozoloji/ uygulama sıklığı ve süresi:
Yetişkinler ve yaşlılar:
Tortikolis için önerilen dozlar, düşük boyun kası kütlesi mevcut olmayan normal ağırlıktaki yetişkinlerin tüm yaş grubuna uygulanabilir. Azalmış kas kütlesi mevcut yaşlılarda veya belirgin derecede normal ağırlığının altında olan hastalarda azaltılmış dozlar uygun olabilir.
Spazmodik tortikolis tedavisinde önerilen başlangıç dozu, iki ya da üç en aktif boyun kasına uygulanan ve bölünmüş dozlar halinde verilen hasta başına 500 ünitedir.
Rotasyonlu tortikolis için, rotasyona kontralateral olarak sternomastoid kasına 150 ünite ve çene/boyun rotasyon yönüne ipsilateral splenius capitis kasına 350 ünite olmak üzere toplam 500 ünite uygulanır.
Laterokolis için, 350 ünite ipsilateral splenius capitis kasına ve 150 ünite ipsilateral sternomastoid kası içine olmak üzere toplam 500 ünite uygulanır. Omuz yükselmesi olan vakalarda, elektromiyografik bulgular (EMG) veya görülebilir kas hipertrofisine göre, ipsilateral trapezoid ya da levator scapulae kasları tedavi gerektirebilir. Üç kasa enjeksiyon gerektiğinde, 500 Ünite şu şekilde dağıtılır: 300 ünite splenius capitis, 100 ünite sternomastoid ve 100 ünite üçüncü kasa.
Retrokolis için her splenius capitis kasına 250 ünite olmak üzere toplam 500 ünite uygulanır. Eğer yetersiz yanıt gözlenirse, 6 hafta sonra her trapezius kasına 250 üniteye kadar enjeksiyonlar yapılabilir. Bilateral splenii enjeksiyonları boyun kasında zayıflık riskini artırabilir.
Tortikolisin tüm diğer formlarında, en aktif kası teşhis ile tedavi etmek için EMG ve uygulayan doktorun bilgisine ihtiyaç vardır. EMG, zayıf palpasyonlu boyun kası olan fazla kilolu hastalarda, kas içine derin enjeksiyona kılavuz olması için, kompleks olmayan durumlarda başarısız enjeksiyonlar sonrası yeniden değerlendirme için veya tortikolisin tüm kompleks formlarını teşhis etmek için kullanılabilir.
Daha sonraki uygulamalarda, dozlar gözlenen yan etkiler ve klinik yanıta göre ayarlanabilir. Yüksek dozlar özellikle disfaji gibi yan etkilerde artışa neden oluyorsa da, 250- 1000 ünite aralığındaki dozlar önerilir. 1000 ünite üzeri olan dozlar önerilmez.
Tortikolisde semptomların iyileşmesi enjeksiyondan sonraki hafta içinde gözlenebilir. Enjeksiyonlar semptomların yeniden oluşmasını önlemek için gerektiği kadar veya yaklaşık her 12 haftada bir tekrarlanmalıdır.
Çocuklarda spazmodik tortikolisde kullanım:
Çocuklarda spazmodik tortikolisde Dysport kullanımının etkinlik ve güvenliği belirlenmemiştir. .
Uygulama şekli:
Spazmodik tortikolis tedavi edildiğinde, Dysport mililitrede 500 Ünite içeren bir çözelti elde etmek için 1 ml sodyum klorür enjeksiyonu B.P. (% 0.9) ile sulandırılır. Dysport spazmodik tortikolis tedavi edildiğinde yukarıdaki gibi intramüsküler enjeksiyonla uygulanır.
Blepharospazm ve hemifasiyel spazmPozoloji/ Uygulama sıklığı ve süresi:
Yetişki^n ve yaşlılar:
Bilateral blefarospazm tedavisinde önerilen başlangıç dozu her göze 120 ünitedir.
0.1 ml'lik (20 ünitelik) enjeksiyonlar gözün alt ve üst medialine, 0.2 ml'lik (40 ünitelik) enjeksiyonlar ise, her bir gözün alt ve üst orbicularis oculi kaslarının, preseptal ile orbital kısımları arasındaki kavşak içine lateral olarak yapılmalıdır.
Üst göz kapağına enjeksiyonlar için iğne levator kasından sakınılarak merkezden dışarıya doğru yapılmalıdır. Aşağıdaki diyagram, bu enjeksiyonların yerlerini göstermek için yardımcıdır. Semptomların iyileşmesi, iki- dört gün içinde başlayabilir ve iki hafta içinde maksimum etkiye erişebilir.
Enjeksiyonlar, semptomların yeniden oluşumunu önlemeye yetecek kadar veya yaklaşık olarak her 12 haftada bir tekrarlanmalıdır. Bu şekildeki daha sonraki uygulamalarda doz her göz için 80 üniteye kadar azaltılabilir- önceden tanımlandığı şekilde her gözün alt ve üstüne: 0.1 ml (20 ünite) medial olarak ve 0.1 ml (20 ünite) lateral olarak. Doz, daha sonra medial alt göz kapağı enjeksiyonunun bırakılmasıyla her bir göz için 60 üniteye düşürülebilir.
0.1 ml
0.2 ml
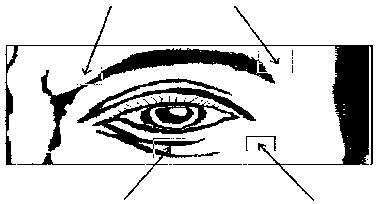 0.1 ml 0.2 ml
0.1 ml 0.2 ml
Unilateral blefarospazm vakalarında enjeksiyonlar sadece hasarlı gözle sınırlandırılmalıdır. Hemifasiyal spazmı olan hastalar unilateral blefarospazmdaki gibi tedavi edilmelidir. Önerilen dozlar yaşlılar dahil tüm yaş grubundaki yetişkinlere uygulanabilir.
Çocuklarda blefarospazm ve hemifasiyal spazmda kullanım:
Çocuklarda blefarospazm ve hemifasiyal spazmda Dysport kullanımının güvenlik ve etkinliği belirlenmemiştir.
Uygulama şekli:
Blepharospazm ve hemifasiyal spazm tedavi edildiğinde, Dysport mililitrede 200 ünite içeren bir çözelti elde etmek için 2.5 ml sodyum klorür enjeksiyonu B.P.(% 0.9) ile sulandırılırorbicularis oculi
kasının preseptal ile orbital kısımları arası kavşağa medial ve lateral subkütan enjeksiyonla uygulanır.
Aksiller hiperhidroz
Pozoloji/ uygulama sıklığı ve süresi:
Yetişkinler ve yaşlılar:
Önerilen başlangıç dozu her koltuk altı için 100 ünitedir. Eğer istenen sonuç elde edilemezse, sonraki enjeksiyonlarda her bir koltuk altı için 200 üniteye kadar çıkılabilir. Enjeksiyon bölgesi uygulama öncesi iyot-nişasta testi ile belirlenebilir. Her iki koltuk altı da temizlenmeli ve dezenfekte edilmelidir. Sonrasında her bir enjeksiyon noktasına 10 ünite olacak şekilde deri içine 10 noktada (100 ünite/koltuk altı) enjeksiyonlar uygulanır. Maksimum etki enjeksiyondan 2 hafta sonra gözlenir. Önerilen doz, vakaların çoğunluğunda yaklaşık 48 hafta kadar terlemenin yeterince baskılanmasını temin eder. Takip eden enjeksiyon zamanı, 12 haftadan önce olmayacak şekilde kişiye göre ayarlanmalıdır. Tekrarlanan dozların gittikçe artan bir etkisinin olduğuna yönelik kanıtlar vardır. Bundan dolayı hastaya verilen her bir tedavinin süresi kişiye özgü olarak belirlenmelidir.
Çocuklarda aksiller hiperhidrozda kullanım:
Çocuklarda aksiller hiperhidrozda Dysport kullanımının güvenlik ve etkinliği belirlenmemiştir.
Uygulama şekli:
Dysport flakonu 2.5 ml enjeksiyonluk sodyum klorür solüsyonu B.P. (% 0.9) ile sulandırılırsa, Dysport'un her mililitresi 200 ünite içeren bir çözelti verir. Aşırı koltuk altı terlemesi tedavisinde, Dysport enjeksiyonları 10 noktadan deri içine uygulanır.
Özel popülasyonlara ilişkin ek bilgiler: Böbrek/ karaciğer yetmezliği:
Özel bir doz ayarlaması gerekli değildir.
Pediyatrik popülasyon:
2 yaşının üzeri çocuklarda pediyatrik serebral palsi spastisite tedavisinde kullanılır. Çocuklarda aşırı koltuk altı terlemesi, hemifasiyal paralizi, blefarospazm spazmodik tortikolis, kol spastisitesi tedavilerinde Dysport'un etkinlik ve güvenilirliği gösterilmemiştir.
Geriyatrik popülasyon:
Klinik çalışmalar dozaj ayarlaması gerekliliğini göstermemiştir.
4.3 Konrendikasyonlar
Dysport bileşenlerden herhangi birine karşı aşırı duyarlılığı bilinen kişilerde kontrendikedir.
4.4 Özel kullanım uyarıları ve önlemleri
Uygulama yerinden diğer bölgelere etkinin yayılmasından dolayı yan etkiler bildirilmiştir (kısım 4.8'e bakınız). Terapötik dozlarla tedavi gören hastalarda aşırı kas zayıflığı olabilir. Bu şekildeki istenmeyen etkilerin oluşum riski önerilen dozun aşılmaması ve en düşük etkili dozun kullanılmasıyla azaltılabilir.
Dysport belirgin defektif nöro-müsküler iletimin klinik veya sub-klinik kanıtlarını gösteren hastalarda yakın gözlem altında ve dikkatli olarak kullanılmalıdır (ör; miyastenia gravis). Bu gibi hastalarda Dysport gibi ajanlara hassasiyet artmıştır ve aşırı kas zayıflığı oluşabilir.
Dysport solunum ve yutma zorluğu bulunan hastalarda dikkatli kullanılmalıdır. Çünkü bu problemler toksinin kaslara dağılmasından sonar daha da kötüleşebilir. Aspirasyon nadir durumlarda oluşmuştur ve kronik solunum hastalığı olan spazmodik tortikolisli hastalar tedavi edildiğinde bir risk oluşturabilir.
Botulinum toksin tip A içeren bir ürüne alerjisi olan hastalarda dikkat edilmelidir.
Botulinum toksin A veya B ile tedavi sonrasında asteni veya pnömopati, disfaji ile beraber çok nadir ölüm vakaları bildirilmiştir.
Defektif nöro-müsküler iletime neden olan hastalığı bulunan kişilerde, yutma ile solunumda zorluk daha fazla risk altında olmalarına sebep olabilir. Bu hastalarda, tedavi doktor kontrolünde ve ancak tedavinin yararı risklere karşı ağır bastığında uygulanmalıdır.
Yutma, konuşma veya solunum hastalığı durumlarında, hastalar ve bakıcıları, ara tıbbi tedavi gerekliliği konusunda uyarılmalıdır.
Çocuklarda serebral palsi tedavisi için, Dysport sadece 2 yaşının üzerindeki çocuklarda kullanılmalıdır.
Dysport'un önerilen doz ve uygulama sıklığı aşılmamalıdır (Bölüm 4.2'ye bakınız).
Dysport alan hastalarda nadiren botulinum toksisine karşı antikor oluşumu bildirilmiştir. Klinik olarak nötralize edici antikorlar tedaviye karşı yanıtta kötüleşmeye neden olabilir veya dozun artırılmasını gerektirebilir.
Dysport tek bir durumda tek bir hastayı tedavi etmek için kullanılmalıdır. Arta kalan kullanılmamış ürün Kısım 6.6. ile uyum içinde atılmalıdır. Ürünün hazırlanması, uygulanması, kullanılmamış olan çözeltinin inaktivasyon ve atılımı için özel dikkat edilmelidir.
İntramüsküler enjeksiyon şeklinde uygulandığında Dysport, önerilen enjeksiyon yerinde iltihap, enfeksiyon veya uzun kanama süresi gösteren hastalarda sadece, çok gerekli olduğunda kullanılmalıdır.
Bu ürün az miktarda insan albumini içermektedir. Viral enfeksiyonların geçiş riski, insan kanı veya kan ürünlerinin kullanımını takiben kesin olarak hariç tutulamaz.
Bu ürün 2.5 gram laktoz içerir. Nadir kalıtımsal galaktoz intoleransı, lapp laktoz yetmezliği ya da glikozgalaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Botulinum toksininin etkileri, nöromüsküler fonksiyonu direkt veya indirekt olarak etkileyen ilaçlarla artabilir (Ör; aminoglikozidler, kürar benzeri non-depolarizan blokörler) ve bu ilaçlar botulinum toksini ile tedavi gören hastalarda dikkatli kullanılmalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Pediyatrik popülasyon:
Pediyatrik popülasyonda etkileşim çalışmaları yapılmamıştır.
Geriyatrik popülasyon:
Geriyatrik popülasyonda etkileşim çalışmaları yapılmamıştır.
4.6 Gebelik ve laktasyon Genel Tavsiye:
Gebelik Kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/ Doğum kontrolü (Kontrasepsiyon):
Dysport ile ilgili hayvanlarda teratolojik ve diğer üreme çalışmaları uygulanmamıştır. Hamile kadınlarda Dysport kullanım ve etkinliği gösterilmediğinden, hamilelik sırasında Dysport kullanılmamalı ve tedavi süresince etkili doğum kontrolü uygulanmalıdır.
Gebelik dönemi:
Hamilelik sırasında Dysport kullanımı önerilmez.
Laktasyon dönemi:
Dysport emzirme döneminde kullanılmamalıdır.
Üreme yeteneği/ Fertilite:
Yüksek dozlar doza bağlı olarak fertilitede azalma ve testiküler atrofiye neden olmuştur. Embriyo üzerine yan etkiler görülmemiştir.
4.7 Araç ve makine kullanımı üzerindeki etkiler
Yan etki riski olarak kas güçsüzlüğü araç ve makine kullanımını etkileyebilir.
4.8 İstenmeyen etkiler
Çok yaygın >1/10; Yaygın >1/100,<1/10; Yaygın olmayan >1/1000, <1/100; Seyrek >1/10 000, <1/1000; Çok seyrek <1/10 000
Klinik çalışma programında Dysport ile tedavi gören hastalarda yaklaşık olarak % 25 yan etki bildirilmiştir. Aşağıdaki yan etkiler aksillar hiperhidroz, inme veya serebral palsi ile ilişkili spastisite, tortikoliz, hemifasiyel spazm, blefarospazm endikasyonlarına karşı tedavi gören hastalarda gözlenmiştir.
Sinir sistemi hastalıkları:
Seyrek: Nevraljik kas erimesi (Nevraljik amyotrofi)
Deri ve subkütan doku hastalıkları
Yaygın değil: Kaşıntı Seyrek: Deride döküntü
Genel hastalıklar ve uygulama yeri koşulları
Yaygın: Güçsüzlük, yorgunluk, grip-benzeri sendrom ve ağrı/ enjeksiyon bölgesinde morarma
İlaveten, kişisel endikasyona spesifik şu yan etkiler bildirilmiştir: inme sonrası yetişkinlerde kol spastisitesi
Hafif ve orta şiddetteki aşağıdaki yan etkiler, yetişkinlerde inme sonrası kol spastisitesi için Dysport ile tedavi gören hastalarda bildirilmiştir:
Gastrointestinal hastalıklar
Yaygın: Disfaji
Kas-iskelet ve konnektif doku hastalıkları
Yaygın: Kolda kas güçsüzlüğü
Yaralanma, zehirlenme ve yöntemsel komlikasyonlar
Yaygın: Kazaren yaralanma/ düşme
Disfaji bölünmüş veya tek bir doz şeklinde uygulandığında 2700 üniyeti aşan dozlarda bildirilmiştir.
Serebral palsiden dolayı pediyatrik bacak spastisitesi
Hafif ve orta şiddetteki aşağıdaki yan etkiler serebral palsiden dolayı pediyatrik bacak spastisitesi için Dysport ile tedavi gören hastalarda gözlenmiştir:
Gastrointestinal hastalıklar
Yaygın: Diyare
Kas-iskelet ve konnektif doku hastalıkları
Yaygın: Bacak kasında güçsüzlük
Böbrek ve üriner hastalıklar
Yaygın: İdrar kaçırma
Genel hastalıklar ve uygulama yeri koşulları
Yaygın: Anormal duruş
Yaralanma, zehirlenme ve yöntemsel komplikasyonlar
Yaygın: Düşmeden dolayı kazaren incinme
Düşmeden dolayı kazaren incinme ve anormal duruş, ambulant ve denge ile ilişkili diğer kaslara Dysport yayılması ve/veya hedef kaslarda aşırı zayıflıktan dolayı oluşabilir.
Spasmodik tortikolis
Hafif ve orta şiddetteki, aşağıdaki yan etkiler spazmodik tortikolis için Dysport ile tedavi gören hastalarda gözlenmiştir:
Sinir sistemi hastalıkları
Yaygın: Disfoni Yaygın değil: Baş ağrısı
Göz hastalıkları
Yaygın değil: Diplopi, görmede bulanıklık
Solunum, torasik ve mediastinal hastalıklar
Seyrek: Solunum hastalıkları
Gastrointestinal hastalıklar
Çok yaygın: Disfaji Yaygın değil: Ağız kuruluğu
Kas-iskelet ve konnektif doku hastalıkları
Yaygın: Boyun kasında güçsüzlük.
Disfaji, sternomastoid kasına enjeksiyonu takiben daha sık olarak oluşmakta ve dozla ilişkili olarak görünmektedir. Semptomlar iyileşinceye kadar hafif diyet gereklidir.
Blefarospasm ve hemifasiyel spasm
Aşağıdaki hafif ve orta şiddetteki yan etkiler, hemifasiyel spazm ve blefarospazm için Dysport ile tedavi gören hastalarda gözlenmiştir:
Sinir sistemi hastalıkları
Yaygın: Yüz kaslarında güçsüzlük Yaygın değil: Yüz sinirlerinde felç
Göz hastalıkları
Çok yaygın: Pitoz
Yaygın: Diplopi, gözde kuruluk, gözde yaşarma Seyrek: Oftalmopleji
Deri ve subkütan deri hastalıkları
Yaygın: Göz kapağında ödem
Yan etkiler, diğer yakın kas gruplarının geçici olarak paralizisi, Dysport'un derin veya yer yanlışlığı enjeksiyonlarından dolayı oluşabilir.
Aksiller hiperhidroz
Hafif ve orta şiddetteki aşağıdaki yan etkiler aksiller hiperhidroz için Dysport ile tedavi gören hastalarda gözlenmiştir:
Deri ve subkütan deri hastalıkları
Yaygın: Kompensatuvar terleme
Pazarlama sonrası deneyim
Pazarlama sonrası kullanım sırasında firmaya bildirilen yan etki profili, ürünün farmakolojisini yansıtır ve klinik çalışmalarda görülenlerle aynıdır. Nadir aşırı duyarlılık reaksiyonları bildirilmiştir. Şiddetli anafilaktik şok veya anafilaksi vakaları bildirilmemiştir.
Enjeksiyon yerinden diğer yerlere toksinin dağılma etkisinden dolayı oluşan yan etkiler, seyrek olarak bildirilmiştir (aşırı kas zayıflığı, disfaji, öldürücü olabilen aspirasyon pnömonisi) (kısım 4.4'e bakınız).
4.9 Doz aşımı ve tedavisi
Aşırı dozlar uzakta ve derin nöro-müsküler paralizi oluşturabilir. Aşırı dozlar solunum kaslarının paralizisi neden olduğunda solunum desteği gerekebilir. Spesifik bir antidot yoktur; antitoksinin yararlı olması beklenmez ve genel destekleyici tedavi önerilir.
Aşırı dozaj kan dolaşımına nörotoksin geçişinin artmasına yol açabilir ve oral botulinum zehirlenmesi etkileri ile ilişkili komplikasyonlara yol açabilir.
Gerekli olduğunda semptomatik tedavi uygulanmalıdır. Aşırı dozaj durumunda hasta sistemik güçsüzlük veya kas paralizisi etkileri bakımından bir kaç hafta boyunca tıbbi olarak izlenmelidir.
5 FARMAKOLOJIK ÖZELLIKLER
5.1 Farmakodinamik özellikler
Farmakoterapötik grup:ATC kodu:
M03AX01
Clostridium botulinum tip A toksin-hemaglutinin kompleksi asetilkolin salıverilmesine karşı proksimal bölgede presinaptik etkiyle nöromüsküler kavşakta periferik kolinerjik transmisyonu bloke eder. Toksin, transmitter verilmesinde aracı olan Ca+2 ile tetiklenen olayları antagonize ederek sinir ucunda etki gösterir. Postganglionik kolinerjik transmisyonu ya da postganglionik sempatik transmisyonu etkilemez.
Toksinin etkisi presinaptik sinir membranına hızlı bir şekilde bağlandığı yerde başlar. İkinci basamak, toksinin presinaptik membranı geçtiği internalizasyon basamağıdır. Son olarak, toksin Ca+2 aracılı asetilkolin salınımını inhibe eder; böylece son plak potansiyelini azaltır ve paralizise neden olur.
İmpuls geçişinin yeniden kazanılması yeni sinir terminallerinin oluşması ile dereceli bir şekilde oluşur, post sinaptik motor son plağı ile temas gerçekleştirilir. Proses deney hayvanlarında 6-8 hafta sürer.
5.2 Farmakokinetik özellikler
Genel özellikler:
Botulinum toksini ile farmakokinetik çalışmalar, yüksek potensi, az dozları içermesi, bileşiğin geniş moleküler ağırlığı, yeterli yüksek spesifik aktivite oluşturmak için toksinin işaretlenme güçlüğü nedeniyle hayvanlarda pek çok probleme neden olmuştur. I125 işaretli toksin kullanılarak yapılan çalışmalar reseptör bağlanmasının spesifik ve doyurulabilir olduğunu, toksin reseptörlerinin yüksek dansitesinin yüksek potens sağlamada önemli faktör olduğunu göstermiştir. Maymunlardaki doz ve zaman yanıtları düşük dozların 2-3 günlük gecikmeyle enjeksiyondan 5-6 gün sonra pik etkisini yaptığını göstermiştir. Kas paralizisi ve oküler değişiklikler ile ölçülen etki süresi 2 hafta ile 8 ay arasında değişir. Bu örnek aynı zamanda insanlarda da görülür ve nöromüsküler kavşaktaki değişikliklere, internalizasyona, bağlanma prosesine atfedilebilir.
Emilim:
Botulinum toksini tip A'nın önerilen dozlarda intramüsküler enjeksiyonunu takiben periferik kanda ölçülebilir düzeylerde bulunması beklenmez.
Dağılım:
Her tedavide uygulanan nörotoksinin önerilen miktarları, başka bir nöromüsküler disfonksiyonu bulunmayan hastalarda sistemik ya da klinik etkilere neden olmaz.
Biyotransformasyon:
Klinik çalışmalar Dysport uygulama yerinden uzaktaki kaslarda klinik elektromiyografik parametrelerde değişiklikler olduğunu göstermiştir. Bu toksinin kan dolaşımıyla yayılması, retro- veya orto- derecede aksonal iletime uğraması, üçüncü, merkezi ya da teşhis edilemeyen bölgelerde toksinin etkilerine bağlanabilir.
Eliminasyon:
Intramüsküler olarak uygulanan toksinin sistemik dolaşıma katılarak eliminasyonu ufak düzeylerdedir.
Doğrusallık/ doğrusal olmayan durum:
Dysport uygulanan doza bağlı olarak doğrusal bir atılım gösterir.
5.3 Klinik öncesi güvenlilik verileri
Kısa ürün bilgilerinin diğer kısımlarında bulunmayan ve doktorlarlara verilebilecek başka bir klinik öncesi veri bulunmamaktadır.
6 FARMASÖTIK ÖZELLIKLER
6.1 Yardımcı maddelerin listesi
İnsan albumin çözeltisi, laktoz
6.2 Geçimsizlikler
Bu tıbbi ürün, kısım 4.2'de bildirilenler hariç diğer tıbbi ürünlerle karıştırılmamalıdır. Kısım 4.2'de bildirilenler hariç diğer tıbbi ürünlerle geçimsizlik çalışmaları yapılmamıştır.
6.3 Raf-ömrü
24 ay
6.4 Saklamaya yönelik özel tedbirler
+ 2°C ve + 8°C arası sıcaklıklarda (buzdolabında) saklanmalıdır. Dondurmayınız. Sulandırıldıktan sonra hemen kullanım önerilir. Buna karşın, çözeltinin 8 saat boyunca stabil kaldığı gösterilmiştir.
6.5 Ambalajın niteliği ve içeriği Kap/ kapak yapısı:
3 ml kapasitede tip 1 cam flakon. 13 mm'lik bromobütil liyofilize kapaklar, 13 mm'lik merkezi delikli, sıkıştırmalı aluminyum mühürle kapatılmıştır.
Ambalajın içeriği:
Sulandırma için beyaz liyofilize toz.
6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Botulinum toksini ısı ve bazı kimyasal ürünlere karşı çok hassastır.
Liyofilize ürünün dökülmesi durumunda;
Dondurulmuş- kurutulmuş ürün döküldüğünde sodyum hipoklorit çözeltisi (ağartıcı) emdirilmiş absorban materyal kullanılarak,
Sulandırılmış ürün döküldüğünde kuru, absorban materyal ile silinmelidir.
Kontamine olan yüzeyler, sodyum hipoklorit çözeltisi (ağartıcı) emdirilmiş absorban materyal kullanılarak temizlenmeli, sonra kurutulmalıdır.
Flakon kırıldığında, yukarıdaki şekilde işlem görmelidir. Kırılan cam parçaları dikkatlice toplanmalı, derinin kesilmesinden sakınılarak, dikkatlice ürün silinmelidir.
Eğer ürün deri ile temasa girerse, sodyum hipoklorit çözeltisi (ağartıcı) ile yıkanmalı ve sonra bol su ile yıkanmalıdır.
Eğer ürün gözle temasa girerse, bol su veya göz yıkama çözeltisiyle yıkanmalıdır.
Kontamine materyallerin elden çıkarılması için öneriler
Boşalan iğne, şırınga ve flakonlar kullanım sonrası atık için tasarlanmış özel kaplara konulmalıdır.
Kontamine materyaller (absorban giysi, eldiven, ampul parçaları) atık için tasarlanmış, delinmez kutular içine yerleştirilmelidir.
Sadece tek bir kullanım içindir. Kullanılmamış her bir çözelti atılmalıdır. Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği ne uygun olarak imha edilmelidir. Çevreyi korumak amacıyla kullanılmayan DYSPORT şehir suyuna veya çöpe atılmamalıdır. Kullanılmamış olan ürünler ya da atık materyaller, yerel düzenlemelere uygun olarak atılmalıdır.
7 RUHSAT SAHIBI
Gen İlaç ve Sağlık Ürünleri San. Ve Tic. Ltd. Şti. Mustafa Kemal Mah., 2119. Sok., No:3, D:2-3, 06520, Çankaya/ ANKARA Tel: 0312 219 62 19 Fax: 0312 219 60 10
8 RUHSAT NUMARASI
112/92
9 İLK RUHSAT TARIHI/ RUHSAT YENILEME TARIHI
İlk ruhsat tarihi: 31/07/2002
Ruhsat yenileme tarihi:
31/07/2007
10 KÜB'ÜN YENILENME TARIHI
Yetişki^n ve yaşlılar:
Bilateral blefarospazm tedavisinde önerilen başlangıç dozu her göze 120 ünitedir.0.1 ml'lik (20 ünitelik) enjeksiyonlar gözün alt ve üst medialine, 0.2 ml'lik (40 ünitelik) enjeksiyonlar ise, her bir gözün alt ve üst orbicularis oculi kaslarının, preseptal ile orbital kısımları arasındaki kavşak içine lateral olarak yapılmalıdır.
Üst göz kapağına enjeksiyonlar için iğne levator kasından sakınılarak merkezden dışarıya doğru yapılmalıdır. Aşağıdaki diyagram, bu enjeksiyonların yerlerini göstermek için yardımcıdır. Semptomların iyileşmesi, iki- dört gün içinde başlayabilir ve iki hafta içinde maksimum etkiye erişebilir.
Enjeksiyonlar, semptomların yeniden oluşumunu önlemeye yetecek kadar veya yaklaşık olarak her 12 haftada bir tekrarlanmalıdır. Bu şekildeki daha sonraki uygulamalarda doz her göz için 80 üniteye kadar azaltılabilir- önceden tanımlandığı şekilde her gözün alt ve üstüne: 0.1 ml (20 ünite) medial olarak ve 0.1 ml (20 ünite) lateral olarak. Doz, daha sonra medial alt göz kapağı enjeksiyonunun bırakılmasıyla her bir göz için 60 üniteye düşürülebilir.
0.1 ml
0.2 ml
 0.1 ml 0.2 ml
0.1 ml 0.2 mlUnilateral blefarospazm vakalarında enjeksiyonlar sadece hasarlı gözle sınırlandırılmalıdır. Hemifasiyal spazmı olan hastalar unilateral blefarospazmdaki gibi tedavi edilmelidir. Önerilen dozlar yaşlılar dahil tüm yaş grubundaki yetişkinlere uygulanabilir.
Çocuklarda blefarospazm ve hemifasiyal spazmda kullanım:
Çocuklarda blefarospazm ve hemifasiyal spazmda Dysport kullanımının güvenlik ve etkinliği belirlenmemiştir.Uygulama şekli:
Blepharospazm ve hemifasiyal spazm tedavi edildiğinde, Dysport mililitrede 200 ünite içeren bir çözelti elde etmek için 2.5 ml sodyum klorür enjeksiyonu B.P.(% 0.9) ile sulandırılırorbicularis oculi
kasının preseptal ile orbital kısımları arası kavşağa medial ve lateral subkütan enjeksiyonla uygulanır.Aksiller hiperhidroz
Pozoloji/ uygulama sıklığı ve süresi:
Yetişkinler ve yaşlılar:
Önerilen başlangıç dozu her koltuk altı için 100 ünitedir. Eğer istenen sonuç elde edilemezse, sonraki enjeksiyonlarda her bir koltuk altı için 200 üniteye kadar çıkılabilir. Enjeksiyon bölgesi uygulama öncesi iyot-nişasta testi ile belirlenebilir. Her iki koltuk altı da temizlenmeli ve dezenfekte edilmelidir. Sonrasında her bir enjeksiyon noktasına 10 ünite olacak şekilde deri içine 10 noktada (100 ünite/koltuk altı) enjeksiyonlar uygulanır. Maksimum etki enjeksiyondan 2 hafta sonra gözlenir. Önerilen doz, vakaların çoğunluğunda yaklaşık 48 hafta kadar terlemenin yeterince baskılanmasını temin eder. Takip eden enjeksiyon zamanı, 12 haftadan önce olmayacak şekilde kişiye göre ayarlanmalıdır. Tekrarlanan dozların gittikçe artan bir etkisinin olduğuna yönelik kanıtlar vardır. Bundan dolayı hastaya verilen her bir tedavinin süresi kişiye özgü olarak belirlenmelidir.Çocuklarda aksiller hiperhidrozda kullanım:
Çocuklarda aksiller hiperhidrozda Dysport kullanımının güvenlik ve etkinliği belirlenmemiştir.Uygulama şekli:
Dysport flakonu 2.5 ml enjeksiyonluk sodyum klorür solüsyonu B.P. (% 0.9) ile sulandırılırsa, Dysport'un her mililitresi 200 ünite içeren bir çözelti verir. Aşırı koltuk altı terlemesi tedavisinde, Dysport enjeksiyonları 10 noktadan deri içine uygulanır.Özel popülasyonlara ilişkin ek bilgiler: Böbrek/ karaciğer yetmezliği:
Özel bir doz ayarlaması gerekli değildir.Pediyatrik popülasyon:
2 yaşının üzeri çocuklarda pediyatrik serebral palsi spastisite tedavisinde kullanılır. Çocuklarda aşırı koltuk altı terlemesi, hemifasiyal paralizi, blefarospazm spazmodik tortikolis, kol spastisitesi tedavilerinde Dysport'un etkinlik ve güvenilirliği gösterilmemiştir.Geriyatrik popülasyon:
Klinik çalışmalar dozaj ayarlaması gerekliliğini göstermemiştir.4.3 Konrendikasyonlar
Dysport bileşenlerden herhangi birine karşı aşırı duyarlılığı bilinen kişilerde kontrendikedir.4.4 Özel kullanım uyarıları ve önlemleri
Uygulama yerinden diğer bölgelere etkinin yayılmasından dolayı yan etkiler bildirilmiştir (kısım 4.8'e bakınız). Terapötik dozlarla tedavi gören hastalarda aşırı kas zayıflığı olabilir. Bu şekildeki istenmeyen etkilerin oluşum riski önerilen dozun aşılmaması ve en düşük etkili dozun kullanılmasıyla azaltılabilir.Dysport belirgin defektif nöro-müsküler iletimin klinik veya sub-klinik kanıtlarını gösteren hastalarda yakın gözlem altında ve dikkatli olarak kullanılmalıdır (ör; miyastenia gravis). Bu gibi hastalarda Dysport gibi ajanlara hassasiyet artmıştır ve aşırı kas zayıflığı oluşabilir.
Dysport solunum ve yutma zorluğu bulunan hastalarda dikkatli kullanılmalıdır. Çünkü bu problemler toksinin kaslara dağılmasından sonar daha da kötüleşebilir. Aspirasyon nadir durumlarda oluşmuştur ve kronik solunum hastalığı olan spazmodik tortikolisli hastalar tedavi edildiğinde bir risk oluşturabilir.
Botulinum toksin tip A içeren bir ürüne alerjisi olan hastalarda dikkat edilmelidir.
Botulinum toksin A veya B ile tedavi sonrasında asteni veya pnömopati, disfaji ile beraber çok nadir ölüm vakaları bildirilmiştir.
Defektif nöro-müsküler iletime neden olan hastalığı bulunan kişilerde, yutma ile solunumda zorluk daha fazla risk altında olmalarına sebep olabilir. Bu hastalarda, tedavi doktor kontrolünde ve ancak tedavinin yararı risklere karşı ağır bastığında uygulanmalıdır.
Yutma, konuşma veya solunum hastalığı durumlarında, hastalar ve bakıcıları, ara tıbbi tedavi gerekliliği konusunda uyarılmalıdır.
Çocuklarda serebral palsi tedavisi için, Dysport sadece 2 yaşının üzerindeki çocuklarda kullanılmalıdır.
Dysport'un önerilen doz ve uygulama sıklığı aşılmamalıdır (Bölüm 4.2'ye bakınız).
Dysport alan hastalarda nadiren botulinum toksisine karşı antikor oluşumu bildirilmiştir. Klinik olarak nötralize edici antikorlar tedaviye karşı yanıtta kötüleşmeye neden olabilir veya dozun artırılmasını gerektirebilir.
Dysport tek bir durumda tek bir hastayı tedavi etmek için kullanılmalıdır. Arta kalan kullanılmamış ürün Kısım 6.6. ile uyum içinde atılmalıdır. Ürünün hazırlanması, uygulanması, kullanılmamış olan çözeltinin inaktivasyon ve atılımı için özel dikkat edilmelidir.
İntramüsküler enjeksiyon şeklinde uygulandığında Dysport, önerilen enjeksiyon yerinde iltihap, enfeksiyon veya uzun kanama süresi gösteren hastalarda sadece, çok gerekli olduğunda kullanılmalıdır.
Bu ürün az miktarda insan albumini içermektedir. Viral enfeksiyonların geçiş riski, insan kanı veya kan ürünlerinin kullanımını takiben kesin olarak hariç tutulamaz.
Bu ürün 2.5 gram laktoz içerir. Nadir kalıtımsal galaktoz intoleransı, lapp laktoz yetmezliği ya da glikozgalaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Botulinum toksininin etkileri, nöromüsküler fonksiyonu direkt veya indirekt olarak etkileyen ilaçlarla artabilir (Ör; aminoglikozidler, kürar benzeri non-depolarizan blokörler) ve bu ilaçlar botulinum toksini ile tedavi gören hastalarda dikkatli kullanılmalıdır.Özel popülasyonlara ilişkin ek bilgiler:
Pediyatrik popülasyon:
Pediyatrik popülasyonda etkileşim çalışmaları yapılmamıştır.Geriyatrik popülasyon:
Geriyatrik popülasyonda etkileşim çalışmaları yapılmamıştır.4.6 Gebelik ve laktasyon Genel Tavsiye:
Gebelik Kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/ Doğum kontrolü (Kontrasepsiyon):
Dysport ile ilgili hayvanlarda teratolojik ve diğer üreme çalışmaları uygulanmamıştır. Hamile kadınlarda Dysport kullanım ve etkinliği gösterilmediğinden, hamilelik sırasında Dysport kullanılmamalı ve tedavi süresince etkili doğum kontrolü uygulanmalıdır.Gebelik dönemi:
Hamilelik sırasında Dysport kullanımı önerilmez.Laktasyon dönemi:
Dysport emzirme döneminde kullanılmamalıdır.Üreme yeteneği/ Fertilite:
Yüksek dozlar doza bağlı olarak fertilitede azalma ve testiküler atrofiye neden olmuştur. Embriyo üzerine yan etkiler görülmemiştir.4.7 Araç ve makine kullanımı üzerindeki etkiler
Yan etki riski olarak kas güçsüzlüğü araç ve makine kullanımını etkileyebilir.4.8 İstenmeyen etkiler
Çok yaygın >1/10; Yaygın >1/100,<1/10; Yaygın olmayan >1/1000, <1/100; Seyrek >1/10 000, <1/1000; Çok seyrek <1/10 000
Klinik çalışma programında Dysport ile tedavi gören hastalarda yaklaşık olarak % 25 yan etki bildirilmiştir. Aşağıdaki yan etkiler aksillar hiperhidroz, inme veya serebral palsi ile ilişkili spastisite, tortikoliz, hemifasiyel spazm, blefarospazm endikasyonlarına karşı tedavi gören hastalarda gözlenmiştir.
Sinir sistemi hastalıkları:
Seyrek: Nevraljik kas erimesi (Nevraljik amyotrofi)
Deri ve subkütan doku hastalıkları
Yaygın değil: Kaşıntı Seyrek: Deride döküntüGenel hastalıklar ve uygulama yeri koşulları
Yaygın: Güçsüzlük, yorgunluk, grip-benzeri sendrom ve ağrı/ enjeksiyon bölgesinde morarma
İlaveten, kişisel endikasyona spesifik şu yan etkiler bildirilmiştir:
inme sonrası yetişkinlerde kol spastisitesi
Hafif ve orta şiddetteki aşağıdaki yan etkiler, yetişkinlerde inme sonrası kol spastisitesi için Dysport ile tedavi gören hastalarda bildirilmiştir:
Gastrointestinal hastalıklar
Yaygın: DisfajiKas-iskelet ve konnektif doku hastalıkları
Yaygın: Kolda kas güçsüzlüğüYaralanma, zehirlenme ve yöntemsel komlikasyonlar
Yaygın: Kazaren yaralanma/ düşmeDisfaji bölünmüş veya tek bir doz şeklinde uygulandığında 2700 üniyeti aşan dozlarda bildirilmiştir.
Serebral palsiden dolayı pediyatrik bacak spastisitesi
Hafif ve orta şiddetteki aşağıdaki yan etkiler serebral palsiden dolayı pediyatrik bacak spastisitesi için Dysport ile tedavi gören hastalarda gözlenmiştir:
Gastrointestinal hastalıklar
Yaygın: DiyareKas-iskelet ve konnektif doku hastalıkları
Yaygın: Bacak kasında güçsüzlükBöbrek ve üriner hastalıklar
Yaygın: İdrar kaçırmaGenel hastalıklar ve uygulama yeri koşulları
Yaygın: Anormal duruşYaralanma, zehirlenme ve yöntemsel komplikasyonlar
Yaygın: Düşmeden dolayı kazaren incinmeDüşmeden dolayı kazaren incinme ve anormal duruş, ambulant ve denge ile ilişkili diğer kaslara Dysport yayılması ve/veya hedef kaslarda aşırı zayıflıktan dolayı oluşabilir.
Spasmodik tortikolis
Hafif ve orta şiddetteki, aşağıdaki yan etkiler spazmodik tortikolis için Dysport ile tedavi gören hastalarda gözlenmiştir:
Sinir sistemi hastalıkları
Yaygın: Disfoni Yaygın değil: Baş ağrısıGöz hastalıkları
Yaygın değil: Diplopi, görmede bulanıklık
Solunum, torasik ve mediastinal hastalıklar
Seyrek: Solunum hastalıklarıGastrointestinal hastalıklar
Çok yaygın: Disfaji Yaygın değil: Ağız kuruluğuKas-iskelet ve konnektif doku hastalıkları
Yaygın: Boyun kasında güçsüzlük.Disfaji, sternomastoid kasına enjeksiyonu takiben daha sık olarak oluşmakta ve dozla ilişkili olarak görünmektedir. Semptomlar iyileşinceye kadar hafif diyet gereklidir.
Blefarospasm ve hemifasiyel spasm
Aşağıdaki hafif ve orta şiddetteki yan etkiler, hemifasiyel spazm ve blefarospazm için Dysport ile tedavi gören hastalarda gözlenmiştir:
Sinir sistemi hastalıkları
Yaygın: Yüz kaslarında güçsüzlük Yaygın değil: Yüz sinirlerinde felçGöz hastalıkları
Çok yaygın: PitozYaygın: Diplopi, gözde kuruluk, gözde yaşarma Seyrek: Oftalmopleji
Deri ve subkütan deri hastalıkları
Yaygın: Göz kapağında ödemYan etkiler, diğer yakın kas gruplarının geçici olarak paralizisi, Dysport'un derin veya yer yanlışlığı enjeksiyonlarından dolayı oluşabilir.
Aksiller hiperhidroz
Hafif ve orta şiddetteki aşağıdaki yan etkiler aksiller hiperhidroz için Dysport ile tedavi gören hastalarda gözlenmiştir:
Deri ve subkütan deri hastalıkları
Yaygın: Kompensatuvar terlemePazarlama sonrası deneyim
Pazarlama sonrası kullanım sırasında firmaya bildirilen yan etki profili, ürünün farmakolojisini yansıtır ve klinik çalışmalarda görülenlerle aynıdır. Nadir aşırı duyarlılık reaksiyonları bildirilmiştir. Şiddetli anafilaktik şok veya anafilaksi vakaları bildirilmemiştir.
Enjeksiyon yerinden diğer yerlere toksinin dağılma etkisinden dolayı oluşan yan etkiler, seyrek olarak bildirilmiştir (aşırı kas zayıflığı, disfaji, öldürücü olabilen aspirasyon pnömonisi) (kısım 4.4'e bakınız).
4.9 Doz aşımı ve tedavisi
Aşırı dozlar uzakta ve derin nöro-müsküler paralizi oluşturabilir. Aşırı dozlar solunum kaslarının paralizisi neden olduğunda solunum desteği gerekebilir. Spesifik bir antidot yoktur; antitoksinin yararlı olması beklenmez ve genel destekleyici tedavi önerilir.Aşırı dozaj kan dolaşımına nörotoksin geçişinin artmasına yol açabilir ve oral botulinum zehirlenmesi etkileri ile ilişkili komplikasyonlara yol açabilir.
Gerekli olduğunda semptomatik tedavi uygulanmalıdır. Aşırı dozaj durumunda hasta sistemik güçsüzlük veya kas paralizisi etkileri bakımından bir kaç hafta boyunca tıbbi olarak izlenmelidir.
5 FARMAKOLOJIK ÖZELLIKLER
5.1 Farmakodinamik özellikler
Farmakoterapötik grup:ATC kodu:
M03AX01Clostridium botulinum tip A toksin-hemaglutinin kompleksi asetilkolin salıverilmesine karşı proksimal bölgede presinaptik etkiyle nöromüsküler kavşakta periferik kolinerjik transmisyonu bloke eder. Toksin, transmitter verilmesinde aracı olan Ca+2 ile tetiklenen olayları antagonize ederek sinir ucunda etki gösterir. Postganglionik kolinerjik transmisyonu ya da postganglionik sempatik transmisyonu etkilemez.
Toksinin etkisi presinaptik sinir membranına hızlı bir şekilde bağlandığı yerde başlar. İkinci basamak, toksinin presinaptik membranı geçtiği internalizasyon basamağıdır. Son olarak, toksin Ca+2 aracılı asetilkolin salınımını inhibe eder; böylece son plak potansiyelini azaltır ve paralizise neden olur.
İmpuls geçişinin yeniden kazanılması yeni sinir terminallerinin oluşması ile dereceli bir şekilde oluşur, post sinaptik motor son plağı ile temas gerçekleştirilir. Proses deney hayvanlarında 6-8 hafta sürer.
5.2 Farmakokinetik özellikler
Genel özellikler:
Botulinum toksini ile farmakokinetik çalışmalar, yüksek potensi, az dozları içermesi, bileşiğin geniş moleküler ağırlığı, yeterli yüksek spesifik aktivite oluşturmak için toksinin işaretlenme güçlüğü nedeniyle hayvanlarda pek çok probleme neden olmuştur. I125 işaretli toksin kullanılarak yapılan çalışmalar reseptör bağlanmasının spesifik ve doyurulabilir olduğunu, toksin reseptörlerinin yüksek dansitesinin yüksek potens sağlamada önemli faktör olduğunu göstermiştir. Maymunlardaki doz ve zaman yanıtları düşük dozların 2-3 günlük gecikmeyle enjeksiyondan 5-6 gün sonra pik etkisini yaptığını göstermiştir. Kas paralizisi ve oküler değişiklikler ile ölçülen etki süresi 2 hafta ile 8 ay arasında değişir. Bu örnek aynı zamanda insanlarda da görülür ve nöromüsküler kavşaktaki değişikliklere, internalizasyona, bağlanma prosesine atfedilebilir.
Emilim:
Botulinum toksini tip A'nın önerilen dozlarda intramüsküler enjeksiyonunu takiben periferik kanda ölçülebilir düzeylerde bulunması beklenmez.
Dağılım:
Her tedavide uygulanan nörotoksinin önerilen miktarları, başka bir nöromüsküler disfonksiyonu bulunmayan hastalarda sistemik ya da klinik etkilere neden olmaz.
Biyotransformasyon:
Klinik çalışmalar Dysport uygulama yerinden uzaktaki kaslarda klinik elektromiyografik parametrelerde değişiklikler olduğunu göstermiştir. Bu toksinin kan dolaşımıyla yayılması, retro- veya orto- derecede aksonal iletime uğraması, üçüncü, merkezi ya da teşhis edilemeyen bölgelerde toksinin etkilerine bağlanabilir.
Eliminasyon:
Intramüsküler olarak uygulanan toksinin sistemik dolaşıma katılarak eliminasyonu ufak düzeylerdedir.
Doğrusallık/ doğrusal olmayan durum:
Dysport uygulanan doza bağlı olarak doğrusal bir atılım gösterir.
5.3 Klinik öncesi güvenlilik verileri
Kısa ürün bilgilerinin diğer kısımlarında bulunmayan ve doktorlarlara verilebilecek başka bir klinik öncesi veri bulunmamaktadır.6 FARMASÖTIK ÖZELLIKLER
6.1 Yardımcı maddelerin listesi
İnsan albumin çözeltisi, laktoz6.2 Geçimsizlikler
Bu tıbbi ürün, kısım 4.2'de bildirilenler hariç diğer tıbbi ürünlerle karıştırılmamalıdır. Kısım 4.2'de bildirilenler hariç diğer tıbbi ürünlerle geçimsizlik çalışmaları yapılmamıştır.6.3 Raf-ömrü
24 ay6.4 Saklamaya yönelik özel tedbirler
+ 2°C ve + 8°C arası sıcaklıklarda (buzdolabında) saklanmalıdır. Dondurmayınız. Sulandırıldıktan sonra hemen kullanım önerilir. Buna karşın, çözeltinin 8 saat boyunca stabil kaldığı gösterilmiştir.6.5 Ambalajın niteliği ve içeriği Kap/ kapak yapısı:
3 ml kapasitede tip 1 cam flakon. 13 mm'lik bromobütil liyofilize kapaklar, 13 mm'lik merkezi delikli, sıkıştırmalı aluminyum mühürle kapatılmıştır.Ambalajın içeriği:
Sulandırma için beyaz liyofilize toz.6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Botulinum toksini ısı ve bazı kimyasal ürünlere karşı çok hassastır.Liyofilize ürünün dökülmesi durumunda;
Dondurulmuş- kurutulmuş ürün döküldüğünde sodyum hipoklorit çözeltisi (ağartıcı) emdirilmiş absorban materyal kullanılarak,
Sulandırılmış ürün döküldüğünde kuru, absorban materyal ile silinmelidir.
Kontamine olan yüzeyler, sodyum hipoklorit çözeltisi (ağartıcı) emdirilmiş absorban materyal kullanılarak temizlenmeli, sonra kurutulmalıdır.
Flakon kırıldığında, yukarıdaki şekilde işlem görmelidir. Kırılan cam parçaları dikkatlice toplanmalı, derinin kesilmesinden sakınılarak, dikkatlice ürün silinmelidir.
Eğer ürün deri ile temasa girerse, sodyum hipoklorit çözeltisi (ağartıcı) ile yıkanmalı ve sonra bol su ile yıkanmalıdır.
Eğer ürün gözle temasa girerse, bol su veya göz yıkama çözeltisiyle yıkanmalıdır.
Kontamine materyallerin elden çıkarılması için öneriler
Boşalan iğne, şırınga ve flakonlar kullanım sonrası atık için tasarlanmış özel kaplara konulmalıdır.Kontamine materyaller (absorban giysi, eldiven, ampul parçaları) atık için tasarlanmış, delinmez kutular içine yerleştirilmelidir.
Sadece tek bir kullanım içindir. Kullanılmamış her bir çözelti atılmalıdır. Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği ne uygun olarak imha edilmelidir. Çevreyi korumak amacıyla kullanılmayan DYSPORT şehir suyuna veya çöpe atılmamalıdır. Kullanılmamış olan ürünler ya da atık materyaller, yerel düzenlemelere uygun olarak atılmalıdır.
7 RUHSAT SAHIBI
Gen İlaç ve Sağlık Ürünleri San. Ve Tic. Ltd. Şti. Mustafa Kemal Mah., 2119. Sok., No:3, D:2-3, 06520, Çankaya/ ANKARA Tel: 0312 219 62 19 Fax: 0312 219 60 108 RUHSAT NUMARASI
112/929 İLK RUHSAT TARIHI/ RUHSAT YENILEME TARIHI
İlk ruhsat tarihi: 31/07/2002Ruhsat yenileme tarihi:
31/07/200710 KÜB'ÜN YENILENME TARIHI
İlaç Bilgileri
Dysport 500 U Enjeksiyonluk Çözelti İçin Toz İçeren Flakon
Etken Maddesi: Clostridium Botulinum tip-A toksin-hemaglutinin kompleksi
Atc Kodu: M03AX01
Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.