Dysport 500 U enjeksiyonluk çözelti için toz içeren flakon Kısa Ürün BilgisiKas İskelet Sistemi » Kas Gevşeticiler » Periferik Etkili Kas Gevşeticiler » Diğer İlaçlar » Botulinum Toksini KISA URUN bILGİSİSİDYSPORT ENJEKSIYONLUK ÇÖZELTI IÇIN TOZİÇEREN FLAKONClostridium botulinumtip-A toksin-hemaglutinin kompleksi1BEŞERITIBBIÜRÜNÜNADIDysport Enjeksiyonluk çözelti için toz içeren flakon2KALITATIFVEKANTİTATIFBİLEŞİMEtkin maddeClostridium botulinumtip A toksin-hemaglutinin kompleksi.....500 Ipsen Ünitesi*Yardımcı maddelerİnsan albumin çözeltisi................................................125 mcg Laktoz....................................................................2.5 mg *Bir Ipsen Ünitesi, farelerdeki medyan letal peritoneal doz olarak tanımlanır. 3FARMASÖTIKFORMEnjeksiyonluk çözelti için toz içeren flakon4KLINIK ÖZELLIKLER4.1Terapötik EndikasyonlarDysport;Fizyoterapi ile birlikte fokal spastisite ile karakterize kol semptomları, İki yaş ve üzeri pediyatrik serebral palsi hastalarında spastisiteden dolayı dinamik equinus ayak deformitesi, Yetişkinlerde spazmodik tortikolis Yetişkinlerde blefarospazm, Yetişkinlerde hemifasiyel spazm, Aksiller hiperhidroz, Hastada önemli psikolojik etkilere neden olan, 65 yaş altı yetişkin hastalarda alın bölgesinde görülen orta veya şiddetli derecedeki glabella çizgilerinin (kaşlar arasındaki dikey çizgiler) görünüşünde geçici iyileştirme tedavilerinde endikedir. 4.2Pozoloji ve Uygulama ŞekliDysport üniteleri Dysport'a spesifiktir ve uygulama dozları diğer botulinum toksin tip A preperatlarnın dozlarından farklıdır.Eğitim:Dysport uygun eğitim almış doktorlar tarafından uygulanmalıdır.Kauçuk tıpanın merkezi kısmı olan septumun delinmesi öncesi, hemen alkolle temizlenmelidir. Steril 23 yada 25 G'lik iğne kullanılmalıdır. İnme sonrası yetişkinlerde kol spastisitesiPozoloji/ Uygulama sıklığı ve süresi:
Önerilen doz, aşağıda gösterilen 5 kas arasında dağıtılmak üzere 1000 ünitedir: |
Biceps |
Flexor |
Flexor |
Flexor |
Flexor |
Toplam |
brachii (BB). |
digitorum |
digitorum |
carpi |
carpi |
doz |
|
|
profundus |
superficialis |
ulnaris |
radialis |
|
|
|
(FDP) |
(FDS) |
(FCU) |
(FCR) |
|
|
300-400 ünite |
150 ünite |
150-250 |
150 ünite |
150 ünite |
1000 ünite |
|
(0.6-0.8 ml) |
(0.3 ml) |
ünite |
(0.3 ml) |
(0.3 ml) |
(2.0 ml) |
|
|
|
(0.3-0.5 ml) |
|
|
|
.Biceps brachiibiceps
kasına iki bölgede enjekte edilmelidir. Uygulanan maksimum doz 1000 üniteyi aşmamalıdır.Başlangıç dozu eğer önerilen doz hedef kaslarda aşırı zayıflığa neden oluyorsa, hedef kaslar ufaksa, BB kasına enjeksiyon yapılamayacaksa veya diğer kas gruplarına da birlikte enjeksiyon gerektiriyorsa, bu hastalarda doz düşürülmelidir. Klinik iyileşme enjeksiyondan sonra 2 hafta içinde gözlenebilir. Tekrarlanan ve uzun dönem tedavi üzerine veriler sınırlıdır.
Çocuklarda kol spastisitesi:
Çocuklarda kol spastisitesinde Dysport kullanımının güvenlilik ve etkinliği gösterilmemiştir.Dysport mililitrede 500 Ünite içeren bir çözelti elde etmek üzere 1.0 ml sodyum klorür enjeksiyonu B.P. (% 0.9) ile sulandırılmalıdır. Dysport, kol spastisitesi tedavisinde yukarıda detayları verilen beş kas içine intramüsküler enjeksiyonla uygulanmalıdır.
Pediyatrik serebral palsi spastisitesiPozoloji/ Uygulama sıklığı ve süresi:
Başlangıç önerilen doz, her iki baldır kasına bölünmüş dozlar olarak verilen 20 Ünite/ kg vücut ağırlığıdır. Eğer sadece bir baldır etkilenmişse, 10 ünite/ kg vücut ağırlığı dozu kullanılmalıdır. Eğer başlangıç dozu hedef kaslarda aşırı zayıflığa neden oluyorsa, hedef kaslar çok ufak veya diğer kas gruplarına da birlikte enjeksiyon gerektiriyorsa, bu başlangıç dozunun düşürülmesi düşünülmelidir. Başlangıç dozuna verilen yanıtın değerlendirmesini takiben, daha sonraki tedavi her iki bacak arasında bölünen 10 ünite/kg veya 30 ünite/kg aralığında titre edilebilir. Uygulanan maksimum doz 1000 ünite/ hasta'yı aşmamalıdır.
Uygulama başlıca gastrocnemius kasına hedeflenmeli ancak, soleus ve tibialis posterior kaslarına da enjeksiyon düşünülmelidir.
Elektromiyografi kullanımı (EMG) rutin klinik pratikte uygulanmaz ama, en aktif kasların teşhisine yardımcı olabilir.
Klinik iyileşme enjeksiyondan sonraki iki hafta içinde gözlenebilir. Enjeksiyonlar 12 haftadan daha sık olarak uygulanmamalı, ancak yanıtın devamı için yaklaşık olarak her 16 haftada bir tekrarlanmalıdır.
Serebral palsy spastisitesi tedavi edilirken, Dysport mililitrede 500 Ünite içeren bir çözelti elde etmek için 1.0 ml sodyum klorür enjeksiyonu B.P. ile (% 0.9) sulandırılmalıdır. Pediyatrik serebral palsy spastisitesi tedavi edildiğinde Dysport her iki baldır kaslarına intramüsküler enjeksiyonla uygulanmalıdır.
Spazmodik tortikolis
Pozoloji/ uygulama sıklığı ve süresi:
Yetişkinler ve yaşlılar:
Tortikolis için önerilen dozlar, düşük boyun kası kütlesi mevcut olmayan normal ağırlıktaki yetişkinlerin tüm yaş grubuna uygulanabilir. Azalmış kas kütlesi mevcut yaşlılarda veya belirgin derecede normal ağırlığının altında olan hastalarda azaltılmış dozlar uygun olabilir.
Spazmodik tortikolis tedavisinde önerilen başlangıç dozu, iki ya da üç en aktif boyun kasına uygulanan ve bölünmüş dozlar halinde verilen hasta başına 500 ünitedir.
Rotasyonlu tortikolis için, rotasyona kontralateral olarak sternomastoid kasına 150 ünite ve çene/boyun rotasyon yönüne ipsilateral splenius capitis kasına 350 ünite olmak üzere toplam 500 ünite uygulanır.
Laterokolis için, 350 ünite ipsilateral splenius capitis kasına ve 150 ünite ipsilateral sternomastoid kası içine olmak üzere toplam 500 ünite uygulanır. Omuz yükselmesi olan vakalarda, elektromiyografik bulgular (EMG) veya görülebilir kas hipertrofisine göre, ipsilateral trapezoid ya da levator scapulae kasları tedavi gerektirebilir. Üç kasa enjeksiyon gerektiğinde, 500 Ünite şu şekilde dağıtılır: 300 ünite splenius capitis, 100 ünite sternomastoid ve 100 ünite üçüncü kasa.
Retrokolis için her splenius capitis kasına 250 ünite olmak üzere toplam 500 ünite uygulanır. Eğer yetersiz yanıt gözlenirse, 6 hafta sonra her trapezius kasına 250 üniteye kadar enjeksiyonlar yapılabilir. Bilateral splenii enjeksiyonları boyun kasında zayıflık riskini artırabilir.
Tortikolisin tüm diğer formlarında, en aktif kası teşhis ile tedavi etmek için EMG ve uygulayan doktorun bilgisine ihtiyaç vardır. EMG, zayıf palpasyonlu boyun kası olan fazla kilolu hastalarda,veya kas içine derin enjeksiyona kılavuz olması için, ve kompleks olmayan durumlarda başarısız enjeksiyonlar sonrası yeniden değerlendirme için tortikolisin tüm kompleks formlarının teşhisinde kullanılmalıdır.
Daha sonraki uygulamalarda dozlar, gözlenen klinik yanıta ve yan etkilere göre ayarlanabilir. Yüksek dozlar özellikle disfaji gibi yan etkilerde artışa neden oluyorsa da, 250- 1000 ünite aralığındaki dozlar önerilir. 1000 ünite üzeri olan dozlar önerilmez.
Tortikolisde semptomların iyileşmesi enjeksiyondan sonraki hafta içinde gözlenebilir. Enjeksiyonlar semptomların yeniden oluşmasını önlemek için gerektiği kadar veya yaklaşık her 12 haftada bir tekrarlanmalıdır.
Çocuklarda spazmodik tortikolisde kullanım:
Çocuklarda spazmodik tortikolisde Dysport kullanımının etkinlik ve güvenliliği belirlenmemiştir. .
Uygulama şekli:
Spazmodik tortikolis tedavi edildiğinde, Dysport mililitrede 500 Ünite içeren bir çözelti elde etmek için 1 ml sodyum klorür enjeksiyonu B.P. (% 0.9) ile sulandırılır. Dysport spazmodik tortikolis tedavi edildiğinde yukarıdaki gibi intramüsküler enjeksiyonla uygulanır.
Blefarospazm ve hemifasiyel spazmPozoloji/ Uygulama sıklığı ve süresi:
Yetişkin ve yaşlılar:
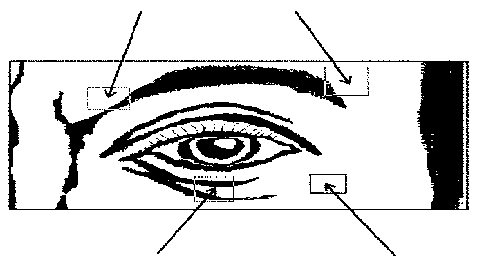
Bilateral blefarospazm tedavisinde önerilen başlangıç dozu her göze 120 ünitedir.
0.1 ml'lik (20 ünitelik) enjeksiyonlar gözün alt ve üst medialine, 0.2 ml'lik (40 ünitelik) enjeksiyonlar ise, her bir gözün alt ve üst orbicularis oculi kaslarının, preseptal ile orbital kısımları arasındaki kavşak içine lateral olarak yapılmalıdır. Üst göz kapağına enjeksiyonlar için iğne levator kasından sakınılarak merkezden dışarıya doğru yapılmalıdır. Aşağıdaki diyagram, bu enjeksiyonların yerlerini göstermek için yardımcıdır. Semptomların iyileşmesi, iki- dört gün içinde başlayabilir ve iki hafta içinde maksimum etkiye erişebilir.
Enjeksiyonlar, semptomların yeniden oluşumunu önlemeye yetecek kadar veya yaklaşık olarak her 12 haftada bir tekrarlanmalıdır. Bu şekildeki daha sonraki uygulamalarda doz her göz için 80 üniteye kadar azaltılabilir- önceden tanımlandığı şekilde her gözün alt ve üstüne: 0.1 ml (20 ünite) medial olarak ve 0.1 ml (20 ünite) lateral olarak. Doz, daha sonra medial alt göz kapağı enjeksiyonunun bırakılmasıyla her bir göz için 60 üniteye düşürülebilir.
0.1 ml
0.2 ml
 0.1 ml0.2 ml
0.1 ml0.2 ml
Unilateral blefarospazm vakalarında enjeksiyonlar sadece hasarlı gözle sınırlandırılmalıdır. Hemifasiyal spazmı olan hastalar unilateral blefarospazmdaki gibi tedavi edilmelidir. Önerilen dozlar yaşlılar dahil tüm yaş grubundaki yetişkinlere uygulanabilir.
Çocuklarda blefarospazm ve hemifasiyal spazmda kullanım:
Çocuklarda blefarospazm ve hemifasiyal spazmda Dysport kullanımının etkinliği ve güvenliliği gösterilmemiştir.
Blefarospazm ve hemifasiyal spazm tedavi edildiğinde, Dysport mililitrede 200 ünite içeren bir çözelti elde etmek için 2.5 ml sodyum klorür enjeksiyonu B.P.(% 0.9) ile sulandırılır. Dysport gözün alt ve üstorbicularis oculi
kasının preseptal ile orbital kısımları arası kavşağa medial ve lateral subkütan enjeksiyonla uygulanır.
Aksiller hiperhidroz
Pozoloji/ uygulama sıklığı ve süresi:
Yetişkinler ve yaşlılar:
Önerilen başlangıç dozu her koltuk altı için 100 ünitedir. Eğer istenen sonuç elde edilemezse, sonraki enjeksiyonlarda her bir koltuk altı için 200 üniteye kadar çıkılabilir. Enjeksiyon bölgesi uygulama öncesi iyot-nişasta testi ile belirlenebilir. Her iki koltuk altı da temizlenmeli ve dezenfekte edilmelidir. Sonrasında her bir enjeksiyon noktasına 10 ünite olacak şekilde deri içine 10 noktada (100 ünite/koltuk altı) enjeksiyonlar uygulanır. Maksimum etki enjeksiyondan 2 hafta sonra gözlenebilmelidir. Önerilen doz, vakaların çoğunluğunda yaklaşık 48 hafta kadar terlemenin yeterince baskılanmasını temin eder. Takip eden enjeksiyon zamanı, 12 haftadan önce olmayacak şekilde kişiye göre ayarlanmalıdır. Tekrarlanan dozların gittikçe artan bir etkisinin olduğuna yönelik kanıtlar vardır. Bundan dolayı hastaya verilen her bir tedavinin süresi kişiye özgü olarak belirlenmelidir.
Çocuklarda aksiller hiperhidrozda kullanım:
Çocuklarda aksiller hiperhidrozda Dysport kullanımının etkinliği ve güvenliliği gösterilmemiştir.
Uygulama şekli:
Dysport flakonu 2.5 ml enjeksiyonluk sodyum klorür solüsyonu B.P. (% 0.9) ile sulandırılırsa, Dysport'un her mililitresi 200 ünite içeren bir çözelti verir. Aşırı koltuk altı terlemesi tedavisinde, Dysport enjeksiyonları 10 noktadan deri içine uygulanır.
Alın ve kaş bölgesindeki çizgilerin tedavisinde kullanım: Pozoloji/ uygulama sıklığı ve süresi:
Dysport sulandırıldığında sadece bir kere ve sadece bir hasta için uygulanmalıdır. Enjeksiyon öncesi ürün yukarıda verilen talimatlar izlenerek sulandırılmalıdır. Yüz üzerindeki makyaj temizlenmeli ve lokal antiseptik ile yüz dezenfekte edilmelidir. İntramüsküler enjeksiyon steril 29-30 G iğne kullanılarak deriye sağ açıda uygulanmalıdır.
Önerilen doz 5 enjeksiyon bölgesine bölünmüş 50 ünite Dysport'tur (sulandırılmış çözeltinin 0.25 ml'si). Her 5 bölgeye intramüsküler olarak 10 ünite uygulanmalıdır (sulandırılmış çözeltinin 0.05 ml'si): aşağıda gösterildiği şekilde her corrugator kasına 2'şer noktaya ve nazofrontal açının civarındaki procerus kasına bir noktaya enjeksiyon yapılır.
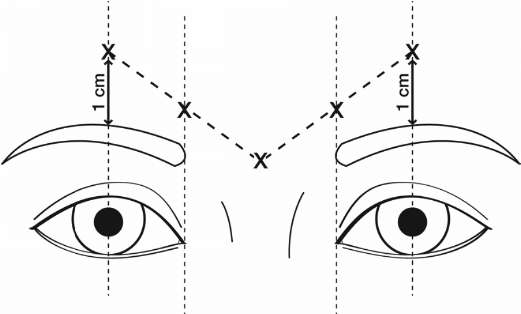 Anatomik sınırlar kaşların maksimum çatılarak gözlenmesi ve palpasyonu ile kolayca tespit edilebilir. Enjeksiyon öncesi, orbital kenar altına ekstravazasyonu önlemek için orbital kenar(rim) üzerine sıkıca işaret parmağı veya baş parmak konulmalıdır. İğne, enjeksiyon sırasında içe ve yukarıya doğru tutulmalıdır. Özellikle "brow-depressor complex" (depressor supercilii) aktivitesi yüksek hastalarda pitozis riskini azaltmak için levator palpebrae superioris kasının yakınına enjeksiyon yapmaktan kaçınılmalıdır. Corrugator kas içine enjeksiyonlar orbital kenarın en az 1 cm üzerinde kasın merkezi kısmına yapılmalıdır. Tedavi aralığı, değerlendirme sonrası hastanın kişisel yanıtına bağlıdır. Klinik çalışmalarda, optimal etki enjeksiyon sonrası 4 aya kadar gösterilmiştir. Bazı hastalar 5 aya kadar halen cevap verebilirler. Tedavi aralığı her 3 ayda birden daha sık olmamalıdır. Tekrarlanan enjeksiyonları takiben, tedavi başarısızlığı veya azalan etki durumunda, alternatif tedavi metodları uygulanmalıdır. İlk tedavi sonrası tedavi başarısızlığı durumunda, aşağıdaki yaklaşımlar göz önünde bulundurulmalıdır: -Hata nedeninin analizi, ör; yanlış kaslara enjeksiyon, enjeksiyon tekniği, toksin-nötralize edici antikorların oluşumu,
Anatomik sınırlar kaşların maksimum çatılarak gözlenmesi ve palpasyonu ile kolayca tespit edilebilir. Enjeksiyon öncesi, orbital kenar altına ekstravazasyonu önlemek için orbital kenar(rim) üzerine sıkıca işaret parmağı veya baş parmak konulmalıdır. İğne, enjeksiyon sırasında içe ve yukarıya doğru tutulmalıdır. Özellikle "brow-depressor complex" (depressor supercilii) aktivitesi yüksek hastalarda pitozis riskini azaltmak için levator palpebrae superioris kasının yakınına enjeksiyon yapmaktan kaçınılmalıdır. Corrugator kas içine enjeksiyonlar orbital kenarın en az 1 cm üzerinde kasın merkezi kısmına yapılmalıdır. Tedavi aralığı, değerlendirme sonrası hastanın kişisel yanıtına bağlıdır. Klinik çalışmalarda, optimal etki enjeksiyon sonrası 4 aya kadar gösterilmiştir. Bazı hastalar 5 aya kadar halen cevap verebilirler. Tedavi aralığı her 3 ayda birden daha sık olmamalıdır. Tekrarlanan enjeksiyonları takiben, tedavi başarısızlığı veya azalan etki durumunda, alternatif tedavi metodları uygulanmalıdır. İlk tedavi sonrası tedavi başarısızlığı durumunda, aşağıdaki yaklaşımlar göz önünde bulundurulmalıdır: -Hata nedeninin analizi, ör; yanlış kaslara enjeksiyon, enjeksiyon tekniği, toksin-nötralize edici antikorların oluşumu,
- Dysport ile tedavinin uygunluğunu yeniden değerlendirme.
Çocuklarda alın ve kaş bölgesindeki çizgilerin tedavisinde kullanım:
18 yaşının altındaki çocuklarda alın ve kaş bölgesindeki çizgilerin tedavisinde Dysport etkinliği ve güvenliliği gösterilmemiştir.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/ karaciğer yetmezliği:
Özel bir doz ayarlaması gerekli değildir.
Pediyatrik popülasyon:
2 yaşının üzeri çocuklarda pediyatrik serebral palsi spastisite tedavisinde kullanılır. Çocuklarda aşırı koltuk altı terlemesi, hemifasiyal paralizi, blefarospazm spazmodik tortikolis, kol spastisitesi tedavilerinde Dysport'un etkinlik ve güvenilirliği gösterilmemiştir.
Geriyatrik popülasyon:
Klinik çalışmalar dozaj ayarlaması gerekliliğini göstermemiştir.
4.3Kontrendikasyonlar
Dysport bileşenlerden herhangi birine karşı aşırı duyarlılığı bilinen kişilerde kontrendikedir.
4.4Özel kullanım uyarıları ve önlemleri
Uygulama yerinden diğer bölgelere etkinin yayılmasından dolayı bazı olgularda disfaji, pnömoni,ve/veya aşırı güçsüzlük ile ilişkili yan etkiler, çok nadir olarak ölüm bildirilmiştir (kısım 4.8'e bakınız). Terapötik dozlarla tedavi gören hastalarda aşırı kas zayıflığı olabilir. Bu şekildeki istenmeyen etkilerin oluşum riski önerilen dozun aşılmaması ve en düşük etkili dozun kullanılmasıyla azaltılabilir.
Dysport belirgin defektif nöro-müsküler iletimin klinik veya sub-klinik kanıtlarını gösteren hastalarda yakın gözlem altında ve dikkatli olarak kullanılmalıdır (ör; miyastenia gravis). Bu gibi hastalarda Dysport gibi ajanlara hassasiyet artmıştır ve terapötik dozlarda aşırı kas zayıflığı oluşabilir. Öncesinde bir nörolojik hastalığı olan kişilerde bu yan etki riski daha fazladır.
Dysport yutma zorluğu ve aspirasyon öyküsü bulunan hastalarda dikkatli kullanılmalıdır. Yutma ve solunum bozuklukları toksinin uygulama bölgesinden daha uzak bölgelere yayılması ile kötüleşebilir. Aspirasyon nadir durumlarda oluşmuştur ve kronik solunum hastalığı olan spazmodik tortikolisli hastalar tedavi edildiğinde bir risk oluşturabilir. Dysport bu şekildeki hastalarda uzman denetim altında kullanılmalı ve sadece tedavinin yararı risklerden ağır bastığında kullanılmalıdır.
Dysport'un önerilen doz ve uygulama sıklığı aşılmamalıdır (Bölüm 4.2'ye bakınız).
Hastalar ve bakıcıları, yutma, konuşma veya solunum ile ilgili problemlerin gelişmesi durumunda, acil tıbbi tedavi gerekliliği konusunda uyarılmalıdır.
Çocuklarda serebral palsi ile ilişkili spastisite tedavisi için, Dysport sadece 2 yaş üzerindeki çocuklarda kullanılmalıdır.
İntramüsküler enjeksiyon şeklinde uygulandığında Dysport, önerilen enjeksiyon yerinde enflamasyon, enfeksiyon bulunan veya kanama süresi uzun olan hastalarda sadece, çok gerekli olduğunda kullanılmalıdır.
Dysport tek bir durumda tek bir hastayı tedavi etmek için kullanılmalıdır. Arta kalan kullanılmamış ürün kısım 6.6. ile uyum içinde atılmalıdır. Ürünün hazırlanması, uygulanması, kullanılmamış olan çözeltinin inaktivasyon ve atılımı için özel dikkat edilmelidir (kısım 4.2).
Bu ürün az miktarda insan albumini içermektedir. Viral enfeksiyonların geçiş riski, insan kanı veya kan ürünlerinin kullanımını takiben kesin olarakdışlanamaz.
Dysport alan hastalarda botulinum toksinine karşı nadiren antikor oluşumu bildirilmiştir. Klinik olarak nötralize edici antikorlar tedaviye karşı yanıtta kötüleşmeye neden olabilir veya dozun artırılmasını gerektirebilir.
Öncesinde botulinum toksin tip A içeren ürünlere alerjik reaksiyon göstermiş kişilerde enjeksiyon öncesi dikkat edilmelidir. Tedavinin yararına ilişkin başka alerjik reaksiyon oluşması göz önünde bulundurulmalıdır.
Kaşlar arasında oluşan çizgilerin tedavisinde kullanıldığında, uygulama öncesi hastanın yüz anotomisinin incelenmesi gerekmektedir. Yüzde asimetri, pitoz, aşırı dermatoşalazis (dermatochalasis), sikatris ve bu anatomide değişiklikler veya önceki cerrahi müdahale sonuçları göz önünde bulundurulmalıdır. Hedef kasın aşırı zayıflık veya atrofi göstermesi durumunda dikkat edilmelidir.
Dysport ile tedavi boyunca farklı tip botulinum nörotoksinlerinin uygulanma etkileri bilinmemektedir ve bu nedenle sakınılmalıdır.
Bu ürün 2.5 gram laktoz içerir. Nadir kalıtımsal galaktoz intoleransı, lapp laktoz yetmezliği ya da glikozgalaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Botulinum toksininin etkileri, nöromüsküler fonksiyonu direkt veya indirekt olarak etkileyen ilaçlarla artabilir (Ör; aminoglikozidler, kürar benzeri non-depolarizan blokörler) ve bu ilaçlar botulinum toksini ile tedavi gören hastalarda dikkatli kullanılmalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Pediyatrik popülasyon:
Pediyatrik popülasyonda etkileşim çalışmaları yapılmamıştır. Geriyatrik popülasyon:
Geriyatrik popülasyonda etkileşim çalışmaları yapılmamıştır.
4.6 Gebelik ve laktasyon Genel Tavsiye: Gebelik Kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/ Doğum kontrolü (Kontrasepsiyon):
Dysport ile ilgili hayvanlarda teratolojik çalışmaları uygulanmamıştır. Hamile kadınlarda Dysport kullanım ve etkinliği gösterilmediğinden, hamilelik sırasında Dysport kullanılmamalı ve tedavi süresince etkili doğum kontrolü uygulanmalıdır.
Gebelik dönemi:
Clostridium botulinum tip A toksin hemaglutinin kompleksinin hamile kadınlarda kullanımına ilişkin limitli veriler mevcuttur.Hayvanlardaki çalışmalar maternal toksisiteye neden olan dozlarda üreme üzerine toksisite göstermiştir (kısım 5.3'e bakınız). Dysport hamilelik sırasında sadece yarar fetüse karşı potansiyel riski doğruladıkça kullanılmalıdır. Hamile kadınlara verildiğinde özel dikkat verilmelidir.
Laktasyon dönemi:
Clostridium botulinum tip A hemaglutinin kompleksinin anne sütüne geçip geçmediği bilinmemektedir. Clostridium botulinum tip A hemaglutinin kompleksinin süte geçmesi hayvanlarda çalışılmamıştır. Bu nedenle Clostridium botulinum tip A hemaglutinin kompleksinin laktasyon sırasında kullanımı önerilmez.
Üreme yeteneği/ Fertilite:
Yüksek dozlar doza bağlı olarak fertilitede azalma ve testiküler atrofiye neden olmuştur. Embriyo üzerine yan etkiler görülmemiştir.
4.7Araç ve makine kullanımı üzerindeki etkiler
Araç ve makine kullanım yeteneğini etkileyebilecek kas güçsüzlüğü ve görsel bozuklukların oluşma riskleri bulunmaktadır.
4.8İstenmeyen etkiler
Çok yaygın >1/10; Yaygın >1/100,<1/10; Yaygın olmayan >1/1000, <1/100; Seyrek >1/10 000, < 1/1000; Çok seyrek <1/10 000
Uygulama yerinden daha uzak bölgelere toksinin yayılması ile ilişkili yan etkiler bildirilmiştir (aşırı kas güçsüzlüğü, disfaji, çok nadir vakalarda ölümcül sonuçlar veren aspirasyon/aspirasyon pnömonisi) (kısım 4.4'e bakınız).
Genel:
Klinik çalışma programında, Dysport ile tedavi gören hastaların yaklaşık olarak % 28'inde yan etkiler görülmüştür.
İnme veya serebral palsi ile ilişkili spastisite, tortikolis, hemifasiyel spazm, blefarospazm dahil değişik endikasyonlar için tedavi gören hastalarda şu yan etkiler gözlenmiştir:
Sinir sistemi hastalıkları:
Seyrek: Nevraljik kas erimesi (Nevraljik amyotrofi)
Deri ve subkütan doku hastalıkları
Yaygın değil: Kaşıntı Seyrek: Deride döküntü
Genel hastalıklar ve uygulama yeri koşulları
Yaygın: Genel güçsüzlük, yorgunluk, grip-benzeri sendrom ve ağrı/ enjeksiyon bölgesinde morarma
İlaveten, kişisel endikasyona spesifik şu yan etkiler bildirilmiştir:
İnme sonrası yetişkinlerde kol spastisitesi
Gastrointestinal hastalıklar
Yaygın: Disfaji
Kas-iskelet ve konnektif doku hastalıkları
Yaygın: Kolda kas güçsüzlüğü
Yaralanma, z^ehirlenme ve yöntemsel komplikasyonlar
Yaygın: Kazaren yaralanma/ düşme
Serebral palsiden dolayı pediyatrik bacak spastisitesi
Gastrointestinal hastalıklar
Yaygın: Diyare, kusma
Kas-iskelet ve konnektif doku hastalıkları
Yaygın: Bacak kasında güçsüzlük
Böbrek ve üriner hastalıklar
Yaygın: İdrar kaçırma
Genel hastalıklar ve uygulama yeri koşulları
Yaygın: Anormal yürüyüş
Yaralanma, zehirlenme ve yöntemsel komplikasyonlar
Yaygın: Düşmeden dolayı kazaren incinme
Düşmeden dolayı kazaren incinme ve anormal yürüyüş, ambulasyon ve denge ile ilişkili diğer kaslara Dysport yayılması ve/veya hedef kaslarda aşırı zayıflıktan dolayı oluşabilir.
Spasmodik tortikolis
Sinir sistemi hastalıkları
Yaygın: Disfoni Yaygın değil: Baş ağrısı
Göz hastalıkları
Yaygın değil: Diplopi, görmede bulanıklık
Solunum, torasik ve mediastinal hastalıklar
Seyrek: Solunum hastalıkları
Gastrointestinal hastalıklar
Çok yaygın: Disfaji Yaygın değil: Ağız kuruluğu
Kas-iskelet ve konnektif doku hastalıkları
Yaygın: Boyun kasında güçsüzlük.
Disfaji, sternomastoid kasına enjeksiyonu takiben daha sık olarak oluşmakta ve dozla ilişkili olarak görünmektedir. Semptomlar iyileşinceye kadar hafif diyet gereklidir.
Bu yan etkilerin iki-dört hafta içinde iyileşmesi beklenir.
Blefarospasm ve hemifasiyel spasm
Sinir sistemi hastalıkları
Yaygın: Yüz kaslarında güçsüzlük Yaygın değil: Yüz sinirlerinde parezi
Göz hastalıkları
Çok yaygın: Pitoz
Yaygın: Diplopi, gözde kuruluk, gözde yaşarma Seyrek: Oftalmopleji
Deri ve subkütan deri hastalıkları
Yaygın: Göz kapağında ödem Seyrek: Göz kapaklarının içe kıvrılması
Yan etkiler, diğer yakın kas gruplarının geçici olarak paralizisi, Dysport'un derin veya yanlış yere enjeksiyonlarından dolayı oluşabilir.
Aksiller hiperhidroz
Dysport ile tedavi gören yaklaşık 217 hastayı kapsayan 4 klinik çalışmada şu yan etkiler bildirilmiştir:
Deri ve subkütan deri hastalıktan
Yaygın: Kompensatuvar terleme
Alın ve kaş bölgesindeki çizgilerin tedavisi (Glabellar çizgiler)
Sinir sistemi hastalıkları
Çok yaygın: baş ağrısı
Yaygın: yüz parezisi (alında parezi olarak tanımlanan) Yaygın değil: baş dönmesi
Göz hastalıkları
Yaygın: görme zayıflığı, pitoz, göz kapağında ödem, göz yaşında artış, göz kuruluğu, gözün çevresindeki kaslarda seğirme
Yaygın değil: görme bozuklukları, bulanık görme, diplopi
Seyrek: gözün hareket bozukluğu
Deri ve deri altı doku hastalıkları
Yaygın değil: kaşıntı, döküntü
Seyrek: ürtiker
Genel bozukluklar ve uygulama bölgesine ilşkin durumlar
Çok yaygın: enjeksiyon bölgesi reaksiyonları (eritem, ödem, irritasyon, döküntü, kaşıntı, parestezi, ağrı, rahatsızlık, batma ve çürükler)
Bağışıklık sistemi hastalıkları
Yaygın değil: Aşırı duyarlılık
Pazarlama sonrası deneyim
Pazarlama sonrası kullanım sırasında firmaya bildirilen yanetki profili, ürünün
farmakolojisini yansıtır ve klinik çalışmalarda görülenlerle aynıdır.Nadir aşırı duyarlılık reaksiyonları bildirilmiştir.
4.9 Doz aşımı ve tedavisi
Aşırı dozlar uzakta ve derin nöro-müsküler paralizi oluşturabilir. Aşırı dozlar dolaşıma nörotoksin geçme riskini artırabilir ve oral botulinum zehirlenmesi etkileri ile ilişkili komplikasyonlara neden olabilir (ör; disfaji ve disfoni). Aşırı dozlar solunum kaslarının paralizine neden olduğunda solunum desteği gerekebilir. Spesifik bir antidot yoktur; antitoksinin yararlı olması beklenmez ve genel destekleyici tedavi önerilir. Aşırı dozaj durumunda hasta sistemik güçsüzlük veya kas paralizisi belirtileri gösterdiğinde tıbbi olarak izlenmelidir. Eğer gerekiyorsa semptomatik tedavi uygulanmalıdır.
Aşırı dozaj semptomları enjeksiyonu takiben hemen görülmeyebilir. Kazaren enjeksiyon veya oral alım olursa, kişi kas paralizi veya aşırı kas zayıflığı semptom ile belirtileri bakımından bir kaç hafta boyunca tıbbi olarak denetlenmelidir.
5FARMAKOLOJİK ÖZELLİKLER
5.1Farmakodinamik özellikler
Farmakoterapötik grup:ATC kodu:
M03AX01
Clostridium botulinum tip A toksin-hemaglutinin kompleksi asetilkolin salıverilmesine karşı proksimal bölgede presinaptik etkiyle nöromüsküler kavşakta periferik kolinerjik transmisyonu bloke eder. Toksin, transmitter verilmesinde aracı olan Ca+2 ile tetiklenen olayları antagonize ederek sinir ucunda etki gösterir. Postganglionik kolinerjik transmisyonu ya da postganglionik sempatik transmisyonu etkilemez.
Toksinin etkisi presinaptik sinir membranına hızlı bir şekilde bağlandığı yerde başlar. İkinci basamak, toksinin paralizi başlangıcına neden olmadan presinaptik membranı geçtiği internalizasyon basamağıdır. Son olarak, toksin Ca+2 aracılı asetilkolin salınımını inhibe eder; böylece son plak potansiyelini azaltır ve paraliziye neden olur.
İmpuls geçişinin yeniden kazanılması yeni sinir terminallerinin oluşması ile dereceli bir şekilde oluşur, post sinaptik motor son plağı ile temas gerçekleştirilir. Bu proses deney hayvanlarında 6-8 hafta sürer.
5.2Farmakokinetik özellikler
Genel özellikler:
Botulinum toksini ile farmakokinetik çalışmalar, yüksek potensi, az dozları içermesi, bileşiğin büyük moleküler ağırlığı, yeterli yüksek spesifik aktivite oluşturmak için toksinin işaretlenme güçlüğü nedeniyle hayvanlarda pek çok probleme neden olmuştur. I125 işaretli toksin kullanılarak yapılan çalışmalar reseptör bağlanmasının spesifik ve doyurulabilir olduğunu, toksin reseptörlerinin yüksek dansitesinin yüksek potens sağlamada önemli faktör olduğunu göstermiştir. Maymunlardaki doz ve zaman yanıtları düşük dozların 2-3 günlük gecikmeyle enjeksiyondan 5-6 gün sonra pik etkisini yaptığını göstermiştir. Kas paralizisi ve oküler değişiklikler ile ölçülen etki süresi 2 hafta ile 8 ay arasında değişir. Bu örnek aynı zamanda insanlarda da görülür ve nöromüsküler kavşaktaki değişikliklere, internalizasyona, bağlanma prosesine atfedilebilir.
Emilim:
Botulinum toksini tip A'nın önerilen dozlarda intramüsküler enjeksiyonunu takiben periferik kanda ölçülebilir düzeylerde bulunması beklenmez.
Dağılım:
Her tedavide uygulanan nörotoksinin önerilen miktarları, başka bir nöromüsküler disfonksiyonu bulunmayan hastalarda sistemik ya da klinik etkilere neden olmaz.
Biyotransformasyon:
Klinik çalışmalar Dysport uygulama yerinden uzaktaki kaslarda klinik elektromiyografik parametrelerde değişiklikler olduğunu göstermiştir. Bu toksinin kan dolaşımıyla yayılması, retro- veya orto- derecede aksonal iletime uğraması, üçüncü, merkezi ya da teşhis edilemeyen bölgelerde toksinin etkilerine bağlanabilir.
Eliminasyon:
intramüsküler olarak uygulanan toksinin sistemik dolaşıma katılarak eliminasyonu ufak düzeylerdedir.
Doğrusallık/ doğrusal olmayan durum:
Dysport uygulanan doza bağlı olarak doğrusal bir atılım gösterir.
5.3 Klinik öncesi güvenlilik verileri
Hamile sıçanlara ve tavşanlara sırasıyla 6.6 ünite/kg (79 ünite/kg total kümülatif doz) ve 3.0 ünite/kg (42 ünite/kg kümülatif doz) dozlarında günlük intramüsküler enjeksiyon ile clostridium botulinum tip A toksin-hemaglutinin kompleksi verilen üreme toksisite çalışmalan,embriyo/fetal toksisite göstermemiştir. Maternal toksik dozlarda implantasyon kayıpları her iki türde de yüksek dozlarda gözlenmiştir. Clostridium botulinum tip A toksin-hemaglutinin kompleksinin sıçan ve tavşanlarda teratojenik olmadığı gösterilmiştir, sıçanlarda F1 jenerasyonu üzerinde pre ve post natal çalışmalarda etkiler gözlenmemiştir. Erkek ve dişi sıçanların fertilitesi, dişilerde haftalık 20 ünite/kg artan implantasyon kaybı ve erkeklerde haftalık 29.4 ünite/kg dozlarında kas paralizine sekonder azalan çiftleşmeden dolayı azalmıştır.
12 ünite/hayvan'a kadar sıçanlarda uygulanan kronik toksisite çalışmasında, sistemik toksisite belirtileri yoktu. Kronik toksisite klinik dışı çalışmalardaki etkiler clostridium botulinum tip A toksin-hemaglutinin kompleksi etki mekanizmasıyla ilişkili enjekte edilen kaslar üzerindeki değişikliklerle sınırlıdır. Tavşanların gözüne clostridium botulinum tip A hemaglutinin kompleksi uygulanmasını takiben oküler irritasyon yoktu.
6FARMASÖTIK ÖZELLIKLER
6.1Yardımcı maddelerin listesi
İnsan albumin çözeltisi, laktoz
6.2Geçimsizlikler
Bilinen bir geçimsizlik yoktur.
6.3 Raf-ömrü
Ambalajı içindeki ürünün raf ömrü 2-80C'de saklandığında 24 aydır. Ürün sulandırma sonrası 2-80C'de 8 saate kadar saklanabilir. Ürün bir antimikrobiyal ajan içermediğinden, mikrobiyolojik açıdan ürünün sulandırılması sonrası hemen uygulanması önerilir.
6.4Saklamaya yönelik özel tedbirler
Açılmamış flakonlar +2°C ve +8°C arası sıcaklıklarda (buzdolabında) saklanmalıdır. Dondurmayınız. Sulandırıldıktan sonra hemen kullanım önerilir. Buna karşın, çözeltinin 8 saat boyunca stabil kaldığı gösterilmiştir.
6.5Ambalajın niteliği ve içeriği Kap/ kapak yapısı:
3 ml kapasitede tip 1 cam flakon. 13 mm'lik bromobütil liyofilize kapaklar, 13 mm'lik merkezi delikli, sıkıştırmalı aluminyum mühürle kapatılmıştır.
Ambalajın içeriği:
Sulandırma için beyaz liyofilize toz.
6.6Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Hastanın tedavisini takiben hemen sonra, flakon veya şırınga içinde arta kalan Dysport seyreltik hipoklorit çözeltisi ile inaktive edilmelidir (% 1 klorin mevcut olan). Sonra, kullanılan tüm malzemeler standart hastane gereklilikleri ile uyum içinde imha edilmelidir.
Dökülen Dysport seyreltik hipoklorit çözeltisi emdirilmiş absorban bezle silinmelidir.
Sadece tek bir kullanım içindir. Kullanılmamış her bir çözelti atılmalıdır. Kullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği" ne uygun olarak imha edilmelidir. Çevreyi korumak amacıyla kullanılmayan DYSPORT şehir suyuna veya çöpe atılmamalıdır.
Kullanılmamış olan ürünler ya da atık materyaller, yerel düzenlemelere uygun olarak atılmalıdır.
7RUHSAT SAHİBİ
Gen İlaç ve Sağlık Ürünleri San. ve Tic. A.Ş. Mustafa Kemal Mah., 2119. Sok., No:3, D:2-3, 06520, Çankaya/ ANKARA Tel: 0312 219 62 19 Fax: 0312 219 60 10
8RUHSAT NUMARASI
112/92
9İLK RUHSAT TARİHİ/ RUHSAT YENİLEME TARİHİ
İlk ruhsat tarihi:
31/07/2002
Ruhsat yenileme tarihi:
31/07/2007
10KÜB 'ÜN YENILENME TARİHİ
Yetişkin ve yaşlılar:
Bilateral blefarospazm tedavisinde önerilen başlangıç dozu her göze 120 ünitedir.0.1 ml'lik (20 ünitelik) enjeksiyonlar gözün alt ve üst medialine, 0.2 ml'lik (40 ünitelik) enjeksiyonlar ise, her bir gözün alt ve üst orbicularis oculi kaslarının, preseptal ile orbital kısımları arasındaki kavşak içine lateral olarak yapılmalıdır. Üst göz kapağına enjeksiyonlar için iğne levator kasından sakınılarak merkezden dışarıya doğru yapılmalıdır. Aşağıdaki diyagram, bu enjeksiyonların yerlerini göstermek için yardımcıdır. Semptomların iyileşmesi, iki- dört gün içinde başlayabilir ve iki hafta içinde maksimum etkiye erişebilir.
Enjeksiyonlar, semptomların yeniden oluşumunu önlemeye yetecek kadar veya yaklaşık olarak her 12 haftada bir tekrarlanmalıdır. Bu şekildeki daha sonraki uygulamalarda doz her göz için 80 üniteye kadar azaltılabilir- önceden tanımlandığı şekilde her gözün alt ve üstüne: 0.1 ml (20 ünite) medial olarak ve 0.1 ml (20 ünite) lateral olarak. Doz, daha sonra medial alt göz kapağı enjeksiyonunun bırakılmasıyla her bir göz için 60 üniteye düşürülebilir.
0.1 ml
0.2 ml
 0.1 ml0.2 ml
0.1 ml0.2 mlUnilateral blefarospazm vakalarında enjeksiyonlar sadece hasarlı gözle sınırlandırılmalıdır. Hemifasiyal spazmı olan hastalar unilateral blefarospazmdaki gibi tedavi edilmelidir. Önerilen dozlar yaşlılar dahil tüm yaş grubundaki yetişkinlere uygulanabilir.
Çocuklarda blefarospazm ve hemifasiyal spazmda kullanım:
Çocuklarda blefarospazm ve hemifasiyal spazmda Dysport kullanımının etkinliği ve güvenliliği gösterilmemiştir.Blefarospazm ve hemifasiyal spazm tedavi edildiğinde, Dysport mililitrede 200 ünite içeren bir çözelti elde etmek için 2.5 ml sodyum klorür enjeksiyonu B.P.(% 0.9) ile sulandırılır. Dysport gözün alt ve üst
orbicularis oculi
kasının preseptal ile orbital kısımları arası kavşağa medial ve lateral subkütan enjeksiyonla uygulanır.Aksiller hiperhidroz
Pozoloji/ uygulama sıklığı ve süresi:
Yetişkinler ve yaşlılar:
Önerilen başlangıç dozu her koltuk altı için 100 ünitedir. Eğer istenen sonuç elde edilemezse, sonraki enjeksiyonlarda her bir koltuk altı için 200 üniteye kadar çıkılabilir. Enjeksiyon bölgesi uygulama öncesi iyot-nişasta testi ile belirlenebilir. Her iki koltuk altı da temizlenmeli ve dezenfekte edilmelidir. Sonrasında her bir enjeksiyon noktasına 10 ünite olacak şekilde deri içine 10 noktada (100 ünite/koltuk altı) enjeksiyonlar uygulanır. Maksimum etki enjeksiyondan 2 hafta sonra gözlenebilmelidir. Önerilen doz, vakaların çoğunluğunda yaklaşık 48 hafta kadar terlemenin yeterince baskılanmasını temin eder. Takip eden enjeksiyon zamanı, 12 haftadan önce olmayacak şekilde kişiye göre ayarlanmalıdır. Tekrarlanan dozların gittikçe artan bir etkisinin olduğuna yönelik kanıtlar vardır. Bundan dolayı hastaya verilen her bir tedavinin süresi kişiye özgü olarak belirlenmelidir.Çocuklarda aksiller hiperhidrozda kullanım:
Çocuklarda aksiller hiperhidrozda Dysport kullanımının etkinliği ve güvenliliği gösterilmemiştir.Uygulama şekli:
Dysport flakonu 2.5 ml enjeksiyonluk sodyum klorür solüsyonu B.P. (% 0.9) ile sulandırılırsa, Dysport'un her mililitresi 200 ünite içeren bir çözelti verir. Aşırı koltuk altı terlemesi tedavisinde, Dysport enjeksiyonları 10 noktadan deri içine uygulanır.Alın ve kaş bölgesindeki çizgilerin tedavisinde kullanım: Pozoloji/ uygulama sıklığı ve süresi:
Dysport sulandırıldığında sadece bir kere ve sadece bir hasta için uygulanmalıdır. Enjeksiyon öncesi ürün yukarıda verilen talimatlar izlenerek sulandırılmalıdır. Yüz üzerindeki makyaj temizlenmeli ve lokal antiseptik ile yüz dezenfekte edilmelidir. İntramüsküler enjeksiyon steril 29-30 G iğne kullanılarak deriye sağ açıda uygulanmalıdır.Önerilen doz 5 enjeksiyon bölgesine bölünmüş 50 ünite Dysport'tur (sulandırılmış çözeltinin 0.25 ml'si). Her 5 bölgeye intramüsküler olarak 10 ünite uygulanmalıdır (sulandırılmış çözeltinin 0.05 ml'si): aşağıda gösterildiği şekilde her corrugator kasına 2'şer noktaya ve nazofrontal açının civarındaki procerus kasına bir noktaya enjeksiyon yapılır.
 Anatomik sınırlar kaşların maksimum çatılarak gözlenmesi ve palpasyonu ile kolayca tespit edilebilir. Enjeksiyon öncesi, orbital kenar altına ekstravazasyonu önlemek için orbital kenar(rim) üzerine sıkıca işaret parmağı veya baş parmak konulmalıdır. İğne, enjeksiyon sırasında içe ve yukarıya doğru tutulmalıdır. Özellikle "brow-depressor complex" (depressor supercilii) aktivitesi yüksek hastalarda pitozis riskini azaltmak için levator palpebrae superioris kasının yakınına enjeksiyon yapmaktan kaçınılmalıdır. Corrugator kas içine enjeksiyonlar orbital kenarın en az 1 cm üzerinde kasın merkezi kısmına yapılmalıdır. Tedavi aralığı, değerlendirme sonrası hastanın kişisel yanıtına bağlıdır. Klinik çalışmalarda, optimal etki enjeksiyon sonrası 4 aya kadar gösterilmiştir. Bazı hastalar 5 aya kadar halen cevap verebilirler. Tedavi aralığı her 3 ayda birden daha sık olmamalıdır. Tekrarlanan enjeksiyonları takiben, tedavi başarısızlığı veya azalan etki durumunda, alternatif tedavi metodları uygulanmalıdır. İlk tedavi sonrası tedavi başarısızlığı durumunda, aşağıdaki yaklaşımlar göz önünde bulundurulmalıdır: -Hata nedeninin analizi, ör; yanlış kaslara enjeksiyon, enjeksiyon tekniği, toksin-nötralize edici antikorların oluşumu,
Anatomik sınırlar kaşların maksimum çatılarak gözlenmesi ve palpasyonu ile kolayca tespit edilebilir. Enjeksiyon öncesi, orbital kenar altına ekstravazasyonu önlemek için orbital kenar(rim) üzerine sıkıca işaret parmağı veya baş parmak konulmalıdır. İğne, enjeksiyon sırasında içe ve yukarıya doğru tutulmalıdır. Özellikle "brow-depressor complex" (depressor supercilii) aktivitesi yüksek hastalarda pitozis riskini azaltmak için levator palpebrae superioris kasının yakınına enjeksiyon yapmaktan kaçınılmalıdır. Corrugator kas içine enjeksiyonlar orbital kenarın en az 1 cm üzerinde kasın merkezi kısmına yapılmalıdır. Tedavi aralığı, değerlendirme sonrası hastanın kişisel yanıtına bağlıdır. Klinik çalışmalarda, optimal etki enjeksiyon sonrası 4 aya kadar gösterilmiştir. Bazı hastalar 5 aya kadar halen cevap verebilirler. Tedavi aralığı her 3 ayda birden daha sık olmamalıdır. Tekrarlanan enjeksiyonları takiben, tedavi başarısızlığı veya azalan etki durumunda, alternatif tedavi metodları uygulanmalıdır. İlk tedavi sonrası tedavi başarısızlığı durumunda, aşağıdaki yaklaşımlar göz önünde bulundurulmalıdır: -Hata nedeninin analizi, ör; yanlış kaslara enjeksiyon, enjeksiyon tekniği, toksin-nötralize edici antikorların oluşumu,- Dysport ile tedavinin uygunluğunu yeniden değerlendirme.
Çocuklarda alın ve kaş bölgesindeki çizgilerin tedavisinde kullanım:
18 yaşının altındaki çocuklarda alın ve kaş bölgesindeki çizgilerin tedavisinde Dysport etkinliği ve güvenliliği gösterilmemiştir.Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/ karaciğer yetmezliği:
Özel bir doz ayarlaması gerekli değildir.Pediyatrik popülasyon:
2 yaşının üzeri çocuklarda pediyatrik serebral palsi spastisite tedavisinde kullanılır. Çocuklarda aşırı koltuk altı terlemesi, hemifasiyal paralizi, blefarospazm spazmodik tortikolis, kol spastisitesi tedavilerinde Dysport'un etkinlik ve güvenilirliği gösterilmemiştir.Geriyatrik popülasyon:
Klinik çalışmalar dozaj ayarlaması gerekliliğini göstermemiştir.4.3Kontrendikasyonlar
Dysport bileşenlerden herhangi birine karşı aşırı duyarlılığı bilinen kişilerde kontrendikedir.4.4Özel kullanım uyarıları ve önlemleri
Uygulama yerinden diğer bölgelere etkinin yayılmasından dolayı bazı olgularda disfaji, pnömoni,ve/veya aşırı güçsüzlük ile ilişkili yan etkiler, çok nadir olarak ölüm bildirilmiştir (kısım 4.8'e bakınız). Terapötik dozlarla tedavi gören hastalarda aşırı kas zayıflığı olabilir. Bu şekildeki istenmeyen etkilerin oluşum riski önerilen dozun aşılmaması ve en düşük etkili dozun kullanılmasıyla azaltılabilir.Dysport belirgin defektif nöro-müsküler iletimin klinik veya sub-klinik kanıtlarını gösteren hastalarda yakın gözlem altında ve dikkatli olarak kullanılmalıdır (ör; miyastenia gravis). Bu gibi hastalarda Dysport gibi ajanlara hassasiyet artmıştır ve terapötik dozlarda aşırı kas zayıflığı oluşabilir. Öncesinde bir nörolojik hastalığı olan kişilerde bu yan etki riski daha fazladır.
Dysport yutma zorluğu ve aspirasyon öyküsü bulunan hastalarda dikkatli kullanılmalıdır. Yutma ve solunum bozuklukları toksinin uygulama bölgesinden daha uzak bölgelere yayılması ile kötüleşebilir. Aspirasyon nadir durumlarda oluşmuştur ve kronik solunum hastalığı olan spazmodik tortikolisli hastalar tedavi edildiğinde bir risk oluşturabilir. Dysport bu şekildeki hastalarda uzman denetim altında kullanılmalı ve sadece tedavinin yararı risklerden ağır bastığında kullanılmalıdır.
Dysport'un önerilen doz ve uygulama sıklığı aşılmamalıdır (Bölüm 4.2'ye bakınız).
Hastalar ve bakıcıları, yutma, konuşma veya solunum ile ilgili problemlerin gelişmesi durumunda, acil tıbbi tedavi gerekliliği konusunda uyarılmalıdır.
Çocuklarda serebral palsi ile ilişkili spastisite tedavisi için, Dysport sadece 2 yaş üzerindeki çocuklarda kullanılmalıdır.
İntramüsküler enjeksiyon şeklinde uygulandığında Dysport, önerilen enjeksiyon yerinde enflamasyon, enfeksiyon bulunan veya kanama süresi uzun olan hastalarda sadece, çok gerekli olduğunda kullanılmalıdır.
Dysport tek bir durumda tek bir hastayı tedavi etmek için kullanılmalıdır. Arta kalan kullanılmamış ürün kısım 6.6. ile uyum içinde atılmalıdır. Ürünün hazırlanması, uygulanması, kullanılmamış olan çözeltinin inaktivasyon ve atılımı için özel dikkat edilmelidir (kısım 4.2).
Bu ürün az miktarda insan albumini içermektedir. Viral enfeksiyonların geçiş riski, insan kanı veya kan ürünlerinin kullanımını takiben kesin olarakdışlanamaz.
Dysport alan hastalarda botulinum toksinine karşı nadiren antikor oluşumu bildirilmiştir. Klinik olarak nötralize edici antikorlar tedaviye karşı yanıtta kötüleşmeye neden olabilir veya dozun artırılmasını gerektirebilir.
Öncesinde botulinum toksin tip A içeren ürünlere alerjik reaksiyon göstermiş kişilerde enjeksiyon öncesi dikkat edilmelidir. Tedavinin yararına ilişkin başka alerjik reaksiyon oluşması göz önünde bulundurulmalıdır.
Kaşlar arasında oluşan çizgilerin tedavisinde kullanıldığında, uygulama öncesi hastanın yüz anotomisinin incelenmesi gerekmektedir. Yüzde asimetri, pitoz, aşırı dermatoşalazis (dermatochalasis), sikatris ve bu anatomide değişiklikler veya önceki cerrahi müdahale sonuçları göz önünde bulundurulmalıdır. Hedef kasın aşırı zayıflık veya atrofi göstermesi durumunda dikkat edilmelidir.
Dysport ile tedavi boyunca farklı tip botulinum nörotoksinlerinin uygulanma etkileri bilinmemektedir ve bu nedenle sakınılmalıdır.
Bu ürün 2.5 gram laktoz içerir. Nadir kalıtımsal galaktoz intoleransı, lapp laktoz yetmezliği ya da glikozgalaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Botulinum toksininin etkileri, nöromüsküler fonksiyonu direkt veya indirekt olarak etkileyen ilaçlarla artabilir (Ör; aminoglikozidler, kürar benzeri non-depolarizan blokörler) ve bu ilaçlar botulinum toksini ile tedavi gören hastalarda dikkatli kullanılmalıdır.Özel popülasyonlara ilişkin ek bilgiler:
Pediyatrik popülasyon:
Pediyatrik popülasyonda etkileşim çalışmaları yapılmamıştır.Geriyatrik popülasyon:
Geriyatrik popülasyonda etkileşim çalışmaları yapılmamıştır.4.6 Gebelik ve laktasyon Genel Tavsiye: Gebelik Kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/ Doğum kontrolü (Kontrasepsiyon):
Dysport ile ilgili hayvanlarda teratolojik çalışmaları uygulanmamıştır. Hamile kadınlarda Dysport kullanım ve etkinliği gösterilmediğinden, hamilelik sırasında Dysport kullanılmamalı ve tedavi süresince etkili doğum kontrolü uygulanmalıdır.Gebelik dönemi:
Clostridium botulinum tip A toksin hemaglutinin kompleksinin hamile kadınlarda kullanımına ilişkin limitli veriler mevcuttur.Hayvanlardaki çalışmalar maternal toksisiteye neden olan dozlarda üreme üzerine toksisite göstermiştir (kısım 5.3'e bakınız). Dysport hamilelik sırasında sadece yarar fetüse karşı potansiyel riski doğruladıkça kullanılmalıdır. Hamile kadınlara verildiğinde özel dikkat verilmelidir.Laktasyon dönemi:
Clostridium botulinum tip A hemaglutinin kompleksinin anne sütüne geçip geçmediği bilinmemektedir. Clostridium botulinum tip A hemaglutinin kompleksinin süte geçmesi hayvanlarda çalışılmamıştır. Bu nedenle Clostridium botulinum tip A hemaglutinin kompleksinin laktasyon sırasında kullanımı önerilmez.Üreme yeteneği/ Fertilite:
Yüksek dozlar doza bağlı olarak fertilitede azalma ve testiküler atrofiye neden olmuştur. Embriyo üzerine yan etkiler görülmemiştir.4.7Araç ve makine kullanımı üzerindeki etkiler
Araç ve makine kullanım yeteneğini etkileyebilecek kas güçsüzlüğü ve görsel bozuklukların oluşma riskleri bulunmaktadır.4.8İstenmeyen etkiler
Çok yaygın >1/10; Yaygın >1/100,<1/10; Yaygın olmayan >1/1000, <1/100; Seyrek >1/10 000, < 1/1000; Çok seyrek <1/10 000
Uygulama yerinden daha uzak bölgelere toksinin yayılması ile ilişkili yan etkiler bildirilmiştir (aşırı kas güçsüzlüğü, disfaji, çok nadir vakalarda ölümcül sonuçlar veren aspirasyon/aspirasyon pnömonisi) (kısım 4.4'e bakınız).
Genel:
Klinik çalışma programında, Dysport ile tedavi gören hastaların yaklaşık olarak % 28'inde yan etkiler görülmüştür.
İnme veya serebral palsi ile ilişkili spastisite, tortikolis, hemifasiyel spazm, blefarospazm dahil değişik endikasyonlar için tedavi gören hastalarda şu yan etkiler gözlenmiştir:
Sinir sistemi hastalıkları:
Seyrek: Nevraljik kas erimesi (Nevraljik amyotrofi)
Deri ve subkütan doku hastalıkları
Yaygın değil: Kaşıntı Seyrek: Deride döküntüGenel hastalıklar ve uygulama yeri koşulları
Yaygın: Genel güçsüzlük, yorgunluk, grip-benzeri sendrom ve ağrı/ enjeksiyon bölgesinde morarma
İlaveten, kişisel endikasyona spesifik şu yan etkiler bildirilmiştir:
İnme sonrası yetişkinlerde kol spastisitesi
Gastrointestinal hastalıklar
Yaygın: DisfajiKas-iskelet ve konnektif doku hastalıkları
Yaygın: Kolda kas güçsüzlüğüYaralanma, z^ehirlenme ve yöntemsel komplikasyonlar
Yaygın: Kazaren yaralanma/ düşmeSerebral palsiden dolayı pediyatrik bacak spastisitesi
Gastrointestinal hastalıklar
Yaygın: Diyare, kusmaKas-iskelet ve konnektif doku hastalıkları
Yaygın: Bacak kasında güçsüzlükBöbrek ve üriner hastalıklar
Yaygın: İdrar kaçırmaGenel hastalıklar ve uygulama yeri koşulları
Yaygın: Anormal yürüyüşYaralanma, zehirlenme ve yöntemsel komplikasyonlar
Yaygın: Düşmeden dolayı kazaren incinmeDüşmeden dolayı kazaren incinme ve anormal yürüyüş, ambulasyon ve denge ile ilişkili diğer kaslara Dysport yayılması ve/veya hedef kaslarda aşırı zayıflıktan dolayı oluşabilir.
Spasmodik tortikolis
Sinir sistemi hastalıkları
Yaygın: Disfoni Yaygın değil: Baş ağrısıGöz hastalıkları
Yaygın değil: Diplopi, görmede bulanıklık
Solunum, torasik ve mediastinal hastalıklar
Seyrek: Solunum hastalıklarıGastrointestinal hastalıklar
Çok yaygın: Disfaji Yaygın değil: Ağız kuruluğuKas-iskelet ve konnektif doku hastalıkları
Yaygın: Boyun kasında güçsüzlük.Disfaji, sternomastoid kasına enjeksiyonu takiben daha sık olarak oluşmakta ve dozla ilişkili olarak görünmektedir. Semptomlar iyileşinceye kadar hafif diyet gereklidir.
Bu yan etkilerin iki-dört hafta içinde iyileşmesi beklenir.
Blefarospasm ve hemifasiyel spasm
Sinir sistemi hastalıkları
Yaygın: Yüz kaslarında güçsüzlük Yaygın değil: Yüz sinirlerinde pareziGöz hastalıkları
Çok yaygın: PitozYaygın: Diplopi, gözde kuruluk, gözde yaşarma Seyrek: Oftalmopleji
Deri ve subkütan deri hastalıkları
Yaygın: Göz kapağında ödem Seyrek: Göz kapaklarının içe kıvrılmasıYan etkiler, diğer yakın kas gruplarının geçici olarak paralizisi, Dysport'un derin veya yanlış yere enjeksiyonlarından dolayı oluşabilir.
Aksiller hiperhidroz
Dysport ile tedavi gören yaklaşık 217 hastayı kapsayan 4 klinik çalışmada şu yan etkiler bildirilmiştir:
Deri ve subkütan deri hastalıktan
Yaygın: Kompensatuvar terlemeAlın ve kaş bölgesindeki çizgilerin tedavisi (Glabellar çizgiler)
Sinir sistemi hastalıkları
Çok yaygın: baş ağrısıYaygın: yüz parezisi (alında parezi olarak tanımlanan) Yaygın değil: baş dönmesi
Göz hastalıkları
Yaygın: görme zayıflığı, pitoz, göz kapağında ödem, göz yaşında artış, göz kuruluğu, gözün çevresindeki kaslarda seğirme
Yaygın değil: görme bozuklukları, bulanık görme, diplopi
Seyrek: gözün hareket bozukluğu
Deri ve deri altı doku hastalıkları
Yaygın değil: kaşıntı, döküntü
Seyrek: ürtiker
Genel bozukluklar ve uygulama bölgesine ilşkin durumlar
Çok yaygın: enjeksiyon bölgesi reaksiyonları (eritem, ödem, irritasyon, döküntü, kaşıntı, parestezi, ağrı, rahatsızlık, batma ve çürükler)
Bağışıklık sistemi hastalıkları
Yaygın değil: Aşırı duyarlılıkPazarlama sonrası deneyim
Pazarlama sonrası kullanım sırasında firmaya bildirilen yanetki profili, ürünün
farmakolojisini yansıtır ve klinik çalışmalarda görülenlerle aynıdır.Nadir aşırı duyarlılık reaksiyonları bildirilmiştir.
4.9 Doz aşımı ve tedavisi
Aşırı dozlar uzakta ve derin nöro-müsküler paralizi oluşturabilir. Aşırı dozlar dolaşıma nörotoksin geçme riskini artırabilir ve oral botulinum zehirlenmesi etkileri ile ilişkili komplikasyonlara neden olabilir (ör; disfaji ve disfoni). Aşırı dozlar solunum kaslarının paralizine neden olduğunda solunum desteği gerekebilir. Spesifik bir antidot yoktur; antitoksinin yararlı olması beklenmez ve genel destekleyici tedavi önerilir. Aşırı dozaj durumunda hasta sistemik güçsüzlük veya kas paralizisi belirtileri gösterdiğinde tıbbi olarak izlenmelidir. Eğer gerekiyorsa semptomatik tedavi uygulanmalıdır.Aşırı dozaj semptomları enjeksiyonu takiben hemen görülmeyebilir. Kazaren enjeksiyon veya oral alım olursa, kişi kas paralizi veya aşırı kas zayıflığı semptom ile belirtileri bakımından bir kaç hafta boyunca tıbbi olarak denetlenmelidir.
5FARMAKOLOJİK ÖZELLİKLER
5.1Farmakodinamik özellikler
Farmakoterapötik grup:ATC kodu:
M03AX01Clostridium botulinum tip A toksin-hemaglutinin kompleksi asetilkolin salıverilmesine karşı proksimal bölgede presinaptik etkiyle nöromüsküler kavşakta periferik kolinerjik transmisyonu bloke eder. Toksin, transmitter verilmesinde aracı olan Ca+2 ile tetiklenen olayları antagonize ederek sinir ucunda etki gösterir. Postganglionik kolinerjik transmisyonu ya da postganglionik sempatik transmisyonu etkilemez.
Toksinin etkisi presinaptik sinir membranına hızlı bir şekilde bağlandığı yerde başlar. İkinci basamak, toksinin paralizi başlangıcına neden olmadan presinaptik membranı geçtiği internalizasyon basamağıdır. Son olarak, toksin Ca+2 aracılı asetilkolin salınımını inhibe eder; böylece son plak potansiyelini azaltır ve paraliziye neden olur.
İmpuls geçişinin yeniden kazanılması yeni sinir terminallerinin oluşması ile dereceli bir şekilde oluşur, post sinaptik motor son plağı ile temas gerçekleştirilir. Bu proses deney hayvanlarında 6-8 hafta sürer.
5.2Farmakokinetik özellikler
Genel özellikler:
Botulinum toksini ile farmakokinetik çalışmalar, yüksek potensi, az dozları içermesi, bileşiğin büyük moleküler ağırlığı, yeterli yüksek spesifik aktivite oluşturmak için toksinin işaretlenme güçlüğü nedeniyle hayvanlarda pek çok probleme neden olmuştur. I125 işaretli toksin kullanılarak yapılan çalışmalar reseptör bağlanmasının spesifik ve doyurulabilir olduğunu, toksin reseptörlerinin yüksek dansitesinin yüksek potens sağlamada önemli faktör olduğunu göstermiştir. Maymunlardaki doz ve zaman yanıtları düşük dozların 2-3 günlük gecikmeyle enjeksiyondan 5-6 gün sonra pik etkisini yaptığını göstermiştir. Kas paralizisi ve oküler değişiklikler ile ölçülen etki süresi 2 hafta ile 8 ay arasında değişir. Bu örnek aynı zamanda insanlarda da görülür ve nöromüsküler kavşaktaki değişikliklere, internalizasyona, bağlanma prosesine atfedilebilir.
Emilim:
Botulinum toksini tip A'nın önerilen dozlarda intramüsküler enjeksiyonunu takiben periferik kanda ölçülebilir düzeylerde bulunması beklenmez.
Dağılım:
Her tedavide uygulanan nörotoksinin önerilen miktarları, başka bir nöromüsküler disfonksiyonu bulunmayan hastalarda sistemik ya da klinik etkilere neden olmaz.
Biyotransformasyon:
Klinik çalışmalar Dysport uygulama yerinden uzaktaki kaslarda klinik elektromiyografik parametrelerde değişiklikler olduğunu göstermiştir. Bu toksinin kan dolaşımıyla yayılması, retro- veya orto- derecede aksonal iletime uğraması, üçüncü, merkezi ya da teşhis edilemeyen bölgelerde toksinin etkilerine bağlanabilir.
Eliminasyon:
intramüsküler olarak uygulanan toksinin sistemik dolaşıma katılarak eliminasyonu ufak düzeylerdedir.
Doğrusallık/ doğrusal olmayan durum:
Dysport uygulanan doza bağlı olarak doğrusal bir atılım gösterir.
5.3 Klinik öncesi güvenlilik verileri
Hamile sıçanlara ve tavşanlara sırasıyla 6.6 ünite/kg (79 ünite/kg total kümülatif doz) ve 3.0 ünite/kg (42 ünite/kg kümülatif doz) dozlarında günlük intramüsküler enjeksiyon ile clostridium botulinum tip A toksin-hemaglutinin kompleksi verilen üreme toksisite çalışmalan,embriyo/fetal toksisite göstermemiştir. Maternal toksik dozlarda implantasyon kayıpları her iki türde de yüksek dozlarda gözlenmiştir. Clostridium botulinum tip A toksin-hemaglutinin kompleksinin sıçan ve tavşanlarda teratojenik olmadığı gösterilmiştir, sıçanlarda F1 jenerasyonu üzerinde pre ve post natal çalışmalarda etkiler gözlenmemiştir. Erkek ve dişi sıçanların fertilitesi, dişilerde haftalık 20 ünite/kg artan implantasyon kaybı ve erkeklerde haftalık 29.4 ünite/kg dozlarında kas paralizine sekonder azalan çiftleşmeden dolayı azalmıştır.12 ünite/hayvan'a kadar sıçanlarda uygulanan kronik toksisite çalışmasında, sistemik toksisite belirtileri yoktu. Kronik toksisite klinik dışı çalışmalardaki etkiler clostridium botulinum tip A toksin-hemaglutinin kompleksi etki mekanizmasıyla ilişkili enjekte edilen kaslar üzerindeki değişikliklerle sınırlıdır. Tavşanların gözüne clostridium botulinum tip A hemaglutinin kompleksi uygulanmasını takiben oküler irritasyon yoktu.
6FARMASÖTIK ÖZELLIKLER
6.1Yardımcı maddelerin listesi
İnsan albumin çözeltisi, laktoz6.2Geçimsizlikler
Bilinen bir geçimsizlik yoktur.6.3 Raf-ömrü
Ambalajı içindeki ürünün raf ömrü 2-80C'de saklandığında 24 aydır. Ürün sulandırma sonrası 2-80C'de 8 saate kadar saklanabilir. Ürün bir antimikrobiyal ajan içermediğinden, mikrobiyolojik açıdan ürünün sulandırılması sonrası hemen uygulanması önerilir.6.4Saklamaya yönelik özel tedbirler
Açılmamış flakonlar +2°C ve +8°C arası sıcaklıklarda (buzdolabında) saklanmalıdır. Dondurmayınız. Sulandırıldıktan sonra hemen kullanım önerilir. Buna karşın, çözeltinin 8 saat boyunca stabil kaldığı gösterilmiştir.6.5Ambalajın niteliği ve içeriği Kap/ kapak yapısı:
3 ml kapasitede tip 1 cam flakon. 13 mm'lik bromobütil liyofilize kapaklar, 13 mm'lik merkezi delikli, sıkıştırmalı aluminyum mühürle kapatılmıştır.Ambalajın içeriği:
Sulandırma için beyaz liyofilize toz.6.6Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Hastanın tedavisini takiben hemen sonra, flakon veya şırınga içinde arta kalan Dysport seyreltik hipoklorit çözeltisi ile inaktive edilmelidir (% 1 klorin mevcut olan). Sonra, kullanılan tüm malzemeler standart hastane gereklilikleri ile uyum içinde imha edilmelidir.Dökülen Dysport seyreltik hipoklorit çözeltisi emdirilmiş absorban bezle silinmelidir.
Sadece tek bir kullanım içindir. Kullanılmamış her bir çözelti atılmalıdır. Kullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği" ne uygun olarak imha edilmelidir. Çevreyi korumak amacıyla kullanılmayan DYSPORT şehir suyuna veya çöpe atılmamalıdır.
Kullanılmamış olan ürünler ya da atık materyaller, yerel düzenlemelere uygun olarak atılmalıdır.
7RUHSAT SAHİBİ
Gen İlaç ve Sağlık Ürünleri San. ve Tic. A.Ş. Mustafa Kemal Mah., 2119. Sok., No:3, D:2-3, 06520, Çankaya/ ANKARA Tel: 0312 219 62 19 Fax: 0312 219 60 108RUHSAT NUMARASI
112/929İLK RUHSAT TARİHİ/ RUHSAT YENİLEME TARİHİ
İlk ruhsat tarihi:
31/07/2002Ruhsat yenileme tarihi:
31/07/200710KÜB 'ÜN YENILENME TARİHİ
İlaç Bilgileri
Dysport 500 U enjeksiyonluk çözelti için toz içeren flakon
Etken Maddesi: Clostridium botulinum tip A toksin-hemaglutinin kompleksi
Atc Kodu: M03AX01
Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.