Botox liyofilize toz içeren flakon Kısa Ürün BilgisiKas İskelet Sistemi » Kas Gevşeticiler » Periferik Etkili Kas Gevşeticiler » Diğer İlaçlar » Botulinum Toksini KISA URUN biLGİSİ1.BEŞERITIBBI URUNUN ADIBOTOX® liyofilize toz içeren flakon2.KALITATIF VE KANTİTATIF BİLEŞİMEtkin madde:Botulinum toksini tip A*, 100 Allergan Ünitesi/flakon.*Botulinum toksini Clostridium botulinum'danürünler arasında birbirinin yerine kullanılamaz.Yardımcı maddeler:Yardımcı maddeler arasında, 0.9 mg sodyum klorür içermektedir. İlgili uyarı için 4.4 Özel kullanım uyarıları ve önlemleri bölümüne bakınız.Yardımcı maddelerin tam bir listesi için, Bölüm 6.1'e bakınız. 3.FARMASÖTIK FORMEnjeksiyon solüsyonu için toz. Beyaz toz.4.KLİNİK ÖZELLIKLER4.1 Terapötik endikasyonlarBOTOX®, 2 yaş ve üzeri çocuklarda aşağıdaki tabloların tedavisi için endikedir:Ambulatuar pediyatrik serebral palsi hastalar ığıdinamik equinus ayak deformitesi ile ilişkili fokal spastisitedeBOTOX®, yetişkinlerde ve 12 yaş üstü çocuklarda aşağıdaki tabloların tedavisi için endikedir: Blefarospazm, hemifasyal spazm ve ili şkili fokal distonilerStrabismus BOTOX®, yetişkinlerde aşağıdaki tabloların tedavisi için endikedir: Servikal distoni (spazmodik tortikolis) Erişkin hastalarda inme sonrası gözlenen bilek ve el fokal spastisite Kronik migreni (her ay en az 8 günü migren şeklinde olan, en az 15 gün süreyle baş ağrıları) olan erişkinlerde baş ağrılarının profilaksisi için endikedir. Kronik migren yanı sıra aşırı ilaç kullanımı başağrısı olan hastalarda en az iki ay süre ile profilaksisiz ve profilaksili tedavi dönemine rağmen (kötü ilaç kullanımının bırakılması ve medikal tedavi) baş ağrılarının geçmediği hastalarda baş ağrılarının profilaksisi için BOTOX® erişkinlerde aksillada günlük yaşam aktivitelerini etkileyen ve topikal tedaviye dirençli olan, inatçı şiddetli primer hiperhidroz tedavisi için endikedir. BOTOX® aynı zamanda, 65 yaşına gelmemiş erişkinlerde, kaşlar çatık iken aralarında oluşan orta ile ileri derecede derin vertikal çizgiler hastanın psikolojisini önemli oranda etkiliyorsa, bu çizgilerin görünümünde geçici iyileşme elde etmek için de endikedir. 4.2 Pozoloji ve uygulamaşekliPozoloji, uygulama sıklığı ve süresi / Uygulamaşekli:Botulinum toksini üniteleriürünler arasında birbirinin yerine kullanılamaz. Allergan Ünitesi olarak önerilen dozlar, başka botulinum toksini preparatlarından farklıdır.BOTOX® yalnızca steril sodyum klorür 9 mg/mL (%0.9) enjeksiyon solüsyonu ile sulandırılarak hazırlanmalıdır. Uygun miktardaki seyreltici (aşağıdaki seyreltim tablosuna bakınız) içeren enjektöre çekilmelidir. BOTOX® 100 Allergan Ünitesi flakon büyüklüğü için seyreltim tablosu:
ııçıııır.Flakonların kullanımı, işlenmesi ve elden çıkarılması konusundaki talimatlar için lütfen bölüm 6.6'ya bakınız. BOTOX® yalnızca uygun niteliklere sahip, tedavi ve gerekli ekipmanların kullanımı konusunda uzmanlık sahibi doktorlar tarafından uygulanmalıdır. Elektromiyografi rehberliği enjeksiyon hassasiyetini artırabilir. Enjeksiyon iğnesinin ucu tarafından kaydedilen elektrik aktivitesi, iğneyi hedef kas içerisinde pozisyonlandırırken bir rehber olarak kullanılır. Bu rehberlik strabismus tedavisi için zorunludur. BOTOX®, sulandırılarak hazırlandıktan sonra, her hastada yalnızca bir enjeksiyon uygulama seansı için kullanılmalıdır.Bütün endikasyonlar için genel olarak geçerli optimum doz düzeyleri ve kas başına enjeksiyon bölgelerinin sayısı belirlenmemiştir. Dolayısıyla bu gibi durumlarda, doktor tarafından bireysel tedavi rejimleri planlanmalıdır. Optimum doz düzeyleri titrasyon yoluyla belirlenmeli, ancak önerilen maksimum doz aşılmamalıdır. Glabellar çizgiler için, her kas bölgesi başına önerilen enjeksiyon hacmi 0.1 mL'dir. Aynı zamanda bölüm 6.6'daki seyreltim tablosuna da bakınız. Glabellar çizgiler içine enjekte edilirken, BOTOX®'un bir kan damarı içine enjekte edilmediğinden emin olunmalıdır. Blefarospazm/hemifasyal spazmSulandırılmış BOTOX® steril bir 27-30 gauge/0.40-0.30 mm iğne kullanılarak enjekte edilir. Elektromiyografi rehberliği gerekli değildir. Önerilen başlangıç dozu 1.25-2.5 Ünite'dir ve üst göz kapağında medial ve lateral orbicularis oculi'ye ve alt göz kapağında lateral orbicularis oculi'ye enjekte edilir. Kaş alanındaki ek bölgeler olan lateral orbicularis ve yüzün üst bölgesine de, eğer bu bölgelerdeki spazmlar görmeyi etkiliyor ise, enjeksiyon yapılabilir. Levator palpebrae superioris yakınlarına enjeksiyon yapmaktan kaçınılması, pitozis komplikasyonunu azaltabilir. Alt göz kapağının medyaline enjeksiyon yapmaktan kaçınılması, inferior oblique içine difüzyonu azaltarak, diplopi komplikasyonunu azaltabilir. Aşağıdaki şemalarda enjeksiyon yapılabilecek olası bölgeler gösterilmektedir: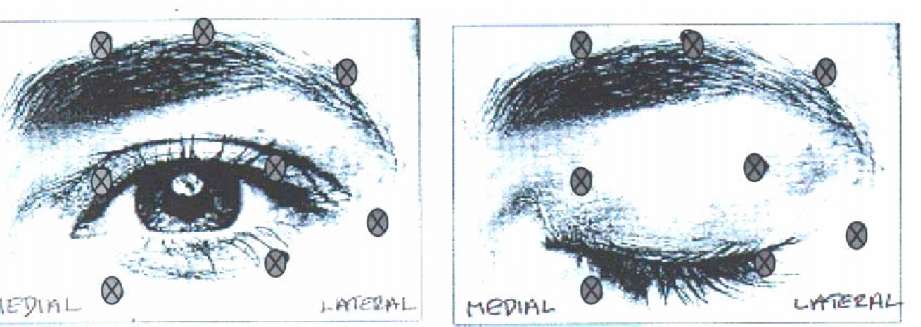 Genel olarak, enjeksiyonların etki başlangıcı üç gün içerisinde görülür ve tedavi sonrası bir ile iki haftada doruk düzeye ulaşılır. Her bir tedavi yaklaşık üç ay kalıcı olur, sonrasında prosedür ihtiyaca göre tekrarlanabilir. Eğer başlangıç tedavisine alınan yanıt yetersiz bulunmuşsa, tekrarlanan tedavi seanslarında doz iki katına kadar artırılabilir. Ancak, bölge başına 5 Ünite'den daha fazla enjekte edilmesinden sağlanan yararın az olduğu görülmektedir. Başlangıç dozu bir göz için 25 Ünite'yi aşmamalıdır. Olağan halde, üç ayda birden daha sık tedavi uygulamasından ek bir yarar elde edilmez.
Genel olarak, enjeksiyonların etki başlangıcı üç gün içerisinde görülür ve tedavi sonrası bir ile iki haftada doruk düzeye ulaşılır. Her bir tedavi yaklaşık üç ay kalıcı olur, sonrasında prosedür ihtiyaca göre tekrarlanabilir. Eğer başlangıç tedavisine alınan yanıt yetersiz bulunmuşsa, tekrarlanan tedavi seanslarında doz iki katına kadar artırılabilir. Ancak, bölge başına 5 Ünite'den daha fazla enjekte edilmesinden sağlanan yararın az olduğu görülmektedir. Başlangıç dozu bir göz için 25 Ünite'yi aşmamalıdır. Olağan halde, üç ayda birden daha sık tedavi uygulamasından ek bir yarar elde edilmez.Blefarospazm tedavisinde toplam doz 12 haftada bir 100 Ünite'yi aşmamalıdır. Hemifasyal spazmı ya da VII. sinir bozuklukları olan hastalar unilateral blefarospazmdaki gibi tedavi edilmelidir; etkilenen diğer yüz kaslarına ihtiyaca göre enjeksiyon yapılmalıdır. Strabismus2.5 Ünite/0.1 mL içeren bir solüsyon hazırlanır (bkz. 6.6, Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler). 40 mm uzunluğunda 27-gauge bir iğne kullanılır.BOTOX® ekstra-oküler kaslar içine enjekte edilir ve elektromiyografi rehberliği gereklidir (bkz. elektromiyografi rehberliği hakkındaki önceki bölüm). Gözün BOTOX® enjeksiyonuna hazırlanması için, enjeksiyondan birkaç dakika önce, birkaç damla lokal anestezik ve oküler dekonjestan uygulanmalıdır. Başlangıç dozları: Hafif sapmaların tedavisi için en düşük dozlar, daha belirgin sapmalarda ise daha yüksek dozlar kullanılır. Vertikal kaslar için ve 20 prizm diyoptriden dü şüçin: Herhangi bir kas tipinde 1.25 - 2.5 Ünite (0.05 ile 0.10 mL).20 ile 50 prizm diyoptri arası horizontal strabismus için: Herhangi bir kas tipinde 2.5 ile 5 Ünite (0.10 ile 0.20 mL). Bir ay ya da daha uzun süren inatçı eksternal okülomotor sinir felci için: Medial rectus kasına 1.25 ile 2.5 Ünite (0.05 ile 0.10 mL). Seyreltilmiş BOTOX®'un başlangıç için verilen dozları, genellikle, enjekte edilen kaslarda enjeksiyondan sonra 1 ya da 2 gün içinde paralizi oluşturur. Paralizinin yoğunluğu ilk hafta boyunca artar. Paralizi 2 ile 6 hafta sürer ve yaklaşık olarak benzer bir dönem içinde giderek azalır. Altı aydan uzun süren düzelmeler enderdir. Tedavi edilen hastaların yaklaşık yarısında, başlangıç dozundan sonra kasın yeterince paralize olmaması nedeniyle veya geniş sapmalar ya da kısıtlamalar gibi mekanik faktörlere bağlı olarak veya düzelmeyi stabilize etmek için gerekli olan binoküler motor füzyonun bulunmaması nedeniyle ilave dozlar gerekecektir. Hastaların her enjeksiyondan 7-14 gün sonra, o dozun etkisini değerlendirmek için yeniden muayene edilmesi önerilmektedir. Hedef kasta yeterli paralizi elde edilen hastalarda sonraki dozlar, başlangıçtaki doz ile kıyaslanabilir olmalıdır. Hedef kasta yeterli paralizi elde edilemeyen hastalarda sonraki dozlar, önceden uygulanan doza kıyasla iki katına kadar artırılabilir. Daha sonraki enjeksiyonlar önceki dozun etkileri kayboluncaya kadar uygulanmamalıdır; enjeksiyon yapılan kaslar ve komşu kaslarda fonksiyonun geri dönmesi, etki kaybının göstergesidir. Herhangi bir kas için önerilen maksimum tek enjeksiyon dozu 25 Ünite'dir. Strabismus tedavisi için enjekte edilmesi önerilen BOTOX® hacmi, kas başına 0.05 mL ile 0.15 mL'dir. Servikal distoniSulandırılmış BOTOX® uygun boyutlarda bir iğne kullanılarak enjekte edilir (genellikle 25-30 gauge/0.50-0.30 mm).Klinik araştırmalarda servikal distoni tedavisinde tipik olarak sternocleidomastoid, levator scapulae, scalene, splenius capitis, semispinalis, longissimus ve/veya trapezius kası/kaslarına BOTOX® enjeksiyonları uygulanmıştır. Bu liste tam bir liste değildir, çünkü baş pozisyonunun kontrol edilmesinden sorumlu kaslardan herhangi biri tutulabilir ve dolayısıyla tedavi gerektirebilir. Kasın kütlesi ve hipertrofi ya da atrofi derecesi, uygun doz seçilirken dikkate alınması gereken faktörlerdir. Servikal distonide, distoninin klinik prezantasyonunda bir değişiklik olmaksızın, kas aktivasyon paternleri spontan olarak değişebilir. Tekil kasların izole edilmesinde herhangi bir güçlük durumunda, enjeksiyonlar elektromiyografi yardımıyla yapılmalıdır. Servikal distonide güvenlilik ve etkinliğin belirlenmesi amacıyla, başlangıçta yürütülen kontrollü klinik araştırmalarda, sulandırılmış BOTOX® dozları 140 ile 280 Ünite arasındaydı. Daha yeni çalışmalarda, 95 ile 360 Ünite arasında değişen dozlar kullanılmıştır (ortalama yaklaşık 240 Ünite). Herhangi bir ilaç tedavisinde olduğu gibi, tedavi-naif bir hastada başlangıç doz uygulaması etkili en düşük doz ile başlatılmalıdır. Herhangi bir bölgeye 50 Ünite'den fazlası verilmemelidir. Sternomastoide 100 Ünite'den fazlası verilmemelidir. Disfaji insidansını en aza indirmek için, sternomastoid bilateral olarak enjekte edilmemelidir. İlk tedavi küründe toplam 200 Ünite'den fazlası enjekte edilmemeli ve daha sonraki kürlerde başlangıç yanıtına göre uyarlamalar yapılmalıdır. Herhangi bir seansta toplam 300 Ünite'lik doz aşılmamalıdır. Enjeksiyon bölgelerinin optimal sayısı kasın büyüklüğüne bağlıdır. Klinik gelişim genel olarak, enjeksiyondan sonraki ilk iki hafta içerisinde ortaya çıkar. Maksimum klinik yarar genel olarak, enjeksiyondan sonra yaklaşık altı haftada ortaya çıkar. On haftadan daha kısa tedavi aralıkları önerilmemektedir. Klinik araştırmalarda bildirilen yararlı etki süresi belirgin değişkenlik göstermiş (2 ile 33 hafta) ve tipik süre yaklaşık 12 hafta olmuştur. Pediyatrik serebral palsiSeyreltilmiş BOTOX® steril bir 23-26 gauge/0.60-0.45 mm iğne kullanılarak enjekte edilir. Doz bölünerek, tutulan gastrocnemius kasının medial ve lateral başlarına tek enjeksiyonlar şeklinde uygulanır. Hemiplejide önerilen toplam başlangıç dozu, tutulan uzuvda 4 Ünite/kg'dır. Diplejide önerilen toplam başlangıç dozu olan 6 Ünite/kg, tutulan uzuvlar arasında bölünür. Toplam doz 200 Ünite'yi geçmemelidir.Klinik gelişim genel olarak, enjeksiyondan sonraki ilk iki hafta içerisinde ortaya çıkar. Tekrar dozları bir önceki enjeksiyonun klinik etkisi azaldığında uygulanmalı, ancak üç ayda birden daha sık olmamalıdır. Doz rejiminin, tedavi seansları arasında en az altı ay olacak şekilde uyarlanması mümkün olabilir. İnmeye bağlı fokal üst uzuv spastisitesiSulandırılmış BOTOX® yüzeyel kaslar için steril bir 25, 27 ya da 30 gauge iğne ve derin kaslar için daha uzun bir iğne kullanılarak enjekte edilir. Tutulan kasların lokalize edilmesinde elektromiyografi rehberliği ya da sinir stimülasyon teknikleri yararlı olabilir. Çok sayıda bölgeye enjeksiyon uygulaması, BOTOX®'un kastaki innervasyon alanlarıyla daha dengeli bir şekilde temasını sağlayabilir ve büyük kaslarda özellikle yararlıdır.Doğru dozaj ve enjeksiyon bölgelerinin sayısı; tutulan kasların büyüklük, sayı ve lokasyonu, spastisitenin şiddeti, lokal kas zayıflığı bulunması ve hastanın önceki tedaviye verdiği yanıt temelinde, bireye göre belirlenmelidir. Kontrollü klinik araştırmalarda aşağıdaki dozlar uygulanmıştır:
Kontrollü klinik araştırmalarda hastalar tek tedavi seansından sonra 12 hafta süreyle izlenmiştir. Kas tonüsünde düzelme iki hafta içinde ortaya çıkmış, ve doruk etki genel olarak dört ile altı hafta içerisinde görülmüştür. Açık tasarımlı, kontrollü olmayan bir devam çalışmasında hastaların çoğuna, 12 ile 16 haftalık aralarla, kas tonüsü üzerindeki etki azaldığında yeniden enjeksiyon yapılmıştır. Bu hastalara 54 hafta boyunca, maksimum kümülatif doz 960 Ünite olacak şekilde, en fazla dört enjeksiyon yapılmıştır. Eğer tedavi eden doktor uygun görürse, bir önceki enjeksiyonun etkisi ortadan kalktığında tekrar dozları uygulanabilir. Tekrar enjeksiyon uygulamaları 12 haftadan önce yapılmamalıdır. Tekrar enjeksiyon zamanında kas spastisitesinin derecesi ve paterni, BOTOX® dozunda ve enjeksiyon yapılacak kaslarda değişiklik yapılmasını gerektirebilir. Etkin en düşük doz kullanılmalıdır. Primer aksiller hiperhidrozSulandırılmış BOTOX® (100 Ünite/4 mL) 30 gauge iğne kullanılarak enjekte edilir. 50 Ünite BOTOX®, her bir aksillanın hiperhidrotik alanı içerisinde 1-2 cm civarında aralıkları olan çok sayıda bölgeye eşit bir şekilde paylaştırılarak, intradermal olarak enjekte edilir. Hiperhidrotik alan standart boyama teknikleri, örn. Minor iyot-nişasta testi kullanılarak belirlenebilir. Aksilla başına 50 Ünite'nin dışındaki dozlar incelenmemiştir ve bu nedenle önerilmemektedir.Klinik düzelme genel olarak enjeksiyondan sonraki ilk hafta içinde ortaya çıkar. Bir önceki enjeksiyonun klinik etkisi azaldığında ve tedavi eden doktor gerekli gördüğünde BOTOX® enjeksiyonu tekrar edilebilir. Enjeksiyonlar 16 haftadan daha sık tekrarlanmamalıdır (bkz. bölüm 5.1). Kronik MigrenKronik migren tedavisi için önerilen seyreltilmiş BOTOX® dozu, 30-gauge, 1.27 cm (0.5 inç) iğne kullanılarak intramuskuler yoldan (IM) uygulanan 155 Ünite ile 195 U'dir. Enjeksiyonlar 31 veya en fazla 39 bölgeye 0.1 mL (5 U) verilecek şekilde uygulanır. Enjeksiyonlar aşağıdaki şemalarda belirtildiği üzere 7 spesifik baş/boyun kas alanı arasında bölünmelidir. Boyun kasları aşırı kalın olan hastalar için boyun bölgesinde 2.54 cm (1 inç) iğneye ihtiyaç duyulabilir. Bir bölgeden (orta hat) enjekte edilmesi gereken procerus kası dışında, bütün kaslar bilateral olarak enjekte edilmelidir ve enjeksiyon bölgelerinin yarısı baş ve boynun sol tarafında, yarısı ise sağ tarafında olmalıdır. Eğer öne çıkan bir ağrı lokasyonu ya da lokasyonları varsa, 3 spesifik kas grubuna kadar (occipitalis, temporalis ve trapezius) tek veya her iki taraftan ilave enjeksiyonlar yapılabilir. Kas başına maksimum doz aşağıdaki tabloda verilmektedir.Aşağıdaki şemalarda enjeksiyon bölgelerigösterilmektedir: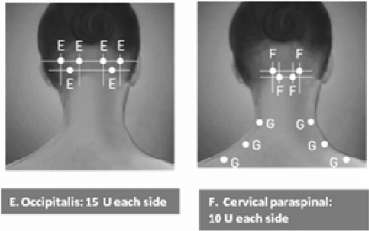 â TrıpczİLis: 15 U CKh
â TrıpczİLis: 15 U CKhKasa göre BOTOX® Dozları:
bÖnerilen tekrar tedavi planı 12 haftada bir uygulamadır. Kaşlar arasındaki vertikal çizgiler (Glabellar Çizgiler)Seyreltilmiş BOTOX® (100 Ünite/2.5 mL) steril bir 30 gauge iğne kullanılarak enjekte edilir. Beş enjeksiyon bölgesinin her birine 0.1 mL (4 Ünite) uygulanır; toplam doz 20 Ünite olacak şekilde her corrugator kasına 2 enjeksiyon ve procerus kasına 1 enjeksiyon. Orbital rimin aşağılarına ekstravazasyonu önlemek amacıyla, enjeksiyondan önce başparmak ya da işaret parmağı ile orbital rimin altına sıkıca bastırılmalıdır. Enjeksiyon esnasında iğne yukarıya ve medyale doğru yönlendirilmelidir. Özellikle "brow-depressor complex" (depressor supercilii)'li hastalarda, pitozis riskini azaltmak için, levator palpebrae superioris kasının yakınına enjeksiyon yapmaktan kaçınılmalıdır. Corrugator kasında enjeksiyonlar merkezi bölgeden yapılmalıdır.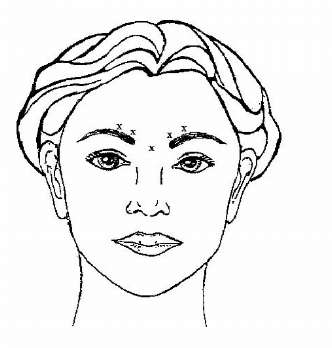 Kaşlar arasındaki vertikal çizgilerin (glabellar çizgiler) şiddetinde düzelme genel olarak tedaviden sonraki bir hafta içerisinde ortaya çıkar. Bu etkinin enjeksiyondan sonra 4 aya kadar kalıcı olduğu gösterilmiştir.
Kaşlar arasındaki vertikal çizgilerin (glabellar çizgiler) şiddetinde düzelme genel olarak tedaviden sonraki bir hafta içerisinde ortaya çıkar. Bu etkinin enjeksiyondan sonra 4 aya kadar kalıcı olduğu gösterilmiştir.Tedavi aralıkları üç ayda birden daha sık olmamalıdır. Tekrar enjeksiyonlarını izleyen tedavi başarısızlığı ya da etki azalması durumunda, alternatif tedavi yöntemleri uygulanmalıdır. Tüm endikasyonlarİlk tedavi seansından sonra tedavi başarısızlığı halinde, başka bir ifadeyle enjeksiyondan bir ay sonra, başlangıca göre anlamlı klinik düzelme olmadığında, aşağıdaki önlemler alınmalıdır:-Klinik doğrulama; bu süreçte toksinin enjekte edilen kas ya da kaslar üzerinde gösterdiği aktivitenin uzmanlar tarafından yapılacak elektromiyografik muayenesi de yer alabilir; -Başarısızlık nedenlerinin analizi, örn. enjekte edilecek kasların iyi seçilmemesi, yetersiz doz, kötü enjeksiyon tekniği, sabit kontraktür görünümü, antagonist kasların çok zayıf oluşu, toksin-nötralizan antikorların oluşması; -Botulinum toksini tip A tedavisinin uygun olup olmadığının yeniden değerlendirilmesi; -İlk tedavi seansından sonra herhangi bir istenmeyen etki ortaya çıkmamış ise, aşağıdaki gibi bir ikinci tedavi seansı düzenleyiniz: i) Önceki tedavi başarısızlığının analizini dikkate alarak doz uyarlaması yapınız (glabellar çizgilerin tedavisinde, dozu 40 ya da 50 Ünite'ye kadar çıkarmayı düşününüz); ii) EMG kullanınız; ve iii) İki tedavi seansı arasında üç aylık bir süre bırakınız. Tekrar enjeksiyonları izleyen tedavi başarısızlığı ya da etki azalması durumunda alternatif tedavi yöntemleri kullanılmalıdır. Özel popülasyonlara ilişkin ek bilgiler: Böbrek yetmezliği:Özel veri bulunmamaktadır.Karaciğer yetmezliği:Özel veri bulunmamaktadır.
BOTOX®'un çocuklarda (12 yaşından küçük) blefarospazm, hemifasyal spazm, strabismus,
Pediyatrik popülasyon:BOTOX®'un çocuklarda servikal distoni ve kronik migren tedavisindeki güvenlilik ve etkinliği kanıtlanmamıştır.BOTOX®'un 12 yaşından küçük çocuklarda, primer aksiller hiperhidroz tedavisindeki güvenlilik ve etkinliği araştırılmamıştır. BOTOX®'un 12 ile 17 yaş arası çocuklarda şiddetli aksiller hiperhidroz tedavisindeki güvenlilik ve etkinliği belirlenmemiştir. Halen elimizde bulunan veriler bölüm 4.8 ve 5.1'de açıklanmıştır, ama pozoloji konusunda bir öneri yapılamamaktadır. Bölüm 4.8 ve 5.1'e bakınız. BOTOX®'un 18 yaşın altındaki bireylerde kronik migren tedavisindeki güvenlilik ve etkinliği kanıtlanmamıştır. BOTOX®'un 18 yaşın altındaki bireylerde kaşlar arasındaki vertikal çizgilerin (glabellar çizgiler olarak da bilinir) tedavisindeki güvenlilik ve etkinliği kanıtlanmamıştır. 18 yaşın altındaki bireylerde BOTOX® kullanımı önerilmemektedir (bkz. bölüm 4.4). Bunlar ıışıçöışçııız.Geriyatrik popülasyon:Geriyatrik dozaj üzerinde yeterli çalışma yürütülmemiştir. Etkili en düşük dozun uygulanması ve enjeksiyonlar arasında klinik olarak endike en uzun sürenin bırakılması önerilmektedir. Tıbbi geçmişleri anlamlı olan ve aynı zamanda başka ilaçlar almakta olan yaşlı hastalar dikkatle tedavi edilmelidir.65 yaşın üzerindeki hastalarda, kaşlar arasındaki vertikal çizgilerin (glabellar çizgiler) tedavisi konusunda BOTOX® ile kısıtlı faz 3 klinik veri bulunmaktadır (bkz. bölüm 5.1). Bu yaş grubunda daha fazla çalışma yapılıncaya kadar, 65 yaşın üzerindeki hastalarda BOTOX® önerilmemektedir. 4.3 KontrendikasyonlarBOTOX® aşağıdaki durumlarda kontrendikedir:-Botulinum toksini tip A ya da yardımcı maddelerden herhangi birine karşı aşırı duyarlığı olduğu bilinenlerde, -Planlanan enjeksiyon bölgesi ya da bölgelerinde enfeksiyon bulunması durumunda. 4.4 Özel kullanım uyarılan ve önlemleri-Kullanan kişiler konu ile ilgili eğitilmelidir.-Kullanım talimatı ile verilen noktalara dikkat edilerek kullanılmalı ve ilgili formlar doldurulmalıdır. -İlacın dağıtımı ve saklanmasında talimatla belirlenmiş konulara uyulmalı ve kayıtlar tutulmalıdır. -Kullanılmış atıkların imhası ve ayrıcalıklı atımı talimatlarına uyulmalıdır. Not: Konu ile ilgili talimatlar dağıtıcıya, uygulayıcıya ve ilgili kişilere ayrıca verilmelidir. BOTOX uygulanmadan önce ilgili bölgenin anatomisi ve daha önceden yapılmış cerrahi prosedürlere bağlı anatomi değişiklikleri bilinmeli ve hassas anatomik yapılara enjeksiyon yapmaktan kaçınılmalıdır. Önerilen BOTOX dozajı ve kullanım sıklığı aşılmamalıdır. Ender olarak, ciddi ve/veya ani aşırı duyarlılık reaksiyonları bildirilmiştir; anaflaksi, serum hastalığı, ürtiker, yumuşak doku ödemi ve dispne bunlar arasındadır. Bu reaksiyonların bazıları BOTOX®'un tek başına ya da diğer ürünler ile birlikte kullanılmasından sonra bildirilmiştir. Eğer böyle bir reaksiyon ortaya çıkar ise, BOTOX® enjeksiyonu kesilmeli ve derhal epinefrin (adrenalin) gibi bir ilaçla uygun tıbbi tedaviye başlanmalıdır. Uygun olmayan bir şekilde 5 mL %1 lidokain ile seyreltilmiş BOTOX® enjekte edildikten sonra hastanın yaşamını kaybettiği bir anaflaksi olgusu bildirilmiştir. Daha geniş bilgi için lütfen bölüm 4.8c'ye bakınız. Toksinin uygulama bölgesinden uzaklara yayılmasına bağlı yan etkiler bildirilmiştir (bkz. bölüm 4.8); bunlar bazı olgularda disfaji, pnömoni ve/veya belirgin özürlülük ile ilişkilendirilen ölümlerle sonuçlanmıştır. Terapötik dozlar ile tedavi edilen hastalarda aşırı kas zayıflığı ortaya çıkabilir. Yutma güçlüğü gibi altta yatan nörolojik bozuklukları olan hastalarda bu tür yan etkilerin gelişme riski yüksektir. Botulinum toksini ürünü bu hastalarda uzman gözetimi altında ve yalnızca tedaviden edinilecek yararın risklere karşı üstün geldiği durumlarda kullanılmalıdır. Disfaji ve aspirasyon öyküsü olan hastalar son derecede dikkatli tedavi edilmelidir. Hastalar ya da bakıcılar yutma, konuşma ya da solunum bozuklukları ortaya çıktığında derhal doktora başvurmaları önerilmelidir. Disfaji aynı zamanda, servikal kas yapısı dışındaki bölgelere enjeksiyon uygulamasından sonra da bildirilmiştir (daha fazla bilgi için bkz. aşağıda 4.4 'servikal distoni' bölümü). Tekrarlı BOTOX® kullanımı sırasındaki klinik dalgalanmalar (bütün botulinum toksinlerinde olduğu gibi); farklı flakon sulandırma prosedürleri, enjeksiyon aralıkları, enjekte edilen kaslar ve kullanılan biyolojik test yöntemine göre verilen hafifçe farklı potens değerlerinin bir sonucu olabilir. Botulinum toksini tip A'ya karşı nötralizan antikorların oluşması, toksinin biyolojik aktivitesini inaktive ederek, BOTOX® tedavisinin etkinliğini azaltabilir. Bazı çalışmalardan edinilen sonuçlar, daha sık aralıklarla ya da daha yüksek dozlarla yapılan BOTOX® enjeksiyonlarının, antikor oluşum insidansında artışa yol açabileceğini düşündürmektedir. Uygun durumlarda, antikor oluşma potansiyeli, enjeksiyonlar arasında klinik olarak endike en uzun süre bırakılarak ve etkili en düşük doz enjekte edilerek, en aza indirilebilir. Daha öncesinde sedanter yaşayan hastaların aktivitelerine başlamasını sağlayacak potansiyele sahip herhangi bir tedavide olduğu gibi, sedanter hasta, aktivitelerine aşamalı olarak başlaması konusunda uyarılmalıdır. Planlanan enjeksiyon bölgelerinde enflamasyon varlığında ya da hedef kasta aşırı zayıflık veya atrofi varsa, BOTOX® kullanılırken dikkatli olunmalıdır. Periferik motor nöropatik hastalığı (örn. amiyotrofik lateral skleroz ya da motor nöropati) olan kişilerin tedavisinde BOTOX® kullanılırken de dikkatli olunmalıdır. Myasthenia gravis ya da Eaton Lambert Sendromu gibi nöromüsküler ileti defektlerine yönelik subklinik ya da klinik verileri olan hastalarda, BOTOX® mutlaka son derecede dikkatle ve yakın gözetim altında kullanılmalıdır. Bu gibi hastalarda BOTOX® gibi ajanlara karşı duyarlık artışı olabilir, ve bu durum aşırı kas zayıflığı ile sonuçlanabilir. Nöromüsküler bozuklukları olan hastalarda, tipik BOTOX® dozları ile şiddetli disfaji ve solunum sıkıntısı gibi klinik olarak anlamlı sistemik etki riski artabilir. Herhangi bir enjeksiyonda olduğu gibi, prosedüre bağlı yaralanma olabilir. Enjeksiyon sonucunda lokalize enfeksiyon, ağrı, enflamasyon, parestezi, hipoestezi, hassasiyet, şişme, eritem ve/veya kanama/morarma ortaya çıkabilir. İğneye bağlı ağrı ve/veya anksiyete sonucu, bayılma, hipotansiyon vb. gibi vazovagal yanıtlar görülebilir. Hassas anatomik yapılara yakın enjeksiyonlarda dikkatli olunmalıdır. BlefarospazmÖzellikle VII. sinir bozuklukları olan hastalarda, orbicularis kası içine botulinum toksini enjeksiyonundan sonra göz kırpma hareketleri azalabilir ve bu durum korneal maruziyet, ısrarcı epitel defekti ve korneada ülserasyon ile sonuçlanabilir. Önceden opere edilmiş gözlerde dikkatli bir kornea hassasiyeti incelemesi yapılmalı, ektropiondan kaçınmak için alt göz kapağı alanına enjeksiyondan sakınılmalı ve herhangi bir epitel defekti yoğun bir şekilde tedavi edilmelidir. Bu süreç koruyucu damlalar, merhemler, terapötik yumuşak kontakt lensler kullanılmasını ya da gözün pet ya da başka yöntemlerle kapatılmasını gerektirebilir. Yumuşak göz kapağı dokusunda kolayca ekimoz oluşabilir. Bu durum, enjeksiyondan hemen sonra, enjeksiyon bölgesine hafif bir baskı uygulanarak en aza indirilebilir. Botulinum toksininin antikolinerjik aktivitesinden dolayı, anatomik olarak dar açısı olan hastalar dahil, dar açılı glokom riski taşıyan hastalar tedavi edilirken dikkatli olunmalıdır. StrabismusBOTOX® kronik paralitik strabismusda, antagonistin kontraktürünü cerrahi onarım ile birlikte azaltmak dışında etkisizdir. BOTOX®'un 50 prizm diyoptriden büyük sapmalarda, restriktif strabismusta, lateral rectus zayıflığı ile birlikte olan Duane sendromunda ve önceki bir cerrahi girişimde antagonistin fazla geri çekilmesiyle oluşan sekonder strabismusta etkinliği kuşkuludur. Etkinliği arttırmak için, zaman içinde tekrarlı enjeksiyonlara gerek duyulabilir. Strabismus tedavisi için BOTOX® uygulaması sırasında orbitada iğne penetrasyonuna bağlı olarak, retinal dolaşımı tehlikeye atmaya yetecek ölçüde retrobulber hemoraji oluşmuştur. Orbitayı incelemek ve dekomprese etmek için uygun enstrümanların hazır bulundurulması önerilmektedir. İğne ile oküler (glob) penetrasyonları da görülmüştür. Bu durumun tanısı için bir oftalmoskop hazır bulundurulmalıdır. Bir ya da daha çok ekstraoküler kasta indüklenen paralizi, uzaysal dezoriyentasyon, çift görme, ya da hedefi aşmaya (past-pointing) neden olabilir. Tutulan gözün kapatılması bu semptomları hafifletebilir. Servikal distoniServikal distoni hastaları çok hafif, ancak şiddetli de olabilen bir disfaji geçirme olasılığı hakkında bilgilendirilmelidir. Disfaji enjeksiyondan sonra iki ile üç hafta sürebilir, ancak enjeksiyondan sonra beş aya kadar sürdüğü de bildirilmiştir. Disfaji ile birlikte aspirasyon, dispne olasılığı vardır ve bazen tüple beslenme ihtiyacı oluşabilir. Ender olgularda disfajiyi izleyen aspirasyon pnömonisi ve ölüm bildirilmiştir. Sternokleidomastoid kasına enjekte edilen dozun 100 Ünite altında sınırlandırılması, disfaji oluşumunu azaltabilir. Boyun kas kütlesi daha küçük olan ya da sternokleidomastoid kasa bilateral enjeksiyon yapılan hastalarda, disfaji riskinin daha fazla olduğu bildirilmiştir. Disfaji, toksinin özofagus kas yapısına yayılmasına bağlı olabilir. Levator scapulae içine yapılan enjeksiyonlar, üst solunum yolu enfeksiyonu ve disfaji riskinde artış ile ilişkili olabilir. Disfaji besin ve su alımında azalmaya katkıda bulunabilir; bu durumun sonucunda kilo kaybı ve dehidratasyon görülebilir. Subklinik disfajisi olan hastalarda, BOTOX® enjeksiyonundan sonra daha şiddetli disfaji geçirme riski artabilir. Pediyatrik serebral palsiye bağlı fokal spastisite ve erişkin hastalarda inme sonrası el ve bilek spastisitesiBOTOX® fokal spastisite tedavisinde yalnızca, olağan standart bakım rejimleriyle birlikte incelenmiştir ve bu tedavi modalitelerinin yerine kullanılması düşünülmemiştir. Sabit kontraktür bulunan bir eklemde BOTOX®'un hareket aralığını düzeltmede etkili olması beklenmez. Başlıca serebral palsi olmak üzere, komorbiditeleri olan pediyatrik hastalarda, toksinin uzak bölgelere olası yayılması, pazarlama sonrası raporlar çok ender olarak bildirilmiştir. Genel olarak bu olgularda kullanılan doz, önerilen dozun üstündeydi (bkz. bölüm 4.2). Şiddetli serebral palsisi olan çocuklarda botulinum toksiniyle tedaviden sonra, bazıları aspirasyon pnömonisiyle ilişkilendirilmiş, ender spontan ölüm raporları bulunmaktadır. Önemli nörolojik özürlülük hali, disfajisi ya da yakın geçmişinde aspirasyon pnömonisi veya akciğer hastalığı olan pediyatrik hastaları tedavi ederken dikkatli olunmalıdır. Primer aksiller hiperhidrozPotansiyel sekonder hiperhidroz nedenlerinin (örn. hipertiroidizm, feokromasitoma) ekarte edilmesi için, tıbbi geçmiş ve fizik muayenenin yanı sıra, gerekli spesifik ek incelemeler de yapılmalıdır. Bu işlemler, altta yatan hastalık tanı ve/veya tedavisiz kalırken, semptomatik hiperhidroz tedavisi uygulamasından sakınılmasını sağlayacaktır. Kronik migrenEpisodik migr profilaksisinde etkili olduğu gösterilmemiştir.Kaşlar arasındaki vertikal çizgiler (Glabellar Çizgiler)Geçmişinde disfaji ve aspiras; enjeksiyonu önerilmemektedir.
Episodik migreni (ayda < 15 gün baş ağrıları) olan hastalarda, BOTOX®'un baş ağrısı
Geçmişinde disfaji ve aspirasyon olan hastalarda glabellar çizgilerin tedavisi için BOTOX®
BOTOX®'un 18 yaş altı ve 65 yaş üzeri hastalarda glabellar çizgiler için kullanılması önerilmemektedir.DiğerBOTOX®'un tek bir seans içinde, yalnızca tek bir hastanın tedavisi için kullanılması zorunludur. Kullanılmamış ürün bölüm 6.6'da açıklandığı şekilde atılmalıdır. Ürünün hazırlanmasında, uygulanmasında ve aynı zamanda kalan kullanılmamış solüsyonun inaktivasyonu ve elden çıkarılmasında belirli önlemler alınmalıdır (bkz. bölüm 6.6). Sodyum klorürBu t ıüüşııçermez".4.5Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşimşekilleriTeorik olarak, botulinum toksininin etkisi aminoglikozid antibiyotikler ya da spektinomisin, veya nöromüsküler iletiyi etkileyen diğer tıbbi ürünler (örn. gerek depolarizan (süksinilkolin) gerekse non-depolarizan (tubokürarin türevleri) nöromüsküler bloke edici ajanlar, linkozamidler, polimiksinler, kinidin, magnezyum sülfat ve antikolinesterazlar) ile potansiyalize olabilir.Farklı botulinum nörotoksin serotiplerinin aynı anda ya da birkaç ay içerisinde uygulanmasının etkisi bilinmemektedir. Daha önceden uygulanan botulinum toksininin etkileri geçmeden bir başkasının uygulanmasıyla, aşırı nöromüsküler zayıflık oluşabilir. Etkileşim çalışmaları yürütülmemiştir. Klinik olarak anlamlı etkileşimler bildirilmemiştir. Özel popülasyonlara ilişkin ek bilgiler:Özel veri bulunmamaktadır.Pediyatrik popülasyon:Özel veri bulunmamaktadır.4.6Gebelik ve laktasyonGenel tavsiye:Gebelik kategorisi C'dir.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon):Çocuk doğurma potansiyeli olan kadınlar, tedavi süresince etkili doğum kontrolü uygulamalıdır.Gebelik dönemi:Botulinum toksini tip A'nın gebe kadınlarda kullanımına ait yeterli veri bulunmamaktadır. İnsanlardaki potansiyel riski bilinmemektedir. BOTOX® gebelik sırasında açık bir şekilde gerekli olmadıkça kullanılmamalıdır.Laktasyon dönemi:BOTOX®'un insanlarda süte geçip geçmediği bilinmemektedir. Laktasyon sırasında BOTOX® kullanımı önerilemez.Üreme yeteneği/Fertilite:BOTOX® hayvan çalışmalarında üreme toksisitesi göstermiştir (bkz. bölüm 5.3).4.7Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanma becerileri üzerindeki etkileri konusunda herhangi bir çalışma yürütülmemiştir. Ancak, BOTOX® asteni, kas zayıflığı, baş dönmesi (sersemlik) ve görme bozukluğuna neden olabilir; bu durumlar ise araç sürmeyi etkileyebilir ve makine kullanmayı tehlikeli hale getirebilir.4.8İstenmeyen etkiler a. GenelKontrollü klinik araştırma verileri temelinde, hastaların BOTOX® tedavisinden sonra, blefarospazm için %35, servikal distoni için %28, pediyatrik serebral palsi için %17 ve primer aksiller hiperhidroz için %11 oranında advers reaksiyon geçirmeleri beklenecektir.Klinik araştırmalarda kollarda inmeye bağlı fokal spastisite için BOTOX® ile tedavi edilen katılımcıların %16'sı advers reaksiyon geçirmiştir. Kronik migren üzerindeki klinik araştırmalarda, insidans ilk tedavide %26 olmuş ve ikinci tedavide %11'e düşmüştür. Kontrollü klinik araştırma verileri temelinde, glabellar çizgiler için BOTOX® tedavisinden sonra advers reaksiyon geçirmeleri beklenecek hastaların oranı %23,5'tir (plasebo: %19,2). Bu advers reaksiyonlar tedaviye, enjeksiyon tekniğine ya da her ikisine bağlı olabilir. Genel olarak, advers reaksiyonlar enjeksiyonu izleyen ilk birkaç gün içerisinde ortaya çıkar ve çoğunlukla geçici olmakla birlikte, birkaç ay ya da, ender olgularda, daha uzun süreli olabilir. Lokal kas zayıflığı, botulinum toksininin kas dokusundaki beklenen farmakolojik aktivitesini temsil etmektedir. Herhangi bir enjeksiyon prosedüründen beklendiği gibi, enjeksiyona bağlı lokalize ağrı, enflamasyon, parestezi, hipoestezi, hassasiyet, şişme/ödem, eritem, lokalize enfeksiyon, kanama ve/veya morarma görülmüştür. İğneye bağlı ağrı ve/veya anksiyete, geçici semptomatik hipotansiyon ve senkop dahil, vazovagal yanıtlar görülebilir. Botulinum toksini enjeksiyonundan sonra ateş ve grip sendromu da bildirilmiştir. b. Advers reaksiyonlar - endikasyona göre sıklık dereceleriHer endikasyon için klinik deneyimlerden edinilen advers reaksiyon sıklıkları verilmektedir. Sıklık dereceleri aşağıdaki gibi tanımlanmıştır:Çok yaygın (> 1/10); Yaygın (> 1/100 ile <1/10); Yaygın olmayan (>1/1,000 ile <1/100); Seyrek (> 1/10,000 ile <1/1,000); Çok seyrek (<1/10,000). Blefarospazm/hemifasyal spazmSinir sistemi hastalıkları
Yaygın olmayan: Baş dönmesi, fasyal parezi, fasyal palsi
Tedavi etkisi erkek hastalar alt grubunda (N=188), çalışma populasyonunun bütününde olduğundan daha küçük görünüyordu. Kaşlar arasındaki vertikal çizgiler (Glabellar Çizgiler)Kaşlar maksimum çatıklık durumunda iken aralarında orta derece ile şiddetli vertikal çizgiler (glabellar çizgiler) bulunan 537 hasta klinik çalışmalarda yer almıştır. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
100 Ünite flakon |
Oluşan doz (Ünite/0.1 mL) |
100 Ünite flakona eklenen seyreltici miktarı (sodyum klorür 9 mg/mL (%0.9) enjeksiyon solüsyonu) |
|
20 Ünite |
0.5 mL |
|
10 Ünite |
1 mL |
|
5 Ünite |
2 mL |
|
4 Ünite |
2.5 mL |
|
2.5 Ünite |
4 mL |
|
1.25 Ünite |
8 mL |
Eğer bir enjeksiyon seansında farklı doz büyüklüklerinde BOTOX® flakonları kullanılıyor ise, 0.1 mL başına istenilen özel Ünite sayısının elde edilmesi için, doğru miktarı seyreltici kullanılmasına dikkat edilmelidir. Seyreltici miktarı BOTOX® 50 Allergan Ünitesi ve BOTOX® 100 Allergan Ünitesi arasında değişmektedir. Her enjektör içerdiği miktarı belirtecek şekilde etiketlenmelidir.
BOTOX® kabarcıklanma ya da benzeri bir kuvvetli çalkalama ile denatüre olduğundan, seyreltici flakon içine yavaşça enjekte edilmelidir. Eğer vakum seyrelticiyi flakon içine çekmiyor ise, flakon atılmalıdır. Sulandırılarak hazırlanmış BOTOX® berrak, renksiz ile hafif sarı renkte, taneciksiz bir çözeltidir. Seyreltilmiş çözelti kullanmadan önce, berraklık ve tanecik içermemesi yönleriyle, görsel olarak incelenmelidir. BOTOX® seyreltildiğinde, kullanım öncesinde 24 saate kadar buzdolabında (2-8°C) saklanabilir. Sulandırarak hazırlama işleminin tarih ve saati, etiket üzerindeki boşluğa kaydedilmelidir. Bu ürün yalnızca tek kullanım içindir ve kullanılmayan çözelti atılmalıdır.
Glabellar çizgilerin tedavisinde BOTOX®'un tek bir seansta, yalnızca tek bir hastanın tedavisi için kullanılması zorunludur.
BOTOX® için flakon,şırınga ve materyallerin güvenli birşekilde bertaraf edilmesi için prosedür:
Güvenlilik açısından, kullanılmayan flakonlar atılmadan önce az miktarda su ile sulandırılmalı ve daha sonra otoklavlanmalıdır. Kullanılmış flakonlar, enjektörler ve dökülmüş solüsyon vb. otoklavlanmalı, ya da kalan BOTOX®, 5 dakika süreyle dilüe hipoklorit solüsyonu (%0.5) kullanılarak inaktive edilmelidir.
Botulinum toksini işlenirken herhangi bir kaza durumunda öneriler:
Ürün işlenirken bir kaza oluşması durumunda, gerek vakumla kurutulmuş ürün halinde gerekse sulandırılmış halde iken, derhal aşağıda açıklanan uygun önlemler alınmalıdır.
Toksin ısıya ve belirli kimyasal ajanlara karşı çok duyarlıdır.
Herhangi bir döküntü silinmelidir. Vakumla kurutulmuş ürün için sodyum hipoklorit (Javel solüsyonu) ile ıslatılmış emici bir materyal, sulandırılarak hazırlanmış ürün için kuru bir emici materyal kullanılır.
Kontamine olmuş yüzeyler sodyum hipoklorit (Javel solüsyonu) ile ıslatılmış emici bir materyal ile temizlenmeli ve daha sonra kurutulmalıdır.
Flakon kırılırsa, cildin yaralanmasından kaçınılarak, cam parçaları dikkatle toplanmalı ve ürün yukarıda belirtildiği şekilde silinmelidir.
Eğer cilde sıçrarsa, önce sodyum hipoklorit solüsyonuyla ve daha sonra bol su ile iyice yıkayınız.
Eğer göze sıçrarsa, gözleri bol su ile ya da bir oftalmik göz yıkama solüsyonu ile iyice yıkayınız.
Eğer enjeksiyonları yapan kişi kendini yaralarsa (kesme, batma), yukarıda belirtilenleri uygulayınız ve enjekte edilen doza göre uygun tıbbi adımları atınız.
Bu kullanım, işleme ve elden çıkarma talimatlarına titizlikle uyulmalıdır.
Kullanılmamış olan ürün ya da atık materyaller, "Tıbbi Atıkların Kontrolü" ve "Ambalaj ve Ambalaj Atıklarının Kontrolü" yönetmeliklerine uygun olarak imha edilmelidir.
7. RUHSAT SAHİBİ
B
İ
Allerganİçı.Ş.İ-Şşİ
stanbulTel: (0212) 365 50 00 Faks: (0212) 290 72 11
8. RUHSAT NUMARASI
130/209.ILK RUHSAT TARIHI/RUHSAT YENILEME TARIHI
LK RUHSAT TAR
I
H
I
/RUHSAT YEN
I
LEME TAR
I
H
I
İlk ruhsat tarihi: 06.10.2010 Ruhsat yenileme tarihi:10. KÜB'ÜNYENILENME TARIHI
İlaç Bilgileri
Botox liyofilize toz içeren flakon
Etken Maddesi: Botulinum toksini tip A
Atc Kodu: M03AX01
Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.