Pegasys 180 mikrogram/0.5 mL kullanıma hazır şırınga Kısa Ürün BilgisiAntineoplastik ve İmmünomodülatör Ajanlar » İmmünostimülanlar » İmmünostimülan İlaçlar » İnterferonlar » Peginterferon Alfa2a KISA ÜRÜN BİLGİSİ1.BEŞERİ TIBBİ ÜRÜNÜN ADIPEGASYS 180 mikrogram/0.5 mL kullanıma hazır şırınga2.KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:(Escherichia colf denMn moleküler kütleli bis-[monometoksi polietilen glikol] konjugatı) içerir. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Tablo 1 HCV Hastaları için Kombinasyon Tedavisi için Dozaj Öneri |
eri | ||
|
Genotip |
PEGASYS Dozu |
Ribavirin Dozu |
Süre |
|
HVY'li* Genotip 1 DVY |
180 mikrogram |
<75 kg = 1000 mg >75 kg = 1200 mg |
24 hafta veya 48 hafta |
|
HVY'li* Genotip 1 YVY |
180 mikrogram |
<75 kg = 1000 mg >75 kg = 1200 mg |
48 hafta |
|
HVY'li* Genotip 4 |
180 mikrogram |
<75 kg = 1000 mg >75 kg = 1200 mg |
24 hafta veya 48 hafta |
|
HVY'siz* Genotip 1 veya 4 |
180 mikrogram |
<75 kg = 1000 mg >75 kg = 1200 mg |
48 hafta |
|
HVY'li** Genotip 2 ve 3 DVY |
180 mikrogram |
800 mg |
16 hafta veya 24 hafta |
|
HVY'li* Genotip 2 veya 3 YVY |
180 mikrogram |
800 mg |
24 hafta |
|
HVY'siz* Genotip 2/3 |
180 mikrogram |
800 mg |
24 hafta |
Önceki Hepatit C tedavisinin başarısızlığı
PEGASYS ve ribavirin kombinasyonunun önerilen dozu, haftada bir kez, karın veya uyluk bölgesine uygulanan 180 mikrogramdır. Ribavirin yiyecek ile beraber uygulanmalıdır. <75 kg ve >75 kg olan hastalar için sırasıyla 1000 mg ve 1200 mg ribavirin uygulanmalıdır. Tavsiye edilen tedavi süresi genotip 1 veya 4 hastalar için 72 hafta ve genotip 2 veya 3 hastalar için 48 haftadır.
HIV-HCV Ko-enfeksiyonu
Tek başına veya 800 mg ribavirin ile kombine olarak, önerilen PEGASYS dozu genotipe bakılmaksızın, 48 hafta süreyle subkütan olarak haftada bir kez 180 mikrogramdır. Günlük 800 mg'ın üzerindeki ribavirin dozları ile kombinasyon tedavisinin veya 48 haftadan daha az süreli bir tedavinin etkinlik ve güvenliliği araştırılmamıştır.
Naif hastalarda tedaviye yanıtın ve yanıtsızlığın önceden tahmin edilmesi
Viral yükte 2 log azalma veya HCV RNA seviyelerinin saptanamaması olarak tanımlanan, 12. haftadaki erken viral yanıtın, kalıcı yanıt için işaret olabileceği gösterilmiştir (bkz. Tablo 2).
Tablo 2 HCV Hastalarında PEGASYS Kombinasyon Tedavisi Sırasında Tavsiye Edilen
|
Doz Rejimiyle 12. Haftadaki Viral Yanıtın Predikti |
¦ Değeri | |
|
Genotip |
Negatif |
Pozitif |
12. haftaya Kalıcı , . ^ ^ Prediktif kadar yanıt yanıtD-yok yokğ |
12. Kalıcı haftadaki anıt Prediktif Değer yanıt y | |
|
Genotip 1 (N = 569) |
102 97 %95 102 97 (97/102) |
467 971 %58 467 271 (271/467) |
|
Genotip 2 ve 3 (N=96) |
3 3 %100 3 3 (3/3) |
93 «1 %87 93 81 (81/93) |
Önceki tedaviye yanıt vermemiş hastalarda yanıtın veya yanıtsızlığın tahmin edilmesi
72 hafta tedavi edilmiş yanıtsız hastalarda, tedavi sırasındaki en iyi belirleyici 12. haftadaki viral supresyondur (HCV RNA saptanmaması, HCV RNA<50 IU/mL olarak tanımlanabilir). 12. haftada viral supresyonun negatif tahmin değeri %96 (324/339) ve pozitif tahmin değeri %57 (57/100)'dir.
Özel Doz Talimatları
PEGASYS için doz ayarlanması
Genel: Orta veya şiddetli derecede advers reaksiyonlar (klinik ve/veya laboratuvar) için doz değişikliği gerektiğinde, başlangıçtaki doz azaltımı olarak 135 mikrogram'a inilmesi genelikle yeterli olur. Ancak bazı durumlarda, dozun 90 mikrogram veya 45 mikrogram'a düşürülmesi gerekebilir. Advers reaksiyon ortadan kalktığında, doz artışları veya orijinal doza dönüş düşünülebilir (bkz. bölüm 4.4 ve 4.8).
Hematolojik: MNS (mutlak nötrofil sayısı) <750/mm olduğunda doz azaltımı önerilir. MNS <500/mm3 olan hastalarda MNS >1000/mm3 olana kadar tedavi ertelenmelidir. Tedaviye yeniden 90 mikrogram PEGASYS ile başlanmalı ve nötrofil sayısı izlenmelidir.
Trombosit sayısı <50,000/mm3 ise dozun 90 mikrogram'a düşürülmesi önerilir. Trombosit sayısı 25,000/mm3'ün altına düştüğünde tedavinin kesilmesi önerilir.
Karaciğer fonksiyonu: Kronik hepatitli hastalarda karaciğer fonksiyon testlerindeki anormalliklerde dalgalanmalar yaygındır. Ancak diğer alfa interferonlarda olduğu gibi PEGASYS ile tedavi edilen hastalarda, viral yanıt olanlar dahil olmak üzere ALT düzeylerinde başlangıç seviyesine göre artışlar gözlenmiştir.
HCV hastaları için, ALT düzeyi başlangıç seviyesinin üstünde olduğunda, doz ilk olarak 135 mikrogram'a düşürülmelidir. Doz azaltımına rağmen ALT düzeylerindeki
artış progresif olduğunda veya bu artışa bilirubin düzeyinde artış veya karaciğer dekompansasyon bulguları eşlik ettiğinde tedavi kesilmelidir (bkz. bölüm 4.4).
HBV hastaları için, bazen normalin üst sınırını 10 kat aşan ALT seviyelerinde alevlenmeler seyrek değildir ve immün klerensi yansıtabilir. ALT alevlenmeleri sırasında tedaviye karaciğer fonksiyonları daha sık izlenerek devam edilmesine önem verilmelidir. Eğer PEGASYS dozu azaltılırsa veya bırakılırsa, alevlenme kaybolunca tedaviye devam edilebilir (bkz. bölüm 4.4).
Kombinasyon tedavisinde uygulandığında ribavirin için doz ayarlanması
Tedaviden kaynaklanan anemilerin kontrol altına alınması için, aşağıdakilerden herhangi birisi geçerli olduğunda, ribavirin dozu günde 600 miligram'a düşürülmelidir (sabah 200 miligram ve akşam 400 miligram):
Ciddi bir kardiyovasküler hastalığı olmayan bir hasta, hemoglobin seviyesinde <10 g/dL ve >8.5 g/dL'ye bir düşüş yaşarsa veya
Stabil kardiyovasküler hastalığı olan bir hasta, tedavi sırasında herhangi bir 4 haftalık süre içinde hemoglobin seviyesinde >2 g/dL'lik bir düşüş yaşarsa.
Aşağıdakilerden herhangi biri geçerli olduğunda ribavirin kullanımına
son verilmelidir::
Ciddi bir kardiyovasküler hastalığı olmayan bir hasta hemoglobin seviyesinde doğrulanmış <8.5 g/dL'ye bir düşme yaşarsa
Stabil kardiyovasküler hastalığı olan bir hastada 4 hafta süreyle dozun azaltılmasına rağmen <12 g/dL hemoglobin değeri devam ederse
Laboratuvar anormalliğine veya klinik nedenlere bağlı olarak hastanın ribavirin dozuna ara verilmişse, günlük 600 miligramla tekrar ribavirine başlamak ve tedaviyi gerçekleştiren doktorun takdirine göre 800 miligrama yükseltmek üzere harekete geçilebilir. Ancak, ribavirinin orijinal doza (1000 mg veya 1200 mg) çıkarılması tavsiye edilmemektedir.
Ribavirine karşı intolerans durumunda, PEGASYS monoterapisine devam edilebilir.
Uygulama şekli:
Abdomen veya uyluk bölgesine subkütan olarak uygulanır.Özel popülasyonlara ilişkin ek bilgiler: Böbrek yetmezliği:
Son safha böbrek hastalığı olan hastalarda, 135 mikrogramlık bir başlangıç dozu kullanılmalıdır (bkz. bölüm 5.2). Başlangıç dozu veya böbrek yetmezliği seviyesine bakılmaksızın, hastalar izlenmelidir ve advers reaksiyonlarda tedavi süresince uygun PEGASYS doz azaltımları yapılmalıdır.Pediyatrik popülasyon:
18 yaşın altındaki hastalarda güvenliliği ve etkinliği belirlenmemiştir. Ayrıca, PEGASYS enjekte edilebilir çözeltiler benzil alkol içermektedir. Aşırı derecede benzil alkole maruz kaldığı belirlenen yenidoğanlarda ve süt çocuklarında seyrek olarak ölümbildirilmiştir. Yenidoğanlarda ve süt çocuklarında, hangi toksisitede ne kadar benzil alkol bulunduğu veya advers etkilerinin olup olmadığı bilinmemektedir. Bu nedenle, PEGASYS yenidoğanlarda ve süt çocuklarında kullanılmamalıdır (bkz. bölüm 4.3).
Geriyatrik popülasyon:
Klinik çalışmalardan elde edilen farmakokinetik, farmakodinamik, tolerabilite ve güvenlik verilerine dayanılarak, yaşlı hastalarda özel bir doz ayarlanmasına gerek yoktur.Karaciğer yetmezliği:
Kompanse sirozlu (örn.Child-Pugh A) hastalarda, PEGASYS'in etkili ve güvenli olduğu gösterilmiştir. Dekompanse sirozlu (örn.Child-Pugh B veya C veya kanamalı özofagus varisli) hastalarda PEGASYS değerlendirilmemiştir (bkz. bölüm 4.3).Child-Pugh sınıflandırması hastaları, sırasıyla 5-6, 7-9 ve 10-15 skorlarına denk gelen, A, B ve C veya "Hafifi', "Orta" ve "Ciddi" gruplarına ayırmaktadır.
Modifiye Değerlendirme
|
Değer |
Anormallik derecesi |
Skor |
|
Ensefalopati |
Yok |
1 |
|
|
Sınıf 1-2 |
2 |
|
|
Sınıf 3-4* |
3 |
|
Asit |
Yok |
1 |
|
|
Hafif |
2 |
|
|
Orta |
3 |
|
S-Bilirubin |
<2 |
1 |
|
(mg/dL) |
2-3 |
2 |
|
|
>3 |
o 3 |
|
SI birimi = ^mol/l |
<34 |
1 |
|
|
34-51 |
2 |
|
|
>51 |
3 |
|
S-Albumin |
>3.5 |
1 |
|
(g/dL) |
3.5-2.8 |
2 |
|
|
<2.8 |
3 |
|
INR |
<1.7 |
1 |
|
|
1.7-2.3 |
2 |
|
|
>2.3 |
O 3 |
4.3. Kontrendikasyonlar
PEGASYS, alfa interferonlara,E. coli
türevi ürünlere, polietilenglikole veya ürünün bileşimindeki maddelerden herhangi birine karşı aşırı duyarlılığı, otoimmün hepatiti, dekompanse sirozu, son altı ay içinde stabil olmayan veya kontrol edilmemiş kalp hastalığı dahil önceden mevcut olan ciddi kalp hastalığı geçmişi olan hastalarda kontrendikedir.Atazanavir ve indinavir gibi ilaçlardan kaynaklanan indirekt hiperbilirubinemiye bağlı olanlar hariç sirozlu ve Child-Pugh skoru >6 olan HIV-HCV hastalarında PEGASYS tedavisine başlanması kontrendikedir.
PEGASYS 3 yaşına kadar olan çocuklarda ve yeni doğanlarda kontrendikedir. Gebelerde, PEGASYS/ribavirin kombinasyon tedavisi kullanılmamalıdır. Ek olarak, peginterferon alfa-2a ve ribavirin kombinasyon tedavisi,
-Ribavirin ya da ribavirin tabletin içerdiği yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olan hastalarda
-Eşleri gebe olan erkeklerde
-Hemoglobinopatisi (örn. talasemi, orak hücre anemisi) olan hastalarda kontrendikedir.
PEGASYS, ribavirin ile kombine kullanılacağı zaman lütfen ribavirin ürün bilgilerine başvurunuz.
4.4. Özel kullanım uyarıları ve önlemleri
PEGASYS monoterapisi veya PEGASYS/ribavirin kombinasyonu ile yapılan tedavi, uzman bir hekimin rehberliğinde uygulanmalıdır ve doz azaltımını, geçici olarak doza ara verilmesini veya tedavinin kesilmesini gerektiren, orta veya şiddetli derecede advers olaylara sebep olabilir.Laboratuvar Testleri
PEGASYS monoterapisine veya PEGASYS/ribavirin kombinasyon tedavisine başlamadan önce, standart hematolojik ve biyokimyasal laboratuvar testlerinin yapılması tüm hastalar için önerilir. Tedaviye başlandıktan iki ve dört hafta sonra hematolojik testler, dördüncü haftada biyokimyasal testler tekrarlanmalıdır. Ek testler tedavi sırasında periyodik olarak yapılmalıdır.
Tek başına veya ribavirin ile kombine PEGASYS'in klinik çalışmaları için kullanılan katılım kriterleri, tedaviye başlanmadan önceki başlangıç değerlerine yol gösterici olarak kabul edilebilir:
-Trombosit sayısı > 90,000/mm3
-Mutlak Nötrofil Sayısı (MNS) >1500/mm3
-Normal limitlerdeki TSH ve T4 veya yeterli şekilde kontrol edilmiş tiroid fonksiyonları
-HIV-HCV koenfeksiyonu için: CD4+ > 200 ^L veya CD4+ > 100 ^L - < 200 ^L ve Amplicor HIV-1 Monitor Test, v1.5 ile HIV-1-RNA < 5000 kopya/mL
Diğer laboratuvar katılım kriterleri ile ilgili lütfen ribavirin ürün bilgilerine başvurunuz.
PEGASYS ve PEGASYS/ribavirin tedavileri, genellikle tedavinin ilk 2 haftasında başlayan, total beyaz kan hücresi (BKH) sayısı ve MNS'deki düşüş ile ilişkili olmuştur (bkz. bölüm 4.8). Klinik çalışmalarda, 4 ila 8 haftalık tedaviden sonra progresif düşüşler yaygın olmamıştır. MNS 750/mm3'ün altına düştüğünde doz azaltımı önerilir (bkz. bölüm 4.2). MNS 500/mm3'ün altındaki hastalar için, MNS 1000/mm3'ün üstüne dönene kadar tedaviye ara verilmelidir. PEGASYS veya PEGASYS/ribavirin ile yapılan klinik çalışmalarda MNS'daki azalma, doz azaltımı veya tedaviye ara verilmesi ile geri dönmüştür.
PEGASYS ve PEGASYS/ribavirin tedavileri, tedavi sonrası gözlem döneminde tedavi öncesi (başlangıç) değerlere dönen, trombosit sayısındaki düşüş ile ilişkilidir (bkz. bölüm 4.8). Trombosit sayısı 50,000/mm3'ün altındaki değerlere indiğinde doz azaltımı önerilir ve trombosit sayısı 25,000/mm3'ün altındaki değerlere indiğinde tedaviye ara verilmesi önerilir (bkz. bölüm 4.2).
Klinik çalışmalarda, 48 hafta boyunca 1000 mg veya 1200 mg PEGASYS/ribavirin ile tedavi gören hastaların %13'ünde ve 24 hafta boyunca 800 mg PEGASYS/ribavirin ile tedavi gören hastaların da %3'ünde anemi (hemoglobin<10 g/dL) gözlenmiştir (bkz. bölüm 4.8). Hemoglobindeki maksimum düşüş, ribavirin tedavisi başladıktan sonra 4 hafta içinde olmuştur. Tam kan değerleri, tedaviden önce, tedavinin 2. ve 4. haftasında ve sonrasında periyodik olarak belirlenmelidir. Kardiyovasküler durumda kötüleşme olursa, ribavirin tedavisine ara verilmelidir veya tedavi sonlandırılmalıdır (bkz. bölüm 4.2). Ayrıca ribavirin ürün bilgilerine bakınız.
Önceki tedavinin başarısız olduğu kronik hepatit C hastalarında, PEGASYS ve ribavirin kombinasyon tedavisinin kullanılması, daha önceki tedavilerini hematolojik advers olaylar nedeniyle sona erdirmiş hastalarda yeteri kadar çalışılmamıştır. Tedavi planlayan doktorlar, bu hastalarda, yeniden tedavinin risk ve yararlarını dikkatle ölçmelidir.
Tam kan değerlerinin (TKD) tedavi öncesinde belirlenmesi ve tedavi süresince düzenli gözlenmesi tavsiye edilmektedir. PEGASYS monoterapisi veya PEGASYS/ribavirin kombinasyon tedavisi, başlangıç nötrofil değeri <1500/mm3, başlangıç trombosit sayısı <90.000/mm3 veya başlangıç hemoglobini <12g/dL olan hastalarda dikkatle uygulanmalıdır (bkz. bölüm 4.2). Diğer interferonlarda olduğu gibi, PEGASYS potansiyel miyelosüpresif ajanlarla birlikte uygulanırken dikkatli olunmalıdır.
Literatürde, ribavirin ve azatiyoprinin eşzamanlı kullanımının ardından 3 ila 7 hafta içinde pansitopeni (kırmızı kan hücreleri, nötrofiller ve trombositlerde belirgin düşüş) ve kemik iliği supresyonu bildirilmiştir. Miyelotoksisite, HCV antiviral tedavisi ve azatiyoprinin eşzamanlı kullanımının bırakılmasına bağlı olarak 4-6 hafta içinde geri dönüşlü olmuştur ve iki tedaviden birine yeniden başlamasına bağlı olarak tekrarlanmamıştır (bkz. bölüm 4.5).
Karaciğer ve diğer nakil hastalarında, PEGASYS ve Copegus tedavisinin güvenliliği ve etkinliği kanıtlanmamıştır. Diğer alfa interferonlarda da olduğu gibi, tek başına veya ribavirin ile kombinasyon halinde PEGASYS kullanımında karaciğer ve böbrek graft reddi rapor edilmiştir.
Enfeksiyonlar
Ateş, interferon tedavisi sırasında yaygın biçimde bildirilen grip-benzeri sendromla ilişkili olmasına rağmen, persistan ateşin diğer nedenleri özellikle nötropenik hastalarda dışlanmalıdır. PEGASYS'in de dahil olduğu alfa interferonlarla yapılan tedavilerde, ciddi enfeksiyonlar (bakteriyel, viral, fungal) bildirilmiştir. Uygun anti-infektif tedaviye hemen başlanmalıdır ve tedavinin sonlandırılması düşünülmelidir.
Otoimmün hastalıklar
Alfa interferon tedavisi alan hastalarda otoimmün hastalıklarda artış bildirilmiştir; PEGASYS veya PEGASYS/ribavirin otoimmün bozuklukları olan hastalarda dikkatle kullanılmalıdır.
Alfa interferonların kullanımı, psöriyazisin şiddetlenmesi veya provokasyonu ile ilişkilendirilebilir. Tek başına veya ribavirin ile kombine PEGASYS, psöriyazisi bulunan hastalarda dikkatle kullanılmalıdır ve psöriyatik lezyonların ortaya çıkması veya kötüleşmesi durumunda tedavinin kesilmesi düşünülmelidir.
Endokrin
Diğer interferonlarla olduğu gibi PEGASYS veya PEGASYS/ribavirin, hipotiroidizm veya hipertiroidizme sebep olabilir veya ağırlaştırabilir. Tiroid anormallikleri yeterli tedavi edilemeyen hastalarda, tedavinin kesilmesi düşünülmelidir. Alfa interferonlarla tedavi edilen hastalarda hipoglisemi, hiperglisemi ve diabetes mellitus gözlenmiştir. İlaç tedavisi ile etkili bir biçimde kontrol edilemeyen bu koşullardaki hastalarda, PEGASYS monoterapisine veya PEGASYS/ribavirin kombinasyon tedavisine başlanmamalıdır. Tedavi sırasında bu koşulların meydana geldiği veya ilaç tedavisi ile kontrol edilemeyen hastalarda PEGASYS veya PEGASYS/ribavirin tedavisi sonlandırılmalıdır.
Nöropsikiyatrik
PEGASYS veya PEGASYS/ribavirinin de dahil olduğu, interferon tedavisi gören hastalarda ciddi psikiyatrik advers etkiler görülebilir. Önceden psikiyatrik bozukluğu olan veya olmayan hastalarda depresyon, intihar düşüncesi ve intihar girişimi oluşabilir. PEGASYS monoterapisi ve PEGASYS/ribavirin kombinasyon tedavisi depresyon öyküsü bildiren hastalarda dikkatle kullanılmalı ve hekimler hastaları depresyon bulguları açısından izlemelidir. PEGASYS veya PEGASYS/ribavirin tedavisine başlanmadan önce hekimler depresyon gelişmesi olasılığı konusunda hastaları bilgilendirmeli ve hastalar depresyona ait semptom veya bulguları derhal bildirmelidir. Ağır olgularda tedavinin kesilmesi düşünülmeli ve psikiyatrik müdahale yapılmalıdır. (bkz. bölüm 4.8).
Oftalmolojik
Diğer interferonlarla olduğu gibi, PEGASYS ile tedaviden sonra, görme kaybına yol açabilen retina hemorajisi, iskemik alanlar, papilödem, optik nöropati ve retinal arter veya ven tıkanıklığı içeren retinopati bildirilmiştir. Tüm hastalar temel bir göz muayenesinden geçirilmelidir. Önceden oftalmolojik rahatsızlıkları (örn. diyabet veya hipertansif retinopati) olan hastaların, alfa interferon tedavisi sırasında periyodik göz muayeneleri yapılmalıdır. Görme azalması veya kaybından yakınan her hasta vakit kaybetmeden kapsamlı bir göz muayenesine alınmalıdır. Oftalmolojik rahatsızlıkları yeni ortaya çıkan veya kötüleşen hastalarda PEGASYS veya PEGASYS/ribavirin tedavisi kesilmelidir.
Kardiyovasküler
Kardiyak hastalıklar ribavirinin sebep olduğu anemi tarafından kötüleşebildiğinden, geçmiş 6 ay içinde kayda değer veya stabil olmayan kalp hastalığı geçmişi bulunan HCV hastaları ribavirin kullanmamalıdır. Hipertansiyon, supraventriküler aritmiler, konjestif kalp yetmezliği, göğüs ağrısı ve miyokard enfarktüsü gibi kardiyovasküler olaylar, PEGASYS ve PEGASYS/ribavirinin de dahil olduğu interferon tedavileri ile ilişkili bulunmuştur. Önceden kardiyak anormallikleri bulunan hastaların, tedaviye başlamadan önce bir elektrokardiyogram çektirmeleri tavsiye edilir. Kardiyovasküler durumda herhangi bir kötüleşme varsa, tedavi askıya alınmalı veya sona erdirilmelidir (bkz. bölüm 4.2 ve ribavirin ürün bilgileri).
Aşırı duyarlılık
Alfa interferon tedavisi süresince ciddi, akut aşırı duyarlılık reaksiyonları (örn., ürtiker, anjiyoödem, bronkokonstriksiyon, anafilaksi) çok seyrek olarak gözlenmiştir. Eğer PEGASYS veya PEGASYS/ribavirin ile yapılan tedavi sırasında bu tip bir durum meydana geliyorsa, tedavi kesilmeli ve uygun tıbbi tedaviye derhal başlanmalıdır. Geçici döküntüler tedavinin kesilmesini gerektirmez.
Pulmoner
Diğer alfa interferonlarda olduğu gibi, tek başına veya ribavirin ile kombine PEGASYS tedavisi sırasında, dispne, pulmoner infiltratlar, pnömoni ve pnömonitin dahil olduğu pulmoner semptomlar bildirilmiştir. Persistan veya açıklanamayan pulmoner infiltratlar veya akciğer fonksiyon yetmezliği durumunda tedavi kesilmelidir.
Karaciğer fonksiyonu
Tedavi sırasında hepatik dekompansasyon bulguları gelişen hastalarda PEGASYS veya PEGASYS/ribavirin tedavisi kesilmelidir.
HCV: PEGASYS veya PEGASYS/ribavirin ile tedavi edilen hastalarda, viral yanıt olanlar dahil olmak üzere, diğer alfa interferonlarda olduğu gibi, ALT düzeylerinde başlangıca göre artışlar gözlenmiştir. Doz azaltımına rağmen ALT düzeyindeki artış progresif ve klinik açıdan anlamlı olduğunda veya bu artışa bilirubin düzeyinde artış eşlik ettiğinde tedavi kesilmelidir (bkz. bölüm 4.2).
HBV: HCV'nin aksine, tedavi sırasındaki hastalık alevlenmeleri seyrek olmayıp, serum ALT düzeylerinde geçici ve potansiyel olarak anlamlı artışlarla karakterizedir. HBV'de PEGASYS ile gerçekleştirilen klinik çalışmalarda, belirgin transaminaz alevlenmelerine, hepatik dekompansasyon bulguları olmaksızın, diğer hepatik fonksiyonlarında hafif değişiklikler eşlik etmiştir. Normalin üst sınırını 10 kat aşan alevlenme vakalarının yaklaşık yarısında PEGASYS dozu azaltılmış veya transaminaz yükselmeleri ortadan kayboluncaya dek durdurulurken, kalanlarda tedavi değiştirilmeden sürdürülmüştür. Her durumda hepatik fonksiyonların daha sık olarak izlenmesi önerilmiştir.
HIV-HCV koenfeksiyonu
İleri sirozlu ve HAART (Highly Active Anti-Retroviral Therapy) tedavisi gören koenfeksiyonlu hastalarda, PEGASYS de dahil olmak üzere, alfa interferonlarla kombine ribavirin tedavisi uygulandığında, karaciğer dekompansasyonu ve ölüm riski yüksek olabilir. Tedavi sırasında, koenfeksiyonlu hastalar hepatik dekompansasyon belirtileri ve semptomları (asit, ensefalopati, varis kanaması, karaciğerin sentez fonksiyonu bozukluğu; örneğin Child-Pugh skoru >7) için yakından izlenmelidir. Child-Pugh skoru tedaviye bağlı faktörler (örneğin, indirekt hiperbilirubinemi, azalmış albumin) tarafından etkilenebilir ve hepatik dekompansasyona kesin olarak bağlanamaz. Hepatik dekompansasyon olan hastalarda PEGASYS tedavisine derhal son verilmelidir.
Yardımcı maddeler: Bu tıbbi ürün her ml'sinde 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani esasında "sodyum içermez".
Benzil alkol için 4.2 ve 4.3 bölümlerine bakınız.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
PEGASYS'in ribavirin ile birlikte kullanıldığı HCV klinik çalışmalarında, PEGASYS ile ribavirin arasında farmakokinetik etkileşim olmadığı gözlenmiştir. Benzer olarak, PEGASYS'in lamuvidin ile kombine kullanıldığı HBV klinik çalışmalarında, lamuvidinin PEGASYS'in farmakokinetiği üzerinde etkisi olmamıştır. PEGASYS'in 4 hafta süreyle, haftada bir kez, 180 mikrogram dozuyla sağlıklı erkek olgulara uygulanması tolbutamidin (CYP 2C9), mefenitoin (CYP 2C19), debrisokin (CYP 2D6), ve dapson (CYP 3A4) farmakokinetik profilleri üzerinde etki göstermemiştir. Aynı çalışmada teofilinin EAA'nında yaklaşık %25 artış olmuştur ve bu, PEGASYS'in sitokrom P450 1A2 aktivitesinin zayıf bir inhibitörü olduğunu göstermiştir. Teofilinin farmakokinetiği üzerindeki karşılaştırılabilir etkiler, standart alfa interferonlarla yapılan tedaviden sonra gözlenmiştir. Alfa interferonların, hepatik mikrozomal sitokrom P450 enzimlerinin aktivitesini azaltarak, bazı ilaçların oksidatif metabolizmasını etkilediği gösterilmiştir. Teofilin ile birlikte PEGASYS veya PEGASYS/ribavirin alan hastalarda, serumdaki teofilin konsantrasyonları izlenmeli ve teofilin dozunda uygun ayarlama yapılmalıdır.Metadon idame tedavisini (medyan doz 95 mg; 30 mg ile 150 mg arası) beraberinde alan 24 HCV hastasıyla yapılan bir farmakokinetik çalışmada, 4 hafta boyunca haftada bir PEGASYS 180 mikrogram ile yapılan tedavi, ortalama metadon seviyelerinde başlangıç değerine göre %10 ila %15 arasında yükselme ile ilişkilendirilmiştir. Bu bulgunun klinik olarak önemi bilinmemektedir, buna rağmen hastalar metadon toksisitesinin bulgu ve semptomlarına karşın sürekli takip edilmelidir.
HIV-HCV ko-enfeksiyonlu hastalar
Bazı nükleozid revers transkriptaz inhibitörlerinin (lamivudin ve zidovudin veya stavudin) intraselüler fosforilizasyonuna ribavirinin etkilerini araştırmak için düzenlenen 12 haftalık bir farmakokinetik alt-çalışmasını tamamlayan 47 HIV-HCV ko-enfeksiyonlu hastada ilaç etkileşimine ait bir bulgu gözlenmemiştir. Ribavirinin plazmada bulunuşu, eş zamanlı olarak nükleozid revers transkiptaz inhibitörleri (NRTI) uygulanmasından etkilenmemiştir.
Ribavirin ve didanozinin birlikte uygulanması önerilmemektedir. Didanozin ribavirin ile birlikte uygulandığında, didanozin veya aktif metabolitine (dideoksiadenozin 5'-trifosfat) maruz kalma artmaktadır. Ribavirin kullanımı ile birlikte ölümcül karaciğer yetmezliği ve yanı sıra periferik nöropati, pankreatit ve semptomatik hiperlaktasidemi/laktik asidoz bildirilmiştir.
Günlük telbivudin 600 mg'ın haftada bir 180 mikrogram subkütan pegile interferon alfa-2a kombinasyonu uygulamasını araştıran, Roche dışında yapılmış bir klinik çalışma, kombinasyonun periferal nöropati gelişme riskinin artması ile ilişkili olduğunu göstermiştir. Bu olayların arkasındaki mekanizma bilinmemektedir. Bu çeşit bir risk artışı diğer interferonlar (pegile veya standart) için göz ardı edilemez. Bununla beraber telbivudinin interferon alfa (pegile veya standart) ile kombinasyonun yararları halihazırda tespit edilmemiştir.
Azatiyoprin:
Azatiyoprin ile tedavi edilen hastalarda miyelotoksisite ile ilişkili olarak, ribavirin, inosin monofasfat dehidrojenaz üzerinde inhibitör etkisine sahip olduğundan, azatiyoprin metobolizmasına etki edebilir ve 6- metiltiyoinozin monofosfat (6-MTIMP)'ın birikmesine sebep olabilir.
Bağımsız vakalarda, eşzamanlı ribavirin ve azatiyoprin kullanımının faydası potansiyel riskten fazla olduğunda, eşzamanlı azatiyoprin kullanımı sırasında miyelotoksisite belirtilerini ve ilacın ne zaman durdurulması gerektiğini tespit etmek amacıyla yakın hematolojik takip tavsiye edilir (bkz. bölüm 4.4).
4.6. Gebelik ve laktasyon
Genel tavsiye
Gebelik kategorisi: C : Monoterapi olarak kullanıldığındaGebelik kategorisi: X: Ribavirin ile birlikte kullanıldığında (Pegasys'in ribavirinle
birlikte kullanılması gerektiğinde lütfen ribavirin ürün bilgilerine de bakınız.)
PEGASYS'in gebelerde kullanımına ilişkin yeterli veri mevcut değildir.
Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir.
İnsanlara yönelik potansiyel risk bilinmemektedir.
PEGASYS gebelik döneminde kullanılmamalıdır.
PEGASYS gebe kadınlarda ribavirin ile beraber kullanılmamalıdır.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Peginterferon alfa-2a'nın teratojenik etkisi üzerine herhangi bir çalışma mevcut değildir. İnterferon alfa-2a ile yapılan tedavi, rhesus maymunlarda düşük riski istatistiksel olarak gözle görülür bir artmayla sonuçlanmıştır. Vaktinde dünyaya gelen yavru hayvanlarda herhangi bir teratojenik etki gözlenmemiştir. Ancak, diğer alfa interferonlarla olduğu gibi, PEGASYS tedavisi gören çocuk doğurma potansiyeli olan kadınlar, etkili doğum kontrol yöntemleri kullanmaları konusunda uyarılmalıdır.Ribavirinle birlikte kullanım
Ribavirine maruz kalan tüm hayvan türlerinde, kayda değer teratojenik ve/veya embriyosidal etkiler kanıtlanmıştır. Ribavirin tedavisi gebelerde ve eşleri gebe olan erkeklerde kontrendikedir. Kadın hastalarda veya ribavirin alan erkek hastaların partnerlerinde gebeliği önlemeye çok dikkat edilmelidir. Her türlü doğum kontrol yöntemi başarısız olabilir. Bu nedenle, gebelik potansiyeli olan kadınların ve eşlerinin, tedavi sırasında ve tedaviyi izleyen 6 ay boyunca eşzamanlı olarak 2 etkili doğum kontrol yöntemi kullanmaları gerekir.
PEGASYS'in ribavirinle birlikte kullanılması gerektiğinde lütfen ribavirin ürün bilgilerine de bakınız.
Gebelik dönemi
5.3. bölümüne bakınız.Laktasyon dönemi
Peginterferon alfa-2a ve/veya ribavirinin insan sütüyle atılıp atılmadığı bilinmemektedir. Birçok ilaç insan sütüne geçtiğinden, emzirilen bebeklerde peginterferon alfa-2a veya ribavirine bağlı oluşabilecek herhangi bir ciddi advers reaksiyonu engellemek için, tedavinin anne için önemi göz önünde tutularak emzirme veya tedavinin kesilmesi yönünde bir karara varılmalıdır.Üreme yeteneği (fertilite)
PEGASYS'in üreme üzerine etkisi ile ilgili çalışma yoktur. Adet döneminin uzaması, diğer alfa interferonlarla olduğu gibi, dişi maymunlara peginterferon alfa-2a uygulamasının ardından gözlenen 17p-estradiol ve progesteron pikinde gecikme ve azalma ile ilişkilendirilmiştir. Tedavinin sona erdirilmesinin ardından adet dönemleri düzene girmiştir.PEGASYS'in erkek üremesi üzerine etkisi ile ilgili yapılmış herhangi bir çalışma yoktur. Ancak, interferon alfa-2a ile 5 ay boyunca 25x106 lU/kg/gün doza kadar yapılan tedavi, erkek rhesus maymunların üremesini etkilememiştir.
4.7.Araç ve makine kullanımı üzerindeki etkiler
Baş dönmesi, konfüzyon, uyku hali ve yorgunluk gelişen hastalar araç veya makine kullanmamaları konusunda uyarılmalıdır.4.8.İstenmeyen etkiler
Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1000 ila <1/100); seyrek (>1/10000 ila <1/1000); çok seyrek (<1/10000), bilinmiyor (eldeki veriler ile tahmin edilemiyor)Tek başına veya ribavirin ile kombine, diğer alfa interferonlarla gözlenen yan etkiler, sırasıyla PEGASYS veya PEGASYS/ribavirin kombinasyon tedavisinde de beklenebilir.
Klinik çalışmalar
PEGASYS ve PEGASYS/ribavirin ile tedavi edilen hastalarda en fazla bildirilen advers reaksiyonların sıklığı ve şiddeti, alfa interferon veya ribavirin ile birlikte alfa interferon ile tedavi edilen hastalarda bildirilenlere benzerdir.
PEGASYS veya PEGASYS/ribavirin ile en sık bildirilen advers reaksiyonlar hafif-orta şiddettedir ve dozaj değişikliği veya tedavinin kesilmesine gerek kalmadan tedaviye devam edilir.
Kronik Hepatit B
48-haftalık tedavi ve 24-haftalık izleme süresi içeren klinik çalışmalarda, PEGASYS'in kronik hepatit B'deki güvenlilik profili, her ne kadar bildirilen advers olayların sıklığı kronik hepatit B'de belirgin şekilde daha düşük olmuşsa da, kronik hepatit C'de görülen ile benzer olmuştur (bkz. Tablo 3). PEGASYS ile tedavi edilen hastaların %88'inin advers olaylar yaşamasına karşılık, lamivudin karşılaştırma grubundaki hastaların %53'ü advers olay yaşamış ve PEGASYS ile tedavi edilen hastaların %6 ve lamivudin ile tedavi edilen hastaların %4'ü çalışmalar sırasında ciddi advers olaylar yaşamıştır. Hastaların %5'i PEGASYS tedavisini advers olaylar veya laboratuvar değerlerindeki anormallikler nedeniyle yarım bırakırken, hastaların %1'inden azı lamivudin tedavisini güvenlilik nedenleri ile yarım bırakmıştır. Her iki tedavi kolunda da sirozlu hastaların tedaviyi yarım bırakma oranları, genel tedaviyi yarım bırakma oranları ile benzer olmuştur. Lamivudin eklenmesinin PEGASYS güvenlilik profili üzerine bir etkisi olmamıştır.
Kronik Hepatit C
Klinik çalışmalarda, tüm hastalar arasında advers olaylara ve laboratuvar anormalliklerine bağlı olarak tedaviyi bırakma oranı PEGASYS monoterapisinde %9 ve 48 hafta boyunca 1000/1200 mg verilen ribavirin ile kombine PEGASYS için ise %13 olmuştur. Sırasıyla, laboratuvar anormalliklerine bağlı olarak, hastaların sadece %1 veya %3'ünde PEGASYS veya PEGASYS/ribavirin'in sonlandırılması gerekmiştir. Sirozlu hastalar için tedaviyi bırakma oranı, tüm populasyon ile benzerdir. 48 haftalık 1000/1200 mg'lık ribavirin ve PEGASYS tedavisine kıyasla, tedavi süresinin 24 haftaya ve ribavirinin günlük dozunun 800 mg'a düşürülmesi, ciddi advers olaylarda (%11'e kıyasla %3), güvenlik sebebiyle yapılan erken tedavi sonlanmalarında (%13'e kıyasla %5) ve ribavirin doz ayarlamasına olan ihtiyaçta (%39'a kıyasla %19) azalmayla sonuçlanmıştır.
Önceki tedaviye yanıtsız Kronik Hepatit C hastaları
Daha önce pegile interferon alfa-2b/ribavirin tedavisine yanıt vermemiş hastaların, 72 ve 48 haftalık tedavisini içeren bir klinik çalışmada, 72 hafta kolundaki hastalar için, advers olaylara veya laboratuvar anormalliklerine bağlı tedaviyi bırakma sıklığı, PEGASYS tedavisinde %12 ve Copegus tedavisinde %13'dür. Karşılaştırmada, 48 hafta kolunda, PEGASYS tedavisini bırakma %6, Copegus tedavisini bırakma %7'dir. Benzer şeklide, sirozlu hastalar için, PEGASYS ve Copegus tedavilerini bırakma sıklığı, 48 haftalık tedavi (%6 ve %6) ile karşılaştırıldığında, 72 haftalık tedavide (%13 ve %15) daha
yüksektir. Daha önceki tedavisi hematolojik toksisiteye bağlı olarak kesilmiş hastalar, bu çalışmada kayıt dışı tutulmuştur.
Başka bir klinik çalışmada, daha önceki tedaviye yanıt vermemiş ileri evre fibrozlu veya sirozlu hastalar (Ishak değeri 3-6 arası), en az 50.000/mm3 başlangıç trombosit sayısı ile dahil edilmiş ve 48 hafta tedavi edilmiştir. Bu çalışmada hastalar arasında, ileri evre siroz/fibroz durumunun yüksek prevalansı ve trombosit sayısının başlangıçta düşük olmasına bağlı olarak, çalışmanın ilk 20 haftasında hematolojik laboratuar anormalliklerinin sıklığı şu şekildedir: hemoglobin <10g/dL, %26.3; MNS <750/mm3, %30; trombosit <50.000/ mm3, %13.
HIV-HCV ko-enfeksiyonu
HIV-HCV ko-enfeksiyonlu hastalarda, tek başına veya ribavirin ile kombine olarak PEGASYS için bildirilmiş olan klinik advers olay profilleri HCV mono-enfekte hastalarda gözlenenler ile benzerdir. CD4+ hücre değeri <200/mikrolitre olan ko-enfekte hastalarda, güvenlilik verileri sınırlıdır (N=51). Çalışma NR15961'de, klinik advers olaylar, laboratuvar anormallikleri veya AIDS ilişkili olaylardan dolayı tedavinin bırakılma oranı, 48 hafta boyunca PEGASYS monoterapisi için %16 ve 800 mg ribavirin ile kombine verilen PEGASYS için %15 olmuştur. Laboratuvar anormallikleri nedeniyle, sırasıyla hastaların %4 ve %3'ünde PEGASYS veya PEGASYS/ribavirin'in sonlandırılması gerekmiştir. Ko-enfekte hastalarda, kombinasyon tedavisinde, PEGASYS doz ayarlanması %39 oranında ve ribavirin doz ayarlaması da %37 oranında olmuştur. PEGASYS monoterapisi veya ribavirin ile kombine tedavi uygulanan hastalarda, rapor edilen ciddi advers olaylar sırasıyla %21 ve %17 olmuştur.
PEGASYS içeren tedavi, tedavi süresince CD4+ hücre yüzdesinde düşüş olmadan, mutlak CD4+ hücre sayısında azalma ile ilişkilendirilmiştir. CD4+ hücre sayısının göstergeleri, çalışmanın takip süresi boyunca başlangıç değerlerine dönmüştür. PEGASYS içeren tedavinin, HIV viremi kontrolüne tedavi süresince veya takibinde negatif etkisi olmamıştır.
Tablo 3, farklı endikasy onlarda PEGASYS, PEGASYS ile ribavirin veya interferon alfa-2b ile ribavirin alan hastalarda çok yaygın meydana gelen advers reaksiyonları göstermektedir.
Tablo 3: Advers Reaksiyonlar (Herhangi bir Tedavi Grubunda Çok Yaygın Görülenler)
|
|
HBV |
HCV |
HIV-HCV |
HCV Peginterferon alfa-2b tedavisine yanıtsız | |||
|
Vücut Sistemi |
PEG 180 mikrogram* |
PEG 180 mikrogram |
PEG 180 mikrogram + 800 mg ribavirin |
PEG 180 mikrogram + 1000 mg veya 1200 mg ribavirin |
IFN alfa-2b + 1000 mg veya 1200 mg ribavirin |
PEG 180 mikro gram + 800 mg ribavirin |
PEG 180 mikrogram + 1000 mg veya 1200 mg ribavirin |
|
|
48 hafta (WV16240 + WV16241) |
48 hafta (NV15801 + monoterapi programı) |
24 hafta (NV15942) |
48 hafta (NV15801 + NV15942) |
48 hafta (NV15801) |
48 hafta (NV15961) |
72 hafta (MV17150) |
|
|
N = 448 |
N=827 |
N=207 |
N=887 |
N=443 |
N=288 |
N=156 |
|
|
% |
% |
% |
% |
% |
% |
% |
Metabolizma ve beslenme bozuklukları |
| ||||||
|
İştahsızlık |
13 |
16 |
20 |
27 |
26 |
23 |
15 |
|
Kilo kaybı |
4 |
5 |
2 |
7 |
10 |
16 |
9 |
Psikiyatrik hastalıklar |
| ||||||
|
Uykusuzluk |
6 |
20 |
30 |
32 |
37 |
19 |
29 |
|
Depresyon |
4 |
18 |
17 |
21 |
28 |
22 |
16 |
|
İrritabilite |
3 |
17 |
28 |
24 |
27 |
15 |
17 |
|
Konsantrasyon bozukluğu |
2 |
9 |
8 |
10 |
13 |
2 |
5 |
|
Anksiyete |
3 |
6 |
8 |
8 |
12 |
8 |
6 |
Sinir sistemi bozuklukları | |||||||
|
Baş ağrısı |
23 |
52 |
48 |
47 |
49 |
35 |
32 |
|
Sersemlik (baş dönmesi haricinde) |
6 |
15 |
13 |
15 |
14 |
7 |
10 |
Solunum, göğüs bozuklukları ve mediastinal hastalıklar | |||||||
|
Dispne |
1 |
5 |
11 |
13 |
14 |
7 |
11 |
|
Öksürük |
2 |
4 |
8 |
13 |
7 |
3 |
17 |
Gastrointestinal hastalıklar | |||||||
|
Mide bulantısı |
6 |
24 |
29 |
28 |
28 |
24 |
24 |
|
İshal |
6 |
16 |
15 |
14 |
10 |
16 |
13 |
|
Karın ağrısı |
4 |
15 |
9 |
10 |
9 |
7 |
9 |
Deri ve deri altı doku hastalıkları | |||||||
|
Alopesi |
17 |
23 |
25 |
24 |
33 |
10 |
18 |
|
Kaşıntı |
6 |
13 |
25 |
21 |
18 |
5 |
22 |
|
Dermatit |
<1 |
9 |
15 |
16 |
13 |
1 |
1 |
|
Cilt kuruluğu |
1 |
5 |
13 |
12 |
13 |
4 |
17 |
Kas- iskelet bozuklukları, bağ doku ve kemik hastalıkları | |||||||
|
Kas ağrısı |
25 |
37 |
42 |
38 |
49 |
32 |
22 |
|
Eklem ağrısı |
10 |
26 |
20 |
22 |
23 |
16 |
15 |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | |||||||
|
Yorgunluk |
21 |
49 |
45 |
49 |
53 |
40 |
36 |
|
Yüksek ateş |
52 |
35 |
37 |
39 |
54 |
41 |
20 |
|
Üşüme ve titremeler |
6 |
30 |
30 |
25 |
34 |
16 |
12 |
|
Enjeksiyon bölgesi reaksiyonu |
7 |
22 |
28 |
21 |
16 |
10 |
12 |
|
Ağrı |
1 |
11 |
9 |
10 |
9 |
6 |
6 |
|
Asteni |
11 |
7 |
18 |
15 |
16 |
26 |
30 |
HBV, HCV ve HIV-HCV hastalarında, PEGASYS monoterapi sinde veya PEGASYS/ribavirin kombinasyon tedavisinde yaygın bildirilen advers etkiler:
Enfeksiyonlar ve enfestasyonlar:
herpes simpleks, üst solunum yolu enfeksiyonu, bronşit, oral kandidiyazisKan ve lenf sistemi hastalıkları:Endokrin hastalıkları:
hipotiroidizm, hipertiroidizmPsikiyatrik ve sinir sistemi hastalıkları:
bellek zayıflığı, tat alma duyusu bozukluğu, parestezi, hipoestezi, titreme, güçsüzlük, duygusal bozukluklar, ruh hali değişikliği, sinirlilik, agresif davranışlar, cinsel istekte azalma, migren, uyku hali, hiperestezi, kabus görme, senkopGöz hastalıkları:Kulak ve iç kulak hastalıkları;
vertigo, kulak ağrısıKardiyak hastalıkları:Vasküler bozukluklar:
yüzde kızarıklıkSolunum, göğüs bozukları ve mediastinal hastalıkları:Gastrointestinal hastalıklar:Deri ve deri altı doku hastalıkları:
cilt bozukluğu, döküntü, egzema, psöryaz, ürtiker, ışığa karşı duyarlık reaksiyonu, terleme artışı, gece terlemesiKas-iskelet bozuklukları, bağ doku ve kemik hastalıkları:Üreme sistemi ve meme hastalıkları:
impotensGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklar:
grip benzeri hastalık, kırıklık, letarji, göğüs ağrısı, sıcak basması, susamaPEGASYS/ribavirin kombinasyonu alan HIV-HCV hastalarının yaygın rapor edilen diğer advers reaksiyonlar şunlardır: hiperlaktasidemi/laktik asidoz, grip, pnömoni, hastalığa karşı dirençsizlik, apati, kulak çınlaması, yutak-gırtlak ağrısı, dudak iltihabı, edinilmiş lipodistrofi ve idrarın anormal renk alması.
Klinik çalışmalar sırasında PEGASYS/ribavirin kombinasyonu veya PEGASYS monoterapisi uygulanan hastalarda, diğer alfa interferon tedavilerinde olduğu gibi, aşağıdaki seyrek görülen ciddi advers etkiler rapor edilmiştir: alt solunum yolu enfeksiyonu, cilt enfeksiyonu, dış kulak iltihabı, endokard iltihabı, intihara meyil, yüksek doz madde alımı, karaciğer bozukluğu, karaciğer yağlanması, kolanjit, malign karaciğer neoplazması, peptik ülser, gastrointestinal kanama, pankreatit, aritmi, atriyal fibrilasyon, perikardit, otoimmün olaylar (ITP (idyopatik trombositopenik purpura), tiroidit, psöriyazlar, romatoid artrit, SLE), miyozit, periferal nöropati, koma, sarkoidoz, ölümle sonuçlanan interstisyel pnömonit, pulmoner embolizm, kornea ülseri, koma, beyin kanaması, TTP, psikoz ve halusinasyon.
Ribavirin ile kombine olarak kullanılan PEGASYS'in de dahil olduğu alfa interferonların, seyrek olarak pansitopeni çok seyrek olarak da aplastik anemi ile ilişkilendirilebildiği bildirilmiştir.
Laboratuvar anormallikleri
HCV hastalarındaki kombinasyon tedavisinde, ribavirinin laboratuvar parametrelerine olan etkileri için, lütfen ribavirin ürün bilgilerine bakınız.
Hematoloji:
Diğer interferonlarla olduğu gibi, PEGASYS veya PEGASYS/ribavirin ile yapılan tedavi, genel olarak doz ayarlaması ile düzeltilebilen ve tedavinin iyileştirilmesinin ardından 4 ila 8 hafta içinde tedavi öncesi değerlere döndürülebilen, hematolojik değerlerdeki düşüşler ile ilişkilendirilmiştir (bkz. bölüm 4.4 ve 4.2). Her ne kadar hematolojik toksisiteler nötropeni, trombositopeni ve anemi HIV-HCV hastalarında daha sık olarak ortaya çıkmışsa da, bunların çoğunluğu doz değişiklikleri ve büyüme faktörlerinin kullanılması ile giderilebilmiş ve seyrek olarak tedavinin erken kesilmesini gerektirmiştir.
Hemoglobin ve hematokrit:
PEGASYS monoterapisi ile yapılan tedavi, hemoglobin ve hemotokritte küçük aşamalı azalmalar ile ilişkilendirilmesine rağmen, sirozlu olanlar dahil tüm HCV hastalarının %1'den azında anemi için doz ayarlanması gerekmiştir. 48 haftalık 1000/1200 mg PEGASYS/ribavirin kombinasyon tedavisindeki HCV hastalarının yaklaşık %48'inde anemi için doz ayarlaması gerekmiştir. PEGASYS monoterapisi veya ribavirin ile kombine tedavi gören HIV-HCV koenfeksiyonlu hastalarda, sırasıyla, %7 ve %14 oranında anemi rapor edilmiştir (hemoglobin <10g/dL).
Beyaz kan hücreleri:
PEGASYS tedavisi, hem toplam BKH sayısı ve hem de MNS değerlerindeki azalmalar ile ilişkilendirilmiştir. PEGASYS alan HBV veya HCV hastalarının yaklaşık %4'ünde ve PEGASYS/ribavirin alan HCV hastalarının %5'inde, tedavinin herhangi bir zamanında MNS değerlerinde 500 hücre/mm3 düzeyinin altına düşüşler olmuştur. PEGASYS monoterapi ve kombinasyon tedavisi uygulanan hastaların sırasıyla %13 ve %11'inde MNS düzeylerinde 500 hücre/mm3 altına düşüşler gözlenmiştir.
Trombosit sayıları:
PEGASYS tedavisi, trombosit sayılarındaki düşüşler ile ilişkilendirilmiştir. Klinik çalışmalarda, çoğunlukla sirozu olan ve çalışmaya başlangıç trombosit sayısı 75,000/mm3 kadar düşükken katılan, HCV hastalarının yaklaşık %5'inde trombosit sayılarında 50,000/mm3 düzeylerinin altına düşüşler olmuştur. Hepatit B için yapılan klinik çalışmalarda, çoğunlukla çalışmaya düşük trombosit başlangıç değerleri ile katılan hastaların yaklaşık %14'ünde trombosit sayılarında 50,000/mm3'ün altında düşüşler olmuştur. HIV-HCV hastalarında, PEGASYS monoterapi ve kombinasyon tedavisi uygulanan hastaların sırasıyla %10 ve %8'inde trombosit sayılarında 50,000/mm3'ün altında düşüşler olmuştur.
Tiroid fonksiyonu:
PEGASYS tedavisi tiroid laboratuvar değerlerinde klinik müdahale gerektiren ve klinik açıdan anlamlı anormallikler ile ilişkilidir (bkz. bölüm 4.4). PEGASYS/ribavirin (NV15801) alan hastalarda gözlenen sıklıklar diğer interferonlar ile gözlenen sıklıklarla benzerdir.
Trigliseridler:
PEGASYS dahil, alfa interferon tedavisi gören hastalarda, trigliserid düzeyleri yüksek bulunmuştur.
Anti-interferon Antikorları:
Ribavirin ile veya ribavirinsiz PEGASYS alan HCV hastalarının %3'ünde (25/835) düşük-titre nötralizan anti-interferon antikorları gelişmiştir. Serum nötralizan antikorlarının ortaya çıkışındaki klinik ve patolojik bulgular bilinmemektedir. Klinik cevap veya advers etki olarak antikor gelişiminde, gözle görülür bir ilişki belirlenememiştir.
Pazarlama sonrası deneyim
Pazarlama sonrasındaki süre boyunca, PEGASYS ve ribavirin kombinasyon tedavisi ile birlikte çok seyrek olarak eritem multiform, Stevens Johnson sendromu, toksik epidermal nekroliz, Saf Kırmızı Hücre Aplazisi (SKHA) ve adam öldürmeye yönelik düşünceler bildirilmiştir.PEGASYS ve ribavirin'in kombinasyon tedavisinde seyrek olarak dehidratasyon bildirilmiştir.
Diğer alfa interferonlar ile olduğu gibi, PEGASYS ve Copegus kombinasyon tedavisinde ciddi retina dekolmanı vakaları bildirilmiştir.
Diğer alfa interferonlarda da olduğu gibi, tek başına veya ribavirin ile kombinasyon halinde PEGASYS kullanımında karaciğer ve böbrek graft reddi rapor edilmiştir.
4.9. Doz aşımı ve tedavisi
Birbirini izleyen günlerde (haftalık aralar yerine) yapılan en az iki enjeksiyondan, 1 hafta boyunca (örn. 1260 mikrogram/hafta) her gün enjeksiyon yapılmasına kadar değişen PEGASYS doz aşımları bildirilmiştir. Bu hastaların hiçbiri sıradışı, ciddi veya tedaviyi sınırlayan olaylar yaşamamıştır. Haftalık 540 mikrograma ve 630 mikrograma varan dozlar sırasıyla renal hücre karsinomu ve kronik miyeloid lösemisi olan hastalara uygulanmıştır. İnterferon tedavisine bağlı, dozu sınırlayan toksisiteler yorgunluk, karaciğer enzimlerinde yükselme, nötropeni ve trombositopenidir. Klinik çalışmalarda ribavirinin doz aşımı ile ilgili herhangi bir vaka rapor edilmemiştir.5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grubu: İmmünostimulan ajan/sitokin ATC kodu: L03A B11PEG reaktifinin (bis-monometoksipolietilen glikol) interferon alfa-2a'ya konjügasyonu, polietilen glikollü bir interferon alfa-2a oluşturur. İnterferon alfa-2a, DNA rekombinant teknolojisi kullanılarak biyosentetik olarak üretilmektedir ve klonlanmış insan lökosit interferon geninin
E. coli
içinde kodlanması sonucunun bir ürünüdür. PEG kısmının yapısı, PEGASYS'in klinik farmakolojisini direk olarak etkilemektedir. Özellikle, 40 kD'lik PEG kısmının büyüklüğü ve dallanması, PEGASYS'in emilim, dağılım ve eliminasyon karakteristiklerini belirlemektedir.Ribavirinin farmakodinamik özellikleri için, lütfen ribavirin ürün bilgilerine bakınız. Etki mekanizması
PEGASYS, interferon alfa-2a'nın in-vitro antiviral ve antiproliferatif aktivitelerine sahiptir. İnterferonlar, hücre yüzeyindeki spesifik reseptörlere bağlanarak kompleks hücreiçi sinyal yolunu başlatır ve gen transkripsiyonunu hızla aktive eder. İnterferon stimule edici genler, infekte hücrelerdeki viral replikasyonun inhibisyonu, hücre çoğalmasının inhibisyonu ve immün-modülasyon da dahil, pek çok biyolojik etkiyi modüle eder.
HCV RNA seviyeleri, PEGASYS'le tedavi edilen ve tedaviye yanıt veren hepatit C'li hastalarda iki aşamalı olarak azalır. İlk azalma aşaması ilk PEGASYS dozunu izleyen 24 ila 36 saat içinde gerçekleşir ve bunu takiben ikinci azalma aşaması da uzun süreli yanıt veren hastalarda sonraki 4 ila 16 hafta boyunca devam eder. Haftalık 180 mikrogram PEGASYS, standart alfa interferon ile yapılan tedaviye kıyasla, viral klerensi arttırır ve tedavinin viral sonucundaki cevapları iyileştirir.
PEGASYS, serum neopterin ve 2',5'-oligoadenilat sentetaz gibi dengeleyici proteinlerin üretimini doza bağlı olarak stimüle eder. 2',5'-oligoadenilat sentetazın stimülasyonu, PEGASYS 135 mikrogram ve 180 mikrogramın tek dozlarının ardından maksimumdur ve bir doz aralığı boyunca maksimumda kalır. 2',5'-oligoadenilat sentetaz aktivitesinin büyüklüğü ve süresi, PEGASYS tarafından belirlenir ve 62 yaşından daha yaşlı kişilerde ve önemli derecede böbrek bozukluğu (kreatin klerensi 20 ila 40 mL/dk arası) olan kişilerde azalır. PEGASYS'in farmakodinamik işaretleri ile bu bulguların klinik ilişkisi bilinmemektedir.
Klinik etkinlik ve güvenlilik
Hepatit B:
Klinik çalışmalar, PEGASYS monoterapisinin, HBeAg pozitif ve HBeAg negatif/anti-HBe-pozitif olan kronik hepatit B'li hastaların tedavisinde etkili olduğunu göstermiştir.
Doğrulayıcı amaçlı klinik çalışmalar
Tüm klinik çalışmalara, HBV DNA ile ölçülen aktif viral çoğalması, yüksek ALT düzeyleri ve kronik hepatit ile uyumlu karaciğer biyopsisi bulunan kronik hepatit B'li hastalar dahil edilmiştir. Çalışma WV16241'e HBeAg negatif ve anti-HBe pozitif hastalar dahil edilirken, çalışma WV16240'a HBeAg pozitif hastalar dahil edilmiştir. Her iki çalışmada da, tedavi süresi 48 hafta olmuştur ve bunu tedavisiz 24 haftalık izleme süresi takip etmiştir. İki çalışma da PEGASYS ve plasebo, PEGASYS ve lamivudin ve tek başına lamivudini karşılaştırmıştır. Bu klinik çalışmalara, HBV-HIV koenfeksiyonlu hastalar alınmamıştır.
Her iki çalışma için izleme süresi sonundaki yanıt oranları Tablo 4'te sunulmuştur. HBV DNA, COBAS AMPLICOR HBV MONITOR tetkiki ile (saptama sınırı 200 kopya/mL) ölçülmüştür.
|
Tablo 4: Kroni |
k Hepatit B'de Serolojik, Viral ve Biyo |
kimyasal Yanıtlar | ||||
|
|
Ç |
HBeAg pozitif :alışma WV 16240 |
HBeAg ( |
; negatif/anti-HBe pozitif Çşma WV16241 | ||
|
PEGASYS 180 mikrogram & Plasebo (N =271) |
PEGASYS 180 mikrogram & Lamivudin 100 mg (N = 271) |
Lamivudin 100 mg (N = 272) |
PEGASYS 180 mikrogram & Plasebo (N = 177) |
PEGASYS 180 mikrogram & Lamivudin 100 mg (N = 179) |
Lamivudin 100 mg (N = 181) | |
|
HBeAg Sero-konversiyonu |
% 32 1 |
% 27 |
% 19 |
N/A |
N/A |
N/A |
|
HBV DNA* |
% 32 2 |
% 34 |
% 22 |
% 43 5 |
% 44 |
% 29 |
|
ALT Normalle şmesi |
% 41 3 |
% 39 |
% 28 |
% 59 6 |
% 60 |
% 44 |
|
HBsAg Sero-konversiyonu |
%3 4 |
% 3 |
% 0 |
% 3 |
% 2 |
% 0 |
1Lamivudine karşı olasılık oranı (% 95 CI (güven aralığı) =2.00 (1.34-2.97) p-değeri (sınıflandırılmış Cochran-Mantel-Haenszel testi) <0.001
2Lamivudine karşı olasılık oranı (% 95 CI (güven aralığı) =1.64 (1.12-2.42) p-değeri (sınıflandırılmış Cochran-Mantel-Haenszel testi) =0.012
3Lamivudine karşı olasılık oranı (% 95 CI (güven aralığı) =1.77 (1.23-2.54) p-değeri (sınıflandırılmış Cochran-Mantel-Haenszel testi) =0.002
4Olasılık oranı tanımlanamazp-değeri (sınıflandırılmış Cochran-Mantel-Haenszel testi) =0.004
5Lamivudine karşı olasılık oranı (% 95 CI (güven aralığı) =1.84 (1.17-2.89) p-değeri (sınıflandırılmış Cochran-Mantel-Haenszel testi) =0.007
6Lamivudine karşı olasılık oranı (% 95 CI (güven aralığı) =1.86 (1.22-2.85) p-değeri (sınıflandırılmış Cochran-Mantel-Haenszel testi) =0.004
Hepatit C:
Klinik çalışmalar tek başına veya ribavirin ile kombine PEGASYS'in, kompanse karaciğer hastalığı bulunan sirozlu hastaların da dahil olduğu kronik hepatit C'li hastaların ve aynı zamanda HIV-HCV ko-enfeksiyonlu hastaların tedavisinde etkili olduğunu göstermiştir.
Naif hastalarda doğrulayıcı amaçlı klinik çalışmalar
Tüm klinik çalışmalarda, saptanabilir HCV RNA serum seviyeleri, yüksek ALT seviyeleri ve kronik hepatitle tutarlı bir karaciğer biyopsisiyle doğrulanmış, daha önce interferon almamış, kronik hepatit C'li hastalar dahil edilmiştir. Çalışma NV15495'te özellikle histolojik olarak siroz teşhisi koyulmuş (yaklaşık %80) veya siroza ilerleyen hastalar (yaklaşık %20) dahil edilmiştir. Tedavi rejimleri, tedavi süresi ve çalışma sonucu için 2. ve 3. tablolara bakınız. Viral yanıt, COBAS AMPLICOR HCV Test, sürüm 2.0 ile ölçüldüğünde saptanamayan HCV RNA (saptama limiti: 50 IU/mL eşdeğeri 100 kopya/mL) ve kalıcı viral yanıt, tedavinin bitişinden yaklaşık 6 ay sonra bir negatif numune olarak tanımlanmıştır.
Tablo
5: Kronik Hepatit C Hastalarında Viral Yanıt
|
|
PEGASYS Monoterapisi |
PEGASYS Kombine Tedavisi | |||||
|
Sirozu olan ve olmayan |
Sirozu olan |
Sirozu olan ve olmayan | |||||
|
Çalışma NV15496 + NV15497 + NV15801 |
Çalışma NV15495 |
Çalışma NV15942 |
Çalışma NV15801 | ||||
|
PEGASYS 180 mikrogram (N=701) 48 hafta |
İnterferon alfa-2a 6 MIU/ 3 MIU & 3 MIU (N=478) 48 hafta |
PEGASYS 180 mikrogram (N=87) 48 hafta |
İnterferon alfa-2a 3 MIU (N=88) 48 hafta |
PEGASYS 180 mikrogram & Ribavirin 1000/1200 mg (N=436) 48 hafta |
PEGASYS 180 mikrogram & Ribavirin 1000/1200 mg (N=453) 48 hafta |
İnterferon alfa-2b 3 MIU & Ribavirin 1000/1200mg (N=444) 48 hafta | |
|
Tedavi sonunda yanıt |
%55 - 69 |
%22 - 28 |
%44 |
%14 |
%68 |
%69 |
%52 |
|
Kalıcı Viral yanıt |
%28 - 39 |
%11 - 19 |
%30* |
%8* |
%63 |
%54** |
%45** |
PEGASYS ve ribavirin kombinasyonu ile tedavi edilen hastaların genotip ve viral yüklere göre viral yanıtları Tablo 6'da özet halinde verilmiştir. Çalışma NV15942'nin sonuçları genotip bazında tedavi rejimleri önerme gerekçesini vermektedir (bkz. Tablo 2).
Tedavi rejimleri arasındaki fark genel olarak viral yükten veya siroz varlığından/yokluğundan etkilenmemiştir. Bu nedenle genotip 1, 2 ve 3 için tedavi önerileri bu temel özelliklerden bağımsızdır.
Tablo 6: Kronik Hepatit C'de Genotip ve Viral Yüke Göre PEGASYS ve Ribavirin Kombinasyon Tedavisi Sonucunda Kalıcı Viral Yanıt
|
|
Çalışma NV15942 |
Çalışma NV15801 | ||||
|
|
PEGASYS 180 mikrogram & Ribavirin 800 mg 24 hafta |
PEGASYS 180 mikrogram & Ribavirin 1000/1200 mg 24 hafta |
PEGASYS 180 mikrogram & Ribavirin 800 mg 48 hafta |
PEGASYS 180 mikrogram & Ribavirin 1000/1200 mg 48 hafta |
PEGASYS 180 mikrogram & Ribavirin 1000/1200 mg 48 hafta |
İnterferon alfa-2b 3 MIU & Ribavirin 1000/1200 mg 48 hafta |
|
Genotip 1 |
%29 (29/101) |
%42 (49/118)* |
%41 (102/250)* |
%52 (142/271)* |
%45 (134/298) |
%36 (103/285) |
|
Düşük viral yük |
%41 (21/51) |
%52 (37/71) |
%55 (33/60) |
%65 (55/85) |
%53 (61/115) |
%44 (41/94) |
|
Yüksek viral yük |
%16 (8/50) |
%26 (12/47) |
%36 (69/190) |
%47 (87/186) |
%40 (73/182) |
%33 (62/189) |
|
Genotip 2/3 |
%84 (81/96) |
%81 (117/144) |
%79 (78/99) |
%80 (123/153) |
%71 (100/140) |
%61 (88/145) |
|
Düşük viral yük |
%85 (29/34) |
%83 (39/47) |
%88 (29/33) |
%77 (37/48) |
%76 (28/37) |
%65 (34/52) |
|
Yüksek viral yük |
%84 (52/62) |
%80 (78/97) |
%74 (49/66) |
%82 (86/105) |
%70 (72/103) |
%58 (54/93) |
|
Genotip 4 |
(0/5) |
(8/12) |
(5/8) |
(9/11) |
(10/13) |
(5/11) |
ilekarşılaştırması:
Olasılık oranı (%95 GA) = 1.52 (1.07 ila 2.17) P-değeri (sınıflandırılmış Cochran-Mantel-Haenszel testi) = 0.020*PEGASYS 180 mikrogram & ribavirin 1000/1200 mg, 48 hafta
ilekarşılaştırması:
Olasılık oranı (%95 GA) = 2.12 (1.30 ila 3.46) P-değeri (sınıflandırılmış Cochran-Mantel-Haenszel testi) = 0.002PEGASYS'in interferon alfa-2a'ya kıyasla etki üstünlüğü, sirozlu hastalar ve HIV-HCV koenfeksiyonlu hastalar da dahil histolojik yanıt bakımından da gösterilmiştir. Genotip 1 ve 4 hastalarında tedavi süresininin 24 haftaya kısaltılmasının düşünülmesi ihtimali, NV15942 (bkz. Tablo 7) çalışmasında 4. haftada hızlı viral yanıt veren hastalarda gözlenen kalıcı hızlı viral yanıta dayanarak incelenmiştir.
Tablo 7 HCV Hastalarında PEGASYS'in Ribavirin İle Kombine Kullanımından Sonra
4. Haftada Genotip 1 ve 4 İçin Hızlı Viral Yanıta Bağlı Kalıcı Viral Yanıt
|
Çalışma NV15942 | ||
|
|
PEGASYS 180 mikrogram & Ribavirin 1000/1200 mg 24 hafta |
PEGASYS 180 mikrogram & Ribavirin 1000/1200 mg 48 hafta |
|
| ||
|
Genotip 1 HVY Düşük viral yük Yüksek viral yük |
%90 (28/31) %93 (25/27) %75 (3/4) |
%92 (47/51) %96 (26/27) %88 (21/24) |
|
Genotip 1 HVY olmayan Düşük viral yük Yüksek viral yük |
%24 (21/87) %27 (12/44) %21 (9/43) |
%43 (95/220) %50 (31/62) %41 (64/158) |
|
Genotip 4 HVY |
(5/6) |
(5/5) |
|
Genotip 4 HVY olmayan |
(3/6) |
(4/6) |
IU/mL: yüksek viral yük=>800,000 IU/mL
yanıt (HCV RNA saptanamaz) ve 24.haftada HCV RNA saptanamaz.
Genotip 2 veya 3 hastalarında tedavi süresinin 16 haftaya indirilmesi olasılığı, NV17317 çalışmasında, 4. haftada hızlı viral yanıtı olan hastalarda, kalıcı hızlı viral yanıta göre incelenmiştir (bkz. Tablo 8).
NV17317 çalışmasında, viral genotip 2 veya 3 ile enfekte olmuş hastalarda, tüm hastalara PEGASYS 180 mikrogram subkütan/haftada bir ve 800 mg dozda ribavirin verilmiş ve 16 ve 24 haftalık tedavilere randomize edilmişlerdir. 16 haftalık toplam tedavi 24 haftalık tedaviye denk değildir (bkz. Tablo 8). 16 haftalık tedavi (%65), 24 haftalık tedaviye (%76) göre daha düşük kalıcı viral yanıtla sonuçlanmıştır. Fakat 4 haftada HCV RNA negatif olan ve başlangıç noktasında DVY'si olan hastaların geriye dönük bir analizi 16 haftalık tedavide elde edilen kalıcı viral yanıtın 24 haftalık tedavide elde edilene yakın olduğunu göstermiştir (16 haftalık tedavide %89 ve 24 haftalık tedavide %94) (bkz. Tablo 8).
Tablo 8 HCV Hastalarında Ribavirin ile Yapılan PEGASYS Kombinasyon Tedavisi
|
Çalışma NV17317 | ||
|
|
PEGASYS 180 mikrogram ve Ribavirin 800 mg 16 hafta |
PEGASYS 180 mikrogram ve Ribavirin 800 mg 24 hafta |
|
Genotip 2 veya 3 |
%65 (443/679) |
%76 (478/630) |
|
Genotip 2 veya 3 HVY Düşük viral yük Yüksek viral yük |
%82 (378/461) %89 (147/166) %78 (231/295) |
%90 (370/410) %94 (141/150) %88 (229/260) |
|
Genotip 2 veya 3, HVY olmayan Düşük viral yük Yüksek viral yük |
%30 (65/218) %44 (22/50) %26 (43/168) |
%49 (108/220) %50 (25/50) %49 (83/170) |
Önceki Kronik Hepatit C tedavisine yanıtsız hastalar
MV17150 çalışmasında, pegile interferon alfa-2b ve ribavirin kombinasyon tedavisine daha önce yanıt vermemiş hastalar 4 farklı tedaviye randomize edildi:12 hafta PEGASYS 360 mikrogram/hafta bunu takip eden ilave 60 hafta 180 mikrogram/hafta; 12 hafta PEGASYS 360 mikrogram/hafta bunu takip eden ilave 36 hafta 180 mikrogram/hafta; 72 hafta PEGASYS 180 mikrogram/hafta veya 48 hafta 180 mikrogram/hafta. Bütün hastalar, PEGASYS ile kombinasyon halinde ribavirin (1000 veya 1200mg/gün) almıştır. Tüm tedavilerin 24 hafta tadavisiz takibi vardır. Tedavinin süresini karılaştıran, birleştirilmiş bir analizden kalıcı viral yanıtlar veya PEGASYS indüksyon dozları tablo 9'da özetlenmiştir.
Tablo 9 Daha önce Peginterferon alfa-2b ile tedaviye yanıtsızlarda kalıcı viral yanıt:
|
MV17150 | ||||
|
|
72 Hafta grubu N=473 |
48 Hafta grubu N=469 |
360 mikrogram grubu N=473 |
180 mikrogram grubu N=469 |
|
KVY |
%16* |
%8* |
%13 |
%10 |
Kalıcı viral yanıt oranı, 48 hafta tedaviden sonrakine göre 72 hafta tedaviden sonra daha yüksektir.
MV17150 çalışmasında bulunan tedavi süresi ve demografisine göre kalıcı viral yanıt farklılıklar Tablo 10'da gösterilmiştir.
Tablo 10 Peginterferon alfa-2b/ribavirin ile önceki tedaviye yanıtsızlarda PEGASYS ve
|
|
Peginterferon alfa-2b/ribavirine yanıtsızların 48 hafta yeniden tedavisi % (N) |
Peginterferon alfa-2b/ribavirine yanıtsızların 72 hafta yeniden tedavisi % (N) |
|
Tüm yanıtsız hastalar |
%8 (38/469) |
%16 (74/473) |
|
Genotip 1/4 |
%7 (33/450) |
%15 (68/457) |
|
Genotip 2/3 |
%25 (4/16) |
%33 (5/15) |
|
Genotip |
|
|
|
1 |
%7 (31/426) |
%14 (60/430) |
|
2 |
0 (0/4) |
%33 (1/3) |
|
3 |
%33 (4/12) |
%33 (4/12) |
|
4 |
%8 (2/24) |
%30 (8/27) |
|
Başlangıç viral yükü |
|
|
|
YVY (800,000 IU/mL'den yüksek) |
%7 (25/363) |
%12 (46/372) |
|
DVY (800,000 IU/mL'den düşük veya eşit) |
%13 (11/84) |
%31 (27/86) |
|
Tablo 11 |
Tedavi süresi ve yanıtsız hastal |
arda KVY oranı | |||
|
Tedavi süresi |
İnterferon |
Pegile İnterferon |
İnterferon ve Ribavirin |
Pegile İ Ri |
nterferon ve bavirin |
|
48 hafta |
%27(70/255)* |
%34(13/38)* |
%13(90/692)* |
%11(7/61) * |
%8(38/469)** |
|
72 hafta |
- |
- |
- |
- |
%16(74/473)* * |
Önceki Kronik Hepatit C tedavisinden sonra nüks görülmüş hastalar
48 haftalık pegile interferon alfa-2 ve ribavirin ile tedavisinden sonra nüks görülmüş ağırlıklı genotip 1 kronik hepatit C hastalarında yapılan bir çalışmada, hastalar ya PEGASYS 180 mikrogram/hafta ve günlük ağırlığa göre ayarlanmış ribavirin rejimi ile ya da konsensüs günlük interferon (9 mikrogram) ve günlük ağırlığa göre ayarlanmış ribavirin rejimi ile 72 hafta tedavi edilmiştir. 72 hafta PEGASYS ve ribavirin kombinasyon terapisi ile tedavi edilen hastalar için kalıcı viral yanıt %42'dir. 24 haftalık PEGASYS ve ribavirin ile tedavisinden sonra nüks görülmüş genotip 2 ve 3 kronik hepatit C hastalarında yapılan açık etiketli bir çalışmada, hastalar 48 hafta PEGASYS 180 mikrogram/hafta ve günlük ribavirin 1000 veya 1200 mg (ağırlığa göre) kombinasyon terapisi ile tedavi edilmiştir ve tedavisiz 24 hafta izlenmiştir. Kalıcı viral yanıt %64'dür.
HIV-HCV Ko-enfeksiyonu
Çalışma NR 15961'de, 860 HIV-HCV ko-enfeksiyonlu hasta randomize edilerek, 48 hafta süre ile PEGASYS 180 mikrogram/hafta ve plasebo, PEGASYS 180 mikrogram/hafta ve ribavirin 800 mg/gün veya interferon alfa-2a 3 MIU haftada üç kez ve ribavirin 800 mg/gün ile tedavi edilmiş ve ardından 24 hafta süre ile tedavisiz olarak izlenmiştir. Üç tedavi grubunda kalıcı viral yanıtlar, tablo 12'de tüm hastalar için genotiplere göre özetlenmiştir.
Tablo 12: HIV-HCV Koenfeksiyonlu Hastalarda Kalıcı Viral Yanıtlar
|
|
PEGASYS 180 mikrogram + Plasebo 48 hafta |
PEGASYS 180 mikrogram + RIBAVIRIN 800 mg 48 hafta |
İnterferon alfa-2a 3MIU + RIBAVIRIN 800 mg 48 hafta |
|
Tüm hastalar |
%20 (58/286)* |
%40 (116/289)* |
%12 (33/285)* |
|
Genotip 1 |
%14 (24/175) |
%29 (51/176) |
%7 (12/171) |
|
Genotip 2/3 |
%36 (32/90) |
%62 (59/95) |
%20 (18/89) |
ilekarşılaştırması:
%95 GA fark için: %22 ile %35 arası, p-değeri (sınıflandırılmış Cochran-Mantel-Haenszel testi) < 0.0001*PEGASYS 180 mikrogram & ribavirin 800 mg
ilekarşılaştırması:
%95 GA fark için: %13 ile %27 arası, p-değeri (sınıflandırılmış Cochran-Mantel-Haenszel testi) < 0.00015.2. Farmakokinetik özellikler Genel özellikler
PEGASYS'in farmakokinetiği, sağlıklı gönüllülerde ve hepatit C virüsü ile enfekte hastalarda çalışılmıştır (bkz. Tablo 13). Kronik hepatit B'li hastalar için sonuçlar, kronik hepatit C'li hastalar için olanlarla benzerdir.Emilim:
PEGASYS'in emilimi, dozlamadan sonraki 72 ila 96 saat sonrasında erişilen pik serum konsantrasyonları ile artar. Serum konsantrasyonları, tek bir PEGASYS 180 mikrogram subkütan enjeksiyonundan sonra 3 ila 6 saat içinde ölçülebilir. 24 saat içinde, pik serum konsantrasyonun yaklaşık %80'inine erişilir. PEGASYS'in mutlak biyoyararlanımı %84'tür ve interferon alfa-2a'nınki ile benzerdir.
Dağılım:
Peginterferon alfa-2a insanlarda intravenöz uygulamadan sonra kararlı durumdaki 6-14 litrelik dağılım hacmiyle (Vd) en fazla kan dolaşımında ve hücre dışı sıvılarda görülür. Sıçanlarda gerçekleştirilen çalışmalara göre, ilacın kanda yüksek oranda bulunmasına ek olarak karaciğer, böbrekler ve kemik iliğine de dağılmaktadır.
Metabolizma:
Metabolizma, PEGASYS için asıl klerens mekanizmasıdır. PEGASYS'in metabolik karakteri tamamen anlaşılmamıştır. İnsanlarda PEGASYS'in sistemik klerensi 100mL/saat'tir ve özgün interferon alfa-2a'dan 100 kez daha düşüktür. Sıçanlarda yapılan çalışmalar, PEGASYS'in metabolik ürünlerinin idrara ve az miktarda da safraya karıştığını göstermektedir. Tüm peginterferon alfa-2a dozunun % 10'dan daha azı böbrekler tarafından elimine edilmektedir. PEG kısmı interferon alfa-2a'ya bağlı kalırken, hem PEG hem de interferon alfa-2a metabolize olmaktadır.
Eliminasyon:
İntravenöz uygulamadan sonra, sağlıklı kişilerde PEGASYS'in terminal yarı ömrü yaklaşık 60 saat iken, standart interferon için bu süre 3-4 saattir. Hastalarda, terminal yarı ömür subkütan uygulamadan sonra, ortalama 160 saat ile (84-353 saat) daha da uzundur. Terminal yarı ömür yalnızca bileşiğin eliminasyon fazını değil, PEGASYS'in uzun süreli absorbsiyonunu da yansıtıyor olabilir.
Sağlıklı kişiler ve kronik hepatit C'li hastalarda, haftada bir PEGASYS doz uygulanmasının ardından, EAA ve Cmax'da dozla orantılı artışlar gözlenmiştir. PEGASYS'in farmakokinetik parametreleri, tek subkütan 180 mikrogram PEGASYS enjeksiyonu uygulanan sağlıklı kişiler için ve 48 hafta boyunca haftada bir 180 mikrogram PEGASYS alan kronik hepatit C'li hastalar için Tablo 13'de verilmektedir.
Tablo 13: Tek ve Çok Doz PEGASYS 180 mikrogramın Farmakokinetik Parametre'
|
|
Sağşiler 180 mikrogram (N=50) |
Çalışma NV15496'da KHC Hastaları 180 mikrogram Tedavi (N=16) | |
|
PEGASYS Farmakokinetik Özellikler |
Tek Doz Ortalama ± SD [Aralık] |
Tek Doz Ortalama ± SD [Aralık] |
48. Hafta Dozu Ortalama ± SD [Aralık] |
|
Cmax (ng/mL) |
14 ± 5 [6-26] |
15 ± 4 [7-23] |
26 ± 9 [10-40] |
|
Tmax (saat) |
92 ± 27 [48-168] |
80 ± 28 [23-119] |
45 ± 36 [0-97] |
|
EAA1-168 saat (ng*saat/mL) |
1725 ± 586 [524-3013] |
1820 ± 586 [846-2609] |
3334±994 [1265-4824] |
|
Klerens/F (mL/saat) |
94 ± 56 [34-337] |
83 ± 50 [33-186] |
60 ± 25 [37-142] |
48. Hafta Düşük Konsantrasyon (ng/mL) |
- |
- |
16 ± 6 [4-28] |
48. Haftaİçin Tepe Vadi Oranı |
- |
- |
1.7 ± 0.4 [1.1-2.5] |
|
Birikme (EAA48. Hafta /EAAxek Doz) |
- |
- |
2.3 ± 1.0 [1.1-4.0] |
eri
30 n
Ortalfiınii Kiirfiılı Hal Koııs. (ııy iııL)
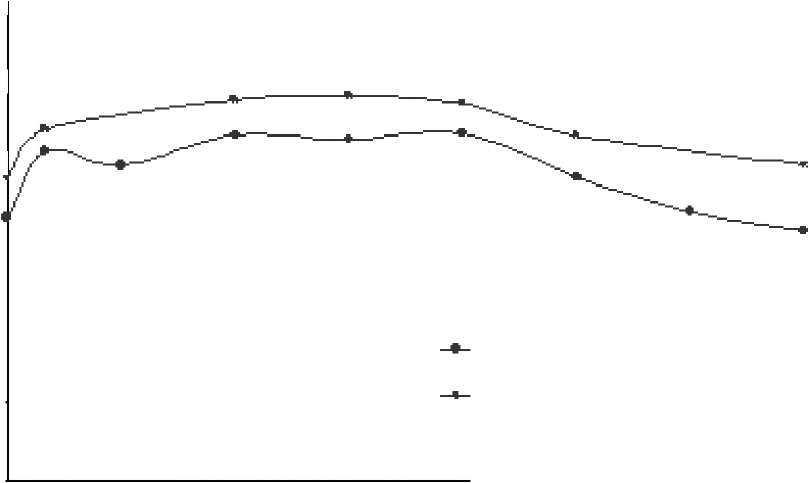
25 -
20 -15 -
10 -
Çalışma MV15496 (48. hafta)- Monoterapi
Çalışma NV15801 (48. hafta)- Ribavirin ile kombinasyon
Haftalık 1. Gün 2. Gün Verilen Doz
3. Gün 4. Gün
5. Gün 6. Gün haftalık Verilen
Haftiilık doz soııriisı yün olarnk znınnıı
Şekil 1: 180 mikrogram PEGASYS Monoterapisi (NV15496) ve Ribavirin ile Kombinasyon (NV15801) Tedavisini Takiben, KHC'li Hastalarda Ortalama Kararlı Hal Peginterferon alfa-2a KonsantrasyonlarıHastalardaki karakteristik özellikler
Böbrek yetmezliği olan hastalar:
Normal böbrek fonksiyonu ile önemli böbrek yetmezliği olan 23 hastada (Kreatin klerensi 20 ile <100mL/dk arası), PEGASYS farmakokinetikleri ve kreatin klerensi arasında kayda değer bir ilişki gözlenmemiştir. Hemodiyalize giren son safha böbrek hastalarında, klerenste %25 ile %45 arası azalma olur ve 135 mikrogram dozları normal böbrek fonksiyonu bulunan hastalardaki, 180 mikrogram dozları ile benzer maruziyet gösterir. Başlangıç dozundan veya böbrek yetmezliğinin seviyesinden bağımsız olarak, hastalar izlenmelidir ve advers etki oluşması durumunda tedavi süresince PEGASYS'te uygun doz azaltmaları yapılmalıdır (bkz. bölüm 4.2). Lütfen ribavirin ürün bilgilerine de bakınız.
Cinsiyet:
PEGASYS farmakokinetiği sağlıklı kadın ve erkek kişilerde karşılaştırılabilirdir.
Geriyatrik popülasyon:
62 yaşından daha yaşlı kişilerde, EAA hafif düzeyde artar, ancak pik konsantrasyonları 62 yaşından yaşlı ve genç olanlarda benzerdir. İlacın vücutta tutulması, farmakodinamik yanıt ve tolerabiliteye dayanarak, yaşlı hastalarda daha düşük bir PEGASYS başlangıç dozuna gerek yoktur (bkz. bölüm 4.2).
Sirozlu Olmayan ve Sirozlu Hastalar:
PEGASYS'in farmakokinetikleri sağlıklı kişilerde ve kronik hepatit B veya kronik hepatit C'li hastalar arasında benzerdir. Sirozlu kompanse karaciğer hastalığı olan ve sirozu olmayan hastaların maruz kalma ve farmakokinetik profilleri karşılaştırılabilir düzeydedir.
Uygulama bölgesi:
Subkütan PEGASYS uygulaması abdomen ve uyluk sınırları içine yapılmalıdır. Yapılan çalışmalar, kola yapılan uygulamalarda PEGASYS'in vücutta kalım süresinin abdomen ve uyluk uygulamalarına göre azaldığını göstermektedir.
5.3. Klinik öncesi güvenlilik verileri
PEGASYS ile yapılan preklinik toksisite çalışmaları, interferon türlerinin özelliklerinden dolayı sınırlıdır. Akut ve kronik toksisite çalışmaları maymunlarda yapılmıştır ve peginterferon alfa-2a verilen maymunlarda gözlenen bulgular interferon alfa-2a ile meydana gelen bulgulara benzer olmuştur.PEGASYS ile üreme toksisitesi çalışmaları yapılmamıştır. Diğer alfa interferonlarda olduğu gibi dişi maymunlara peginterferon alfa-2a uygulamasının ardından adet döneminin uzadığı gözlenmiştir. İnterferon alfa-2a ile tedavi rhesus maymunlarındaki düşük aktivitesinde anlamlı artışla sonuçlanmıştır. Zamanında doğan yavrularda teratojenik etki gözlenmemiş olmasına karşın insanlardaki advers etkiler göz ardı edilemez.
PEGASYS ve ribavirin
PEGASYS ribavirin ile kombine halde kullanıldığında, önceden maymunlarda iki etken madde ile de ayrı ayrı görülmeyen etkilerin hiçbiri görülmemiştir. En büyük tedavi kaynaklı değişiklik hafif - orta düzeyde geri dönüşlü anemidir ve şiddeti her iki aktif maddenin de ayrı ayrı uygulanması ile görülenden fazladır.
Karsinojenez
PEGASYS, karsinojenik potansiyeli için test edilmemiştir. Mutajenez
PEGASYS, metabolik aktivasyonun varlığında veya yokluğunda, Ames bakteriyel mutajenisite tayininde ve insan lenfositlerindeki in vitro kromozomal sapma tayininde test edildiğinde, mutajenik veya klastojenik olmadığı anlaşılmıştır. Lütfen ribavirin ürün bilgilerine de bakınız.
6. FARMASÖTİK ÖZELLİKLERİ
6.1.Yardımcı maddelerin listesi
Sodyum klorür, polisorbat 80, benzil alkol, sodyum asetat, asetik asit, enjeksiyonluk su.6.2.Geçimsizlikler
Geçimlilik araştırmaları bulunmadığından, bu tıbbi ürün diğer tıbbi ürünlerle karıştırılmamalıdır.6.3.Raf ömrü
36 ay6.4.Saklamaya yönelik özel tedbirler
2OC-8OC'de (buzdolabında) saklayınız. Dondurmayınız. Işıktan koruyunuz ve orijinal ambalaj ında saklayınız.6.5.Ambalajın niteliği ve içeriği
PEGASYS 180 mikrogram/0.5 mL enjeksiyon solüsyonu Tip I camdan yapılmış kullanıma hazır şırıngadadır. Cam Ph. Eur. gereklerine uygundur ve dimetikon emülsiyonu ile muamele edilmiştir. Uç kapağı ve piston tutucu bütil lastikten yapılmış ve kimyasal olarak inert fluroresin film ile ürünün ön yüzüne lamine edilmiştir.- 1 adet kullanıma hazır şırınga ve 1 enjeksiyon iğnesi
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Enjeksiyon solüsyonu tek kullanımlıktır. Uygulamadan önce partiküllü materyal ve renk değişikliği açısından gözle kontrol edilmelidir.Şırıngaların ve iğnelerin imhası
İğnelerin imhası ile ilgili aşağıdaki maddelere dikkatle uyulmalıdır;
Şırınga ve iğneler hiç bir zaman yeniden kullanılmamalıdır.
Tüm atıklar 'Tıbbi atıkların kontrolü yönetmeliği' ve 'Ambalaj ve Ambalaj Atıklarının Kontrolü yönetmelikleri'ne uygun olarak imha edilmelidir.
Kullanılmamış/Son kullanma tarihi geçmiş ürünlerin imhası
Tüm atıklar 'Tıbbi atıkların kontrolü yönetmeliği' ve 'Ambalaj ve Ambalaj Atıklarının Kontrolü yönetmelikleri'ne uygun olarak imha edilmelidir.
7.RUHSAT SAHİBİ
Roche Müstahzarları Sanayi Anonim Şirketi,Eski Büyükdere Asfaltı No:17/A 34398 Maslak/İstanbul
Tel: 0212 366 90 00Faks: 0212 285 22 00
8.RUHSAT NUMARASI(LARI)
114/329.İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ
İlk ruhsat tarihi: 18.07.2003 Ruhsat yenileme tarihi:10.KÜB'ÜN YENİLENME TARİHİ
İlaç Bilgileri
Pegasys 180 mikrogram/0.5 mL kullanıma hazır şırınga
Etken Maddesi: Peginterferon alfa-2a
Atc Kodu: L03AB11
Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.