Emend Kapsül Kısa Ürün BilgisiSindirim Sistemi ve Metabolizma » Bulantı ve Kusmada Kullanılan İlaçlar » Antiemetikler ve Bulantıyı Önleyici İlaçlar » Antiemetik İlaçlar » Aprepitant KISA URUN bilgisi 1. BEŞERİ TIBBİ ÜRÜNÜN ADI EMEND® Kapsül2. KALİTATIF ve KANTtTATİF BİLEŞİM Etkin madde:1 kapsülde................................125 mg aprepitant2 kapsülde................................80 mg aprepitant Yardımcı maddeler:125 mg kapsülde:Sükroz..........................................................125 mg 80mg kapsülde: Sükroz..........................................................80 mg Yardımcı maddeler için 6. Te bakınız. 3. FARMASÖTİK FORMUKapsül125 mg kapsül opak, pembe/beyaz renkli, üzerinde siyah renkle "462" ve "125 mg" yazılı. 80 mg kapsül opak, beyaz renkli, üzerinde siyah renkle "461" ve "80 mg" yazılı, 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarEMEND erişkinlerde; diğer antiemetik ajanlarla birlikte, yüksek doz sisplatin dahil olmak üzere yüksek derecede emetojenik kanser kemo terapi sinin başlangıç ve tekrar kürleri ile oluşan akut ve gecikmiş bulantı ve kusmanın Önlenmesinde antrasiklin (doksorubisin veya epirubisin) ve siklofosfamid kombinasyon kemoterapisinin başlangıç ve tekrar kürleri ile ilişkili bulantı veya kusmanın önlenmesinde endikedir. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Kemoterapive bağlı bulantı ve kusmadan korunmaEMEND, bir kortikosteroid ve bir 5-HT3 antagonısti içeren rejimin bir bölümü olarak 3 gün süreyle verilir. EMEND'in önerilen dozu kemoterapinin 1. gününde tedaviden 1 saat önce oral yoldan alınan 125 mg (1. gün) ve 2. ve 3. günün sabahlan günde bir kez alınan 80 mg'dır. Klinik çalışmalarda aşağıdaki rejim emetojenik kanser kemoterapisiyle ilişkili bulantı ve kusmanın önlenmesinde kullanılmıştır:
3. Gün
2. Gün
1. Gün
4. Gün 125 mg oral80 mg oral
Alınmıyor 80 mg oral
EMEND 12 mg oral8 mg oral8 mg oral8 mg oral
Deksametazon
Alınmıyor
Alınmıyor
Alınmıyor
Ondansetron
32 mg intravenöz
EMEND 1. gün kemoterapi tedavisinden 1 saat önce ve 2. ve 3. günde sabahlan oral olarak alınmıştır. Deksametazon 1. gün kemoterapi tedavisinden 30 dakika önce ve 2-4. günlerin sabahında uygulanmıştır. Deksametazon dozu ilaç etkileşimleri dikkate alınarak seçilmiştir. Ondansetron 1. günde kemoterapi tedavisinden 30 dakika önce intravenöz olarak uygulanır. Orta Derece Emetojenik Kemoterapi Rejimi
1. Gün
3. Gün
2. Gün 80 mg oral
125 mg oral EMEND80 mg oral
Deksametazon
12 mg oral AlınmıyorAlınmıyor
Ondansetron
2 X 8 mg oral
Alınmıyor Alınmıyor
EMEND 1. gün kemoterapi tedavisinden 1 saat önce ve 2. ve 3. günde sabahlan oral olarak alınmıştır. Deksametazon 1. gün kemoterapi tedavisinden 30 dakika önce uygulanmıştır. Deksametazon dozu ilaç etkileşimlerini anlatmak için seçilmiştir. Bir tane 8 mg ondansetron kapsül 1. gün ilk doz kemoterapi tedavisinden 30-60 dakika önce uygulanmıştır ve bir tane 8 mg kapsül kemoterapi tedavisinden 8 saat sonra uygulanmıştır. Diğer kortikosteroidler ve S-HT? antagonistleriyle kombinasyona ilişkin etkinlik verileri sınırlıdır. Kortikosteroidlerle birlikte uygulama hakkında ilave bilgi için Bkz. Bölüm 4.5. Lütfen, birlikte uygulanan antiemetik tıbbi ürünlerin Kısa Ürün Bilgisine başvurunuz. Uygulama şekli:EMEND bütün halinde yutulmalıdır. EMEND aç kamına veya yiyeceklerle birlikte alınabilir.Özel popülasyoniara ilişkin ek bilgiler Böbrek yetmezliği:Böbrek yetmezliği olan hastalarda veya hemodiyalize giren son evre böbrek hastalığı olan hastalarda doz ayarlamasına gerek yoktur (Bkz. Bölüm 5.2).Karaciğer yetmezliği:Hafif derecede karaciğer yetmezliği olan hastalara doz ayarlaması yapılması gerekmez. Orta düzeyde karaciğer yetmezliği olan hastalara ilişkin veriler sınırlıdır ve şiddetli karaciğer yetmezliği olan hastalara dair hiçbir veri yoktur. Aprepitant bu hastalarda dikkatli kullanılmalıdır (Bkz. Bölüm 4.4 ve 5.2).Pediyatrik popülasyon:EMEND'in 18 yaşın altındaki çocuklarda yeterli etkinlik ve güvenlik verisi bulunmamaktadır. Bu nedenle bu yaş grubunda kullanılması önerilmemektedir.Geriyatrik popülasyon(> 65 yaş):Yaşlılarda doz ayarlamasına gerek yoktur (Bkz. Bölüm 5.2).iCinsiyetCinsiyete göre doz ayarlamasına gerek yoktur (Bkz. Bölüm 5.2).IrkEMEND'in tekli 125 mg dozunun oral yolla uygulanmasmdan sonra, EAAo-24saat değerleri beyazlara ve siyahlara göre İspanyol kökenli kişilerde sırasıyla yaklaşık %25 ve %29 daha yüksektir. Aprepitant'ın Cmaks'ı beyazlara ve siyahlara göre İspanyol kökenli kişilerde sırasıyla %22 ve %31 daha yüksektir. Bu farklann klinik yönden anlamlı olmadığı kabul edilir. EAAo-24saat vcya Cmaks bakımmdan beyazlar ve siyahlar arasında herhangi bir fark yoktur. Irka göre göre doz ayarlamasına gerek yoktur.Vücut Kütle İndeksi (BMI)Vücut Kütle İndeksine (BMI) göre doz ayarlamasına gerek yoktur (Bkz. Bölüm 5,2).4.3. KontrendikasyonlarEtkin maddeye veya bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine aşın duyarlılık.EMEND pimozid, terfenadin, astemizol veya sisaprid ile birlikte kullanılmamalıdır (Bkz. Bölüm 4.5). 4.4. Özel kullanım uyarıları ve önlemleriOrta derecede ve şiddetli karaciğer vetmezliği olan hastalarOrta düzeyde karaciğer yetmezliği olan hastalardaki veriler kısıtlıdır, şiddetli düzeyde karaciğer yetmezliği olan hastalarda veri yoktur. EMEND bu hastalarda dikkatle kullanılmalıdır (Bkz. Bölüm 4,2). CYP3A4 etkileşimleriEMEND, siklosporin, takrolimus, sirolimus, everolimus, alfentanil, diergotamin, ergotamin, fentanil ve kinidin gibi, ağırlıklı olarak CYP3A4 yoluyla metabolize olan ve dar bir terapötik aralığa sahip oral yoldan uygulanan eşzamanlı etkin maddeler alan hastalarda dikkatli kullanılmalıdır (Bkz. Bölüm 4.5). Aynca, irinotekan ile eşzamanlı uygulamada özellikle dikkatli olunmalıdır; çünkü bu kombinasyon toksisitede artışa yol açabilir. mEMEND'in CYP3A4 substratlan olan ergot alkoloid türevleri ile eşzamanlı uygulanması bu etkin maddelerin plazmada konsantrasyonlarının yükselmesine neden olabilir. Bu nedenle ergot ile bağlantılı potansiyel toksisite riski nedeniyle dikkatli olunması önerilmektedir. EMEND'in CYP3A4 aktivitesini güçlü bir şekilde indükleyen etkin maddelerle (örn., rifampisin, fenitoin, karbamazepin, fenobarbital) eşzamanlı olarak uygulanmasından kaçınılmalıdır; çünkü bu kombinasyonun aprepitant'ın plazmadaki konsantrasyonunu düşürmesi beklenmektedir (Bkz. Bölüm 4.5). EMEND'in St. John's Wort {Hypericum perforatum)içeren bitkisel preparatlarla birlikte uygulanması önerilmemektedir.EMEND'in CYP3A4 aktivitesini güçlü bir şekilde inhibe eden etkin maddelerle (örn., ketokonazol, itrakonazol, vorikanozol, posakonazol, klaritromisin, telitromisin, nefazodon ve preteaz inhibitörleri) eşzamanlı olarak uygulanması, aprepitant'ın plazma konsantrasyonlannda artışa sebep olabileceğinden bu kombinasyonlarla dikkatle kullanılmalıdır (Bkz. Bölüm 4.5). Varfarin (bir CYP2C9 substratı) ile birlikte uveulamaEMEND'in varfarin ile birlikte uygulanması, protrombin zamanının Uluslararası Normalleştirilmiş Oranında (INR) bildirilen azalmayla sonuçlanır. Kronik varfarin tedavisi alan hastalarda, EMEND tedavisi süresince ve EMEND'in 3 günlük her bir küründen sonra 14 gün süreyle INR takip edilmelidir (Bkz. Bölüm 4.5). Hormonal kontraseptifler ile birlikte uygulamaEMEND'in uygulanması sırasında ve uygulanmasından sonraki 28 günde hormonal kontraseptiflerin etkinliği azalabilir. EMEND tedavisi sırasında ve EMEND'in son dozundan sonraki 2 ay boyunca alternatif veya destekleyici kontrasepsiyon yöntemleri kullanılmalıdır (Bkz. Bölüm 4.5). Yardımcı madde uvansı:Emend sükroz içermektedir. Nadir kalıtımsal früktoz intoleransı, glukoz-galaktoz malabsorpsiyonu veya sükraz-izomaltaz yetmezliği problemi olan hastalann bu ilacı kullanmamalan gerekir. 4.5. Diğer tıbbi ürünler ile etkileşim ve diğer etkileşim şekilleriAprepitant (125 mg/80 mg) CYP3A4'ün bir substratı, orta düzeyde inhibitörü ve indükleyiçişidir. Aprepitant CYP2C9'un da bir indükleyiçişidir. EMEND tedavisi sırasında CYP3A4 inhibe edilir. Tedaviden sonra EMEND CYP2C9, CYP3A4 ve glukuronidasyonda geçici, hafif düzeyde bir indüksiyona neden olmaktadır. Aprepitantın, digoksin ile etkileşiminin olmadığının gösterildiği gibi, P-glikoprotein taşıyıcısının substratı olan ilaçlarla aprepitantın etkileşimi yoktur.Aprepitant'ın diğer ajanların farmakokinetiği üzerine etkisi CYP3A4 inhibisyonuCYP3A4'ün orta düzeyde bir inhibitörü (125 mg/80 mg) olarak aprepitant, CYP3A4 yoluyla metabolize olan ilaçlarla birlikte uygulandığında onların plazma konsantrasyonlannı yükseltebilir. EMEND ile yapılan 3 günlük tedavi sırasında, oral yoldan uygulanan CYP3A4 substratlannın toplam maruziyeti, yaklaşık 3 kata kadar artış gösterebilir. Aprepitant'ın, intravenöz yoldan uygulanan CYP3A4 substratlannın plazma konsantrasyonları üzerindeki etkisinin daha düşük olması beklenmektedir. EMEND pimozid, terfenadin, astemizol ya da sisapridle birlikte kullanılmamalıdır (Bkz. Bölüm 4.3). Aprepitant'la CYP3A4 inhibisyonu bu etkin maddelerin plazma konsantrasyonlannı yükseltebilir ve potansiyel olarak ciddi ya da hayatı tehdit eden reaksiyonlara yol açabilir. EMEND siklosporin, takrolimus, sirolimus, everolimus, alfentanil, diergotamin, ergotamin, fentanil ve kinidin gibi, ağırlıklı olarak CYP3A4 yoluyla metabolize olan ve dar bir terapötik aralığa sahip oral yoldan uygulanan eşzamanlı etkin maddeler alan hastalarda dikkatli kullanılmalıdır (Bkz. Bölüm 4.4). Kortikosteroidler: Deksametazon:EMEND 125 mg/80 mg rejimi ile birlikte uygulandığında, olağan oral deksametazon dozu yaklaşık %50 azaltılmalıdır. Kemoterapi ile indüklenen mide bulantısı ve kusma ile ilgili çalışmalarda, etkin madde etkileşimleri göz önüne alınarak bir deksametazon dozu seçilmiştir (Bkz. Bölüm 4.2). EMEND'in 1. günde 20 mg olarak oral yoldan eşzamanlı uygulanan deksametazon ile birlikte 125 mg'lık bir rejim içinde uygulandığında ve 2.gün ile 5.gün arasında 8 mg olarak oral yoldan eşzamanlı uygulanan deksametazon ile birlikte 80 mg/gün olarak uygulandığında, bir CYP3A4 substratı olan deksametazon EAA değerini 1. ve5. günde 2.2 kat artırmıştır. Metilprednizolon:EMEND 125 mg/80 mg rejimle eşzamanlı uygulandığında, intravenöz yoldan uygulanan olağan metilprednizolon dozu yaklaşık %25 azaltılmalı ve olağan oral metilprednizolon dozu yaklaşık %50 azaltılmalıdır. Metilprednizolon 1. günde 125 mg olarak intravenöz yoldan ve 2. ve 3 günde 40 mg olarak oral yoldan eşzamanlı olarak uygulandığında, 1. günde 125 mg ve 2. ve 3. günde 80 mg/gün'lük bir rejim olarak uygulanan EMEND, bir CYP3A4 substratı olan metilprednizolonun EAA değerini 1,günde 1.3 kat ve3.günde 2.5 kat arttırmıştır. Metilprednizolonla sürekli tedavi sırasında, aprepitant'm CYP3A4 üzerindeki indükleme etkisi nedeniyle EMEND ile doz uygulamasmın başlatılmasını takiben 2 hafta içinde daha geç zaman noktalannda metilprednizolonun EAA değeri azalabilir. Bu etkinin oral yoldan uygulanan metilprednizolon için daha belirgin olması beklenebilir. Kemoterapötik tıbbi ürünlerFarmakokinetik çalışmalarda, 1.günde 125 mg ve 2. ve 3. günde 80 mg/gün'lük bir rejim olarak verilen EMEND, 1.günde intravenöz yoldan uygulanan dosetakselin ya da 1. ve 8. günlerde intravenöz yoldan uygulanan vinorelbinin farmakokinetiğini etkilememiştir. EMEND'in oral yoldan uygulanan CYP3A4 substratlannın farmakokinetiği üzerindeki etkisinin, intravenöz yoldan uygulanan CYP3A4 substratlannın farmakokinetiği üzerindeki etkisinden daha yüksek olması nedeniyle, ağırlıklı olarak ya da kısmen CYP3A4 yoluyla metabolize edilen, oral yoldan uygulanan kemoterapötik ajanlarla (örn., etoposid, vinorelbin) bir etkileşim olasılık dışı bırakılamaz. Bu tip ajanlan oral yoldan alan hastalarda dikkatli olunması önerilmektedir ve ilave takip uygun olabilir (Bkz. Bölüm 4.4). immünosüpresanlar3 günlük CINV rejimi sırasında, CYP3A4 ile metabolize edilen immünosüpresanlann maruziyetinde (örn., siklosporin, takrolimus, everolimus ve sirolimus) orta düzeyde geçici bir artış ve bunu takiben hafif bir düşme beklenmektedir, 3 günlük rejimin kısa süresi ve maruziyetteki zamana bağlı sınırlı değişiklikler göz Önüne alındığında, EMEND ile 3 günlük eşzamanlı uygulama sırasında immünosüpresanlann dozunda bir azaltma önerilmemektedir. MidazolamCYP3A4 ile metabolize edilen midazolam ve diğer benzodiazepinlerin (aiprazolam, triazolam) plazma konsantrasyonlanndaki artışın potansiyel etkileri, EMEND'in (125 mg/80 mg) bu tıbbi ürünlerle eşzamanlı uygulanması sırasında göz önüne alınmalıdır. EMEND, 1.günde 125 mg ve 2. gün ile 5.gün arasında 80 mg/gün EMEND rejiminin 1. ve 5. gününde tekli oral doz 2 mg midazolam ile eşzamanlı uygulandığında, duyarlı bir CYP3A4 substratı olan midazolamın EAA'smı l. günde 2.3 kat ve 5. günde 3.3 kat arttırmıştır. Midazolamm intravenöz yoldan uygulandığı bir başka çalışmada, EMEND 1.günde 125 mg ve 2.ve 3. günde 80 mg/gün olarak verilmiştir; aynca 3 günlük EMEND rejimi uygulanmadan önce ve 4., 8. ve 15. günlerde 2 mg midazolam intravenöz yoldan uygulanmıştır. EMEND midazolam EAA değerini 4. günde %25 arttırmış ve 8. günde %19 ve 15. günde %4 azaltmıştır. Bu etkilerin klinik açıdan önemli olmadığı düşünülmüştür. İntravenöz ve oral midazolam uygulamasının yapıldığı üçüncü bir çalışmada, 1. günde 32 mg ondansetron ve 1. günde 12 mg deksametazon ve 2.-4. günlerde 8 mg deksametazon ile birlikte 1. günde 125 mg ve 2. ve 3. günlerde 80 mg/gün EMEND verilmiştir. Bu kombinasyon (yani, EMEND, ondansetron ve deksametazon) oral midazolamın EAA değerini 6. günde %16, 8. günde %9, 15. günde %7 ve 22. günde %17 düşürmüştür. Bu etkilerin klinik açıdan önemli olmadığı düşünülmüştür. intravenöz midazolam ve EMEND uygulamasının yapıldığı başka bir çalışma daha tamamlanmıştır. 125 mg tekli doz oral EMEND uygulamasından l saat sonra 2 mg intravenöz midazolam verilmiştir. Midazolamm plazma EAA değeri 1.5 kat artmıştır. Bu etkinin klinik açıdan önemli olmadığı düşünülmüştür. İndüksiyonCYP2C9, CYP3A4 ve glukuronidasyonun zayıf bir indükleyicisi olarak aprepitant, tedaviye başlandıktan sonraki iki hafta içerisinde bu yollarla elimine edilen substratlann plazma konsantrasyonlannı düşürebilir. Bu etki, yalnızca EMEND ile yapılan 3 günlük tedavi sonlandıktan sonra görünür hale gelebilir. CYP2C9 ve CYP3A4 substratlan için indüksiyon geçicidir ve maksimum etkiye 3 günlük EMEND tedavisi sonlandıktan 3-5 gün sonra ulaşılır. Etki birkaç gün boyunca sürdürülür ve bundan sonra yavaşça azalır; EMEND tedavisi bittikten iki hafta sonra klinik açıdan önemsiz hale gelir. 7 gün boyunca verilen 80 mg oral aprepitant ile glukuronidasyonda da hafif bir indüksiyon görülmüştür. CYP2C8 ve CYP2C19 üzerindeki etkilerle ilgili veri bulunmamaktadır. Bu dönem sırasında varfarin, asenokumarol, tolbutamid, fenitoin ya da CYP2C9 yoluyla metabolize olduğu bilinen diğer etkin maddeler uygulanırken dikkatli olunmalıdır. tVarfarin:Kronik varfarin tedavisi gören hastalarda EMEND tedavisi sırasında ve kemoterapi ile indüklenen mide bulantısı ve kusma için uygulanan her 3 günlük EMEND kürünü takiben 2 hafta boyunca protrombin zamanı (INR) yakından takip edilmelidir (Bkz. Bölüm 4.4). Kronik varfarin tedavisiyle stabilize olan sağlıklı kişilere, 1. günde tek doz 125 mg ve 2. ve 3. günde 80 mg/gün EMEND uygulandığında EMEND, R(+) veya S(-) varfarinin 3. günde belirlenen plazma EAA değeri üzerinde bir etki yapmamıştır; bununla birlikte, EMEND ile tedavi uygulamasından 5 gün sonra S(-) varfarin (bir CYP2C9 substratı) çukur konsantrasyonunda %34'lük azalmayla birlikte INR'de %14'lük azalma meydana gelmiştir,Tolbutamid:EMEND, 1. günde 125 mg ve 2. ve 3. günde 80 mg verildiğinde, 3 günlük EMEND rejiminden önce ve 4., 8. ve 15. günlerde tek doz 500 mg tolbutamid (bir CYP2C9 substratı) oral olarak uygulandığında, tolbutamidin EAA değeri 4. günde %23, 8. günde %28 ve 15. günde %15 azalmıştır.tHormonal Kontraseptijler:EMEND uygulaması sırasında ve uygulamadan sonra 28 gün boyunca hormonal kontraseptiflerin etkililiği azalabilir. EMEND tedavisi sırasında ve EMEND'in son dozunu takiben 2 ay boyunca alternatif ya da yardımcı doğum kontrol yöntemleri kullanmalıdır.Yapılan klinik bir çalışmada etinil östradiol ve noretindron içeren bir oral kontraseptifin tekli dozlan 1-21. günler arasında EMEND'in aşağıdaki tedavi rejimleri ile birlikte verilmiştir: 8. günde 125 mg ve 9. ve 10. günlerde 80 mg/gün ile birlikte 8. günde 32 mg intravenöz yoldan ondansetron ve 8. günde 12 mg ve 9, 10 ve 11. günlerde 8 mg/gün olarak verilen oral deksametazon. Bu çalışmadaki 9-21.günler arasında etinil östradiol çukur konsantrasyonlannda %64'e kadar azalma ve noretindron çukur konsantrasyonlarında %60 kadar azalma olmuştur. 5~HTi antagonistleri:Klinik etkileşim çalışmalannda, aprepitant'm ondansetron, granisetron ya da hidrodolasetron (dolasetronun aktif metaboliti) farmakokinetiği üzerinde klinik olarak önemli etkileri olmamıştır.Diğer tıbbi ürünlerin aprepitant'm farmakokinetiği üzerine etkileriEMEND'in CYP3A4 aktivitesini inhibe eden tıbbi ürünlerle (örn. ketokonazol, itrakonazol, vorikonazol, posakonazol, klaritromisin, telitromisin, nefazodon ve proteaz inhibitörleri) birlikte uygulanması konusunda dikkatli olunmalıdır çünkü bu kombinasyon aprepitantın plazma konsantrasyonlarında birkaç kat artışa yol açabilir (Bkz. Bölüm 4.4). EMEND'in CYP3A4 aktivitesini güçlü biçimde indükleyen tıbbi ürünlerle (örn. rifampisin, fenitoin, karbamazepin, fenobarbital) birlikte uygulanmasından kaçınılmalıdır, çünkü bu kombinasyonlar aprepitantın plazma konsantrasyonlannda azalmaya yol açar ve EMEND'in etkinliğinde azalmaya neden olabilir. EMEND'in St. John's Wort {Hypericum perforatum)içeren bitkisel preparatlarla birlikte uygulanması önerilmemektedir.Ketokonazol:Güçlü bir CYP3A4 inhibitörü olan ketokonazol 400 mg/gün dozunda 10 günlük tedavi rejiminin 5. gününde bir kez 125 mg'lık aprepitant dozu uygulandığında, aprepitant'ın EAA değeri yaklaşık 5 kat artmıştır ve aprepitant'ın ortalama terminal yan-ömrü yaklaşık 3 kat yükselmiştir.Rifampisin:Güçlü bir CYP3A4 indükleyici olan 600 mg/gün rifampisinle yapılan 14 günlük rejimin 9. gününde tekli 375 mg aprepitant dozu uygulandığında, aprepitant'ın EAA'sı %91 azalmış ve ortalama terminal yanlanma ömrü %68 düşmüştür.t4.6. Gebelik ve laktasyon Gebelik Kategorisi: BÇocuk doğurma potansiyeli bulunan kadmlar / Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. EMEND'in uygulanması sırasında ve uygulanmasından sonraki 28 günde hormonal kontraseptiflerin etkinliği azalabilir. EMEND tedavisi sırasında ve EMEND'in son dozundan sonraki 2 ay boyunca alternatif veya destekleyici kontrasepsiyon yöntemleri kullanılmalıdır (Bkz. Bölüm 4.4 ve 4.5).Gebelik dönemiAprepitanta maruz kalmış gebelere ilişkin hiçbir veri mevcut değildir, Aprepitantın üreme toksisitesi potansiyeli tam olarak tanımlanmamıştır çünkü 125 mg/80 mg dozunda insanlarda gözlenen terapötik maruz kalımın üzerindeki maruz kalım düzeylerine hayvan çalışmalannda ulaşılamamıştır.Bu çalışmalar, gebelik, embriyonal / fetal gelişim, doğum ya da doğum sonrası gelişim ile ilgili olarak doğrudan ya da dolaylı zararlı etkiler olduğunu göstermemektedir (Bkz. Bölüm 5.3). Nörokinin regülasyonunda değişikliklerin üreme üzerindeki potansiyel etkileri bilinmemektedir. EMEND çok gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Laktasyon dönemiAprepitant emziren sıçanlann sütüne geçmiştir. Aprepitant'ın insanda anne sütüne geçip geçmediği bilinmemektedir.Emzirme sırasında ilaç kullanımı önerilmemektedir. üreme yeteneği (fertilite)Aprepitant'ın fertilite üzerinde etkiler oluşturma potansiyeli tam olarak karakterize edilmemiştir; çünkü hayvan çalışmalannda insanlardaki terapötik maruziyetin üzerindeki maruziyet düzeylerine ul aşı İmamı ştır. Bu fertilite çalışmalan, gebelik, embriyonal/föta! gelişim veya sperm sayısı ve hareketliliği açısından doğrudan ya da dolaylı zararlı etkilere işaret etmemektedir (Bkz. Bölüm 5.3).4.7. Araç ve makine kullanımı üzerindeki etkilerEMEND araç ve makine kullanma yeteneğini üzerinde hafif bir etki oluşturabilir. EMEND almdıktan sonra baş dönmesi ve yorgunluk görülebilir(Bkz. Bölüm 4.8).4.8. İstenmeyen etkilerGüvenlilik profilinin ÖzetiAprepitant'm güvenlilik profili yaklaşık 6500 kişide değerlendirilmiştir. Yüksek dereceli emetojenik tedavi (HEC) gören hastalarda standart tedavi rejimine göre aprepitant ile tedavi edilen hastalarda daha yüksek insidansta rapor edilen en yaygın advers reaksiyonlar şunlardır: hıçkınk (%4.6'e karşılık %2.9), al anin aminotransferaz (ALT) artışı (%2.8'e karşılık %1.1), dispepsi (%2.6'a karşılık %2.0), kabızlık (%2.4'e karşılık %2,0), baş ağnsı (%2.0'e karşılık %1.8) ve iştah azalması (%2.0'a karşılık %0.5). Orta düzeyde emetojenik kemoterapi (MEC) alan hastalarda, standart tedaviyle karşılaştınidığında aprepitant tedavisi rejimi ile tedavi edilmiş hastalarda daha yüksek bir insidansla bildirilen en yaygın advers reaksiyon yorgunluk olmuştur (%I.4'e karşılık %0.9). Advers reaksivonlarm listesiAşağıdaki advers reaksiyonlar pazarlama sonrası kullanımda veya HEC ve MEC çalışmalarının birleştirilmiş analizinde standart tedaviye kıyasla aprepitant ile daha yüksek insidansla gözlenmiştir. Sıklıklar aşağıdaki şekilde sıralanmıştır: Çok yaygın (>1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (> 1/1,000 ila <1/100), seyrek (> 1/10,000 ila <1/1,000), çok sejrek (< 1/10,000) bilinmiyor (eldeki verilerden harekede tahmin edilemiyor). Enfeksiyonlar ve enfestasyonlar;Seyrek: Kandidiyazis, stafilokok enfeksiyonuKan ve lenf sistemi hastalıkları:Yaygın olmayan: Anemi, febril nötropeniBağışıklık sistemi bozukluklarıBilinmiyor: Anaflaktik reaksiyonlan içeren aşın duyarlılık reaksiyonlarıMetabolizma ve beslenme bozuklukları:Yaygın: Anoreksi Seyrek: PolidipsiPsikiyatrik hastalıklar:Yaygın olmayan: Anksiyete Seyrek: Dezoryantasyon, öforiSinir sistemi bozuklukları:Yaygın: Baş ağnsıYaygın olmayan: Baş dönmesi, uyku basması Seyrek: Zihinsel bozukluklar, letarji, tat duyumunda bozukluk Göz hastalıkları:Seyrek: KonjunktivitKulak ve iç kulak hastalıkları:Seyrek; Tinnitus (Kulak çınlaması)Kardiyak hastalıklar:Yaygın olmayan: PalpitasyonlarSeyrek: Bradikardi, kardiyovasküler bozukluk Vasküler hastalıklar:Yaygın olmayan: Sıcak basmasıSolunum sistemi, göğüs hastalıkları ve mediastinal hastalıklar:Yaygın: HıçkınkSeyrek: Orofaringeal ağrı, hapşınk, öksürük, post nazal akıntı, boğaz iritasyonu ^ Gastrointestinal bozukluklar:9 Yaygın: Kabızlık, dispepsiYaygın olmayan: Geğirme, bulantı1, kusma*, gastroözofageal reflü hastalığı, kann ağnsı, ağız kuruluğu, şişkinlik, Seyrek; Perfore duodenal ülser, stomatit, abdominal distansiyon, sert dışkı, nötropenik kolit Deri ve deri altı dokusu hastalıkları:Yaygın olmayan: Döküntü, akne.Seyrek: Fotosensitivite, hiperhidroz, yağlı cilt, kaşıntılı deri döküntüsü, Stevens-Johnson sendromu/toksik epidermal nekroliz Bilinmiyor: Prurit, ürtiker Kas-iskelet sistemi bozuklukları, bağ dokusu ve kemik hastalıkları:Seyrek: Kas kramplan, kaslarda güçsüzlükBöbrek ve üriner sistem hastalıkları:Yaygın olmayan: Dizüri ^ Seyrek: Polaküri.Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar:Yaygın: YorgunlukYaygın olmayan: Asteni/bitkinlik Seyrek: Ödem, göğüste huzursuzluk, yürüme bozukluğu Laboratuvar bulguları:Yaygın: ALT artışı,Yaygın olmayan: AST artışı, kanda alkalin fosfataz artışı, hiperglisemi, mikroskobik hematüri, hiponatremi, Seyrek: İdrarda kırmızı kan hücreleri pozitif, kan sodyum seviyesinde azalma, kilo kaybı, nötrofil sayısında azalma, idrar glikoz bulunması, idrar çıkışında artış Seçilmiş advers reaksivonlann tarifiKemoterapiye ek olarak 6 siklusa kadar HEC ve MEC çahşmalannın çok sikluslu uzatmada istenmeyen etki profilleri genellikle 1. siklusta görülenlerle aynıdır. Aprepitant ve HEC (yüksek derecede emetojenik kemoterapi) alan 1,169 hastada yürütülen başka bir aktif-kontrollü klinik çalışmada advers reaksiyonlann profili, aprepitant ile yürütülen diğer HEC çalışmalarında gözlenenlerle genel olarak benzerdi. Postoperatif bulantı ve kusma (PONV) için aprepitant ile tedavi edilen hastalarda ondansetrondan daha büyük insidansta rapor edilen diğer yan etkiler şunlardır: üst abdominal ağn, anormal barsak sesleri, kabızlık*, dizartri, dispne, hipoestezi, uykusuzluk, miyozis, bulantı, duyusal bozukluk, mide rahatsızlığı, sub-ileus*, görsel keskinlikte azalma, hınitı. * Aprepitantm daha yüksek bir dozunu alan hastalarda bildirilmiştir. 4.9. Doz aşımı ve tedavisiDoz aşımı durumunda, EMEND kesilmelidir ve genel destekleyici tedavi ve gözlem sağlanmalıdır. Aprepitant'm antiemetik etkinliğinden dolayı, ilaç yoluyla kusturma etkili olmayabilir.Aprepitant hemodiyaliz ile uzaklaştınlamaz. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grubu: Antiemetikler ve bulantıya karşı kullanılan ilaçlar ATC kodu: A04AD12EMEND (aprepitant), insanda P maddesi nörokinin 1 (NK|) reseptörlerinin seçici, yüksek afiniteli antagonistidir, Aprepitantm 3 günlük rejimi>70 mg/m^ sisplatin içeren kemoterapi alan toplam 1,094 hastada yürütülen 2 randomize, çift-kör çalışmada, aprepitant ile birlikte ondansetron/deksametazon rejimi (Bkz. bölüm 4.2) standart rejimle karşılaştın İm ıştır (plasebo + 1. gün intravenöz yolla ondansetron 32 mg + 1. günde oral 20 mg deksametazon ve 2-4. günlerde günde iki kez 8 mg deksametazon) Etkinlikte aşağıdaki kombine ölçütün değerlendirmesi esas alınmıştır: ağırlıklı olarak l. kürde tam yanıt (kusma yok ve kurtarma tedavisi yok). Sonuçlar her bir çalışma ve toplu olarak 2 çalışma için ayn ayn değerlendirilmiştir. Kombine analizde elde edilen ana çalışma sonuçlannın özeti Tablo 1 'de gösterilmektedir.
Tablo 1 Yüksek Derecede Emetojenik Kemoterapi Alan Hastalarda Tedavi Grubu ve Faza GöreYanıt Veren Hastaların Yüzdesi -l.Kür
Aprepitant rejimi (N- 521) %
Standart tedavi (N= 524)^ %
Farklar* KOMBİNE ÖLÇÜTLER% (%95 GA)Tam Yanıt (kusma yok ve kurtarma tedavisi yok)
Genel (0-120 saat) 0-24 saat 25-120 saat
67.7 86.0 71.5
47.8 73.2 51.2
19.9 (14.0,25.8) 12.7 (7.9, 17.6) 20.3 (14.5,26.1)BİREYSEL ÖLÇÜTLERKusma yok (kurtarma tedavisi kullanımından bağımsız olarak kusma yok)
Genel (0-120 saat) 0-24 saat 25-120 saat
71.9 86.8 76.2
49.7 74.0 53.5
22.2 12.7 22.6
(16.4, 28.0) (8.0, 17.5) (17.0, 28.2) Anlamlı bulantı yok (0-100 mm skalada maksimum VAS <25mm)
Genel (0-120 saat) 25-120 saat
72.1 74.0
64.9 66.9
7.2 7.1
(1.6, 12.8) (1.5, 12.6)
*Güven aralıklan cinsiyet ve eş zamanlı kemoterapi için düzeltme yapılmadan hesaplanmıştır; bunlar olasılık cranlanm ve lojistik modelleri içeren primer analize dahil edilmiştir. ^ Aprepitant rejimi alan bir hastanın sadece akut faz verileri mevcuttu ve genel ve geç faz analizlerinden dışlandı; Standart tedavi alan bir hastanın sadece geç faz verileri mevcuttu ve genel ve akut faz analizlerine alınmadı. Kombine analizde ilk kusmaya kadar geçen tahmini süre Şekil 1 'deki Kaplan-Meier grafiğiyle gösterilmektedir. Şekil 1 Yüksek Derecede Emetojenik Kemoterapi Alan ve Zaman içinde Kusma Yaşamayan Hastaların Yüzdesi- 1. Kür
"O N >- 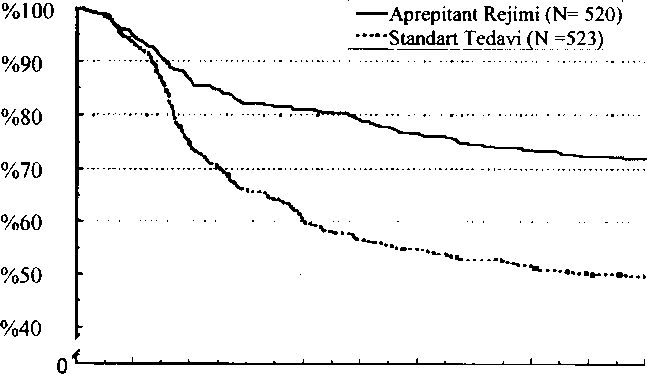 O 12 24 36 48 60 72 84 96 108 120
O 12 24 36 48 60 72 84 96 108 120Zaman (saat) iki ayrı çalışmada etkinlik bakımından da istatistiksel olarak anlamlı farklar gözlenmiştir. Aynı iki klinik çalışmada, 851 hasta Çoklu-Kür Uzatma dönemine devam etti ve ilave 5 kemoterapi kürü aldı. Aprepitant tedavisinin etkinliği tüm kürlerde devam etti Siklofosfamid 750-1500 mg/m ; veya siklofosfamid 500-1500 mg/m ve doksorubisin (>60 mg/m^) veya epirubisin {>100 mg/m ) içeren kemoterapi alan toplam 866 (864 kadın, 2 erkek) hastada yürütülen randomize, çift-kör bir çalışmada, aprepitant ile birlikte ondansetron/ deksametazon rejimi (bkz. bölüm 4.2) standart tedaviyle karşılaştırıldı (plasebo + oral ondansetron 8 mg (1. günde iki kez ve 2. ve 3. günlerde 12 saatte bir) + 1. günde oral deksametazon 20 mg). Etkinlikte kombine Ölçütün değerlendirmesi esas alındı: Ağırlıklı olarak 1. kürde tam yanıt (kusma yok ve kurtarma tedavisi yok). Önemli çalışma sonuçlarının özeti Tablo 2'de sunulmaktadır. Tablo 2 Orta Derecede Emetojenik Kemoterapi Alan Hastalarda Tedavi Grubu ve Faza Göre Yanıt Veren Hastalann Yüzdesi -l.Kür
Anlamlı bulantı yok (0-100 mm skalada maksimmn<25 mm)
t Aprepitant tedavisi alan bir hastanın sadece akut faz verileri mevcuttu ve genel ve geç faz analizlerinden dışlandı. Aynı klinik çalışmada 744 hasta üç ilave kemoterapi kürüne kadar uzatılmış Çoklu Kürlere devam etmiştir. Aprepitant rejiminin etkinliği tüm kürlerde korunmuştur. Çok-merkezli, randomize, çift-kör, paralel gruplu ikinci bir klinik çalışmada, aprepitant rejimi oksaliplatin, karboplatin, epirubisin, idarubisin, ifosfamid, irinotekan, daunorubisin, doksorubisinin herhangi bir intravenöz dozu; intravenöz yolla verilen siklofosfamid 2 2 (<1,500 mg/m ) veya intravenöz yolla verilen sitarabin (>1 g/m ) içeren bir kemoterapi rejimi alan 848 hastada (652 kadm, 196 erkek) standart tedaviyle karşılaştmlmıştır. Aprepitant rejimi alan hastalar çeşitli tümör tipleri için kemoterapi almaktaydı ve bu hastalann %52'sinde meme kanseri, %2Tinde gastrointestinal kanserler (kolorektal kanser dahil), %13'ünde akciğer kanseri ve %6'smda jinekolojik kanserler mevcuttur. Aprepitant rejimi ile birlikte ondansetron/deksametazon rejimi (bkz. Bölüm 4.2) standart tedaviyle karşılaştınidı (plasebo + oral ondansetron 8 mg (1. günde iki kez ve 2. ve 3. günlerde 12 saatte bir) + 1. günde oral deksametazon 20 mg). Etkinlikte aşağıdaki ana birincil ve ikincil son noktalann değerlendirilmesi esas alındı: tüm dönemde (kemoterapiden sonraki 0-120 saat) kusma yokluğu, CINV için aprepitant rejiminin güvenlilik ve tolerabilite değerlendirmesi ve tüm dönemde (kemoterapiden sonraki 0-120 saat) tam yamt (kusma olmaması ve kurtarma tedavisi kullanılmaması şeklinde tanımlandı). Aynca, anlamlı bulantı yokluğu tüm dönem için araştırma amaçlı bir son nokta olarak ve akut ve gecikmiş fazlarda bir post-hoc analiz olarak değerlendirildi. Önemli çalışma sonuçlannm özeti Tablo 3'de gösterilmektedir. Tablo 3 2. Çalışmada Orta Derecede Emetojenik Kemoterapi Alan Hastalarda Tedavi Grubu ve Faza Göre Yanıt Veren Hastalann Yüzdesi -l.Kür
Çalışma popülasyonunun tamamında aprepitant kombine tedavisinin yaran, esas olarak standart rejimle yetersiz kontrol sağlanan hastalarda (örn., kadınlarda) gözlenen sonuçlardan kaynaklandı; bununla birlikte yaş, tümör tipi veya cinsiyetten bağımsız olarak sonuçlar kombine aprepitant rejimiyle sayısal olarak daha iyiydi. Aprepitant rejimiyle tam yanıta kadınlarda 324 hastadan 209'unda (%65) ve erkeklerde 101 hastadan 83'ünde (%82) ulaşılırken, standart tedaviyle tam yanıta ulaşanların oranı kadınlarda %50 (161/320) ve erkeklerde %78'di (68/87). Pediyatrik popülasvonPediyatrik hastalarda aprepitant kullanımını değerlendiren çalışmalar devam etmektedir (pediyatrik kullanım hakkında bilgi için Bkz. Bölüm 4.2). 5.2. Farmakokinetik özellikler Genel özelliklerAprepitant doğrusal olmayan farmakokinetik özellik göstermektedir. Dozun artıniması ile hem klerens hem de mutlak biyoyararlanım azalır.EmilimAprepitant'ın ortalama oral biyoyararlanımı 80 mg kapsül için %67 ve 125 mg kapsül için % 59'dur. Aprepitant'ın ortalama maksimum plazma konsantrasyonuna (Cmaks) yaklaşık 4 saatte (tmaks) ulaşılmıştır. Kapsülün yaklaşık 800 Kcal veren standart bir kahvaltıyla oral yoldan uygulanması, aprepitant'ın EAA'smda %40'a kadar artışa yol açmıştır. Bu artış klinik yönden önemli kabul edilmemektedir. EMEND'in 1. gün, günde bir kez 125 mg'lık oral doz uygulamasını, 2. ve 3. günlerde günde bir kez 80 mg olarak oral uygulamasını takiben, EAAo-24saat (ortalamaiSD) l, ve 3. günlerde sırasıyla yaklaşık 19.6 mikrogram*sa/ml ve 21.2 mcg*sa/ml olmuştur. 1. ve 3. günlerde Cnıax sırasıyla 1.6 ± 0.36 ng/ml ve 1.4 ± 0.22 jig/ml'ydi. DağılımAprepitant ortalama %97 oranında plazma proteinlerine bağlanır. İnsanlarda, geometrik ortalama dağılım hacmi kararlı durumda (Vdjs) yaklaşık 66 L'dir. BivotransformasvonAprepitant geniş ölçüde metabolizasyona uğrar. Sağlıklı genç erişkinlerde, aprepitantın bir ön ilacı olan fosaprepitantm ile işaretlenmiş tekli 100 mg dozunun intravenöz yolla uygulanmasından sonra aprepitant 72 saat boyunca plazmadaki radyoaktivitenin yaklaşık %19'unu oluşturmaktadır; bu, plazmada metabolitlerin kayda değer varlığını gösterir. İnsan plazmasında aprepitantın 12 metaboliti saptanmıştır. Aprepitant metabolizması büyük ölçüde morfolin halkası ve yan zincirlerinin oksidasyonuyla gerçekleşir ve oluşan metabolitler çok zayıf şekilde aktiftir. İnsan karaciğer mikrozomlannın kullanılarak yapıldığı in vitroçalışmalar, aprepitant'm başlıca CYP3A4 ile, daha az oranda CYP1A2 ve CYP2C19 ile metabolizmaya uğradığım göstermiştir.EliminasvonAprepitant idrara değişmemiş şekilde atılmaz. Metabolitler idrara ve safra yoluyla atılarak feçese geçer. Sağlıklı kişilere [14C]-aprepitant ön ilacının (fosaprepitant) tekli intravenöz 100 mg dozunun uygulanmasının ardından radyoaktivitenin %57'si idrarda ve %45'i feçeste saptandı. Aprepitantın plazma klerensi doza bağımlıdır ve doz arttıkça azalır; terapötik doz aralığında yaklaşık 60-72 mL/dak arasındadır. Terminal yanlanma ömrü yaklaşık 9-13 saat arasında değişir. Doğrusallık/ Doğrusal olmayan durum:Aprepitant doğrusal olmayan farmakokinetik özellik göstermektedir. Dozun artınlması ile hem klerens hem de mutlak biyoyararlamm düşer. Hastalardaki karakteristik özellikler:Böbrek yetmezliği:EMEND'in tekli 240 mg dozu şiddetli böbrek yetmezliği olan hastalara (KrKl<30 ml/dak) ve hemodiyaliz gerektiren son evre böbrek hastalığı (SEBH) olan hastalara uygulanmıştır.Şiddetli böbrek yetmezliği olan hastalarda total aprepitant'm EAAo-oo değeri (bağlanmamış ve proteine bağlı) sağlıklı kişilere göre %21 azalırken, Cmaks %32 azalmıştır. Hemodiyalize giren SEBH'lı hastalarda total aprepitant'm EAAo-oo değeri %42 azalırken, Cmaks %32 azalmıştır. Böbrek hastalığı olan hastalarda aprepitant'm proteinlere bağlanmasındaki küçük azalmalara bağlı olarak, farmakolojik yönden aktif, bağlanmamış ilacın EAA'sı böbrek yetmezliği olan hastalarda sağlıklı kişilere göre anlamlı olarak etkilenmemiştir. Dozajdan 4-48 saat sonra V yapılan hemodiyalizin aprepitant'm farmakokinetiği üzerinde anlamlı etkisi olmamış; dozun %0.2'sinden azı diyaliz maddesinde saptanmıştır. Böbrek bozukluğu olan hastalarda ve hemodiyalize giren SEBH'li hastalarda EMEND dozunda ayarlama yapılması gerekmez. Karaciğer yetmezliği:Hafif karaciğer yetmezliği (Child-Pugh sınıf A) aprepitantın farmakokinetik özelliklerini klinik yönden önemli şekilde etkilemez. Hafif karaciğer yetmezliği olan hastalarda doz ayarlaması gerekmez. Mevcut verilere dayanarak, orta düzeyde karaciğer yetmezliğinin (Child-Pugh sınıf B) aprepitant farmakokinetiği üzerindeki etkisi hakkında yargıya varılamaz. Şiddetli karaciğer yetmezliği olan hastalara (Child-Pugh sınıf C) ilişkin herhangi bir klinik veya farmakokinetik veri yokturGeriyatrik popülasyon^ 65 yaş):Aprepitantın tekli 125 mg dozunun 1. günde ve ardından 80 mg dozunun 2-5. günlerde günde bir kez oral yolla uygulanmasının ardından, aprepitantın EAAo-24 saat değeri yaşlılarda (65 yaş ve üzeri) genç erişkinlere kıyasla 1. gün %2l daha yüksek ve 5. gün %36 daha yüksek ^ bulunmuştur. Cmaks yaşlılarda genç erişkinlere kıyasla 1. gün %10 daha yüksek ve 5. gün %24 daha yüksek bulunmuştur. Bu farklar klinik yönden anlamlı kabul edilmemektedir. Yaşlı hastalarda EMEND dozunda ayarlama gerekmez.CinsiyetEMEND'in tekli 125 mg dozunun oral yolla uygulanmasından sonra, aprepitant'm Cmaks'ı erkeklere göre kadınlarda %16 daha yüksektir. Aprepitant'm yanlanma ömrü kadınlarda erkeklere göre %25 daha düşüktür ve Tmaks'a yaklaşık olarak aynı sürede ulaşılır. Bu farklann klinik yönden anlamlı olmadığı kabul edilir. Cinsiyete dayalı olarak EMEND dozunda ayarlama yapılması gerekmez.IrkEMEND'in tekli 125 mg dozunun oral yolla uygulanmasından sonra, EAAo-24saat değerleri beyazlara ve siyahlara göre İspanyol kökenli kişilerde sırasıyla yaklaşık %25 ve %29 daha yüksektir. Aprepitant'm Cmaks'ı beyazlara ve siyahlara göre İspanyol kökenli kişilerde sırasıyla %22 ve %31 daha yüksektir. Oral aprepitantın Asyahlara tekli doz şeklinde uygulanması beyazlara kıyaslaEAAÛ-24 SAATve Cmaks değerlerinde sırasıyla %62 ve %41 oranında artışa yol açmıştır. Bu farkların klinik yönden anlamlı olmadığı kabul edilir. Irka dayalı olarak EMEND dozunda ayarlama yapılması gerekmez.Vücut Kütle İndeksi (BMI)Vücut Kütle İndeksi (BMI) aprepitantın farmakokinetiği üzerinde klinik yönden anlamlı bir etkiye yol açmamıştır.Farmakokinetik/farmakodinamik ilişki(ler)Sağlıklı genç erkekler üzerinde oldukça spesifik bir NKı-reseptör izleyici kullanılarak yapılan pozitron emisyon tomografisi (PET) çalışmalannda, aprepitant'm beyne nüfuz ettiği ve doza ve plazma konssıntrasyonuna bağlı bir şekilde NKı reseptörlerine bağlandığı gösterilmiştir. 3 günlük EMEND rejimi ile ulaşılan aprepitant plazma konsantrasyonlannm, beyin NKı reseptörlerinin %95'ten fazlasını bağlayacağı öngörülmektedir.5.3. Klinik öncesi güvenlilik verileriKlinik öncesi veriler tekli ve tekrarlı doz toksisitesi, genotoksisite, karsinojenite potansiyeli ve üreme toksisitesiyle ilgili rutin çalışmalar insanlar için herhangi bir özel tehlikeyi ortaya ^ koymamaktadır. Ancak kemirgenlerdeki sistemik maruz kalımın 125 mg/80 mg dozundaW insanlardaki terapötik maruz kalımla benzer ve hatta ondan daha düşük olduğu bildirilmiştir. Özellikle de, insanlardaki maruz kalım düzeylerinde yapılan üreme çalışmalannda herhangi bir istenmeyen etki gözlenmemesine rağmen, hayvanlardaki maruz kalımlar insanlarda uygun risk değerlendirmesi yapmak için yeterli değildir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiKapsül içeriği |
İlaç BilgileriEmend KapsülEtken Maddesi: Aprepitant Atc Kodu: A04AD12 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.