Norodol Dekanoat 50 mg/ml İ.M. Enjeksiyon İçin Çözelti, 3 ml Kısa Ürün BilgisiSinir Sistemi » Psikoleptikler (Psikolojik İlaçlar) » Antipsikotikler » Butirofenon Türevleri » Haloperidol KISA URUN BILGISI 1. BEŞERI TIBBI ÜRÜNÜN ADINORODOL® DEKANOAT 50 mg/ml i.m. Enjeksiyon için Çözelti, 3ml2. KALITATIF VE KANTİTATIF BILEŞIMEtkin madde:Haloperidol dekanoat 211,56 mg/3ml(50 mg Haloperidole eşdeğer) Yardımcı madde(ler):Benzil alkol 36,0 mg/3mlSusam yağı q.s 3 ml Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTIK FORMİntramüsküler enjeksiyon için sarı renkli, berrak çözelti4. KLİNIK ÖZELLIKLER4.1 Terapötik endikasyonlarNORODOL® DEKANOA örneğin şizofreni grubu psikotik bozukluklar gibi durumlarda endikedir.
NORODOL® DEKANOAT, antipsikotiklerle uzun dönemli idame tedavisinin gerektiği 4.2 Pozoloji ve uygulama şekliPozoloji/ Uygulama sıklığı ve süresi:NORODOL® DEKANOAT, sadece yetişkinlerin kullanımı içindir. Çoğu hastada gluteal bölgeye derin kas içi enjeksiyon şeklinde uygulanarak bir aylık tedaviyi sağlamak amacıyla formüle edilmiştir. Ürün, intravenöz yolla uygulanmamalıdır.Nöroleptik ilaçlara bireysel yanıtların farklı olması sebebiyle, dozlama bireye uygun olarak belirlenmelidir. Hatta, en uygunu dozlamaya yakın klinik gözetim altında başlanmalı ve doz ayarlanması bu şekilde yapılmalıdır. Başlangıç dozunun miktarı, hem semptomların şiddetine hem de hastanın depo tedaviye başlamadan önce gereken oral tedavisinin miktarına bağlıdır. NORODOL DEKANOAT, klinik olarak etkili olan minimum dozda kullanılmalıdır. Başlangıç dozu olarak, her dört hafta için 50 mg önerilmektedir. Gerekli olduğunda doz her dört hafta 50 mg'lık artışlarla 300 mg'a kadar çıkarılabilir. Eğer klinik sebeplerle, 2 haftada bir kullanılan tedavi tercih edilmiş ise, bu dozlar yarıya düşürülmelidir. Şiddetli semptomlar görülen veya idame tedavisinde büyük oral dozlara ihtiyaç duyulan hastalarda, NORODOL® DEKANOAT'ın yüksek dozda kullanımı gerekmektedir. Bununla birlikte, aylık 300 mg'dan fazla dozlardaki klinik deneyimler sınırlıdır. Tek enjeksiyonda 3 ml'den fazla hacimlerdeki rutin uygulamalar, hasta için rahatsızlık verici olduğundan önerilmemektedir. NORODOL® DEKANOAT, kas içine derin bir şekilde tercihen 5-6 cm uzunluğunda ve en az 21 gaugelik enjeksiyon iğnesi yardımıyla enjekte edilir. Z-track yöntemi gibi iyi bir enjeksiyon yöntemi uygulanarak, lokal reaksiyonlar ve enjeksiyon bölgesinden ilaç sızıntısı gibi durumlar azaltılabilir. Diğer tüm yağlı enjeksiyonlarda olduğu gibi enjeksiyondan önce aspirasyon ile intravenöz girişimin önlenmesini sağlamak önemlidir. Daha önce oral nöroleptik ile tedavisini sürdüren hastalar için, başlangıç dozu ortalama şu 500 mg kloropromazin ayda 100 mg NORODOL
®
şekilde belirlenir: Günde DEKANOAT'a eşittir. Daha önce flufenazin dekanoat veya flupentiksol dekanoat ile tedavi edilen hastaların geçişi için ortalama eşitlik şu şekildedir; iki haftada bir 25 mg flufenazin dekanoat veya 2 haftada bir 40 mg flupentiksol dekanoat ayda 100 mg Haloperidol dekanoat'a eşittir. Bu doz her bir hastanın tedaviye yanıtına uygun olacak şekilde ayarlanmalıdır. Uygulama şekli:Gluteal bölgeye derin intramusküler enjeksiyon yoluyla uygulanır.Kullanmadan önce ellerinizde ampulü içeriğin geri çekilmesine ve dışarı taşmamasına yardımcı olmak için ısıtın. 1. Ampulün büyük kısmını nokta işareti size dönük olacak şekilde başparmağınız ile işaret parmağınız arasında tutun. 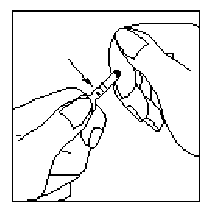 2. Diğer elinizin işaret parmağını ampulün boynuna destek olmak için yerleştirin. Başparmağınızı aşağıda gösterildiği gibi nokta işaretini kapatacak biçimde yerleştirin.
2. Diğer elinizin işaret parmağını ampulün boynuna destek olmak için yerleştirin. Başparmağınızı aşağıda gösterildiği gibi nokta işaretini kapatacak biçimde yerleştirin.
Özel popülasyonlara ilişkin ek bilgiler Böbrek / Karaciğer yetmezliğiBöbrek/karaciğer yetmezliği olan hastalarda yeterli veri bulunmadığından kullanımı önerilmez.
3. İşaret parmaklarınızı birbirine yakın tutun, nokta işaretinin üzerinde aşağı doğru sıkıca basınç uygulayıp ampulü açın.  Pediyatrik popülasyonNORODOL® DEKANOAT, sadece yetişkinlerin kullanımı içindir.Geriyatrik popülasyonHer 4 haftada bir 12,5 mg-25 mg gibi düşük dozlarda başlanması önerilir. Doz, sadece hastanın bireysel tedavi yanıtına göre arttırılır.4.3 KontrendikasyonlarKoma durumlarında, santral sinir sistemi depresyonunda, Parkinson hastalığında, haloperidole hipersensitivitesi olduğu bilinen kişilerde, bazal gangliyon lezyonlarında kontrendikedir.Yaygın olarak, diğer nöroepileptiklerle birlikte, haloperidol nadir olarak QT süresinin uzamasına neden olabilir. Haloperidol kullanımı bu nedenle klinik olarak belirgin kardiyak sorunları örneğin yakın zamanlı akut miyokart enfaktüs geçirmiş, kalp yetmezliği bulunan, sınıf IA ve sınıf III antiaritmik ilaçlarla tedavi edilen aritmisi bulunan, QTc intervali uzamış, ventriküler aritmi hikayesi veya Torsades de pointes klinik olarak belirgin bradikardisi olan, ikinci veya üçüncü derece kalp bloğu ve düzeltilmemiş hipokalemisi olan hastalarda kontrendikedir. Haloperidol diğer QT uzatıcı ilaçlarla eşzamanlı olarak kullanılmamalıdır. 4.4 Özel kullanım uyarıları ve önlemleriKaraciğer hastalığı ve böbrek yetmezliği durumlarında, feokromositomada, epilepsili hastalarda ve epilepsiye veya konvülziyonlara ortam hazırlayan durumlarda (örneğin alkol ve beyin hasarı ) dikkatli olunmalıdır. Haloperidol tiroid fonksiyon bozukluğu olan hastalarda çok dikkatli kullanılmalıdır. Bu hastalarda antipsikotik terapi her zaman tiroid fonksiyon bozukluğunun kontrol altına alınmasıyla birlikte yürütülmelidir.Antipsikotik ilaçlar alan psikiyatrik hastalarda olduğu gibi, haloperidol alan hastalarda da ani ölüm vakaları rapor edilmiştir. Yaşlı hastalarda, demans ile ilişkilli psikozların antipsikotik ilaçlarla tedavi sırasında ölüm riski artmaktadır. Her ne kadar ölüm nedenleri çeşitli ise de; çoğu ölümlerin kardiyovasküler (örn. kalp yetmezliği, ani ölüm) veya doğal enfeksiyon kökenli (pnömoni) olduğu görülmektedir. Gözlemsel çalışmalar, atipik antipsikotik ilaçlara benzer olarak geleneksel antipsikotik ilaçlarla tedavinin de ölüm oranını artırdığını göstermektedir. Kardiyovasküler etki Haloperidol tedavisinin risk ve faydaları tedaviye başlamadan dikkatlice değerlendirilmelidir ve kalp hastalığı gibi ventrikül aritmisi olanların, aile hikâyesinde ani ölüm ve/veya uzamış QT'si olanların, düzeltilmemiş elektrolit rahatsızlığı, subaraknoid kanaması, beslenme yetersizliği olanların, fazla alkol kullananların, özellikle tedavinin başlangıç safhasında plazma seviyelerini sabitlemek için EKG ve potasyum seviyeleri dikkatlice izlenmelidir. Haloperidol, CYP2D6'yi yavaş metabolize ettiği bilinen hastalarda ve sitokrom P450 inhibitörleri'nin kullanımı süresince, dikkatli kullanılmalıdır. Antipsikotikler ile birlikte kullanımından kaçınılmalıdır. Tüm hastalarda, özellikle yaşlılarda ve kendinde veya aile hikayesinde kalp hastalığı veya anormal kardiyak klinik bulgular olan hastalarda EKG öncelikli olarak önerilmektedir, Tedavi sırasında EKG izlenmesi (örn.doz artırımında); hastanın durumuna göre gerekli olabilir. Tedavi sürerken eğer QT süresi uzamış ise doz azaltılmalı ve eğer QTc 500 ms'yi geçerse haloperidol kesilmelidir. Periyodik olarak elektrolitlerin izlenmesi özellikle diüretik alan hastalarda veya ilave başka hastalıklar için önerilmektedir. Bazı atipik antipsikotiklerle demanslı popülasyonda yapılan randomize plasebo kontrollü klinik çalışmalarda, yaklaşık olarak 3 kat yüksek serebrovasküler yan etki görülmüştür. Bu yüksek riskin mekanizması bilinmemektedir. Yüksek risk diğer antipsikotikler ve diğer hasta toplulukları için gözardı edilemez. Haloperidol inme riski bulunan hastalarda dikkatli kullanılmalıdır. Nöroleptik malignant sendrom (NMS) Diğer antipsikotik ilaçlarda olduğu gibi NORODOL® DEKANOAT'da Nöroleptik Malign Sendrom (NMS) ile ilişkilidir: Seyrek olarak kendine özgü bir yanıt ile hipertermi, genelleşmiş kas sertleşmesi, otonom instabilite, bilinç düzeyinde değişim şeklinde tanımlanır. Hipertermi genel olarak bu sendromun erken işaretidir. Antipsikotik tedavi hemen durdurulmalı, uygun destekleyici bir tedavi uygulanmalı ve hasta dikkatlice gözlenmelidir. Tardif diskinezi Tüm antipsikotik ajanlarda olduğu gibi, uzun dönemli tedavi gören veya tedavisi sonlandırılan bazı hastalarda Tardif diskinezi görülebilir. Bu sendrom genel olarak dilin, yüzün, ağız veya çenenin ritmik olarak istemsiz hareketleriyle tanımlanır. Bu belirtiler bazı hastalarda kalıcı olabilir. Sendrom, tedaviye yeniden başlandığında, doz arttırıldığında veya farklı bir antipsikotik ilaca geçiş yapıldığında maskelenebilir. Tedavi en kısa zamanda durdurulmalıdır. Ekstrapiramidal semptomlar Eğer eş zamanlı anti-Parkinson tedavisi gerekli ise haloperidolün kesilmesinden sonra eliminasyon oranlarındaki herhangi bir değişiklik dikkate alınarak tedaviye devam edilebilir. Doktorların, anti-Parkinson ajanların eşlik ettiği antikolinerjik etkileri dikkate alması gerekir. Nöbet/ Konvülsiyon İnmenin NORODOL® DEKANOAT tarafından tetiklenebileceği bildirilmiştir. Epilepsisi olan hastalarda ve havaleye zemin hazırlayabilecek durumlarda (örn.,alkol yoksunluğu ve beyin sarsıntısı) dikkatli olunmalıdır. Hepatobiliyer hastalık NORODOL® DEKANOAT karaciğer tarafından metabolize edildiğinden karaciğer hastalığı olanlarda dikkatli olunmalıdır. İstisnai vakalarda karaciğer fonksiyon anormallikleri veya çoğu kez kolestatik olmak üzere hepatit bildirilmiştir. Endokrin sistem hastalığı Tiroksin, NORODOL® DEKANOAT toksisitesini kolaylaştırabilir. Dolayısıyla hipertiroid hastalarında ancak çok dikkatli bir şekilde kullanılabilir. Bu tip hastalarda tedavi çok dikkatli bir şekilde yürütülmeli ve daima ötiroid sağlayıcı bir tedaviyle beraber yürütülmelidir. Antipsikotik Nöroleptik ilaçların hormonal etkileri Galoktere, jinekomasti, ve oligo veya amonereye neden olabilen hiperprolaktinemi şeklindedir. Çok seyrek vakalarda hipoglisemi ve uygunsuz antidiüretik hormon salgılanması bildirilmiştir. Venöz tromboembolizm Antipsikotik ilaçlarda venöz tromboembolizm (VTE) vakaları bildirilmiştir. Çoğunlukla kazanılmış VTE risk faktörlerine sahip antipsikotikler ile tedavi edilen hastalarda, NORODOL® DEKANOAT ile tedaviye başlamadan önce ve tedavi sırasında mümkün olabilecek tüm VTE riskleri belirlenmeli ve koruyucu tedbirler alınmalıdır. İlave değerlendirmeler Şizofrenide antipsikotik ilaç tedavisine olan yanıt gecikebilir. Eğer ilaç kullanımı bırakılırsa, semptomlar birkaç hafta veya ay süresince ortaya çıkmayabilir. Tüm antipsikotik ajanlar gibi haloperidol depresyonun baskın olduğu durumlarda tek başına kullanılmamalıdır. Depresyon ve psikozun birlikte görüldüğü durumlarda antidepresanlar ile kombine edilebilir. Haloperidol trisiklik antidepresanların metabolizmasını bozabilmektedir (klinik önemi bilinmemektedir). NORODOL® DEKANOAT her bir mL'sinde 12 mg benzil alkol içerir. Bebeklerde ve 3 yaşına kadar olan çocuklarda toksik reaksiyonlara ve anafilaktoid reaksiyonlara sebebiyet verebilir. NORODOL® DEKANOAT içeriğinde susam yağı bulunmaktadır. Bu madde nadir olarak ciddi alerjik reaksiyonlara neden olabilir. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriHaloperidolün QT aralığını uzattığı bilinen ilaçlarla eş zamanlı kullanılması torsade de pointes de dahil, ventrikül aritmi riskini arttırabilir, dolayısıyla bu ürünlerin eş zamanlı kullanılması önerilmemektedir. Örnekler: anti-aritmikler Sınıf 1A (kinidin, dizopiramid ve prokainamid gibi) ve Sınıf III (amiodaron, sotalol ve dofetilid gibi), belirli antimikrobiyaller (sparfloksasin, moksifloksasin, eritromisin IV gibi), trisiklik antidepresanlar (amitriptilin gibi), belirli tetrasiklik antidepresanlar (maprotilin gibi), diğer nöroepileptikler (örn. Fenotiyazinler, pimozid ve sertindol), belirli antihistaminikler (terfenadin gibi), sisaprid, bretilyum ve kinin ve meflokin gibi belirli antimalaryaller.Elektrolit dengesizliğine neden olan ilaçların eş zamanlı kullanımı, ventriküler aritmi riskini arttırabilir ve bu nedenle önerilmemektedir. Özellikle hipokalemiye neden olan diüretiklerin kullanımından kaçınılmalıdır fakat gerekli ise potasyum tutucu diüretikler tercih edilmelidir. Haloperidol glukoronidasyon ve sitokrom P450 enzim sistemi (özellikle CYP 3A4 veya CYP 2D6) de dahil olmak üzere çeşitli yollardan metabolize olur. Bu metabolizma yolların başka bir ilaç veya düşen CYP 2D6 enzimi aktivitesi ile inhibisyonu, yükselen haloperidol konsantrasyonları ve uzamış QT de dahil artan yan etki riski ile sonuçlanır. Farmakokinetik çalışmalarda, haloperidolün itrakanazol, buspiron, venlafaksin, alprazolam, fluvoksamin, kinidin, fluoksetin, sertalin, klorpromazin ve prometazin gibi substratlar denen veya CYP 3A4 veya CYP 2D6 izoenzim inhibitörleri ile eş zamanlı verildiğinde, yükselmiş haloperidol seviyeleri rapor edilmiştir. CYP 2D6 ezim aktivitesininin azalması haloperidol konsantrasyonunun azalmasıyla sonuçlanabilir. Haloperidol, paroksetin (20 mg/gün) ve ketakonazolun metabolik inhibitörlerinin (400 mg/gün) kombinasyonuyla verildiğinde, OTc ve ekstraprimidal semptomlarda artış gözlenmiştir. Haloperidol dozunun düşürülmesi gerekebilir. Diğer ilaçların haloperidol üzerindeki etkileri Karbamazepin, fenobarbital ve rifampisin gibi enzim indükleyici ilaçlarla uzun süreli tedavilerin, NORODOL® DEKANOAT tedavisine eklenmesi haloperidol plazma seviyesinde belirgin bir düşüşe neden olur. Dolayısıyla kombine tedavilerde, gerekli olduğunda NORODOL® DEKANOAT dozunun veya doz aralığının ayarlanması gerekebilir. Bu tür ilaçların kullanımı sonlandırıldıktan sonra haloperidolün dozunun yeniden düşürülmesi gerekebilir. Glukoronidasyonu inhibi ettiği bilinen Sodyum valproat haloperidol plazma konsantrasyonlarını etkilemez. Haloperidol'ün diğer ilaçlar üzerindeki etkileri Diğer tüm nöroleptiklerde olduğu gibi haloperidol, alkol, hipnotik, sedatif veya güçlü analjezikler içeren diğer santral sinir sistemi depresan ilaçlarının neden olduğu santral sinir sistemi depresyonunu arttırabilir. SSS etkilerinin metildopa ile birlikte kombine edildiğinde arttığı rapor edilmiştir. Haloperidol adrenalin ve diğer semptomatik ajanların etkisini antagonize edebilir ve guanetidin gibi adrenerjik blokör ajanların kan basıncını düşürücü etkisini tersine çevirebilir. Haloperidol trisiklik antidepresanların metabolizmasını ve levodopanın anti-parkinson etkilerini bozabilir. Haloperidol CYP 2D6 inhibitörüdür. NORODOL® DEKANOAT trisiklik antidepresanların metabolizmasını inhibe eder, böylece bu ilaçların plazma seviyelerini yükseltir. Diğer etkileşme şekilleri Seyrek vakalarda, lityum ve NORODOL® DEKANOAT'ın kombinasyonunda ensefalopati benzeri sendrom rapor edilmiştir. Bu vakaların, belirgin klinik durum mu yoksa NMS ve/veya lityum zehirlenme vakası mı olduğu tartışmalıdır. Ensefalopati benzeri sendrom konfüzyon, zaman ve yer kavramının kaybı, baş ağrısı, denge bozukluğu ve uyuşukluğu kapsar. Kombinasyon üzerine semptomsuz EEG anormalliklerini gösteren bir rapor, EEG izlemenin makul olabileceğini göstermektedir. Lityum ve haloperidol birlikte kullanıldığında, haloperidol en düşük etkili dozda verilmeli, lityum seviyeleri izlenmeli ve 1 mmol/l altında tutulmalıdır. Eğer ensefalopati-benzeri sendrom meydana gelirse, tedavi acilen durdurulmalıdır. Fenindionun antagonist etkisi rapor edilmiştir. Düşen inme eşiği seviyesini hesaba katma için antikolvüzanların dozunu arttırmak gerekebilir. Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlara ilişkin herhangi bir etkileşim çalışması tespit edilmemiştir.Pediyatrik popülasyon:Pediyatrik popülasyona ilişkin herhangi bir etkileşim çalışması tespit edilmemiştir.4.6 Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi C'dir.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Hayvanlar üzerinde yapılan araştırmalar üreme toksitesisinin bulunduğunu göstermiştir (bkz. Kısım 5.3.). İnsanlara yönelik potansiyel risk bilinmemektedir.NORODOL® DEKANOAT gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Gebelik dönemiHaloperidolün hamilelerde güvenli kullanımına ilişkin bir çalışma bildirilmemiştir. Hayvan çalışmalarında bazılarında, zarar verici etkileri olduğuna dair kanıtlar vardır. Hamileliğin son trimestrinde uterusda haloperidole maruz kalan yenidoğan bebeklerde geri dönüşümlü ekstrapramidal semptomlar gözlemlenmiştir.NORODOL® DEKANOAT, hamilelikte yalnızca yarar risk değerlendirilmesi yapıldıktan sonra kullanılmalıdır. Uygulanan doz mümkün olan en düşük doz olmalı ve uygulama süresi mümkün olan en kısa süre olmalıdır. Laktasyon dönemiHaloperidol anne sütünde NORODOL® DEKANOAT'ın terapötik dozları emziren kadınlara uygulandığı taktdirde memedeki çocuk üzerinde etkiye neden olabilecek ölçüde atılmaktadır. Emzirmenin durdurulup durdurulmayacağına ya da NORODOL® DEKANOAT tedavisinin durdurulup durdurulmayacağına/tedaviden kaçınılıp kaçınılmayacağına karar verilmelidir.Üreme yeteneği/FertiliteSınırlı sayıdaki verilere göre, kemirgenlerde görülen embriyo toksik etkiler gibi düşük fertilite, sınırlı teratojenite dışında belirgin bir tehlike göstermemiştir.4.7 Araç ve makine kullanımı üzerindeki etkilerTedavinin başlangıcında ve özellikle yüksek dozlarda sedasyonun bazı dereceleri veya uyanıklık bozukluğu meydana gelebilir. Alkol veya diğer santral sinir sistemi depresanlarıyla birlikte bu etkiler artmaktadır. Hastalar, tedavileri süresince dikkat gerektiren araç ve makine kullanımı gibi aktivitelerden uzak durmaları konusunda uyarılmalıdır.4.8 İstenmeyen etkilerHaloperidol dekanoat'a bağlı istenmeyen etkiler sıklık sıralamasına göre aşağıda yer almaktadır:Çok yaygın (>1/10), yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor) Kan ve lenf sistemi hastalıklarıYaygın olmayan: LökopeniBilinmiyor: Agranülositoz, nötropeni, pansitopeni, trombositopeni Bağışıklık sistemi hastalıklarıYaygın olmayan: Hipersensitivite Bilinmiyor: Anafilaktik reaksiyonEndokrin hastalıklarıSeyrek: HiperprolaktinemiBilinmiyor: Uygunsuz antidiüretik hormon salgılanması Metabolizma ve beslenme hastalıklarıBilinmiyor: HipoglisemiPsikiyatrik hastalıklarıÇok yaygın: Ajitasyon, insomnia Yaygın: Depresyon, psikotik hastalıklarYaygın olmayan: Sersemlik hali, libido azalması, libido kaybı, huzursuzluk Sinir sistemi hastalıklarıÇok yaygın: Ekstrapramidal bozukluk, hiperkinezi, baş ağrısıYaygın: Tardif diskinezi, okülojirik kriz, distoni, diskinezi, akatizi, bradikinezi, hipokinezi, hipertoni, maske yüz ifadesi, somnolans. tremor, sersemlik Yaygın olmayan: Konvülsiyon, Parkinson, akinezi, dişli çark rijiditesi, istemsiz kas kasılması, sedasyon Seyrek: Nöroleptik malignant sendrom, motor fonksiyon bozukluğu, nistagmus Göz hastalıklarıYaygın: Görme bozukluğu,Yaygın olmayan: Görmede bulanıklık Kardiyak hastalıklarıYaygın olmayan: TaşikardiBilinmiyor: Ventrikül fibrilasyon, Torsades de pointes, ventrikül taşikardi, ekstrasistol Vasküler hastalıklarıYaygın: Ortostatik hipotansiyon, hipotansiyonSolunum, göğüs bozuklukları ve mediastinal hastalıklarıYaygın olmayan: DispneSeyrek: Bronkospazm Bilinmiyor: Larinks ödemi, laringospazm Gastrointestinal hastalıklarıYaygın: Konstipasyon, ağız kuruluğu, aşırı tükürük salgılanması, bulantı, kusmaHepato-bilier hastalıklarıYaygın: Karaciğer testlerinde anormallik Yaygın olmayan: Hepatit, sarılık Bilinmiyor: Akut karaciğer yetmezliği, kolestazDeri ve deri altı doku hastalıklarıYaygın: DöküntüYaygın olmayan: Fotosensitivite, ürtiker, kaşıntı, aşırı terleme Seyrek: Lökostoklastik vaskülit, eksfoliyatif dermatit Kas-iskelet bozukluklar, bağ doku ve kemik hastalıklarıYaygın olmayan: Boyun tutulması, kas katılığı, kas spazmı, kas-iskelet sertliği Seyrek: Çene kitlenmesi, kas seyirmesiBöbrek ve idrar hastalıklarıYaygın: İdrar retansiyonuÜreme sistemi göğüs hastalıklarıYaygın: Erektil disfonksiyonYaygın olmayan: Amenore, dismenore, meme ağrısı, memede rahatsızlık hissi Seyrek: Menoraji, menstrüel düzensizlik, cinsel işlev bozukluğu Bilinmiyor: Jinekomasti, priapizm Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın: Enjeksiyon yerinde oluşan reaksiyonlar Yaygın olmayan: Yürüme bozukluğu, hipertermi, ödem Bilinmiyor: Ani ölüm, yüzde ödem, hipotermiAraştırmalarYaygın: Kilo alımı, kilo kaybıSeyrek: Elektrokardiyogram, QT süresinin uzaması 4.9 Doz aşımı ve tedavisiGenellikle, haloperidol dozaşımı göstergeleri onun farmakolojik etkilerinin uzamasıdır, en belirgin şiddetli ekstrtapramidal belirtiler, hipotansiyon ve uykuya doğru geçiş gösteren ruhsal hissizliktir. Muhtemel QT uzamasına eşlik eden ventrikül aritmi riski düşünülmelidir.Hasta solunum depresyonu ve şok durumu yaratacak kadar ciddi hipotansiyon ile birlikte komada gözükebilir. Çelişkili olarak hipotansiyondan ziyade hipertansiyon meydana gelebilir. Ayrıca konvülziyon da oluşabilir. Haloperidolün belirgin bir antidotu yoktur. Hastanın solunum yolu açık tutulmalıdır ve eğer gerekirse mekanik ventilasyon uygulanabilir. Çeşitli aritmi raporlarına göre, EKG izlenmesi şiddetli olarak önerilir. Hipotansiyon ve kolaps, plazma hacmi genişlemesi ve diğer uygun ölçülerle tedavi edilmelidir. Adrenalin kullanılmamalıdır. Hasta vücut ısısı izlenmeli ve yeterli miktarda sıvı alımı sağlanmalıdır. Ciddi ekstrapramidal semptom durumlarında, uygun anti Parkinson tedavisi uygulanmalıdır. 5. FARMAKOLOJIK ÖZELLIKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Butirofenon TürevleriATC kodu: N05AD01 Haloperidolün antipsikotik etkinliği özellikle merkezi dopamin bloke edici etkisine dayanmaktadır. Nöroadrenaline ve daha az olarak serotonine karşı etkisi vardır. Histamine ve asetilkolin reseptörlerine karşı sadece çok az düzeyde etkisi vardır. Haloperidol dekanoat, uzun zamandır iyi bilinen bir ilacın depo preparatı olduğundan, haloperidolün prodrogu olarak kullanımını valide etmek üzere birçok deneysel hayvan çalışması yapılmadan önce klinik olarak kullanılmıştır (ve değerli bir ilaç olduğu bulunmuştur). Bununla birlikte, ilacın farmakolojik aktivitesini ortaya çıkarmak için daha sonra çalışmalar yapılmıştır. Yapılan çalışmalarda; haloperidol dekanoat uygulamasından sonra köpeklerde apomorfin-kaynaklı emesiz antagonizmasına paralel haloperidol plazma konsantrasyonları elde edildiği bildirilmiştir. Haloperidol dekanoatın sıçan ve farelerde antipsikotik benzeri davranış modelinde herhangi bir intrinsik aktiviteye sahip olmadığını ve in vitro dopamin reseptörüne bağlanmada haloperidol aktivitesinin yalnızca %2.5'lik bölümüne sahip olduğu gösterilmiştir. Haloperidol ve haloperidol dekanoatın, intraserebroventriküler enjeksiyonları sonrasında dopamin metabolitlerinin (homo-vanilik asit ve 3,4-dihidroksifenilasetik asit) artan birikimi gözlenmiştir, bu birikimdeki değişiklik haloperidol dekanoat ile daha azdır. Haloperidol dekanoatın tekli enjeksiyonunu takiben, beynin dopamin yönünden zengin bölümlerinde haloperidol konsantrasyonları (ön korteks, limbik ön beyin, striatum) 2. günde pik düzeylere ulaşmış, 7 gün boyunca yüksek kalmış ve ardından yavaş şekilde düşüş göstermiştir. Kemirgenlerde intramüsküler haloperidol dekanoat enjeksiyonunu takiben davranışsal ve biyokimyasal olayların gözlenmesine kadar geçen sürenin değişken olduğu tespit edilmiştir. Haloperidol dekanoat, şartlı sakınma hızını uzun süreyle azaltmıştır. Bu etki enjeksiyondan 24 saat sonra pik düzeylere erişmiş, 9 güne kadar yüksek düzeylerde kalmış ve ardından yavaş şekilde azalarak yirmi sekizinci günde uygulama öncesi düzeylere dönmüştür. Benzer şekilde, ön kortekste homo-vanilik asit ve 3,4-dihidroksifenilasetik asit konsantrasyonları 8 saat sonra pik düzeylere erişmiş ve enjeksiyondan 21 gün sonra normalden anlamlı şekilde daha yüksek düzeylerde kalmayı sürdürmüştür. Haloperidol dekanoatın prolaktin-salım aktivitesi ve antiapomorfin aktivitesi uzun sürmemiştir. Her iki etki de 24 saat içinde pik düzeylere ulaşmış ancak 7 gün içinde uygulama öncesi düzeylere inmiştir. Striatumda dopamin metabolitlerinin birikimi haloperidol dekanoat enjeksiyonundan 8 saat sonra pik düzeylere erişmiş ancak 21 gün içinde normale dönmüştür. Dopamin metabolitlerinin farklı birikimi, ekstrapiramidal yan etkilerin nigrostriatal dopamin sisteminde dopamin reseptör blokajından kaynaklandığı yaygın olarak kabul gördüğünden dolayı, haloperidol dekanoatın neden uzun süreli antipsikotik klinik etkiye ancak daha kısa süreli ekstrapiramidal etkiye sahip olduğunu açıklamaya yardımcı olabilir. İnsanlarda bilgisayarlı EEG farmakodinami çalışmaları, 75 ila 300 mg/ay dozunda verilen haloperidol dekanoatın, enjeksiyondan sonra ilk haftada psikotik hastalarda teta spektrum kuvvetini arttırdığını ve artışın klinik iyileşme ile orantılı olduğunu göstermiştir. Haloperidol dekanoatın diğer farmakodinamik etkileri haloperidolünkine benzerdir. 5.2 Farmakokinetik özelliklerGenel özelliklerEmilim:Solüsyondaki Haloperidol dekanoat, enjeksiyon yerinden yavaşça yayılır ve esteraz ile haloperidole hidrolize olarak, sistemik dolaşıma girer. Dağılım:30-300 mg haloperidol dekanoat başlangıç dozundan sonra plazma konsantrasyonu dağılımı 0.8 ila 3.2 ng/ml olur. İkinci dozdan sonra kararlı doz 2.8ng/ml'e ulaşır. Oral idame tedavinin yaklaşık 20 katı aylık dozun klinik olarak eşdeğeri olduğu belirtilmiştir. Kan seviyeleri hastalar arasında önemli ölçüde farklılık gösterir. Proteinlerine bağlanma oranı % 90'dır. Biyotransformasyon:Karaciğerde inaktif bileşenlerine ayrılır.Eliminasyon:Yarılanma ömrü yaklaşık 1 gündür. İdrar( % 33 ila% 40 metabolit olarak) ve feçes (%15) ile atılır. Klerensi 550± 133 mL/dk'dır.Doğrusallık/ doğrusal olmayan durum:Haloperidol dekanoat dozu ile plazma haloperidol konsantrasyonu 450 mg'ın altındaki dozlarda yaklaşık olarak doğrusaldır. Bununla birlikte intramuskuler enjeksiyon olarak uygulanan haloperidol dekanoatın farmakokinetiği uygulanan kişiler arasında oldukça değişiklik gösterebilmektedir.5.3 Klinik öncesi güvenlilik verileriSınırlı sayıda veri mevcuttur bununla birlikte bu veriler, kemirgenlerde görülen embriyo toksik etkiler gibi düşük fertilite, sınırlı teratojenite dışında belirgin bir tehlike göstermemiştir. Yayınlanmış olan birkaç in vitro çalışmada Haloperidol'ün kardiyak hERG kanallarını bloke ettiği gösterilmiştir. Birkaç in vivo çalışmada bazı hayvan modellerine haloperidolün yaklaşık 0,3mg/kg i.v. dozunda ve 4 ila 20 ng/ml olan etkili insan plazma konsantrasyonundan 3 ila 7 kat yüksek cmax plazma seviyesinde İV uygulaması, QTc de kayda değer bir uzamaya neden olmuştur. OTc de uzamaya neden olan bu i.v dozlar aritmiye yol açmamıştır. 1 ila 5 mg/kg arasındaki bazı yüksek i.v. dozları, etkili insan plazma konsantrasyonlarından 9 ila 68 kat yüksek Cmaks plazma seviyesinde QTc de uzamaya ve/veya ventriküler aritmiye yol açmıştır.6.FARMASÖTİK ÖZELLİKLERİ6.1 Yardımcı Maddelerin ListesiHer ampulde;Benzil Alkol Susam Yağı 6.2 GeçimsizliklerBilinmemektedir.6.3 Raf ömrü24 ay.6.4 Saklamaya yönelik özel tedbirler30°C'nin altındaki oda sıcaklığında saklayınız.Buzdolabına koymayınız, dondurmayınız. Işıktan koruyunuz. Reçete ile satılır. 6.5 Ambalajın niteliği ve içeriği1 ml'lik amber cam ampul, 1 ampul içeren paketlerde 1 ml'lik amber cam ampul, 5 ampul içeren paketlerde 3 ml'lik amber cam ampul, 1 ampul içeren paketlerde 3 ml'lik amber cam ampul, 5 ampul içeren paketlerde6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir.7. RUHSAT SAHİBIAli Raif İlaç San. A.Ş.Eski Büyükdere Caddesi Dilaver Sokak No:4 34418 Oto Sanayi - 4. Levent/İstanbul Tel: 0212 316 78 00 Faks: 0212 316 78 78 8. RUHSAT NUMARASI227/309. İLK RUHSAT TARIHI/ RUHSAT YENILEME TARIHIİlk ruhsat tarihi: 02.12.2010 Ruhsat yenileme tarihi:10. KÜB'ÜN YENİLENME TARİHI |
İlaç BilgileriNorodol Dekanoat 50 mg/ml İ.M. Enjeksiyon İçin Çözelti, 3 mlEtken Maddesi: Haloperidol dekanoat Atc Kodu: N05AD01 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.