Sandostatin LAR 30mg Microkapsül İçeren Flakon Kısa Ürün BilgisiEndokrin Sistem » Hipofiz ve Hipotalamus Hormonları ve Analogları » GONADOTROP SERBESTLEYİCİ HORMON » Antigrowth hormon » Oktreotid KISA URUNBILGISI1.BEŞERI TIBBI URUNUN ADI:SANDOSTATİN LAR 30 mg mikrokapsül içeren flakon2.KALITATIF VE KANTİTATIF BİLEŞİM:Etkin madde:OktreotidT (serbest peptid olarak)30 mg(t33.6 mg oktreotid asetat'a eşdeğerdir.) Yardımcı maddeler:Sodyum karboksi metil selüloz12.5 mgYardımcı maddeler için 6.1'e bakınız. 3.FARMASÖTIKFORM:Mikrokapsül içeren flakonEnjeksiyonluk kuru etkin madde içeren renksiz cam flakon ve çözücü içeren şırınga. Flakonlar, beyaz ila kırık beyaz renkte toz halinde etkin madde içerir. Enjeksiyonluk süspansiyon için verilen çözücü berrak ve renksizdir. 4.KLINIK ÖZELLIKLER4.1. Terapötik endikasyonlarAşağıdaki akromegali vakalarında:-Subkütan SANDOSTATİN tedavisiyle yeterince kontrol altında tutulan hastalarda, -Ameliyatın veya radyoterapinin uygun olmadığı ya da etkisiz kaldığı hastalarda veya radyoterapinin tam etkisini göstermesine kadar geçen ara-dönemde (bkz.4.2 Pozoloji ve uygulama şekli.), Fonksiyonel gastro-entero-pankreatik endokrin tümörlere eşlik eden semptomları, subkütan SANDOSTATİN tedavisiyle yeterince kontrol altında tutulan hastaların tedavisinde: -Karsinoid sendromun özelliklerini taşıyan karsinoid tümörlerde -VIPoma vakalarında -Glukagonomalarda -Gastrinomalarda / Zollinger-Ellison sendromunda -İnsülinomalarda; hipogliseminin ameliyat öncesi kontrol altına alınması amacıyla ve idame tedavisinde -GRFomalarda kullanılır. 4.2. Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:Akromegalide:Semptomları subkütan SANDOSTATİN ile yeterince kontrol altında tutulan hastalarda tedaviye, 3 ay boyunca her 4 haftada bir 20 mg SANDOSTATİN LAR kullanarak başlanması önerilir. SANDOSTATİN LAR tedavisi, son uygulanan subkütan SANDOSTATİN dozundan sonraki gün başlatılabilir. Daha sonraki dozaj ayarlamaları, klinik semptomlar ve serumdaki büyüme hormonu (GH) ve insülin-benzeri büyüme faktörü 1/somatomedin C (IGF 1) düzeyleri göz önünde bulundurularak yapılmalıdır. Bu 3 aylık uygulama sırasında klinik semptomları ve biyokimyasal parametreleri (GH; IGF 1) tamamen kontrol altına alınamayan (GH konsantrasyonları hala 2.5 ^.g/litreden yüksek olan) hastalarda doz, her 4 haftada bir 30 mg'a yükseltilebilir. 3 ay boyunca her 4 haftada bir uygulanan 20 miligramlık dozla büyüme hormonu (GH) konsantrasyonları daima < 1 ^.g/litre bulunan, serum IGF 1 konsantrasyonları normale dönen ve akromegalinin reversibl nitelikteki hemen bütün belirtileri/semptomları ortadan kalkan hastalarda tedaviye, her 4 haftada bir 10 mg SANDOSTATİN LAR kullanarak devam edilebilir. Ancak özellikle bu hasta grubunda olmak üzere düşük SANDOSTATİN LAR dozlarının kullanılması sırasında serum GH ve IGF 1 konsantrasyonlarının ve klinik belirtilerin/semptomların yeterince kontrol altında olup olmadığının yakından izlenmesi önerilir. Stabil SANDOSTATİN LAR dozu alan hastalarda her 6 ayda bir büyüme hormonu (GH) ve insülin-benzeri büyüme hormonu (IGF 1) değerlerine bakılmalıdır. Ameliyatın veya radyoterapinin uygun olmadığı ya da etkisiz kaldığı hastalarda veya radyoterapinin tam etkisini göstermesine kadar geçen ara-dönemde: Oktreotide alınacak terapötik cevabın ve oktreotid tolerabilitesinin değerlendirilebilmesi amacıyla, yukarıda anlatılan şekilde SANDOSTATİN LAR kullanımına başlanmadan önce kısa bir test süresi boyunca subkütan SANDOSTATİN kullanılması önerilir. Gastro-entero-pankreatik endokrin tümörlerde: Semptomları subkütan SANDOSTATİN ile yeterince kontrol altında olan hastalarda: Tedaviye 4 haftada bir 20 mg SANDOSTATİN LAR kullanılarak başlanması önerilir. İlk SANDOSTATİN LAR enjeksiyonunu izleyen 2 hafta boyunca, önceden etkili olduğu bilinen subkütan SANDOSTATİN dozlarının kullanılmaya devam edilmesi gerekir. Daha önce subkütan SANDOSTATİN kullanmamış olan hastalarda: Yukarıda anlatılan şekilde SANDOSTATİN LAR kullanılmaya başlanmadan önce kısa bir süre (yaklaşık 2 hafta) boyunca günde 3 defa 0.1 mg subkütan SANDOSTATİN kullanılarak terapötik cevabın ve tolerabilitenin değerlendirilmesi önerilir. 3 aylık tedaviyle semptomları ve biyolojik parametreleri iyi bir şekilde kontrol altına giren hastalarda doz, her 4 haftada bir 10 mg SANDOSTATİN LAR olarak düşürülebilir. 3 aylık tedaviyle semptomları yalnızca kısmen kontrol altına alınabilen hastalarda doz, her 4 haftada bir 30 mg SANDOSTATİN LAR olmak üzere yükseltilebilir. SANDOSTATİN LAR tedavisi sırasında gastro-entero-pankreatik tümörlere eşlik eden semptomları artabilen hastalarda, SANDOSTATİN LAR tedavisinde önce kullanılmakta olan dozda subkütan SANDOSTATİN kullanılması önerilir. Bu durum daha çok, SANDOSTATİN LAR tedavisinin ilk 2 ayında, oktreotid konsantrasyonları terapötik değerlere ulaşıncaya kadar gözlenebilmektedir. Uygulama şekli:Doktor tarafından başka şekilde tavsiye edilmediği takdirde;SANDOSTATİN LAR, yalnızca derin intragluteal enjeksiyon yoluyla uygulanmalıdır. Arka arkaya yapılacak enjeksiyonlarda sağ ve sol kalçalar sırayla kullanılmalıdır (bkz. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler). SANDOSTATİN LAR, oktreotid etkin maddesinin uzun etkili depo enjeksiyonluk formudur. SANDOSTATİN LAR yalnızca derin intragluteal(im) enjeksiyon içindir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Böbrek fonksiyonlarının bozuk olması, subkütan SANDOSTATİN tedavisi sırasında oktreotid EAA değerini etkilememiş olduğundan bu gibi hastalarda SANDOSTATİN LAR dozunun değiştirilmesi gerekmez.Karaciğer yetmezliği:SANDOSTATİN subkütan ve intravenöz olarak kullanıldığı bir çalışmada eliminasyon kapasitesinin karaciğer sirozu vakalarında azalabildiği, yağlı karaciğer hastalıklarında ise böyle bir azalmanın söz konusu olmadığı gösterilmiştir. Karaciğer sirozu vakalarında SANDOSTATİN LAR dozunun ayarlanması, oktreotid terapötik aralığının geniş olması nedeniyle gereksizdir.Pediyatrik popülasyon:SANDOSTATİN LAR'ın çocuklarda kullanılması konusundaki deneyimlerimiz sınırlıdır.Geriyatrik popülasyon:Yaşı 65 veya daha fazla olan vakalarda subkütan SANDOSTATİN kullanılarak yapılan bir çalışmada herhangi bir doz ayarlanmasına ihtiyaç duyulmamış olduğundan bu hasta grubunda SANDOSTATİN LAR dozunun ayarlanmasına ihtiyaç yoktur.4.3.KontrendikasyonlarOktreotide veya herhangi bir yardımcı maddeye karşı bilinen aşırı duyarlılığı olan hastalarda kontrendikedir.4.4.Özel kullanım uyarıları ve önlemleriGenel:Büyüme hormonu salgılayan hipofiz tümörleri bazen büyüyerek görme alanı kusurları gibi ağır komplikasyonlara neden olabildiğinden, bütün hastaların dikkatle izlenmesi şarttır. Tümörün büyüdüğünü gösteren kanıtlar ortaya çıkarsa, daha başka tedavi yaklaşımlarına başvurulması önerilir. Akromegalik kadın hastalarda büyüme hormonu (GH) düzeylerindeki azalmanın terapötik yararları ve insülin benzeri büyüme faktörü 1 (IGF-1) konsantrasyonunun normale dönmesi fertilitenin yeniden oluşmasını sağlayabilmektedir. Oktreotid ile uzun süreli tedavilerde hastalarda tiroid fonksiyonları izlenmelidir. Kardiyovasküler ilişkili olaylar: Seyrek bradikardi vakaları bildirilmiştir.Beta-blokörler, kalsiyum kanal blokörleri, veya sıvı kontrol eden ve elektrolit dengeleyici ajanlar gibi ilaçların doz ayarlanması gerekebilir. Safra taşları ve ilişkili olaylar: Uzun süre subkütan SANDOSTATİN kullanan hastaların %15-30 kadarında safra taşlarının geliştiği bildirilmiştir. Genel popülasyonda yaygınlık oranı (40 ila 60 yaş arası) yaklaşık % 5-20 arasındadır. Akromegali veya gastro-entero-pankreatik tümör vakalarının uzun süre SANDOSTATİN LAR ile tedavi edilme sonuçları, bu formülasyonun subkütan formülasyona kıyasla safra taşı insidansında artış yapmadığı izlenimini vermektedir. Yine de SANDOSTATİN LAR tedavisine başlanmadan önce ve daha sonra da her 6 ayda bir safra kesesinin ultrasonla muayenesi önerilir. Safra taşı gelişecek olursa, genellikle asemptomatiktir; Semptom veren safra taşları ise ya ameliyatla ya da safra asitlerinin kullanıldığı eritme tedavisiyle tedavi edilmelidir (bkz 'SANDOSTATİN LAR tedavisi sırasında safra taşı gelişme riskiyle ilgili olarak alınacak önlemleri içeren tedavi önerileri). Glukoz metabolizması: Büyüme hormonu, glukagon ve insülin salgılanmasını inhibe etmesi nedeniyle SANDOSTATİN LAR glukoz kontrolünü etkileyebilir. Öğün sonrası glukoz toleransı bozulabilir. SANDOSTATİN subkütan ile tedavi edilen hastalarda bildirildiği gibi bazı vakalarda, kronik uygulamanın sonucu olarak inatçı hiperglisemi durumu gelişebilir. Aynı zamanda Tip I diabetes mellitusu olan hastalarda, SANDOSTATİN LAR muhtemelen glikoz regülasyonu üzerine etki eder ve insülin gereksinimini azaltabilir. Non-diyabetik ve kısmi bozulmamış insülin rezervli Tip II diyabetiklerde SANDOSTATİN s.c. uygulanması öğün sonrası gliseminin artması ile sonuçlanır. Böylece bu hastalarda glikoz toleransının ve antidiabetik tedavinin izlenmesi önerilir. Büyüme hormonu (GH) ve glukagon salgısını inhibe etme gücünün insüline kıyasla daha fazla olması ve insülin üzerindeki inhibitör etkisinin daha kısa sürmesi nedeniyle oktreotid, hipogliseminin süresini ve derinliğini artırabilir. Bu hastalar yakından izlenmelidir. Beslenme: Oktreotid, bazı hastalarda diyet ile alınan yağların emilimini değiştirebilir. Oktreotid tedavisi kullanan bazı hastalarda, azalmış vitamin B12 düzeyleri ve anormal Schilling testleri gözlemlenmiştir. Vitamin B12 eksikliği hikayesi olan hastalarda SANDOSTATİN LAR ile tedavi süresince vitamin B12 seviyelerinin izlenmesi tavsiye edilir. Bu tıbbi ürün her <doz>unda 1mmol(23mg)'dan az sodyum ihtiva eder; yani esasında "sodyum içermez". 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriOktreotidin barsaklardaki siklosporin emilimini azalttığı ve simetidin emilimini geciktirdiği bulunmuştur.Oktreotid ve bromokriptinin birlikte kullanılması, bromokriptin biyoyararlanımını artırır. Limitli sayıda yayınlanmış literatür somatostatin analoglarının, büyüme hormonunun baskılanması sonucu sitokrom P450 enzim sistemi ile metabolize edildiği bilinen bileşiklerin metabolik klirensini azaltabildiğini göstermektedir. Oktreotid'in bu etkiye sahip olabileceği göz ardı edilemeyeceğinden başlıca CYP3A4 yoluyla metabolize olan diğer ilaçlardan düşük terapötik indekse sahip olanların (kinidin, terfenadin) dikkatli kullanılması gerekir. Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlara ilişkin veri bulunmamaktadır.Pediyatrik popülasyon:Pediyatrik popülasyonlara ilişkin veri bulunmamaktadır.4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi B'dir.Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)SANDOSTATİN LAR için, gebeliklerde maruz kalmaya iliskin klinik veri mevcut değildir.Hayvanlar üzerinde yapılan calısmalar, gebelik / embriyonal / fetal gelisim / doğum ya da doğum sonrası gelisim ile ilgili olarak doğrudan ya da dolaylı zararlı etkiler olduğunu göstermemektedir (bkz. kısım 5.3). Okreotid tedavisi boyunca eğer gerekli ise çocuk doğurma potansiyeli olan bayan hastalar için uygun kontrasepsiyon kullanılması tavsiye edilmelidir. Gebelik DönemiGebe kadınlara verilirken tedbirli olunmalıdır.Gebe kadınlar üzerinde yeterli ve iyi kontrollü çalışmalar yapılmamıştır. Pazarlama sonrası deneyimde, akromegalisi olan hastalarda maruziyetin gerçekleştiği sınırlı sayıda gebelik bildirilmiştir; bununla birlikte vakaların yarısında gebelik sonuçları bilinmemektedir. Kadınların büyük kısmı gebeliğin ilk trimesterinde 100 ila 300 mikrogram/gün SANDOSTATİN s.c. ya da 20 ila 30 mg/ay SANDOSTATİN LAR doz aralıklarında oktreotide maruz kalmıştır. Sonucu bilinen vakaların yaklaşık üçte ikisinde kadınlar gebelikleri sırasında oktreotid tedavisine devam etmeye karar vermiştir. Sonucu bilinen vakaların büyük kısmında normal yenidoğanlar bildirilmiştir; fakat ilk trimesterde birkaç spontan düşük ve az sayıda indüklenmiş düşük bildirilmiştir. Gebelik sonuçlarının bildirildiği vakalarda, oktreotid kullanımına bağlı konjenital anomalilere ya da malformasyonlara rastlanmamıştır. Yapılan hayvan çalışmaları, belirli oranda geçici fizyolojik büyüme geriliği dışında, gebelik, embriyonal/fötal gelişim, doğum ya da doğum sonrası gelişim açısından doğrudan ya da dolaylı zararlı etkilere işaret etmemektedir (bkz. bölüm 5.3 Klinik öncesi güvenlilik verileri). SANDOSTATİN gebe kadınlara ancak zorlayıcı koşulların olması durumunda reçete edilmelidir (ayrıca bkz. bölüm 4.4 Özel kullanım uyarıları ve önlemleri). Laktasyon dönemiOktreotidinin insan sütüyle atılıp atılmadığı bilinmemektedir. Hayvanlar üzerinde yapılan çalısmalar, oktreotidinin sütle atıldığını göstermektedir. SANDOSTATİN LAR tedavisi sırasında emzirme yapılmamalıdır.Üreme yeteneği/Fertilite:Dişi sıçanlarda yapılan ve hergün 1 mg/kg'a kadar çıkabilen subkütan dozların kullanıldığı pre-peri ve postnatal çalışmalar ve fertilite çalışmaları, hayvanın üreme performansında ve yavrunun gelişmesinde herhangi bir advers etki göstermemiştir. Yavruların fizyolojik büyümesinde gözlemlenen bir miktar gecikme, geçici olmuş ve aşırı farmakodinamik aktiviteden kaynaklanan büyüme hormonu inhibisyonuna bağlanmıştır (bkz. Bölüm 5.3 Klinik öncesi güvenlilik verileri).4.7.Araç ve makine kullanımı üzerindeki etkilerSANDOSTATİN LAR'ın araç ve makine kullanma yeteneği üzerindeki etkileri konusunda herhangi bir veri mevcut değildir.4.8.istenmeyen etkilerOktreotid tedavisi boyunca rapor edilen en sık yan etkiler gastrointestinal hastalıklar, sinir sistemi hastalıkları, hepato-bilier hastalıklar ve metabolizma ve beslenme hastalıkları içermektedir.Oktreotid uygulamaları ile klinik uygulamada rapor edilen çok yaygın yan etkiler diyare, karın ağrısı, bulantı, bağırsakta aşırı gaz, safra kesesi taşı, hiperglisemi ve kabızlık. Diğer yaygın rapor edilen yan etkiler baş dönmesi, lokal enjeksiyon bölgesi ağrısı,safra çamuru,tiroid disfonksiyonu(tiroid stimule eden hormonun(TSH), Total T4 ve serbest T4'ün azalması vs), gevşek dışkı,glukoz toleransının bozulması,kusma, iştahsızlık,ve hipoglisemi. Seyrek vakalarda gastrointestinal yan etkiler akut ileusu taklit edebilir ve hastanın karnında gittikçe fazlalaşan şişlik, şiddetli epigastrik ağrı, hassasiyet ve defans görülebilir. Dışkıdaki yağ miktarı artabilirse de uzun süreli oktreotid tedavisinin malabsorpsiyon sonucu beslenme eksikliklerine yol açabildiğini gösteren hiçbir kanıt yoktur. Subkütan SANDOSTATİN tedavisine başlanmasını izleyen ilk saatlerde veya günlerde çok seyrek olarak akut pankreatit gelişebildiği ve ilacın bırakılması ile düzeldiği bildirilmiştir. Ayrıca, uzun süre subkütan SANDOSTATİN kullanan hastalarda kolestazisin indüklediği pankreatit gelişebildiği bildirilmiştir. Akromegali ve karsinoid sendromlu hastalarda QT uzaması, aks değişiklikleri, erken repolarizasyon, düşük voltaj, R/S değişimleri, erken R dalgası progresyonu ve non-spesifik ST-T dalga değişiklikleri gibi EKG değişiklikleri bildirilmiştir. Ancak bu olaylarla oktreotid asetatın ilişkisi tespit edilememiştir çünkü birçok akromegalik ve karsinoid hastada altta yatan kardiyak hastalıklar bulunmaktadır (bkz. Bölüm 4.4 Özel kullanım uyarıları ve önlemleri). Aşağıdaki yan etkiler ,oktreotidle yapılan klinik çalışmalardan ve kendiliğinden bildirilen yan etkilerden toplanmıştır: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek >.1/10.000 ila <1/1000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Her sıklık grubu içinde advers reaksiyonlar azalan ciddiyet sırasıyla dizilmiştir. Endokrin hastalıklarıYaygın: Hipotroidizm, troid disfonksiyonu(tiroid stimule eden hormonun(TSH), Total T4 ve serbest T4'ün azalması vs)Metabolizma ve beslenme hastalıklarıÇok yaygın: HiperglisemiYaygın: Hipoglisemi, glukoz tolerans bozukluğu, anoreksia, Yaygın olmayan:Dehidratasyon Sinir sistemi hastalıkları:Çok yaygın: Baş ağrısı Yaygın: Baş dönmesiKardiyak hastalıklarıYaygın:Bradikardi Yaygın olmayan: TaşikardiSolunum, göğüs bozuklukları ve mediastinal hastalıklarıYaygın:DispneGastrointestinal hastalıklarıÇok yaygın:Diyare, karın ağrısı, bulantı, kabızlık, barsakta aşırı gaz. Yaygın: Dispepsi, kusma, karında şişkinlik, steatore, gevşek dışkı, renksiz dışkı.Hepato-bilier hastalıklarıÇok yaygın: Safra taşları.Yaygın: Kolesistit, safra çamuru, hiperbilüribinemi. Deri ve derialtı doku hastalıklarıYaygın: Kaşıntı, lokal kızarıklık, geçici saç dökülmeleri.Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarÇok yaygın: Lokal enjeksiyon bölgesinde ağrıAraştırmalar:Yaygın: Transaminaz seviyelerinde artışPazarlama sonrası deneyim: Spontan oluşmuş yan etkiler gönüllü olarak rapor edilmiştir, sıklık veya ilaç etkileşimi ile ilişkisini güvenle yayınlamak her zaman mümkün değildir. Bağışıklık sistemi hastalıkları:Anafilaksi, alerji/aşırı hassasiyet reaksiyonlarıKardiyak hastalıkları:AritmiHepato-bilier hastalıkları:Akut pankreatit, kolestazın eşilik etmediği akut hepatit, kolestatik hepatit, kolestaz, sarılık hastalığı, kolestatik sarılık.Deri ve deri altı doku hastalıkları:ÜrtikerAraştırmalar:Alkalin fosfataz seviyesinde artış, gama glutamil transferaz seviyesinde artış.4.9. Doz aşımı ve tedavisiSınırlı sayıda SANDOSTATİN LAR'ın kazara alınan aşırı dozları rapor edilmiştir. Dozlar ayda 100 mg ila 163 mg SANDOSTATIN LAR arasında değişmektedir. Rapor edilen tek yan etki sıcak basmasıdır.Kanser hastalarının ayda 60 mg ve 2 haftada 90 mg'a kadar kullandığı SANDOSTATİN LAR dozları bildirilmiştir. Genelde dozlar iyi tolare edildiyse de aşağıdaki yan etkiler rapor edilmiştir: sık idrar kaçırma, yorgunluk, depresyon, anksiyete, konsantrasyon eksikliği. Doz aşımında semptomatik tedavi uygulanmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grubu: Büyüme hormonu inhibitörü ATC kodu: H01CB02.Oktreotid, doğal somatostatinin, benzer farmakolojik etkilere sahip olan, ancak etki süresi çok daha uzun, sentetik bir oktapeptit türevidir. Patolojik olarak artmış bulunan büyüme hormonu(GH) ve gastro-entero-pankreatik (GEP) endokrin sistemdeki serotonin ve peptit salgılanmasını inhibe eder. Hayvanlarda, oktreotid, somatostatine göre daha güçlü bir GH, glukagon ve insülin salımı inhibitörüdür ve GH ve glukagon supresyonu açısından daha yüksek bir seçiciliğe sahiptir. Sağlıklı insanlarda oktreotidin, aynen somatostatin gibi aşağıdaki inhibitör etkilere sahip olduğu gösterilmiştir: -arginin, efor ve insüline bağlı hipoglisemi etkisiyle uyarılan büyüme hormonu salgılanmasını -yemek sonrası insülin, glukagon, gastrin ve gastro-entero-pankreatik (GEP) sistemindeki diğer peptitlerin salgılanmasını: argininle uyarılan insülin ve glukagon salgısını - Tirotropin serbestleştirici faktör (TRH) etkisiyle uyarılan tiroid stimülan hormon (TSH) salgılanmasını Oktreotid somatostatinin aksine, insülinden çok büyüme hormonunu inhibe eder ve oktreotid kullanımını, hormonlarda (örneğin akromegalide büyüme hormonunda) rebound salgılanma izlemez. Akromegali vakalarında SANDOSTATİN LAR (4 hafta arayla kullanıma uygun, galenik bir oktreotid formülasyonu), sabit ve terapötik oktreotid serum konsantrasyonları sağlayarak hastaların çok büyük bir bölümünde büyüme hormonu düzeylerini azaltır ve IGF 1 serum konsantrasyonlarını normalleştirir. SANDOSTATİN LAR, hastaların hemen hepsinde baş ağrısı, terleme, parestezi, yorgunluk, kemik ağrıları ve karpal tünel sendromu gibi klinik akromegali semptomlarını belirgin şekilde azaltır. Daha önceden tedavi edilmemiş, büyüme hormonu salgılayan hipofiz adenomu olan akromegali hastalarında, SANDOSTATİN LAR tedavisinin hastaların önemli bölümünde(%50), tümör hacmini >%20 küçülttüğü bildirilmiştir. Gastro-entero-pankreatik endokrin sistemde fonksiyonel tümör olan hastalarda SANDOSTATİN LAR tedavisi, arka plandaki patolojiyle bağlantılı semptomların sürekli kontrol altına alınmasını sağlar. Oktreotidin farklı gastro-entero-pankreatik tümörlerdeki etkileri: Karsinoid tümörler: Oktreotid verilmesi, özellikle ishal ve deride kızarıklık olmak üzere hastalığın semptomlarının düzelmesiyle sonuçlanabilir. Birçok vakada buna plazma serotonin düzeylerinin ve idrarla atılan 5-hidroksiindol asetik asit (5-HIAA) düzeylerinin azalması eşlik eder. VIPoma: Vazoaktif intestinal polipeptitin (VIP) aşırı miktarda yapılması, bu tümörlerin biyokimyasal karakteristiğidir. Vakaların büyük çoğunluğunda oktreotid, bu durumun tipik özelliği olan,şiddetli sekretuvar ishali ortadan kaldırarak yaşam kalitesini düzeltir. Bunu, ishale eşlik eden hipokalemi gibi elektrolit anormalliklerinin düzelmesi ve böylelikle de gerek enteral gerekse parenteral elektrolit takviyesine ihtiyaç kalmaması izler. Bazı hastalardaki bilgisayarlı tomografi sonuçları tümörün büyümesinin yavaşladığı veya durduğu, hatta tümörün ve özellikle de karaciğerdeki metastazların küçüldüğü izlenimini vermektedir. Plazma VIP düzeylerinin normal sınırlara inmesine genellikle klinik düzelme eşlik eder. Glukagonoma: Oktreotid verilmesi hemen bütün vakalarda, bu tümörlerin karakteristik belirtisi olan nekrotik gezici deri döküntüsünün önemli ölçüde düzelmesiyle sonuçlanır. Oktreotidin, yine glukagonoma vakalarında sık görülen bir durum olan hafif diabetes mellitus üzerindeki etkisi belirgin değildir ve genelde bu tedavi, insülin ya da oral hipoglisemik ilaç dozlarının azaltılmasına ihtiyaç doğurmaz. Oktreotid, hastalarda ishali düzeltir ve hastanın kilo almasını sağlar. Oktreotid verilmesi plazma glukagon düzeylerini gerçi hemen düşürürse de bu azalma, uzun süreli kullanımlarda, semptomatik düzelmenin varlığını sürdürmesine rağmen genellikle devam etmez. Gastrinoma/Zollinger-Ellison sendromu: H2-reseptör blokerleriyle veya proton pompası inhibitörleriyle uygulanan tedavi, mide asidinin gastrin tarafından devamlı uyarılma sonucu aşırı salgılanmasına bağlı peptik ülserasyonu kontrol altına alırsa da bu kontrol, tam olmayabilir. Bu hastalarda ishal de, söz konusu tedaviyle tam olarak geçmeyebilir. Tek başına veya proton pompası inhibitörleriyle ya da H2-reseptör antagonistleriyle birlikte oktreotid kullanılması, mide asitinin aşırı salgılanmasını engelleyebilir ve ishal dahil semptomları düzeltebilir. Muhtemelen tümörün yaptığı peptitlere bağlı diğer semptomlar, örneğin deride kızarma da geçebilir. Bazı hastalarda plazma gastrin düzeylerinde azalma elde edilir. İnsülinoma: Oktreotid verilmesi, dolaşımdaki immünoreaktif insülin düzeylerini azaltır. Tümörleri ameliyatla alınmaya elverişli (operabl) olan hastalarda oktreotid, ameliyat öncesinde normoglisemi sağlayabilir ve bunu devam ettirebilir. Ameliyatı olanaksız ya da habis tümörü olan hastalarda glisemi kontrolu, dolaşımdaki insülin düzeylerinde sürekli bir azalma sağlanmasa bile düzelebilir. GRFoma: Ender görülen bu tümörlerde diğer aktif peptitlerle birlikte veya tek başına büyüme hormonu serbestleştirici faktör (GRF) yapılmasıyla özellik kazanır. Oktreotid, sonuçta gelişen, tedaviye dirençli akromegalinin belirti ve semptomlarında düzelme sağlar. Bu düzelme olasılıkla, GRF ve büyüme hormonu salgılanmasının inhibisyonuna bağlıdır ve bunu, hipofizin büyümesinin azalması izleyebilir. 5.2. Farmakokinetik özellikler Genel özellikler:Flakonlar, beyaz ila kırık beyaz renkte toz halinde etkin madde içerir. Enjeksiyonluk süspansiyon için verilen çözücü berrak ve renksizdir.Emilim:Bir tek intramusküler SANDOSTATİN LAR enjeksiyonundan sonra serum oktreotid konsantrasyonu, sonraki 1 saat içinde geçici olarak maksimal değerlere yükselir ve bunu, oktreotid düzeylerinin 24 saat içerisinde ölçülemeyen değerlere indiği bir dönem izler. Birinci gündeki bu maksimal düzeyden sonraki 7 gün boyunca hemen bütün hastalardaki oktreotid düzeyleri subterapötik değerlerde kalır ve daha sonra tekrar yükselerek 14. gün dolayında bir plato çizmeye başlar ve sonraki 3-4 hafta boyunca nispeten sabit kalır. 1. gün elde edilen maksimal düzey, plato fazındakinden daha düşüktür ve ilk gün total dozun en çok %0.5'i salıverilir. Yaklaşık 42. günden sonra oktreotid konsantrasyonları yavaş yavaş azalır ve bu, dozaj formundaki polimer matriksin terminal parçalanma fazına eşlik eder. Akromegali vakalarında 10, 20 ve 30 miligramlık tek doz SANDOSTATİN LAR uygulamalarından sonraki ortalama oktreotid plato düzeyleri, sırasıyla litrede 358, 926 ve 1710 nanogram olarak ölçülmüştür. 4 hafta arayla yapılan 3 enjeksiyondan sonra elde edilen kararlı serum düzeyleri, bu değerlerden yaklaşık 1.6-1.8 kat daha yüksek olup 20 ve 30 miligramlık çoklu SANDOSTATİN LAR enjeksiyonlarından sonra sırasıyla 1557 ve 2384 nanogram olarak ölçülmüştür. Karsinoid tümör vakalarında 4 hafta arayla uygulanan 10, 20 ve 30 miligramlık çoklu SANDOSTATİN LAR enjeksiyonlarından sonra serumdaki ortalama (ve median) kararlı oktreotid düzeyleri de yine doz arttıkça yükselmiş ve sırasıyla litrede 1231 (894), 2620 (2270) ve 3928 (3010) nanogram bulunmuştur. Dağılım:Oktreotidin kararlı düzeylerdeki dağılım hacmi 0.27 litre/kg'dır. Plazmadaki oktreotidin %65 kadarı proteinlere bağlanır ve kan hücrelerine bağlanma, söz konusu değildir. Biyotransformasyon:SANDOSTATİN LAR enjeksiyonunu izleyen farmakokinetik oktreotid profili, polimer matriksten gerçekleşen salıverilmeyi ve bu matriksin biyodegradasyonunu yansıtır. Sistemik dolaşıma salıverilen oktreotid, bilinen ve subkütan uygulama sonrası için anlatılan farmakokinetik özelliklerine uygun olarak dağılır. Eliminasyon:Total vücut klirensi 160 ml/dakikadır. Doğrusallık/Doğrusal Olmayan:28 aya kadar uzayabilen süreler boyunca 4 haftada bir yapılan SANDOSTATİN LAR uygulamalarından sonra vücutta oktreotid, salıverme profillerinin üstüste gelmesiyle beklenenden daha fazla birikmemiştir. Hastalardaki karakteristik özelliklerBu bölüme ait bilgi bulunmamaktadır.5.3. Klinik öncesi güvenilirlik verileriAkut toksisite:Farelerdeki akut toksisite çalışmaları oktreotid LD50 değerlerinin intravenöz yoldan 72, subkütan yoldan 470 mg/kg olduğunu göstermiştir. Sıçanlardaki akut intravenöz LD50 değeri ise 18 mg/kg bulunmuştur. Oktkeotid asetat, intravenöz bolus olarak vücut ağırlığının her kilogramı başına 1 miligrama kadar yükselen dozlarda iyi tolere edilmiştir. Tekrarlanan doz toksisitesi: Sıçanlarda 21 hafta boyunca her 4 haftada bir uygulanan intramusküler tekrarlanan doz çalışmalarında 50 miligramlık mikrosferlerdeki 2.5 mg SANDOSTATIN LAR 26. haftadaki otopsi ile kendisine ait herhangi bir otopsi bulgusuna neden olmamıştır.. Tedavi ve kontrol grubu hayvanlarında enjeksiyon yerinde karşılaşılan histopatolojik değişiklikler, bu çalışmada karşılaşılan tek önemli gelişme olmuş ve mikrosferlerin etkisiyle reversibl granülomatöz miyozit meydana gelmiştir. Tavşanlara ve sıçanlara intramusküler olarak bir tek SANDOSTATIN LAR enjeksiyonundan sonra mikrosferlerin biyodegradasyonu, her iki türde de 75 gün sonra tamamlanmıştır. Mutajen etki: Octreotide ve/veya metabolitleri, in vitroin vitroin vivoin vitrobakteri tekniğiyle incelenen mikrosferlerde mutajen potansiyel gözlemlenmemiştir.Karsinojenik etki/kronik toksisite: 12.5 mg/kg'a kadar çıkabilen günlük subkütan SANDOSTATIN dozları verilen farelerde subkütan enjeksiyon yerinde, 52, 104 ve 113/116 hafta sonra öncelikle erkek hayvanlarda olmak üzere fibrosarkoma geliştiği gözlemlenmiştir. Lokal tümörlere kontrol hayvanlarında da rastlanmış, ancak bu tümörler, enjeksiyon yerindeki sürekli irritan etkiden kaynaklanan ve asidik laktik asit/mannitol taşıyının etkisiyle şiddet kazanan bozuk fibroplaziye bağlanmıştır. Nonspesifik tabiattaki bu doku reaksiyon, sıçanlara özgü gözükmektedir. Ne 98 hafta boyunca hergün 2 mg/kg'a kadar yükselen subkütan SANDOSTATIN enjeksiyonlarının uygulandığı farelerde ne de 52 hafta süreyle hergün subkütan dozlar verilen köpeklerde neoplastik lezyonlar gözlemlenmiştir. Sıçanlarda subkütan SANDOSTATIN kullanılarak yapılan 116 hafta süreli karsinojenik etki çalışmasında uterus endometrium kanserlerine rastlanmış ve bunların sıklığı, en yüksek doz olan günde 1.25 mg/kg kullanılan hayvanlarda istatistiksel olarak anlamlı düzeye erişmiştir. Bu bulguya endometrit insidansının artması, overlerdeki corpus luteum sayılarının azalması, meme adenomlarında azalma ve uterusta, hormonal bir dengesizlik izlenimini veren glandüler dilatasyon ve lumen dilatasyonu eşlik etmiştir. Elimizdeki bilgiler sıçanlardaki bu endokrin bağlantılı tümörlerin bu hayvan türüne özgü olduğunu ve ilacın insanlarda kullanılmasını ilgilendirmediğini açıkça göstermektedir. Üreme toksisitesi: Dişi sıçanlarda yapılan ve hergün 1 mg/kg'a kadar çıkabilen subkütan dozların kullanıldığı pre-peri ve postnatal çalışmalar ve fertilite çalışmaları, hayvanın üreme performansında ve yavrunun gelişmesinde herhangi bir advers etki göstermemiştir. Yavruların fizyolojik büyümesinde gözlemlenen bir miktar gecikme, geçici olmuş ve aşırı farmakodinamik aktiviteden kaynaklanan büyüme hormonu inhibisyonuna bağlanmıştır. 6. FARMASÖTİK ÖZELLİKLER6.1.Yardımcı maddelerin listesiPoli (DL-laktit-ko-glikolit) 566.4 mg Steril mannitol122.9 mgÇözücü içeren şırınga (parenteral kullanım): Sodium karboksimetil selüloz12.5 mg Mannitol15 mg Enjeksiyonluk suk.m.(yaklaşık2.5ml) 6.2.GeçimsizliklerEnjeksiyonluk SANDOSTATİN LAR mikrokapsülleri, diğer ürünlerle karıştırılmaksızın, tek başına kullanılan bir üründür. Bu nedenle, diğer ürünlerle geçimsizlik konusunda herhangi bir veri elde edilmemiştir.6.3.Raf ömrü36 ay6.4.Saklamaya yönelik özel tedbirler2°-8° C arasında buzdolabında saklayınız.Işıktan korumak için flakonu kutunun içinde saklayınız. SANDOSTATİN LAR, enjeksiyon günü 25°C'nin altındaki oda sıcaklığında kalabilir. Ancak süspansiyon intramusküler enjeksiyondan hemen önce hazırlanmalıdır. 6.5.Ambalajın niteliği ve içeriğiRenksiz cam flakon.Lastik tıpa ve koyu mavi renkli flip-off aluminyum kapak. SANDOSTATİN LAR 30 mg mikrokapsül içeren flakon + çözücü içeren şırınga 40 mm'lik 19 numara 2 iğne ). 6.6.Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerÜrünün uygulanması ile ilgili daha detaylı bilgi için bölüm 4.2 Pozoloji ve uygulama şekli bölümüne bakınız.SANDOSTATİN LAR i.m.kullanma talimatı Yalnızca derin intragluteal enjeksiyon içindir. 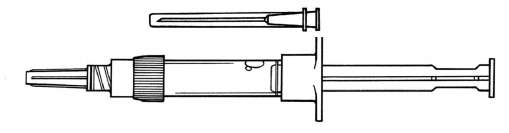 Çözücü içeren şırınga + 2 iğne
Çözücü içeren şırınga + 2 iğne
içerik: 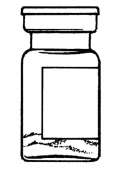 SANDOSTATİN LAR flakon
SANDOSTATİN LAR flakonSANDOSTATİN LAR süspansiyonu uygulamadan hemenönce hazırlanmalıdır. SANDOSTATİN LAR sadece eğitimli sağlık personeli tarafından uygulanmalıdır.SANDOSTATİN LAR ^akonu ve çözücü içeren şırıngayı oda sıcaklığına ulaşması için bekletiniz. 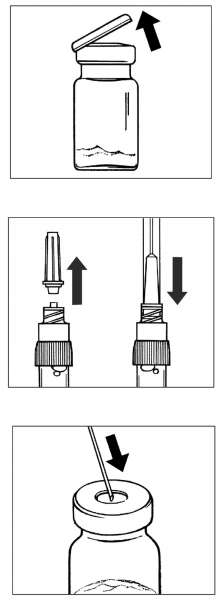 Kapağı çözücü içeren şırınganın üzerinden alın. Mevcut iğnelerden birini şırıngaya tutturun. Flakonun kauçuk tapasını alkollü bir pamuk ile dezenfekte edin. İğneyi SANDOSTATİN LAR flakonunun kauçuk tapasının merkezinden batırın. Çözücünün tamamını, SANDOSTATİN LAR tozuna temas etmeden ve yavaşça flakon iç duvarına doğru akıtarak enjekte edin. Çözücüyü doğrudan toz içine enjekte etmeyin. İğneyi flakondan geri çekin. 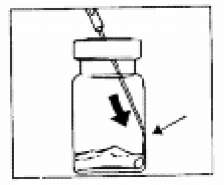 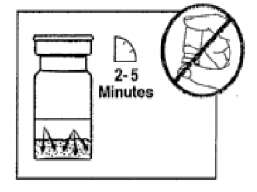 şişeye dokunmayınFlakonu tersyüzetmedenduvarlardaki ve şişe dibindeki tozları kontrol edin. Kuru lekeler varsa, dokunmadan ıslatmayı sürdürün. Bu aşamada enjeksiyona hazırlayın. 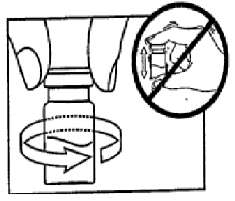 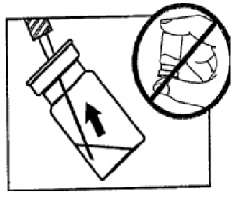 şişeyi kuvvetlice çalkalamayın.İğneyi derhal kauçuk tıpaya yeniden batırın ve ardından flakonu yaklaşık 45° yana eğerek flakon içeriğini yavaşça şırınga içine çekin. Şırıngayı doldururken içeri çekilecek miktarı etkileyebileceğindenflakonu tersyüz etmeyin.İğneyi, verilen diğer iğneyle derhal değiştirin. Uygulama süspansiyon hazırlandıktan hemen sonra yapılmalıdır. Süspansiyonun homojenliğini devam ettirmek için gerektiği üzere şırıngayı hafifçe tersyüz edin. Şırınganın havasını alın. Enjeksiyon yerini alkollü pamuk ile dezenfekte edin. İğneyi sağ ya da sol gluteus içine sokun ve herhangi bir kan damarına giriş yapılmadığından emin olmak için geri çekin. Sabit basınçta derin Intragluteal injeksiyon yoluyla yavaşça i.m. olarak enjekte edin. İğne tıkanırsa aynı çapta ( 19 numara) yeni bir iğne takın. SANDOSTATIN LAR yalnızca intragluteal enjeksiyon yoluyla uygulanmalı asla intravenöz verilmemelidir. Bir kan damarına giriş olduğunda, yeni bir iğne takın ve başka bir enjeksiyon yeri seçin. 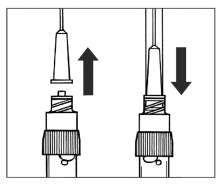 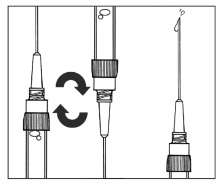 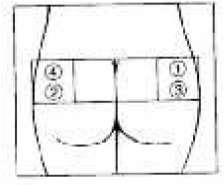 SANDOSTATİN LAR yalnızca derin intragluteal enjeksiyonla uygulanmalı ve asla intravenöz verilmemelidir. Eğer bir kan damarı delinecek olursa,yeni bir iğne kullanılarakdiğer bir enjeksiyon yeri seçilir.SANDOSTATİN LAR tedavisi sırasında safra taşı gelişme riskiyle ilgili olarak alınacak önlemleri içeren tedavi önerileri:1.Oktreotid tedavisine başlanmadan önce safra kesesi, ultrasonla muayene edilmelidir. 2.Safra kesesinin ultrasonla muayenesine, SANDOSTATİN LAR tedavisi sırasında belirli aralıklarla, tercihen her 6 ayda bir devam edilmelidir. 3.Tedavi başlangıcından önce safra taşı varsa, SANDOSTATİN LAR tedavisiyle sağlanabilecek faydalar, safra taşlarına eşlik edebilecek risklerle bir arada değerlendirilmelidir. SANDOSTATİN LAR tedavisinin önceden mevcut safra taşlarının prognozunu olumsuz yönde etkilediğini gösteren herhangi bir kanıt, bugün için mevcut değildir. 4.SANDOSTATİN LAR tedavisi sırasında safra taşı gelişen hastalarda: Asemptomatik vakalarda Fayda/risk oranı tekrar değerlendirilerek SANDOSTATİN LAR tedavisine devam edilebilir. Tedaviye devam edilen ya da tedavinin durdurulduğu hastalarda gerektiğinde sık olmak üzere hastanın izlenmesine devam edilmenin dışında başka bir işlem yapılmasına ihtiyaç yoktur. Semptomatik vakalarda Fayda/risk oranı tekrar değerlendirilerek SANDOSTATİN LAR tedavisi devam ettirilebilir veya durdurulabilir. Her iki durumda da safra taşları, semptom veren diğer herhangi bir safra taşındaki gibi tedavi edilmelidir. Tıbbi açıdan bu tedavi, taşlar tamamen kayboluncaya kadar ve ultrason tetkikleri devam etmek üzere safra asiti tedavisi (örneğin kenodeoksikolik asit [CDCA] ile birlikte ursodeoksikolik asit [UDCA] veya monoterapi şeklinde ursodeoksikolik asit [UDCA]) şeklindedir. Kullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği"ne uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİNovartis Ürünleri 34912 Kurtköy-İstanbul Tel: 0 216 560 10 00 Fax: 0 212 326 90 748.RUHSAT NUMARASI109/749.İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi:Ruhsat yenileme tarihi:-10.KÜB'ÜN YENİLEME TARİHİ |
İlaç BilgileriSandostatin LAR 30mg Microkapsül İçeren FlakonEtken Maddesi: Oktreotid Atc Kodu: H01CB02 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.