Tobi 300 mg/5 ml Nebülizör İçin İnhalasyon Çözeltisi İçeren Ampul Kısa Ürün BilgisiEnfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar » Antibakteriyel (Antibiyotik) İlaçlar » Aminoglikozidler » Diğer Aminoglikozidler » Tobramisin KISA URUN BILGISI1. BEŞERİ TIBBİ ÜRÜNÜN ADITOBI 300 mg/5 mİ nebülizör için inhalasyon çözeltisi içeren ampul2. KALİTATİF VE KANTİFATİF BİLEŞİM Etkin madde :Tobramisin 300 mg (5 mriik her ampulde)Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMNebülizör ile inhalasyon çözeltisi içeren tek kullanımlık ampul Sulu çözelti (berrak ve hafif san renkli)4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlar6 yaş ve üstündeki kistik fıbroz (KF) hastalanndaPseudomonas aeruginosa'ysibağlı kronik akciğer enfeksiyonun tedavisinde endikedir.4.2. Pozoloji ve uygulama şekliTOBI solunum yoluyla kullanmak üzere hazırlanmıştır ve parenteral kullanım içinuygun değildir.Pozoloji/uygulama sıklığı ve süresi:lljp Kullanılacak TOBI dozu yaş ve kiloya bakılmaksızın tüm hastalarda aynıdır. Yetişkinler veçocuklar (6 yaş ve üzeri) için önerilen doz, 28 gün boyunca günde iki kez bir ampuldür (tek kullanımlık 300 mg/5 mPlik ampuller). Doz aralığı mümkün olduğunca 12 saat olmalı ve 6 saatten az olmamalıdır. 28 günlük tedaviden sonra, hastalar TOBI tedavisine müteakip 28 gün ara vermelidir. 28 günlük aktif tedavi ve 28 günlük dinlenme devreleri tekrarlanmalıdır. Kontrollü Klinik Çalışmalarda TOBI Doz Rejimi
kortikosteroidleri, hava yollannı temizlemeye yönelik teknikleri içermektedir. Ek olarak hastalann yaklaşık %77'si domaz alfa kullanmaktadır. Altı yaşından daha küçük hastalarda, beklenen FEVı'i (1. saniyedeki Zorlu Ekspiratuvar Hacim) <%25 veya >%75 olan hastalarda veya Burkholderia cepaciakolonizasyonu olan hastalarda güvenlilik ve etkililik gösterilmemiştir.Tedaviye kistik fıbroz tedavisinde deneyimli bir hekim tarafından başlanmalıdır. TOBI tedavisine, hekim hastanın TOBI tedavisinden klinik yarar sağladığını düşündüğü sürece belirtilen devreler şeklinde devam edilmelidir. Akciğerlerde klinik olarak kötüleşme söz konusuysa aynca anti-psödomonal tedavi uygulanmalıdır. Klinik çalışmalar, ilaca karşı in vitrodirenç gösterildiğini belirten mikrobiyolojik raporlar bulunsa bile hastaların klinik açıdan fayda görebildiğini göstermektedir.Uygulama şekli:TOBI, folyo ambalaj içinde yer alan, her biri 300 mg tobramisin içeren tek dozluk, kullanıma hazır ampuller şeklinde satılır. Bir TOBI ampulünün içeriği nebülizöre boşaltılır, sonra elle kullanılan PARI LC PLUS tekrar kullanılabilir tip nebüHzör ve uygun bir kompresör ile yaklaşık 15 dakika solunur. Kompresörün uygun sayılması için PARI LC PLUS nebülizöre takıldığında 4-6 litre/dakika akış hızı ve/veya 110 - 227 kPa geri basınç sağlaması gerekir. Üreticilerin nebülizör ve kompresör bakımına ve kullanımına ilişkin talimatlan yerine getirilmelidir. TOBI'nin PARI LC PLUS dışındaki nebülizörlerle birlikte kullanılması yeterince araştınlmamıştır.Hastalar dik otururken veya ayakta dururken ve nebülizörün ağızlığından normal nefes alırken TOBI solunmalıdır. Hastalann ağızlanndan nefes almasına yardımcı olması için burun klipsleri kullanılabilir. Hastalar kendi standart göğüs fizyoterapisi doz rejimlerine devam etmelidir. Klinik açıdan gerekli görüldüğü takdirde uygun bronkodilatörler kullanmaya devam edilmelidir. Hastalar solunum sistemine doğrudan etkili birden fazla tedavi görüyorsa bunlann aşağıda belirtilen sıraya göre uygulanması tavsiye edilir; 1) bronkodilatör, «2) göğüs fizyoterapisi, 3)inhalasyonla kullanılan diğer tıbbi ürünler,4)son olarak TOBI.TOBI kullanımına ilişkin temel talimatlar aşağıdaki gibidir: Hazırlanması1. Ellerinizi su ve sabunla iyice yıkayın ve tam olarak kurulayın,2. Tüpün ucunu kompresörün hava çıkışına bağlayın. Tüp buraya rahatça oturmalıdır. Kompresörü elektrik prizine takın. 3. Tek bir TOBI ampulünü çıkann; alt kısmından hafifçe çekerek bağlı olduğu diğer ampullerden ayınn. 4. PARI LC PLUS nebülizörü temiz kuru kâğıt veya bez bir havlu üzerine serin. 5. Nebülizörün üst kısmını çevirerek alt kısmından ayırın ve temiz bir kâğıt veya bez bir havlunun üzerine koyun. Nebülizörün alt kısmını havlunun üzerine dik olarak koyun. 6. Ampulü bir elinize alın, diğer elinizle ampulün üstünü çevirerek açın. İçeriğim nebülizörün alt kısmına boşaltana dek ampulü sıkmamaya dikkat edin. 7. Ampul içeriğinin tamamını nebülizörün alt kısmına sıkın. 8. Nebülizörün üst kısmım geri takın. 9. Ağızlığı nebülizör çıkışına takın. İnspiratuvar valf başlığını nebülizör girişine sıkıca itin. 10. Kompresörün bağlantı borusunu nebülizörün altına bağlayın ve nebülizörü dik tutmaya dikkat edin. Boruyu sıkıca hava giriş yerine doğru bastınn. TOBI Tedavisi1. Kompresörü çalıştınn.2. Ağızlıktan buhar çıkışını kontrol edin. Buhar çıkışı yoksa, tüm tüp bağlantılannı kontrol edin ve kompresörün doğru şekilde çalıştığından emin olun. 3. Normal şekilde nefes almanıza olanak tanıyacak şekilde dik olarak oturun veya ayakta durun. 4. Ağızlığı dişleriniz ile dilinizin üstü arasına yerleştirin ve sadece ağız yoluyla normal bir şekilde nefes alıp verin. Burun klipsi kullanılması burundan değil, ağızdan nefes alıp vermenize yardımcı olmasına yardımcı olabilir. Hava akışını dilinizle bloke etmeyin. 5. TOBI çözeltisi nebülize olana ve artık buhar çıkmaymcaya kadar tedaviye devam edin. Nebülizörün alt kısmı boşaldığında bir fışkırma sesi duyulabilir. TOBI tedavisinin tamamı yaklaşık 15 dakika sürmelidir. Not: tedavi sırasında kesinti olması veya öksürme ya da dinlenme ihtiyacı duyulması halinde kompresörü kapatarak ilacın ziyan olmasını önleyin. Tedaviye yeniden başlamaya hazır olduğunuzda kompresörü yeniden çalıştınn. t6. Tedavi bittikten sonra nebülizörü üretici talimatlanna uygun olarak temizleyin ve dezenfekte edin. Tolere edilebilir en yüksek günlük doz:TOBI nin tolere edilebilir en yüksek günlük dozu saptanmamıştır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Tobramisin büyük oranda idrar yoluyla, değişmemiş olarak atılır ve böbrek fonksiyonunun tobramisine maruziyeti etkilemesi beklenir. Serum kreatinini 2 mg/dl veya üstünde olan ya da kan üre azotu (BUN) 40 mg/dl veya üstünde olan hastalar klinik çalışmalara dahil edilmemişlerdir ve bu popülasyonda TOBI'de doz değişikliği yapılması yönünde veya aleyhinde Önerileri destekleyen veri mevcut değildir, (bkz Bölüm 4.4. nefrotoksisite bölümü).cKaraciğer yetmezliği:Karaciğer yetmezliği olan hastalarda yapılmış çalışmabulunmamaktadır. Tobramisin metabolize edilmediğinden, karaciğer yetmezliğinin tobramisin maruziyetini etkilemesi beklenmez (bkz. Bölüm 5.2). Pediyatrik popülasyon:TOBI, 6 yaşın altındaki hastalarda kullanılmamalıdır.Geriyatrik popülasyon (>65 yaş):Bu popülasyonda bir doz ayarlaması yapılması yönünde veya aleyhine öneriyi destekleyen veriler yetersizdir. Yaşlı hastalarda TOBI kullanımı sırasında böbrek fonksiyonları göz önüne alınmalıdır (bkz Bölüm 4.4. nefrotoksisite bölümü).Organ transplantasyonu yapılnuş hastalar:Organ transplantasyonu yapılmış hastalarda TOBI kullanımına ilişkin yeterli veri bulunmamaktadır.4.3. KontrendikasyonlarTOBI aminoglikozitlerden herhangi birine karşı aşırı duyarlılığı olduğu bilinen hastalarda kontrendikedir.4.4. Özel kullanım uyarıları ve önlemleriOtotoksisite:Parenteral yoldan aminoglikozit uygulanan hastalarda hem işitsel (işitme kaybı) hem de vestibüler toksisite olarak ortaya çıkan ototoksisite bildirilmiştir. Vestibüler toksisite belirtileri arasında vertigo, ataksi veya sersemlik bulunabilir. Tinnitus, ototoksisitenin başlangıç bulgusu olabilir ve bu nedenle bu semptomun ortaya çıkması önlem alınmasını gerektirir. Klinik çalışmalarda TOBI tedavisi sırasında işitme kaybı şikâyeti veya odyometrik incelemelerle saptanan ototoksisite gözlenmemiştir. Pazarlama sonrası deneyimlerde, TOBI kullanan hastalarda işitme kaybı bildirilmiştir. Bunlardan bazıları önceden veya eş zamanlı sistemik aminoglikozit tedavisi görmüş hastalarda bildirilmiştir. İşitme kaybı olan hastalarda tinnitus sıklıkla bildirilmiştir. Bilinen veya şüpheli bir işitsel ya da vestibüler disfonksiyonu olan hastalara TOBI reçete edilirken dikkatli olunmalıdır. Hekimler, aminoglikozitlerin vestibüler veya kohlear toksisiteye yol açma potansiyelini dikkate almalı ve TOBI tedavisi sırasında işitme ile ilgili işlevleri uygun şekilde ölçmelidirler. Önceden uzun süreli sistemik aminoglikozit tedavisine bağlı olarak risk bulunan hastalarda, TOBI tedavisine başlanmadan önce odyolojik değerlendirme yapılması gerekebilir. Kulak çınlamasının başlaması önemli bir uyandır, çünkü ototoksisitenin uyancı belirtilerinden biridir. Eğer bir hasta aminoglikozit tedavisi sırasında kulak çınlaması veya işitme kaybı şikâyeti bildirirse hekim odyolojik inceleme yaptırmalıdır. Aynı zamanda parenteral aminoglikozit tedavisi gören hastalar, kümülatif toksisite riski dikkate alınarak klinik açıdan uygun şekilde gözlenmelidir. Serum tobramisin konsantrasyonlannın takibi ile ilgili olarak Laboratuvar testi ve takibi bölümüne bakınız. Nefrotoksisite: Parenteral aminoglikozit tedavisinde nefrotoksisiteye rastlanmıştır, ancak TOBI ile yapılan klinik çalışmalar sırasında nefrotoksisite kanıtına rastlanmamıştır. TOBI, böbrek fonksiyon bozukluğu bilinen veya şüphelenilen hastalarda dikkatli kullanılmalıdır ve tobramisin serum konsantrasyonlan gözlenmelidir. Serum tobramisin konsantrasyonlannın takibi ile ilgili olarak Laboratuvar testi ve takibi bölümüne bakınız. iŞiddetli böbrek yetmezliği olan hastalar, örneğin serum kreatinini 2 mg/dL (176,8 p.mol/L)'nin üzerinde olanlar, klinik çalışmalara dahil edilmemiştir. Mevcut klinik uygulamalara göre, böbrek fonksiyonunun alt sının incelenmelidir. Tamamlanan her altı TOBI tedavi devresinin ardından (180 günlük nebülizör ile uygulanan aminoglikozit tedavisi) üre ve kreatinin değerleri tekrar değerlendirilmelidir. Nefrotoksisiteyi gösteren bir kanıt bulunursa, serum konsantrasyonlan 2 ng/mL'nin altına düşene kadar tüm tobramisin tedavisi durdurulmalıdır. Daha sonra hekimin görüşüne göre TOBI tedavisine devam edilebilir. TOBI ve beraberinde parenteral aminoglikozit tedavisi gören hastalar kümülatif toksisite riski dikkate alınarak klinik açıdan uygun şekilde gözlenmelidir. Klinik olarak gerekli görüldüğünde de böbrek fonksiyonuna ilişkin laboratuvar testleri yapılmalıdır. Laboratuvar testleri ve takibi - serum konsantrasyonlan; Bilinen veya şüpheli işitsel veya renal fonksiyon bozukluğu olan hastalarda serum tobramisin konsantrasyonlannm takip edilmesi gerekir. TOBI kullanan hastalarda ototoksisite veya nefrotoksisite görülmesi halinde serum konsantrasyonlan 2 jig/ml'nin altmda düşene kadar tobramisin tedavisinin kesilmesi gerekir. Böbrek fonksiyonlan normal olan ve TOBI tedavisi gören hastalarda serum tobramisin konsantrasyonlannm doz uygulamasmdan bir saat sonra yaklaşık 1 |ig/ml olması gerekir. Eş zamanlı parenteral aminoglikozit tedavisi (veya böbrek atılımı etkileyebilecek diğer ilaçlan kullanan) gören hastalarda serum tobramisin konsantrasyonlannm takip edilmesi gerekir. Bu hastalar klinik olarak gerekli görüldüğünde takip edilmelidir. Serum tobramisin konsantrasyonu, parmak ucundan kan örneklemesi ile değil, sadece ven ponksiyonu ile kan örneklemesi ile takip edilmelidir. Parmak derisi ile tobramisinin temas etmesi ilacın serum düzeylerinde yanlış yüksek sonuçlar elde edilmesine yol açabilir. Bu bulaşma, testten önce ellerin yıkanmasıyla bütünüyle önlenemez. Bronko spazm: Tıbbi ürünler inhalasyon yolu ile alındığında bronkospazm meydana gelebilir. Tobramisinin nebülizör ile uygulanmasında bronkospazm meydana geldiği bildirilmiştir. İlk TOBI dozu gözetim altmda verilmeli ve eğer hastanın mevcut doz rejiminin bir parçası ise ön-nebülizasyon ile bronkodilatör ilaç kullanılmalıdır. Nebülizasyondan önce ve sonra FEVı değeri ölçülmelidir. Eğer bronkodilatör ilaç almayan bir hastada tedavinin bronkospazma yol açtığı saptanırsa, test başka bir zamanda bronkodilatör kullanarak tekrar yapılmalıdır. Bronkodilatör ilaç tedavisi sırasında bronkospazmm meydana gelmesi alerjik bir yanıtı belirtiyor olabilir. Alerjik bir yanıttan şüphelenilirse TOBI kullanımına son verilmelidir. Bronkospazm uygun bir tıbbi yöntemle tedavi edilmelidir. Nöromüsküler bozukluklar: Miyastenia gravis veya Parkinson hastalığı gibi bilinen veya şüpheli bir nöromüsküler bozukluğu olan hastalara TOBI reçete ederken dikkatli olunmalıdır. Aminoglikozidtler nöromüsküler fonksiyon üzerindeki potansiyel kürar benzeri etkileri ile kas zayıflığını artırabilir. eHemoptizi (Kan tükürme); Nebülizör ile uygulanan çözeltilerin teneffüs edilmesi, öksürük refleksini artırabilir. Aktif, şiddetli hemoptizisi olan hastalarda TOBI, sadece tedavinin faydalannın kanamayı artırma riskinden fazla olması durumunda uygulanmalıdır. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriTOBI ile yapılmış klinik ilaç etkileşimi çalışması bulunmamaktadır. Bazı diüretikler serum ve dokudaki antibiyotik konsantrasyonlannı değiştirerek aminoglikozit toksisitesini artırabilmektedir. TOBI'nin etakrinik asit, furosemid, üre veya mannitol ile eş zamanlı kullanılmaması gerekir.TOBI'nin nörotoksik, nefrotoksik veya ototoksik potansiyele sahip diğer ilaçlarla eş zamanlı ve/veya ardışık kullanımından kaçınılmalıdır. Etkileşim yokluğuTOBI ile yapılan klinik çalışmalarda TOBI ile eş zamanlı olarak domaz alfa, P agonist, inhaler kortikosteroid, diğer anti-psödomonal antibiyotikleri veya parenteral aminoglikozitleri kullanan hastalarda gözlenen advers olay profilleri çalışma popülasyonunun geneli ile benzerlik göstermiştir.Parental olarak uygulanan amino glikoziti erin olası toksisitesini artırdığı bildirilen diğer ilaçlar aşağıda belirtilmiştir: Amfoterisin B, sefalotin, siklosporin, takrolimus, polimiksin (nefrotoksisiteyi artırma riski) Platin bileşikleri (nefrotoksisiteyi ve ototoksisiteyi artırma riski) Antikolinesterazlar, botulinum toksinleri (nöromüsküler etkiler) 4.6. Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi: DÇocuk doğurma potansiyeli bulunan kadmlar/Doğum kontrolü (Kontrasepsiyon)Tobramisinin gebe kadınlarda inhalasyon yoluyla kullanımına ilişkin yeterli veri bulunmamaktadır. Amino glikoziti er gebe kadınlarda yüksek sistemik konsantrasyonlara ulaştıklannda fetusta hasara yol açabilirler (örn. konjenital sağırlık).Gebelik dönemiTOBI, gerekli olmadıkça gebelik döneminde kullanılmamalıdır.Laktasyon dönemiİnhalasyon yoluyla uygulama sonrasında anne sütüne geçen tobramisin miktan bilinmemektedir. Bebeklerde ototoksisite ve nefrotoksi s ite potansiyeli nedeniyle, ilacın anne açısından olan önemi de dikkate alınarak emzirmenin sonlandınlması veya TOBI tedavisinin sürdürülmesi konusunda bir karar verilmelidir.Üreme yeteneği/Fertilite:Hayvanlarda subkutan tobramisin uygulamasına ilişkin veriler erkek veya dişilerde fertiliteye ilişkin bir soruna veya olası bir soruna işaret etmemiştir (bkz. bölüm 5.3).4.7. Araç ve makine kullanımı üzerindeki etkilerBildirilen advers etki reaksiyonlarına göre, TOBI'nin araç ve makine kullanma üzerine etkisi olmadığı tahmin edilmektedir.4.8. İstenmeyen etkilerGüvenlilik profilinin özetiTOBI'nin güvenlilik profili iki randomize, çift kör, plasebo kontrollü çalışmada (paralel olarak yürütülmüş) ve iki ardışık açık etiketli takip çalışmasında değerlendirilmiştir. Dört çalışmanın tümünde de hastalara 28 gün ilaç kullanılan ve 28 gün ilaç kullanılmayan sikluslar halinde günde iki kez çalışma ilacı verilmiştir. Çift kör çalışmalarda hastalar TOBI veya plasebo ile tedavi gruplarına randomize edilmiştir. Açık etiketli çalışmalarda tüm hastalara TOBI verilmiştir. Plasebo kontrollü çalışmalarda 24 haftalık tedavi dönemleri uygulanmış ve çalışma serilerinin açık etiketli izlem çahşmalannı da içeren toplam süresi 96 hafta olmuştur. 24 haftalık iki çift kör çalışmayı tamamlayan 464 hastanın 396'sı açık etiketli uzatma çalışmalanna katılmıştır. Toplamda 313, 264 ve 120 hasta sırasıyla 48, 72 ve 96 haftalık TOBI tedavilerini tamamlamıştır. Bu çalışma serileri boyunca tüm hastalara çalışma ilacının yanı sıra doktorlarının takdirine göre kistik fıbroza yönelik standart bakım verilmiştir. İki paralel 24-haftalık plasebo kontrollü klinik çalışmada TOBI yaşlan 6 ila 48 arasındaki 258 kistik fibroz hastasında genel olarak iyi tolere edilmiştir. En yaygın (^olO) bildirilen advers olaylar (çalışma ilacı ile ilişkisine bakılmaksızın) ve bunlann plasebo kontrollü çalışmalardaki sıklıklan (TOBI'ye karşılık plasebo) şu şekildedir: t
%46.1'e karşılık %47.3 Sıklık%38.0'a karşılık %39.3
%37.6'ya karşılık %39.7%35.7'ye karşılık %39.3%34.5'e karşılık %33.6
%33.7'ye karşılık %38.5 %32.9^a karşılık %43.5%31.4'e karşılık %31.3
%26.7^ye karşılık %32.1
%26.0^a karşılık %29.8 Advers olayöksürük farenjitbalgamlı öksürükasteni rinit dispnepireksiakciğer hastalığıbaş ağnsıgöğüs agnsıbalgamda renk değişikliği
%21.3'e karşılık % 19.8 %19.4'e karşılık %23.7 hemoptizianoreksi %18.6^ya karşılık %27.9akciğer fonksiyon testlerinde azalma
% 1 6.3'e karşılık %15.3
%14.0'a karşılık %22.1
%12.8'e karşıhk %23.7
%15.9'a karşılık %2Q.2 %12.8'e karşılık %6.5%11.2'ye karşılık %16.0
%10.1'e karşılık %15.3
astım t
kusma kann ağnsıdisfoni bulantı kilo kaybıPlasebo grubuna kıyasla TOBI grubunda anlamlı olarak daha sık bildirilen tek advers ilaç reaksiyonu disfoni (TOBI ve plasebo tedavi gruplarında sırasıyla %12.8 ve %6.5) ve tinnitus (sırasıyla %3.1 ve %0) olmuştur. Disfoni genel olarak hafif olmuştur ve ilaç kullanılan dönemlerde daha sık görülmüştür. Tüm tinnitus olaylan geçici karakterde olmuş ve tedavinin bırakılması ile düzelmiş, işitme kaybına yol açmamıştır. Baş dönmesi gibi vestibüler advers deneyimler bildiren hastalann sayısı TOBI ve plasebo gruplannda benzer bulunmuştur. Aynca TOBI ile yapılan çift kör çalışmalarda, 8000 Hz'e kadarki işitmenin değerlendirildiği odyometrik testlerde işitme kaybı saptanmamıştır. Pazarlama sonrası deneyimde, TOBI kullanan hastalarda işitme kaybı bildirilmiştir. Bu raporlardan bazılan önceden ve eş zamanlı sistemik aminoglikozit tedavisi görmüş hastalarda bildirilmiştir. İşitme kaybı olan hastalarda tinnitus sıklıkla bildirilmiştir. ilacın piyasaya verilmesinden sonra meydana gelen aşağıdaki advers ilaç reaksiyonlan, MedDRA sistem organ smıfma göre sıralanmıştır. Advers reaksiyonlar her bir sistem organ sınıfı içinde aşağıdaki kategoriler altında azalan sıklık sırasına göre dizilmiştir (CIOMS III): Çok yaygın (^/lO); yaygın (â/100, <1/10); yaygın olmayan (^/1,000, <1/100); seyrek (^/10,000, <1/1,000); çok seyrek (<1/10,000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Enfeksiyonlar ve enfestasyonlar Yaygın:LarenjitÇok seyrek:Oral kandidiyazis, mantar enfeksiyonuKan ve lenf sistemi hastalıkları Çok seyrek:LenfadenopatiBağışıklık sistemi hastalıkları Çok seyrek:Aşın duyarlılıkMetabolizma ve beslenme hastalıkları Çok yaygın:AnoreksiyaSinir sistemi hastalıkları Seyrek:Baş ağnsı, baş dönmesi, afoniÇok seyrek:UyuklamaKulak ve iç kulak hastalıkları Yaygm:Kulak çınlamasıSeyrek:İşitme kaybıÇok seyrek:Kulak rahatsızlığı, kulak ağrısıSolunum, göğüs bozuklukları ve mediastinal hastalıkları Çok yaygın:Akciğer hastalığı, rinit, ses değişikliği, balgamda renk değişikliği, farenjit, öksürük, balgamlı öksürük, rinit, dispne, astım, kan tükürmeSeyrek:Bronkospazm, göğüste rahatsızlık hissi, burun kanamasıÇok seyrek:Hiperventilasyon, hipoksi, sinüzitGastrointestinal hastalıklar Çok yaygın:Kusma, bulantı, kilo kaybı, kann ağnsıSeyrek:Tat algısında değişiklik, ağızda ülserasyonÇok seyrek:DiyareDeri ve deri altı doku hastalıkları Seyrek:DöküntüÇok seyrek:Ürtiker, kaşıntıKas-iskelet bozuklukları, bağ doku ve kemik hastalıkları Yaygın:MiyaljiÇok seyrek:Sırt ağnsıGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklar Yaygın:Keyifsizlik, asteni, ateş, göğüs ağnsı(Seyrek:AğnAraştırmalar Çok yaygın:Akciğer fonksiyon testlerinde bozulmaAçık etiketli çalışmalarda ve ürün piyasaya çıktıktan sonra elde edilen deneyimlere göre, daha önceden uzun süreli intravenöz aminoglikozit kullanım öyküsü olan hastalarda veya TOBI ile beraber intravenöz aminoglikozit kullanan hastalarda işitme kaybı meydana gelmiştir (bkz. Bölüm 4.4). Parenteral aminoglikozitler; aşın duyarlılık, ototoksisite ve nefrotoksisite ile ilişkilendirilmiştir (bkz. Bölüm 4.3, 4,4). İki açık etiketli uzatma çalışmasında, TOBI'ye maruziyetin süresi arttıkça balgamlı öksürük ve akciğer fonksiyon testlerinde bozulma da artış; fakat disfoni insidansında düşüş gözlenmiştir. Genel olarak aşağıdaki MedDRA Sistem Organ Sınıfına (SOC) ilişkin advers olaylann insidansı TOBFye maruziyetin artmasıyla azalmıştır; Solunum, göğüs bozukluklan ve mediasten hastalıklar, Gastrointestinal hastalıklar ve Genel bozukluklar ve uygulama bölgesine ilişkin bozuklukları Spontan bildirimlerden elde edilen advers ilaç reaksiyonlarıAşağıda yer alan spontan bildirilen advers reaksiyonlar gönüllü olarak bildirilmiştir ve sıklık veya ilaca maruziyet ile nedensel ilişkinin kurulması her zaman için mümkün değildir.Kulak ve labirent bozukluklarıİşitme kaybıDeri ve subkutan doku bozukluklarıAşın duyarlılık, kaşıntı, ürtiker, döküntüSinir sistemi bozukluklarıAfoni, disgöziSolunum, toraks ve mediasten bozukluklarıBronkospazm, orofaringeal ağnm4.9. Doz aşımı ve tedavisiTOBl'nin tolere edilebilen maksimum dozu belirlenmemiştir. Tobramisin serum konsantrasyonlan doz aşımının takibinde yararlı olabilmektedir.Akut toksisite, TOBI derhal kesilerek tedavi edilmeli ve temel renal fonksiyon testleri yapılmalıdır. Tobramisinin gastrointestinal sistemden emilimi çok az olduğundan, TOBI'nin yanlışlıkla oral yoldan alınması halinde sistemik toksisite beklenmez. TOBI'nin yanhşlıkla intravenöz yoldan uygulanması halinde baş dönmesi, tinnitus, vertigo, yüksek tonda işitme keskinliği kaybı, solunum sıkıntısı, nöromüsküler blokaj ve böbrek bozukluğu gibi parenteral tobramisin doz aşımı belirti ve semptomlan ortaya çıkabilir. Hemodiyaliz tobramisinin vücuttan uzaklaştınlmasında yararlı olabilmektedir. m5. FARMAKOLOJİK ÖZELLİKLER5.L Farmakodinamik özelliklerFarmakoterapötik grup: Sistemik kullanılan antibakteriyeller - Diğer aminoglikozitler ATC kodu: JOIGBOIEtki mekanizması: Tobramisin, Streptomyces tenebrariustarafından üretilen bir aminoglikozit antibiyotiktir. Etkisini esas olarak bakteri hücresinde protein sentezini bozarak gösterir. Protein sentezinin bozulması bakteri hücre membran geçirgenliğini değiştirir, bakteri hücre duvanm ileriye dönük bozar ve sonuçta bakteri hücresinin ölümüne sebep olur. İnhibitör konsantrasyonlanna eşit veya biraz daha yüksek konsantrasyonlarda bakterisit etki gösterir.Duyarhlık Testi: Parenteral tobramisin tedavisinde kullanılan in vitroP. aeruginosaduyarlılığının takibinde kullanılabilir.Tobramisin parenteral uygulaması için bilinen duyarlılık kınima noktaları inhaler tobramisin uygulaması için geçerli değildir. Kistik fıbrozda balgamın nebülize aminoglikozitlerin lokal biyolojik etkisi üzerinde inhibitör etkisi vardır. Bu balgamdaki aerosol tobramisin konsantrasyonlannın, P. AeruginosaP. aeruginosaMİK değerinin 10 katı balgam konsantrasyonlanna ve TOBI kullanan hastalann %95'inde en yüksek MİK değerinin 25 katma ulaşılmıştır. MİK değerleri parenteral kınima noktasının üzerinde kültür suşlan olan hastalann çoğunda da klinik yarar sağlanmaktadır (bkz. Klinik çalışmalar bölümü).Farmakodinamik özellikler - mikrobiyoloji: Nebülize uygulama yolu için konvansiyonel duyarlılık sınır değerlerinin yokluğunda, organizmalan nebülize tobramisine duyarlı ve duyarlı değil şeklinde tanımlarken dikkat edilmelidir. mTOBI ile yapılan klinik çalışmalarda, başlangıçta >128 ^g/mLTik tobramisin MICTeri ile P. aeruginosaP, aeruginosaizolatma sahip hastalann klinik bir yanıt gösterme olasılığı daha düşüktür. Bununla birlikte, plasebo kontrollü çalışmalarda TOBI kullanırken ^28 jıg/mL MIC ile izolat edinmiş 13 hastadan yedisi (%54) pulmoner fonksiyonda iyileşme göstermiştir.İn vitrove/veya klinik çalışma deneyimine dayalı olarak, CF'de pulmoner enfeksiyonlarla ilişkili organizmalann TOBI tedavisine aşağıdaki şekilde yanıt vermesi beklenebilir.
P. aeruginosaP. aeruginosa''âsiP. aeruginosa'mnaynca antibiyotik uzaklaştmldığmda duyarlılığa geri dönme ile karakterize adaptif bir aminoglikozid direnci sergilediği gösterilmiştir.Klinik çalışmalar; P. aeruginosa'hkistik fıbroz hastalannda eş tasarımlı, çift kör, randomize, plasebo kontrollü, paralel grup, 24 haftalık iki klinik çalışma (Çalışma 1 ve Çalışma 2) yapılmıştır. Bu çalışmalara başlangıçtaki FEVı değeri ön görülen nonnal değerin %25 ve %75'i arasında olan520 olgu katılmıştır. Altı yaşın altında olan veya başlangıçtaki kreatinin düzeyi >2 mg/dL olan veya balgamından Burkholderia cepaciaizole edilen hastalar çalışmadan dışlanmıştır. Bu klinik çalışmalarda 258 hastaya elle kullanılan PARI LC PLUS"^^ Tekrar Kullanılabilir Nebülizör ve DeVilbiss® Pulmo-Aide® kompresör aracılığıyla ayaktan tedavi şeklinde TOBI uygulanmıştır (bkz Tablo 1).Klinik çalışmalardaki doz rejimleriTablo 1Siklus 2Siklus 3Siklus 128 gün28 gün28 gün28 gün28 gün28 gün
standart bakım
standart bakım
TOBI 300 mg BID + standart bakım
standart bakım
TOBI 300 mg B1D + standart bakım
TOBI 300 mg BID + standart bakım TOBIrejimin=258m
standart bakım
standart bakım
Plasebo BID + standart bakım
standart bakım
Plasebo BID + standart bakım
Plasebo BID + standart bakım Plaseborejimin=262Tüm hastalara kistik fıbroz hastalan için önerilen ve oral ve parenteral anti-psödomonal tedavi, p2 agonisti, kromolin, inhaler steroid ve hava yolu klirens yöntemlerini içeren standart tedaviye ek olarak TOBI veya plasebo (tatlandıncı olarak 1.25 mg kinin) verilmiştir. Aynca hastalann yaklaşık %77'sine domaz alfa (Pulmozyme®, Genentech) ile eş zamanlı tedavi uygulanmıştır. Her çalışmada TOBI ile tedavi edilen hastalann solunum fonksiyonlannda anlamlı düzeyde iyileşme gözlenmiştir. Çalışma Tde 24 haftalık süre içerisinde TOBI grubunda FEVı'de başlangıca göre yaklaşık %11 Tik bir ortalama artış gözlenirken plasebo hastalannda ortalama değişiklik olmamıştır. Çalışma 2'de TOBI ile tedavi edilen hastalarda FEVı'de yaklaşık %7 ortalama artış kaydedilirken plasebo ile tedavi edilen hastalarda yaklaşık %1 ortalama azalma kaydedilmiştir. Şekil 12-1 her iki çalışmada da 24 haftalık dönemde FEVı'deki ortalama bağıl değişikliği göstermektedir. İlaç kullanılmayan 28 günlük dönemlerde ortalama FEVı başlangıcın üzerinde seyretmiş, fakat bazen tersine de dönebilmiştir. mBaşlangıçtaki %FEVı'e göre bağıl değişiklikÇalışma 1: Plasebo (n=l 14*)Şekil 1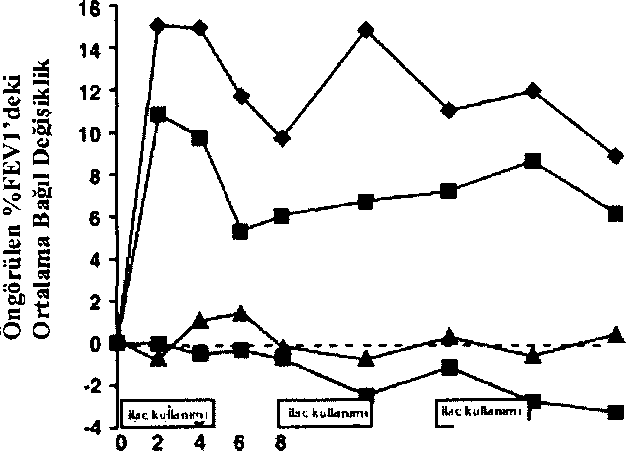 Çalışma 1: TOBI (n= 109 *)
Çalışma 1: TOBI (n= 109 *)Çalışma 2 :TOBI(n= 149*) mÇalışma 2: Plasebo (n=148*) ^ ^başlangıçtaki sayı HaftaHer çalışmada TOBI tedavisi, ilaç kullanılan dönemlerde balgamın gramı başına düşenP. aeruginosaCFU (colony forming unit) sayısında anlamlı azalmaya (Çalışma 1 'de log -1.17 ve Çalışma 2'de log -0.99 ) yol açmıştır. İlaç kullanılmayan dönemlerde balgamın bakteri yel yoğunluğu başlangıçtaki düzeylerine dönmüştür. Balgamdaki bakteri yel yoğunluktaki azalma ardışık her siklusta giderek azalmıştır (bkz Şekil 1).logio CFU'larda başlangıca göre mutlak değişiklikŞekU2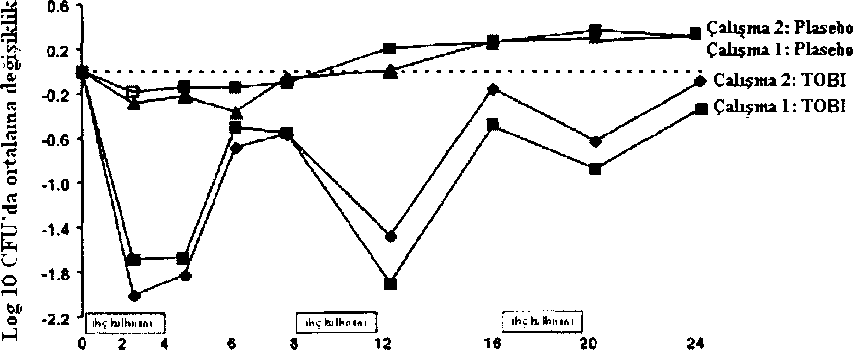 Hafta
HaftaTOBI ile tedavi edilen hastalar ortalama 5,1 gün hastanede yatarken bu oran plasebo ile tedavi edilen hastalarda 8.1 olmuştur. TOBI ile tedavi edilen hastalarda ortalama 9.6 gün parenteral anti-psödomonal antibiyotik tedavisi uygulanması gerekirken plasebo ile tedavi edilen hastalarda bu süre 14.1 gün olmuştur. Altı aylık tedavi döneminde TOBI hastalanmn %40'ı ve plasebo hastalanmn %53'ü parenteral anti-psödomonal antibiyotik ile tedavi edilmiştir. 24 haftalık iki çift kör çalışmalan tamamlayan 464 hastanm 396'sı açık etiketli uzatma çalışmalanna katılmıştır. Toplamda 313, 264 ve 120 hasta sırasıyla 48, 72 ve 96 haftalık TOBI tedavilerini tamamlamıştır. Akciğer fonksiyonundaki kaybın oranı çift kör randomize tedavi döneminde TOBI tedavisinin başlatılmasından sonra plasebo hastalanndakine kıyasla anlamlı olarak daha düşük bulunmuştur. Ortalama akciğer fonksiyonu değerleri, TOBI tedavisinin başlangıcında kaydedilenlerden yüksek (ortalama FEVı'de başlangıca göre %4.7 bağıl değişiklik) ve 96 haftaya kadar plasebo ile tedavi edilen hastalarda regresyon modelinde hesaplanandan yüksek seyretmiştir. Akciğer fonksiyonundaki kaybın regresyon modelinde hesaplanan eğimi körleştirilmiş plasebo tedavisinde -%6.52 ve TOBI tedavisi sırasında -%2.53 bulunmuştur (p^O.OOOl). Diğer Bilgiler18 aya kadar TOBI ile tedavi edilen hastalannB. cepacia, S. maltophiliaA. xylosoxidansAspergillustürleri TOBI kullanan hastalann balgamından daha sık olarak geri kazanılmıştır; ancak, Alerjik Bronkopulmoner Aspergilloz (ABPA) gibi klinik sekel nadiren ve kontrol grubundaki benzer bir sıklıkta bildirilmiştir.5.2. Farmakokinetik özelliklerGenel özelliklerTobramisin içeren TOBI, katyonik polar bir molekül olup ve epitel membranlardan kolayca geçemez.TOBI özel olarak inhalasyon yoluyla uygulanmak üzere formüle edilmiştir. TOBI'nin biyoyararlanımı nebülizör performansı ve hava yolu patolojisine bağlı olarak değişkenlik gösterebilir. TOBI uygulamasını takiben, tobramisin özellikle hava yolunda konsantre halde bulunur Emilim:TOBI inhalasyonu sonrasında tobramisine sistemik maruziyetin akciğerlere ulaştınlan doz fraksiyonunun pulmoner emiliminden kaynaklanması beklenir; çünkü tobramisin oral yoldan uygulandığında dikkate değer düzeyde emilmez. TOBI'nin biyoyararl anımı nebülizör performansı ve hava yolu patolojisindeki bireysel farklılıklara bağlı olarak değişiklik gösterebilmektedir. Balgam konsantrasyonları: İlk 300 mg TOBI dozunun inhalasyonundan on dakika sonra balgamdaki ortalama tobramisin konsantrasyonu 1,237 ^ıg/g bulunmuştur (35 ila 7,414 ]ig/g aralığında). Tobramisin balgamda birikmez; 20 haftalık TOBI rejimi tedavisinden sonra tobramisinin inhalasyondan 10 dakika sonraki ortalama balgam konsantrasyonu 1,154 jig/g (aralık: 39 ila 8,085 ^g/g'a kadar) bulunmuştur. Balgam tobramisin konsantrasyonlarında yüksek değişkenlik de gözlenmiştir. İnhalasyondan iki saat sonra balgam konsantrasyonları inhalasyondan sonraki 10. dakikada ölçülen tobramisin düzeylerinin yaklaşık %14'üne düşmüştür. Serum konsantrasyonları: Kistik fıbroz hastalarında tek bir 300 mgTık TOBI dozunun inhalasyonundan 1 saat sonraki ortalama serum tobramisin konsantrasyonu 0.95 |ıig/mL bulunmuştur (aralık: kantitasyon sınınnın altında [BLQ] - 3.62 |ig/mL). Yirmi haftalık TOBI tedavisinden sonra doz uygulamasından 1 saat sonraki ortalama serum tobramisin konsantrasyonu 1.05 jıg/mL bulunmuştur (aralık: BLQ >3.41 ^g/mL). Dafohm:TOBI uygulamasından sonra tobramisin primer olarak hava yollannda konsantre olur. Tobramisinin serum proteinlerine bağlanması ihmal edilebilir düzeydedir. Bivotransformasvon:Tobramisin metabolize edilmez ve büyük oranda idrarla değişmemiş halde atılır. Eliminasvon:Inhalasyon yolu ile uygulanan tobramisinin eliminasyonu araştırılmamıştır. İntravenöz uygulamayı takiben, sistematik olarak emilen tobramisin başlıca glomerüler fıltrasyonu yoluyla atılır. Tobramisinin serumdan eliminasyon yanlanma ömrü yaklaşık 2 saattir. Tobramisinin %10'undan azı plazma proteinlerine bağlıdır. TOBI uygulamasını takiben emilmemiş tobramisin muhtemelen başlıca çıkartılmış balgamda elimine edilir. Hastalardaki karakteristik özelliklerKaraciğer yetmezliği:Tobramisin metabolize edilmediğinden, karaciğer yetmezliğinin tobramisin maruziyetine etkisinin olması beklenmez (bkz. bölüm 4.2.). Böbrek yetmezliği:Tobramisin büyük oranda idrar yoluyla, değişmemiş olarak atılır ve böbrek fonksiyonunun tobramisine maruziyeti etkilemesi beklenir. Pedivatrik popülasvon:TOBI, 6 yaşın altındaki hastalarda kullanılmamalıdır. Geriyatrik popülasvon:Bu popülasyonda bir doz ayarlaması yapılması yönünde veya aleyhine öneriyi destekleyen veriler yetersizdir. 5.3. Klinik öncesi güvenlilik verileriPreklinik veriler güvenlilik farmakolojisi, tekrarlanan doz toksisitesi, genotoksisite veya üreme toksisitesi çahşmalan ışığında insanlardaki başlıca tehlikenin renal toksisite ve ototoksisite olduğunu göstermiştir. Tekralanan doz toksisitesi çalışmalarında, hedef toksisite organlan böbrekler ve vestibüler/koklear fonksiyonlardır. Genel olarak önerilen klinik dozda inhalasyon ile elde edilebilecek olandan daha yüksek sistemik tobramisin düzeylerinde toksisite gözlenmiştir.TOBI'nin karsinojenik potansiyelini araştıran iki yıllık bir sıçan inhalasyon toksikolojisi çalışması tamamlanmıştır. Sıçanlar 95 hafta boyunca günde 1.5 saat süresince TOBI'ye maruz bırakılmıştır. Sıçanlarda 35 jag/mL'ye varan serum tobramisin düzeyleri bulunurken, klinik çalışmalarda kistik fibroz hastalarında maksimum 3.62 p.g/mL düzeyi gözlenmiştir. Herhangi bir tümör türünün insidansmda ilaca bağlı artış gözlenmemiştir. Aynca tobramisin bir dizi in vitroin vivotestte genotoksisite yönünden de değerlendirilmiştir. Beş test suşu üzerinde gerçekleştirilen Ames bakteriyel reversiyon testinde hiç bir suşta metabolik aktivasyonlu veya aktivasyonsuz olarak revertanlarda anlamlı bir artış gösterilmemiştir. Tobramisin için fare lenfoma ileriye dönük mutasyon deneyi negatif bulunmuş; Çin hamsteri över hücrelerinde kromozomal sapmalan tetiklememiş ve fare mikronükleus testinde negatif bulunmuştur.İnhalasyon yoluyla uygulanan tobramisin ile üreme toksikolojisi çalışması yapılmamıştır. Fakat tobramisinin organogenez sırasında 100 (sıçan) veya 20 (tavşan) mg/kg/gün dozlannda subkutan yoldan uygulanması teratojen bulunmamıştır. Tobramisinin >40 mg/kg/gün dozları dişi tavşanlarda ağır derecede matemal toksisiteye neden olmuş (spontan abort ve ölüme yol açan nefrotoksisite) ve teratojenite değerlendirmesine engel olmuştur. Tobramisin ile yapılan klinik dışı üreme toksisitesi çalışmalannda yavrularda ototoksisite değerlendirilmemiştir. Hayvanlardan elde edilmiş mevcut veriler doğrultusunda prenatal maruziyet düzeylerinde toksisite (örn. ototoksisite) riski dışlanamaz. Tobramisinin 100 mg/kg'a kadar subkutan yoldan uygulanması erkek veya dişi sıçanlarda çiftleşme davramşım etkilememiş veya fertilitede bozulmaya yol açmamıştır. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiSodyum klorür Enjeksiyonluk supH ayarlaması için sülfürik asit ve sodyum hidroksit Nitrojen (işlem yardımcısı) 6.2. GeçimsizliklerTOBI, nebülizör içinde diğer ilaçlarla seyreltilmemeli veya karıştınimamalıdır.6.3. Raf ömrü36 ayAmpulım açılmasından hemen sonra tüm içeriği kullamimalıdır (bkz. 6.6). 6.4. Saklamaya yönelik özel tedbirler2 - 8°C arasında buzdolabında ve orijinal kutusunda saklayınız. TOBI yoğun ışığa karşı hassastır.Buzdolabından çıkartıldıktan sonra veya buzdolabının bulunmadığı ortamlarda, TOBI torbalan (kapalı veya açık), 25°C'nin altında en fazla 28 gün saklanabilir. TOBI'nin buzdolabında saklandığında (2-8 ®C) ampul üzerinde basılı olan son kullanma tarihinden sonra veya oda sıcaklığında saklandığında (25 ®C) 28 günden uzun süre kullanılmaması gerekir. TOBI ampulleri bulanıksa, çözelti içerisinde parçacıklar varsa veya 28 günden uzun süreyle oda sıcaklığında saklanmışsa kullamimamalıdır. TOBI ampulleri yoğun ışığa maruziyetten korunmalıdır. Buzdolabında saklanmaması halinde normalde hafif san renkli olan TOBI'nin zamanla rengi koyulaşabilir; fakat ürün önerilen saklama koşullannda saklandığı müddetçe renk değişikliği ürünün kalitesinde değişiklik olduğunu göstermez. Açıldıktan sonra ampulün tüm içeriği kullanılmalıdır; açılmış ampuller asla yeniden kullanılmak üzere saklanmamalıdır. 6.5. Ambalajın niteliği ve İçeriğiTOBI, 5 mL tek kullanımlık düşük yoğunluklu polietilen ampuller içinde bulunur. Bir dış karton kutu içinde plastik bölmelere dizili her biri 14 ampul içeren 4 kapalı folyo torba şeklinde toplam 56 ampul vardır.6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlersKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıklann Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklan Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. TOBI, sadece tek kullanımlık, steril, pirojenik olmayan sulu bir preparattır. İçeriğinde koruyucu madde olmadığı için açıldıktan sonra tüm ampul içeriği hemen kullanılmalı ve kullanılmamış çözelti çöpe atılmalıdır. Açüan ampuller hiçbir zaman tekrar kullanım için saklanmamalıdır. 7. RUHSAT SAHİBİ Novartis Ürünleri 34912 Kurtköy - İstanbul Tel no: 0216 560 10 00 Faks no:0216 482 64 08 8. RUHSAT NUMARASI 123/31 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİ: İlk ruhsat tarihi: 10.10.2007 Ruhsat yenileme tarihi: - 10. KÜB'ÜN YENİLENME TARİHİ: |
İlaç BilgileriTobi 300 mg/5 ml Nebülizör İçin İnhalasyon Çözeltisi İçeren AmpulEtken Maddesi: Tobramisin Atc Kodu: J01GB01 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.