Levemir Penfill 100U/ml, 3mlkartuş içinde enjeksiyonluk çözelti Kısa Ürün BilgisiSindirim Sistemi ve Metabolizma » Diyabet (Şeker Hastalığı) İlaçları » İnsülinler ve Analogları » İnsülin ve Analogları enjektabl (uzun etkili) » İnsülin Detemir KISA URUN BILGISI1. BEŞERİ TIBBİ ÜRÜNÜN ADILEVEMIR® Penfill® 100 U/ml, 3 ml kartuş içinde enjeksiyonluk çözelti2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:insülin detemir*.............................................................100 U (14.2 mg) /mİ*insülin Saccharomyces cerevisiae'dçrekombinant DNA teknolojisi ile üretilmiştir.1 kartuş 300 U insüline eşdeğer 3 ml içermektedir. Yardımcı maddeler:Sodyum klorür...........................................................................1.17 mg/mlDisodyum fosfat dihidrat...............................................................0.89 mg/ml Sodyum hidroksit........................................................................y.m. Yardımcı maddeler için 6.1 'e bakımz. 3. FARMASÖTİK FORMKartuş içinde enjeksiyonluk çözelti. Penfill.Berrak, renksiz, nötr çözelti. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarYetişkinler, adolesanlar ve 2 yaş ve üstü çocuklarda diabetes mellitusun tedavisi.4.2. Pozoloji ve uygulama şekli Pozoloji/uyguiama sıklığı ve süresi:İnsan insülinlerinin potensi uluslararası ünite (lU) olarak ifade edilirken insülin detemir de dahil olmak üzere, insülin analoglannm potensi ünite (U) olarak ifade edilmektedir. 1 ünite (U) insülin detemir, 1 uluslararası ünite (lU) insan insülinine karşılık gelmektedir.LEVEMIR bazal insülin olarak kendi başına veya bolus insülin ile kombine kullanılabilir. Aynca oral antidiyabetik tıbbi ürünlerle beraber veya liraglutid tedavisine eklenerek kullanılabilir. Oral antidiyabetik ilaçlarla kombinasyonda ve liraglutide eklendiğinde, LEVEMIR'in başlangıç dozu 10 U veya 0.1-0.2 U/kg olacak şekilde, günde tek doz kullanılması tavsiye edilir. LEVEMIR'in dozu, hastanın ihtiyaçlanna göre bireyselleştirilmelidir. Çalışma sonuçlanna dayanarak, yetişkin diyabetli hastalara aşağıdaki titrasyon kılavuzu
LEVEMIR bazal bolus insülin rejiminin bir parçası olarak kullanıldığında, hastalann ihtiyaçlanna bağlı olarak günde bir ya da iki defa uygulanmalıdır. LEVEMIR'in dozu bireysel hasta ihtiyaçlanna göre ayarlanmalıdır. Hastalann her zamanki fiziksel aktivitelerinde bir artış olursa, olağan diyetlerinde bir değişiklik yaparlarsa veya eşzamanlı seyreden bir hastalık süresince doz ayarlamasının yapılması gerekebilir. Uygulama şekli:LEVEMIR bazal insülin olarak kullanılan uzun ekili bir insülin analoğudur . LEVEMIR sadece deri altı uygulama içindir. Şiddetli hipoglisemiye yol açabileceğinden LEVEMIR intravenöz olarak uygulanmamalıdır. Intramusküler uygulamadan da kaçınılmalıdır. LEVEMIR insülin infiizyon pompalannda kullanılmaz.LEVEMIR®, kann duvan, uyluk, üst kol, deltoid veya kalça bölgelerine deri altına enjekte edilerek kullanılır. Lipodistrofi riskini azaltmak için, enjeksiyon yerleri aynı bölge içinde sürekli değiştirilmelidir. Tüm insülinlerde olduğu gibi etki süresi doz, enjeksiyon bölgesi, kan akımı, sıcaklık ve fiziksel aktivite düzeyine göre değişebilir. Enjeksiyon gün içinde herhangi bir saatte, ancak her gün aynı saatte yapılmalıdır. Kan glukoz kontrolünün optimizasyonu için günde iki dozlamaya ihtiyaç duyan hastalarda, akşam dozu akşam veya yatarken uygulanabilir. LEVEMIR Penfİll Novo Nordisk insülin enjeksiyon sistemleri ve NovoFine® veya NovoTwist iğne uçlan ile kullanılmak üzere tasarlanmıştır. Hasta taklit iğne uçlarını kullanmaması konusunda bilgilendirilmelidir. LEVEMIR Penfill ile birlikte, kullanım ile ilgili detaylı bilgilerin bulunduğu kullanma talimatı bulunmaktadır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Böbrek veya karaciğer yetmezliği hastanın insülin ihtiyacında azalmaya sebep olabilir.Diğer bütün insülinlerde olduğu gibi, karaciğer veya böbrek yetmezliği olan hastalarda glukoz monitorizasyonu yoğunlaştınimalı ve LEVEMIR dozu bireysel olarak ayarlanmalıdır. Pediyatrik popûlasyon:LEVEMIR'in, adolesanlardaki ve 2 yaş ve üstü çocuklardaki etkinlik ve güvenliliği 12 aya kadar olan çalışmalarda gösterilmiştir (bkz. bölüm 5.1)Diğer bütün insülinlerde olduğu gibi, çocuk ve adolesanlarda, glukoz monitorizasyonu yoğunlaştmimalı ve insülin detemir dozu bireysel olarak ayarlanmalıdır. LEVEMIR , 2 yaşın altındaki çocuklarda çalışılmamıştır. Geriyatrik popûlasyon (> 65 yaş):LEVEMIR yaşlı hastalarda kullamlabilir. Diğer bütün insülinlerde olduğu gibi, yaşlı hastalarda glukoz monitorizasyonu yoğunlaştmimalı ve LEVEMIR dozu bireysel olarak ayarlanmalıdır.Diğer insülinlerden geçiş:Orta veya uzun etkili insülinlerden geçişte, uygulanan dozun ve zamammn ayarlanması gerekebilir (bkz. bölüm 4.4).Diğer tüm insülinlerde olduğu gibi, geçiş sırasında ve geçişten sonraki ilk haftalarda yakın glukoz monitorizasyonu tavsiye edilmektedir (bkz. bölüm 4.4). Eş zamanlı kullanılan antidiyabetik tedavinin (aynı zamanda kullamlan kısa/hızlı etkili insülinlerin veya oral antidiyabetik ilaçlann dozu ve/veya zamammn) ayarlanması gerekebilir. 4.3. KontrendikasyonlarEtkin madde veya içindeki maddelerden herhangi birisine aşın duyarlılık (bkz. bölüm 6.1).4.4. Özel kullanım uyarılan ve önlemleriHasta için insülin ve öğünlerini farklı zamanlarda alması anlamına geldiğinden, farklı saat dilimleri arasındaki seyahatin öncesinde hasta doktorunun tavsiyesini almalıdır.HiperglisemiYetersiz dozlarda kullanımı veya tedavinin kesilmesi, özellikle Tip 1 diyabette hiperglisemi ve diyabetik ketoasidoza yol açabilir. Hipergliseminin ilk semptomlan genellikle saatler veya günler içinde ortaya çıkabilir. Bu semptomlar susuzluk, sık idrara çıkma, bulantı, kusma, uyku hali, deride kızanklık ve kuruluk, ağız kuruluğu, iştah kaybı ve nefeste aseton kokusudur. Tip 1 diyabette tedavi edilmeyen hiperglisemi dunımlan ölümcül potansiyele sahip diyabetik ketoasidoza neden olabilir.Hipoglisemi^ Öğün atlanması veya planlanmamış ağır fizik egzersizler hipoglisemiye neden olabilir.İnsülin ihtiyacına göre insülin dozu çok yüksekse hipoglisemi ortaya çıkabilir (bkz. bölüm 4.8 ve 4.9). İntensif insülin tedavisi gibi tedavilerle kan glukoz kontrolü sağlanmış olan hastalarda hipogliseminin alışılagelmiş uyancı semptomlarında değişiklik olabileceğinden, hastalar bu konuda bilgilendirilmelidir. Uzun süredir diyabet olan hastalarda hipogliseminin alışılagelmiş uyancı semptomlan kaybolabilir. Eşlik eden başka hastalık, özellikle enfeksiyon hastalıkları ve ateşli durumlar genellikle hastamn insülin gereksinimini artırır. Adrenal, hipofiz veya tiroid bezini etkileyen veya diyabete eşlik eden böbrek ve karaciğer hastalıktan insülin dozunda değişiklik gerektirebilir. Hastalar değişik tipte insülinler arasında transfer edildiğinde, hipogliseminin erken uyarıcı semptomlan önceki insülinle tecrübe edilene göre değişebilir veya daha az belirgin hale ^ gelebilir. Diğer insülinlerden geçişHastalann yeni bir çeşit veya marka insüline transfer edilmesi sıkı bir tıbbi denetim altında yapılmalıdır. Dozaj, marka (üretici), çeşit, tür (hayvan, insan, insan insülin analogu) ve/veya üretim metodundaki değişiklikler (hayvan kaynaklı insüline karşı rekombinant DNA) doz değişiklikleri gerektirebilir. Başkatip bir insülinden LEVEMIR'e geçiş yapan hastalann dozlannda, her zaman kullandıklan insülin dozıma göre değişiklik yapılması gerekebilir. Doz ayarlaması gerektiğinde, bu bazen ilk dozda bazen de ilk birkaç hafta veya ay içinde yapılabilir.Enjeksiyon bölgesi reaksiyonlarıTüm insülin tedavilerinde olduğu gibi enjeksiyon bölgesinde ağn, kızanklık, ürtiker, enflamasyon, morarma, şişme ve kaşmtı gibi enjeksiyon bölgesi reaksiyonlan görülebilir. Enjeksiyon yerinin aynı bölge içinde sürekli olarak değiştirilmesi bu reaksiyonlann azalmasına ya da önlenmesine yardımcı olabilir. Reaksiyonlar birkaç günden birkaç haftaya kadar düzelir. Nadir durumlarda enjeksiyon bölgesi reaksiyonları LEVEMIR kullammına son vermeyi gerektirebilir.HipoalbûminemiŞiddetli hipoalbüminemisi olan hastalarda kullammı ile ilgili veriler sımrlıdır. Bu hastalarda dikkatli monitorizasyon yapılması önerilmektedir.LEVEMIR ile pioglitazon kombinasyonuÖzellikle kalp yetmezliği gelişimi riski yüksek olan hastalarda, pioglitazon ile insülin kombine kullamidığmda kalp yetmezliği vakalan bildirilmiştir. Bu, pioglitazon ve LEVEMIR'in kombine tedavisi düşünüldüğünde akılda tutulmalıdır. Eğer bu kombinasyon kullamhrsa, hastalar kalp yetmezliği, kilo alımı ve ödemin semptom ve belirtileri için incelenmelidir. Pioglitazon, kardiyak semptomlarda herhangi bir kötüleşme olduğunda kesilmelidir.LEVEMIR her ml'sinde 1 mmol (23 mg)'dan daha az sodyum (1.17 mg/ml sodyum klorür, 0.89 mg/ml disodyum fosfat dihidrat ve pH ayan için yeteri miktarda sodyum hidroksit) ihtiva eder. Sodyuma bağlı herhangi bir etki beklenmez. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriBazı ilaçlann glukoz metabolizması ile etkileşime gİrdiğİ bilinmektedir.Aşağıdaki maddeler hastanın insülin ihtiyacım azaltabilir: Oral antidiyabetik ilaçlar, monoamin oksidaz inhibitörleri (MAOİ), beta blokörler, anjiyotensin dönüştürücü enzim (ADE) inhibitörleri, salisilatlar, anabolik steroidler ve sülfonamidler. Aşağıdaki maddeler hastanın insülin ihtiyacım artırabilir: Oral kontraseptifler, tiyazidler, glukokortikoidler, tiroid hormonları, sempatomimetikler, büyüme hormonu ve danazol. Beta blokörler hipoglisemi semptomlannı maskeleyebilirler. Oktreotid/lanreotid insülin ihtiyacını hem artırabilir, hem de azaltabilir. Alkol insülinin hipoglisemik etkisini güçlendirebilir veya azaltabilir. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi B'dir.Çocuk doğurma potansiyeli bulunan kadmlar/Doğum kontrolü (Kontrasepsiyon)Herhangi bir bilgi bulunmamaktadır.Gebelik donemiGebelik döneminde LEVEMIR ile tedavi değerlendirilebilir, ancak elde edilebilecek potansiyel fayda, gebelik ile ilgili olası bir olumsuz sonuç riskine karşı avantaj sağlamalıdır.Genelde, diyabetli gebe kadınlann gebelikleri süresince ve gebelik sonlandıktan sonra kan glukozımun yoğun şekilde takip edilmesi ve kontrolü önerilmektedir. İnsülin gereksinimi genellikle gebeliğin ilk trimesterinde azalmakta ve ikinci ve üçüncü trimesterde giderek artmaktadır. Normalde doğum sonrası insülin ihtiyacı, hızla gebelik öncesindeki değerlere geri döner. Açık-etiketli, randomize kontrollü bir klinik çalışmada, tip 1 diyabetli (n=310) gebe kadınlar bazal-bolus tedavi rejiminde, NovoRapid® ile kombine şekilde, bazal insülin olarak LEVEMIR (n=152) veya NPH insülini (n=158) ile tedavi edilmişlerdir. Bu çalışmamn birincil amacı, diyabetli gebe kadınlarda LEVEMIR'in kan glukozu regülasyonu üstündeki etkisini değerlendirmektir (bakımz bölüm 5.1). Matemal advers olayların genel oram LEVEMIR ve NPH insülin tedavi gruplan için benzerdir. Ancak, LEVEMIR ile annelerde (61 (%40)'e karşı 49 (%31) ve yenidoğan çocuklarda (36 (%24)'ya karşı 32 (%20) NPH insülin ile karşılaştınidığında sayısal olarak daha yüksek sıklıkta ciddi advers olay görülmüştür. Randomizasyon sonrası gebe kalan kadınlann canlı doğan çocuklannm sayısı LEVEMIR için 50 (%83) ve NPH için 55 (%89) idi. Konjenital malformasyonlann sıklığı LEVEMIR için 4 (%5) ve NPH için 11 (%7) iken, LEVEMIR için majör malformasyon sayısı 3 (% 4), NPH için 3 (% 2) idi. Ek olarak 250 sonucu kapsayan pazarlama sonrası veriler, LEVEMIR kullanılan gebe kadınlarda, insülin detemirin gebelik üstüne advers etkisinin olmadığını ve insülin detemirin malformatif veya feto/neonatal toksisitesinin olmadığını göstermektedir. Hayvanlarda yapılan çalışma verileri üreme ile ilgili bir toksisiteyi işaret etmemektedir (bakımz bölüm 5.3). Laktasyon dönemiİnsülin detemirin insan sütüyle atılıp atılmadığı bilinmemektedir. İnsülin detemirin peptid yapıda olması ve insan gastrointestinal kanalında aminoasitlere parçalanması nedeniyle, anne sütü ile beslenen yeni doğan/infantta, sindirilen insülin detemir kaynaklı bir metabolik etki beklenmemektedir.Emziren kadınlar insülin dozunda ve diyette ayarlamaya ihtiyaç duyabilir üreme yeteneği /FertiliteHayvanlarda yapılan çalışmalar fertilite üzerinde zararlı bir etki göstermemiştir.4.7. Araç ve makine kullanımı üzerindeki etkilerHastamn konsantre olma ve reaksiyon gösterme becerisi hipogliseminin bir sonucu olarak bozulabilir. Bu durum, bu becerilerin özel önem gösterdiği koşullarda risk oluşturabilir (örn. araba sürme veya makine kullanma).Hastalar araba sürme esnasında hipoglisemiye girmemeleri için gerekli önlemleri almalan konusunda uyanlmahdır. Bu durum özellikle hipogliseminin uyancı semptomlanm az olarak fark eden veya hiç fark etmeyen kişiler için ya da sık sık hipoglisemi atağı geçiren hastalar için önemlidir. Bu durumlarda araba kullammı önerilmeyebilir. 4.8. İstenmeyen etkilera. Güvenlilik profilinin özetiLEVEMIR kullanan hastalarda gözlenen advers ilaç reaksiyonlan çoğunlukla insülinin farmakolojik etkisine bağlıdır. Tedavi edilen hastalarda, advers ilaç reaksiyonu görülmesi beklenen hastalann oranı %12 olarak tahmin edilmektedir. Tedavi sırasında en sık raporlanan advers reaksiyon hipoglisemidir, lütfen aşağıdaki c bölümüne bakımz. Klinik araştmnalardan, başka kişilerin yardımım gerektiren majör hipogliseminin, LEVEMIR ile tedavi edilen hastalann yaklaşık %6'smda görüldüğü bilinmektedir. LEVEMIR ile tedavi sırasında insan insülininden daha sıklıkla enjeksiyon bölgesi reaksiyonlan görülür. Bu reaksiyonlar arasında enjeksiyon bölgesinde ağn, kızanklık, ürtiker, enflamasyon, morarma, şişme ve kaşıntı bulunmaktadır. Enjeksiyon bölgesi reaksiyonlannın çoğu minör ve geçici özelliktedir; normalde tedavi devam ederken birkaç günden birkaç haftaya kadar kaybolur, insülin tedavisinin başlangıcında, refraksiyon (kırılma) anomalileri ve ödem oluşabilir; bu reaksiyonlar genelde geçici karakterdedir. Kan glukoz kontrolündeki hızlı iyileşme, genellikle geçici akut ağnlı nöropati ile ilişkili olabilir. Uzun dönemli iyileşmiş glisemik kontrol diyabetik retinopatide ilerleme riskini azaltırken, insülin tedavisinin yoğunlaştınimasıyla birlikte glisemik kontrolde ani iyileşme, diyabetik retinopatinin geçici olarak kötüleşmesiyle birlikte seyredebilir. b. Advers reaksivon listesinin tablosuAşağıda listelenen advers ilaç reaksiyonlan klinik çalışma verilerine dayanmakta ve sıkhklanna ve sistem organ sınıfına göre MedDRA'ya uygun olarak sınıflandın 1 mıştır. Sıklıklar; çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor) olarak tammlanrmştır. Yaygm olmayan - Aleijik reaksiyonlar, potansiyel olarak alerjik reaksiyonlar, ürtiker, döküntü, erüpsiyon*
İmmün sistem bozuklukları Çok seyrek - Anafilaktik reaksiyonlar'* Metabolizma ve beslenme bozukluklan
Çok yaygm - Hipoglisemi' Seyrek - Periferik nöropati
Sinir sistemi bozukluklan Yaygm olmayan - Kınlma bozukluklan
Göz bozukluklan Yaygm olmayan - Diyabetik retinopati
Cilt ve cilt altı doku bozukluklan Yaygın olmayan - Lipodistrofi' Genel rahatsızlıklar ve uygulama bölgesi reaksiyonlan Yaygın - Enjeksiyon bölgesi reaksiyonlarıYaygın olmayan - Ödem* bakımz bölüm c c. Seçilmiş advers reaksivonlann tarifiAlerjik reaksiyonlar, potansiyel alerjik reaksiyonlar, ürtiker> döküntü, erüpsiyonAleijik reaksiyonlar, potansiyel olarak aleijik reaksiyonlar, ürtiker, döküntü ve erüpsiyon LEVEMIR bazal-bolus rejimde kullamidığmda yaygın değildir. Ancak, oral antidiyabetik ilaçlarla kombine edilmiş hastalarla yapılan üç klinik çalışma yaygın bir sıklık göstermiştir (%2.2'lik sıklıkta aleijik reaksiyonlar ve potansiyel aleijik reaksiyonlar gözlenmiştir).Anafilaktik reaksiyonlarYaygın aşın duyarlılık reaksiyonlan (yaygm döküntü, kaşıntı, terleme, gastrointestinal bozukluk, anjionörotik ödem, solumada zorluk, çarpıntı ve kan basıncında düşme) çok nadirdir ancak potansiyel olarak yaşamı tehdit edicidir. HipoglisemiEn sık raporlanan advers reaksiyon hipoglisemidir. Eğer insülin ihtiyacıyla ilişkili insülin dozu çok yüksekse oluşabilir. Ciddi hipoglisemi, bilinç kaybı ve/veya konvülziyonlara neden olabilir ve beyin fonksiyonlannda geçici ya da kalıcı bozuklukla veya hatta ölümle sonuçlanabilir. Hipoglisemi semptomlan genellikle aniden oluşur. Bu semptomlar arasında soğuk terleme, soğuk solgun deri, halsizlik, sinirlilik veya titreme, endişe duygusu, olağan olmayan yorgunluk veya güçsüzlük, konfuzyon, konsantre olmada güçlük, uyku hali, aşırı açlık, görme değişiklikleri, baş ağnsı, bulantı ve çarpıntı sayılabilir. LipodistrojiLipodistrofi (lipohipertrofi ve lipoatrofiyi kapsayan) enjeksiyon bölgesinde oluşabilir. Aynı enjeksiyon bölgesi içinde enjeksiyon yerlerinin sürekli olarak değiştirilmesi bu reaksiyonlann gelişme riskini azaltabilir. d. Pedivatrik popülasvonPazarlama sonrası kaynaklar ve klinik çalışmalar baz alındığında, pediyatrik popülasyonda gözlenen advers reaksiyonlann sıklığı, tipi ve şiddeti, genel popülasyondaki yaygın tecrübeden farklılık göstermemektedir. e. Diğer özel popülasvonlarPazarlama sonrası kaynaklar ve klinik çalışmalar baz alındığında, yaşlı hastalarda ve böbrek veya karaciğer bozukluğu olan hastalarda gözlenen advers reaksiyonlann sıklığı, tipi ve şiddeti, genel popülasyondaki yaygın tecrübeden farklılık göstermemektedir, 4.9. Doz aşımı ve tedavisiİnsülin için spesifik olarak bir doz aşımı tammlanamaz; ancak hastamn ihtiyacına göre çok yüksek dozlarda verilirse birbirini takip eden evreler sonucunda hipoglisemi gelişebilir: Hafif hipoglisemi ataklan oral yoldan glukoz veya şekerli gıdalar almarak tedavi edilebilir. Bu nedenle diyabetli hastalann beraberlerinde her zaman şekerli gıdalar bulundurmalan önerilmektedir. Hastamn bilincini kaybettiği şiddetli hipoglisemi ataklan, eğitimli bir kişi tarafından kas içi veya deri altı (0.5 - 1 mg) glukagon veya profesyonel sağlık çalışam tarafından damar içi yoluyla glukoz enjekte edilerek tedavi edilebilir. Hasta, glukagon enjeksiyonuna 10-15 dakika içinde yanıt vermezse, damar içine glukoz da verilmelidir. Hipoglisemik atağm tekrannın önlenmesi amacıyla hastanın bilinci yerine geldiğinde oral yolla karbohidrat verilmesi önerilmektedir. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Diyabette kullanılan ilaçlar. Enjeksiyon için insülin ve analoglan, uzun etkili.ATC kodu: A10AE05. Etki mekanizmasıLEVEMIR, çözünür, etki süresi uzatılmış, bazal insülin olarak kullanılan, uzun etkili bir insülin analogudur.LEVEMIR'in kan şekerini düşürücü etkisi, insülinin kas ve yağ hücrelerindeki reseptörlere bağlanarak glukozun hücre içine girişini kolaylaştırmasına ve eş zamanlı olarak karaciğerden glukoz açığa çıkmasını da inhibe etmesine bağlıdır. Tablo 1 'de, total ve maksimum farmakodinamik etki için bireyin kendi içindeki varyasyon katsayısında (CV) görüldüğü üzere, LEVEMIR'in etki profili, NPH (Nötral Protamin Hagedom) insülin ile kıyaslandığında istatistiksel olarak anlamlı derecede daha az değişken ve daha öngörülebilirdir. Tablo 1. LEVEMIR ve NPH insülinin zaman etki profilinin bireylerin kendi içindeki değişkenliği
LEVEMIR'in uzamış etkisi enjeksiyon bölgesinde insülin detemir moleküllerinin güçlü birlikteliği ve yağ asidi yan zinciri ile albumine bağlanması sonucu oluşur. İnsülin detemir, NPH insülin ile kıyaslandığında periferik hedef dokularda çok daha yavaş dağılır. Bu kombine etki uzatma mekanizmalan, insülin detemirin NPH insüline kıyasla daha tekrarlanabilir absorpsiyonunu ve etki profilini sağlar. 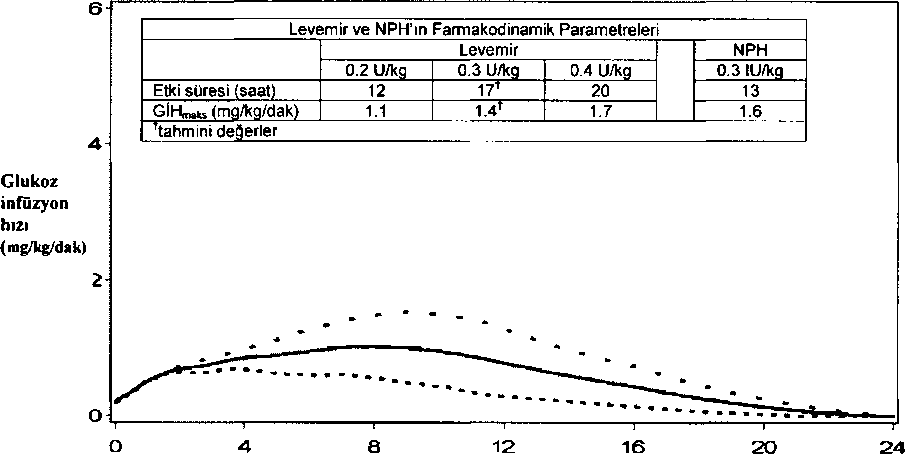 İnsUiin enjeksiyonundan itibaren geçen süre (saat) LEVEMIR..............0.2 U/ks, 0.3 U/kg 0.4 U/ks
İnsUiin enjeksiyonundan itibaren geçen süre (saat) LEVEMIR..............0.2 U/ks, 0.3 U/kg 0.4 U/ksŞekil 1. Tip 1 diyabetli hastalarda LEVEMIR'in aktivite profiliEtki süresi günde bir veya iki enjeksiyonla sağlanan doza bağlı olarak 24 saattir. Eğer günde iki kez uygulanırsa, 2-3 doz uygulamasından sonra kararlı durum oluşur, 0.2-0.4 U/kg aralığındaki dozlar için, LEVEMIR'in maksimum etkisinin %50'sinden fazlası doz uygulamasından sonra 3-4 saatten yaklaşık 14 saate kadar görülür.Farmakodinamik cevapta doz orantısallığı (maksimum etki, etki süresi, toplam etki) deri altı uygulama sonrası gözlenmiştir. Uzun süreli klinik çalışmalarda NPH'a kıyasla LEVEMIR'le tedavi sırasında günden güne daha az değişkenlik gösteren APG (Açlık Plazma Glukozu) gösterilmiştir. Oral antidiyabetik ilaçlarla birlikte kullanılan bazal insülin ile tedavi edilmiş Tip 2 diyabetli hastalardaki çalışmalar, LEVEMIR(HbAic), NPHLEVEMIR'LEVEMIRtedavisi alan hastalann %55'i, 52 haftalık çalışmayı günde iki kezlik rejim ile tamamlamıştır.Tablo 2. İnsülin tedavisinden sonra vücut ağırlığında değişiklik
Oral antidiyabetik ilaçlarla hedefe ulaşamayan tip 2 diyabetlilerde, açık etiketli bir randomize çalışma yürütülmüştür. Çalışma liraglutid+metformin kullanılan 12 haftalık bir hazırlık dönemi ile başlamış, hastalann %61'i HbAic<%7'yebu dönemde ulaşmışlardır. Hedefe ulaşamayan %39'luk hasta grubu 52 hafta boyunca tedavilerine ek olarak günde bir LEVEMIR veya liraglutid+metformin alacak şekilde randomize oldular. Tedaviye LEVEMIR eklenmesi 52 hafta sonunda HbAic'de %7.6'dan %7.re ek bir azalma sağlamıştır. Hiç majör hipoglisemik atak olmamıştır. Majör hipoglisemik atak, hastanın kendisini tedavi edemediği ve glukagon veya i.v glukoz ihtiyacı duyulan atak olarak belirlenmiştir. Bakınız Tablo 3.Tablo 3. Klinik çalışma verileri - Liraglutid+metformin tedavisine LEVEMIR eklenmesiLEVEMIR+ liraglutid + metformin'e randomize olanlarN-160 Liraglutid + metformin'e randomize olanlar
Çalışma haftası
P-değeri N=149
0-26. hafta
Başlangıca göre ortalama HbAic değişimi (%)
-0.51
+0.02
<0.0001
0-52. haftal
-0.50
<0.0001
0.01
HbA,c<%7 hedefme ulaşan hasta sayısı (%)
0-26. hafta
43.1
16.8
<0.0001
0-52. hafta
51.9
21.5
<0.0001
0-26. hafta
Başlangıca göre vücut ağırhğındaki değişim (kg) -0.16
-0.95
0.0283
0-52. hafta
-0.05
-1.02
0.0416
Minör hipoglisemik ataklar (her hasta yılı için)
0-26. hafta
0.286
0.029
0.0037
0-52. hafta
0.228
0.034
0.0011 Bazal/bolus insülin tedavisi alan tip 1 diyabetli hastalardaki uzun dönemli çalışmalarda, LEVEMIR açlık plazma glukozunu, NPH(HbAjc) NPHinsülin ile kıyaslanabilirdir; ayrıca noktümal hipoglisemi riski daha düşüktür ve kilo alımı ile ilişkili değildir.Bazal bolus insülin tedavisi kullanılan klinik çalışmalarda, LEVEMIR ve NPH insülin ile hipoglisemi görülme oranlan benzerdir. Tip l diyabetli hastalarda yapılan noktümal hipoglisemi analizleri, NPH insüline göre belirgin olarak daha düşük minör noktümal hipoglisemi (hastanın kendini tedavi edebildiği ve 2.8 mmol/l'den düşük kapiler kan glukozu ya da 3.1 mmol/1 plazma glukozu ile de gösterilen) riski göstermiştir; tip 2 diyabette ise bir fark görülmemiştir. LEVEMIR'in kullanımı ile antikor gelişimi gözlenmiştir. Ancak bu durum glisemik kontrolü etkiliyor gibi gözükmemektedir. Gebelik LEVEMIR, açık-etiketli, randomize kontrollü bir klinik çalışmada çalışılmış, tip 1 diyabetli (n=310) gebe kadınlar bazal-bolus tedavi rejiminde bazal insülin olarak LEVEMIR (n=152) veya NPH insülini (n=158), NovoRapid® ile kombine kullanmışlardır (bakınız bölüm 4.6). Gebeliğin 36. haftasında ölçülen HbAic değerlerine LEVEMIR, NPH'e karşı daha etkisiz değildir ve gebelik boyunca ortalama HbAic düşüşü benzerdir, bakınız tablo.4 Tablo 4. Maternal glisemik kontrolFark / Olasılık Oranı / %95 GA oranı
LEVEMIR
NPH
36. gebelik haftasındaki ortalama HbAic
Fark: -0.06 r-0.21; 0.081621
6.33
36. gebelik haftasında ortalama _ APG (mmolA)_
Fark: -0.65r-1.19; -0.121
4.76
5.41
Hem 24. hem de 36. gebelik haftasında HbAlc <% 6 hedefine ulaşan hasta oranı
Olasılık Oranı: 1.36 [0.78; 2.371
% 41
%32
Gebelik sırasındaki toplam majör hipoglisemi atağı sayısı (hasta yılı başına)_
Olasılık Oram: 0.82 [0.39; 1.75]
1.1
1.2 Pedivatrik popülasvonLEVEMIR'in etkililik ve güvenliliği adolesan ve çocuklarda yapılan iki randomize kontrollü klinik çalışmada 12 aya kadar izlenmiştir (toplamda n=694); bu çalışmalardan biri 2-5 yaş arası toplam 82 çocuk içermekteydi. Her iki çalışmada bazal-bolus tedavi olarak verildiğinde LEVEMIR ile sağlanan glisemik kontrolün (HbAic), %0.4 eş-değerlik sımn kullamidığında, NPH insülin ile karşılaştınlabilir olduğu gösterilmiştir. Ek olarak NPH insüline oranla LEVEMIR ile daha az kilo alımı (SS skoru, kilo cinsiyet ve yaş için düzeltilmiştir) gözlenmiştir. LEVEMIR ile uzun dönemli tedavi sonra antikor oluşumunu değerlendirmek amacıyla, 2 yaş üstündeki çocuklan içeren çahşma ek olarak 12 ay daha (toplam 24 aylık tedavi verisi) uzatılmıştır. İnsülin antikorlannda ilk yıldaki artış sonrası, ikinci yıl sırasında insülin antikorlan çalışma öncesi seviyelerin hafifçe üstünde olacak şekilde azalmıştır. Sonuçlar antikor gelişiminin glisemik kontrol ve LEVEMIR dozu üzerinde negatif etkisinin olmadığını göstermektedir. 5.2. Farmakokinetik özelliklerEmilim
Yaşlı ve genç bireyler arasında LEVEMIR'in farmakokinetik özelliklerinde klinik olarak belirgin bir farklılık bulunmamıştır. |
İlaç BilgileriLevemir Penfill 100U/ml, 3mlkartuş içinde enjeksiyonluk çözeltiEtken Maddesi: İnsülin detemir Atc Kodu: A10AE05 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
|||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.