Formoday 12 mcg İnhalasyon Toz İçeren Kapsül Kısa Ürün BilgisiSolunum Sistemi » Solunum Sisteminde Tıkanma - Astım İlaçları » Adrenerjikler (İnhalan) » Selektif Beta 2 Adrenoreseptör Agonistleri » Formoterol KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIFORMODAY 12 mcg inhalasyon için toz içeren kapsül2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkinmadde:Formoterol furaarat dihidrat 12 mcgYardımcı madde:Laktoz 24,98 mgYardımcı maddeler için, 6.1'e bakınız. 3. FARMASÖTİK FORMİnhalasyon için toz içeren kapsül.Şeffaf kapak ve natural transparan kapsül içinde beyaz toz. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlar Astım semptomlanmn düzeltilmesi ve kontrol altına alınması amacıyla bir mhale kortikosteroid ile birlikte kullanılır. Astım hastalığının basamaklı tedavisinde 3. basamaktan itibaren (inhaler steroidlerle kontrol altma almamayan astımlı hastalarda) kullanılır. Orta ve ağır KOAH olgularında uzun etkili agonistler, hem semptomlan kontrol altına almada hem de yaşam kalitesini düzeltmede ve alevlenme sıklığını azaltmada etkilidir. İnhale alerjenler, soğuk hava ya da egzersizle indüklenen bronkospazm profılaksisi. 4.2. Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:Astım:Yetişkinler: FORMODAY'in etkin maddesi formoterolün de dahil olduğu uzun etkili betaz agonist smifi ilaçlar, astımlı hastalarda, yalnızca düzenli ve yeterli dozda inhale kortikosteroid alan hastalarda bu tedaviye ek olarak kullanılır. FORMODAY dozu, hastamn kişisel ihtiyacına göre ayarlanmalı ve terapötik amaca ulaşılmasını sağlayan en düşük dozda uygulanmalıdır. Doz, önerilen maksimum dozu aşacak şekilde arttınlmamalıdır. İnhalasyondan 12 saat sonra FORMODAY, hala Önemli derecede bronkodilatör etki gösterdiğinden, çoğu olguda günde iki defa uygulama şeklindeki idame tedavisi, kronik durumlarla ilişkili gündüz ve gece görülen bronkokonstriksiyonu kontrol altına alır. Düzenli idame tedavisi için, günde iki defa 1 inhaler kapsül (12 mikrogram formoterole eşdeğer) kullanılması önerilir. Daha ciddi vakalarda günde 2 kez 2 inhaler kapsül verilir. Önerilen en yüksek idame dozu günde 48 mikrogramdır. Gerekirse belirtilerin hafifletilmesi için önerilen en yiiksek günlük doz olan 48 mikrogramı aşmamak kaydıyla her gün 1-2 ilave kapsül kullamlabilir. Ancak haftada iki günden fazla ilave dozlara ihtiyaç olduğu takdirde doktora damşılmalı ve tedavi yeniden değerlendirilmelidir, çünkü bu durum hastalığın ağırlaştığmm belirtisi olabilir. FORMODAY, astım ataklarının akut semptomlarım hafifletmek için kullanılmamalıdır. Akut atak durumunda, kısa etkili bir beta 2-agonist kullanılmalıdır (bkz. Bölüm 4.4).Çocuklar (5 yaş ve üzeri): FORMODAYsadece inhale bir kortikosteroide ilave olarak reçete edilmeli ve kullanılmalıdır. Düzenli idame tedavisi için, günde iki defa 1 inhaler kapsül (12 mikrogram) kullamiması önerilir. inhale kortikosteroid ile uzun etkili beta 22agonist (LABA) içeren bir kombinasyon preparatla tedavi uygulanması tavsiye edilir (bkz. Bölüm4.4. ve 4.8). Önerilen en yüksek doz günde 24 mikrogramdır. FORMODAY, bir astım atağımn akut semptomlanm hafifletmek için kullamimamahdır. Akut atak durumunda, kısa etkili bir beta 2-agonist kullamimalıdır (bkz. Bölüm 4.4).FORMODAY, 5 yaşın altındaki çocuklarda önerilmez. Egzersizin neden olduğu bronkospazma karşı veya bilinen kaçınılamaz bir alerjen ile temastan önce profılaksi: Yetişkinler: Egzersizden veya aleijenle temastan en az 15 dakika önce 1 inhaler kapsül (12 mikrogram) inhale edilmelidir. Ciddi bronkospazm öyküsü olan hastalarda profılaktik olarak 2 inhaler kapsül (24 mikrogram) gerekli olabilir. Persistan astımı olan hastalarda, egzersizin neden olduğu bronkospazma karşı ya da bilinen kaçmılamaz bir aleıjen ile temastan önce FORMODAY'in kullamiması klinik açıdan endike olabilir. Ancak astım tedavisi bir inhale kortikosterid de içermelidir. Çocuklar (5 yaş ve üzeri): Egzersizden veya alerj enlerle temastan en az 15 dakika önce 1 inhaler kapsül (12 mikrogram) inhale edilmelidir. FORMODAY, sadece bir inhale kortikosteroide ek olarak kullanılmalıdır. Persistan astımı olan hastalarda, egzersizin neden olduğu bronkospazma karşı ya da bilinen kaçınılamaz bir aleıjen ile temastan önce FORMODAY'm kullanılması klinik açıdan endike olabilir. Ancak astım tedavisi bir inhale kortikosteroid de içermelidir. Kronik obstrüktif akciğer hastahğı (KOAH): Düzenli idame tedavisi için, günde iki defa 1 inhaler kapsül (12 mikrogram) kullamiması önerilir. Çocuklar (5 yaş ve üzeri): Uygun değildir. Uygulama şekli:FORMODAY, yetişkinlerde ve 5 yaş ve üzerindeki çocuklarda sadece oral inhalasyon içindh-, FORMODAY inhalasyon tozu kapsülleri, yalnızca kutudan çıkan cihaz ile tatbik edilmelidir. İlacın akciğerlerdeki hedef bölgelere ulaşabilmesi ve uygun şekilde kullanıldığından emin olunması için doktor veya bir başka sağlık personeli kullanım talimatına uygun olarak cihazm nasıl kullamlacağını hastalara öğretmeli ve göstermeli; kapsüllerm sadece cihaz aracılığıyla inhalasyon yolu ile uygulanması gerektiği ve yutulmaması konusunda hastayı uyarmalıdır. Hastaların jelatin kapsülün parçalanabileceğini ve küçük jelatin parçalarının inhalasyondan sonra ağız veya boğaz bölgesine ulaşabileceğini bilmesi önemlidir. Hastaya jelatinin zararsız olduğu, ağızda yumuşayacağı ve yutulabildiği söylenmelidir. Kapsülü bir defadan fazla delmemek suretiyle parçalanma olasılığı asgari düzeye indirilebilir.Kapsüller blister ambalajındankullanımdan hemen önceçıkanbnalıdır.Kullamma ilişkin detaylı bilgi, kullanma talimatında mevcuttur. İnhalasyon cihazmm doğru kullanımıiçin aşağıda verilen kuralları dikkatle izleyiniz.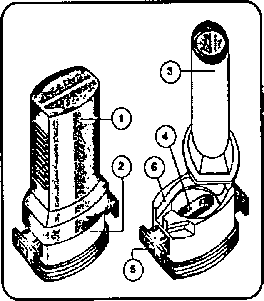 İnhalasyon cihazı aşağıdaki bölümlerden oluşmaktadır: 1. Tabanın ağızlığım koruyan beyaz bir kapak, 2. İlacm kapsülden düzgün olarak salınmasını sağlayan bir taban, Taban kısmı aşağıdaki bileşenlerden oluşur: 3. Bir ağızlık, 4. Bir kapsül bölmesi, 5. Her bir yanda kulakçıkları (çıkık yan taraflar) ve her bir tarafında iğnesi olan kırmızı bir düğmesi 6. Bir hava giriş kanalı İnhalasyon cihazı kullanım talimatları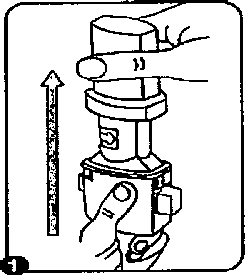 1. Kapağı çekip çıkanmz.
1. Kapağı çekip çıkanmz.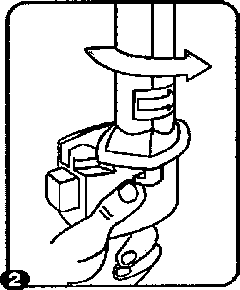 2. Kapsül bölmesini açınız.
2. Kapsül bölmesini açınız.inhalerin tabanını sıkıca tutup, açmak için ağızlığı üzerinde yer alan ok işareti yönünde döndürünüz. 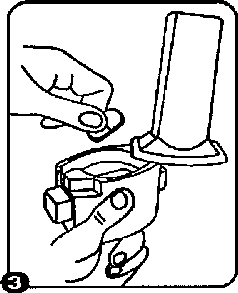 3. Parmaklar
3. Parmaklarınızıntamamen kuru olduğundan emin olunuz.Blisterden bir kapsül çıkarımz ve bu kapsülü cihazm tabanındaki kapsül bölmesine yatık olarak yerleştiriniz. Kapsülü kullammdan hemen önce ambalajından çıkarınız. ÖNEMLİ: Kapsülü ağızlığın içerisine yerleştirmeyiniz!
4. Tık sesini duyana kadar ağızhğı geri döndürerek kapsül böhnesini kapayınız.  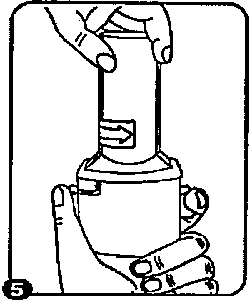 5. Tozu kapsülden serbestlemek için:
5. Tozu kapsülden serbestlemek için: İnhalasyon cihazım ağızlık yukan doğru bakacak şekilde dik olarak tutunuz, Kenarlardaki iki kulakçığa (düğmelere) aynı andasadece bir kezsıkıca basarak kapsülü deliniz. Sonra düğmeleri bırakmız.Not:Kapsül bu aşamada parçalanabilir ve küçük jelatin parçacıkları ağzınıza ya da boğazmıza gelebilir. Fakat jelatin yenilebilirnitelikte olduğu için zararlı değildir.
6. Nefesinizi olabildiğince dışarıya veriniz.   7. ilacı derin bir şekilde hava yollarınıza çekmek için:
7. ilacı derin bir şekilde hava yollarınıza çekmek için: Ağızlığı ağzınıza yerleştiriniz ve başımzı hafifçe geriye doğru eğiniz. Dudaklanmzla ağızlığm etrafım sıkıca sannız. Hızlı, duraksamadan ve alabildiğiniz kadar derin bir nefes almız. Not:Kapsülün, kapsül bölmesinin üzerindeki alanda dönmesine bağlı olarak bir vızıldama sesi duymalısmız. Eğer bu vızıldama sesini duymazsamz, kapsül bölmesiniaçuliz ve kapsülün, kapsül bölmesinde sıkışıp sıkışmadığım kontrol ediniz. Daha sonra 7. basamağı tekrarlayımz. Kapsülü sıkıştığı yerden kurtarmak için düğmelere tekrar tekrar BASMAYINIZ. 8. İnhalasyon cihazının içerisinden nefes aldıktan sonra, nefesinizi rahatsız olmayacak şekilde, tutabildiğiniz kadar tutunuz ve inhaleri ağzınızdan çıkarınız.Sonra burnunuzdan nefes veriniz. Kapsül bölmesini açımz ve kapsülde toz kalıp kalmadığım kontrol ediniz. Eğer kalmış ise 6-8. basamakları tekrarlayınız.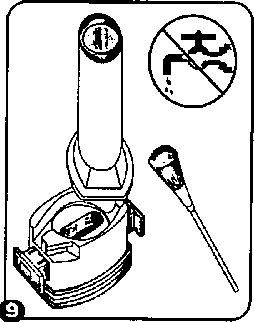 9. Tüm tozu kullandıktan sonra kapsül bölmesini açınız (bkz. basamak 2). Boş kapsülü çıkanmz ve içeride kalan tozlan temizlemek için kuru bir kağıt mendil ya da yumuşak bir fırça kullamnız.
9. Tüm tozu kullandıktan sonra kapsül bölmesini açınız (bkz. basamak 2). Boş kapsülü çıkanmz ve içeride kalan tozlan temizlemek için kuru bir kağıt mendil ya da yumuşak bir fırça kullamnız.NOT: İnhalasyon cihazmı temizlemek için SU KULLANMAYINIZ.10. Önce ağızlığı, ardından kapağı kapatınız.Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Formoterolün karaciğer veya böbrek yetmezliği olan hastalardaki kullanımına ilişkin klinik çalışma yapılmamıştır. Ancak, FORMODAY'in böbrek ve karaciğer yetmezliği olan hastalarda kullammmda doz ayarlaması gerektiği konusunda teorik bir sebep bulunmamaktadır.Pediyatrik popülasyon:FORMODAY, 5 yaşından küçük çocuklara tavsiye edilmez.Geriyatrik popülasyon:FORMODAY, 65 yaş ve üzerindeki hastalarda diğer yetişkinlerle aynı dozlarda kullanılabilir.7 4.3. KontrendikasyonlarEtkin madde formoterole ya da içeriğindeki yardımcı madde laktoza karşı aşın duyarlılıkta kontrendikedir.4.4. Özel kullanım uyarıları ve önlemleriFormoterol, astımlı hastalarda tek başma monoterapi olarak kullanılmamakdır.FORMODAY'in etkin maddesi formoterol, uzun etkili p22-agonist olan salmeterol ile yapılan bir çalışmada, salmeterol ile tedavi edilen hastalarda plasebo grubu ile karşılaştınldıgmda astım nedeniyle ölüm oranımn daha yüksek olduğu gözlenmiştir (sırasıyla 13/13176 ve 3/13179). Astımla ilişkiH ölüm oramnm formoterol ile artıp artmadığına dair yeterli çalışma yürütülmemiştir. Uzun etkili beta agonist preparatlarma bağlı olarak nadiren, ciddi ve bazen ölümcül olabilen astım ile ilgili solunum problemleri meydana gelebilir.FORMODAY başka bir uzun etkili betaı-agonist ile birlikte kullanılmamalıdır. FORMODAY, astımda ilk tedavi seçeneği olarak kullamimamalıdır. FORMODAY, hafif astım hastalığının başlangıç tedavisi olarak önerilmez. Uzun etkili beta agonistler astım semptom kontrolünü sağlayan en kısa süre boyunca kullamimah ve astım kontrolüne ulaşıldığında eğer mümkünse kullanımlan durdurulmalıdır. Sonrasında hastalann kontrol edici bir tedaviyle idamesi sağlanmalıdır. Antienflamatuvar tedavi; Astım hastalannı tedavi ederken uzun etkili bir betaa agonist (LABA) olan FORMODAY, tek başma bir inhale kortikosteroid ile yeterli düzeyde kontrol edilemeyen ya da hastalığının şiddeti bir LABA ve inhale kortikosteroidin her ikisi ile tedavinin başlatıhnasım kesin olarak gerektiren hastalarda bir inhale kortikosteroide ilave tedavi olarak kullanılmalıdır. hıhale kortikosteroid ile uzun etkili betaı agonistin ayn kullanılmasının gerekli olduğu durumlar dışında 5-12 yaş arası çocuklarda, mhale kortikosteroid ile uzun etkili betaa agonist (LABA) içeren bir kombinasyon preparatla tedavi uygulanması tavsiye edilir (bkz. Bölüm 4.2. ve 4.8). İnhale kortikosteroide ek olarak uzun etkili beta agonist kullanan pediyatrik ve adolesan hastalarda, her iki ilaca uyumu garanti altına almak için, hem inhale kortikosteroid hem de uzun etkili beta agonist içeren bir kombinasyon preparatı kullamiması önerilir. FORMODAY reçete edildiğinde hastalar aldıkları antienflamatuvar tedavinin yeterliliği açısından değerlendirilmelidirler. Hastalara, FORMODAY almaya başladıktan sonra, belirtilerde düzelme olduğunda bile antienflamatuvar tedaviye değişiklik yapmaksızın devam etmeleri öğütlenmelidir. Günlük FORMODAY dozu, önerilen maksimum dozu aşmamalıdır. Astım semptomlan kontrol altına alındıktan sonra, FORMODAY dozunun kademeli olarak azaltılması düşünülmelidir. Tedavinin azaltılması sırasında hastalar yakından izlenmeli ve FORMODAY etkili en düşük dozda kullanılmahdır. Astım ataklan: Formoterol ile yapılan klinik çalışmalar, formoterol kullanan hastalarda (özellikle 5-12 yaş arası hastalarda) ciddi astım ataklannm sıklığının plasebo alanlara göre daha yüksek olduğunu düşündürmüştür (bkz. Bölüm 4.8). Bu çalışmalar, ciddi astım alevlenme oranlan açısından tedavi gruplan arasındaki farklann doğru olarak ölçülmesine imkan vermemektedir. Semptomlar devam ettiği takdirde ya da semptomların kontrol edilebilmesi için gereken FORMODAY dozlannm sayısı arttığı takdirde, doktorlar böyle bir gelişmenin genellikle altta yatan durumun kötüleştiğini gösteriyor olması nedeniyle kullanılan astım tedavisini yeniden değerlendirmelidir. Astım alevlenmesi esnasmda FORMODAY tedavisine başlanmamalı ya da doz arttınlmamalıdır. Hastalar alevlenme döneminde ise ya da önemli ölçüde veya akut olarak kötüye giden astım şikayetleri varsa, uzun etkili beta agonistlerle tedaviye başlanmamalıdır. FORMODAY, akut astım semptomlarının rahatlatılması için kullamlmamahdır. Akut ataklarda kısa etkili bir betaı-agonist kullanılmalıdır. Hastalar, astımları aniden kötüleştiği takdirde tıbbi tedavi almalan gerektiği konusunda bilgilendirilmelidir. Eşlik eden şartlar: FORMODAY kullanan hastalarda aşağıdaki durumların varhğmda, özellikle doz sımrları konusunda olmak üzere, özel dikkat ve denetleme gereklidir: İskemik kalp hastalığı, kardiyak aritmiler (özellikle üçüncü derece atriyoventriküler blok), şiddetli kardiyak dekompansasyon, idiyopatik subvalvüler aortik stenoz, şiddetli hipertansiyon, anevrizma, feokromositoma, hipertroflk obstrüktif kardiyomiyopati, tirotoksikoz, QT aralığmda bilinen veya şüphe edilen uzama (QTc >0.44 saniye; bkz. Bölüm 4.5). Daha önceden kardiyak problemleri bulunan ve teofilin ile fomıoterolü bir arada kullanan hastalarda dikkatli olunmalıdır. FORMODAY dahil betaı uyarıcıların hiperglisemik etkileri nedeniyle, diyabetik hastalarda FORMODAY tedavisi başlatıldığında kan glukoz değerlerinin izlenmesi tavsiye edilir. Hipokalemi: FORMODAY dahil beta 2-agonist tedavisi sonucunda ciddi hipokalemi görülebilir. Hipokalemi, kardiyak aritmilere duyarlılığı artırabilir. Hipoksi ve birlikte uygulanan tedavi hipokalemiyi şiddetlendirebileceğinden, şiddetli astımlı hastalarda özel bir dikkat önerilir (bkz. Bölüm 4.5). Böyle durumlarda serum potasyum düzeylerinin izlenmesi tavsiye edilir.Paradoksal bronkospazm: Diğer inhalasyon tedavilerinde olduğu gibi paradoksal bronkospazm ihtimali akılda tutulmalıdır. Böyle bir durum görüldüğünde, FORMODAY tedavisi derhal kesilmeli ve alternatif tedavi başlatılmalıdır. Fonnoterol gibi uzun etkili beta 2-agonistler kullanılırken, özellikle astım ile ilgili advers olaylar bakımından, bu ilaç başlandıktan sonra ilk üç ay hastalar yakından takip edilmelidir.FORMODAY inhaler kapsüller laktoz içermektedir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastalann bu ilacı kullanmamaları gerekir. 4.5. Diğer tıbbi ürünler ile etidleşimler ve diğer etkileşim şekilleriDiğer beta2-agonistleri gibi FORMODAY de; kinidin, disopiramid, prokainamid, fenotiyazmler, antihistaminikler, makrolidler, monoamin oksidaz inhibitörieri ve trisiklik antidepresanlar gibi ilaçlarla veya QTc aralığını uzattığı bihnen herhangi bir İlaçla birlikte dikkatli kullamlmalıdır. Çünkü bu ilaçlar, adrenerjik agonistlerin kardiyovasküler sistem üzerindeki etkilerini güçlendirebilir. QTc-aralığını uzattığı bilinen ilaçlara ventriküler aritmi eşlik etme riski artar (bkz. Bölüm 4.4).Diğer sempatomimetik maddelerin birlikte verilmesi, FORMODAY'in istenmeyen etkilerini güçlendirebilir. Atomoksetin formoterolden kaynaklanan taşikardiyi artırabilir. Ksantin türevleri, steroidler veya diüretikler ile birlikte tedavi betaı-agonistlerin muhtemel hipokalemik etkisini kuvvetlendirebilir (bkz. Bölüm 4.4). Halojenli hidrokarbonlarla eşzamanh anestezi alan hastalarda aritmi riski artmaktadır. Beta-adreneıjik blokörler FORMODAY'in etkisini zayıflatabilirler veya antagonize edebilirler. Bu yüzden FORMODAY, zorunlu olmadıkça, beta-adreneıjik blokörler (göz damlalan dahil) ile birlikte verilmemelidir. Formoterol, beta-blokörlerin (betaı-selektif) bradikardik etkisini azaltabilir. Antİkolineıjik ilaçlar formoterolün bronkodilatör etkisini artırabilir. Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlara ilişkin hiçbir klinik etkileşim çalışması yürütülmemiştir.Pediyatrik popülasyon:Pediyatrik popülasyona ilişkin hiçbir klinik etkileşim çalışması yürütülmemiştir.4.6. Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi: CÇocuk doğurma potansiyeli bulunan kadmlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadmlar için FORMODAY tedavisi sırasında özel bir gereklilik bulunmamaktadır. Eğer gebelik tespit edilirse, devam eden FORMODAY tedavisinin altematif tedavilere karşı yarar/risk oranı değerlendirilmelidir.Gebelik dönemiFORMODAY, gerekli olmadıkça gebelik döneminde kullanılmamalıdır.FORMODAY'in gebelik döneminde emniyeti henüz tespit edilmemiştir. Daha güvenli bir altematif olduğu takdirde gebelik dönemi (özellikle hamileliğin sonunda ve doğum esnasında) süresince kullanımından kaçımlmahdır. Diğer beta 2-adreneıjik uyancılar gibi formoterol de uterus düz kası üzerine gevşetici etkisi nedeniyle, doğum sürecini basblayabilir. Hayvan deneylerinde teratojenik etki görülmemiştir. Oral verildikten sonra formoterol emziren sıçanların sütünde tespit edilmiştir.Hamilelikte sadece anneye sağlayacağı yarar fetusa olabilecek riskten daha fazlaysa kullanılmalıdır. Laktasyon dönemiFORMODAY'in emzirme döneminde emniyeti henüz tespit edilmemiştir. Ancak, FORMODAY kullanan anneler emzirmemelidir. Formoterolün insan sütüne geçip geçmediği bilinmemektedir. Etkin madde emziren sıçanlann sütünde tespit edilmiştir.Üreme yeteneği/FertiIiteBölüm 5.3'e bakımz.4.7. Araç ve makine kullanımı üzerindeki etkilerBaş dönmesi veya buna benzer yan etkiler gelişen hastalara, araç ve makine kullanmamalan önerilmelidir.4.8. İstenmeyen etkilerCiddi astım ataklan:Formoterol ile uygulanan en az 4 haftalık plasebo-kontrollü klinik çalışmalar, formoterol alan hastalarda ciddi astım ataklarının sıklığının (günde iki kez 10-12 mikrogram için %0.9, günde iki kez 24 mikrogram için %1.9) plasebo alanlardakine (%0.3) göre daha yüksek olduğunu düşimdürmüştür (özellikle 5-12 yaş arası hastalarda). Astımh adolesan ve yetişkin hastalardaki deneyimler: ABD'de ruhsatlandırma için yapılan ve 12 yaş ve üstü toplam 1095 hastanın katıldığı 12 haftalık iki önemli kontrollü çalışmada, ciddi astım ataklannm (astımın hastanın hastaneye yatınimasmı gerektiren akut kötüleşmesi) günde iki kez verilen formoterol 24 mikamuygulamasında (9/271, %3.3) günde iki kez verilen formoterol 12 mikrogram uygulamasına (1/275, %0.4), plaseboya (2/277, %0.7) ya da albuterole (2/272, %0.7) göre daha sık ortaya çıktığı gözlenmiştir.Bu gözlemi araştırmak amacıyla daha sonra yapılan ve 2085 hastanın katıldığı bir klinik çalışmada, yüksek ve düşük doz gruplannda astımla ilgili ciddi advers olaylar karşılaştmbmştır. 16 hafta süren bu klinik çalışmada elde edilen sonuçlar, formoterol dozuyla açık bir ilişki göstermemiştir. Bu çalışmada, ciddi astım ataklarımn görüldüğü hastalann yüzde orammn formoterolde plaseboya göre biraz yüksek olduğu görülmüştür (üç çift-kör tedavi grubu için: formoterol 24 mikrogram günde iki kez (2/527, %0.4), formoterol 12 mikrogram günde iki kez (3/527, %0.6) ve plasebo (1/514, %0.2) ve açık-etiketli tedavi grubu için: formoterol 12 mikrogram günde iki keze ilave olarak ayrıca günde en fazla iki ek doz (1/517, %0.2). 5 yaş ve üzerindeki astımlı çocuklardaki deneyimler: Günde iki kez verilen formoterol 12 mikrogram dozun günde iki kez verilen fonnoterol 24 mikrogram doza ve plaseboya göre güvenliliği; günlük bronkodilatör ve antienflamatuvar tedaviye ihtiyaç duyan astım hastası 518 çocuğun (5-12 yaş arasmdaki) katıldığı 52 haftalık, çok merkezli, randomize, çift-kör büyük bir çalışmada araştınimıştır. Günde iki kez formoterol 24 mikrogram (11/171, %6.4) ya da günde iki kez formoterol 12 mikrogram alan (8/171, %4.7) çocuklarda görülen ciddi astım ataklarmın plasebo alan çocuklardakine (0/176, %0.0) göre daha fazla olduğu görülmüştür. Diğer istenmeyen etkiler: Advers ilaç reaksiyonlan, en sık görülen advers reaksiyon ilk sırada olacak şekilde sıklıklarına göre aşağıda sıralanmıştır. Her sıklık grubunda advers reaksiyonlar azalan ciddiyet derecesine göre sıralanmıştır. Advers ilaç reaksiyonlan MedDRA'daki sistem organ sınıflanna göre listelenmektedir. Her bir sistem organ sımft içinde advers ilaç reaksiyonları azalan ciddiyet sırasına göre sunulmaktadır: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (< 1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Bağışıklık sistemi hastalıklarıÇok seyrek: Aşın duyarhlık (hipotansiyon, ürtiker, anjiyonörotik ödem, kaşıntı, egzantem dahil)Psikiyatrik hastalıklarYaygın olmayan: Ajitasyon, anksiyete, asabiyet, uykusuzlukYaygın olmayan: Baş dönmesi Çok seyrek: Tat alma duyusu bozukluklan Sinir sistemi hastalıklarıYaygın: Baş ağrısı, titremeKardiyak hastalıklarYaygm: Palpitasyonlar Yaygın olmayan: Taşikardi Çok seyrek: Periferik ödemSolunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın olmayan: Paradoksal bronkospazm dahil bronkospazm, boğaz irritasyonu, akut astım alevlenmesiGastrointestinal hastalıklarÇok seyrek: BulantıKas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın olmayan: Kas kramplan, miyaljiPazarlama sonrası spontan bildirimlerden elde edilen istenmeyen etkilerFormoterol ile tedavi edilen hastalarda aşağıdaki pazarlama sonrası advers ilaç reaksiyonlan bildirilmiştir. Bu reaksiyonlar büyüklüğü kesin olmayan bir popülasyondan isteğe bağlı olarak bildirilmiş olduğundan, güvenilir bir şekilde sıklığı belirlemek mümkün değildir; dolayısıyla bilinmiyor olarak kategorize edilmiştir.Metabolizma ve beslenme hastalıklarıBilinmiyor: Hipokalemi, hiperglisemiKardiyak hastalıklarBilinmiyor: Elektrokardiyogramda QT uzaması, anjina pektoris, atriyal fıbrilasyon gibi kardiyak aritmiler, ventriküler ekstrasistol, taşiaritmiSolunum, göğüs bozuklukları ve mediastinal hastalıklarıBilinmiyor: ÖksürükDeri ve deri altı doku hastalıklarıBilinmiyor: Deri döküntüsüAraştırmalarBilinmiyor: Kan basıncında artış (hipertansiyon dahil)4.9. Doz aşımı ve tedavisiBelirtiler:FORMODAY'in aşın dozuna bağlı olarak beta 2-adrenerjik uyancılann tipik etkilerinin görülmesi beklenir: bulantı, kusma, baş ağnsı, tremor, sedasyon, palpitasyonlar, taşikardi, ventriküler aritmiler, metabolik asidoz, hipokalemi, hiperglisemi, hipertansiyon.Tedavi: Destekleyici ve semptomatik tedavi uygulanır. Ciddi vakalarda hastalar hastaneye yatınimalıdır. Kardiyoselektif beta-blokörlerin kullanılması düşünülebilir, fakat beta-adrenerjik blokör kullanımı bronkospazma neden olabileceğinden bu tedavi yalnızca doktor gözetimi altında ve çok dikkatli uygulanmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1, Farmakodinamik özelliklerFarmakoterapötik grup: Selektif beta2-adrenoreseptör agonisti ATC kodu: R03AC13Formoterol güçlü seçici bir beta 2-adreneıjik uyarıcıdır. Geri dönüşlü soluk yolu tıkanmaları olan hastalarda bronkodilatör bir etki gösterir. Etkisi çabuk (1-3 dakika içinde) başlar ve inhalasyondan 12 saat sonra hala belirgindir. Terapötik dozlarda, kardiyovasküler etkileri önemsizdir ve ara sıra görülür.Formoterol pasif olarak duyarlı hale getirilen insan akciğerlerinden lökotrienlerin ve histaminin salıverilmesini inhibe eder. Hayvanlarda yapılan deneylerde; ödemin ve iltihap hücrelerinin toplanmasının inhibisyonu gibi bazı antienflamatuvar özellikler gözlenmiştir. Kobay trakeasındaki in2-adrenoseptör agonistleri olduklannı göstermiştir. (R,R)-enantiomerinden 800-1000 kat daha az potent olan (S,S)-enantiomeri, (R,R)-enantiûmerinin trakea düz kası üzerindeki aktivitesini etkilemez. Enantiomerlerden herhangi birinin rasemik karışıma tercih edilmesini gerektirecek herhangi bir farmakolojik neden yoktur.İnsanda, inhale edilen aleıjenlerin, egzersizin, soğuk hava, histamin veya metakolinin neden olduğu bronkospazmı önlenmede formoterolün etkili olduğu gösterilmiştir. Kuru toz inhaler ile günde iki defa 12 mikrogram ve günde iki defa 24 mikrogram dozlarda inhale edilen formoterolün, stabil kronik obstrüktif akciğer hastalığı (KOAH) olan hastalarda hi7.1ıetki ile bronkodilatasyon sağladığı, etkisinin en az 12 saat sürdüğü ve Saint George Solunum Yolları Anketi sonucuna göre yaşam kalitesi açısından kişisel faydayı beraberinde getirdiği gösterilmiştir.5.2. Farmakokinetik özellikler Genel özelliklerFORMODAY'in terapötik doz aralığı günde iki kez 12-24 mikrogramdır. Formoterolün plazma farmakokinetiği verileri sağlıklı gönüllülerde önerilen doz aralığından daha yüksek dozlar ve KOAH hastalannda terapötik dozların inhale edilmesi ile derlenmiştir. İdrarda saptanan ve sistemik maruziyetin dolaylı bir göstergesi olarak kullanılan değişime uğramamış formoterol düzeyleriyle, plazmadaki ilaç farmakokinetiği verileri arasında korelasyon vardır, idrar ve plazma için hesaplanan eliminasyon yan ömürleri birbirine yakındır.Emilim:Sağlıklı gönüllülerde formoterol fiimaratm 120 mikrcgramlık tek bir doz inhalasyonunu takiben, formoterol hızla plazmaya geçerek inhalasyonu izleyen 5 dakika içerisinde, maksimum konsantrasyon olan 266 pmol/rye ulaşmıştır. 12 hafta boyunca günde iki defa 12 veya 24 mikrogram formoterol fumarat ile tedavi edilen KOAH hastalannda inhalasyondan 10 dakika, 2 saat ve 6 saat sonraki ortalama plazma formoterol konsantrasyonları; sırasıyla, 11.5-25.7 ve 23.3 -50.3 pmol/1 arasında değişmiştir. Formoterolün ve/veya (R,R) ve (S,S) enantiomerlerinin k ümülatif üriner itrahım araştıran çalışmalar, dolaşımdaki formoterol miktarmın inhale edilen doz ile orantılı olarak arttığını göstermiştir (12- 96 mikrogram).12 hafta süreyle günde 2 defa 12 mikrogram veya 24 mikrogram inhalasyonundan sonra idrarla atılan, değişikliğe uğramamış formoterol düzeyleri, astım hastalannda %63 ve %73 (ilk dozla son doz karşılaştınidığmda), KOAH hastalannda %19 ve %38 arasında değişen oranlarda yükselmiştir. Bu veriler, tekrarlanan dozlarda kullamlan formoterolün plazmada sınırlı olarak biriktiği izlenimini vermektedir. Tekrarlayan dozlardan sonra enantiomerlerden birinin, diğerinden daha fazla biriktiğine tamk olunmamıştır. inhale edilen diğer ilaçlar için bildirildiği üzere inhaler aracıhğıyla kullanılan formoterol dozımun çok büyük bölümü yutuhnakta ve daha sonra gastrointestinal kanaldan emilmektedir. ^H ile işaretlenmiş 80 mikrogram formoterolün, iki gönüllüye oral olarak verilmesinin ardmdan dozun en az %65'i emilmiştir. Dağılım:Formoterolün pla 2ma proteinlerine bağlanma oranı %61-64'tür. Bunun önemli bir kısmı (%34) insan serum albüminine bağlanır. Terapötilc dozlar ile erişilen konsantrasyon aralığında bağlanma yerlerinde doyma olmaz.Biyotransformasvon:Formoterol başlıca metabolizma ile elimine edilir; doğrudan glukuronidasyon biyotransformasyonun ana yoludur. Glukuronidasyonun izlediği O-demetilasyon, diğer bir biyotransformasyon yoludur. Formoterolün sülfat konjugasyonu ve ardmdan yine sülfat konjugasyonunun gerçekleştiği deformilasyon, minör metabolik yollardır. Formoterolün glukuronidasyonunda (UGTİAI, 1A3, 1A6, 1A7, 1A8, 1A9, lAlO, 2B7 ve 2B15) ve 0-demetilasyonunda (CYP2D6, 2C19, 2C9 ve 2A6) çok sayıda izoenzimin katalizör rolünü oynuyor olması; formoterol metabolizmasındaki spesifik bir izoenzimin inhibisyonu üzerinden ilaç-ilaç etkileşim potansiyelinin düşük olduğu izlenimini vermektedir. Terapötik dozlarla elde edilen konsantrasyonlardaki formoterol, sitokrom P450 izoenzimlerini inhibe etmemiştir veya indüklememiştir. Rliminasvon:12 hafta boyunca günde 2 defa 12 veya 24 mikrogram formoterol flımaratla tedavi edilen astım ve KOAH hastalannda, verilen dozun sırasıyla yaklaşık %10'u ve %7'si değişikliğe uğramamış olarak idrarda saptanmıştır. İdrardaki, değişikliğe uğramamış formoterolün; 12120 mikrogram arasında değişen tek dozların verildiği sağlıklı gönüllülerdeki ve tek ve tekrarlanan dozlar kullanan astım hastalanndaki %40'ınm (R,R), %60'ının (S,S)-enantiomeri olduğu görülmüştür. İlaç ve metabolitleri vücuttan tamamen atılırlar; bir oral dozun yaklaşık 2/3'si idrarla ve 1/3'i feçesle atılır. Kandaki formoterolün renal klerensi 150 ml/dakikadır. Sağlıklı gönüllülerde 120 mikrogram tek doz formoterol fumarat inhalasyonundan sonra, idrarla atılma oranlanndan hesaplanan, plazmadaki eliminasyon yarı-ömrü, formoterolde 10 saat; (R,R) ve (S,S)- enantiomerlerinde ise sırasıyla 13.9 ve 12.3 saat ölçülmüştür. Doğrusallık/Doğrusal Olmavan Durum:Doğrusallık/doğrusal olmayan durum hakkında mevcut veri bulunmamaktadır. Hastalardaki karakteristik özelliklerKaraciğer/Böbrek yetmezliği:Formoterolün karaciğer veya böbrek yetmezliği bulunan hastalardaki farmakokinetiği incelenmemiştir. Pedivatrik popülasvon:5-12 yaş grubundaki astımlı çocuklara 12 hafta boyunca inhalasyon yoluyla günde iki defa 12 veya 24 mikrogram formoterol flmıarat verilerek yapılan bir çalışmada; değişime uğramaksızın idrarla atılan formoterol miktarı, ilk dozdan sonrakine kıyasla %18 ile %84 arasında değişen oranda artmıştır. Çocuklardaki birikim, erişkin hastalardakinden farklı olmamış ve %63 ile %73 arasmda değişen bir oranda artmıştır (bkz. Emilim). İncelenen çocuklarda verilen formoterol dozunun yaklaşık %6'sı, değişmemiş formoterol olarak idrarda bulunmuştur. Gerivatrik popülasvon:Formoterolün yaşlı hastalardaki farmakokinetiği incelenmemiştir. Cinsiyet:Formoterol farmakokinetiği, hastalann kilosuna göre düzeltildikten sonra, erkeklerle kadınlar arasında, istatistiksel anlama sahip fark göstermemiştir. 5.3. Klinik öncesi güvenlilik verileriMutajenisite:Deneysel bitiş noktalan geniş bir alanı kapsayan mutajenik etki testleri yapılmış; hiçbir 'm viiroinvivotestte genotoksik etki bulunmamıştu-.Karsinojenisite:Sıçanlarda ve farelerde yapılan iki yılhk çalışmalarda, herhangi bir karsinojenik potansiyel görülmemiştir. Çok yüksek dozlarla muamele edilmiş erkek farelerde selim adrenal subkapsüler hücre tümörleri görülme sıklığı hafifçe yüksek bulunmuştur. Ancak bu bulgu, yüksek dozlarda dişi genital organındaki selim düz kas tümörler ininve her iki cinsiyette görülen karaciğer tümörlerinin görülme sıklığında artış şeklinde patolojik değişikliklerin olduğu ikinci bir fare çalışmasında görülmemiştir.Çeşitli doz aralıklannda sıçanlarda yapılan iki çalışmada, mezovariyal leyomiyomlarda artış görülmüştür. Bu selim neoplazmalar sıçanlann beta 2-adrenerjik ilaçların yüksek dozlan ile uzun süreli tedavisinde genellikle görülürler. Över kistleri ve selim granulosa/tekal hücreli tümörlerde de artış görülmüştür; beta agonistlerin sıçanlarda överlere, çok muhtemelen kemiricilere has olan, etkileri olduğu bilinmektedir. Daha yüksek dozlarm kullanıldığı birinci çalışmada bildirilen diğer birkaç tip tümör, kontrol grubundakilere benzer sıklıkta görülmüş ve daha düşük doz kullanılan çalışmalarda görülmemiştir.Tümör sıkhklanmn hiçbiri ikinci çahşmada kullanılan en düşük doz (insanlarda formoterolün tavsiye edilen maksimum dozundan beklenenden 10 kat daha yüksek sistemik düzeye yol açan bir doz) da istatistiksel olarak anlamh bir dereceye yükselmemiştir. Bu bulgulara ve mutajenik potansiyelinin olmamasına dayanarak, formoterolün terapötik dozlarda kullanımının karsinojenik bir riski olmadığı hükmüne vanimıştır. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiLaktoz6.2. GeçimsizliklerBilinen geçimsizliği yoktur.6.3. Raf ömrü24 ay6.4. Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında saklayımz.6.5. Ambalajın niteliği ve içeriğiFORMODAY 12 mcg inhalasyon için toz içeren 60 ve 120 kapsül, PVC/PVDC/Alü blister ambalajlarda inhalasyon cihazı içeren karton kutuda, kullanma talimatı ile beraber ambalajlanır.6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullamimamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklannm Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir.7. RUHSAT SAHİBİUlm İlaç San. Tie. Ltd. Şti.General Ali Rıza Gürcan Cad. Merter İş Merkezi Bağımsız Bölüm No 2/2 Güngören /İSTANBUL Telefon: O 212 481 94 91 Faks: O 212 481 94 91 e-mail: [email protected] 8. RUHSAT NUMARASI (LARI)235/999. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 20.10.2011 Ruhsat yenileme tarihi:10. KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriFormoday 12 mcg İnhalasyon Toz İçeren KapsülEtken Maddesi: Formoterol fumarat dihidrat Atc Kodu: R03AC13 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.