Onbrez Breezhaler 150µg İnhaler Kapsül Kısa Ürün BilgisiSolunum Sistemi » Solunum Sisteminde Tıkanma - Astım İlaçları » Adrenerjikler (İnhalan) » Selektif Beta 2 Adrenoreseptör Agonistleri » Indacaterol KISA URUN BILGISI1. BEŞERI TIBBI ÜRÜNÜN ADIONBREZ BREEZHALER 150 mikrogram İnhaler kapsül2. KALITATIF VE KANTIFATIF BILEŞIMEtkin madde :İndakaterol maleat 194 ^g (150 mikrogram indakaterole eşdeğer bazda) Cihazdan serbestlenen doz (ONBREZ BREEZHALER cihazının ağız parçasından çıkan doz) 120 mikrogram indakateroldür. Yardımcı maddeler: Laktoz monohidrat 24.806 mg Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTIK FORMİnhaler kapsüliçerisinde beyaz toz bulunan, şeffaf ve renksiz gövde ve başlığa sahip sert jelatin kapsüllerin başlık kısmındaki siyah bir çizginin altında siyah renkte firma logosu ", no: 3 boyutundaki gövdesindeki siyah çizginin üst kısmında siyah renkte ürün kodu IDL 150 basılıdır. 4. KLİNIK ÖZELLIKLER4.1. Terapötik endikasyonlarONBREZ BREEZHALER, kronik obstrüktif akciğer hastalığı (KOAH) olan yetişkin hastalardaki hava yolu obstrüksiyonunun idame (sürekli) tedavisinde endikedir. 4.2. Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi: Önerilen doz, ONBREZ BREEZHALER inhalasyon cihazı kullanılarak bir adet 150 mikrogramlık kapsül içeriğinin günde bir kere inhalasyonudur. Doz, sadece tıbbi tavsiye üzerine artırılmalıdır. Günde bir kez, 1 adet 300 mikrogramın ONBREZ BREEZHALER cihazı ile inhalasyonunun, özellikle şiddetli KOAH'ı olan hastalarda nefes darlığı açısından ilave klinik yarar sağladığı gösterilmiştir. Gerektiğinde maksimum doz olan günde 300 mikrograma çıkılabilir. Uygulama şekli: ONBREZ BREEZHALER kapsülleri sadece ONBREZ BREEZHALER inhalasyon cihazı kullanılarak oral inhalasyon yolu ile uygulanmalıdır. ONBREZ BREEZHALER kapsüller yutulmamalıdır. ONBREZ BREEZHALER kapsüller her zaman blister ambalajında saklanmalı ve KULLANMADAN HEMEN ÖNCE blisterden çıkarılmalıdır. ONBREZ BREEZHALER, her gün aynı saatte uygulanmalıdır. Eğer bir doz kaçırılırsa, sonraki doz ertesi gün her zamanki saatinde alınmalıdır. Her ürün ambalajı bir adet ONBREZ BREEZHALER cihazı içermektedir. Kutu içerisindeki kapsüller bittikten sonra inhalasyon cihazı atılır. Kullanıma ilişkin talimatlar: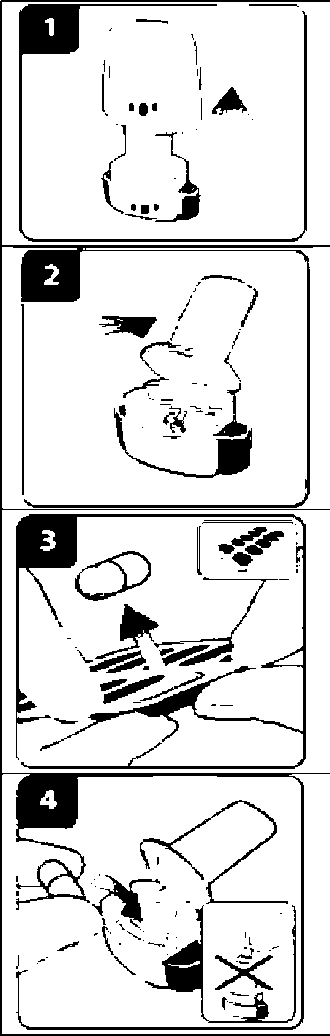 Başlığı çekerek çıkartın. İnhalasyon cihazını açın: İnhalasyon cihazının alt kısmını sıkı bir şekilde tutarken, ağızlığı cihaz üzerindeki işaret yönünde eğerek inhalasyon cihazını açın. Kapsülü hazırlayın: Kullanmadan hemen önce blisterden bir kapsül çıkarın.(Bu sırada ellerinizin kuru olmasına özen gösterin.) Kapsülü yerleştirin: Kapsülü kapsül haznesinin içerisine yerleştirin. Kapsülü hiçbir zaman doğrudan ağızlığa yerleştirmeyin. Inhalasyon cihazını kapatın: İnhalasyon cihazını bir klik sesi duyacak şekilde kapatın. 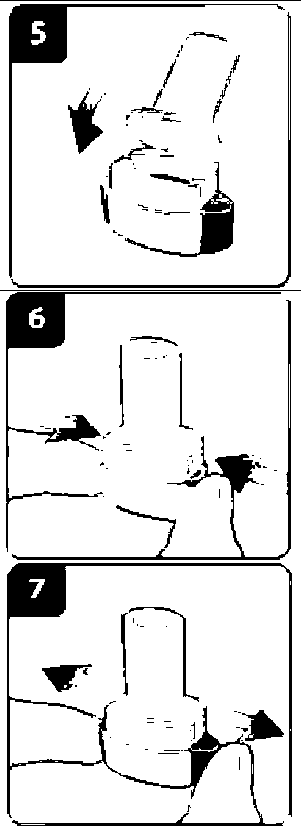 Kapsülün delinmesi: İnhalasyon cihazını ağızlık kısmı yukarı bakacak şekilde dik tutun. Yandaki düğmelere aynı anda sıkıca basın ve bırakın. Bu şekilde kapsül delinmiş olacaktır. Bu işlemi sadece bir kere yapın. Kapsül delinirken bir klik sesi duymuş olmalısınız. Nefes verin: 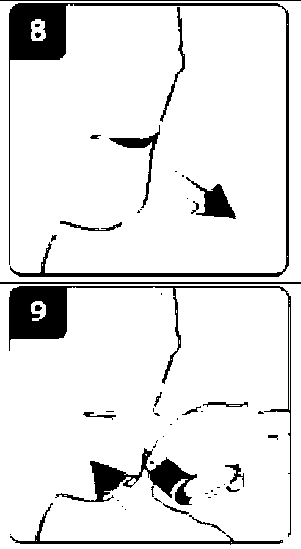 Ağızlığı ağzınıza yerleştirmeden önce nefesinizi tam olarak verin. Ağızlığın içine üflemeyin. Ilacı inhalasyon yoluyla uygulayın İlacın derin nefes alma yoluyla solunum yollarına çekilmesi için: İnhalasyon cihazını şekilde görüldüğü gibi tutun. Yandaki düğmeler sağa ve sola bakmalıdır. Yandaki düğmelere basmayın. Ağızlığı ağzınıza yerleştirin ve dudaklarınızı sıkı bir şekilde kapatın. Hızlı, fakat kesintisiz ve olabildiğince derin bir nefes alın. Not: İnhalasyon cihazı aracılığıyla nefes alırken, kapsül hazne içinde dönecektir ve bu sırada bir 'vızıldama' sesi duymanız gerekir. İlaç akciğerlerinize doğru giderken şeker tadı hissedeceksiniz. 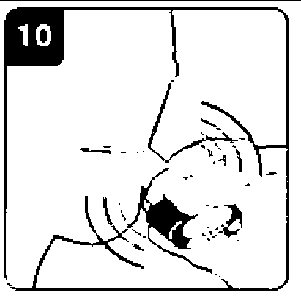 İlave bilgi Nadiren kapsül parçacıkları ara bölmeyi geçip ağzınıza gelebilir ve bunları dilinizde hissedebilirsiniz. Bu parçacıkların yutulması ya da inhale edilmesi zararlı değildir. Eğer kapsül kazara bir kereden fazla delinmişse (6. adım) kapsülün parçalanma olasılığı artacaktır. Eğer bir vızıldama sesi duymazsanız: Kapsül, kapsül haznesinde sıkışmış olabilir. Böyle bir durumun meydana gelmesi durumunda: İnhalasyon cihazını açın ve cihazın alt parçasına hafifçe vurarak kapsülün rahat hareket etmesini sağlayın. Yandaki düğmelere basmayın. 8. ve 9. adımları tekrarlayarak ilacı inhalasyon yoluyla alın. Nefesinizi tutun:  İlacı inhalasyon yoluyla aldıktan sonra: İnhalasyon cihazını ağzınızdan çıkarırken, en az 5-10 saniye ya da rahatsızlık duymayacağınız kadar nefesinizi tutun. Daha sonra nefesinizi verin. Kapsül içinde toz kalıp kalmadığını görmek için inhalasyon cihazını açın. Eğer kapsülde toz kalmışsa: İnhalasyon cihazını kapatın. 8., 9., 10. ve 11. adımları tekrarlayın. Hastaların büyük kısmı bir ya da iki inhalasyonda kapsülü boşaltabilmektedir. İlave bilgi Bazı kişiler ilacı inhalasyon yoluyla aldıktan sonra nadiren kısa süre öksürebilmektedir. Eğer öksürürseniz endişelenmeyin. Kapsül boş olduğu sürece yeterince ilaç almış olacaksınız._İlaç uygulamasını tamamladıktan sonra: Ağızlığı tekrar açın ve kapsül haznesini eğerek boş kapsülü çıkartın. Boş kapsülü atın. 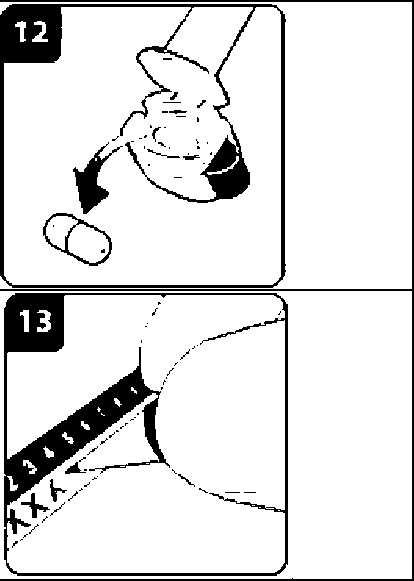 İnhalasyon cihazını kapatın ve kapağı yerine takın. Kapsülleri Onbrez Breezhaler inhalasyon cihazı içinde saklamayın. Günlük doz takip çizelgesini işaretleyin: Paketin içinde günlük doz takip çizelgesi bulunmaktadır. Eğer bir sonraki dozu ne zaman almanız gerektiğini hatırlama konusunda size yardımcı oluyorsa, o günün kutusuna bir işaret koyun. Özel popülasyonlara ilişkin ek bilgiler: Böbrek yetmezliği: Böbrek yetmezliği olan hastalarda doz ayarlamasına gerek bulunmamaktadır (bkz. Bölüm 5.2). Karaciğer yetmezliği: Hafif ila orta şiddette karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Şiddetli karaciğer yetmezliği olan hastalarda ONBREZ BREEZHALER kullanımı ile ilgili veri mevcut değildir (bkz. Bölüm 5.2). Pediyatrik popülasyon: ONBREZ BREEZHALER, 18 yaşın altındaki hastalarda kullanılmamalıdır. Geriyatrik popülasyon: Maksimum plazma konsantrasyonu ve genel sistemik maruziyet yaşla birlikte artmaktadır; ancak yaşlı hastalarda doz ayarlamasına gerek bulunmamaktadır (bkz. Bölüm 5.2). 4.3. Kontrendikasyonlar Etkin maddeye ya da yardımcı maddelerden herhangi birine karşı aşırı duyarlılıkta kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleri Astım: ONBREZ BREEZHALER, astımda kullanılmamalıdır, çünkü astımda ONBREZ BREEZHALER ile ilgili uzun dönem sonuç verileri yoktur. Paradoksal bronkospazm: Diğer inhalasyon tedavilerinde olduğu gibi ONBREZ BREEZHALER uygulaması da yaşamı tehdit edebilen paradoksal bronkospazm ile sonuçlanabilir. Paradoksal bronkospazm oluşursa, ONBREZ BREEZHALER hemen kesilmeli ve alternatif tedavi başlanmalıdır. Hastalığın kötüleşmesi: ONBREZ BREEZHALER, akut bronkospazm epizotlarının tedavisi için (yani kurtarma tedavisi olarak) endike değildir. ONBREZ BREEZHALER tedavisi sırasında KOAH'ta (Kronik Obstrüktif Akciğer Hastalığı) kötüleşme görülürse, hastanın ve KOAH tedavi rejiminin tekrar değerlendirilmesi gereklidir. ONBREZ BREEZHALER günlük dozunun, 300 mikrogramlık maksimum dozun üzerine çıkarılması uygun değildir. Sistemik etkiler: Önerilen dozlarda ONBREZ BREEZHALER uygulamasından sonra kardiyovasküler sistem üzerinde klinik olarak anlamlı herhangi bir etki genellikle gözlenmemesine rağmen diğer beta2-adrenerjik agonistlerde olduğu gibi ONBREZ BREEZHALER de kardiyovasküler bozukluğu (koroner arter hastalığı, akut miyokard infarktüsü, kardiyak aritmiler ve hipertansiyon), konvülsif bozukluğu veya tirotoksikozisi olan hastalarda ve beta2-adrenerjik agonistlere beklenmedik şekilde yanıt veren hastalarda dikkatle kullanılmalıdır. Diğer inhale beta2-adrenerjik ilaçlarla olduğu gibi ONBREZ BREEZHALER, tavsiye edilenden daha yüksek dozda ve sıklıkta kullanılmmalıdır. ONBREZ BREEZHALER, diğer uzun etkili beta2-adrenerjik agonistlerle ya da uzun etkili beta2-adrenerjik agonistleri içeren bir tedavi ile birlikte kullanılmamalıdır. Kardiyovasküler etkiler: ONBREZ BREEZHALER, diğer beta2-adrenerjik agonistler gibi, bazı hastalarda, nabız, kan basıncı ve/veya semptomlarda artışla ölçülen klinik olarak anlamlı kardiyovasküler etki oluşturabilir. Bu tür etkiler oluşursa tedavinin kesilmesi gerekebilir. Ayrıca, beta-adrenerjik agonistlerin EKG değişiklikleri (T dalgasında düzleşme ve ST segment depresyonu) oluşturduğu bildirilmiştir. Bu bulguların klinik önemi bilinmemektedir. Önerilen terapötik dozlarda ONBREZ BREEZHALER'in kullanıldığı klinik çalışmalarda QTc-aralığının uzaması üzerinde klinik açıdan anlamlı etkiler gözlenmemiştir (bkz. bölüm 5.1). Hipokalemi: Beta2-adrenerjik agonistler, bazı hastalarda kardiyovasküler advers etkiler oluşturma potansiyeli olan anlamlı hipokalemi oluşturabilir. Serum potasyum düzeyinde düşüş genellikle geçicidir ve takviye gerektirmez. Şiddetli KOAH'lı hastalarda hipokalemi; hipoksi ve eş zamanlı olarak kullanılan tedavilerle (bkz. Bölüm 4.5.) artabilir ve bu da kardiyak aritmilere karşı duyarlılığı artırabilir. Hiperglisemi: Beta2-adrenerjik agonistlerin yüksek dozlarda inhalasyonu, plazma glukozunda artışlara yol açabilir. ONBREZ BREEZHALER tedavisinin başlatılmasını takiben plazma glukozu diyabetik hastalarda daha yakından takip edilmelidir. Klinik çalışmalar sırasında kan glukozundaki klinik açıdan anlamlı değişiklikler, önerilen dozlarda ONBREZ BREEZHALER'in uygulandığı grupta plaseboya göre %1-2 daha sık gözlenmiştir. ONBREZ BREEZHALER, diyabeti iyi kontrol altında olmayan hastalarda araştırılmamıştır. Laktoz: Nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glikoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri QTc aralığını uzattığı bilinen ilaçlar: Diğer beta2-adrenerjik agonistler gibi ONBREZ BREEZHALER, monoamin oksidaz inhibitörleri, trisiklik antidepresanlar ya da QT aralığını uzattığı bilinen ilaçlar ile tedavi edilen hastalarda dikkatli kullanılmalıdır. Zira bu ilaçların QT aralığı üzerindeki etkisi artabilir. QT aralığını uzattığı bilinen ilaçlar, ventriküler aritmi riskini artırabilir (bkz. bölüm 4.4.) Sempatomimetik ajanlar: Diğer sempatomimetik ajanların eş zamanlı uygulanması (tek başına veya kombinasyon tedavisinin bir parçası olarak) ONBREZ BREEZHALER'in istenmeyen etkilerini güçlendirebilir. ONBREZ BREEZHALER, diğer uzun etkili beta2-adrenerjik agonistler ya da uzun etkili beta2-adrenerjik agonistler içeren tıbbi ürünlerle birlikte kullanılmamalıdır. Hipokalemik tedavi: Metilksantin türevleri (örn. teofilin), steroidler (örn. prednizolon) veya potasyum tutucu olmayan diüretikler ile eş zamanlı tedavi, beta2-adrenerjik agonistlerin olası hipokalemik etkisini güçlendirebilir, bu nedenle dikkatli kullanılmalıdır (bkz. Bölüm 4.4). Beta-adrenerjik blokerler: Beta-adrenerjik blokerler (örn. propranolol), beta2-adrenerjik agonistlerin etkisini zayıflatabilir veya antagonize edebilir. Bu nedenle, kullanılmaları zorunlu olmadığı sürece indakaterol, beta-adrenerjik blokerlerle (timolol içeren göz damlaları dahil) birlikte kullanılmamalıdır. Gerekli olduğu durumlarda kardiyoselektif beta-adrenerjik blokerler tercih edilmeli, ancak bunlar dikkatle uygulanmalıdır. Metabolik ve taşıyıcı bazlı etkileşimler: İndakaterol klerensinde temel rolü olan CYP3A4 ve P-glikoproteinin inhibisyonu, sistemik indakaterol maruziyetini iki kata kadar artırmaktadır. ONBREZ BREEZHALER'in önerilen maksimum terapötik dozların 2 katına kadar olan dozlarda, 1 yıla kadar süreyle kullanıldığı klinik çalışmalarda tedavi konusunda elde edilen güvenlilik deneyimi göz önüne alındığında, ilaç etkileşimlerine bağlı olarak maruziyet büyüklüğünün artışı herhangi bir güvenlilik endişesi oluşturmamaktadır. İndakaterolün eş zamanlı kullanılan ilaçlarla etkileşime neden olduğu gösterilmemiştir. İn vitroaraştırmalar indakaterolün, klinik uygulamada elde edilen sistemik maruziyet düzeylerinde, ilaçlarla metabolik etkileşimlere neden olma potansiyelinin ihmal edilebilir düzeyde olduğunu göstermiştir.4.6. Gebelik ve laktasyon Genel tavsiye Gebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) Diğer beta2-adrenerjik agonistler gibi ONBREZ BREEZHALER de, uterus düz kası üzerinde gevşetici etkiye bağlı olarak doğum eylemini inhibe edebilir. Gebelik dönemi Hayvanlar üzerinde yapılan calışmalar, gebelik /ve-veya/ embriyonal/fetal gelisim /veveya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. ONBREZ BREEZHALER, gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Laktasyon dönemi İndakaterol/metabolitlerin insan sütüne geçip geçmediği bilinmemektedir. Hayvanlardan elde edilen farmakokinetik/toksikolojik veriler indakaterol/metabolitlerin süte geçtiğini göstermektedir. Emzirmenin çocuk için ve tedavinin anne için yararları göz önüne alınarak emzirmenin ya da ONBREZ BREEZHALER tedavisinin bırakılması kararı verilmelidir. Üreme yeteneği/Fertilite: Sıçanlarda gebelik oranlarında düşme gözlenmiştir. Yine de, önerilen maksimum dozda inhalasyonu takiben, indakaterolün insanlarda üreme ya da fertilite performansını etkilemesinin pek olası olmadığı düşünülmektedir (bkz. bölüm 5.3). 4.7. Araç ve makine kullanımı üzerindeki etkiler ONBREZ BREEZHALER'in araç ve makine kullanımı üzerine hiçbir etkisi yoktur ya da ihmal edilebilir bir etkisi vardır. 4.8. İstenmeyen etkiler Önerilen dozlarda gözlenen en yaygın advers reaksiyonlar; nazofarenjit (%9.6), öksürük (%6.6), üst solunum yolu enfeksiyonu (%5.6) ve kas spazmlarıdır (3.8%). Bunların büyük kısmı hafif ya da orta şiddettedir ve tedavinin devam ettirilmesi durumunda sıklıkları azalmaktadır. KOAH hastalarında önerilen dozlarda ONBREZ BREEZHALER'in advers ilaç reaksiyonu profili, beta2-adrenerjik stimülasyonunun klinik olarak anlamlı olmayan sistemik etkilerini göstermektedir. Ortalama kalp atım hızı değişiklikleri dakikada birden daha az olmuştur; taşikardi nadir olarak gözlenmiştir ve plasebo grubuna benzer oranda bildirilmiştir. Plasebo ile karşılaştırıldığında, QTcF aralıklarında anlamlı uzamalar saptanmamıştır. Dikkate değer QTcF aralığı [yani >450 ms (erkekler) ve >470 ms (kadınlar)] ve hipokalemi bildirimleri plasebo ile benzer bulunmuştur. Kan şekerinde maksimum değişikliklerin ortalaması, ONBREZ BREEZHALER ve plasebo gruplarında benzer bulunmuştur. ONBREZ BREEZHALER, Faz III klinik geliştirme programına, orta ila şiddetli KOAH klinik tanısı konmuş hastalar alınmıştır. Bu çalışmaların güvenlilik verileri, günde bir kere önerilen maksimum dozun iki katına kadar indakaterole maruz kalan 2484 hastadan toplanmıştır. Bunların 957'si günde bir kere 150 mikrogram ile, 853'ü ise günde bir kere 300 mikrogram ile tedavi edilmiştir. Hastaların yaklaşık olarak %41'inde şiddetli KOAH saptanmıştır. Hastaların ortalama yaşı 63 bulunmuş, %47'sinin 65 yaşın üzerinde olduğu ve çoğunluğunun (%86) beyaz ırka mensup olduğu belirlenmiştir. Aşağıdaki advers ilaç reaksiyonları, KOAH güvenlilik veritabanında MedDRA sistem organ sınıfına göre sıralanmıştır. Advers reaksiyonlar her bir sistem organ sınıfı içinde aşağıdaki kategoriler altında azalan sıklık sırasına göre dizilmiştir (CIOMS III): Çok yaygın (>1/10); yaygın (>1/100, <1/10); yaygın olmayan (>1/1,000, <1/100); seyrek (>1/10,000, <1/1,000); çok seyrek (<1/10,000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Enfeksiyonlar ve enfestasyonlar Yaygın: Nazofarenjit, üst solunum yolu enfeksiyonu, sinüzit Metabolizma ve beslenme hastalıkları Yaygın: Diyabet ve hiperglisemi Sinir sistemi hastalıkları Yaygın olmayan: Parestezi Vertigo Kardiyak hastalıkları Yaygın: İskemik kalp hastalığı Yaygın olmayan: Atriyal fibrilasyon Solunum, göğüs bozuklukları ve mediastinal hastalıkları Yaygın: Öksürük, orofaringeal ağrı, rinore, solunum yolu konjesyonu Gastrointestinal hastalıkları Yaygın: Ağız kuruluğu Kas-iskelet bozuklukları, bağ dokusu ve kemik hastalıkları Yaygın: Kas spazmı, miyalji, kas-iskelet ağrısı Genel bozukluklar ve uygulama bölgesine ilişkin hastalıkları Yaygın: Periferik ödem Göğüs ağrısı Yaygın olmayan: Kalple bağlantılı olmayan göğüs ağrısı Önerilen maksimum dozun iki katı dozda uygulanan ONBREZ BREEZHALER'in güvenlilik profili, önerilen dozlarda gözlenen profile benzerdir. Bu grupta ek olarak gözlenen diğer advers olaylar titreme (yaygın) ve anemidir (yaygın değil). Seçilmiş advers ilaç reaksiyonları tanımı: Faz III klinik çalışmalarda, sağlık mesleği mensupları, klinik vizitlerde, ortalama olarak hastaların %17-20'sinde, genellikle inhalasyonu takiben 15 saniye içinde ortaya çıkan ve tipik olarak 5 saniye süren sporadik öksürük (sigara içerenlerde yaklaşık 10 saniye) olduğunu gözlemlemişlerdir. Bu öksürük, erkeklerle karşılaştırıldığında kadınlarda ve sigarayı bırakmış olanlarla karşılaştırıldığında halen sigara kullanmakta olanlarda daha yüksek sıklıkta gözlenmiştir. İnhalasyondan sonra ortaya çıkan bu öksürük, genel olarak iyi tolere edilmiştir ve önerilen dozlarda hiçbir hastanın çalışmalardan ayrılmasına yol açmamıştır (öksürük KOAH'ta gözlenen bir semptomdur ve genel olarak hastaların yalnızca %6.6'sında-öksürük bir advers olay olarak bildirilmiştir). İnhalasyon sonrası ortaya çıkan öksürüğün, bronkospazm, alevlenmeler, hastalığın kötüleşmesi veya etkililik kaybı ile ilişkili olduğunu gösteren bulgu yoktur. 4.9. Doz aşımı ve tedavisi KOAH hastalarında, önerilen maksimum terapötik dozun 10 katı olan tek dozlar, nabızda, sistolik kan basıncında ve QTc aralığında orta derece bir artışla ilişkilendirilmiştir. İndakaterol ile doz aşımının, beta2-adrenerjik uyarıcılar için tipik olan abartılı etkilere (yani taşikardi, titreme, çarpıntılar, baş ağrısı, bulantı, kusma, baş dönmesi, ventriküler aritmiler, metabolik asidoz, hipokalemi ve hiperglisemi) yol açma olasılığı yüksektir. Destekleyici ve semptomatik tedavi endikedir. Ciddi vakalarda hastalar hastaneye yatırılmalıdır. Kardiyoselektif beta-bloker kullanımı düşünülebilir, ancak beta-adrenerjik blokerler bronkospazmı uyarabildiğinden, bunlar doktor gözetiminde çok dikkatli bir şekilde uygulanmalıdır. 5. FARMAKOLOJIK ÖZELLIKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Uzun-etkili beta2-adrenerjik agonisti ATC kodu: R03AC18 Etki Mekanizması: İndakaterol gibi beta2-adrenoseptör agonistlerinin farmakolojik etkileri, en azından kısmen, intraselüler adenil siklazın (adenozin trifosfatın (ATP) siklik-3', 5'-adenozin monofosfata (siklik monofosfat) dönüşmesini katalize eden enzim) stimülasyonuna bağlanabilir. Yüksek siklik AMP düzeyleri, bronşiyal düz kasta gevşemeye neden olur. İn vitroçalışmalar, uzun etkili bir beta2-adrenerjik agonist olan indakaterolün beta2 reseptörlerdeki agonist aktivitesinin, beta1-reseptörlerindekinden 24 kattan daha fazla ve beta3-reseptörlerdekinden 20 kattan daha fazla olduğunu göstermiştir.İnhale edildiğinde indakaterol akciğerlerde lokal olarak bronkodilatör etki gösterir. İndakaterol, insan beta2-adrenerjik reseptör düzeyinde nanomolar potensi olan bir kısmi agonisttir. İzole insan bronşunda indakaterolün etkisi hızlı başlar ve etki süresi uzundur. Beta2-reseptörlerin, bronş düz kasında, beta1-reseptörlerin insan kalbinde hakim olan adrenerjik reseptörler olmasına rağmen, insan kalbindeki toplam adrenerjik reseptörlerin %10-50'sini beta2-adrenerjik reseptörleroluşturur. Kalpteki beta2-adrenerjik reseptörlerin kesin fonksiyonu bilinmemektedir; fakat bunların varlığı yüksek düzeyde seçici beta2-adrenerjik agonistlerin bile kardiyak etkilerinin olma olasılığını artırmaktadır. Farmakodinamik Etkiler: Bir dizi klinik farmakodinami ve etkililik çalışmasında, günde bir kere 150 ve 300 mikrogram dozlarda uygulanan ONBREZ BREEZHALER, akciğer fonksiyonunda (birinci saniyedeki zorlu ekspiratuar hacim, FEV1, ölçümlerine göre) tutarlı bir şekilde 24 saati aşan klinik açıdan anlamlı düzelme sağlamıştır. İnhalasyondan sonra etkisi, beş dakika içinde hızlı bir şekilde ortaya çıkar ve başlangıca göre FEV1'de 110-160 ml artış meydana gelir. Bu, hızlı etkili beta2-agonist salbutamol 200 mg'ın etkisine benzemektedir; ayrıca salmeterol/flutikazon 50/500 mikrogram ile karşılaştırıldığında etkisi, istatistiksel olarak anlamlı oranda daha hızlıdır. Kararlı durumda başlangıca göre FEV1'deki azami düzelmelerin ortalaması 250-330 ml'dir. Bronkodilatör etkinin doz uygulama saatine (sabah veya akşam) bağlı olmadığı saptanmıştır. ONBREZ BREEZHALER'in akciğer hiperinflasy onunu azalttığı gösterilmiştir; bu durum plasebo ile karşılaştırıldığında egzersiz sırasında ve dinlenirken inspiratuar kapasitenin artmasına yol açar. Kardiyak elektrofizyoloji üzerindeki etkiler: 404 sağlıklı gönüllüye 2 hafta süre ile indakaterolün çoklu dozlarının (günde bir kere 150, 300 veya 600 mikrogram) uygulandığı çift-kör, plasebo ve aktif (moksifloksasin) kontrollü bir çalışmada, QTcF aralığındaki maksimum ortalama (%90 güven aralıkları) uzamaların 150, 300 ve 600 mikrogram için sırası ile 2.66 (0.55, 4.77), 2.98 (1.02, 4.93) ve 3.34 (0.86, 5.82) olduğu gösterilmiştir. Bu durum, önerilen terapötik dozlarda ya da önerilen maksimum dozun iki katı dozlarda, QT aralığı uzaması ile ilişkili pro-aritmik potansiyel açısından endişe olmadığını göstermektedir. Değerlendirilen doz aralığında konsantrasyon-delta QTc ilişkisine dair bulgu saptanmamıştır. KOAH'ı olan 605 hasta üzerinde yapılan 26 haftalık, çift kör, plasebo kontrollü bir faz III çalışmada gösterildiği üzere, başlangıçta ve 26 haftalık tedavi döneminde 3 kereye kadar yapılan 24 saatlik monitorizasyona göre önerilen dozlarda ONBREZ BREEZHALER ile plasebo ya da tiotropium ile tedavi edilmiş hastalar arasında aritmik olayların gelişimi açısından klinik olarak anlamlı bir fark gözlenmemiştir. Klinik etkililik ve güvenlik: Klinik geliştirme programı, KOAH klinik tanısı konulmuş hastalarda yürütülen bir tane 12 haftalık, iki tane altı aylık (bunlardan bir tanesi güvenlilik ve tolerabilitenin değerlendirilmesi için bir yıla uzatılmıştır) ve bir tane bir yıllık randomize kontrollü çalışmayı kapsamaktadır. Bu çalışmalar akciğer fonksiyonu ölçümlerini ve dispne, alevlenmeler ve sağlıkla bağlantılı yaşam kalitesi gibi sağlık sonuçlarını kapsamaktadır. Akciğer fonksiyonu: ONBREZ BREEZHALER günde bir kere 150 mikrogram ve 300 mikrogram dozlarda uygulandığında akciğer fonksiyonunda klinik açıdan anlamlı iyileşmelere neden olmuştur. 12-haftalık primer sonlanım noktasında (24-saatlik 'through' FEV1-doz öncesi-) 150 mikrogram dozu plasebo ile karşılaştırıldığında 130-180 ml artışa (p<0.001) ve günde iki kere 50 mikrogram salmeterol ile karşılaştırıldığında 60 ml artışa yol açmıştır (p<0.001). 300 mikrogram dozu plasebo ile karşılaştırıldığında 170-180 ml artışa (p<0.001) ve günde iki kere 12 mikrogram formoterol ile karşılaştırıldığında 100 ml artışa (p<0.001) yol açmıştır. Her iki doz da günde bir kere uygulanan açık etiketli 18 mikrogram tiotropium ile karşılaştırıldığında 40-50 ml artışa neden olmuştur (150 mikrogram, p = 0.004; 300 mikrogram, p = 0.01). ONBREZ BREEZHALER'in 24 saatlik bronkodilatör etkisi ilk dozdan itibaren bir yıl boyunca korunmuş ve etkililik kaybına (taşifilaksi) dair kanıta rastlanmamıştır. Semptomatik yararlar: Her iki doz da dispne ve sağlık durumu açısından (sırasıyla Tranzisyonel Dispne İndeksi [TDI] ve St. George Solunum Anketi [SGRQ] ile yapılan değerlendirmelere göre) semptomların rahatlatılmasında plaseboya göre istatistiksel olarak anlamlı düzelmeler sağlamıştır. Yanıt büyüklüğü genellikle aktif karşılaştırma grupları ile gözlenenden daha yüksektir (Tablo 2). Ayrıca, ONBREZ BREEZHALER ile tedavi edilmiş hastalar kurtarma ilacına anlamlı oranda daha az gereksinim duymuş, plasebo ile karşılaştırıldığında bu hastalarda kurtarma ilacına gereksinim duyulmayan günlerin sayısı daha fazla olmuş ve gündüz semptomlarının gözlenmediği günlerin yüzdesinde anlamlı bir artış meydana gelmiştir. 6 aydan daha uzun süreli tedavilerin birleştirilmiş etkililik analizi, KOAH alevlenmesi oranının plasebodan istatistiksel olarak anlamlı oranda daha düşük olduğunu göstermiştir. Plaseboya göre yapılan tedavi karşılaştırmasında sırasıyla 150 mikrogram ve 300 mikrogram için 0.68 (%95 CI [0.47, 0.98]; p-değeri 0.036) ve 0.74'lük (%95 CI [0.56, 0.96]; p-değeri 0.026) oranları bulunmuştur. Afrika kökenli kişilerde tedavi deneyimi sınırlıdır. Tablo 2 6 aylık tedavi sonucunda semptomlardaki rahatlama
Çalışma tasarımında belirtilen ilaçlar kullanılmıştır: a5.2. Far mako kinetik özelliklerGenel özellikler İndakaterol, R-konfigürasyona sahip bir kiral moleküldür. Farmakokinetik veriler, sağlıklı gönüllüler ve KOAH hastaları üzerinde yapılan bir dizi klinik çalışmadan elde edilmiştir. Emilim:İndakaterolün doruk serum konsantrasyonuna ulaşması için medyan süre, tek dozdan veya tekrarlanan inhale dozlardan sonra yaklaşık olarak 15 dakika olarak saptanmıştır. Artan dozla birlikte indakaterole sistemik maruziyet, dozla orantılı bir şekilde artmıştır. İnhale dozdan sonra indakaterolün mutlak biyoyararlanımı ortalama %43 olmuştur. Sistemik maruziyet, akciğer emilimi ve bağırsak emiliminin bileşimine bağlıdır. İndakaterol serum konsantrasyonları, günde bir kere uygulanan tekrarlı dozlarla artış göstermiştir. Kararlı duruma 12-14 günde ulaşılmıştır. İndakaterolün ortalama birikim oranı (yani, 1. günle karşılaştırıldığında 14. günde 24 saatlik dozlama aralığı için EAA), 150 ile 600 mikrogram aralığında günde bir kere uygulanan inhale dozlar için 2.9 ila 3.5 arasında bulunmuştur. Dağılım:İntravenöz infüzyondan sonra indakaterolün dağılım hacmi (Vz) 2557 L olarak bulunmuştur ve bu değer yaygın bir dağılıma işaret etmektedir. İn vitroolarak insan serum ve plazma proteinlerine bağlanma sırasıyla %94.1-95.3 ve %95.1-96.2 olarak saptanmıştır.Biyotransformasyon:İnsanda gerçekleştirilen bir ADME (emilim, dağılım, metabolizma, atılım) çalışmasında radyoaktif element ile işaretlenmiş indakaterolün oral uygulamasından sonra değişmemiş indakaterolün serumdaki temel bileşen olduğu belirlenmiştir; bu bileşen 24 saatlik toplam EAA'nin yaklaşık olarak üçte birini oluşturur. Hidroksile bir türev, serumdaki en belirgin metabolittir. Hidroksile indakaterol ve indakaterolün fenolik O-glukuronidleri de diğer belirgin metabolitlerdir. Hidroksile türevin diastereomeri, indakaterolün bir N-glukuronidi ve C- ve N- dealkile ürünler, belirlenen diğer metabolitler olmuştur. İn vitroİn vitroaraştırmalar, indakaterolün 'efflux' pompası P-gp için düşük afiniteli bir substrat olduğunu göstermiştir.Eliminasyon:İdrar örneklerinin de toplandığı klinik çalışmalarda, idrar yoluyla değişmeden atılan indakaterol miktarı, genellikle dozun %2'sinden az olmuştur. İndakaterolün böbrek klerensi ortalama olarak 0.46 ile 1.20 arasındadır. İndakaterolün 23.3 litre/saat'lik serum klerensi ile karşılaştırıldığında, böbrek klerensinin, sistemik olarak mevcut indakaterolün atılmasında önemsiz bir rol oynadığı açık olarak görülmektedir (sistemik klerensin %2-5'i). İndakaterolün oral yoldan verildiği bir insan ADME çalışmasında, dışkıyla atılımın, idrarla atılımdan daha belirgin olduğu bulunmuştur. İndakaterol, insanlarda dışkıyla büyük oranda değişmeden ana ilaç şeklinde (dozun %54'ü) ve daha az oranda hidroksile indakaterol metabolitleri şeklinde atılmıştır (dozun %23'ü). Dışkıda dozun >%90'ı toplandığı için kütle dengesi tam olmuştur. Tekrarlı dozlardan sonra indakaterol birikiminden hesaplanan efektif yarı ömür 40 ila 52 saat arasında değişmektedir (yaklaşık olarak 12-14 gün olan kararlı hale kadar geçen süre ile uyumludur). Doğrusallık/Doğrusal Olmayan Durum:İndakaterol serum konsantrasyonu, multifazik bir şekilde düşmektedir (ortalama terminal yarı ömrü 45.5 ile 126 saat arasında değişmektedir). Hastalardaki karakteristik özellikler Karaciğer yetmezliği:Hafif ila orta şiddette karaciğer yetmezliği olan hastalarda indakaterolün Cmaks ya da EAA'sinde anlamlı değişiklikler gözlenmemiştir; ayrıca hafif ila orta şiddette karaciğer yetmezliği olan gönüllüler ve sağlıklı gönüllüler arasında protein bağlama oranları açısından da fark yoktur. Şiddetli karaciğer yetmezliği olan hastalarda çalışma yapılmamıştır (bkz. bölüm 4.2.). Böbrek yetmezliği:Toplam vücut eliminasyonunda idrar yolunun çok düşük bir katkısı olduğundan, böbrek yetmezliği olan hastalarda bir çalışma yapılmamıştır. Pediyatrik popülasyon:ONBREZ BREEZHALER'in 18 yaşın altındaki hastalarda kullanılması önerilmemektedir. Geriyatrik popülasyon:Maksimum plazma konsantrasyonu ve genel sistemik maruziyet yaşla birlikte artmaktadır (bkz.Bölüm 4.2.). Ancak yaşlı hastalarda doz ayarlamasına gerek bulunmamaktadır. Yaş, cinsiyet, kilo, ırk:Yapılan bir popülasyon farmakokinetiği analizinde, yaşın (88 yaşına kadar yetişkinler), cinsiyetin, kilonun (32-168 kg) ya da ırkın indakaterol farmakokinetiği üzerinde klinik açıdan anlamlı bir etki meydana getirmediği gösterilmiştir. Elde edilen bulgular bu popülasyonda etnik alt gruplar arasında herhangi bir farka işaret etmemiştir. 5.3. Klinik öncesi güvenlilik verileri Köpeklerde yapılan çalışmalarda, indakaterolün kardiyovasküler sistem üzerindeki beta2-agonistik özelliklerine bağlanan etkileri taşikardi, aritmiler ve miyokard lezyonlarını kapsamaktadır. Sıçanlarda, burun boşluğu ve larinkste hafif düzeyde tahriş gözlenmiştir. Tüm bu bulgular insanlarda beklenenin yeterince üzerinde olan maruziyetlerde meydana gelmiştir. Bir sıçan fertilitesi çalışmasında indakaterol genel üreme performansını etkilememiş olsa da, gelişim ve gelişim sonrası dönemde olan sıçanlar üzerinde yapılan ve ONBREZ BREEZHALER ile tedavi edilen insanlardakinden 14 kat daha yüksek maruziyetin kullanıldığı bir çalışmada gebe F1 dölünün sayısında bir azalma gözlenmiştir. İndakaterol sıçanlarda ya da tavşanlarda embriyotoksik ya da teratojenik değildir. Genotoksisite çalışmalarında, mutajenik ya da klastojenik potansiyel gözlenmemiştir. İndakaterolün karsinojenisitesi, sıçanlarda 2 yıllık bir sıçan çalışmasında ve 6 aylık transgenik fare çalışmasında değerlendirilmiştir. Sıçanlarda iyi huylu over leyomiyomu ve over düz kasında fokal hiperplazi insidanslarında artışların, diğer beta2-adrenerjik agonistler için bildirilen benzer bulgularla tutarlı olduğu görülmüştür. Farelerde karsinoj eni site kanıtına rastlanmamıştır. Bu çalışmalarda advers etkilerin gözlenmediği düzeylerde sıçanlarda ve farelerde meydana gelen sistemik maruziyetler (EAA), günde bir kere 300 mikrogram dozda ONBREZ BREEZHALER ile tedavi edilmiş olan insanlarda gözlenen değerlerden sırasıyla en az 7 ve 49 kat daha yüksek olmuştur. 6. FARMASÖTIK ÖZELLIKLER6.1. Yardımcı maddelerin listesiLaktoz monohidrat Jelatin Siyah baskı mürekkebi 6.2. Geçimsizlikler Geçerli değil. 6.3. Raf ömrü 18 ay 6.4. Saklamaya yönelik özel tedbirler 30°C'nin altındaki oda sıcaklığında ve ambalajında saklayınız. Nemden koruyunuz. ONBREZ BREEZHALER kapsüllerini nemden korumak için blister içinde saklanmalı ve yalnızca kullanımdan hemen önce çıkarılmalıdır. 6.5. Ambalajın niteliği ve içeriği Her biri 10'ar kapsül içeren PA/Alu/PVC - Alu blisterler (şekillendirici folyo: PA/Alu/PVC, kapatıcı folyo: Alüminyum) ve her kutuda bulunan bir adet BREEZHALER inhalasyon cihazı BREEZHALER bir tekli doz inhalasyon cihazıdır. İnhalasyon cihazının gövdesi ve kapağı, akrilonitril bütadien stiren, basma düğmeleri metil metakrilat akrilonitril bütadien stirenden yapılmıştır. İğneler ve yaylar paslanmaz çelikten imal edilmiştir. 30 kapsüllük ambalaj: Her biri 10'ar kapsül içeren 3 blister ve 1 inhaler (BREEZHALER) 2 kutuluk (60 kapsül) çoklu ambalaj: Her biri 30 kapsül + 1 inhaler (BREEZHALER) içeren iki kutu 3 kutuluk (90 kapsül) çoklu ambalaj: Her biri 30 kapsül +1 inhaler (BREEZHALER) içeren üç kutu 30 kutuluk (300 kapsül) çoklu ambalaj: Her biri 10 kapsül+ 1 inhaler (BREEZHALER) içeren otuz kutu 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıkları Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. Her bir ONBREZ BREEZHALER kutusu içeriğinde inhalasyon kapsüllerine ek olarak bir inhalasyon cihazı (Breezhaler) yer almaktadır. Kutu içeriği bittiğinde inhalasyon cihazı da atılmalıdır. 7. RUHSAT SAHİBİ Novartis Ürünleri 34912 Kurtköy - İstanbul Tel no: 0216 560 10 00 Faks no:0216 482 64 08 8. RUHSAT NUMARASI 131/44 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİ: İlk ruhsat tarihi: 13.05.2011 Ruhsat yenileme tarihi: - 10. KÜB'ÜN YENİLENME TARİHİ: |
İlaç BilgileriOnbrez Breezhaler 150µg İnhaler KapsülEtken Maddesi: İndakaterol maleat Atc Kodu: R03AC18 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.