Decapeptyl Depot 3,75mg Enjeksiyonluk Suspansiyon için Toz ve Çözücü Kısa Ürün BilgisiAntineoplastik ve İmmünomodülatör Ajanlar » Hormonal Tedavi İlaçları » Hormonlar » Gonadotropin Salgılatıcı Hormon Analogları » Triptorelin asetat KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIDECAPEPTYL® DEPOT 3,75 mg Enjeksiyonluk Süspansiyon için Toz ve Çözücü (I+II)2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:1 şırınga 3.75 mg triptoreline eşdeğer 4.12 mg triptorelin asetat içerir.Yardımcı maddeler:Sodyum klorür 8.11 mgYardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMKullanıma hazır şırıngalarda uzun-süreli salım formunda enjeksiyonluk süspansiyon için toz ve çözücüKarıştırmadan önce: Beyaz ile hafif sarı arası toz ve berrak hafif sulu sıvı. Karıştırdıktan sonra: Süt beyazı ile hafif sarı arası homojen süspansiyon. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarErkeklerde: Tedavi amaçlı: İlerlemiş hormon bağımlı prostat kanserinin semptomatik tedavisinde. Tanı amaçlı: Prostat kanserinin hormon bağımlılığının ayırıcı tanısında. Kadınlarda: Semptomatik uterus miyomları olan kadınlarda kanama ve ağrı semptomlarını azaltmak için miyom boyutunun preoperatif olarak küçültülmesi. Primer olarak cerrahi tedavi gerektirmeyen şekilde over hormonogenezinin baskılanmasının endike olduğu zaman laparoskopi ile doğrulanan semptomatik endometriyozis. Yardımla üreme teknikleri (ART) için kontrollü over hiperstimülasyonu yapılan kadınlarda prematüre luteinize edici hormonun (LH) downregülasyonu ve artışının önlenmesi. Çocuklarda: 9 yaş altı kızlarda ve 10 yaş altı erkeklerde doğrulanan santral puberte prekoks'un tedavisinde. 4.2 Pozoloji ve uygulama şekliÜrün, tedaviye cevabın düzenli izlenmesi için gerekli donanımı olan ünitelerde, uygun bir uzmanın denetim ve gözetimi altında kullanılmalıdır.Enjeksiyonunun 6.6 kısmında verilen talimatlara harfiyen bağlı şekilde gerçekleştirilmesi önemlidir. Sulandırma işleminden sonra, süspansiyon derhal enjekte edilmelidir. Pozoloji:DECAPEPTYL® DEPOT, her 28 günde bir kez subkutan olarak (örneğin; abdominal bölge, gluteal bölge veya uyluklar) ya da derin intramüsküler olarak enjekte edilir. Enjeksiyon her seferinde farklı bir yere uygulanmalıdır.Erkeklerde: Prostat kanseri tedavisi: Dört haftada bir 3,75 mg triptorelin uygulanır. Testosteron seviyesini sürekli baskılamak için dört haftalık tedavi dönemine uyum önem taşımaktadır. Diyagnostik olarak: Dört haftada bir 3,75 mg triptorelin uygulanır. Genellikle 3 aylık uygulamadan sonra prostattaki kanserin androjen bağımlı olup olmadığı belirlenebilmektedir. Kadınlarda: Uterus miyomu ve endometriyozis: Dört haftada bir 3,75 mg triptorelin uygulanır. Pre-menopozal kadınlarda, tedavi siklusun ilk 5 gününde başlatılmalıdır. Yardımla üreme teknikleri: Siklusun 2. ya da 3. günü (foliküler faz), veya 21. gününde (luteal faz) tek enjeksiyon uygulaması. Çocuklarda: Santral puberte prekoks (CPP): Tedavinin başında 0.,14. ve 28. günlerde 3.75 mg triptorelin uygulanır. Daha sonra 4 haftada bir enjeksiyon uygulanır. Eğer etkisi yeterli olmazsa enjeksiyonlar 3 haftada bir uygulanabilir. Doz ayarlaması kişinin vücut ağırlığına göre yapılır. Kilosu 20 kg'dan az olan çocuklara 1.875 mg (yarım doz), 20 ile 30 kg arasında olanlara 2.5 mg (2/3 doz) ve 30 kg'dan fazla olanlara ise 3.75 mg (tam doz) triptorelin enjekte edilir. Uygulama sıklığı ve süresi:Erkeklerde:Prostat kanseri: DECAPEPTYL® DEPOT tedavisi genellikle uzun süreli bir tedavidir. Kadınlarda: Uterus miyomları ve endometriyozis: Tedavinin süresi endometriyozisin şiddetinin başlangıç derecesine, klinik belirtilerinin (fonksiyonel ve anatomik) oluşumuna ve tedavi süresince ultrasonografi ile belirlenen uterus miyomlarının büyüklüklerinin değişimine bağlıdır. Genelde maksimum elde edilebilir sonuç 3 ile 4 ay sonra beklenmektedir. Kemik yoğunluğu üzerindeki olası etkisi göz önünde bulundurulduğunda add-back (geri-ekleme) tedavisi olmaksızın DECAPEPTYL® DEPOT tedavisi 6 ayı geçmemelidir. Çocuklarda: Santral puberte prekoks (CPP) Eğer kemik gelişimi kızlarda 12 yaşın üstüne ulaştıysa ve erkeklerde de 13 yaşın üstüne çıktıysa tedaviye son verilmelidir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Mevcut bilgiler doğrultusunda böbrek fonksiyon bozukluğu olan hastalarda doz azaltılması ya da uygulama aralıklarının uzatılması gerekli değildir.Pediyatrik popülasyon:Eğer kemik gelişimi kızlarda 12 yaşın üstüne ulaştıysa ve erkeklerde de 13 yaşın üstüne çıktıysa tedaviye son verilmelidir.Geriyatrik popülasyon:Yaşlılar için doz ayarlamasına gerek yoktur.4.3 KontrendikasyonlarGenel: Triptorelin, poli-(d,l-laktid koglikolid), dekstran veya diğer herhangi bir bileşene aşırı duyarlılık gösteren kişiler Gonadotropin serbestleyen hormon (GnRH) veya herhangi bir GnRH analoguna aşırı duyarlılık gösteren kişiler Erkeklerde: Hormona bağlı olmayan prostat kanseri, Omur iliğe bası yapan veya omurga metastazı saptanan prostat kanserli hastalarda tek tedavi olarak kullanımı. Orşiektomi sonrası (cerrahi kastrasyonu durumunda DECAPEPTYL® DEPOT, serum testosteron düzeyinde ilave bir azalmaya neden olmaz). Kadınlarda: Klinik olarak belirgin osteoporoz Hamilelik veya laktasyon Çocuklarda: Progresif beyin tümörleri 4.4 Özel kullanım uyarıları ve önlemleriGenel:Triptorelin gonadotropinlerin hipofiz sekresyonunu etkileyen ilaçlarla birlikte kullanıldığında tedbir alınmalı ve hastanın hormonal durumu izlenmelidir. Depresyon da dahil olmak üzere ruh hali değişimleri kayıt edilmiştir. Depresyonu olduğu bilinen hastalar tedavi süresince yakından takip edilmelidir. Erkeklerde: Prostat kanseri: Hastaların birkaçında serum testosteron düzeyinin başlangıçta kısa süreli artışı hastalığa ait semptomların geçici olarak kötüleşmesi ile ilişkilendirilmiştir. Bu semptomlardan herhangi birinin kötüleşmesi durumunda hastanın hekime danışması tavsiye edilmelidir. Bu nedenle DECAPEPTYL® DEPOT kullanımı omurilik basısına dair belirtiler gösteren hastalarda dikkatlice değerlendirilmeli ve metastazlara bağlı idrar yolu tıkanıklığı ve/veya spinal metastazları olan hastalar başta olmak üzere tedavinin ilk haftalarında hastalara yakın bir tıbbi gözetim yapılmalıdır. Klinik semptomların şiddetlenmesini önlemek için tedavinin başlangıç evresinde ek olarak uygun bir antiandrojen ajanın uygulanması düşünülmelidir. Terapötik etkisini kontrol edebilmek için tedavi süresince prostat spesifik antijen (PSA) ve testosteron plazma düzeyleri düzenli olarak takip edilmelidir. Testosteron düzeyleri 1 ng/ml'yi aşmamalıdır. Ayrıca epidemiyolojik verilere dayanarak, hastalarda androjen deprivasyon tedavisi sırasında kardiyovasküler hastalık riskinde artış veya metabolik değişiklikler (glukoz intoleransı, diabetes mellitus vb.) gözlemlenmiştir. Ancak ileriye yönelik verilerde, GnRH analogları ile tedavi ve kardiyovasküler ölüm oranındaki artış arasında herhangi bir bağ kurulamamıştır. Metabolik ve kardiyovasküler hastalık riski yüksek olan hastalar tedaviye başlanmadan önce dikkatlice değerlendirilmeli ve androjen deprivasyonu tedavisi sırasında yakından takip edilmelidir. Kadınlarda: Tedaviye başlamadan önce potansiyel olarak fertil kadınların gebe olmadıkları kesin olarak saptanmalıdır. Uterus miyomları ve endometriyozis: Tedavi boyunca menstürasyon gerçekleşmez. Tedavi sürerken metroraji meydana gelmesi normal değildir (ilk ay dışında) ve plazma östrojen düzeyi doğrulanmalıdır. Bu düzey 50 pg/ml'den düşük olduğunda olası ilgili organik lezyonlar araştırılmalıdır. Tedavinin bırakılmasıyla birlikte over fonksiyonuna kaldığı yerden devam eder, örneğin menstural kanama en son enjeksiyondan 7-12 hafta sonra yeniden başlayacaktır. Gonadotropinlerin ilk salıverilmesiyle birlikte ovülasyon başlatılabildiğinden tedavinin birinci ayı süresince hormonal olmayan kontrasepsiyon uygulanmalıdır. Ayrıca menstrüasyon yeniden başlayana kadar veya başka bir kontrasepsiyon metodu belirlenene kadar son enjeksiyondan 4 hafta sonra kontrasepsiyon uygulanmalıdır. Uterus miyomlarının tedavisi süresince uterus ve miyom boyutu örneğin ultrasonografi vasıtasıyla düzenli olarak saptanmalıdır. Miyom dokusunun azalmasına kıyasla uterus boyutunun orantısız bir biçimde hızla küçülmesi nadiren görülse de kanama ve sepsise neden olabilir. Birkaç ayın üstünde DECAPEPTYL" DEPOT tedavisi kemik yoğunluğunun azalmasına neden olabilir. Bu nedenle add-back tedavi olmaksızın uygulama 6 aydan fazla olmamalıdır. Tedavinin bırakılmasından sonra kemik kaybı genellikle 6-9 ay içerisinde geri döner. Buna bağlı olarak osteoporoz sebebiyle ek risk faktörleri konusunda hastalara özel bir uyarı yapılmalıdır. DECAPEPTYL DEPOT tedavisi süresince menstürasyonun kesilmesi gerektiğinden menstürasyon düzenli olarak devam ettiği takdirde hasta bu durumu doktoruna bildirmesi yönünde bilgilendirilmelidir. Yardımla üreme teknikleri: Çocuk doğurma potansiyeli bulunan kadınlar tedaviden önce dikkatle muayene edilmelidir. ART; çoklu gebelik, gebelik kaybı, ektopik gebelik ve konjenital malformasyon risk artışı ile ilişkilendirilmektedir. Bu riskler kontrollü over hiperstimülasyonunda yardımcı tedavi olarak DECAPEPTYL DEPOT kullanımında da geçerlidir. Kontrollü over hiperstimülasyonunda DECAPEPTYL® DEPOT kullanımı over hiperstimülasyon sendromu (OHSS) ve over kist riskini artırabilir. Over hiperstimülasyon sendromu (OHSS): OHSS komplike olmayan over büyümesinden farklı bir tıbbi olaydır. OHSS kendisini artan şiddet derecelerinde gösterebilen bir sendromdur. Belirgin over büyümesi, yüksek serum seks steroidleri ve vasküler permeabilite artışından oluşur. Permeabilite artışı, periton, plevra ve ender olarak perikard boşluklarında sıvı birikimiyle sonuçlanabilir. Şiddetli OHSS olgularında şu semptomlar gözlenebilir; abdominal ağrı, abdominal distansiyon, overlerde ileri derecede büyüme, kilo alma, dispne, oligüri ve bulantı, kusma, diyare gibi gastrointestinal semptomlar. Klinik değerlendirmede hipovolemi, hemokonsantrasyon, elektrolit dengesizlikleri, asit, hemoperiton, plevral efüzyon, hidrotoraks, akut pulmoner distres ve tromboembolik olaylar açığa çıkabilir. Gonadotropin tedavisine karşı alınan aşırı over yanıtı, ovülasyonu tetiklemek üzere hCG uygulanmadığı sürece, ender olarak OHSS'ye yol açar. Bu nedenle over hiperstimülasyonu durumunda, hCG uygulamasını iptal etmek ve hastaya en az 4 gün süreyle koitustan kaçınmasını ya da bariyer yöntemlerini kullanmasını tavsiye etmek akılcı bir yaklaşım olacaktır. OHSS hızla ilerleyebilir (24 saat ile birkaç gün içerisinde) ve ciddi bir tıbbi olay haline gelebilir, bu nedenle hastalar hCG uygulamasından sonra en az iki hafta süreyle izlenmelidir. Gebelik gelişmesi durumunda OHSS daha şiddetli olabilir ve daha uzun sürebilir. OHSS en büyük sıklıkla hormon tedavisi bittikten sonra ortaya çıkar ve en yüksek şiddetine tedaviyi izleyen yedi ile on gün civarında ulaşır. OHSS sıklıkla, menstrüasyonun başlamasıyla spontan olarak geriler. Şiddetli OHSS ortaya çıkarsa, eğer halen devam ediyorsa gonadotropin tedavisi durdurulmalı ve hasta hastaneye yatırılmalı ve OHSS'ye spesifik tedavi başlatılmalıdır. Bu sendrom polikistik over hastalarında daha yüksek bir insidansta ortaya çıkmaktadır. Gonadotropinlerle birlikte GnRH agonistlerinin kullanılması tek başına gonadotropinlerin kullanılmasına göre OHSS riskini arttırabilir. Over kistleri GnRH agonistiyle tedavinin başlangıcı süresince over kistleri oluşabilir. Bu kistler genellikle semptom oluşturmazlar ve fonksiyonel değildirler. Çocuklarda: Tedavinin başlangıcında kronolojik yaş kızlarda 9 yaşın altı ve erkeklerde 10 yaşın altı olmalıdır. Tedavi tamamlandıktan sonra puberte özelliklerinin gelişimi meydana gelir. İlerideki doğurganlığı hakkında bilgi sınırlıdır. Bir çok kızda tedavi bittikten bir yıl sonra menstrüasyon başlar ki çoğu vakada düzenli olarak devam eder. GnRH agonisti tedavisi bırakılmasını takiben femur başı epifizi kayması görülebilir. GnRH agonistleri ile tedavi esnasında düşük östrojen konsantrasyonunun epifiz plağının zayıflamasına sebep olduğu yönünde bir teori ortaya konmaktadır. Tedaviyi durdurduktan sonra büyüme hızındaki artış, akabinde epifizin yer değiştirmesi için gerekli olan yanal kuvvetin azalmasına neden olur. Yalancı puberte prekoks (gonadal veya adrenal tümör veya hiperplazi) ve gonadtropin bağımlı puberte prekoks (testis toksikozu, ailevi Leydig hücre hiperplazisi) ekarte edilmelidir. Yetişkinlerde ve çocuklarda alerjik ve anafilaktik reaksiyonlar rapor edilmiştir. Bunlar hem lokal reaksiyonlar hem de sistemik semptomlardır. Raporlama oranı çocuklarda daha sık görülmektedir. Bu tıbbi ürün her flakonda 1 mmol (23 mg)'dan daha az sodyum içerir; sodyum miktarına bağlı herhangi bir olumsuz etki beklenmez. 4.5 Diğer tıbbi ürünler ile etkileşim ve diğer etkileşim şekilleriTedavi esnasında DECAPEPTYL® DEPOT 3,75 mg Enjeksiyonluk Süspansiyon için Toz ve Çözücü (I+II) ile birlikte östrojen içeren hiçbir ilaç kullanılmamalıdır.4.6 Gebelik ve laktasyonGenel tavsiyeGebelikte kategorisi: XÇocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli olan kadınlar tedavi süresince yardımlı üreme teknolojisinin (ART) uygulandığı durumlar hariç etkili doğum kontrolü uygulamak zorundadırlar.Gebelik dönemiDECAPEPTYL® DEPOT gebelik döneminde kontrendikedir.Gebelik süresince triptorelin kullanımına dair çok kısıtlı sayıda veri artmış bir konjenital malformasyon riskine işaret etmemektedir. Ancak gelişme üzerine olan uzun dönem izleme çalışmaları oldukça kısıtlıdır. Hayvanlar üzerinde yapılan çalışmalar, gebeliğe veya fetal gelişime ilişkin doğrudan ya da dolaylı zararlı etkiler olduğunu göstermemektedir, ancak fetal toksisite ve gecikmiş doğuma dair belirtiler bulunmaktadır. Farmakolojik etkilerine dayanılarak gebelik ve yeni doğan üzerindeki zararlı etkisi göz ardı edilemez ve DECAPEPTYL® DEPOT gebelik döneminde kullanılmamalıdır. Laktasyon dönemiTriptorelinin anne sütüyle atılıp atılmadığı bilinmemektedir. Emzirilen infantlarda triptorelinin olası advers reaksiyonlarından dolayı uygulamadan evvel ve uygulama süresince emzirmeye ara verilmelidir.Üreme yeteneği/FertiliteVeri yoktur.4.7 Araç ve makine kullanımı üzerindeki etkilerDECAPEPTYL® DEPOT'nun araç ve makina kullanıma hiçbir etkisi yoktur veya ihmal edilebilir düzeydedir.4.8 İstenmeyen etkilerKlinik çalışmalarda triptorelin ile tedavi edilen hastalar arasında ve pazarlama sonrası rapor edilen istenmeyen etkiler aşağıda belirtilmektedir.Erkekler Düşük testosteron düzeyi nedeniyle hastaların %30'unda sıcak basması meydana gelmesi gibi hastaların büyük bölümünde istenmeyen reaksiyonların oluşması beklenir. Erkek hastaların %30-40'ında impotans ve libido azalması beklenir. Tedavinin ilk haftasında testosteron seviyelerindeki normal artış nedeniyle belirtiler ve şikayetler artabilir (örn. üriner tıkanma, metastazların neden olduğu iskelet ağrısı, spinal kord basısı, kas yorgunluğu ve bacaklarda lenfatik ödem). Bazı durumlarda üriner yolun tıkanması böbrek fonksiyonunu azaltabilir. Bacaklarda asteni, parestezi ve zayıflık ile birlikte nörolojik bası gözlenmiştir. GnRH analogları ile prostat kanseri tedavisi gören hastalarda çok seyrek olarak intihar düşüncesi ve girişimleri raporlanmıştır. İstenmeyen etkiler aşağıdaki sınıflama kullanılarak sıklık gruplarına ayrılmıştır: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Kardiyovasküler bozukluklar:Yaygın olmayan: HipertansiyonEndokrin bozukluklarYaygın: JinekomastiGastro-intestinal bozukluklarYaygın olmayan: İştah kaybı; gastralji; ağız kuruması Yaygın: BulantıGenel bozukluklar ve uygulama bölgesine ilişkin bozukluklarÇok yaygın: Sıcak basmasıYaygın: Aşırı terleme, yorgunluk, uyku bozuklukları, enjeksiyon bölgesi reaksiyonları, enjeksiyon bölgesinde ağrı Bağışıklık sistemi bozukluklarıYaygın: Aşırı duyarlılık (kaşıntı, deri döküntüsü, ateş)Yaygın olmayan: Anafilaktik reaksiyonlar Metabolizma ve beslenme bozuklukları:Bilinmiyor: Diabetes mellitusAraştırmalar:Yaygın olmayan: Enzim düzeylerinde artış (LDH, yGT, SGOT, SGPT), kilo değişimleriKas ve iskelet ile bağdokusu bozukluklarıÇok yaygın: Kemik ağrısı Yaygın: Miyalji, artraljiSinir sistemi bozuklukları:Yaygın: BaşağrısıPsikiyatrik bozukluklar:Yaygın: Depresyon hali, gerginlikBöbrek ve üriner sistem bozuklukları:Çok yaygın: DizüriÜreme sistemi ve meme bozukluklarıÇok yaygın: İmpotans, libido azalması Yaygın olmayan: Testiküler atrofiSolunum, göğüs ve mediyastinal bozukluklarYaygın olmayan: Şiddetli astımDeri ve deri altı doku bozukluklarıYaygın olmayan: Yüzdeki kıllarda azalma, vücut kıllarında dökülmeVasküler bozukluklarYaygın olmayan: Trombo-emboliHafif düzeyde trabeküler kemik kaybı oluşabilir. Bu durum genellikle tedavi bırakıldıktan sonra 6-9 ay içinde geri döndürülebilirdir (bkz. bölüm 4.4). Bazı hastalarda baş dönmesi ve tremor görülebilir. Kadınlarda:(Yardımla üreme teknikleri dışında)Azalan östrojen seviyelerinin sonucu olarak hastaların % 75 ile % 100'ünde rapor edilen sıcak basması gibi istenmeyen etkilerin gözlenmesi beklenebilir. Ayrıca, kanama/spotting, terleme, vajinal kuruma ve disparoni, libido azalması, baş ağrısı ve ruh hali değişimleri % 10 kadından fazlasında görülebilir. Göz bozukluklarıYaygın olmayan: Görme bozukluklarıGastrointestinal bozukluklarYaygın: BulantıGenel bozukluklar ve uygulama bölgesine ilişkin bozukluklarÇok yaygın: Sıcak basması, aşırı terlemeYaygın: Yorgunluk, uyku bozuklukları, enjeksiyon bölgesinde reaksiyonlar, enjeksiyon bölgesinde ağrı Bağışıklık sistemi bozukluklarıYaygın: Aşırı duyarlılık (kaşıntı, deri döküntüsü, ateş)Yaygın olmayan: Anafilaktik şok AraştırmalarYaygın olmayan: Enzim (LDH, yGT, SGOT, SGPT) düzeylerinde artış, kolesterol düzeyinde artışKas ve iskelet ile bağdokusu bozukluklarıÇok yaygın: Kemik ağrısı Yaygın: Miyalji, artralji Yaygın olmayan: Sırt ağrısı Bilinmiyor: Kemik bozuklukları*Sinir sistemi bozukluklarıYaygın olmayan: ParesteziPsikiyatrik bozukluklarÇok yaygın: Ruh hali değişimleri Yaygın: Depresif ruh hali, irritabiliteÜreme sistemi ve meme bozukluklarıÇok yaygın: Libido azalması, vajinal kanama / lekelenme, vajinal kuruluk, disparonia DECAPEPTYL® DEPOT uygulamasından sonra kilo değişimleri bildirilmiştir.Bazı hastalarda baş dönmesi, tremor ve baş ağrısı görülebilir. * Hafif düzeyde trabeküler kemik kaybı oluşabilir. Bu durum genellikle tedavi bırakıldıktan sonra 6-9 ay içinde geri döndürülebilirdir (bkz. bölüm 4.4). Kadınlarda (Yardımla üreme teknikleri endikasyonları):Klinik araştırmalarda DECAPEPTYL® DEPOT ile tedavi esnasında, gonadotropinleri uygulama öncesinde veya çoklu uygulamalarda, sıkça rapor edilen istenmeyen etkiler aşağıda belirtilmektedir. En sık belirtilen istenmeyen etkiler; baş ağrısı (% 21), abdominal ağrı (%17), bulantı (% 8) ve enjeksiyon bölgesi rahatsızlıkları (% 5)'dır. Gastrointestinal bozukluklarÇok yaygın: Abdominal ağrıYaygın: Bulantı, ishal, kusma, abdominal şişkinlik Genel bozukluklar ve Enjeksiyon bölgesi koşulları:Yaygın: Enjeksiyon bölgesi reaksiyonları/ enjeksiyon bölgesi ağrısı, ateş, ameliyat sonrası ağrı, ağrıEnfeksiyonlar ve enfestasyonlar:Yaygın: Üst solunum yolu enfeksiyonu, farenjitSinir sistemi bozuklukları:Çok yaygın: Baş ağrısı Yaygın: Migren, baş dönmesiHamilelik, loğusalık ve perinatal koşullar:Yaygın: DüşükÜreme sistemi ve meme bozukluklarıYaygın: Vajinal kanama, intermenstrüel kanama, pelvik ağrısı, over hiperstimülasyon sendromu, dismenore, meme ağrısıSolunum, torasik ve mediastina bozukluklar:Yaygın: ÖksürmeVasküler bozukluklar:Yaygın: Sıcak basmasıDECAPEPTYL® DEPOT enjeksiyonu sonrasında çok nadir olarak anafilaktik reaksiyonları da içeren bölgesel veya genel alerjik reaksiyonlar rapor edilmiştir. Çocuklarda: DECAPEPTYL® DEPOT ile tedavi edilen çocuklarda gözlemlenen istenmeyen etkiler yaygın değildir. istenmeyen etkiler aşağıda belirtilmektedir. Gastro-intestinal bozukluklarYaygın olmayan: Kusma ve mide bulantısıBağışıklık sistemi bozukluklarıYaygın olmayan: Anafilaktik reaksiyonlarDeri ve derialtı doku bozuklukları:Bilinmiyor: Saç kaybıKas ve iskelet ile bağdokusu bozuklukları:Bilinmiyor: Epifizyoliz*Üreme sistemi ve göğüs rahatsızlıklarıYaygın olmayan: Vajinal kanama ve akıntı* Triptorelin kullanımı esnasında az sayıda epifizyoliz capitis femoris rapor edilmiştir. Sebepsonuç ilişkisi olup olmadığı bilinmemektedir.4.9 Doz aşımı ve tedavisiTriptorelinle kullanımı sonucu gerçekleşen dozaşımı hakkında, dozaşımının muhtemel advers etkileri hakkında bir sonuç çıkarmak için yetersiz düzeyde deneyim vardır. Ambalaj formu ve farmasötik formu dikkate alındığında, dozaşımı olması beklenmemektedir.5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Gonadotropin serbestleştirici hormon analogları ATC kodu: L02AE04Triptorelin, doğal gonadotropin-salınım hormonunun (GnRH) sentetik bir dekapeptid analoğudur. GnRH, hipotalamusta sentezlenen ve hipofizde gonadotropinler olarak da adlandırılan LH (luteinleyici hormon) ve FSH'nin (folikül stimüle edici hormon) biyosentezini ve salınımını regüle eden bir dekapeptiddir. GnRH'nın denk ve karşılaştırılabilir bir dozuna kıyasla, triptorelin, hipofizi LH ve FSH sekresyonuna daha kuvvetli bir düzeyde stimüle eder ve etki süresi daha uzundur. LH ve FSH seviyelerindeki artış, ilk olarak, erkeklerde serum testosteron konsantrasyonlarında bir artışa ve kadınlarda serum östrojen konsantrasyonlarında bir artışa yol açar. Bir GnRH agonistinin kronik uygulaması, pituiter LH- ve FSH-sekresyonunda bir inhibisyona yol açar. Bu inhibisyon, stereoidogenezde bir düşüş olmasını sağlayarak, kadınlarda serum estradiol konsantrasyonunun ve erkeklerde serum testosteron konsantrasyonunun sırasıyla postmenopozal veya kastrasyon düzeylerine düşmesine, yani bir hipogonadotrofik hipogonadal durumun ortaya çıkmasına yol açar. Erken pubertesi bulunan çocuklarda, estradiol veya testosteron konsantrasyonu, prepubertal aralık dahiline düşer. Plazma DHEAS (dihidroepiandrostenedion sülfat) seviyeleri etkilenmez. Terapötik olarak, bu durum, erkeklerde testosterona duyarlı prostat tümörlerinin büyümesinde bir azalma ve kadınlarda endometrioz odakları ve östrojene bağlı uterus miyomlarında bir düşüş olmasını sağlar. Uterus miyomuyla ilgili olarak, tedavinin maksimum yararı, anemisi bulunan kadınlarda (hemoglobini 8 g/dL'ye eşit veya daha az olanlar) gözlemlenir. CPP'den muzdarip çocuklarda, triptorelin tedavisi, gonadotropinlerin, estradiolün ve testosteronun sekresyonunun prepubertal seviyelere süpresyonunu sağlar. Bu etkinlik, pubertal belirtilerin engellenmesine ve hatta gerilemesine ve CPP hastalarının tahmini yetişkin boyunda bir artışa yol açar. Hipofizin DECAPEPTYL® DEPOT etkisiyle downregülasyonu LH etkisini ve dolayısı ile prematüre ovulasyonu ve/veya foliküler luteinizasyonu önler. GnRH agonisti ile downregülasyonunun kullanılması siklus iptali oranını düşürür ve yardımla üreme teknikleri siklusunda gebelik oranını artırır. 5.2 Farmakokinetik özelliklerGenel özelliklerEmilim:Bir triptorelin depot-formülasyonunun (sürekli salım mikrokapsüller) intramüsküler veya subkütan uygulamasının ardından, plazmadaki triptorelin konsantrasyonunda hızlı bir artış kaydedilir ve ilk saatlerde maksimum düzeye erişilir. Daha sonra, triptorelin konsantrasyonu 24 saat içerisinde belirgin düzeyde düşer. 4. günde, değer, ikinci bir maksimuma erişir ve 44 günün ardından çift-üssel seyirle belirleme sınırının altına düşer. Subkütan enjeksiyonlardan sonra, triptorelin artışı, intramüsküler enjeksiyonlardan sonra görülen artışa kıyasla daha kademelidir ve biraz daha düşük bir konsantrasyonda gerçekleşir. Subkütan enjeksiyonundan sonra, triptorelin konsantrasyonundaki düşüş daha uzun sürer ve ilgili değerler, belirleme sınırının altına 65 günün ardından düşer. Dağılım:® DECAPEPTYL® DEPOT ilacının intramüsküler uygulamasından sonra, triptorelinin plazma konsantrasyonları, poli-(d,l laktid koglikolid) polimerin (yavaş) bozunmasıyla belirlenir. Bu uygulama formuna ilişkin mekanizma, triptorelinin polimerden yavaş salımının gerçekleşmesini sağlar. Biyotransformasyon:Hipofizde, sistemik olarak mevcut triptorelin, piroglutamil-peptidaz ve bir nötr endopeptidaz aracılığıyla N-terminal kesimi ile inaktive edilir. Karaciğer ve böbreklerde, triptorelin, biyolojik olarak inaktif peptidlerine ve amino asitlere bozunur. Eliminasyon:6 aylık bir periyot boyunca sürdürülen ve her 28 günde bir yapılan bir uygulamadan oluşan tedavi esnasında, herhangi bir uygulama şeklinde triptorelinin biriktiğine dair bir belirti yoktu. Plazma triptorelin değerleri, bir intramüsküler veya subkütan uygulamadan bir sonraki uygulamadan önce yaklaşık 100 pg/mL düzeyine düştü (medyan değerleri). Sistemik olmayan bir şekilde mevcut bulunan triptorelin miktarının enjeksiyon yerinde, örneğin makrofajlar vasıtasıyla metabolize olduğu varsayılmaktadır. 100 ^g triptorelin infüzyonunun bitiminden (1 saat boyunca) 40 dakika sonra, uygulanan dozun %3 ilâ %14'ü böbreklerden elimine edilmiştir. Renal fonksiyonları bozuk olan hastalar için, triptorelin depot-formülasyonuyla yapılan tedavinin bu hastalara özel olarak uyarlanması ve münferitleştirilmesine gerek yoktur, zira renal eliminasyon yolunun istatistiksel açıdan anlamı ikincil plandadır ve triptorelinin bir etkin madde olarak terapötik aralığı geniştir. Doğrusallık/doğrusal olmayan durum:Biyoyararlanım: Erkekler: İntramüsküler depot kaynaklı etkin bileşen triptorelinin ilk 13 gün içerisindeki biyoyararlanımı %38,3'tür. İlave salım, ortalama olarak beher günde dozun %0,92'sinde doğrusaldır. Subkütan uygulamadan sonraki biyoyararlanım, intramüsküler yararlanımın %69'una tekabül eder. Kadınlar: 27 test gününden sonra, ortalama olarak uygulanan dozun %35,7'si tespit edilebilir ve %25,5'i ilk 13 gün içerisinde serbest kalır ve ortalama olarak, beher günde dozun %0,73'ündeki ilave serbest kalma doğrusaldır. 5.3 Klinik öncesi güvenlilik verileriTriptorelinle uzun bir süre boyunca tedavi edilen sıçanlarda, pituiter tümörlerinde bir artış tespit edilmiştir, ancak benzer bir etki farelerde görülmemiştir. Triptorelinin insanlardaki hipofizer anormallikler üzerinde bir tesirinin bulunup bulunmadığı bilinmemektedir. Yapılan gözlemin insanlarla ilgisi olmadığı değerlendirmesi yapılmıştır. Kemirgenlerde, diğer LHRH analoglarıyla bağlantılı hipofiz tümörlerin ortaya çıktığı da bilinmektedir. Triptorelinin embriyo-/fetotoksik olduğu ve embriyo-/fetal gelişimde bir gecikmeye ve sıçanlarda parturasyonda gecikmeye neden olduğu görülmüştür. Tekrarlanan doz toksisitesi ve genotoksisite çalışmalarına göre, preklinik veriler, ilacın insanlar için özel bir tehlikesinin bulunmadığını göstermektedir.DECAPEPTYL® DEPOT'un veya süspansiyon ajanının tek intramüsküler veya subkütan enjeksiyonu, enjeksiyon yerinde gecikmiş yabancı vücut reaksiyonları üretti. İntramüsküler enjeksiyondan sonra görülen bu geç reaksiyonlar 8 hafta içerisinde hemen hemen düzeldi, intramüsküler enjeksiyonda hemen hemen düzeldi, ancak subkütan enjeksiyondan sonra® sadece bir miktar düzelme gösterdi. DECAPEPTYL® DEPOT'un intravenöz enjeksiyondan sonraki lokal toleransı sınırlıydı. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiÖnceden doldurulmuş toz içeren bir şırıngada:Poli-(d,l laktid koglikolid) Propilenglikol oktanoat dekanoat 1 ml süspansiyon ajanı içeren önceden doldurulmuş bir şırıngada: Polisorbat 80 Dekstran 70 Sodyum klorür Sodyum hidrojen fosfat dihidrat Sodyum hidroksit Enjeksiyonluk su 6.2 GeçimsizliklerGeçimsizlik çalışmalarının bulunmaması nedeniyle bu ilacın diğer ilaçlarla karıştırılmaması gerekir.6.3 Raf ömrü36 ay.Sulandırılmış süspansiyon: 3 dakika 6.4 Saklamaya yönelik özel tedbirler2 °C-8 °C arasında orijinal ambalajında buzdolabında saklanmalıdır. Kabı, dış karton kutu içerisinde tutunuz.6.5 Ambalajın niteliği ve içeriğiToz: Kullanıma hazır dolu şırınga Çözücü: Kullanıma hazır dolu şırıngaBir bağlantı aparatı (polipropilen) bulunan kullanıma hazır dolu şırıngalar (borosilikat cam tipi I, berrak), siyah renkte klorobutil lastik tıpa (piston tıpası, tip I) ve enjeksiyon iğnesi. Ambalaj boyutları: 1 adet kullanıma hazır dolu şırınga (toz) ve 1 adet kullanıma hazır şırınga (çözücü) 3 adet kullanıma hazır dolu şırınga (toz) ve 3 adet kullanıma hazır şırınga (çözücü) 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerÖzel bir gereklilik bulunmamaktadır. Kullanılmamış olan ürün ya da atık materyaller, Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir.İlacın HazırlanmasıDoktorun süspansiyonu nasıl hazırlaması gerektiğine ilişkin talimatlar: Başarılı tedavi, süspansiyonun doğru hazırlanmasına bağlı olduğu için, aşağıda verilen talimatlar harfiyen izlenmelidir: - DECAPEPTYL® DEPOT ambalajını buzdolabından alınız. - Toz içeren tek kullanımlık şırıngadan kapağı çıkarınız. Dökülmesini önlemek için dik tutunuz. - Bağlantı aparatı bulunan ambalajı, bağlantı aparatını çıkartmadan açınız. - Toz içeren şırıngayı, ambalajdaki bağlantı aparatına sıkıştırınız ve daha sonra ambalajı çıkartınız. Sıvı içeren şırıngayı, bağlantı aparatının açıktaki ucuna sıkıca sıkıştırınız ve doğru ve sıkıca oturduğundan emin olunuz. 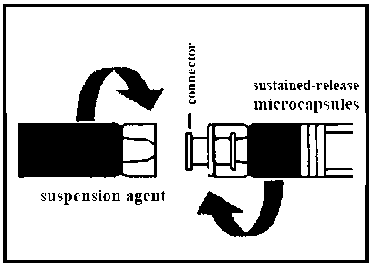 Hazırlama
HazırlamaSüspansiyonun hazırlanmasıSıvıyı, içinde toz madde bulunan şırıngaya doğru itiniz; daha sonra, karışımı ilk şırıngaya geri itiniz; bu işlemi, ilk iki veya üç sefer, enjeksiyon çubuğunun tamamını ittirmeden gerçekleştiriniz. Bu işlemi, yaklaşık 10 defa veya homojen ve beyaz ilâ hafif sarı renkte bir süspansiyon elde edene kadar tekrarlayınız. Süspansiyonu hazırlarken, bir miktar köpük ortaya çıkması muhtemeldir. Enjeksiyon verilmeden önce köpüğün çözündürülmesi veya şırıngadan çıkartılması önemlidir. 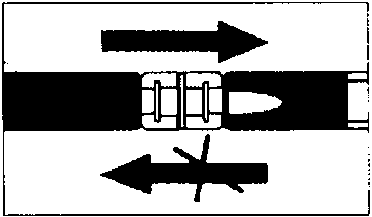 Karıştırma
Karıştırma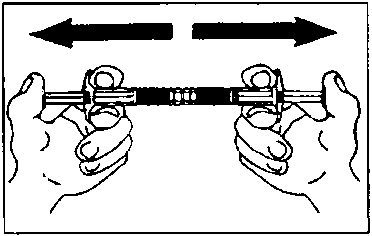 Yaklaşık 10 defa karıştırın
Yaklaşık 10 defa karıştırınEnjeksiyon- Boş şırıngayla beraber bağlantı aparatını çıkartınız. - Seçtiğiniz enjeksiyon tipine uygun iğneyi, kullanıma hazır süspansiyon bulunan şırıngaya monte ediniz. - Derhal, subkütan yolla veya derin intramuskuler olarak enjekte ediniz. RUHSAT SAHİBİ7.Ferring İlaç San.ve Tic. Ltd. Şti. Büyükdere Cad. Nurol Plaza No:255 A Blok Kat 13 Maslak 34398 İstanbul Tel: (0212) 335 62 00 Faks: (0212) 285 42 74 e-posta: [email protected] 8. RUHSAT NUMARASI120/939. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 02.10.2006 Ruhsat yenileme tarihi:10. KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriDecapeptyl Depot 3,75mg Enjeksiyonluk Suspansiyon için Toz ve ÇözücüEtken Maddesi: Triptorelin Asetat Atc Kodu: L02AE04 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.