Miacalcic 100 IU Ampul Kısa Ürün BilgisiEndokrin Sistem » Kalsiyum Metabolizması » Paratiroid Yüksekliği » Kalsitonin Hormonu » Kalsitonin (Salmon Kalsitonin) KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIMİACALCtC® 100 lU Ampul2. KALİTATİF VE KANTİFATİF BİLEŞİMEtkin madde:Etkin madde, sentetik somon kalsitoninidir (EW ismi: Kalsitonin).1 steril ampul (1 mi'lik) 100 lU sentetik somon kalsitonini içerir. Bir Uluslararası Birim (=IU), 0.2 mikrogram sentetik somon kalsitoninine karşılık gelir. Yardımcı madde:Sodyum klorür 7,5 mgSodyum asetat trihidrat 2,0 mg Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMAmpul4. KLİNİK ÖZELLİKLER4.1. Terapötik Endikasyonlar Ani immobiİizasyona bağlı akut kemik kaybmın önlenmesi (tedavi süresi 2 haftadan maksimum 4 haftaya kadar), Alternatif tedavilere cevap vermeyen veya altematif tedavilerin uygun ohnadığı Paget hastalarmda (genellikle 3 ayla sımrlı bir tedavi), Kanserin neden olduğu hiperkalsemi, Sudeck hastalığı (Algodistrofi) tedavisinde endikedir. 4.2. Pozoloji ve uygulama şekli Pozoloji/uygulama sıkbğı ve süresi:Tüm endikasyonlarMalignite gelişimi ve uzun süreli kalsitonin kullammı arasındaki ilişki nedeniyle (bkz. bölüm 4,4 Özel kullamm uyanlan ve önlemleri), tüm endikasyonlarda tedavi etkili en düşük dozda ve mümkün olan en kısa süre ile uygulanmalıdır. Ani İmmobiİizasyona bağlı akut kemik kaybmm önlenmesi Önerilen doz subkutan veya intramusküler enjeksiyon şeklinde uygulanan günde bir kere 100 lU veya günde iki kere 50 lU'dur. Doz yeniden hareketlenmenin başlangıcında günde 50 lU'ya düşürülebilir. Önerilen tedavi süresi 2 haftadır ve uzun süreli kalsitonin kullammı ile artan malignite riski sebebiyle hiç bir durumda 4 haftayı geçmesi önerilmemektedir. Paget hastalığı Paget hastalığında önerilen doz s.c. veya i.m. enjeksiyon şeklinde günlük 100 lUMur, ancak haftada 3 kere 50 lU olan minimum doz rejimi ile klinik ve biyokimyasal gelişime ulaşılmıştır. Doz her hastamn ihtiyacına göre düzenlenmelidir. Hasta tedaviye yamt verdikten ve semptomlar düzeldikten sonra tedavi kesilmelidir. Tedavi süresi uzun süreli kalsitonin kullanımı ile artan malignite riski sebebiyle normalde 3 ayı geçmemelidir, İstisnai durumlarda (örneğin patolojik kınk tehlikesi olan hastalarda) tedavi süresi maksimum 6 aya (önerilen) uzatılabilir. Bu hastalarda periyodik tekrar tedavi düşünülebilir, ancak potansiyel yararlar ve artmış malignite riski ile kalsitoninin uzun süreli kullanımı arasındaki ilişki dikkate alınmalıdır (bkz. Bölüm 4.4). Kalsitoninin etkisi kemik yeniden modellenmesinin uygun işaretleyicileri (serum alkalin fosfataz ya da üriner hidroksipirolin ya da deoksipiridinolin) ile izlenebilir. Not: Tedavi esnasında serum alkalen fosfataz ve üriner hidroksiprolin atılımı belirgin olarak normal düzeylere iner. Bununla beraber, nadiren alkalen fosfataz ve hidroksiprolin atılım düzeylerinde başlangıçtaki düşüşü takiben bir yükselme görülebilir; bu durumda hekim klinik tabloya göre tedavinin kesilmesine ve ne zaman tekrar başlanması gerektiğine karar vermelidir. Tedavinin kesilmesinden bir ya da birkaç ay sonra kemik metabolizma bozukluklan tekrarlayabilir ve yeni bir MİACALCİC kürüne ihtiyaç duyulabilir. Kanserin neden olduğu hiperkalsemi: Önerilen başlangıç dozu, subkutan veya kas içine enjeksiyon yoluyla 6 ila 8 saatte bir 100 lUMur. Aynca, öncesinde yapılan rehidrasyon sonrasında somon kalsitonini intravenöz enjeksiyon yoluyla da uygulanabilir. Bir veya iki gün sonra yanıt yeterli değilse, doz, 6 ila 8 saatte bir maksimum 400 lU'ya yükseltilebilir. Şiddetli ya da acil vakalarda, 500 mİ %0.9 a/h sodyum klorür çözeltisi içinde, 10 lU/ kg vücut ağırlığına kadarki dozlar ile intravenöz infüzyon, en az 6 saat süreyle uygulanabilir. Somon kalsitonini bir peptit olduğundan, inftizyon kitinin plastiği üzerinden adsorpsiyon meydana gelebilir. Bu durum, hastaya uygulanan toplam dozu azaltma potansiyeline sahiptir. Başta tedavinin erken fazlarında olmak üzere, serum kalsiyum ölçümü dahil laboratuar ve klinik yanıtın sıklıkla izlenmesi önerilir. MİACALCİC ile doz uygulamaları, hastaya özgü gereklilikler doğrultusunda birey bazında belirlenmelidir. Sudeck hastalığı (Algodistrofı): Nörodistrofık bozuklukların erken teşhisi önemli olup, tedaviye teşhis konulduktan hemen sonra başlanmalıdır. Önerilen doz, s.c. veya i.m. enjeksiyonla 2-4 hafta boyunca günlük olarak uygulanan 100 lU'dur. Klinik tablodaki gelişmeye göre 6 haftaya kadar gün aşın 100 lU ilave olarak uygulanabilir. Uygulama şekli:Subkutan veya intramüsküler enjeksiyon yoluyla uygulanır.Osteoliz ve/veya osteopeniye bağlı kemik ağnlannm tedavisinde serum fizyolojik içinde yavaş i.v. infüzyonla ya da gün içinde bölünmüş dozlar halinde s.c veya i.m. enjeksiyon şeklinde uygulanabilir. Hiperkalsemik krizin acil tedavisinde en etkili uygulama yöntemi olan intravenöz infüzyon tercih edilmelidir. Not: Subkutan enjeksiyonlan kendileri uygulayacak olan hastalar, doktor veya hemşireden mutlaka uygulama şeklini öğrenmelidir. Uzun süreli tedavilerde kalsitoninlere karşı antikor gelişebilirse de, bu durum klinik cevabı etkilemez. Özellikle uzun süreli tedavi alan pagetik hastalarda, bağlanma yerlerinin doygunluğuna bağlı olarak ortaya çıkan ve antikor oluşumu ile ilgili olmayan kaçış fenomeni görülebilir. Tedaviye ara verilmesiyle, MİACALCİC'e terapötik cevap yeniden oluşur. Antikorların gelişimi Tedavi mümkün olduğu kadar kısa süreli olmalıdır (yukandaki tüm endikasyonlar bölümüne bakınız). Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği;Böbrek ya da karaciğer fonksiyon bozukluğu olan hastalarda herhangi bir çalışma yapılmamış olmasına rağmen geniş deneyimde bu hasta popülasyonlannda tolerabilite azalması görülmemiştir ve doz ayarlamasına gerek yoktur.Son dönem böbrek yetmezliği olan hastalarda metabolik klerens sağlıklı kişilere göre azalmıştır. Ancak bu bulgunun klinik önemi bilinmemektedir. Pediyatrik popülasyon (0-18 yaş):Çocuklarda MİACALCİC Ampul kullammına ait sımrlı deneyim olduğundan bu hasta grubuna hiçbir tavsiye yapılamamaktadır.Geriyatrik popülasyon:Parenteral MİACALCİC'in yaşlılarda uygulanması ile ilgili geniş deneyimde tolerabilite azalması görülmemiştir ve doz ayarlamasına gerek yoktur.4.3. KontrendikasyonlarSomon kalsitonine ya da içeriğindeki yardımcı maddelerden herhangi birine karşı bilinen aşın duyarlılıkta kontrendikedir (bkz. Bölüm 4.4. Özel kullanım uyanlan ve önlemleri, Bölüm 4.8. İstenmeyen etkiler ve Bölüm 6.1. Yardımcı maddelerin listesi).Hipokalsemisi olan hastalarda da kontrendikedir. 4.4 . Özel kullanım uyarıları ve önlemleriSomon kalsitonininin peptid yapısında olmasından dolayı sistemik aleıjik reaksiyonlann oluşma olasılığı vardır ve MİACALCtC uygulanan hastalarda, tek tük anafilalrtik şok vakalanm da içeren, aleıjik tipte reaksiyonlar bildirilmiştir. Somon kalsitonine duyarlılığı olabileceğinden şüphelenilen hastalarda tedavi öncesinde, seyreltilmiş steril MİACALCİC çözeltisi ile deri testi yapılması düşünülmelidir.Osteoartriti ve osteoporozu olan hastalarda yürütülen randomize kontrollü çalışmalann değerlendirildiği meta-analizlerde, uzun süreli kalsitonin kıülammmm, plasebo ile karşılaştınldığında malignite insidansında küçük, fakat istatistiksel olarak anlamlı bir artışla ilişkili olduğu gösterilmiştir (bkz. bölüm 4.8 İstenmeyen etkiler). Bu meta-analizler, plasebo ile karşılaştınidığmda kalsitonin ile tedavi edilmiş hastalar için malignitelerin mutlak meydana gelme oramnda %0.7 ila %2.36 aralığında değişen bir artış olduğunu göstermiştir. 6 ila 12 aylık tedaviden sonra kalsitonin ve plasebo arasında sayısal dengesizlikler gözlenmiştir. Bu gözlemin mekanizması belirlenmemiştir. Bu çalışmalardaki hastalar oral veya intra-nazal formülasyonlarla tedavi edilmiş olmakla birlikte; kalsitonirün uzun süre subkutan, intramüsküler veya intravenöz yoldan uygulanmasına bağlı risk artışı olasılık dışı bırakılamaz. Tedavinin faydalan her hasta için bireysel olarak olası risklere karşı dikkatli bir şekilde değerlendirilmelidir (bkz. bölüm 4.8 İstenmeyen etkiler). MİACALCİC Ampuller, 1 mİ başına 23 mg'dan daha az sodyum içerdiklerinden dolayı sodyum içermedikleri düşünülebilir. 4.5. Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriKalsitonin ve lityumun bir arada kullammı plazma lityum konsantrasyonlarını azaltabilir. Lityum dozunun ayarlanması gerekebilir.Özellikle kemik yıkımı anormal düzeyde yüksek oranda olan hastalarda belirgin olmak üzere, kalsitonin uygulamasından sonra serum kalsiyum düzeyleri, normal düzeylerin altına geçici olarak düşebilir. Osteoklastik aktivite azaldıkça bu etki de hafifler. Bununla birlikte, kardiyak glikozitler veya kalsiyum kanal blokerleri ile eşzamanlı tedavi görmekte olan hastalarda dikkatli olunmalıdır. Hücresel elektrolit konsantrasyonlanndaki değişiklikler nedeniyle etkilerinin modifıye olabileceği göz Önünde bulundurularak, bu ilaçların dozajlannda ayarlamaya gidilmesi gerekebilir. Kalsitoninin bifosfonatler ile kombinasyon halinde kullanımı, aditif kalsiyum düşürücü etki ile sonuçlanabilir. Özel popûlasyonlara ilişkin ek bilgilerHiçbir çalışma yapılmamıştır.Pediyatrik popülasyon:Çalışma yapılmamıştır.4.6. Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi: C.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeline sahip kadınlar uygun bir doğum kontrol yöntemi uygulamalı, eğer hamile kalmaya karar verirlerse hekimlerine danışmalıdır. MIACALCIC'in doğum kontrol yöntemleri ile bilinen bir etkileşimi yoktur.Gebelik dönemiMİACALCİC'in gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve- veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.Gebe kadınlarda çalışma yapılmadığından, MİACALCİC gerekli olmadıkça gebelik döneminde kullamimamalıdır. Laktasyon dönemiEmziren annelerde çalışma yapılmadığından ve somon kalsitonininin anne sütüne geçip geçmediği bilinmediğinden, tedavi sırasında annenin bebeğini emzirmesi tavsiye edilmemektedir.Üreme yeteneği / FertiliteHayvan çalışmaları MİACALCİC'in embriyotoksik ve teratojenik potansiyel taşımadığını göstermiştir. Somon kalsitoninin hayvanlarda plasenta bariyerini geçmediği görülmektedir (bkz. bölüm 5.3).4.7. Araç ve makine kullanımı üzerindeki etkilerMİACALCİC'in araba ve makine kullanımı üzerine etkisine ait hiçbir çalışma bulunmamaktadır. MİACALCİC hastamn reaksiyonlarını azaltan halsizlik, sersemlik ve görme bozukluklanna (Bkz. 4.8. İstenmeyen etkiler) neden olabilir. Bu nedenle, hastalar, bu etkilerin meydana gelebileceği ve böyle durumlarda araç ya da makine kullanmamaları konusımda uyanimalıdır.4.8. İstenmeyen etkilerBulantı, kusma, ateş basması ve baş dönmesi doza bağımlı olup, i.m. veya s.c. uygulamalardan daha sık i.v. uygulamada görülür. Poliüri ve üşüme hissi bildirilmiştir. Bu etkiler genellikle kendiliğinden azalır ve sadece az sayıda vakada geçici doz indirimi gerekir.Advers reaksiyonlar sıklıklanna göre, en sık görülen en üstte olacak şekilde sıralanmıştır: Çok yaygın (> 1/10); yaygın (> 1/100, <1/10); yaygın olmayan (> 1/1.000, <1/100); seyrek (> 1/10.000, <1/1.000); çok seyrek (< 1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Bagısıkhk sistemi hastalıklarıSeyrek: Aşın duyarlılık. Çok seyrek: Anafilaktik ve anafilaktoid reaksiyonlar, anafılaktik şok. Sinir sistemi hastalıklarıYaygın: Baş ağnsı, baş dönmesi, tat alma duyusunda değişiklik (disgözi). Bilinmiyor: Tremor Göz hastalıklarıYaygın olmayan: Görme bozukluğu. Vaskûler hastalıklarÇok yaygın: Ciltte kızarıklık, ateş basması. Yaygın olmayan: Hipertansiyon. Gastrointestinal hastalıklarÇok Yaygın: Bulantı, kusma Yaygın: Diyare, abdominal ağrı Deri ve deri altı doku hastalıklarıYaygın olmayan: Yaygın döküntü, pruritus Kas'iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın: Artralji, kas-iskelet ağrısı. Böbrek ve idrar hastalıklarıYaygın olmayan: Poliüri. Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın: Halsizlik. Yaygın olmayan: Grip benzeri semptomlar, ödem (yüz, ekstremitelerde ve yaygın), enjeksiyon yeri reaksiyonlan, kaşıntı. Araştırmalar: Seyrek: Kalsitonine antikor gelişimi Osteoartriti ve osteoporozu olan hastalarda yürütülen randomize kontrollü çalışmaların değerlendirildiği meta-analizlerde, uzun süreli kalsitonin kullanımının, plasebo ile karşılaştınidığında malignite insidansmda küçük, fakat istatistiksel olarak anlamlı bir artışla ilişkili olduğu gösterilmiştir. Bu gözlemin mekanizması belirlenmemiştir (bkz. bölüm 4.4 Özel kullamm uyanları ve önlemleri). 4.9. Doz aşımı ve tedavisiMLA.CALCİC parenteral uygulandığında bulantı, kusma, sıcak basması ve baş dönmesi doza bağlı bilinen etkilerdir. Bulantı ve kusma parenteral MİACALCİC'in aşın dozda verilmesi sonucu oluşur, ancak aşın doza bağlı ciddi istenmeyen etkiler bildirilmemiştir. Tedavi semptomatiktir.5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Kalsiyum homeostazı düzenleyicisi ATC kodu: H05BA01Etki mekanizması: Bütün kalsitonin yapıları, dizilim açısından türden türe farklılık gösteren N-terminalinde yedi amino asit kalıntısından oluşmuş halka içeren tek sıra halinde 32 aminoasit içermektedir. Somon kalsitonini, reseptör bağlantı bölgelerine, memelilerden elde edilen kalsitoninlerden daha çok afinite gösterdiğinden daha güçlü ve daha uzun etkilidir. Spesifik reseptörleri üzerinden osteoklast aktivitesini inhibe eden somon kalsitonini, kemik rezorpsiyon hızımn arttığı osteoporoz gibi durumlarda kemik yıkımım belirgin olarak azaltır. Hem hayvan modellerinde hem de insanda somon kalsitoninin, muhtemelen merkezi sinir sistemine doğrudan bir etki yolu ile analjezik etkili olduğu saptanmıştır. Farmakodinamik etkiler: MLACALCİC tek bir dozun ardından insanda, kalsiyum, fosfor ve sodyumun idrarla atınunda (tübüler geri emilimlerini azaltarak) artış ve hidroksiprolinin idrarla atımmda azakna şeklinde ortaya çıkan, klinik açıdan anlamlı bir biyolojik yamt oluşturur. Parenteral MİACALCİC'in uzun süreli uygulanması kemik yıkımının biyomedikal göstergeleri olan piridinolin-çapraz bağlan ve alkalen fosfatazın iskelet izoenzimlerini anlamlı olarak baskılar. 5.2 Farmakokinetik özellikleriGenel özelliklerEmilim:İntramüsküler veya subkutan enjeksiyonlardan sonra MİACALCİC'in mutlak biyoyararlammı yaklaşık %70'dir. Doruk plazma konsantrasyonlan 1 saat içinde elde edilir. Subkutan uygulama sonrasında, doruk plazma düzeylerine 23 dakikada ulaşılır. Dağılım:Sanal dağılım hacmi 0.15-0.3 L/kg ve protein bağlanma oranı %30-40'dır. Bivotransformasvon:Somon kalsitonin ile yapılan hayvan çalışmalarından ve insan kaynaklı kalsitoninler ve domuz kalsitoninleri ile yapılan klinik çalışmalardan alınan bilgiler somon kalsitoninin, öncelikli olarak böbreklerde ve bunun yamnda kan ve periferik dokularda inaktif küçük parçalara dönüşerek hızlıca metabolize olduğunu gösterir. Değişmeyen küçük miktar hormon ve inaktif metabolitleri idrar ile atılır. Eliminasvon:Eliminasyon yan ömrü intramüsküler uygulama somrası 1 saat ve subkutan uygulama som-ası 1-1,5 saattir. Ana ilaç fraksiyonu %2 olmak üzere, somon kalsitonini ve metabolitleri %95 oramnda böbrekten atılırlar. 5.3. Klinik öncesi güvenlilik verileriLaboratuvar hayvanlannda konvansiyonel uzun-süreli toksisite, üreme, mutajenisite ve karsinojenisite çalışmalan yapılmıştır.Toksisite çalışmalanndaki minör etkiler, somon kalsitoninin farmakolojik etkisine bağlanmaktadır. Somon kalsitonini embriyotoksik, teratojenik ve mutajenik potansiyel göstermez. Toksisite ve karsinojenisite çalışmalan somon kalsitonininin klinik kullammdan daha düşük miktarlarda, sıçanlarda hipofiz tümörlerini artırdığını göstermiştir. Ancak, yapılan daha ileri preklinik çalışmalarda, özellikle farelerde yürütülen karsinojenisite çalışmalarında en yüksek maruziyetin insanda 50 lU dozda uygulamadan sonraki maruziyetten 760 kez fazla olduğu bulunmuştur. Bu da, hipofiz tümörü indüksiyonunun sadece sıçanlara özgü bir durum olduğunu olduğunu düşündürmektedir. in vivoklinik dışı güvenlilik verileri somon kalsitonin tedavisi ile malignite gelişimi arasında bir ilişkiyi desteklememekte ve tümör progresyonuna yönelik herhangi bir kanıt sunmamaktadır.Bunun yamnda, hastalarda hipofiz tümörleriyle ilgili hiçbir advers olay bildirilmemiştir. Buradan da, hipofiz tümörü indüksiyonunun sıçana özgü vaka olduğu ve sıçan hipofizer tümörlerinin MİACALCİC'in klinik kullanımına ait konuyla ilgili olmadığma dair yeterli kamtm olduğu sonucuna vanlmıştır. 6. FARMASÖTİK BİLGİLER6.1. Yardımcı maddelerin listesiSodyum klorür Asetik asitSodyum asetat trihidrat Enjeksiyonluk su 6.2 GeçimsizliklerGeçerli değil6.3 Raf ömrüAçılmadığı takdirde 5 yıl6.4 Saklamaya yönelik özel uyarılarBuzdolabında 2 - 8°C arasında saklayınız. Dondurmayınız.Ampul bir kez açıldıktan sonra hemen kullanılmalıdır ve koruyucu içermediğinden saklanmamalıdır. 6.5 Ambalajın niteliği ve içeriğiTek noktadan kınlabilen 1 mPlik renksiz. Tip I cam ampuller6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerMİACALCİC ampulleri, görsel olarak incelenmelidir. Ampuller berrak ve renksiz değil ise ve partikül içeriyorsa ya da ampuller hasar görmüş ise çözelti kullamimamalıdır.Ampuller tek kullanımlıktır. Kalan çözeltiler atılmalıdır. İntramüsküler ya da subkutan uygulamadan önce oda sıcaklığına gelmesini bekleyiniz. Ampuller bir noktadan kınlan tiptedir. Aşağıda açıklandığı gibi testeresiz olarak açılır. 1. Ampul bir elle gövdeden diğer elle baş tarafından nokta görülecek şekilde tutulur. 2. Noktanın tersi yönünde baş taraf geriye doğru bastınlarak kınlır. 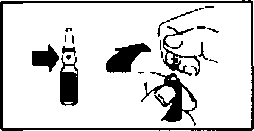
7. RUHSAT SAHIBINovartis Ürünleri 34912 Kurtköy - İstanbulNovartis Pharma Stein AG, İsviçre'de üretilmiştir. 8. RUHSAT NUMARASI102/209. İLK RUHSAT TARİHİ /RUHSAT YENİLEME TARİHİİlk ruhsat tarihi:Ruhsat yenileme tarihi:28 Temmuz 200910. KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriMiacalcic 100 IU AmpulEtken Maddesi: Kalsitonin Atc Kodu: H05BA01 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.