INTANZA 9mikrogram/suş 0,1mL ID Kısa Ürün BilgisiEnfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar » Aşılar » AŞI KOMBİNASYONLARI » Influenza vaccines » Influenza, purified antigen KISA ÜRÜN BİLGİLERİ1.BEŞERİ TIBBİ ÜRÜNÜN ADIINTANZA 9 mikrogram/suş 0,1 mL ID enjeksiyon için süspansiyon içeren kullanıma hazır enjektörGrip aşısı (split virion, inaktive) 2.KALİTATİF VE KANTİTATİF BİLEŞİM Etkin maddeler:Aşağıdaki suşları* içeren (split, inaktif) influenza virüsüdür:A/California/7/2009 (H1N1) - A/California/7/2009 'dan türetilmiş NYMC X-179A benzeri suş.......................................................................................9 mikrogram HA** A/Perth/16/2009 (H3N2) - A/Victoria/210/2009'dan türetilmiş NYMC X-187 benzeri suş......................................................................................9 mikrogram HA** B/Brisbane/60/2008.........................................................................9 mikrogram HA** 0,1 mL'lik doz için Sağlıklı tavuk sürülerinden elde edilen döllenmiş tavuk yumurtalarında üretilmiştir. ** Hemaglutinin Bu aşı, 2011/2012 sezonu için DSÖ tavsiyelerine (Kuzey Yarıküre) ve AB kararına uygundur. Yardımcı maddeler:Sodyum klorür....................0,8 mgPotasyum klorür...................0,02 mg Disodyum fosfat dihidrat........0,115 mg Potasyum dihidrojen fosfat......0,02 mg Yardımcı maddeler için bölüm 6.1'e bakınız. 3.FARMASÖTİK FORMKullanıma hazır enjektörde enjeksiyonluk süspansiyon. Renksiz ve saydam olmayan bir sıvıdır.4. KLİNİK ÖZELLİKLER4.1.Terapötik endikasyonlarÖzellikle gribe bağlı komplikasyon riski yüksek kişiler olmak üzere 18-59 yaş arasındaki yetişkinlerde grip profilaksisinde etkilidir.4.2.Pozoloji ve uygulama şekli Pozoloji:18- 59 yaş arasındaki yetişkinlerde : 0,1 mL'lik tek doz.Uygulama sıklığı ve süresi:Grip aşısı Eylül ayından başlayarak tüm grip sezonu boyunca uygulanabilir. Uygulama her yıl tek doz olarak yapılmalıdır. Grip salgınları başlamış olsa dahi aşılama yapılabilir.Uygulama şekli:Bağışıklama, intradermal yoldan yapılmalıdır. Tavsiye olunan enjeksiyon yeri deltoid bölgesidir. Hazırlanmasına ilişkin daha detaylı talimatlar için Bölüm 6.6'ya bakınız. Kullanıma hazır enjektörün kullanılışı:0,1 mL'lik tek doz için lütfen enjektörün tüm içeriğini enjekte ediniz. Özel popülasyonlar ilişkin ek bilgilerBöbrek/Karaciğer yetmezliği:INTANZA'nın böbrek ve karaciğer yetmezliği olan hastalardaki güvenilirliği ve etkinliği incelenmemiştir.Pediyatrik popülasyon:INTANZA'nın 18 yaşından küçük çocuklar ve adölesanlar üzerindeki güvenilirliği ve etkinliği konusunda yeterli veri bulunmadığından aşının kullanımı önerilmemektedir.Geriyatrik popülasyon:INTANZA 18-59 yaş arasındaki kişilerde endikedir. 60 yaş ve üzeri yaşlılara uygulanması tavsiye edilmemektedir.Diğer:Endojen veya iyatrojen kaynaklı bağışıklık baskılayıcı durumu olan (HIV enfeksiyonu gibi) hastaların antikor yanıtı yetersiz olabilir.4.3.Kontrendikasyonlar-Etkin maddelere, yardımcı maddelerden herhangi birisine, ovalbumin gibi yumurta kalıntılarına, tavuk proteinlerine aşırı duyarlılık. INTANZA'nın her bir dozunda 0,05 mikrogramdan daha fazla ovalbümin içermez.-Aşı, neomisin, formaldehit ve oktoksinol 9 kalıntılarını da içerebilir. -Ateşli hastalık veya akut enfeksiyon geçiren hastalarda aşılama ertelenmelidir. 4.4.Özel kullanım uyarıları ve önlemleriTüm enjekte edilebilir aşılarda olduğu gibi, aşının uygulanmasının ardından nadiren de olsa bir anafilaktik reaksiyonun ortaya çıkması durumunda derhal kullanılmak üzere uygun tıbbi tedavi ve kontrol önlemleri bulunmalıdır.INTANZA kesinlikle "intravasküler yoldan" uygulanmamalıdır.Aşı uygulamasının ardından, enjeksiyon yerinden bir miktar aşı içeriğinin vücut dışına sızması, aşının tekrar uygulanmasını gerektirmez.INTANZA, ovalbumin gibi yumurta kalıntıları içermektedir. Serolojik testlerle etkileşim için Bölüm 4.5'e bakınız. INTANZA, sodyum (klorür, dihidrat disodyum fosfat), potasyum (klorür, monopotasyum fosfat) içerir. INTANZA 0,1 mL'lik dozunda 23 mg'dan daha az sodyum ve 39 mg'dan daha az potasyum ihtiva eder. Sodyum ve Potasyuma bağlı istenmeyen bir etki beklenmediğinden herhangi bir uyarı gerekmemektedir 4.5.Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriDiğer aşılarla birlikte kullanım: INTANZA, diğer aşılarla aynı zamanda uygulanabilir. Bağışıklama farklı bölgelerden yapılmalıdır. Eşzamanlı aşılamaların yan etkilerin şiddetini arttırabileceği dikkate alınmalıdır.Diğer ilaçlarla birlikte kullanım: Eğer hasta kortikosteroidler, sitotoksik ilaçlar veya radyoterapi gibi bağışıklık baskılayıcı bir tedavi görüyorsa, bağışıklık yanıtı azalabilir. Biyolojik testler ile etkileşim: HIV1, Hepatit C ve özellikle de HTLV1'e karşı antikorların saptanması için ELISA yöntemi kullanılan seroloji testlerinde grip aşılamasını takiben yalancı pozitif sonuçlar gözlemlenmiştir. Aşı tarafından oluşturulan IgM yanıtından dolayı ortaya çıkabilen bu geçici yalancı pozitif reaksiyonların geçersizliği Western Blot tekniğiyle kanıtlanmaktadır. 4.6.Gebelik ve laktasyon Genel tavsiyeGebelik kategori CÇocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)Hayvanlar üzerinde yapılan çalışmalar, gebelik/ ve-veya/ embriyonel/fetal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. İnsanlara yönelik potansiyel risk bilinmemektedir.Gebelik dönemiINTANZA gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Gerekli ise, aşının kullanımı gebeliğin 2. trimesterinden itibaren düşünülebilir. Influenza'ya bağlı komplikasyon riski yüksek olan gebe kadınlarda, aşının, gebeliğin dönemine bakılmaksızın uygulanması önerilmektedir.Laktasyon dönemiINTANZA'nın anne sütü ile birlikte salgılanıp salgılanmadığı bilinmemektedir. INTANZA emzirme döneminde kullanılabilinir.Üreme yeteneği / Fertiliteİnsanlarda yapılmış fertilite çalışması bulunmamaktadır. INTANZA ile hayvanlarda yapılmış bir çalışmada, kadınlardaki fertiliteye yönelik herhangi bir tehlikeli etki gözlenmemiştir.4.7.Araç ve makine kullanımı üzerindeki etkilerINTANZA'nın, araç sürme ve makine kullanımı üzerinde etkisi yoktur ya da ihmal edilebilir düzeydedir.4.8.İstenmeyen etkilerKlinik denemelerde gözlemlenen advers reaksiyonlarINTANZA aşısının güvenilirliği, bir enjeksiyon aşı uygulanan 2.384 gönüllü üzerinde gerçekleştirilen 2 adet açık etiketli randomize klinik çalışma yoluyla değerlendirilmiştir. Güvenilirlik değerlendirmesi aşılamayı izleyen ilk üç hafta süresince tüm denekler üzerinde gerçekleştirilmiş ve altı aylık bir takip süresince de ciddi advers reaksiyonlar derlenmiştir. Aşı uygulaması sonrasında en yaygın olarak oluşan reaksiyonlar, enjeksiyon bölgesinde görülen lokal reaksiyonlardır. İntradermal uygulama sonrasındaki görünür lokal reaksiyonlar, intramusküler yoldan uygulanan karşılaştırma aşısı sonrasındakilerden daha fazla sıklıktadır. Oluşan reaksiyonların çoğu başlamalarını izleyen 1 ila 3 gün içinde kendiliğinden düzelmiştir. INTANZA'nın sistemik güvenilirlik profili, intramusküler yoldan uygulanan karşılaştırma aşısınınki ile benzerdir. INTANZA'nın her yıl tekrarlanan enjeksiyonlar sonrasındaki güvenilirlik profili daha önce uygulanan enjeksiyonlarınki ile benzerdir. Aşılama sonrasında kaydedilen advers reaksiyonların sıklığı, aşağıda belirtilen kural sistemi kullanılmak suretiyle çizelgede yer alan veriler vasıtasıyla özetlenmektedir: Çok yaygın ( > 1/10 ); Yaygın ( > 1/100 - < 1/10 ); Yaygın olmayan ( > 1/1000 - < 1/100 ); Seyrek ( > 1/10.000 - < 1/1000); Çok seyrek ( 1 < /10.000 ), bilinmeyen (elde mevcut olan veriler üzerinden tahmin edilemeyen). Kan ve lenfatik sistem hastalıkları Yaygın olmayan: LenfadenopatiSinir sistemi hastalıkları Çok yaygın:Baş AğrısıYaygın olmayan:Parestezi.Deri ve deri altı doku hastalıkları Yaygın olmayan:PruritusDöküntü Seyrek:TerlemeKas-iskelet ve bağ dokusu hastalıkları Çok yaygın:MiyaljiYaygın olmayan:ArtraljiGenel hastalıklar ve enjeksiyon bölgesinde görülen yan etkiler Çok yaygın:Kırıklık (Malazi)Lokal reaksiyonlar: Kızarıklık (bazı vakalarda kızarıklık 7 gün boyunca sürmüştür) Şişme İndürasyon Ağrı, Pruritus. Yaygın:Titreme,Ateş, Lokal reaksiyonlar: Ekimoz. Yaygın olmayan:Asteni.Potansiyel advers etkilerAncak kas içi (intramuskular) veya derin derialtı (subkutan) enjeksiyonu yoluyla uygulanan trivalan grip aşılarından elde edilen deneyimler bağlamında yukarıda belirtilmemiş aşağıdaki sistemik reaksiyonlar bildirilebilir: Kan ve lenfatik sistem hastalıkları Seyrek Geçici trombositopeni. Bağışıklık sistemi hastalıkları Seyrek Ender vakalarda şoka neden olabilen alerjik reaksiyonlar, Anjiyoödem. Sinir sistemi hastalıkları Seyrek Nevralji, Ateşli konvülsiyonlar, Ensefalomyelit, Nevrit, Guillain-Barre sendromu gibi nörolojik hastalıklar. Vasküler hastalıklar Çok seyrek Geçici böbrek rahatsızlığı ile birlikte vaskülit. Deri ve derialtı doku hastalıkları Yaygın olmayan Ürtiker de dâhil olmak üzere genel cilt reaksiyonları. 4.9. Doz aşımıDoz aşımı halinde herhangi bir ters veya olumsuz etki görülmesi olası değildir.5. FARMAKOLOJİK ÖZELLİKLER 5.1. Farmakodinamik özellikler Farmakoterapötik grup:Etki mekanizması |
Suşa spesifik anti-HA antikoru |
A/H1N1 A/Yeni Kaledonya/ 20/99 N=1.296 |
A/H3N2 A/Wisconsin/ 67/2005 N=1.297 |
BB/Malezya/ 2506/2004 N=1.294 |
Sero-koruma oranı |
%87,2 (85,2; 89,0) |
%93,5 (92,0; 94,8) |
%72,9 (70,4; 75,3) |
Sero-konversiyon / Kayda değer artış oranı |
%57,5 (54,7; 60,2) |
% 66,5 (63,8; 69,0) |
%56,7 (54,0; 59,4) |
Geometrik Ortalama Titre Oranı (GMTR) |
9,17 (8,33; 10,1) |
11,5 (10,4; 12,7) |
6,39 (5,96; 6,84) |
** Serokonversiyon = aşılama öncesinde negatif HI titresi ve aşılama sonrasında HI titresi > 40, Kayda değer artış = aşılama öncesinde pozitif HI titresi ve aşılama sonrasında HI titresinde en az 4 misli bir artış
GMTR: Bireylerin geometrik ortalama titre oranı (aşılama öncesi/sonrası titre).
INTANZA, her 3 grip suşunun her biri için de, 18 ila 59 yaşındaki gönüllülere karşılaştırmalı amaçlı olarak intramusküler yoldan uygulanan karşılaştırma amaçlı trivalan inaktive grip aşısı kadar immünojeniktir.
Üç grip suşunun tümü için karşılaştırma amaçlı intramusküler aşısından elde edilen sero-koruma oranları %74,8 ila %95,4; serokonversiyon veya kayda değer artış oranları %56,4 ila %69,3 ve geometrik ortalama titre oranları (GMTR) ise temel çizgisi HI titrelerinin 6,63 ila 11,2 misli aralığında yer almaktadır.
5.2.Farmakokinetik özellikler
Geçerli değildir.5.3.Klinik öncesi güvenilirlik verileri
Yürütülen hayvan çalışmalarından elde edilen klinik olmayan veriler insanlara yönelik hiçbir özel tehlike ortaya çıkartmamıştır. Bu aşı, fareler ve tavşanlar üzerinde immünojeniktir. Tekrar dozu için tavşanlar üzerinde yürütülen toksisite çalışmalarında sistemik toksisiteye ilişkin kayda değer bir bulguya rastlanmamıştır. Ancak tekli ve tekrarlı uygulamaların geçici lokal eritrem ve ödeme yol açtığı gözlemlenmiştir. Bu aşı ile ilgili olmaması nedeniyle genotoksisite ve karsinojenik potansiyel değerlendirilmemiştir. Kadınlarda üremeyle ilgili olarak yürütülen fertilite ve toksisite çalışmaları insanlara yönelik herhangi bir spesifik potansiyel tehlike saptamamıştır.6. FARMASÖTİK ÖZELLİKLER
6.1.Yardımcı maddelerin listesi
Tampon çözelti:Sodyum klorür
Potasyum klorür
Disodyum fosfat dihidrat
Potasyum dihidrojen fosfat
Enjeksiyonluk su
6.2.Geçimsizlikler
Geçimlilik araştırmaları bulunmadığından bu tıbbi ürün diğer tıbbi ürünlerle karıştırılmamalıdır.6.3.Raf ömrü
12 aydır.6.4.Saklamaya yönelik özel tedbirler
Buzdolabında saklayınız (2°C - 8°C). Işıktan korumak üzere enjektörü dış kutusunun içinde muhafaza ediniz. Aşı dondurulmamalıdır. Aşı donmuş ise, çözüp kullanmayınız.Bu aşı renklenmişse veya partikül içeriyorsa kullanılmamalıdır.
6.5.Ambalajın niteliği ve içeriği
Mikro iğnesi takılı, elastomer piston tıpalı (klorobütil), uç başlıklı (termoplastik elastomer ve polipropilen) ve mikro-iğne muhafaza sistemi olan bir Mikro-Enjeksiyon Sistemine sahip kullanıma hazır enjektör (tip I cam) içinde 0,1 mL'lik süspansiyon - 1'lik veya 10'luk veya 20'lik kutuda.Tüm ambalaj büyüklükleri piyasada bulunmayabilir.
6.6.Tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj ve Ambalaj Atıkları Kontrolü Yönetmeliği"ne uygun olarak imha edilmelidir.Kullanıma hazır mikroenjeksiyon sistemi tek kullanım içindir ve birden fazla aşılama için kullanılmamalıdır.
Kullanmadan önce aşıyı çalkalamaya gerek yoktur.
Deri içi (intradermal) enjeksiyon için Mikro-Enjeksiyon Sistemi, bir mikro iğne (1,5 mm) ile bir iğne muhafaza sistemine sahip kullanıma hazır bir enjektörden oluşur.
İğne muhafaza sistemi, kullanım sonrasında mikro iğneyi kapatmak üzere tasarımlanmıştır.
Mikro-Enjeksiyon Sistemi
Mikro İğne Parmak Yerleştirme Yerleri Piston
ia-İğne Başlığı
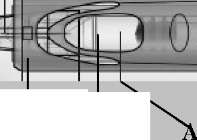
şı Fla
Pencere^
İğne muhafazası
nş
UYGULAMA TALİMATLARIKullanmadan önce aşağıdaki talimatları lütfen okuyun
2-MİKRO-ENJEKSİYON SİSTEMİNİ BAŞ PARMAK İLE ORTA PARMAK ARASINDA
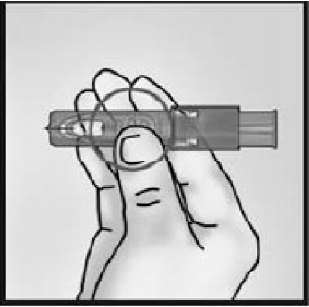
1-İĞNE BAŞLIĞINI ÇIKARTIN
İşaret parmağı serbest kalacak şekilde baş ve orta parmakları parmak yerleştirme yerlerine yerleştirerek sistemi tutun.
Parmakları enjektör pencerelerinin üzerine koymayın.
İğne başlığını Mikro-Enjeksiyon Sisteminden çıkartın.
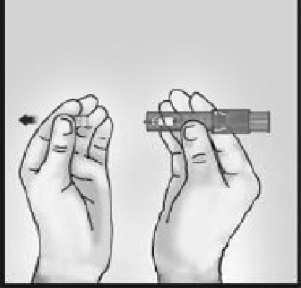
İğne yoluyla dışarıya hava boşaltmayın.
4-İŞARET PARMAĞINI KULLANARAK ENJEKTE EDİN
Mikro-iğnenin saplanmasıyla birlikte deri yüzeyinde hafif bir baskı uygulamaya devam edin ve pistonu itmek üzere işaret parmağını kullanarak aşıyı enjekte edin.
Bu işlem sırasında damar testine gerek yoktur.
3-İĞNEYİ DERİYE DİK BİR AÇIYLA HIZLI BİR ŞEKİLDE SOKUN
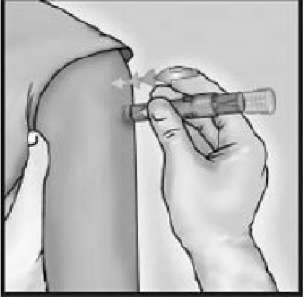
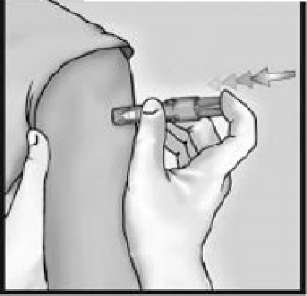 İğneyi deltoid bölgesindeki deriye dik bir açıyla kısa ve hızlı bir hareketle saplayın.
İğneyi deltoid bölgesindeki deriye dik bir açıyla kısa ve hızlı bir hareketle saplayın.
5-PİSTONU SIKICA İTEREK İĞNE MUHAFAZASINI HAREKETE GEÇİRİN
İğneyi deriden çıkartın.
İğneyi kendinizden ve diğerlerinden uzak duracak şekilde tutun. Aynı elin baş parmağını kullanarak pistonu çok sıkı bir şekilde iterek iğne muhafazasını harekete geçirin.
Bir klik sesiyle birlikte iğneyi kaplamak üzere iğne muhafazası dışarı çıkacaktır.
Sistemi derhal en yakınınızdaki uygun tıbbi atık kutusuna atın. Enjeksiyon sonrasında bir püstülün varlığı gözlemlensin veya gözlemlenmesin, gerçekleştirilen enjeksiyon başarılı sayılır. Aşı uygulamasının ardından, enjeksiyon yerinden bir miktar aşı içeriğinin vücut dışına sızması, aşının tekrar uygulanmasını gerektirmez.
f
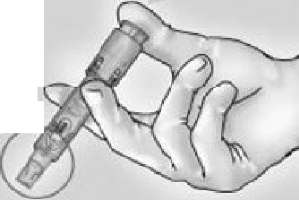 İğne muhafazası harekete geçer
İğne muhafazası harekete geçer
7. RUHSAT SAHİBİ
Sanofi Pasteur Aşı Tic. A.Ş. Büyükdere cad. No: 193 Kat: 3 34394 Levent-Şişli / Istanbul Tel: 0 212 339 10 11 Fax: 0 212 339 13 80
8.RUHSAT NUMARASI :
37
9.İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİ
İlk ruhsat tarihi: 22/09/2010 Ruhsat yenileme tarihi:
10.KÜB 'ÜN YENİLENME TARİHİ :
06/07/2011
1-İĞNE BAŞLIĞINI ÇIKARTIN


İğne yoluyla dışarıya hava boşaltmayın.
3-İĞNEYİ DERİYE DİK BİR AÇIYLA HIZLI BİR ŞEKİLDE SOKUN


f
 İğne muhafazası harekete geçer
İğne muhafazası harekete geçerİlaç Bilgileri
INTANZA 9mikrogram/suş 0,1mL ID
Etken Maddesi: İnaktif grip virüsü
Atc Kodu: J07BB02
Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.