Apidra 100 U/mL Solostar SC Kullanım İçin Enjeksiyonluk Çözelti Kısa Ürün BilgisiSindirim Sistemi ve Metabolizma » Diyabet (Şeker Hastalığı) İlaçları » İnsülinler ve Analogları » İnsülin ve Analogları Enjektabl (kısa etkili) » Insülin GlulisineHızlı KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADI APİDRA® SoloStar® 100 U/ml Subkutan kullanım için enjeksiyonluk çözelti 2. KALİTATİF VE KANTİTATİF BİLEŞİMİ Etkin madde: Her bir ml, 100 U insülin glulisin (3.49 mg'a eşdeğer) içermektedir. Her bir kalem, 300 U'ye eşdeğer, 3 ml enjeksiyonluk çözelti içermektedir. İnsülin glulisin rekombinant DNA teknolojisi ile Escherichia cali'deüretilmektedir.Yardımcı maddeler: Sodyum klorür 5.00 mg/ml Sodyum hidroksit k.m. pH 7.3 Yardımcı maddeler için bölüm 6.1'e bakınız 3. FARMASÖTİK FORM Kullanıma hazır enjeksiyon kalemi içinde enjeksiyonluk çözelti Berrak, renksiz, sulu çözelti 4. KLİNİK ÖZELLİKLER 4.1. Terapötik endikasyonlar İnsülin ile tedavinin gerekli olduğu, diabetes mellituslu, yetişkin, ergen ve 6 yaş ve üzerindeki çocuk hastalarda endikedir. 4.2. Pozoloji ve uygulama şekli Pozoloji: Bu preparatın potensi ünitelerle ifade edilir. Bu üniteler APİDRA®'ya özeldir ve diğer insülin analoglarının potensini belirtmek için kullanılan üniteler veya lU ile aynı değildir. Bkz. Bölüm 5.1. Farmakodinamik Özellikler. Uygulama sıklığı ve süresi: Öğünlerden kısa süre (0-15 dakika) önce ya da hemen sonra verilmelidir. Orta veya uzun etkili bir insülin ya da bazal insülin analogu içeren rejimlerde kullanılmalıdır ve oral hipoglisemik ajanlarla birlikte kullanılabilir. APİDRA® dozajı her bir hasta için bireysel olarak ayarlanmalıdır. Uygulama şekli: APİDRA®, subkutan enjeksiyonla ya da devamlı subkutan pompa infüzyonuyla verilmelidir.® APİDRA®, karın duvarı, uyluk bölgesi veya deltoide subkutan olarak veya karın duvarına devamlı infüzyon yoluyla uygulanmalıdır. Tüm insülinlerde olduğu gibi, bir enjeksiyon bölgesi içindeki (karın, uyluk bölgesi veya deltoid) enjeksiyon yerleri her enjeksiyonda dönüşümlü olarak kullanılmalıdır. Tüm insülinlerde olduğu gibi, emilim hızı ve dolayısıyla etki başlangıcı ve süresi, enjeksiyon yeri, egzersiz ve diğer değişkenlerden etkilenebilir. Karın duvanna yapılan subkutan enjeksiyon, diğer bölgelere göre daha hızlı emilir. (Bkz. Bölüm 5.2.) Kan damarına girilmediğine dikkat edilmelidir. Enjeksiyondan sonra, enjeksiyon yerine masaj yapılmamalıdır. Hasta uygun enjeksiyon tekniklerinin kullanımı konusunda eğitilmelidir. İnsülinlerle karıştırma:
Geçimlilik çalışmalarının yokluğundan dolayı, APİDRA®, NPH (Neutral Protamin Hagedorn) Geçimlilik çalışmalarını insan insülininden başka preparatlarla karıştırılmamalıdır. SoloStar®'ı kullanmadan önce Kullanma Talimatındaki kalemin kullanımı dikkatlice okunmalıdır. (Bkz. Bölüm 6.6) Özel popülasyonlara ilişkin ek bilgiler: Böbrek yetmezliği Böbrek yetmezliği olan hastalarda insülin glulisinin farmakokinetik özellikleri genel olarak aynı kalmıştır. Ancak, böbrek yetmezliğinin varlığında insülin gereksinimi azalabilir. (Bkz. Bölüm 5.2) Karaciğer yetmezliği Karaciğer fonksiyon düşüklüğü olan hastalarda insülin glulisinin farmakokinetik özellikleri araştırılmamıştır. Karaciğer yetmezliği olan hastalarda, azalan insülin metabolizması ve azalan glikojen kapasitesi nedeniyle insülin gereksinimi azalabilir. Pediyatrik Popülasyon APİDRA®'nın 6 yaşından küçük çocuklarda kullanımıyla ilgili yetersiz klinik bilgi mevcuttur. Geriyatrik Popülasyon Diabetes mellituslu yaşlı hastalarda farmakokinetiği ile ilgili kısıtlı veri mevcuttur. Karaciğer fonksiyonunun kötüleşmesi insülin gereksiniminin azalmasına neden olabilir. 4.3. Kontrendikasyonlar İnsülin glulisin veya formülündeki yardımcı maddelerden herhangi birine aşırı duyarlılık, hipoglisemi. 4.4. Özel kullanım uyarıları ve önlemleri Bir hastada yeni bir insülin tipi ya da markasına geçilmesi sıkı tıbbi gözetim altında gerçekleştirilmelidir. Doz, marka (üretici), tip (regüler, nötral protamin Hagedorn [NPH], lente, v.s.), tür (hayvan) ve/veya üretim yöntemindeki değişiklikler, dozajda bir değişikliğe yol açabilir. Birlikte kullanılan oral antidiyabetik tedavinin ayarlanması gerekebilir. Özellikle insülin bağımlı diyabetlilerde, yetersiz doz kullanımı veya tedaviye devam etmemek, hayatı tehdit edici olabilen, hiperglisemi ve diyabetik ketoasidoza neden olabilir. HipoglisemiHipogliseminin gelişme zamanı, kullanılan insülinin etki profiline bağlıdır ve dolayısıyla, tedavi rejimi değiştiğinde değişebilir. Hipogliseminin erken uyarı semptomları aşağıdaki durumlarda değişebilir ya da daha az belirgin olabilir: Uzun süreli diyabet, yoğun insülin tedavisi, diyabetik sinir hastalıkları, beta blokörler gibi ilaçlar veya hayvan kaynaklı insülinden insan insülinine geçişten sonra. Hastaların fiziksel aktivitesinin artması ya da olağan öğün planlarının değişmesi halinde dozaj ayarlaması gerekebilir. Yemekten hemen sonra yapılan fiziksel aktivite hipoglisemi riskini artırabilir. Çözünür insan insülini ile karşılaştırıldığında, hızlı etkili analogların enjeksiyonundan sonra hipoglisemi daha erken meydana gelir. Düzeltilmeyen hipoglisemik veya hiperglisemik reaksiyonlar, bilinç kaybı, koma veya ölüme sebebiyet verebilir. İnsülin gereksinimleri hastalık sırasında veya duygu durumu rahatsızlıklarında değişebilir. Kalemin KullanımıSoloStar®'ı kullanmadan önce, Kullanma Talimatındaki kalemin kullanımı dikkatlice okunmalıdır. SoloStar®, kalemin kullanımı bölümünde tavsiye edildiği gibi kullanılmalıdır (Bkz. Bölüm 6.6). 4.5. Diğer tıbbi ürünler ile etkileşim ve diğer etkileşim şekilleri Farmakokinetik çalışmalarda etkileşimlere bakılmamıştır. Benzer ilaç ürünlerine ait ampirik bilgilere dayanarak, klinik olarak anlamlı farmakokinetik etkileşimlerin oluşması olası değildir. Bir dizi madde glukoz metabolizmasını etkiler ve insülin glulisin dozunun ayarlanmasını ve özellikle de yakından izlemeyi gerektirebilir. Kan şekerini düşürücü etkiyi yükseltebilecek ve hipoglisemi duyarlılığını artırabilecek maddeler; oral antidiyabetikler, anjiotensin dönüştürücü enzim (ADE) inhibitörleri, disopiramid, fibratlar, fluoksetin, monoamin oksidaz inhibitörleri (MAOİ), pentoksifilin, propoksifen, salisilatlar veya sülfonamid antibiyotikleri. Kan-şekerini düşürücü etkiyi azaltabilecek maddeler; kortikosteroidler, danazol, diazoksid, diüretikler, glukagon, isoniazid, fenotiazin türevleri, somatropin, sempatomimetik ajanlar (örn. epinefrin [adrenalin], salbutamol, terbutalin), tiroid hormonları, östrojenler, projestinler (örn. oral kontraseptifler), proteaz inhibitörleri ve atipik antipsikotik ilaçlar (örn. olanzapin ve klozapin) Beta-blokörler, klonidin, lityum tuzları veya alkol insülinin kan şekerini düşürücü etkisini kuvvetlendirebilir veya zayıflatabilir. Pentamidin hipoglisemiye yol açabilir ve bazen bunu hiperglisemi izleyebilir. Bunun yanı sıra, beta-blokörler, klonidin, guanetidin ve rezerpin gibi sempatolitik ilaçların etkisiyle, adrenerjik karşı-düzenleme belirtileri azalabilir veya kaybolabilir. 4.6. Gebelik ve laktasyon Genel tavsiye Gebelik kategorisi C'dir. Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) Hayvan çalışmaları, gebelik embriyo/fetüs gelişimi, doğum veya postnatal gelişim açısından APİDRA® ile insan insülini arasında herhangi bir farklılık ortaya koymamıştır (Bkz. Bölüm 5.3). Gebe kadınlara verilirken tedbirli olunmalıdır. Glukoz kontrolünün dikkatle izlenmesi şarttır. Gebelik dönemi Gebe kadınlarda insülin glulisin kullanımına ilişkin yeterli klinik veri bulunmamaktadır. Önceden var olan veya gestasyonal diyabeti olan hastalarda tüm gebelik süresince iyi metabolik kontrolün sağlanması önemlidir. İnsülin ihtiyacı ilk trimesterde azalır, ancak genellikle ikinci ve üçüncü trimesterde artar. Doğumdan hemen sonra, insülin gereksinimi hızla düşer. Laktasyon dönemi İnsülin glulisinin insan sütüyle atılıp atılmadığı bilinmemektedir. Ancak genel olarak insülin anne sütüne geçmemektedir ve oral uygulamadan sonra emilimi olmamaktadır. Emziren kadınlarda insülin dozu ve diyette ayarlamalar yapılması gerekebilir. 4.7. Araç ve makine kullanımı üzerindeki etkiler Hipoglisemi, hiperglisemi veya örn. görme bozukluğunun bir sonucu olarak hastanın konsantre olma ve tepki verme yeteneği etkilenebilir. Bu durum, bu yeteneklerin özellikle önemli olduğu (örn. araç veya makine kullanma gibi) durumlarda bir risk oluşturabilir. Hastalara araba kullanırken, hipoglisemiden kaçınmak için önlemler almaları tavsiye edilmelidir. Bu durum, hipogliseminin uyarıcı semptomlarını fark etme yeteneği azalmış veya kaybolmuş ya da sık hipoglisemi epizotları yaşayan kişilerde özellikle önemlidir. Bu koşullarda araç veya makine kullanmanın tavsiye edilebilir olup olmadığı düşünülmelidir. 4.8. İstenmeyen etkiler İnsülin tedavisinin en sık görülen ve istenmeyen etkisi olan hipoglisemi, verilen insülin dozunun gereksinimden yüksek olması halinde meydana gelebilir. Klinik araştırmalardan, ilgili advers reaksiyonlar sistem organ sınıfına ve azalan sıklığa göre aşağıda sıralanmıştır: (Sıklıklar; çok yaygın: >1/10; yaygın: >1/100 - <1/10; yaygın olmayan: >1/1.000 - <1/100; seyrek: >1/10.000 - <1/1.000; çok seyrek: <1/10.000 - bilinmeyen) (Elde edilebilir verilerden hesaplanamaz). Her bir sıklık grubunda, istenmeyen etkiler azalan ciddiliğe göre sunulmaktadır. Metabolizma ve beslenme bozuklukları Çok yaygın: Hipoglisemi semptomları genellikle ani olarak ortaya çıkar. Soğuk terleme, beniz solgunluğu, halsizlik, sinirlilik veya titreme, anksiyete, alışılmamış yorgunluk veya zayıflık, konfüzyon, konsantrasyon bozukluğu, uyuşukluk, aşırı açlık, görme değişikliği, baş ağrısı, mide bulantısı ve çarpıntı. Hipoglisemi ciddi boyuta gelebilir ve bilinç kaybı ve/veya konvülsiyona neden olabilir ve beyin fonksiyonlarında geçici veya kalıcı hasara yol açabilir, hatta ölümle sonuçlanabilir. Deri ve subkutan doku bozuklukları Yaygın: enjeksiyon yeri reaksiyonları ve lokal hipersensitivite reaksiyonları. Lokal hipersensitivite reaksiyonları (enjeksiyon yerinde kızarıklık, şişkinlik ve kaşıntı) insülinle tedavi sırasında oluşabilir. Bu reaksiyonlar genellikle geçicidir ve normal olarak tedavinin devamında ortadan kalkar. Seyrek: Lipodistrofi Lipdistrofi belli bir alanda, enjeksiyon yerinin değiştirilmediği durumlarda meydana gelebilir. Genel bozukluklar Yaygın olmayan: Sistemik hipersensitivite reaksiyonları. Sistemik hipersensitivite reaksiyonları, ürtiker, göğüs sıkışması, dispne, alerjik dermatit ve kaşıntıdır. Anaflaktik reaksiyonlar içeren şiddetli alerjik durumlar hayatı tehdit edici olabilir. Yaralanma, zehirlenme ve prosedürel komplikasyonlar Bilinmiyor: İnsulin glulisin yerine özellikle uzun etkili insülin olmak üzere diğer insülinlerin yanlışlıkla uygulanması gibi ilaç kullanım yanlışlıkları bildirilmiştir. 4.9. Doz aşımı ve tedavisi Hipoglisemi, gıda alınımı ve enerji tüketimine oranla fazla insülin etkinliğinin bir sonucu olarak meydana gelebilir. İnsülin glulisin doz aşımına ait spesifik veri mevcut değildir. Ancak takip eden aşamalar sonrasında hipoglisemi gelişebilir: Hafif dereceli hipoglisemi epizodları genellikle glukoz ve şekerli ürünlerin oral olarak uygulanması ile tedavi edilebilir. Bu nedenle diyabet hastalarının yanlarında şeker, tatlı besin, bisküvi veya şekerli meyve suyu bulundurmaları tavsiye edilir. Hastanın bilinç kaybına neden olan ciddi hipoglisemi epizodları eğitimli bir kişi tarafından intramüsküler veya subkutan olarak verilen glukagon (0.5 - 1 mg) ile veya bir sağlık mesleği mensubu tarafından intravenöz olarak verilen glukoz ile de tedavi edilir. Eğer hasta glukagona 10-15 dakika içinde tepki vermez ise intravenöz olarak glukoz da uygulanmalıdır. Bilincin geri gelmesinden sonra, nüksü engellemek için oral karbonhidrat uygulaması tavsiye edilmektedir. Glukagon enjeksiyonundan sonra, hastanın ciddi hipoglisemi nedenlerini tespit etmek ve benzer epizodları engelleyebilmek için, hasta bir hastanede gözetim altına alınmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER 5.1. Farmakodinamik özellikler Farmakoterapötik grubu: hızlı etkili insülin ve analogları. ATC kodu: A10AB06 İnsülin glulisin, regüler insan insülini ile eşit etki gücüne sahip bir rekombinant insan insülini analogudur. İnsülinler ve insülin glulisin gibi insülin analoglarının birincil etkinliği, glukoz metabolizmasının düzenlenmesidir. İnsülinler özellikle iskelet kası ve yağ dokusu tarafından periferik glukoz alınımını uyararak ve hepatik glukoz üretimini inhibe ederek kan glukoz düzeylerini düşürür. İnsülin adipositte lipolizi inhibe eder, proteolizi inhibe eder ve protein sentezini arttırır. Sağlıklı gönüllülerde ve diyabet hastalarında yapılan araştırmalar, subkutan uygulandığında insülin glulisinin regüler insan insülinine kıyasla etkisinin daha hızlı başladığını ve etki süresinin daha kısa olduğunu kanıtlamıştır. İnsülin glulisin subkutan olarak enjekte edildiğinde, glukozu düşürücü etkinliği 10-20 dakika içinde başlayacaktır. İntravenöz yoldan uygulandıklarında, insülin glulisin ve regüler insan insülinin glukozu düşürücü etkinliği eşit güçtedir. Bir ünite insülin glulisin bir ünite regüler insan insülini ile aynı glukoz düşürücü etkiye sahiptir. Doz orantılılığı 21-50 yaşlarındaki tip 1 diyabetes mellituslu 18 erkek gönüllü ile yapılan çalışmada, insülin 0.075-0.15 U/kg olan terapötik uygun doz aralığında doza orantılı glukoz düşürücü etki göstermiştir. Kan glukozu düşürücü etkisi, insan insülini gibi 0.3 U/kg veya daha yüksek dozlarda orantısal artıştan daha az olmuştur. İnsülin glulisin regüler insan insülininden yaklaşık iki kez daha hızlı etki eder ve regüler insan insülininden yaklaşık 2 saat önce glukoz düşürücü etkiyi tamamlar. Tip 1 diabetes mellitusu olan hastalarda yapılan bir faz I araştırmada, 15 dakikalık standart bir öğünle ilişkili olarak farklı saatlerde, 0.15 U/kg dozunda subkutan olarak uygulanan insülin glulisin ve regüler insan insülininin glukozu düşürme profilleri değerlendirilmiştir. Elde edilen veriler, öğünden 2 dakika önce uygulanan insülin glulisinin, öğünden 30 dakika önce uygulanan regüler insan insülini ile benzer postprandiyal glisemik kontrol verdiğini işaret etmektedir. İnsülin glulisin öğünden 2 dakika önce uygulandığında, yemeklerden 2 dakika önce verilen regüler insan insülininden daha iyi postprandial glisemik kontrol sağlamıştır. Öğüne başlandıktan 15 dakika sonra uygulanan insülin glulisin, öğünden 2 dakika önce uygulanan regüler insan insülini ile benzer postprandial glisemik kontrol sağlamaktadır. (Bkz. Şekil 1) 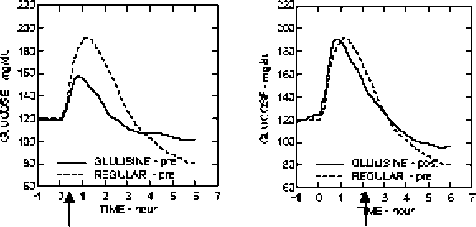 Fi^e IB
Fi^e IBFicine IC Şekil 1: Tip 1 diyabetli 20 hastada 6 saatten daha uzun süre ortalama glukoz düşürücü etki. Öğüne başlamadan 2 dakika önce verilen insülin glulisin (GLULISINE pre) ile öğüne başlamadan 30 dakika önce verilen insan insülini (REGULAR 30 dak) kıyaslaması (Şekil 1A) ve bir öğüne başlamadan 2 dakika önce verilen regüler insan insülini (REGULAR pre) ile kıyaslaması (şekil 1B) de gösterilmektedir. Öğüne başladıktan 15 dakika sonra verilen insülin glulisin ile (GLULISINE post) bir öğüne başlamadan 2 dakika önce verilen regüler insan insülini (REGULAR pre) ise şekil 1C'de gösterilmektedir. X-ekseninde ok ile belirtilen sıfır noktası 15 dakikalık öğünün başlangıcıdır. 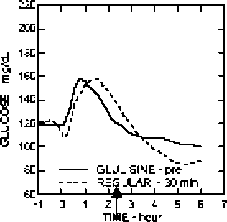 Figııne 1 A
Figııne 1 AObeziteİnsülin glulisin, lispro ve regüler insan insüliniyle obez bir popülasyonda yapılan, bir Faz I çalışması, insülin glulisinin hızlı-etki özelliğini devam ettirdiğini göstermiştir. Bu çalışmada erken glukoz düşürücü etkiyi temsil eden toplam eğri altındaki alanın (AUC) % 20'sine ulaşana kadara geçen zaman ve eğri altında kalan alan [AUC (0-2 st)] insülin glulisin için sırasıyla 114 dakika ve 427 mg/kg-1; lispro için 121 dakika ve 345 mg.kg-1; regüler insan insülini için ise 150 dakika ve 197 mg.kg-1 olarak bulunmuştur (bakınız Şekil 2).  Şekil 2: Obez popülasyona subkutan olarak 0.3 U/kg dozda insülin glulisin (GLULISINE) veya insülin lispro (LISPRO) veya regüler insan insülini (REGULAR) uygulandıktan sonraki glukoz infüzyon oranları
Şekil 2: Obez popülasyona subkutan olarak 0.3 U/kg dozda insülin glulisin (GLULISINE) veya insülin lispro (LISPRO) veya regüler insan insülini (REGULAR) uygulandıktan sonraki glukoz infüzyon oranlarıİnsülin glulisin ve insülin lispro ile diyabetli olmayan ve vücut kitle indeksleri geniş bir aralığa dağılmış olan (18-46 kg/m2) 80 gönüllüde yapılan diğer bir Faz I çalışmasında, glukozu düşürücü toplam etkinin obezite arttıkça azalırken böylesine geniş bir vücut kitle indeksi aralığında dahi genel olarak hızlı etkinin devam ettirildiği gösterilmiştir. 0.2 ve 0.4 U/kg insülin glulisin için 0-1 saat arası toplam glukoz infüzyon oranı eğri altındaki alan değerleri (AUC) sırasıyla 102±75 mg/kg ve 158±100 mg/kg olarak bulunmuştur. Bu değerler, 0.2 ve 0.4 U/kg insülin lispro için ise sırasıyla 83.1±72.8 mg/kg ve 112.3±70.8 mg/kg olarak saptanmıştır. Tip 2 diabetes mellitusu olan 18 obez hastada (VKİ 35 ile 40 kg/m2 arasında) insülin glulisin ve insülin lispro ile yapılan bir Faz I çalışmasında [% 90 lık güvenirlik aralığı: 0.81, 0.95 (p=<0.01)] insülin glulisinin gün içindeki öğün-sonrası kan glukozu iniş çıkışlarını etkin şekilde kontrol altına aldığı gösterilmiştir. Klinik çalışmalarTip 1 diabetes mellitus - ErişkinlerBazal insülin olarak insülin glarjin kullanan tip 1 diabetes mellitus hastalarında her ikisi de bir öğünden kısa süre önce (0-15 dakika) subkutan olarak enjekte edilen insülin glulisin ile insülin lisproyu karşılaştıran 26 haftalık bir faz III klinik çalışmada, insülin glulisin, glikozillenmiş hemoglobinde (HbA1c eşdeğeri olarak ifade edilen) başlangıç ile sonlanım noktası arasındaki değişikliklerle yansıtılan glisemik kontrol açısından insülin lispro ile benzer bulunmuştur. Kendi kan glukozunu izleme değerlerinin benzer olduğu gözlenmiştir. İnsülin lispronun tersine, insülin glulisin ile bazal insülin dozunda hiçbir artış gerekmemiştir. Bazal tedavi olarak insülin glarjin almakta olan tip 1 diabetes mellitus hastalarında gerçekleştirilen 12 haftalık bir faz III klinik çalışma, öğünden hemen sonra uygulanan insülin glulisinin öğünden hemen önce (0-15 dakika) uygulanan insülin glulisin ya da regüler insüline (30-45 dakika) benzer etkinlik sağladığını göstermektedir. Her bir protokol popülasyonunda, öğün öncesi glulisin grubunda regüler insülin grubuna kıyasla GHb'de anlamlı ölçüde daha büyük azalma gözlenmiştir. Tip 1 diabetes mellitus - Pediyatrik26 haftalık bir faz III klinik çalışmada, bazal insülin olarak insülin glarjin veya NPH kullanan tip 1 diabetes mellitus olan çocuklar (4-5 yaş: n=9; 6-7 yaş: n=32 ve 8-11 yaş : n=149) ve adolesanlarda (12-17 yaş: n=382) her ikisi de bir öğünden kısa süre önce (0-15 dakika) subkutan olarak enjekte edilen insülin glulisin ile insülin lispro karşılaştırılmıştır. İnsülin glulisin, kendi kan glukozunu izleme değerleri ile ve glikozillenmiş hemoglobinde (HbA1c eşdeğeri olarak ifade edilen GHb) başlangıç ile sonlanım noktası arasındaki değişikliklerle yansıtılan glisemik kontrol açısından insülin lispro ile benzer bulunmuştur. 6 yaşından küçük çocuklarda APİDRA® kullanımıyla ilişkili klinik bilgiler yetersizdir. Tip 2 diabetes mellitus - ErişkinlerBazal insülin olarak NPH insülin de kullanan tip 2 diabetes mellitus hastalarında subkutan olarak enjekte edilen insülin glulisin (öğünden 0-15 dakika önce) ile regüler insan insülinini (öğünden 30-45 dakika önce) karşılaştırmak amacıyla, 26 haftalık bir faz III klinik çalışma ve ardından 26 haftalık bir uzatma güvenlilik çalışması yürütülmüştür. Hastaların ortalama vücut kitle indeksi (VKİ) 34.55 kg/m olarak bulunmuştur. İnsülin glulisinin, glikozillenmiş hemoglobinde (HbA1c eşdeğeri olarak ifade edilen) başlangıç ile 6 aylık sonlanım noktası arasındaki değişiklikler (insülin glulisin için -%0.46 ve regüler insan insülini için -%0.30, p=0.0029) ve başlangıç ile 12 aylık sonlanım noktası arasındaki değişiklikler (insülin glulisin için -%0.23 ve regüler insan insülini için -%0.13, fark anlamlı değil) açısından regüler insan insülini ile benzer olduğu gösterilmiştir. Bu çalışmada, hastaların çoğunluğu (%79) enjeksiyondan hemen önce kısa etkili insülinlerini NPH insülin ile karıştırmış ve hastaların %58'i randomizasyon sırasında oral hipoglisemik ajanlar kullanmış ve bunları aynı dozda kullanmaya devam etmeleri öğütlenmiştir. Irk ve cinsiyetErişkinlerde yapılan kontrollü klinik çalışmalarda, ırk ve cinsiyete dayalı alt grup analizlerinde insülin glulisin etkililik ve güvenlilik açısından herhangi bir farklılık göstermemiştir. 5.2. Farmakokinetik Özellikler Genel özellikler İnsülin glulisinde, pozisyon B3'de insan insülin amino asidi asparajinin yerini lizinin alması ve B29 pozisyonundaki lizinin yerini glutamik asidin alması daha hızlı emilime olanak sağlamaktadır. Emilim ve biyoyararlanım: Sağlıklı gönüllülerde ve diyabet hastalarındaki (tip 1 veya 2) farmakokinetik profiller, insülin glulisinin emiliminin regüler insan insülinine kıyasla yaklaşık iki kat daha hızlı ve doruk konsantrasyonunun yaklaşık iki kat daha yüksek olduğunu kanıtlamıştır. Tip 1 diyabeti olan hastalarda yapılan bir araştırmada, 0.15 U/kg dozun subkutan olarak uygulanmasından sonra, insülin glulisine için Tmax 55 dakika ve Cmax 82+ 1.3 mikroU/ml olarak ve regüler insan insülini için Tmax 82 dakika ve Cmax 46 + 1.3 mikroU/ml olarak bulunmuştur. İnsülin glulisinin ortalama kalış süresinin (98 dakika) regüler insan insülinine (161 dakika) kıyasla daha kısa olduğu saptanmıştır (Bakınız Şekil 3). İnsülin Konsantrasyonu mikroU/mL 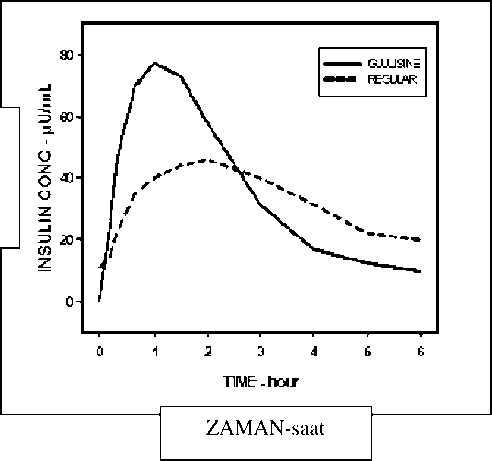 Şekil 3: 0.15 U/kg dozda insülin glulisin ve regüler insan insülin uygulandıktan sonra Tip 1 diabetes mellitus'lu hastalardaki farmakokinetik profili.
Şekil 3: 0.15 U/kg dozda insülin glulisin ve regüler insan insülin uygulandıktan sonra Tip 1 diabetes mellitus'lu hastalardaki farmakokinetik profili.Tip 2 diabetes mellituslu hastalarda yapılan bir çalışmada 0.2 U/kg dozda insülin glulisinin subkutan uygulanmasından sonra, C max değeri 91 ^U/ml olarak bulunmuştur, çeyrek değerler aralığı ise 78-104 ^U/ml arasında değişmiştir. İnsülin glulisin karın, deltoid veya uyluk bölgesine subkutan olarak enjekte edildiğinde, konsantrasyon-zaman profilleri benzer bulunmuş; karına uygulandığında emilimin uyluk bölgesine uygulamaya kıyasla biraz daha hızlı olduğu saptanmıştır. Deltoid bölgesinden emilim ikisinin arasındadır (Bkz. Bölüm 4.2). İnsülin glulisinin mutlak biyoyararlanımı (%70) ve düşük bireyler arası değişkenliği (%11 CV) enjeksiyon bölgeleri arasında benzerdir. Obezite Vücut kitle indeksleri geniş bir aralığa dağılmış (18-46 kg/m2) diyabetli olmayan 80 gönüllüden oluşan bir popülasyonda insülin glulisin ve insülin lispro ile yapılan başka bir Faz I çalışmasında bu geniş aralıktaki vücut kitle indekslerinde de genellikle hızlı emilim ve toplam maruziyetin devam ettirildiği gösterilmiştir. İnsülin glulisin, toplam insülin maruziyetinin % 10'una ulaşmak için geçen süreye yaklaşık 5-6 dakika daha erken ulaşmıştır. Dağılım ve eliminasyon: İntravenöz uygulamadan sonra insülin glulisin ve regüler insan insülininin dağılım ve eliminasyonu benzer olup, dağılım hacimleri sırasıyla 13 L ve 22 L ve yarılanma ömürleri sırasıyla 13 dakika ve 18 dakikadır. Subkutan uygulamadan sonra, 86 dakikaya kıyasla 42 dakika gibi görünürdeki yarılanma ömrü değerleri ile, insülin glulisin regüler insan insülinine kıyasla daha hızlı eliminasyon göstermektedir. Sağlıklı gönüllülerde veya Tip 1 ya da Tip 2 diabetes mellituslu gönüllülerde insülin glulisin ile yapılan bir çapraz çalışma analizinde, görünür yarılanma ömrü 37 dakika ile 75 dakika (çeyrek değerler aralığı) arasında değişmiştir. İnsülin glulisin tıpkı insan insülini gibi plazma proteinlerine düşük oranda bağlanmaktadır. Doğrusallık/Doğrusal olmayan durum: Yaşları 21 ile 50 arasında değişen, Tip 1 diabetes mellituslu 18 erkek gönüllüde yapılan bir çalışmada insülin glulisin, 0.075 U/kg ile 0.4 U/kg arasındaki doz aralığında, erken, maksimum ve toplam maruz kalma açısından doz-orantılılığı göstermiştir. Hastalardaki karakteristik özellikler: Böbrek Yetmezliği:Geniş bir böbrek fonksiyonu aralığını (Kreatinin klerensi >80 ml/dakika, 30-50 ml/dakika, <30 ml/dakika) kapsayan, diyabetik olmayan bireylerde yapılan bir klinik araştırmada, insülin glulisinin hızlı etkiyen özellikleri genel olarak korunmuştur. Ancak böbrek yetmezliğinde insülin ihtiyacı azalabilir. Karaciğer Yetmezliği:Karaciğer yetmezliği olan hastalarda farmakokinetik özellikleri incelenmemiştir. Geriyatrik Popülasyon:Diabetes mellituslu yaşlı hastalarda farmakokinetiği ile ilgili çok kısıtlı veri bulunmaktadır. Çocuklar ve adolesanlar: İnsülin glulisinin farmakokinetik ve farmakodinamik özellikleri, tip 1 diyabeti olan çocuklarda (7-11 yaş) ve adolesanlarda (12-16 yaş) araştırılmıştır. Her iki yaş grubunda insülin glulisin, erişkinlerinkine benzer Cmax ve Tmax ile hızla emilmiştir (Bkz. Bölüm 4.2). Test öğününden hemen önce uygulanan insülin glulisin regüler insan insülinine kıyasla, erişkinlerde olduğu gibi daha iyi glisemik kontrol sağlamıştır (Bkz. Bölüm 5.2). Glukoz iniş çıkışları (0-6 st arası eğri altındaki alan: AUC 0-6 st) insülin glulisin için 641 mg.st.dl-1, regüler insülin için 801mg.sa.dl-1 olarak bulunmuştur. 5.3. Klinik öncesi güvenlilik verileri Klinik öncesi veriler, kan glukozunu düşürücü farmakodinamik etkinlikle (hipoglisemi) bağlantılı bulguların dışında, regüler insan insülininden farklı ya da insanlar için klinik anlam taşıyan herhangi bir toksisite bulgusu ortaya koymamıştır. 6. FARMASÖTİK ÖZELLİKLER 6.1. Yardımcı maddelerin listesi Metakrezol Sodyum klorür Trometamol Polisorbat 20 Sodyum hidroksit Konsantre HCl Enjeksiyonluk su 6.2. Geçimsizlikler İnsülin glulisin ile geçimlilik çalışmaları olmadığından, NPH insan insülini hariç, diğer ilaçlarla karıştırılmamalıdır. 6.3. Raf ömrü 2 yıl Kalemin ilk kullanımdan sonraki raf ömrüÜrün doğrudan ısı veya ışığa maruz bırakılmadan ve 25 °C'nin altındaki oda sıcaklığında maksimum 4 hafta süreyle saklanabilir. Kullanılmakta olan kalemler buzdolabında saklanmamalıdır. Işıktan korumak için her enjeksiyondan sonra kalemin kapağı yerine takılmalıdır. 6.4. Saklamaya yönelik özel tedbirler Kullanılmayan kalemler:Buzdolabında, 2 oC - 8 oC'de saklayınız. Dondurmayınız. APİDRA®'yı buzdolabında dondurucu bölme veya soğutma paketine yakın koymayınız. Işıktan korumak için karton kutusunun içinde saklayınız. Kullanılmakta olan kalemler:Saklanması ile ilgili önlemler için, bkz. bölüm 6.3. 6.5. Ambalajın niteliği ve içeriği Bir kartuş (renksiz cam) içinde 3 ml çözelti, bir piston (elastomerik kauçuk) ve bir tıpalı kapak (alüminyum) ile conta (elastomerik kauçuk). Kartuş kullanıldıktan sonra atılan enjeksiyon kalemi içine monte edilmiştir. 5 kalem içeren ambalajları mevcuttur. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler İlk kullanımdan önce, kalemin 1-2 saat süreyle oda ısısında tutulmalıdır. Kullanmadan önce kartuşu görsel olarak inceleyiniz. Yalnızca çözelti berrak, renksiz ise ve gözle görülebilen katı partiküller içermiyorsa kullanılmalıdır. APİDRA® bir çözeltidir, bu nedenle kullanmadan önce tekrar süspansiyon haline getirilmesi gerekmemektedir. Boş kalemler asla kullanılmamalıdır ve uygun bir şekilde atılmalıdır. Herhangi bir kontaminasyonu önlemek için, her bir kullanıma hazır enjeksiyon kalemi yalnız bir hasta tarafından kullanılmalıdır. İnsülin glulisin ve diğer insülinler arasındaki ilaç kullanım yanlışlığını önlemek için insülin etiketi her enjeksiyon öncesi kontrol edilmelidir. Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. Kalemin Kullanımı SoloStar® kullanılmaya başlanmadan önce, Kullanma Talimatındaki kalemin kullanımı dikkatlice okunmalıdır. Kalem kapağıKalem İğnesi (dahil değil)Koruyucudisk
İğne dış kapağıİğneKalem gövdesiDozpenceresi^ o jj . u . İnsülin haznesiKauçuk disk
lıiinlııııı Dozaj Enjeksiyon düğmesiEnjeksiyon kaleminin şematik çizimi SoloStar®'ın kullanımı için önemli bilgiler Her kullanımdan önce her zaman yeni bir iğne dikkatlice takılmalı ve güvenlilik testi uygulanmalıdır. Sadece SoloStar® enjeksiyon kalemiyle uyumlu iğne kullanınız. İğne ile kazayla oluşacak yaralanmalardan ve enfeksiyon bulaşmasından kaçınmak için gereken önlemler alınmalıdır. Eğer SoloStar® enjeksiyon kalemi zarar gördüyse veya düzgün bir şekilde çalıştığından emin değilseniz, kalemi kesinlikle kullanmayınız.® Kullandığınız SoloStar® enjeksiyon kaleminin kaybolma veya bozulma ihtimaline karşı, her zaman yedek bir SoloStar® kalem bulundurunuz. Saklanması SoloStar® enjeksiyon kaleminin saklanması ile ilgili talimatlar için, Bölüm 6.4'e bakınız. SoloStar® enjeksiyon kalemi soğukta saklandıysa, enjeksiyonu yapmadan 1-2 saat önce kaleminizi normal oda ısısına gelmesi için serin yerden çıkarınız. Soğuk insülin enjekte edildiğinde daha fazla acı verir. Kullanılmış SoloStar® enjeksiyon kalemi Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. Bakımı SoloStar® enjeksiyon kalemi kirden ve tozdan korunmalıdır. SoloStar® enjeksiyon kaleminizin dışı nemli bir bezle silerek temizlenebilir. Kaleminizi suya sokmayınız, yıkamayınız, yağlamayınız. Bu işlemler kaleminize zarar verebilir. SoloStar® enjeksiyon kalemi doğru ve güvenli çalışmak üzere tasarlanmıştır. Özenli kullanınız, kaleminizin zarar görebileceği durumlardan sakınınız. Kaleminizin hasar gördüğünden şüpheleniyorsanız, yeni bir SoloStar® enjeksiyon kalemi kullanınız. 1. Adım İnsülini kontrol ediniz Doğru insülin olduğundan emin olmak için, kalem üzerindeki etiketi kontrol ediniz. APİDRA® SoloStar® mavi renklidir. Enjeksiyon düğmesi koyu mavi renktedir ve tepesinde bir halka bulunur. Kalemin kapağını çıkardıktan sonra, insülinin görünüşünün de kontrol edilmesi gerekir. İnsülin çözeltisinin berrak ve renksiz olması, içinde görünür katı tanecik bulunmaması ve su gibi homojen olması gerekir. 2. Adım İğneyi takınız® Sadece SoloStar® enjeksiyon kalemiyle uyumlu iğnelerin kullanılması gerekir. Her zaman her enjeksiyon için yeni bir steril iğne kullanılmalıdır. Kapak çıkarıldıktan sonra, iğnenin dikkatlice ve dik bir şekilde tutularak kaleme takılması gerekir. 3. Adım Güvenlik testini yapınız Her enjeksiyondan önce güvenlik testinin yapılması gerekir. 2 ünite doz seçiniz. İğnenin dış ve iç kapaklarının çıkarılmalıdır. İğne yukarıya doğru gelecek şekilde kalemi tutarken, parmakla insülin haznesine vurularak, hava kabarcıklarının iğneye doğru toplanması sağlanmalıdır. Bundan sonra enjeksiyon düğmesine sonuna kadar basılmalıdır. Eğer iğnenin ucundan insülin çıktıysa, kalem ve iğne doğru şekilde çalışmaktadır. Eğer iğnenin ucundan hiç insülin çıkmadıysa, 3. adımda belirtilenleri iğnenin ucundan insülin çıkana kadar tekrarlanmalıdır. 4. Adım Dozu seçiniz Doz ayarlaması 1 ünitelik artışlar halinde yapılabilir. En az 1 ünite, en fazla 80 üniteye kadar doz seçilebilir. Eğer 80 üniteden daha fazla doza ihtiyaç varsa, iki veya daha fazla sayıda enjeksiyon ile verilmelidir. Güvenlik testini yaptıktan sonra, doz penceresi 0 göstermelidir. Daha sonra doz seçilmelidir. 5. Adım İnsülin dozunun enjekte edilmesi Hastaya bir sağlık mesleği mensubu tarafından enjeksiyon tekniği öğretilmelidir. İğne deriye batırılmalıdır. Enjeksiyon düğmesine sonuna kadar basılmalıdır. İğne deri altından çıkarılmadan önce 10 saniye süreyle enjeksiyon düğmesi basılı tutulmalıdır. Böylece dozun tam olarak verildiği garanti altına alınmış olur. 6. Adım İğnenin çıkarılması ve atılması Her zaman her enjeksiyondan sonra iğne çıkarılmalı ve uygun şekilde atılmalıdır. Bu şekilde bulaşma ve/veya enfeksiyon gelişmesi, insülin haznesine hava girmesi veya insülin kaçağı oluşması engellenmiş olur. İğneler tekrar kullanılmamalıdır. İğneyi çıkarırken ve atarken dikkatli olunmalıdır. İğne ile yaralanma veya enfeksiyon hastalığı bulaşması riskini azaltmak için, iğnelerin çıkarılması ve atılmasıyla ilgili (örneğin tek elle kapağın kapatılması tekniği gibi) tavsiye edilen güvenlilik önlemlerine uyunuz. Kalemin ucuna kendi kapağı takılmalıdır. İnsülinlerin karıştırılmasıNPH insan insüliniyle karıştırılacağı zaman şırınga içine önce APİDRA®'nın çekilmesi gerekir. Karıştırma yapıldıktan hemen sonra enjeksiyon gerçekleştirilmelidir; çünkü enjeksiyondan ne kadar zaman önce karışımların hazırlanması gerektiği hakkında hiç bir veri bulunmamaktadır. 7. RUHSAT SAHİBİ Sanofi aventis İlaçları Ltd. Şti. No:193 Levent - İstanbul Tel: 212 339 10 00 Faks: 212 339 10 89 8. RUHSAT NUMARASI 120/66 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ: İlk ruhsat tarihi: 14.08.2006 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriApidra 100 U/mL Solostar SC Kullanım İçin Enjeksiyonluk ÇözeltiEtken Maddesi: İnsülin Glulisin Atc Kodu: A10AB06 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.