PRILIGY 30 mg film kaplı tablet Kısa Ürün BilgisiÜrogenital Sistem ve Cinsiyet Hormonları » Ürolojik İlaçlar » DİĞER ÜROLOJİK ÜRÜNLER » Diğer ürolojik » Dapoksetin KISA URUN BILGISI1. BEŞERI TIBBI ÜRÜNÜN ADIPRILIGY 30 mg film kaplı tablet2. KALITATIF VE KANTİTATIF BILEŞIMEtkin madde: 30 mg dapoksetin (hidroklorür tuzu olarak)Yardımcı madde : Laktoz monohidrat: 43,875 mg Yardımcı maddeler için bölüm 6.1'e bakınız. 3. FARMASÖTIK FORMFilm kaplı tablet.Bir yüzünde üçgen içinde ''30'' rakamı basılı, açık gri renkli, konveks ve yuvarlak tabletler. 4.KLINIK ÖZELLIKLER4.1. Terapötik endikasyonlarPRILIGY, aşağıdakilerin hepsinin bulunduğu 18 ile 64 yaş arası erkeklerdeki prematür ejakülasyonun (PE) tedavisinde endikedir. Minimal cinsel uyarı ile penetrasyon öncesinde, penetrasyon anında ya da penetrasyondan kısa bir süre sonra olan ve hastanın arzuladığı süreden önce gerçekleşen persistan veya rekürren ejakülasyon; ve PE'nin bir sonucu olarak belirgin kişisel sıkıntı (stres) ya da kişiler arası ilişkilerde zorluk; ve Ejakülasyonun kontrolünün zayıf olması. 4.2. Pozoloji ve uygulama şekli Pozoloji: Erişkin erkekler (18-64 yaş)Önerilen doz 30 mg'dır ve gerektiğinde ilişkiden yaklaşık 1 ile 3 saat öncesinde alınır. 30 mg ile etki yetersizse ve yan etkiler kabul edilebilir düzeydeyse, doz maksimum önerilen doz olan 60 mg'a yükseltilebilir. Uygulama sıklığı ve süresi: Önerilen maksimum uygulama sıklığı günde bir kezdir. Prematür ejakülasyon tedavisi için PRILIGY'i seçen hekim, hastadaki risk-yarar dengesini ve tedavinin daha sonraki seyrini belirlemek amacıyla tedavinin ilk dört haftasında veya 6 doz sonrasında hasta tarafından bildirilen yararları ve riskleri değerlendirmelidir. Uygulama şekli: Oral yoldan kullanım içindir. Tabletler bütün olarak yutulmalıdır. Tabletlerin, tam olarak dolu en az bir bardak suyla alınması önerilir. PRILIGY yemeklerle birlikte ya da yemek harici alınabilir (bkz. Bölüm 5.2). Özel popülasyonlara ilişkin ek bilgiler: Böbrek yetmezliği: Hafif ya da orta derecede böbrek yetmezliği olan hastalarda doz ayarlamasına gerek yoktur ancak dikkatli olunması önerilir. Ağır böbrek yetmezliği olan hastalarda PRILIGY kullanımı önerilmez (bkz. Bölüm 5.2). Karaciğer yetmezliği: Hafif ya da orta derecede karaciğer yetmezliği olan hastalarda doz ayarlamasına gerek yoktur; ancak orta derecede karaciğer yetmezliği olan hastalarda dikkatli olunması önerilir. Ağır karaciğer yetmezliği (Child-Pugh Kategori C) olan hastalarda PRILIGY kullanımı önerilmez (bkz. Bölüm 5.2). Pediyatrik popülasyon: PRILIGY 18 yaş altı bireylerde kullanılmamalıdır. Geriyatrik popülasyon: Bu popülasyondaki veriler kısıtlı olduğundan, PRILIGY'nin 65 yaş ve üzerindeki hastalardaki güvenilirliği ve etkinliği gösterilmemiştir (bkz. Bölüm 5.2). 4.3. Kontrendikasyonlar PRILIGY, dapoksetin hidroklorüre ya da ilacın bileşimindeki yardımcı maddelerden herhangi birine aşırı duyarlılığı olan hastalarda kontrendikedir. PRILIGY'nin, monoamin oksidaz (MAO) inhibitörleri ile birlikte ya da MAO inhibitörü bir ilaçla tedavinin kesilmesinden sonraki 14 gün içinde kullanımı kontrendikedir. Aynı şekilde, PRILIGY uygulanmasından sonraki 7 gün içinde bir MAO inhibitörü uygulanmamalıdır (bkz. Bölüm 4.5). PRILIGY, tioridazin ile birlikte ya da tioridazin ile tedavinin kesilmesinden sonraki 14 gün içinde kullanımı kontrendikedir. Aynı şekilde, PRILIGY uygulanmasından sonraki 7 gün içinde tioridazin uygulanmamalıdır (bkz. Bölüm 4.5). PRILIGY'nin serotonin gerialım inhibitörleri [selektif serotonin gerialım inhibitörleri (SSRI'lar), serotonin-norepinefrin gerialım inhibitörleri (SNRI'lar), trisiklik antidepresanlar (TCA'lar)] veya serotonerjik etkili diğer tıbbi/bitkisel ürünlerle [örn., L-triptofan, triptanlar, tramadol, linezolid, lityum, sarı kantaron (St. John's Wort-Hypericum perforatum) birlikte kullanımı ya da bu tıbbi/bitkisel ürünlerin kesilmesinden sonraki 14 gün içinde kullanılması kontrendikedir. Aynı şekilde, PRILIGY uygulanmasından sonraki 7 gün içinde bu tıbbi/bitkisel ürünler uygulanmamalıdır (bkz. Bölüm 4.5). 4.4. Özel kullanım uyarıları ve önlemleri Uyarılar ve önlemler: İntihar/intihar düşünceleri:Majör depresif bozukluğu ve diğer psikiyatrik bozuklukları olan çocuk ve adolesanlarda yapılan kısa süreli çalışmalarda SSRI'lar dahil antidepresanlar plaseboyla karşılaştırıldığında, intiharla ilgili düşünce ve intihar riskini arttırdığı bildirilmiştir. Yirmi dört yaşından büyüklerde gerçekleştirilen kısa süreli çalışmalarda ise, antidepresanlar plaseboyla karşılaştırıldığında intiharla ilgili düşünce ve intihar riskinde bir artışa neden olmamıştır. Prematür ejakülasyonun tedavisi için PRILIGY kullanılan klinik çalışmalarda tedaviye bağlı bir intihar girişimine işaret eden kesin bir belirti görülmemiştir. Genel:PRILIGY yalnızca prematür ejekülasyonu olan erkeklerde endikedir. Prematür ejekülasyonu olmayan erkeklerde güvenilirliği gösterilmemiş olup, bu bireylerde ejakülasyonu geciktirici etkileri hakkında bir veri bulunmamaktadır. Hastalara, birlikte kullanım halinde etkileri bilinmediği ve ciddi advers olaylara yol açabileceğinden dolayı PRILIGY'i, keyif verici (uyuşturucu/uyarıcı) ilaçlarla birlikte kullanmamaları öğütlenmelidir. Senkop:PRILIGY'nin klinik geliştirme programlarında, çalışmalara katılan popülasyona bağlı olarak değişen sıklıkta bilinç kaybı ile karakterize senkop bildirilmiştir; senkop sıklığı, Faz 3 plasebo kontrollü klinik çalışmalarda % 0.06 (30 mg) ile % 0.23 (60 mg) arasında değişirken, prematür ejakülasyonu olmayan sağlıklı gönüllülerde yapılan Faz 1 çalışmalarda % 0.64 olarak bildirilmiştir. Klinik çalışmalarda gözlenen, bilinç kaybı ile karakterize senkop vakaları, etiolojik olarak vazovagal olarak değerlendirilmiş ve vakaların büyük çoğunluğu dozun uygulanmasından sonraki ilk 3 saatte, ilk dozdan sonra ya da klinikte çalışmayla ilişkili işlemler sırasında (kan alınması, ortostatik manevra uygulanması ve kan basıncının ölçümü gibi) oluşmuştur. Genel olarak dozun alınmasını izleyen ilk 3 saatte ve sıklıkla senkoptan önce bulantı, baş dönmesi, sersemlik hissi, çarpıntı, asteni, konfüzyon ve terleme gibi olası prodromal semptomlar görülmüştür. Hastalar, PRILIGY tedavisinin herhangi bir aşamasında prodromal semptomlarla birlikte veya prodromal semptomlar görülmeksizin senkop atağı geçirebilecekleri konusunda uyarılmalıdır. İlacı reçeteleyen hekimler, hastalarında bilinç kaybına bağlı düşmeler nedeniyle gelişebilecek ciddi hasar olasılığını azaltmak amacıyla, hastalarına tedavi sırasında uygun hidrasyon sağlanmasının önemi ve prodromal bulgu ve semptomları nasıl tanıyabilecekleri konusunda danışmanlık vermelidir. Hasta olası prodromal semptomları tecrübe ederlerse, hemen yere yatırılarak başının vücudunun diğer bölgelerinden aşağıda kalması sağlanmalı ya da başını dizlerinin arasında tutacak şekilde oturtularak semptomlar düzelene kadar bu durumda bekletilmelidir. İlacı kullananlar senkop ya da diğer merkezi sinir sistemi etkilerinin görülmesi durumunda, aralarında araç kullanma veya tehlikeli makine kullanma gibi hasarla sonuçlanabilecek durumlardan kaçınmaları konusunda uyarılmalıdır (bkz. Bölüm 4.7). Faz 3 çalışmalara kardiyovasküler hastalığı olanlar dahil edilmemiştir. Senkoptan kaynaklanan kardiyovasküler advers sonuçların riski (kardiyak senkop ve diğer nedenlere bağlı senkop), altta yatan yapısal kardiyovasküler hastalığı olan hastalarda (örn., kalbin çıkışında dokümante edilmiş bir obstrüksiyon, kalp kapak hastalığı, karotis stenozu ve koroner arter hastalığı) artmıştır. Bu artmış riskin altta yatan kardiyovasküler hastalığı olan hastalarda vazovagal senkopa neden olup olmayacağını belirlemek için mevcut veriler yetersizdir. Ortostatik hipotansiyon:Klinik çalışmalarda ortostatik hipotansiyon raporlanmıştır. İlacı reçeteleyen doktor, hastalarında, ayağa kalktıktan hemen sonra sersemlik hissi gibi olası prodromal semptomları tecrübe ederlerse, hemen yere uzanarak başlarını vücudunun diğer bölgelerinden aşağıda tutmalarını ya da başlarını dizlerinin arasında tutacak şekilde oturarak, semptomlar düzelene kadar bu durumda beklemelerini öğütlemelidir. Hekim hastasını, uzun süre yatar ya da oturur pozisyonda kaldıysa, aniden ayağa kalkmaması konusunda da bilgilendirmelidir. Buna ek olarak PRILIGY ortostatik toleransta olası bir azalmaya yol açacağından, vazodilatasyona neden olan ilaçları (alfa adrenerjik reseptör antagonistleri, nitratlar, PDE5 inhibitörleri gibi) kullanan hastalarda dikkatle reçete edilmelidir (bkz. Bölüm 4.5). Mani:PRILIGY mani/hipomani ya da bipolar bozukluk hikayesi olan hastalarda kullanılmamalı ve bu bozukluklara ait semptomların geliştiği hastalarda kullanılıyorsa kesilmelidir. Konvülziyon:SSRI'ların konvülsiyon eşiğini düşürme potansiyeli nedeniyle, PRILIGY kullanımı sırasında konvülziyon görülen herhangi bir hastada ilacın kullanımı kesilmeli ve unstabil epilepsisi olan hastalarda PRILIGY kullanımından kaçınılmalıdır. Epilepsisi kontrol altındaki hastalar yakından izlenmelidir. 18 yaş altı çocuk ve adolesanlarda kullanım:PRILIGY 18 yaş altı bireylerde kullanılmamalıdır. Komorbid depresyon ve psikiyatrik bozukluklar:PRILIGY şizofreni gibi psikiyatrik bir hastalığı olan ya da komorbid depresyonu olan erkeklerde, depresyon ile ilişkili semptomlarda kötüleşme halinde, bu durumun altta yatan psikiyatrik hastalığın mı, uygulanan ilaç tedavisinin mi bir sonucu olduğu ayırt edilemeyeceği için kullanılmamalıdır. Hekimler hastalarını, herhangi bir zaman gelişebilecek ve kendilerini sıkıntıya sokan düşünce ya da hislerini bildirmeleri konusunda teşvik etmelidir. Hemoraj:SSRI'ların kullanımı ile kanama anormallikleri bildirilmiştir. Kanama ya da pıhtılaşma bozukluğu hikayesi olan hastalarda ve özellikle trombosit fonksiyonlarını etkileyen ilaçlarla (örn., atipik antipsikotikler ve fenotiyazinler, asetil salisilik asit, nonsteroidal antiinflamatuvar ilaçlar [NSAİ ilaçlar], anti-trombosit ajanlar) veya antikoagülanlar ile (örn. varfarin) PRILIGY'nin birlikte kullanımında dikkatli olunması tavsiye edilir (bkz Bölüm 4.5). Böbrek yetmezliği:Ağır böbrek yetmezliği olan hastalarda PRILIGY kullanımı önerilmez; hafif ya da orta şiddette böbrek yetmezliği olan hastalarda ise dikkatli kullanılmalıdır (bkz Bölüm 4.2 ve 5.2). Karaciğer yetmezliği:Ağır karaciğer yetmezliği olan hastalarda PRILIGY kullanımı önerilmez; orta şiddette karaciğer yetmezliği olan hastalarda dikkatli kullanılmalıdır (bkz. Bölüm 4.2 ve 5.2). Yoksunluk etkileri :Kronik depresyonun tedavisi için uzun süreli SSRI kullanımının ani olarak kesilmesinin şu semptomlara neden olduğu bildirilmiştir: disforik mizaç, irritabilite, ajitasyon, baş dönmesi, duyusal bozukluklar (örn., elektrik çarpması hissi tarzında paresteziler), anksiyete, konfüzyon, baş ağrısı, letarji, emosyonel labilite, insomnia ve hipomani. Buna rağmen prematür ejakulasyonu olanlarda 62 gün süreyle 60 mg PRILIGY'nin günlük ya da gerektiğinde kullanımı şeklinde tasarlanmış bir çift kör klinik çalışmada günlük doz uygulanan gruptan plasebo uygulanan gruba geçen hastalarda geri çekilme sendromu ya hiç görülmemiş ya da hafif-orta dereceli uykusuzluk ve baş dönmesi gibi hafif çekilme belirtileri bildirilmiştir (bkz. Bölüm 5.1). Yirmidört hafta boyunca gerektikçe günlük 30 ve 60 mg'lık dozların kullanıldığı tedavi döneminden sonra çekilme belirtilerinin değerlendirildiği 1 haftalık dönemin olduğu ikinci bir çift kör klinik çalışmada da paralel sonuçlar elde edilmiştir. Etanol :Hastalar PRILIGY ile birlikte alkol kullandıklarında alkolle ilişkili etkilerde olası bir artış konusunda uyarılmalıdır. PRILIGY kullanıyorken, alkol alımının günde 2 içecekten fazla olmaması önerilir (bkz Bölüm 4.5 ve 4.7). Laktoz intoleransı :Nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glikoz galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri Monoamin oksidaz inhibitörleriyle etkileşim potansiyeli :SSRI ilaçları, monoamin oksidaz (MAO) inhibitörleri ile birlikte kullanan hastalarda aralarında hipertermi, rijidite, myoklonus, vital bulgularda olası hızlı oynamalar ile seyreden otonom instabilite ile deliryum ve komaya ilerleyebilen ileri ajitasyonu da içeren mental durum değişikliklerinin de bulunduğu ciddi, bazen fatal olabilen reaksiyonlar rapor edilmiştir. Bu reaksiyonların, SSRI bir ilacı bıraktıktan kısa bir süre sonra MAO inhibitörleri kullanmaya başlayan hastalarda da görülebildiği bildirilmiştir. Bazı vakalar nöroleptik malign sendroma benzeyen özelliklerle kendisini göstermiştir. SSRI ilaçlarla MAO inhibitörlerinin bir arada kullanımını inceleyen hayvan verileri, bu ilaçların kan basıncının yükseltilmesi ve davranışsal eksitasyonunun uyarılması açısından sinerjik etkili olabileceğini öngörmektedir. Bu nedenle PRILIGY, MAO inhibitörleriyle birlikte ya da bir MAO inhibitörü ilacın bırakılmasından sonraki 14 gün içinde kullanılmamalıdır. Aynı şekilde, PRILIGY uygulanmasından sonraki 7 gün içinde bir MAO inhibitörü uygulanmamalıdır (bkz Bölüm 4.3). Tioridazin ile etkileşim potansiyeli :Tioridazin monoterapisi, ciddi ventriküler aritmilerle ilişkili QTc intervalinde uzamaya neden olur. PRILIGY gibi CYP2D6 izoenzimini inhibe eden tıbbi ürünler, tioridazinin metabolizmasını inhibe ederek tioridazinin plazma düzeylerinin yükselmesine neden oluyormuş gibi durmaktadır. Bu nedenle, QTc intervalinde uzama etkisini arttırmaları beklenir. PRILIGY, tioridazin ile birlikte ya da tioridazinin bırakılmasından sonraki 14 gün içinde kullanılmamalıdır. Aynı şekilde, PRILIGY uygulanmasından sonraki 7 gün içinde tioridazin uygulanmamalıdır (bkz Bölüm 4.3). Merkezi sinir sistemi üzerinde etkili tıbbi ürünler:PRILIGY'nin prematür ejakülasyonu olan hastalarda merkezi sinir sistemi üzerinde etkili tıbbi ürünlerle birlikte kullanımı sistematik olarak değerlendirilmemiştir. Bu nedenle, PRILIGY'nin bu tür bir tıbbi ürünle kullanımı gerektiğinde dikkatli olunması önerilir. Serotonerjik etkili tıbbi /bitkisel ürünler:Diğer SSRI ilaçlar gibi PRILIGY de, serotonerjik etkileri olan tıbbi/bitkisel ürünlerle [MAO inhibitörleri, L-triptofan, triptanlar, tramadol, linezolid, SSRI ilaçlar, SNRI ilaçlar, lityum ve sarı kantaron (St.John's Wort, Hypericum perforatum)] ile birlikte kullanıldığında serotoninle ilişkili etkilere neden olabilir. PRILIGY, diğer SSRI ilaçlar, MAO inhibitörleri ya da diğer serotonerjik etkileri olan tıbbi/bitkisel ürünlerle birlikte veya bu tıbbi/bitkisel ürünlerin kesilmesinden sonraki 14 gün içinde kullanılmamalıdır. Aynı şekilde PRILIGY uygulanmasından sonraki 7 gün içinde bu tıbbi/bitkisel ürünler uygulanmamalıdır (bkz. Bölüm 4.3). Birlikte uygulanan tıbbi ürünlerin dapoksetin hidroklorüre etkileri:İnsanlarda karaciğer, böbrekler ve barsak mikrozomlarında yapılan in vitroçalışmalar dapoksetinin primer olarak CYP2D6, CYP3A4 ve flavin mono-oksijenaz 1 (FMO1) enzimleri tarafından metabolize edildiğini göstermektedir. Bu nedenle, bu enzimlerin inhibitörleri dapoksetinin klirensini azaltabilir.Güçlü CYP2D6 inhibitörleri:Fluoksetinin (7 gün süreyle 60 mg/gün) kullanımı dapoksetinin (tek doz 60 mg) Cmax değerini % 50 ve AUCinf değerini % 88 arttırmıştır. Bu nedenle PRILIGY'nin güçlü CYP2D6 inhibitörleri ile birlikte uygulanması, dapoksetinin kan konsantrasyonunu yükseltebilir. Bu durumun klinik açıdan anlamlı etkileşimlere neden olması beklenmez. Güçlü CYP3A4 inhibitörleri:Ketokonazol (7 gün süreyle günde iki defa 200 mg) kullanımı dapoksetinin (tek doz 60 mg) Cmax değerini % 35 ve AUCif değerini % 99 arttırmıştır. Bu nedenle PRILIGY'nin güçlü CYP3A4 inhibitörleri ile birlikte uygulanması, dapoksetinin kan konsantrasyonunu yükseltebilir. Bu durumun klinik açıdan anlamlı etkileşimlere neden olması beklenmez. PDE5 inhibitörleri:Dapoksetinin (60 mg) farmakokinetiği, tadalafil (20 mg) ve sildenafil (100 mg) ile kombine kullanıldığı tek doz çapraz bir çalışmada değerlendirilmiştir. Tadalafil, dapoksetinin farmakokinetiğini etkilememiştir. Sildenafil ise dapoksetinin farmakokinetiğinde, klinik açıdan anlamlı etkileşimlere neden olması beklenmeyecek ölçüde hafif değişikliklere yol açmıştır (AUCinf değerlerinde % 22 ve Cmax değerlerinde % 4 artış). Buna rağmen PRILIGY ortostatik toleransta olası bir azalma nedeniyle, PDE5 inhibitörü kullanan hastalara dikkatle reçete edilmelidir (bkz. Bölüm 4.4). Dapoksetin hidroklorürün birlikte uygulanan tıbbi ürünlere olan etkileriTamsulosin:Günlük dozlarda tamsulosin alanlarda, tek ya da multipl dozlarda 30 mg veya 60 mg dapoksetin alınması, tamsulosinin farmakokinetiğinde değişikliğe neden olmaz. PRILIGY'nin tamsulosin alan hastaların tedavisine eklenmesi ortostatik profilde bir değişikliğe yol açmamış ve tamsulosinin tek başına kullanılmasıyla, 30 ya da 60 mg dozunda PRILIGY ile kombine kullanımı arasında ortostatik etkiler açısından bir fark görülmemiştir; ancak ortostatik toleransta olası bir azalma nedeniyle alfa adrenerjik reseptör antagonisti almakta olan hastalara PRILIGY dikkatli reçetelenmelidir (bkz. Bölüm 4.4). CYP2D6 tarafından metabolize edilen tıbbi ürünler :PRILIGY'nin multipl dozları (6 gün süreyle 60 mg/gün) sonrasında tek doz 50 mg desipramin kullanımı, desipramin monoterapisine göre, desipraminin ortalama Cmax değerini % 11 ve AUCinf değerini % 19 oranında arttırmıştır. Dapoksetin CYP2D6 tarafından metabolize edilen ilaçların plazma konsantrasyonlarında benzer bir artışa yol açabilir. Bu durumun klinikle ilişkisi düşük olasılıktadır. CYP3A4 tarafından metabolize edilen tıbbi ürünler :PRILIGY'nin multipl dozları (6 gün süreyle 60 mg/gün), midazolamın (tek doz 8 mg) AUCinf değerini yaklaşık % 20 oranında (-%60 ile +%18 arasında) azaltmıştır. Bu durumun klinikle ilişkisi düşük olasılıktadır. CYP2C19 tarafından metabolize edilen tıbbi ürünler:PRILIGY'nin multipl dozları (6 gün süreyle 60 mg/gün) sonrasında tek dozda 40 mg omeprazol kullanımı, omeprazolün farmakokinetiğini etkilememiştir. Dapoksetinin diğer CYP2C19 substratlarının farmakokinetiğini etkilemesi olası değildir. CYP2C9 tarafından metabolize edilen tıbbi ürünler:PRILIGY'nin multipl dozları (6 gün süreyle 60 mg/gün) sonrasında tek doz 5 mg gliburid kullanımı, gliburidin farmakokinetiğini ya da farmakodinamisini etkilememiştir. Dapoksetinin, diğer CYP2C9 substratlarının farmakokinetiğini etkilemesi olası değildir. PDE5 inhibitörleri :Tek doz çapraz bir çalışmada dapoksetin (60 mg) tadalafil (20 mg) ya da sildenafilin (100 mg) farmakokinetiğini etkilememiştir. Varfarin:Varfarinin kronik kullanımı ile PRILIGY'nin birlikte kullanımını değerlendiren veri bulunmamaktadır; bu nedenle kronik varfarin kullanan hastalarda PRILIGY kullanımında dikkat edilmesi gerekir (bkz Bölüm 4.4). Yapılan bir farmakokinetik çalışmada dapoksetin (6 gün süreyle 60 mg/gün) tek dozda 25 mg kullanılan varfarinin farmakokinetiğini ve farmakodinamiğini (PT veya INR) etkilememiştir. Etanol:Tek doz olarak 0.5 g/kg (yaklaşık iki içecek) etanol kullanımı, dapoksetinin (tek doz 60 mg) farmakokinetiğini etkilememiştir; ancak etanolle birlikte alınan PRILIGY somnolansı arttırmış ve hastaların kendilerinin değerlendirdiği uyanıklık durumunu önemli derecelerde azaltmıştır. PRILIGY etanolle birlikte uygulandığında, kognitif bozukluğu değerlendiren farmakodinamik ölçümlerde de (Parmak Uyanıklık Hızı, Sayı Sembol Yer Değiştirme Testi) aditif bir etki görülmüştür. Dapoksetin kullanımı etanolün farmakokinetiğini etkilememiştir. Alkol ile PRILIGY bir arada alındıklarında baş dönmesi, sersemlik hali, reflekslerde yavaşlama ya da karar vermeyle ilgili değişiklikler gibi advers etkilerin görülme olasılığı ya da şiddetleri artar. Hastalar PRILIGY ile birlikte alkol kullandıklarında, alkolle ilişkili etkilerde olası bir artış konusunda uyarılmalıdır. Özel popülasyonlara ilişkin ek bilgiler PRILIGY ile yalnızca erişkin popülasyonda etkileşim çalışması yapılmıştır. Pediyatrik popülasyon : PRILIGY ile pediyatrik popülasyonda etkileşim çalışması yapılmamıştır. 4.6. Gebelik ve laktasyon Genel tavsiye PRILIGY'nin kadınlarda kullanım endikasyonu bulunmamaktadır. Gebelik kategorisi: B Dapoksetin için, gebeliklerde maruz kalmaya ilişkin klinik veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik / embriyonal / fetal gelişim / doğum ya da doğum sonrası gelişim ile ilgili olarak doğrudan ya da dolaylı zararlı etkiler olduğunu göstermemektedir (bkz Bölüm 5.3). Klinik deneme veritabanındaki sınırlı sayıdaki gözlemsel veriye dayanarak, Dapoksetin maruziyetinin hamile kadınlar üzerinde etkisi olduğunu iddia etmek için kanıt yoktur. Dapoksetinin hamile kadınlar üzerinde çalışılmış yeterli ve tamamen kontrollü çalışması bulunmamaktadır. Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (kontrasepsiyon) Bu konuda ilişkin klinik veri mevcut değildir. Gebelik dönemi Klinik çalışmalarda ilacın kullanıldığı hastaların eşlerinde gözlenen kısıtlı sayıdaki gebeliklerden elde edilen veriler, PRILIGY kullanımının gebelik ya da fetus / yeni doğan bebeğin sağlığı üzerinde herhangi bir advers etkiye işaret etmemektedir. Laktasyon dönemi Dapoksetin ya da metabolitlerinin insan sütüyle salgılanıp salgılanmadıkları bilinmemektedir. Üreme yeteneği / Fertilite Hayvanlarda yapılan çalışmalarda üreme yeteneği, fertilite ya da üreme organları üzerinde bir etki görülmemiş ve embriyotoksisite ya da fetotoksisiteye işaret eden herhangi bir advers işarete rastlanmamıştır. 4.7. Araç ve makine kullanımı üzerindeki etkiler Klinik çalışmalarda dapoksetin kullananlarda sersemlik hali, dikkatte bozulma, senkop, görmede bulanıklık ve somnolans bildirilmiştir. Bu nedenle hastalar, aralarında araç ve kullanımı tehlikeli makinelerin de bulunduğu senkop ya da diğer merkezi sinir sistemiyle ilgili etkiler oluştuğunda hasar oluşturabilecek durumlardan kaçınmaları konusunda uyarılmalıdır. Alkolün PRILIGY ile birlikte alınması durumunda etkileri artabildiğinden hastalar alkolle birlikte PRILIGY kullanıyorlarsa araç ve makina kullanım yeteneklerinin azalabileceği konusunda uyarılmalıdır. 4.8. istenmeyen etkiler Klinik çalışma verileri : PRILIGY'nin güvenilirliği, çift kör, plasebo kontrollü beş çalışmada prematür ejakülasyonu olan 4224 hastada araştırılmıştır. Çalışmalara katılan 4224 deneğin 1616'sına 30 mg dozunda PRILIGY gerektikçe ve 2608'sına 60 mg dozunda PRILIGY gerektikçe veya günde tek doz olarak uygulanmıştır. Klinik çalışmalarda bilinç kaybı ile karakterize senkop bildirilmiş ve ilaçla ilgili olarak değerlendirilmiştir. Bu vakaların büyük çoğunluğu dozun uygulanmasından sonraki ilk 3 saatte, ilk dozdan sonra ya da klinikte çalışmayla ilişkili işlemler sırasında (kan alınması, ortostatik manevra uygulanması ve kan basıncının ölçümü gibi) oluşmuştur. Senkop öncesi sıklıkla prodromal semptomlar görülmüştür (bkz Bölüm 4.4). Klinik çalışmalarda ortostatik hipotansiyon bildirilmiştir (bkz. bölüm 4.4). Klinik çalışmalar sırasında en sık rapor edilen advers ilaç reaksiyonları (> %5) baş ağrısı, baş dönmesi, bulantı, diyare, insomnia ve halsizlikti. İlacın kesilmesine neden olan advers olaylardan en sık görülenleri bulantı (P RILIGY ile tedavi alanların % 2.2'sinde) ve baş dönmesi (PRILIGY ile tedavi alanların % 1.2'sinde) idi.Klinik çalışmalarda PRILIGY tedavisi uygulananların >%1'inde bildirilen advers ilaç reaksiyonları aşağıda listelenmiştir. Sıklıklar şu şekilde tanımlanmıştır: Çok yaygın (>1/10); yaygın (>1/100 ile <1/10); yaygın olmayan (>1/1000 ile <1/100); seyrek (>1/10000 ile <1/1000); çok seyrek (<1/10000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Psikiyatrik hastalıkları Yaygın : İnsomnia (uykunun ortasındaki ve başlangıcındaki insomnia da dahil), anksiyete, sinirlilik (ajitasyon ve huzursuzluk da dahil), libido azalması (libido kaybı da dahil), depresyon (depresif mizaç da dahil), apati (umursamazlık hali de dahil), anormal rüya (kabus da dahil) Yaygın olmayan: Öforik mizaç, mizaç değişikliği, konfüzyonel durum, uyku bozukluğu, diş gıcırdatma, dezoryantasyon, hipervijilans, anormal düşünce Sinir sistemi hastalıkları Çok yaygın: Baş dönmesi (postural ve egzersize bağlı baş dönmesi de dahil), baş ağrısı Yaygın: Uykuya meyil (hipersomnia ve ani uyku bastırması da dahil), tremor, dikkat bozukluğu, parestezi Yaygın olmayan: Bilinç baskılanması (sedasyon da dahil), tat bozukluğu, letarji, senkop (vazovagal senkop da dahil), akatizi Göz hastalıkları Yaygın: Görmede bulanıklık (görsel rahatsızlıklar da dahil) Yaygın olmayan: Midriyazis Kulak ve iç kulak hastalıkları Yaygın: Çınlama Yaygın olmayan: Vertigo Kardiyak hastalıkları Yaygın olmayan: Taşikardi (kalp hızında artış da dahil), sinüs bradikardisi, sinüs arresti Vasküler hastalıkları Yaygın : Kan basıncı artışı (diastolik kan basıncında artış ve ortostatik kan basıncında artış da dahil), yüzde kızarma Yaygın olmayan : Hipotansiyon, sistolik hipertansiyon Solunum, göğüs bozuklukları ve mediastinal hastalıkları Yaygın : Sinüs konjesyonu, esneme Gastrointestinal hastalıkları Çok yaygın : Bulantı Yaygın : Diyare (acil defekasyon ihtiyacı da dahil), karın ağrısı (üst karında ağrı, midede rahatsızlık hissi, karında rahatsızlık hissi ve epigastrik rahatsızlık hissi de dahil), ağız kuruluğu, kusma, dispepsi, flatulans, kabızlık, karında distansiyon Deri ve deri altı doku hastalıkları Yaygın : Hiperhidrozis Yaygın olmayan : Kaşıntı, soğuk terleme Üreme sistemi ve meme hastalıkları Yaygın : Erektil disfonksiyon Yaygın olmayan:Ejakülasyonun gerçekleşmemesi, erkek orgazm bozukluğu (psikiyatrik hastalıkları bölümünden üreme sistemi ve meme hastalıklarına alınan anorgazmi de dahil), erkek genital organ parestezisi Genel bozukluklar ve uygulama bölgesine ilişkin hastalıkları Yaygın : Halsizlik, irritabilite Yaygın olmayan : Asteni, anormal hissetme, sıcak hissetme, gergin hissetme, içkili hissetme 4.9. Doz aşımı ve tedavisi Klinik çalışmalarda doz aşımı vakası bildirilmemiştir. PRILIGY ile gerçekleştirilen bir klinik farmakoloji çalışmasında 240 mg'a kadar olan günlük dozlarda (3 saat arayla verilen iki 120 mg'lık doz) beklenmeyen bir advers olaya rastlanmamıştır. Genel olarak, SSRI ilaçlarla olan doz aşımı belirtileri somnolans, bulantı-kusma gibi gastrointestinal bozukluklar, taşikardi, tremor, ajitasyon ve baş dönmesi gibi serotonin tarafından oluşturulan advers reaksiyonlardan ibarettir. Doz aşımı durumunda, gerektiği ölçüde standart destekleyici önlemler alınmalı ve uygulanmalıdır. Dapoksetin hidroklorürün proteinlere yüksek oranda bağlanma özelliği ve büyük bir dağılım hacmi olması nedeniyle, doz aşımı durumunda zorlu diürez, diyaliz, hemoperfüzyon ve kan değişimi gibi yöntemlerin faydalı olması olası değildir. PRILIGY'nin bilinen spesifik bir antidotu bulunmamaktadır. 5. FARMAKOLOJİK ÖZELLİKLER 5.1. Farmakodinamik özellikler Farmakoterapötik grup: Diğer Ürolojikler ATC kodu: G04BX14 Etki mekanizmasıDapoksetinin prematür ejakülasyondaki etkisinin nöronlardaki serotonin geri alımının inhibisyonu ardından nörotransmitterin presinaptik ve postsinaptik reseptörlerde etkisinin potensiyalize olması yoluyla olduğuna inanılmaktadır. İnsanlarda ejakülasyon esas olarak sempatik sinir sistemince yönetilmektedir. Ejakülasyon yolağı, başlangıç olarak beyindeki bir dizi nükleusun (medial preoptik ve paraventriküler nükleuslar) etkisi altındaki beyin sapı tarafından yönetilen ve bir spinal refleks merkezinden orijin alır. Sıçanlarda dapoksetin ejakülatuar dışarı fırlatma refleksini, bu etki için gerekli beyin yapısı olan supraspinal seviyedeki lateral paragigantoselüler nükleus (LPGi) üzerinde etki ederek inhibe eder. Seminal vezikülleri, vas deferensi, prostatı, bulboüretral kasları ve mesane boynunu innerve eden postgangliyonik sempatik lifler, bu yapıların koordineli bir şekilde kasılmasını sağlayarak ejakülasyonun oluşmasını sağlar. Dapoksetin sıçanlarda bu ejakülatuar refleksi modüle ederek pudental motor nöron refleks deşarj (PMRD) latensinde uzama ve PMRD süresinde bir azalmaya neden olur. Klinik çalışmalarPRILIGY'nin prematür ejakülasyonun tedavisindeki etkinliği toplam 6081 deneğin randomize edildiği çift kör, plasebo kontrollü beş klinik çalışmayla gösterilmiştir. Çalışmaya dahil edilenler 18 yaş ve üzerindeydi, çalışmaya alınmadan önceki 6 aylık dönemdeki cinsel ilişki deneyimlerinin çoğunda bir prematür ejakülasyon hikayesi bulunuyordu. Ek olarak beş çalışmadan dördünde çalışma başlangıcı döneminde cinsel birleşme deneyimlerinin en az % 75'inde intravajinal ejakülasyon gecikme (latens) süresi (IELT; vajinal penetrasyondan intravajinal ejakülasyona kadar geçen süre) 2 dakika veya daha kısaydı. Erektil disfonksiyon dahil diğer cinsel bozuklukların olduğu bireyler ya da prematür ejakülasyon nedeniyle diğer farmakoterapi formlarını kullananlar çalışmalara dahil edilmemiştir. Beş çalışmanın dördünde primer sonlanma noktası olan ortalama IELT, her bir cinsel birleşme epizodunda saat durdurma yöntemiyle ölçülmüştür. Tüm randomize çalışmaların sonuçları birbiriyle uyumlu olarak bulunmuştur. Örnek olarak en uzun tedavi süresinin (24 hafta) olduğu çalışmada, 385'i plasebo, 388'i gerektiğinde 30 mg PRILIGY alacak şekilde ve 389'u gerektiğinde 60 mg PRILIGY alacak şekilde toplam 1162 kişi randomize edilmiştir. Şekil 1'de tüm tedavi gruplarında çalışma başlangıcında ve sonundaki ortalama IELT'leri görülmektedir. Yirmidördüncü haftadaki sonlanma noktasında, ortalama IELT'deki artışlar, her iki PRILIGY grubunda da plaseboya göre istatistiksel olarak anlamlı derecede farklıydı (p<0.001). IELT'de uzamanın boyutu başlangıçtaki IELT ile ilişkili ve bireyler arasında değişkendi. PRILIGY tedavisinin klinikle ilişkisi aşağıda hastalar tarafından bildirilen yanıt oranlarıyla açıklanmaktadır. Zamana göre ortalama (+/- SE) lELT (dk) - Çalışma R096769-PRE-3001 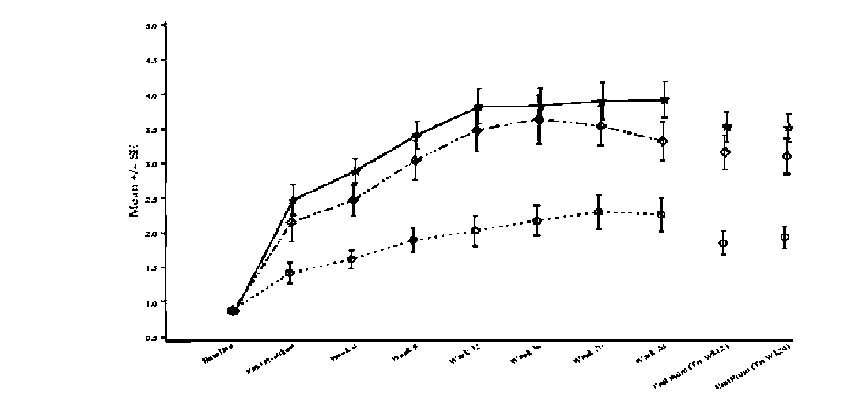
Tedavi grubu: o PLASEBO ? DPX 30 mg gerektiğinde ? DPX 60 mg gerektiğinde Sonlanma noktası (Tedavinin 12'inci haftası) = ileriye doğru taşınan 12'inci hafta sonlanma noktası (Tedavinin 24'üncü haftası) = 24'üncü haftaya LPOCFLPOCF ileriye doğru taşınan en sonuncu başlangıç sonrası gözlemdir.
Şekil 1: Her iki PRILIGY grubunda yer alanların, plaseboya oranla istatistiksel olarak anlamlı derecede daha fazlasında, 4'üncü haftadan başlayarak 24. haftaya kadar (24. hafta dahil) daha iyi yanıt alınmıştır (Çalışmanın 16. haftasında dapoksetin 30 mg grubuyla plasebo grubu için p = 0.003, diğer tüm karşılaştırmalar için p <0.001). Bireylerdeki sıkıntıda (streste) anlamlı bir azalma ve hastaların cinsel birleşmeden memnuniyetinde anlamlı bir artış da gözlenmiştir. Kilit ikincil sonlanma noktaları olan 12. ve 24. haftalardaki düzelmeler Tablo 1'de gösterilmektedir. Tablo 1: Kilit ikincil sonlanma kriterlerinde düzelme görülen hastaların yüzdesi Çalışma R096769-PRE-3001
Kilit ikincil sonlanma noktası (LPOCF*)
Plasebo
PRILIGY 30 mg %
PRILIGY 60 mg %
%
Tedavi Yanıt Bileşkesi (kontrolde 2 ya da daha fazla artış, sıkıntıda (streste) 1 ya da daha fazla azalma) Hafta 12 Hafta 24
(n=346)
(n=359)
(n=353)
27.3* 25.3*
34.0* 37.1*
12.1 13.0
Sıkıntıda (streste) 1 ya da daha fazla azalma Hafta 12 Hafta 24
(n=347) 46.1 47.8
(n=360) 63.1* 60.0*
(n=353) 65.4* 68.6*
Memnuniyette 1 ya da daha fazla artış Hafta 12 Hafta 24
(n=347) 31.7 35.7
(n=360) 51.3* 48.5*
(n=353) 56.1* 55.8* * PRILIGY'nin plaseboyla karşılaştırmasında p değeri <0.001. LPOCF ileriye doğru taşınan en sonuncu başlangıç sonrası gözlemdir. Klinik çalışmalarda, aralarında hastaların kendi durumlarını değerlendirmesi için sıklıkla kullanılan durumdaki değişikliğin klinik genel izlenimi (CGIC)'in de bulunduğu, diğer ikincil hasta tarafından bildirilen sonuçlara ait ikincil sonlanma noktaları da (PRO) değerlendirilmiştir. Hastalardan çalışmanın başlangıcından itibaren prematür ejakülasyonlarını, daha fazla iyileşmeden daha fazla kötüleşmeye değişen aralıkta karşılaştırmaları istenmiştir. CGIC için sonlanma noktalarında plaseboya göre anlamlılık derecesinde nominal anlamlılık 0.05 düzeyinde olacak şekilde (2-yönlü) istatistiksel olarak önemli düzelme görülmüştür. Tablo 2'de yukarıdaki çalışmanın sonunda elde edilen CGIC sonuçları tedavi grubuna göre verilmektedir. Tablo 2: Çalışma Sonlanma Noktasında (LPOCF*) Durumdaki Değişikliğin Klinik Genel İzleniminin Sonuçları Çalışma R096769-PRE-3001
Prematür ejakülasyonun tedavisi için kronik günlük kullanımda ve gerektiğinde kullanılan PRILIGY 60 mg'ın geri çekilme etkileri, 1238 deneğin randomize edildiği plasebo kontrollü, çift kör ve paralel gruplu bir çalışmayla değerlendirilmiştir. Plasebo ya da 60 mg PRILIGY tedavisini 62 gün boyunca ya günde bir defada ya da gerektiğinde almaya müteakip hastalar, 7 günlük bir dönem daha geri çekilmeyle ilgili değerlendirmeler için izlenmiştir. Tedavinin aniden kesilmesine bağlı geri çekilme etkileri, serotonin geri alım inhibitör tedavisine son verilmesiyle ilişkili semptom ve bulguların klinisyen tarafından puanlandığı bir araç olan İlacı Bırakmayla Ortaya Çıkan Bulgu ve Semptomlar (Discontinuation Emergent Signs and Symptoms; DESS) kullanılarak değerlendirilmiştir. Her hasta için, çalışmanın 63. gününden 70. gününe kadar olan haftalık DESS skorunda en az 4 puanlık bir artış olması ilacı bırakmayla ilişkili sendrom olarak tanımlanmıştır. Bu çalışmada, PRILIGY tedavisinin aniden kesilmesiyle, ilacın kesilme (geri çekilme) sendromu ile ilişkisine dair kesin bir kanıt bulunamamıştır. DESS skorlarına dayanan ilacı kesme sendromunun oluşmamasıyla uyumlu olacak şekilde, advers olaylarla ilgili veriler de geri çekilmeyle ilgili düşük korelasyon sergilemiştir. İlacın gerektiğinde 30 ve 60 mg dozlarında kullanıldığı 24 haftalık ilaçlı dönemi takiben geri çekilmenin değerlendirildiği 1 haftalık ilaçsız bir dönemden oluşan ikinci bir çift kör klinik çalışmada da benzer sonuçlar görülmüştür. 5.2. Farmakokinetik özellikler Genel özellikler Dapoksetin oral uygulama sonrası hızla emilir, hemen tümüyle plazma proteinlerine bağlı olarak hızlı bir dağılıma uğrar, karaciğer ve böbreklerdeki multipl enzim sistemleri tarafından metabolize edildikten sonra idrarla konjuge metabolitler şeklinde elimine edilir. Eliminasyonu hızlıdır ve oral yoldan uygulama sonrası terminal yarılanma ömrü 19.3 saattir. Emilim:Dapoksetin oral uygulama sonrası, tabletin alınmasından sonra yaklaşık 1 saatte maksimum plazma konsantrasyonuna (Cmax) ulaşılacak şekilde hızla emilir. Mutlak biyoyararlanımı %42'dir (%15 ile %76 arasında; bireyler arası farklılık %38 ve bireyin kendi içindeki farklılık %14 olacak şekilde). Aç karına alınan 30 ve 60 mg'lık tek oral dozlardan sonra, dapoksetinin 1.01 saat ve 1.27 saatteki maksimum plazma konsantrasyonları sırasıyla 297 ng/ml ve 498 ng/ml olmuştur. Yağ oranı yüksek yemekle birlikte alınması dapoksetinin pik plazma konsantrasyonunu orta derecede (%10) azaltmış, AUC düzeyini orta derecede (%12) arttırmış ve plazma konsantrasyonuna ulaşma zamanını hafifçe uzatmıştır; buna rağmen, yağ oranı yüksek yemek tüketimiyle emilen miktarda bir değişiklik olmamıştır. Bu değişiklikler klinik olarak anlamlı değildir. PRILIGY yemeklerle birlikte ya da yemek haricinde alınabilir. Dağılım:In vitrokoşullarda dapoksetinin % 99'dan fazlası insan serum proteinlerine bağlıdır. Dapoksetin 162 litrelik bir ortalama kararlı düzey dağılım hacmiyle hızlı bir dağılıma uğrar. İnsanda intravenöz uygulamayı takiben dapoksetinin tahmin edilen ortalama başlangıç, orta ve terminal yarı ömrü sırasıyla 0.10, 2.19 ve 19.3 saattir.Biyotransformasyon:Yapılan in vitroçalışmalar dapoksetinin esas olarak CYP2D6, CYP3A4 ve flavin mono-oksijenaz (FMO-1) olmak üzere karaciğer ve böbreklerdeki multipl enzim sistemleri ile metabolize olduğu gösterilmiştir. 14C-dapoksetin metabolizmasını incelemek için dizayn edilmiş bir klinik çalışmada, dapoksetin oral yoldan uygulama sonrasında, N-oksidasyon, N-demetilasyon, naftil hidroksilasyon, glukuronidasyon ve sülfatlanma şeklinde metabolize olur. Oral uygulama sonrası presistemik ilk geçiş etkisine işaret eden kanıtlar bulunmaktadır.İntakt dapoksetin ve dapoksetin-N-oksit plazmada dolaşan majör maddeler olarak bulunmuştur. Yapılan in vitroin vitrobağlanma ve taşınma çalışması bu metabolitin aktif olmadığını göstermiştir.Diğer metabolitler arasında dolaşımdaki tıbbi ilaçla ilişkili maddelerin %3'ünden azını oluşturan desmetildapoksetin ile didesmetildapoksetin bulunmaktadır. In vitrobağlanma çalışmalarında desmetildapoksetinin dapoksetinle eşit potense sahip olduğu gösterilmiştir. Ancak desmetildapoksetinin plazmadaki toplam ve serbest (Cmax) düzeyleri sırasıyla ana ilacın %3-5 ve %20-25'i olarak tahmin edildiğinden, bu metabolitin toplam etkiye katkısı sınırlı olarak kabul edilir.60 mg PRILIGY kullanılan bir tek doz klinik farmakoloji çalışmasında CYP2D6 enzimi açısından zayıf metabolize edicilerdeki plazma düzeyleri yoğun metabolize edicilerdekinden daha yüksek olarak bulunmuştur (Cmax düzeyleri yaklaşık % 31, AUCinf düzeyleri ise yaklaşık % 36 daha yüksek). CYP2D6 metabolizma yolağının durumunu belirlemek açısından gerçekleştirilen çoklu dozlu iki Faz 3 çalışmaya toplam 120 zayıf metabolize ediciyle, 1598 yoğun metabolize edici dahil edilmiş ve PRILIGY ile tedavi uygulanmıştır. Zayıf ve yoğun metabolize ediciler arasında etkinlik ve güvenilirlik açısından genel olarak bir farklılık görülmemiştir. Ayrıca, prematür ejakülasyonu olan hastalarla sağlıklı gönüllüler arasında farmakokinetik açıdan da bir fark gözlenmemiştir. Eliminasyon:Dapoksetin esas olarak idrarla konjuge metabolitler şeklinde elimine edilir; idrarda değişmeden atılan aktif madde tespit edilememiştir. Dozlamadan 24 saat sonra tespit edilen düşük dozların da (pikin % 5'inden daha düşük) gösterdiği gibi dapoksetinin eliminasyonu hızlıdır. Günlük dozlamayı takiben dapoksetin minimal düzeyde birikir. Oral uygulanma sonrası terminal yarılanma ömrü 19.3 saattir. Doğrusallık / doğrusal olmayan durum:Konu ile ilgili bir bilgi mevcut değildir. Özel popülasyonlardaki farmakokinetik özellikler:Irk Tek doz 60 mg dapoksetin kullanılarak gerçekleştirilen bir klinik farmakolojik analizde beyaz, siyah, İspanyol asıllı ve Asya kökenli ırklar arasında istatistiksel açıdan anlamlı bir fark tespit edilmemiştir. Japon ırkından ve beyaz ırktan hastalarda farmakokinetik özelliklerin karşılaştırıldığı bir klinik çalışmada dapoksetinin plazma düzeyleri, Japon ırkından olan hastalarda, bu ırktaki hastaların vücut ağırlığının daha az olmasına bağlı olarak % 10 ile % 20 daha yüksek olarak bulunmuştur (AUC ve maksimum konsantrasyonlar). İlaca çok düşük miktarda daha fazla maruz kalmanın anlamlı bir klinik etkisi beklenmemektedir. Yaşlılar (65 yaş ve üzeri)60 mg dapoksetin kullanılarak gerçekleştirilen tek doz klinik farmakoloji çalışmasının analizi sağlıklı yaşlı erkeklerle sağlıklı genç erişkin erkekler arasında farmakokinetik parametreler (Cmax, AUCinf, Tmax) açısından bir farklılık göstermemiştir. Böbrek yetmezliği60 mg dapoksetin kullanılarak gerçekleştirilen tek doz klinik farmakoloji çalışmasında hafif (kreatinin klerensi 50 ile 80 ml/dakika), orta (kreatinin klerensi 30 ile <50 ml/dakika) ve şiddetli (kreatinin klerensi <30 ml/dakika) böbrek yetmezliği olan hastalarda kreatinin klerensi ve dapoksetinin Cmax veya AUCinf değerleri arasında bir korelasyon görülmemiştir. Bu hastaların tamamında, 3-4 gün boyunca idrarda sadece küçük bir oranda (< %1) dapoksetin elde edilmiştir. Böbrek işlevlerinin hafif veya orta derecede bozulduğu hastalarda doz ayarlamasına gerek yoktur, ancak kullanımda dikkatli olunması önerilir. Dapoksetinin renal diyalize gerek duyan hastalardaki farmakokinetiği değerlendirilmemiştir. Şiddetli böbrek yetmezliği hastalarındaki veriler sınırlıdır. Ağır böbrek yetmezliği hastalarının ilaca maruziyet halinde düşük tolerabilite ya da çok farklı tepkiler gösterme potansiyelleri olabilir; bu nedenle PRILIGY'nin ağır böbrek yetmezliği hastalarında kullanımı önerilmez. Karaciğer yetmezliğiDapoksetin karaciğerde yoğun olarak metabolize edilir. 60 mg dapoksetin kullanılarak gerçekleştirilen bir tek doz klinik farmakoloji çalışmasında, dapoksetinin doruk plazma konsantrasyonları (Cmax), hafif, orta derecede ve ağır karaciğer yetmezliği (Child-Pugh sınıflamasına göre sınıf A, B ve C) olan hastalarda %23 ile %67 kadar azalmıştır. Proteinlere bağlanmaya göre düzeltildiğinde Cmax düzeylerindeki azalma %4 ile %44 arasında olmuştur. Desmetildapoksetin metabolitinin doruk plazma konsantrasyonları %7 ile %43 arasında azalmıştır. Hafif ve orta dereceli karaciğer yetmezliği durumunda doz ayarlamasına gerek yoktur, ancak tekrarlayan alımlardan sonra dapoksetin ve desmetildapoksetine maruziyet (AUC) belirli ölçülerde arttığından orta derecede karaciğer yetmezliğinde kullanımı sırasında dikkatli olunması önerilir. Ağır karaciğer yetmezliği durumunda dapoksetine maruziyet önemli derecelerde arttığından, ağır karaciğer yetmezliği durumunda (Child-Pugh sınıflamasına göre sınıf C) önerilmez. 5.3. Klinik öncesi güvenlilik verileri Güvenilirlik, farmakoloji, tekrar-doz toksisitesi, genotoksisite, karsinojenik potansiyel ve üreme toksisitesini değerlendiren konvansiyonel çalışmalara dayanan klinik dışı veriler insanlara yönelik özel bir risk olmadığını göstermektedir. Dapoksetin, Maksimum Önerilen İnsan Dozunun (Maximum Recommended Human Dose; MRHD) 60 mg olduğu göz önünde tutularak erkeklere verilen mutat dozun yaklaşık iki katı maruziyet (AUC) sağlayan 225 mg/kg/gün dozlarına kadar olan dozlarda ve yaklaşık iki yıl süreyle sıçanlarda kullanıldığında karsinojen bir etki oluşturmamıştır. Dapoksetin aynı zamanda uygulanabilecek en yüksek doz olan 6 ay süreyle 100 mg/kg ve 4 ay süreyle 200 mg/kg dozunda uygulandığında Tg.rasH2 farelerinde tümör oluşumuna neden olmamıştır. Transjenik farelere 6 ay süreyle 375, 750 ya da 1500 mg/kg/gün dozlarında günlük topikal uygulama sonrasında, 750 mg/kg/gün ya da daha yüksek dozlarda bazı tümör promoter aktiviteler (uygulama bölgesinde papillomlar) gözlenmiştir. Dapoksetin ve insanlardaki majör metabolitlerinin AUC değeri olarak ölçülen sistemik tıbbi ürün maruziyeti, Maksimum Önerilen İnsan Dozu (MRHD) olan 60 mg'lık maruziyetin yaklaşık 1-2 katı kadardır. Bu topikal maruziyet modeli, oral yoldan alınan tıbbi ürünlerle ilişkisi bilinmemektedir. Dapoksetin ve insandaki majör metaboliti in vitrobakteriyel Ames testinde ya da fare lenfoma hücrelerinde yapılan ileri mutasyon testinde mutajenik bir etki oluşturmamıştır.Dapoksetin Çin hamsteri over hücresinde yapılan in vitroin vivofare mikronukleus testinde klastojenik etkilere neden olmamıştır.İki yıllık sıçan karsinojenite çalışmasına dayanan veriler, 6 aylık Tg.rasH2 karsinojenite çalışması ve genetik toksikoloji çalışmalarından elde edilen verilere göre dapoksetinin karsinojenisite riski bulunması beklenmemektedir. Erkek ve dişi sıçanlarda fertilite, üreme performansı ya da üreme organ morfolojisi üzerinde bir etki görülmemiş ve sıçan veya tavşanlarda embriyotoksisite ya da fetotoksisiteye işaret eden herhangi advers bir bulguya rastlanmamıştır. 6. FARMASÖTİK ÖZELLİKLERİ 6.1. Yardımcı maddelerin listesi Laktoz monohidrat Mikrokristalin selüloz Kroskarmelloz sodyum Kolloidal anhidroz silika Magnezyum stearat Hipromelloz Titanyum dioksit (E171) Triasetin Siyah demir oksit (E172) Sarı demir oksit (E172) 6.2. Geçimsizlikler Bilinen herhangi bir geçimsizliği bulunmamaktadır. 6.3. Raf ömrü 36 ay 6.4. Saklamaya yönelik özel tedbirler 25°C'nin altındaki oda sıcaklığında saklayınız. 6.5. Ambalajın niteliği ve içeriği Her biri 3 tablet içeren PVC-PE-PVDC/Alüminyum blisterler 3, 6 ve 18 film-kaplı tablet içeren kutularda. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler Arta kalan maddelerin imhası için özel bir öneri ya da önlem bulunmamaktadır. Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBIJohnson and Johnson Sıhhi Malzeme San. ve Tic. Ltd. Şti.Kavacık Mahallesi Ertürk Sokak Keçeli Plaza No:13
131/76 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİ İlk ruhsat tarihi: 14.07.2011 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriPRILIGY 30 mg film kaplı tabletEtken Maddesi: Dapoksetin Atc Kodu: G04BX14 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.