Xeplion 150mg/1.5ml IM Uzun Salımlı Süspansiyon İçeren Kullanıma Hazır Enjektör Kısa Ürün BilgisiSinir Sistemi » Psikoleptikler (Psikolojik İlaçlar) » Antipsikotikler » Diğer İlaçlar » Paliperidon KISA URUNBILGISI1.BEŞERI TıBBı ÜRÜNÜNADIXEPLION 150 mg/1.50 ml I.M. uzun salımlı süspansiyon içeren kullanıma hazır enjektör2.KALITATIF VE KANTİTATIF BİLEŞİMEtkin madde:Her kullanıma hazır dolu enjektörün 1,50 ml'sinde; Paliperidon palmitat 234 mg (150 mg paliperidona eşdeğer)
5 mg 2,5 mg 2,84 mg
Yardımcı maddeler:Her 1 ml'de;Anhidr disodyum hidrojen fosfat: Sodyum dihidrojen fosfat monohidrat: Sodyum hidroksit: Diğer yardımcı maddeler için 6.1'e bakınız. 3.FARMASÖTIK FORMKullanıma hazır enjektör içinde uzun salımlı süspansiyon Beyaz ile grimsi beyaz arası renkte süspansiyon.4.KLİNİK ÖZELLIKLER4.1. Terapötik endikasyonlarXEPLION şizofreni tedavisi ve şizofreni semptomlarının tekrarının önlenmesinde endikedir.4.2. Pozoloji ve uygulama şekli Pozoloji:Bugüne kadar paliperidon ya da risperidon kullanmamış hastalar için XEPLION ile tedaviye başlanmadan önce, oral paliperidon veya oral risperidonun tolerabilitesinin kanıtlanması önerilir.XEPLION'un önerilen başlangıç dozu, terapötik konsantrasyonlara hızla ulaşılması amacıyla tedavinin birinci gününde 150 mg ve bir hafta sonra (8. gün) 100 mg'dır (her ikisi de deltoid kas içine uygulanır) (Bkz. Bölüm 5.2). Önerilen aylık idame dozu 75 mg'dır. Önerilen 25 mg ila 150 mg'lık doz aralığında hastanın bireysel tolerabilitesine ve/veya etkililiğe göre bazı hastalar daha düşük ya da daha yüksek dozlardan yarar görebilir. İkinci dozu takiben aylık idame dozları deltoid veya gluteal kas içine uygulanabilir. Uygulama sıklığı ve süresi:İdame dozunun ayarlanması ayda bir yapılabilir. XEPLION'un uzatılmış salım özelliği doz ayarlaması yaparken göz önüne alınmalıdır (Bkz. Bölüm 5.2); çünkü idame dozlarının tam etkisi birkaç ay ortaya çıkmayabilir.Uygulama şekli:XEPLION, sadece intramüsküler kullanım için hazırlanmıştır. Kas içine yavaş ve derin olarak enjekte edilmelidir. Kan damarı içine yanlışlıkla enjeksiyondan kaçınmak için dikkat edilmelidir. Her enjeksiyon bir sağlık uzmanı tarafından uygulanmalıdır. Uygulama tek bir enjeksiyon şeklinde yapılmalıdır. Doz, ayrı enjeksiyonlar şeklinde uygulanmamalıdır. İntravasküler veya subkütan enjeksiyon uygulanmamalıdır.XEPLION' un deltoid kas içine uygulanması için önerilen iğne boyutu hastanın vücut ağırlığı le belirlenir. 90 kg veya daha ağır olan hastalarda merkezi gri renkli (1 ^ inch 22 G) güvenlik ğnesi önerilir. 90 kg'dan hafif olan hastalarda merkezi mavi renkli (1 inch 23 G) güvenlik ğnesi önerilir. Deltoid enjeksiyonlar iki deltoid kas arasında değiştirilmelidir. XEPLION'un gluteal kas içine uygulanması için önerilen iğne merkezi gri renkli (1 ^ inch 22 G) güvenlik iğnesidir. Uygulama gluteal bölgenin üst dış kadranı içine yapılmalıdır. Gluteal enjeksiyonlar, iki gluteal kas arasında değiştirilmelidir. Oral veya intramüsküler olarak uygulanan risperidon, değişen derecelerde paliperidona metabolize edilmektedir. Risperidon ya da oral paliperidon XEPLION ile eşzamanlı olarak kullanılacaksa dikkatli olunmalıdır. Atlanan dozlarDozların atlanmasının önlenmesi:XEPLION'un ikinci başlangıç dozunun ilk dozdan bir hafta sonra verilmesi önerilir. Doz atlanmasını önlemek için ikinci doz, bir haftalık (8. gün) zaman noktasından iki gün önce veya sonra verilebilir. Benzer şekilde, başlangıç rejiminden sonra üçüncü enjeksiyonun ve sonraki enjeksiyonların ayda bir verilmesi önerilir. Aylık dozun atlanmaması için enjeksiyon, aylık zaman noktasından yedi gün önce veya sonra verilebilir.İkinci XEPLION enjeksiyonu için hedef tarih (gün 8 ± 2 gün) atlanırsa, önerilen yeniden başlangıç zamanı hastaya ilk enjeksiyonun uygulanmasından itibaren geçen süreye bağlıdır. Atlanan ikinci başlangıç dozu (ilk enjeksiyondan sonra <4 hafta): İlk enjeksiyondan sonra 4 haftadan daha kısa bir süre geçmişse, deltoid kas içine mümkün olan en kısa sürede 100 mg'lık ikinci enjeksiyon uygulanmalıdır. 75 mg'lık üçüncü XEPLION enjeksiyonu, ilk enjeksiyondan 5 hafta sonra deltoid ya da gluteal kas içine uygulanmalıdır (ikinci enjeksiyonun zamanlamasından bağımsız olarak). Daha sonra hastanın bireysel tolerabilitesine ve/veya etkililiğe göre 25 mg ila 150 mg aralığındaki deltoid ya da gluteal dozun normal aylık enjeksiyon siklusu takip edilmelidir. Atlanan ikinci başlangıç dozu (ilk enjeksiyondan sonra 4-7 hafta): İlk XEPLION enjeksiyonundan sonra 4 ila 7 haftalık bir süre geçmişse, doz uygulamasına aşağıdaki şekilde 100 mg'lık iki enjeksiyonla devam edilmelidir: 1.Mümkün olan en kısa sürede deltoid kas içine bir enjeksiyon, 2.Bir hafta sonra bir kez daha deltoid kas içine bir enjeksiyon, 3.Hastanın bireysel tolerabilitesine ve/veya etkililiğe göre 25 mg ila 150 mg aralığındaki deltoid ya da gluteal dozun normal aylık enjeksiyon siklusunun sürdürülmesi. Atlanan ikinci başlangıç dozu (ilk enjeksiyondan sonra >7 hafta): İlk XEPLION enjeksiyonunun üzerinden yedi haftadan daha uzun bir süre geçmişse, doz uygulaması yukarıda "Pozoloji" bölümünde tarif edildiği şekilde başlatılır. Atlanan aylık idame dozu (1 ay - 6 hafta): Tedaviye başlandıktan sonra XEPLION'un ayda bir enjeksiyon siklusu önerilir. Son enjeksiyondan sonra altı haftadan daha kısa bir süre geçmişse, daha önce stabilize olmuş doz, mümkün olan en erken zamanda uygulanmalı ve bunu takiben ayda bir enjeksiyon yapılmalıdır. Atlanan aylık idame dozu (>6 hafta - 6 ay): Son XEPLION enjeksiyonunun üzerinden altı haftadan daha uzun bir süre geçmişse öneriler şu şekildedir: 25 mg ila 100 mg arasındaki dozlarla stabilize olan hastalar için: 1.Mümkün olan en kısa sürede hastanın daha önce stabilize olduğu aynı dozda deltoid kas içine bir enjeksiyon, 2.Bir hafta sonra (8. gün) bir kez daha deltoid kas içine bir enjeksiyon (aynı doz), 3.Hastanın bireysel tolerabilitesine ve/veya etkililiğe göre 25 mg ila 150 mg aralığındaki deltoid ya da gluteal dozun normal aylık enjeksiyon siklusunun sürdürülmesi. 150 mg ile stabilize olan hastalar için: 1.Mümkün olan en kısa sürede 100 mg dozda deltoid kas içine bir enjeksiyon, 2.Bir hafta sonra (8. gün) 100 mg dozda bir kez daha deltoid kas içine bir enjeksiyon, 3.Hastanın bireysel tolerabilitesine ve/veya etkililiğe göre 25 mg ila 150 mg aralığındaki deltoid ya da gluteal dozun normal aylık enjeksiyon siklusunun sürdürülmesi. Atlanan aylık idame dozu (>6 ay): XEPLION'un son enjeksiyonunun üzerinden altı aydan daha uzun bir süre geçmişse, yukarıda XEPLION'un önerilen başlangıç tedavisi için tarif edildiği şekilde doz uygulaması başlatılır. Diğer antipsikotik ilaçlardan XEPLION'a geçiş: Hastaların diğer antipsikotik ilaçlardan XEPLION'a geçişini ele alan veya XEPLION'un diğer antipsikotiklerle birlikte eşzamanlı kullanılması ile ilgili sistematik olarak toplanmış veri bulunmamaktadır. Risperidon da dahil olmak üzere diğer antipsikotik ilaçların farmakolojik profillerindeki farklılıklar göz önüne alındığında, diğer antipsikotik ilaçlardan XEPLION' a geçildiğinde bireysel tolerabilitede ve etkililik profilinde değişiklikler meydana gelebilir. Bugüne kadar paliperidon ya da risperidon kullanmamış hastalar için XEPLION ile tedaviye başlanmadan önce, oral paliperidon veya oral risperidonun tolerabilitesi kanıtlanmalıdır. Oral antipsikotik ilaçlardan XEPLION'a geçiş: XEPLION tedavisi başlanacağı zaman daha önce kullanılan oral antipsikotikler kesilebilir. XEPLION, yukarıda Bölüm 4.2'nin başlangıcında tarif edildiği şekilde başlatılmalıdır. Uzun etkili enjektabl antipsikotik ilaçlardan XEPLION'a geçiş: Hastalar uzun etkili enjektabl antipsikotik ilaçlardan XEPLION'a geçerken, XEPLION tedavisi bir sonraki programlanmış enjeksiyon zamanında başlatılmalıdır. XEPLION bundan sonra ayda bir aralıklarla devam edilmelidir. Yukarıda Bölüm 4.2'nin başlangıcında tarif edilen bir haftalık doz uygulaması başlatma rejimi gerekli değildir. RİSPERDAL® CONSTA® intramüsküler enjeksiyon için uzatılmış salımlı süspansiyonun farklı dozlarında daha önce stabilize olmuş hastalar, ayda bir verilen dozlarla aşağıda tarif edildiği şekilde XEPLION ile idame tedavisi sırasında benzer paliperidon kararlı durum maruziyetine ulaşabilirler: Kararlı durumda benzer paliperidon maruziyetine ulaşmak için gerekli RİSPERDAL CONSTA® ve XEPLION dozları
Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:XEPLION, böbrek yetmezliği olan hastalarda sistematik olarak incelenmemiştir (Bkz. Bölüm 5.2). Hafif böbrek yetmezliği olan hastalarda (kreatinin klerensi >50 - <80 ml/dak.), XEPLION'un önerilen başlangıç dozu, tedavinin birinci gününde 100 mg ve bir hafta sonra 75 mg'dır (her ikisi de deltoid kas içine uygulanır). Daha sonra deltoid veya gluteal kas içine ayda bir 50 mg uygulanır.Orta derece veya ağır böbrek yetmezliği olan hastalarda (kreatinin klerensi <50 ml/dak.) XEPLION önerilmez. Karaciğer yetmezliği:XEPLION, karaciğer yetmezliği olan hastalarda incelenmemiştir. Oral paliperidon ile yapılan çalışmaya göre hafif veya orta derece karaciğer yetmezliği olan hastalarda, doz ayarlaması gerekli değildir.Paliperidon, ağır karaciğer yetmezliği olan hastalarda incelenmemiştir (Bkz. Bölüm 5.2). Pediyatrik popülasyon:XEPLION'un çocuklarda ve 18 yaşın altındaki hastalarda güvenliliği ve etkinliği incelenmemiştir.Geriyatrik popülasyon:Genel olarak, böbrek fonksiyonu normal olan yaşlı hastalarda, XEPLION'un önerilen dozu, böbrek fonksiyonu normal olan genç erişkin hastalarda önerilen dozla aynıdır. Yaşlı hastalarda böbrek fonksiyonları azalabileceğinden, böbrek fonksiyonunun durumuna göre doz ayarlaması gerekebilir (Bkz. Bölüm 4.2).XEPLION, inme için risk faktörüne sahip demanslı yaşlı hastalarda dikkatli kullanılmalıdır (Bkz. Bölüm 4.4). DiğerXEPLION için cinsiyet, ırk veya sigara kullanımına bağlı olarak doz ayarlaması yapılması önerilmez (Gebe kadınlar ve emziren anneler için Bkz. Bölüm 4.6).4.3.KontrendikasyonlarPaliperidon palmitate veya yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olduğu bilinen hastalarda kontrendikedir.Paliperidon, risperidonun aktif bir metaboliti olduğu için XEPLION risperidona karşı bilinen aşırı duyarlılığı olan hastalarda kontrendikedir. 4.4.Özel kullanım uyarıları ve önlemleriQT AralığıDiğer antipsikotiklerle olduğu gibi, bilinen kardiyovasküler hastalığı olan veya ailesinde QT uzama öyküsü olan hastalarda ve QT aralığını uzattığı düşünülen diğer ilaçlar ile birlikte kullanılacağı durumlarda, XEPLION reçetelenirken dikkatli olunmalıdır. Nöroleptik malign sendromHipertermi, kas rijiditesi, otonomik instabilite, bilinç değişikliği ve serum kreatinin fosfokinaz seviyelerinde yükselme ile karakterize olan nöroleptik malign sendrom'un (NMS), paliperidon da dahil; antipsikotik ilaçlar ile oluştuğu bildirilmiştir. Ek klinik belirtiler arasında miyoglobülinüri (rabdomiyoliz) ve akut böbrek yetmezliği de bulunabilir. Eğer bir hastada NMS işaret eden bulgu ve semptomlar gelişirse, XEPLION da dahil olmak üzere tüm antipsikotik ilaçlar kesilmelidir. Tardif DiskineziDopamin reseptör antagonisti özelliğine sahip ilaçlar, özellikle dil ve/veya yüzde, ritmik, istem dışı hareketlerle karakterize olan tardif diskinezinin indüksiyonu ile ilişkili bulunmuştur. Eğer tardif diskinezinin bulgu ve semptomları ortaya çıkarsa, XEPLION da dahil olmak üzere tüm antipsikotik ilaçların kesilmesi değerlendirilmelidir. HiperglisemiXEPLION ile yapılan klinik çalışmalarda seyrek olarak glukoza bağlı advers olaylar, örn.; kan glukoz düzeyinde artış bildirilmiştir. Diğer antipsikotik ilaçlarla olduğu gibi, diyabeti olan ve diabetes mellitus gelişmesi açısından risk faktörleri taşıyan hastalarda, uygun klinik izleme önerilir. Ortostatik hipotansiyonPaliperidon, alfa-blokör aktivitesinden dolayı bazı hastalarda ortostatik hipotansiyonu indükleyebilir. Oral paliperidon (INVEGA 3 mg, 6 mg, 9 mg ve 12 mg) ile yapılan plasebo kontrollü, 6 haftalık, sabit dozlu üç çalışmanın birleştirilmiş verilerine göre, plasebo ile tedavi edilen deneklerin %0,8'ine karşılık oral paliperidon ile tedavi edilen deneklerin %2,5'inde ortostatik hipotansiyon bildirilmiştir. XEPLION, bilinen kardiyovasküler hastalığı olan hastalarda (örn.; kalp yetmezliği, miyokart infarktüsü veya iskemi, ileti anormallikleri), serebrovasküler hastalığı veya hipotansiyona neden olabilecek durumlarda (örn.; dehidratasyon, hipovolemi ve antihipertansif ilaçlarla tedavi) dikkatli kullanılmalıdır. NöbetlerXEPLION, diğer antipsikotik ilaçlarda olduğu gibi nöbet öyküsü olan hastalarda veya nöbet eşiğini potansiyel olarak düşüren diğer koşulların bulunduğu hastalarda dikkatli kullanılmalıdır. Böbrek yetmezliğiPaliperidonun plazma konsantrasyonu, böbrek yetmezliği olan hastalarda artmıştır ve bu nedenle hafif böbrek yetmezliği olan hastalarda doz ayarlaması önerilmektedir. Orta derece veya ağır böbrek yetmezliği olan hastalarda (kreatinin klerensi <50 ml/dak.) XEPLION önerilmez (Bkz. Bölüm 4.2 ve Bölüm 5.2). Karaciğer yetmezliğiPaliperidon, ağır karaciğer yetmezliği olan hastalarda (Child-Pugh Sınıf C) incelenmemiştir. Paliperidon, bu tür hastalarda kullanılıyorsa dikkatli olunması önerilir. Demansı olan yaşlı hastalarKonvansiyonel ve atipik antipsikotik ilaçlar demansa bağlı psikozu olan yaşlı hastaların tedavisinde kullanıldığında ölüm riskinde artışa neden olmaktadır.XEPLION, demansı olan yaşlı hastalarda incelenmemiştir. Paliperidon, risperidonun aktif bir metaboliti olduğu için risperidon ile deneyim göz önünde bulundurulmalıdır.Genel mortalite17 kontrollü klinik çalışmanın meta-analizinde, risperidon, aripiprazol, olanzapin ve ketiapin dahil olmak üzere diğer atipik antipsikotik ilaçlarla tedavi edilen ve demansı olan yaşlı hastalarda, mortalite riski plaseboya kıyasla artmıştır. Risperidon ile tedavi edilen hastalarda, plasebo için %3.1 olan mortalite %4 olmuştur. S^^eh^^^askül^^ advers olaylarRandomize plasebo kontrollü klinik çalışmalarda, risperidon, aripiprazol ve olanzapin gibi bazı atipik antipsikotik ilaçlarla tedavi edilen demanslı yaşlı hastalarda serebrovasküler advers olaylarda yaklaşık 3 kat artmış risk görülmüştür. Bu artmış riskin mekanizması bilinmemektedir. XEPLION, inme açısından risk faktörleri taşıyan demanslı yaşlı hastalarda dikkatli kullanılmalıdır. Parkinson Hastalığı ve Lewy Cisimcikli DemansParkinson hastalığı veya Lewy cisimcikli demanslı hastalara XEPLION da dahil olmak üzere antipsikotik ilaçlar reçete edilirken doktorlar yarar risk değerlendirmesi yapmalıdır; çünkü her iki hasta grubunda da, antipsikotik ilaçlara karşı duyarlılığın artmış olması ile birlikte Nöroleptik Malign Sendrom riski artmış olabilir. Bu artmış duyarlılığın belirtileri, ekstrapiramidal semptomlara ek olarak konfüzyon, obtundasyon, sık düşmeler ile birlikte postural instabilite olabilir. PriapizmAlfa-adrenerjik blokör etkileri olan antipsikotik ilaçların (risperidon dahil), priapizmi indüklediği bildirilmiştir. XEPLION ile yapılan klinik çalışmalarda, priapizm vakası bildirilmemiş olmasına rağmen, pazarlama sonrası gözetim esnasında oral paliperidon ile priapizm bildirilmiştir. Hastalar, priapizmin 3-4 saat içinde düzelmemesi durumunda acil tıbbi yardım almaları konusunda bilgilendirilmelidir. Vücut ısısının kontrolüVücudun iç vücut ısısını düşürme yeteneğinin bozulması, antipsikotik ilaçlara bağlanmıştır. Aşırı egzersiz yapmak, aşırı sıcağa maruziyet, antikolinerjik aktivitesi olan ilaçların eş zamanlı uygulanması veya dehidratasyon bulunması gibi iç vücut ısısında yükselmeye katkıda bulunabilecek koşulları olan hastalara XEPLION reçete edilirken dikkatli olunması önerilir. Venöz tromboembolik olayAntipsikotik ilaçlarla venöz tromboembolik olaylar (VTE) bildirilmiştir. Antipsikotik ilaç tedavisi gören hastalarda çoğunlukla kazanılmış VTE risk faktörleri bulunduğu için, VTE için tüm olası risk faktörleri, XEPLION ile tedaviden önce ve tedavi süresince tanımlanmalı ve koruyucu önlemler alınmalıdır. Antiemetik etkiPaliperidon ile yapılan klinik öncesi çalışmalarda, antiemetik etki gözlenmiştir. Bu etki, eğer insanlarda oluşursa, bağırsak tıkanması, Reye sendromu ve beyin tümörü gibi durumları veya belli ilaçların aşırı doz bulgu ve semptomlarını maskeleyebilir. UygulamaXEPLION'un kan damarı içine kaza ile enjekte edilmesinin önlenmesi için dikkatli olunmalıdır. XEPLION her ml'sinde 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani esasında "sodyum içermez". Sodyuma bağlı herhangi bir etki gözlenmez. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriXEPLION'un QT aralığını uzattığı bilinen ilaçlar, örn.; sınıf lA antiaritmikler (örn.; kinidin, disopramid) ve sınıf III antiaritmikler (örn.; amiodaron, sotalol), bazı antihistaminikler, bazı diğer antipsikotik ilaçlar ve bazı antimalaryaller (örn.; meflokin) ile birlikte reçete ederken dikkatli olunması önerilir.Paliperidon palmitat, paliperidona hidroliz olduğu için (Bkz. Bölüm 5.2), ilaç-ilaç etkileşim potansiyeli değerlendirilirken oral paliperidon ile yapılan çalışmaların bulguları göz önünde bulundurulmalıdır. XEPLION' un diğer ilaçları etkileme potansiyeli Paliperidonun, sitokrom P-450 izoenzimleri ile metabolize olan ilaçlar ile klinik açıdan önemli farmakokinetik etkileşimlere neden olması beklenmemektedir. İnsan karaciğer mikrozomlarında yapılan in vitroçalışmalar, paliperidonun, CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 ve CYP3A5 de dahil olmak üzere sitokrom P450 izoenzimleri tarafından metabolize edilen ilaçların metabolizmasını önemli derecede baskılamadığını göstermiştir. Bu nedenle, paliperidonun, bu metabolik yolaklarla metabolize edilen ilaçların klerensini klinik açıdan belirgin bir biçimde baskılaması beklenmemektedir. Paliperidonun, ayrıca enzim indükleyici özelliklerinin olması beklenmemektedir.Paliperidon, yüksek konsantrasyonlarda P-glikoproteinin (P-gp) zayıf bir inhibitörüdür. In vivoveri mevcut değildir ve klinik açıdan ilişki bilinmemektedir.Paliperidonun santral sinir sistemi üzerindeki primer etkileri ele alındığında (Bkz. Bölüm 4.8), XEPLION diğer santral etkili ilaçlar, örn.; anksiyolitikler, antipsikotiklerin çoğu, hipnotikler, opiatlar, vb. veya alkol ile birlikte dikkatli kullanılmalıdır. Paliperidon, levodopa ve diğer dopamin agonistlerinin etkilerini antagonize edebilir. Bu kombinasyonun gerekli olduğuna karar verilirse, özellikle son evre Parkinson hastalığında her bir tedaviye ilişkin en düşük etkili doz reçete edilmelidir. Ortostatik hipotansiyonu indükleme potansiyeli nedeni ile (Bkz. Bölüm 4.4), XEPLION bu potansiyele sahip olan diğer terapötik ilaçlar, örn.; diğer antipsikotik ilaçlar, trisiklikler ile birlikte uygulandığı zaman aditif etki gözlenebilir. Paliperidon nöbet eşiğini düşürdüğü bilinen diğer ilaçlar ile birlikte kombine edilirse dikkatli olunması önerilir (yani fenotiyazinler veya butirofenonlar, trisiklikler veya SSRI'lar, tramadol, meflokin, vb.). Kararlı durumdaki oral uzatılmış salımlı paliperidon tabletlerin (günde bir kez 12 mg) uzatılmış salımlı divalproeks sodyum tabletlerle (günde bir kez 500 mg ila 2000 mg) eşzamanlı olarak uygulanması, valproatın kararlı durum farmakokinetiğini etkilememiştir. XEPLION ve lityum arasında farmakokinetik etkileşim olası değildir. Diğer ilaçların XEPLION'ı etkileme potansiyelleri Paliperidon, CYP1A2, CYP2A6, CYP2C9, CYP2C19 ve CYP3A5'in bir substratı değildir. Bu durum, bu izoenzimlerin inhibitörleri veya indükleyicileri ile bir etkileşimin olası olmadığını düşündürmektedir. In vitroin vitroin vivoIn vitroçalışmalar, paliperidonun bir P-gp substratı olduğunu göstermiştir.Paliperidon, CYP2D6 ile kısıtlı derecede metabolize edilir (Bkz. Bölüm 5.2). Sağlıklı gönüllülerde yapılan bir etkileşme çalışmasında, oral paliperidonun güçlü bir CYP2D6 inhibitörü olan paroksetinle birlikte uygulanması sonucu paliperidonun farmakokinetiği üzerinde klinik açıdan belirgin bir etki gözlenmemiştir. Günde bir kere uygulanan uzatılmış salımlı oral paliperidonun günde iki kere 200 mg karbamazepin ile birlikte uygulanması, paliperidonun ortalama kararlı durum Cmax ve EAA değerlerinde yaklaşık olarak %37 oranında bir düşüşe neden olmuştur. Bu düşüş, büyük ölçüde, karbamazepin tarafından renal P-gp'nin indüklenmesinin bir sonucu olarak paliperidonun renal klerensinde %35 oranında artışa bağlıdır. Karbamazepinin eş zamanlı olarak uygulanması esnasında, idrarla değişmeden atılan ilaç miktarında minör bir azalma, paliperidonun CYP metabolizması veya biyoyararlanımı üzerinde düşük derecede etki olduğunu düşündürmektedir. Karbamazepin kullanımına başlandığında XEPLION dozu yeniden değerlendirilmeli ve gerekirse arttırılmalıdır. Bu durumun tersine, karbamazepin kullanımı kesildiğinde XEPLION dozu yeniden değerlendirilmeli ve gerekirse azaltılmalıdır. Fizyolojik pH koşullarında bir katyon olan paliperidon, yaklaşık olarak yarısı filtrasyon, yarısı aktif sekresyon yolu ile primer olarak değişmeden böbreklerden atılır. Böbrekte katyonik ilaçların aktif taşınmasını baskıladığı bilinen bir ilaç olan trimetroprimin eş zamanlı olarak uygulanması, paliperidonun farmakokinetiğini etkilememiştir. 12 mg oral uzatılmış salımlı paliperidon tabletin tekli bir dozunun, uzatılmış salımlı divalproeks sodyum tabletlerle (günde bir kez iki 500 mg'lık tablet) eşzamanlı olarak uygulanması muhtemelen artmış oral absorpsiyonun bir sonucu olarak paliperidonun Cmax ve EAA'sında yaklaşık %50'lik bir artışla sonuçlanmıştır. Sistemik klerenste herhangi bir etki gözlenmediğinden, uzatılmış salımlı divalproeks sodyum tabletler ve XEPLION'un intramüsküler enjeksiyonu arasında klinik olarak anlamlı bir etkileşim beklenmemektedir. Bu etkileşim XEPLION ile çalışılmamıştır. XEPLION ve lityum arasında farmakokinetik etkileşim olası değildir. XEPLION'un Risperidon ile birlikte kullanımı XEPLION'un risperidon ile birlikte kullanımı incelenmemiştir. Paliperidon, risperidonun aktif bir metaboliti olduğu için risperidon XEPLION ile birlikte kullanılacaksa, aditif paliperidon maruziyeti göz önüne alınmalıdır. Özel popülasyonlara ilişkin ek bilgiler Pediyatrik popülasyon:Bilgi bulunmamaktadır.4.6. Gebelik ve laktasyon Genel tavsiyeGebelik Kategorisi: CÇocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir. (Bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.Gebelik dönemiXEPLION' un gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. XEPLION, kesin gerekli olmadıkça gebelik döneminde kullanılmamalıdır.Yüksek doz oral paliperidon ile tedavi edilen laboratuar hayvanlarında fetal ölümlerde hafif bir artış görülmüştür. İntramüsküler enjeksiyonla paliperidon palmitat uygulanan sıçanlarda, gebelik parametreleri etkilenmemiştir. Yüksek dozlar, anneler için toksik olmuştur. Maksimum insan maruziyetinin 20-22 katı daha yüksek olan oral dozlar veya maksimum insan maruziyetinin 6 katı daha yüksek intramüsküler dozlar, fetüsü etkilememiştir. XEPLION'un insanda doğum sancısı ve doğum üzerindeki etkisi bilinmemektedir. Gebeliğin üçüncü trimesterinde antipsikotik ilaçlara (paliperidon da dahil) maruz kalan yeni doğanlar, doğumu takiben şiddeti değişebilen, anormal kas hareketleri (ekstrapiramidal işaretler/ekstrapiramidal semptomlar) ve/veya ilaç kesilme semptomları açısından risk altındadırlar. Bu semptomlar, ajitasyon, hipertoni, hipotoni, tremor, somnolans, respiratuar distres veya beslenme bozukluklarını içermektedir. Laktasyon dönemiPaliperidon anne sütü ile atılmaktadır (süte geçmektedir). XEPLION emzirme döneminde kullanılmamalıdır.Üreme yeteneği/FertiliteOral paliperidon tedavisi, prolaktin- ve santral sinir sistemi- aracılı etkiler ile sonuçlanmış olmasına rağmen, erkek ve dişi sıçanların fertilitesi etkilenmemiştir. Maternal olarak toksik bir dozda, dişi sıçanların canlı embriyo sayısında çok az bir düşüş göstermiştir.4.7.Araç ve makine kullanımı üzerindeki etkilerXEPLION, zihin açıklığı gerektiren aktivitelere engel olabilir ve görsel etkilere neden olabilir (Bkz. Bölüm 4.8). Bu nedenle hastalar, XEPLION'a karşı bireysel duyarlılıkları bilinene kadar araç veya makine kullanmamaları konusunda uyarılmalıdır.4.8.istenmeyen etkilerKlinik çalışmalarda en sık bildirilen advers ilaç reaksiyonları (ADR'ler) insomnia, baş ağrısı, kilo alımı, enjeksiyon bölgesi reaksiyonları, ajitasyon, somnolans, akatizi, bulantı, konstipasyon, sersemlik, tremor, kusma, üst solum yolu enfeksiyonu, diyare ve taşikardidir. Bu advers ilaç reaksiyonları arasından akatizi dozla ilişkili olarak ortaya çıkmaktadır.Aşağıda verilen tüm ADR'ler klinik çalışmalarda XEPLION ile tedavi edilen hastalardan bildirilen reaksiyonlardır. Şu terimler ve sıklık dereceleri kullanılmıştır: Çok yaygın (>1/10); yaygın (>1/100 ile <1/10); yaygın olmayan (>1/1000 ile <1/100); seyrek (>1/10.000 ile <1/1000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Bu bölümde tarif edilen veriler, 25 mg ile 150 mg arasındaki önerilen doz aralığında en az bir doz XEPLION almış olan toplam 3817 şizofreni hastasından ve tüm çalışma boyunca plasebo almış olan toplam 510 şizofreni hastasından ve RISPERDAL CONSTA almış olan 1199 hastadan oluşan klinik çalışma veri tabanından (dokuz adet faz 2/3 çalışması ve bir adet uzun süreli faz 1 güvenlilik çalışması) elde edilmiştir. XEPLION ile tedavi edilen 3817 hastanın 1293'ü, sabit dozlu, çift-kör, plasebo kontrollü dört çalışmada XEPLION kullanmış (biri 9 haftalık ve üçü 13 haftalık çalışma), 849'u idame çalışmasında XEPLION kullanmış (bunların 205'i bu çalışmanın çift-kör, plasebo kontrollü fazında XEPLION almaya devam etmişlerdir) ve 1675'i plasebo kontrollü olmayan beş çalışmada (üçü eşit etkinlik [non-inferiority] aktif karşılaştırıcı çalışması, biri açık etiketli farmakokinetik ve güvenlilik çalışması ve biri enjeksiyon bölgesi [deltoid-gluteal] çapraz çalışması) XEPLION kullanmıştır. 13 haftalık çalışmalardan birisi 150 mg'lık XEPLION başlangıç dozu ve bunu takiben aylık 25 mg, 100 mg veya 150 mg'lık dozla tedaviyi içermiştir. Enfeksiyonlar ve enfestasyonlarYaygın: Üst solunum yolu enfeksiyonuBağışıklık sistemi hastalıklarıYaygın olmayan: HipersensitiviteEndokrin hastalıklarıYaygın olmayan: HiperprolaktinemiMetabolizma ve beslenme hastalıklarıYaygın: Kilo alımı, kan glukoz düzeyinde yükselme, kan trigliserit düzeyinde yükselmeYaygın olmayan: Hiperglisemi, hiperinsülinemi, iştah artışı, iştah azalması, kan kolesterol düzeyinde yükselme Psikiyatrik hastalıklarÇok yaygın: İnsomnia Yaygın: AjitasyonYaygın olmayan: Huzursuzluk, kabus Sinir sistemi hastalıklarıÇok yaygın: Baş ağrısıYaygın: Ekstrapiramidal bozukluklar, akatizi, tremor, diskinezi, sersemlik, somnolans Yaygın olmayan: Senkop, konvülsiyon, tardif diskinezi, disartri, oromandibüler distoni, distoni, parkinsonizm, psikomotor hiperaktivite, hipertoni, bradikinezi, postural sersemlik, ağızda sulanma, letarji Seyrek: Nöroleptik malign sendrom, serebrovasküler olay Göz hastalıklarıYaygın olmayan: Okülojirik kriz, bulanık görme Seyrek: Göz kayması, göz hareket bozukluğuKulak ve iç kulak hastalıklarıKardiyak hastalıklarYaygın: TaşikardiYaygın olmayan: Sinüs taşikardisi, kondüksiyon bozukluğu, birinci derece atrioventriküler blok, bradikardi, postural ortostatik taşikardi sendromu, palpitasyonlar, elektrokardiyogramda QT uzaması, normal olmayan elektrokardiyogram Vasküler hastalıklarYaygın: HipertansiyonYaygın olmayan: Ortostatik hipotansiyon Gastrointestinal hastalıklarYaygın: Kusma, abdominal rahatsızlık/üst abdominal ağrı, diyare, bulantı, konstipasyon, diş ağrısıYaygın olmayan: Tükrük hipersekresyonu, ağız kuruluğu Deri ve deri altı doku hastalıklarıYaygın: DöküntüYaygın olmayan: Ürtiker, jeneralize kaşıntı, kaşıntı Seyrek: İlaç erüpsiyonu Kas-iskelet bozukluklar, bağ doku ve kemik hastalıklarıYaygın: Sırt ağrısı, kas-iskelet sertliği, ekstremitede ağrıYaygın olmayan: Kas rijiditesi, kas gerginliği, kas spazmları, kas seyirmesi, miyalji, eklem sertliği Seyrek: Ense rijiditesi Üreme sistemi ve meme hastalıklarıYaygın olmayan: Jinekomasti, erektil disfonksiyon, seksüel disfonksiyon, galaktore, amenore, düzensiz menstrüasyon, menstrüel bozukluk, gecikmiş menstrüasyonSeyrek: Meme akıntısı Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın: Enjeksiyon bölgesi reaksiyonları, asteni, yorgunlukAşağıda şizofreni tedavisinde oral paliperidon ile bildirilen ek advers ilaç reaksiyonları sıralanmıştır: Bağışıklık sistemi hastalıklarıAnafilaktik reaksiyonSinir sistemi hastalıklarıGrand mal konvülsiyonKardiyak hastalıklarSinüs aritmisiVasküler hastalıklarHipotansiyon, iskemiSolunum, göğüs bozuklukları ve mediastinal hastalıklarAspirasyon pnömonisiÜreme sistemi ve meme hastalıklarıPriapizmGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarÖdemBu sınıfa özgü olaylar Ekstrapiramidal Semptomlar (EPS): 13 haftalık, sabit dozlu, çift-kör, plasebo kontrollü iki şizofreni çalışmasının birleştirilmiş verileri (Bkz. Bölüm 5.1), plasebo ile XEPLION arasında acil tedavi gerektiren EPS açısından farklılık göstermemiştir. EPS'nin değerlendirilmesi, aşağıdaki EPS gruplarının toplu analizini içermektedir: diskinezi, distoni, hiperkinezi, parkinsonizm ve tremor. 150 mg'lık başlangıç dozunu içeren 13 haftalık çalışma, 9 haftalık, sabit dozlu, çift-kör, plasebo kontrollü çalışma ve uzun dönemde nüksü önleme çalışmasının bütün fazları benzer bulgular göstermiştir. Kilo alma: 150 mg'lık başlangıç dozunun kullanıldığı 13 haftalık çalışmada, vücut ağırlığının %7'si ve daha fazla kilo alma kriterini karşılayan bireylerin oranları, XEPLION gruplarında plasebo grubuna göre daha yüksek orandadır. %7 ve daha fazla anormal kilo alımı olan denek oranı, dozla ilişkili bir eğilim göstermiştir ve insidans oranı plasebo grubunda %5 iken; XEPLION 25 mg, 100 mg ve 150 mg gruplarında plasebo ile karşılaştırmalı olarak sırasıyla %6, %8 ve %13 bulunmuştur. 13 haftalık, sabit dozlu, çift-kör, plasebo kontrollü iki çalışmada (birleştirilmiş veriler), %7 ve daha fazla kilo artışı kriterine uyan denek oranı %2 olan plasebo grubu ile karşılaştırmalı olarak 25 mg, 50 mg ve 100 mg XEPLION gruplarında sırasıyla %6, %9 ve %10 olarak bulunmuştur. 9 haftalık, sabit dozlu, çift-kör, plasebo kontrollü çalışmada, bu kritere plasebo grubunun %4'ü uyarken, bununla karşılaştırmalı olarak 50 mg ve 100 mg XEPLION grupları sırasıyla %8'i ve %6'sı bu kritere uymuştur. Uzun dönemde nüksü önleme çalışmasının 33 haftalık açık etiketli geçiş/idame dönemi esnasında, XEPLION ile tedavi edilen deneklerin %12'si bu kritere uymuştur (çift-kör fazından son noktaya kadar >%7 kilo artışı); açık etiketli başlangıca göre ortalama (SD) ağırlık değişikliği +0.7 (4.79) kg olmuştur. Değişken uzunluktaki çift-kör fazda, bu kriter, plasebo ile tedavi edilen gönüllülerin %3'ünde bulunmasına (ortalama süre 105 gün [aralık 8441 gün]) kıyasla, XEPLION ile tedavi edilen deneklerin %6'sında bulunmuştur (ortalama süre 171 gün [aralık 1 -407 gün]); çift-kör başlangıç düzeyine göre ortalama ağırlık değişikliği plasebo için -1.0 kg (3.08) iken, karşılaştımalı olarak XEPLION için +0.5 (3.83) kg olarak saptanmıştır. Bu çalışmanın açık etiketli uzatılmış fazında da benzer bulgular saptanmıştır. Laboratuar testleri Serum prolaktin: 13 haftalık, sabit dozlu çift-kör, plasebo kontrollü iki çalışmanın birleştirilmiş verilerine göre (Bkz. Bölüm 5.1) XEPLION alan deneklerde her iki cinsiyette de, serum prolaktin düzeyinde ortalama artışlar gözlenmiştir. 150 mg'lık başlangıç dozunu kapsayan 13 haftalık çalışma, 9 haftalık, sabit dozlu, çift-kör, plasebo kontrollü çalışma ve yeniden nüksü önleme çalışmasının çift kör fazı, benzer bulgular göstermiştir. 13 haftalık, çift kör, plasebo kontrollü üç çalışmadan elde edilen verilere göre, prolaktin düzeylerinde artışı düşündürebilecek advers olaylar (örn.; amenore, galaktore, jinekomasti) genelde deneklerin %1'inden azında bildirilmiştir. Metabolik parametreler Hem kısa süreli hem de uzun süreli çalışmalarda metabolik parametrelerdeki (glukoz, C-peptit, insülin, HDL, LDL, trigliseritler ve kolesterol) genel değişiklikler plaseboya benzer bulunmuştur. 13 haftalık, sabit dozlu, çift kör, plasebo kontrollü iki çalışmadan toplanmış verilerde metabolik laboratuar parametrelerinde başlangıçtan itibaren meydana gelen ortalama değişiklikler (birleştirilmiş plaseboya karşı toplam XEPLION): glukoz (0.1 mmol/L'ye karşı 0.1), C-peptit (0.1 nmol/L'ye karşı 0.1), insülin (9.3 pmol/L'ye karşı -7.7), LDL (-0.2 mmol/L'ye karşı -0.2), HDL (0.0 mmol/L'ye karşı 0.0), kolesterol (-0.3 mmol/L'ye karşı -0.2) ve trigliseritler (-0.2 mmol/L'ye karşı -0.1). Uzun süreli relaps önleme çalışmasında, çift kör başlangıçtan çift kör sonlanım noktasına aşağıdaki metabolik parametreler açısından meydana gelen ortalama değişiklikler (plaseboya karşı XEPLION): glukoz (0.0 mmol/L'ye karşı 0.1), C-peptit (0.1 nmol/L'ye karşı 0.0), insülin (10.7 pmol/L'ye karşı 10.0), LDL (-0.1 mmol/L'ye karşı -0.1), HDL (0.0 mmol/L'ye karşı 0.0), kolesterol (-0.1 mmol/L'ye karşı -0.1) ve trigliseritler (0.0 mmol/L'ye karşı -0.1). Sınıf etkileri Antipsikotik ilaçların kullanılması sonucunda QT uzaması, ventriküler aritmiler (ventriküler fibrilasyon, ventriküler taşikardi), ani beklenmedik ölüm, kardiyak arrest ve Torsades de pointes görülebilir. Pulmoner embolizm ve derin ven trombozu vakaları da dahil olmak üzere, antipsikotik ilaçlarla venöz tromboembolik olay bildirilmiştir (Sıklık bilinmemektedir). Risperidon ile Bildirilen Güvenlilik Bulgusu Paliperidon, risperidonun aktif bir metabolitidir. XEPLION'un salınma profili ve farmakolojik özellikleri, hem uzun etkili risperidon enjeksiyonu ile gözlenen, hem de oral hızlı salımlı risperidon formülasyonları ile gözlenenden anlamlı derecede farklıdır (Bkz. Bölüm 5.1). Klinik çalışmalarda ve pazarlama sonrası deneyimde oral risperidon ve uzun etkili risperidon enjeksiyonu kullanımında bildirilen güvenlilik bilgileri, bu ürünlerin ürün bilgilerinde bulunabilir. 4.9. Doz aşımı ve tedavisiXEPLION'un, sağlık personeli tarafından uygulanması gerektiğinden hastaların aşırı doz alma potansiyeli düşüktür.BelirtilerGenellikle, beklenen bulgu ve semptomlar paliperidonun bilinen farmakolojik etkilerinin artması şeklindedir. Bunlar, uyuşukluk ve sedasyon, taşikardi ve hipotansiyon, QT uzaması ve ekstrapiramidal semptomlardır. Akut doz aşımı durumunda, birden fazla ilaç ihtimali düşünülmelidir. TedaviTedavi gereksinimleri ve iyileşme değerlendirilirken XEPLION'un uzatılmış salım özelliği ve paliperidonun uzun yarılanma ömrü göz önünde tutulmalıdır. Paliperidonun spesifik bir antidotu yoktur. Genel destekleyici önlemler uygulanmalıdır. Hava yolu açık tutulmalı, korunmalı ve yeterli oksijenasyon, ventilasyon sağlanmalıdır. Kardiyovasküler izlemeye hemen başlanmalı ve olası aritmiler için sürekli elektrokardiyografik izleme yapılmalıdır. Hipotansiyon ve dolaşım kollapsı, intravenöz sıvı ve/veya sempatomimetik ilaçlar gibi uygun önlemlerle tedavi edilmelidir. Ciddi ekstrapiramidal semptomların varlığında antikolinerjik ilaçlar uygulanmalıdır. Hasta iyileşene kadar yakın denetim ve gözlem sürdürülmelidir. 5.FARMAKOLOJIK ÖZELLIKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Diğer antipsikotikler ATC kodu: N05A X13XEPLION paliperidonun (+)- ve (-)- rasemik karışımını içerir. Etki mekanizması: Paliperidon palmitat, paliperidona hidrolize olur (Bkz. Bölüm 5.3). Paliperidon, daha çok serotonerjik 5-HT2A antagonistik aktivitesi olan merkezi etkili dopamin D2 antagonistidir. Paliperidon, aynı zamanda alfa-1 ve alfa-2 adrenerjik reseptörlerin ve H1 histaminerjik reseptörlerin antagonisti olarak etki eder. Paliperidonun kolinerjik muskarinik veya B1- ve B2-adrenerjik reseptörlere afinitesi yoktur. (+)- ve (-)- paliperidon enantiyomerlerinin farmakolojik aktivitesi, kalitatif ve kantitatif olarak benzerdir. Şizofrenide etkili olan diğer ilaçlarda olduğu gibi paliperidonun etki mekanizması bilinmemektedir. Ancak, ilacın şizofrenideki terapötik aktivitesinin, dopamin Tip 2 (D2) ve serotonin Tip 2 (5HT2a) reseptör antagonizmasının kombinasyonu ile kontrol edildiği öne sürülmüştür. D2 ve 5HT2A dışındaki diğer reseptörlerdeki antagonizma, paliperidonun diğer etkilerinin bazılarını açıklayabilir. Elektrofizyoloji Oral paliperidonun QT aralığı üzerindeki etkileri, şizofreni ve şizoafektif bozukluğu olan erişkinlerde yapılan iki randomize, çift-kör, çok merkezli, faz 1 çalışmasında ve şizofrenili erişkinlerde yapılan aktif kontrollü, 6 haftalık, sabit dozlu etkinlik çalışmalarında değerlendirilmiştir. İlk faz 1 çalışmasında (n=141), denekler 7 gün süre ile günde bir kere hızlı salımlı oral paliperidon (4 mg'dan 8 mg'a titre edilerek) veya tek doz moksifloksasin (400 mg) almak üzere randomize olarak ayrılmışlardır. Günde tek doz 8 mg hızlı salımlı oral paliperidon (n=50, Cmax ss= 113 ng/ml) ile elde edilen ortalama kararlı durum maksimum plazma konsantrasyonu, deltoid kas içine uygulanan önerilen maksimum 150 mg'lık XEPLION dozu ile gözlenen 2 kat daha yüksek maruziyete göre daha yüksek bulunmuştur (öngörülen ortalama Cmax ss = 50 ng/ml). Model-ayarlı, gün-ortalamalı lineer-deriveli QT düzeltmesinde (QTcLD), XEPLION tedavi grubunda (n=50) 5.5 milisaniyelik (ms) ortalama artış saptanmıştır (%90 CI: 3.66; 7.25). İkinci faz 1 çalışmasında (n=109) denekler; plasebo, maksimum önerilen oral uzatılmış salımlı paliperidon dozu (günde bir kere 12 mg) ve bunu takiben önerilen aralığın üzerinde bir doza titrasyon (günde bir kere 18 mg) veya aynı farmakolojik ilaç sınıfından bir ilacı (günde iki kez 400 mg ketiapin) aktif kontrol olarak alacak şekilde rastgele ayrılmışlardır. Bu 10 günlük eşit etkinlik çalışmasında, birincil karşılaştırma 12 mg uzatılmış salımlı paliperidon ile ketiapin arasında yapılmıştır. Her bireyin saptanan tmax değerinde QTcLD'de başlangıca göre en düşük kareler ortalamasının değişikliği, 12 mg uzatılmış salımlı paliperidon için (ortalama Cmax 34 ng/ml), günde iki kez 400 mg ketiapin ile karşılaştırıldığında (ortalama Cmax 1183 ng/ml) 5.1 ms daha düşük bulunmuştur (%90 CI: -9.2; -0.9). Bu değer önceden belirlenmiş 10 ms olan eşit etkinlik kriterine uygundur. Her bireyin saptanan tmax değerinde QTcLD'de başlangıca göre ortalama değişiklik, 18 mg uzatılmış salımlı paliperidon için (ortalama Cmax 53 ng/ml), günde iki kez 400 mg ketiapin ile karşılaştırıldığında (ortalama Cmax 1183 ng/ml) 2.3 ms daha düşük bulunmuştur (%90 CI: -6.8; 2.3). Her bireyin saptanan tmax değerinde QTcLD'de ortalama değişiklik, eşzamanlı plasebo grubunda saptanan ortanca tmax değerinde (karşılaştırılan aktif ilacın) QTcLD'de başlangıca göre ortalama değişiklikle karşılaştırıldığında, 12 mg uzatılmış salımlı paliperidon için 1.5 ms daha yüksek (%90 CI: -3.3; 6.2) ve günde iki kez 400 mg ketiapin için 8.0 ms daha yüksek (%90 CI: 3.1; 12.9) bulunmuştur. Her bireyin saptanan tmax değerinde QTcLD'de ortalama değişiklik, eşzamanlı plasebo grubunda saptanan ortanca tmax değerinde (karşılaştırılan aktif ilacın) QTcLD'de başlangıca göre ortalama değişiklikle karşılaştırıldığında, 18 mg uzatılmış salımlı paliperidon için 4.9 ms daha yüksek (%90 CI: --0.5; 10.3) ve günde iki kez 400 mg ketiapin için 7.5 ms daha yüksek (%90 CI: 2.5; 12.5) bulunmuştur. Bu çalışmaların hiçbirisinde herhangi bir zamanda deneklerde, başlangıca göre 60 milisaniyeyi geçen bir değişiklik veya 500 milisaniyeyi geçen bir QTcLD görülmemiştir. Oral uzatılmış salımlı paliperidonla ilgili sabit dozlu üç etkinlik çalışmasında, standardize edilmiş bir yöntem kullanılarak belirli günlerde (beklenen Cmax sürelerini içeren) 15 zaman noktasında, kapsamlı elektrokardiyografi (ECG) ölçümleri alınmıştır. Uzatılmış salımlı paliperidon ile tedavi edilen 836 denek, olanzapin ile tedavi edilen 357 denek ve plasebo ile tedavi edilen 350 deneğin toplu verilerine göre herhangi bir zaman noktasında, herhangi bir tedavi grubunda ortalama QTcLD artışı 5 milisaniyeyi geçmemiştir. Bu çalışmalar esnasında, uzatılmış salımlı 12 mg paliperidon ve olanzapin gruplarının her birisinde bir denekte bir zaman noktasında 60 milisaniyeyi geçen değişiklik olmuştur (sırası ile 62 ve 110 milisaniye artışları). XEPLION' un dört sabit dozlu etkinlik çalışmasında, deneklerin tamamında 60 milisaniyeyi geçen QTcLD değişikliği olmamış ve herhangi bir zaman noktasında 500 milisaniyeden fazla QTcLD değeri görülmemiştir. Uzun süreli nüksü önleme çalışmasında, deneklerin tamamında 60 milisaniyeyi geçen QTcLD değişikliği olmamıştır ve bir denekte 507 milisaniyelik QTcLD değeri saptanmıştır (Bazett düzeltilmiş QT aralığı [QTcB] 483 milisaniye). Bu hastada ayrıca kalp hızı 45 atım/dakika bulunmuştur. Klinik Etkinlik XEPLION'un şizofreninin akut tedavisinde etkililiği, şizofreni için DSM-IV kriterlerini karşılayan akut nüks gelişmiş yatan erişkin hastalarda yapılan kısa süreli (biri 9 haftalık ve üçü 13 haftalık) çift-kör, randomize, plasebo kontrollü, sabit dozlu dört çalışmada değerlendirilmiştir. Bu çalışmalarda I XEPLION'un sabit dozları, 9 haftalık çalışmada 1. , 8. ve 36. günlerde ve 13 haftalık çalışmalarda ek olarak 64. günde verilmiştir (ilk iki doz için bir haftalık aralıklarla ve daha sonra idame için 4 haftada bir). Etkinlik, Pozitif ve Negatif Sendrom Ölçekleri (PANSS) kullanılarak değerlendirilmiştir. PANSS, pozitif semptomları, negatif semptomları, dağınık düşünceleri, kontrol edilemeyen saldırganlık/heyecanı ve anksiyete/depresyonu değerlendirmek için beş faktörden oluşan valide edilmiş çok maddeli bir ölçektir. Fonksiyon, Kişisel ve Sosyal Performans (PSP) ölçeği kullanılarak değerlendirilmiştir. PSP, sosyal olarak yararlı aktivite alanlarında kişisel ve sosyal fonksiyonu ölçen ve klinisyenin derecelendirdiği valide edilmiş bir ölçektir: iş ve çalışma, kişisel ve sosyal ilişkiler, kendi kendine bakım ve rahatsız edici ve agresif davranışlar. Sosyal, kişisel ve kendi kendine bakım alanlarında disfonksiyonun şiddeti, bu aktiviteleri başkalarının yardımı ile ve başkalarının yardımı olmaksızın uygulamada zorluk derecesi (yok, hafif, aşikar, belirgin, şiddetli) ile ölçülür. Benzer şekilde, agresif davranışlarda disfonksiyonun şiddeti, agresif davranışların varlığı veya yokluğu (kabalık, başkalarına toplum içinde hakaret etmek, nesneleri kırmak, sözlü tehditler, fiziksel saldırı) ve bu davranışların sıklığı ile ölçülür. XEPLION'un üç sabit dozunu (başlangıçta 150 mg'lık deltoid enjeksiyon ve bunu takiben 25 mg/4 hafta, 100 mg/4 hafta veya 150 mg/4 hafta şeklinde 3 gluteal veya deltoid doz) plasebo ile karşılaştıran 13 haftalık çalışmada (n=636), XEPLION'un üç dozu da, PANSS toplam puanını düzeltmek açısından plaseboya göre üstün bulunmuştur. Bu çalışmada, hem 100 mg/4 hafta hem de 150 mg/4 haftalık tedavi grupları PSP puanı açısından plaseboya göre istatistiksel olarak anlamlı üstünlük göstermişken, 25 mg/4 haftalık tedavi grubu üstünlük göstermemiştir. Bu bulgular, tedavi süresi boyunca etkililiği ve PANSS'de düzelmeyi desteklemektedir ve dördüncü gün kadar erken dönemde gözlenmiştir. Sekizinci günde ise 25 mg ve 150 mg'lık XEPLION gruplarında plaseboya göre anlamlı farklılık gözlenmiştir. XEPLION'un üç sabit dozunu (50 mg/4 hafta, 100 mg/4 hafta ve 150 mg/4 hafta) plasebo ile karşılaştıran diğer bir 13 haftalık çalışmada (n=349), sadece 100 mg/4 haftalık XEPLION grubu, PANSS toplam puanında düzelme açısından plaseboya göre üstün bulunmuştur. Bu çalışmada, hem 50 mg/4 hafta, hem de 100 mg/4 hafta dozları, PSP puanını düzeltmek açısından plaseboya üstün bulunmuştur. Bu çalışmaya 150 mg'lık bir doz dahil edilmesine rağmen, bu dozu alan gönüllü sayısı, bu dozun etkililiği ile ilgili kesin sonuçlara varmak için yeterli değildir. XEPLION'un üç sabit dozunu (25 mg/4 hafta, 50 mg/4 hafta ve 100 mg/4 hafta) plasebo ile karşılaştıran üçüncü 13 haftalık çalışmada (n=513), XEPLION'un üç dozu da, PANSS toplam puanını düzeltmek açısından plaseboya göre üstün bulunmuştur. Bu çalışmada, paliperidon doz grupların tamamında, PSP puanı açısından plaseboya göre istatistiksel olarak anlamlılık saptanmamıştır. XEPLION'un iki sabit dozunu (50 mg/4 hafta ve 100 mg/4 hafta) plasebo ile karşılaştıran 9 haftalık çalışmada (n=197), XEPLION'un iki dozu da, PANSS toplam puanını düzeltmek açısından plaseboya göre üstün bulunmuştur. XEPLION' un şizofrenide semptomatik kontrolü idame etmek açısından etkililiği, şizofreni için DSM-IV kriterlerini karşılayan erişkin gönüllüleri içeren uzun süreli çift-kör, plasebo kontrollü, esnek dozlu bir çalışmada belirlenmiştir. Bu çalışma, 33 haftalık açık etiketli akut tedavi ve stabilizasyon fazı ve randomize, plasebo kontrollü bir faz (nüks açısından gözlem yapmak üzere) içermiştir. Değişken uzunlukta çift-kör faz esnasında, hastalar stabilizasyon fazında aldıkları aynı XEPLION'un doz grubuna (ortanca süre 171 gün [aralıklar 1 gün-407 gün] [4 haftada bir uygulanan 25 mg, 50 mg veya 100 mg]) veya plasebo grubuna (ortalama süre 105 gün [aralıklar 8 gün-441 gün] randomize olarak ayrılmıştır. Toplam 410 stabilize hasta, şizofreni semptomlarında nüks oluşana kadar, XEPLION veya plasebo gruplarına randomize olarak ayrılmıştır. Nüks, aşağıdakilerden birinin veya daha fazlasının ilk olarak ortaya çıkma zamanı olarak tanımlanmıştır. Bunlar; psikiyatrik hospitalizasyon, iki ardışık değerlendirmede toplam PANSS puanında >%25 artış (başlangıç puanı >40 ise) veya 10 puanlık artış (başlangıç puanı <40 ise), kasıtlı olarak kendi kendini yaralamak, saldırgan davranış, intihar/öldürmeye eğilimli düşünceler veya PANSS maddelerinin P1 (Delüzyonlar), P2 (kavramsal disorganizasyon), P3 (Halüsinasyonla ilgili davranış), P6 (Şüphecilik/perseküsyon), P7 (Düşmanlık) veya G8 (işbirliği yapamama) ardışık iki değerlendirmesinde puanın >5 (maksimum başlangıç puanı <3 ise) veya >6 (maksimum başlangıç puanı 4 ise) olmasıdır. Primer etkinlik değişkeni, nükse kadar geçen süre olmuştur. Daha önceden planlanmış bir ara analiz (68 nüks olayı yaşandıktan sonra), nükse kadar geçen sürenin, XEPLION ile tedavi edilen hastalarda, plaseboya kıyasla anlamlı derecede daha uzun olduğunu göstermiştir ve etkililiğin devam ettiği gösterildiğinden çalışma erken sonlandırılmıştır. Popülasyon alt gruplarının incelenmesi, cinsiyet, yaş veya ırk temel alınarak tedaviye yanıt açısından klinik olarak anlamlı fark göstermemiştir. 5.2. Farmakokinetik özellikler Genel ÖzelliklerEmilim:Sudaki çözünürlüğünün aşırı düşük olmasına bağlı olarak paliperidon palmitat, intramüsküler enjeksiyondan sonra paliperidona hidroliz olmadan önce yavaşça çözünür ve sistemik dolaşıma absorbe olur. Tek bir intramüsküler enjeksiyonu takiben paliperidonun plazma konsantrasyonları, 13 günlük ortalama tmax süresi içinde yavaş yavaş yükselerek maksimum plazma konsantrasyonlarına yükselir. İlacın salınması, birinci gün kadar erken bir zamanda başlar ve 126 gün kadar sürer. Deltoid kas içine tek doz intramüsküler enjeksiyonunu takiben (25 mg-150 mg), gluteal kas içine enjeksiyonla karşılaştırıldığında ortalama olarak %28 daha yüksek bir Cmax gözlenmiştir. 1. günde 150 mg ve 8. günde 100 mg'ın iki başlangıç deltoid intramüsküler enjeksiyonu, terapötik konsantrasyonlara hızla ulaşılmasına yardımcı olur. XEPLION'un salım profili ve doz rejimi, terapötik konsantrasyonların devam etmesini sağlamaktadır.100 mg'lık XEPLION dozu için ortalama kararlı durum doruk noktası: iki dalga arasındaki çukur oranı, gluteal uygulamayı takiben 1.8 ve deltoid uygulamayı takiben 2.2 olmuştur. 25 mg-150 mg'lık doz aralığında XEPLION uygulamasını takiben paliperidonun görünen ortalama yarılanma ömrü 25 ile 49 gün arasında değişmiştir. Paliperidon palmitat uygulamasını takiben paliperidonun (+) ve (-) enantiyomerleri birbirine dönüşür ve yaklaşık olarak 1.6-1.8'lik bir EAA (+)/(-) oranına ulaşır. Dağılım:Popülasyon analizine göre paliperidonun görünen dağılım hacmi 391 litredir. Rasemik paliperidon plazma proteinine %74 oranında bağlanır. Biyotransformasyon:1 mg hızlı salımlı 14C-paliperidonun tek bir oral dozunun uygulanmasından 1 hafta sonra, dozun %59'u idrarla değişmeden atılmıştır. Bu durum, paliperidonun karaciğerde ileri derecede metabolize olmadığını göstermektedir. Hiçbirisi verilen dozun %6.5'inden fazlasını kapsamayan in vivoIn vitroin vivoin vitroçalışmalar, paliperidonun, CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 ve CYP3A5'i içeren sitokrom P450 izoenzimleri tarafından metabolize edilen ilaçların metabolizmasını büyük ölçüde inhibe etmediğini göstermiştir.In vitroIn vivoveriler yoktur ve klinik ilişki bilinmemektedir.Eliminasyon:1 mg hızlı salımlı 14C-paliperidonun tek bir oral doz uygulanması ile verilen radyoaktivitenin yaklaşık %80'i idrarda ve %11'i feçeste bulunmuştur. Doğrusallık/Doğrusal olmayan durum:XEPLION uygulamasını takiben toplam paliperidon maruziyeti, 25 mg-150 mg'lık doz aralığının üzerinde dozla orantılı olmuştur ve 50 mg'ı aşan dozlarda Cmax için dozla-orantıdan düşüktür. Uzun etkili paliperidon palmitat enjeksiyonu ile oral uzatılmış salımlı paliperidonun karşılaştırılmasıXEPLION, paliperidonu ayda bir uygulamak üzere tasarlanmıştır. Uzatılmış salımlı oral paliperidon ise günde bir kere uygulanır. Şekil 1, önerilen başlangıç rejimi kullanılarak XEPLION uygulamasını takiben 5 hafta süre ile paliperidonun ortanca farmakokinetik profilini, oral uzatılmış salımlı tablet (6 mg veya 12 mg) uygulaması ile karşılaştırmalı olarak sunmaktadır. XEPLION'un başlangıç rejimi (1. gün/8. günde deltoid kas içine 150 mg/100 mg), tedaviyi oral destek kullanmaksızın başlatırken kararlı durum paliperidon konsantrasyonlarına hızla ulaşmak üzere tasarlanmıştır. 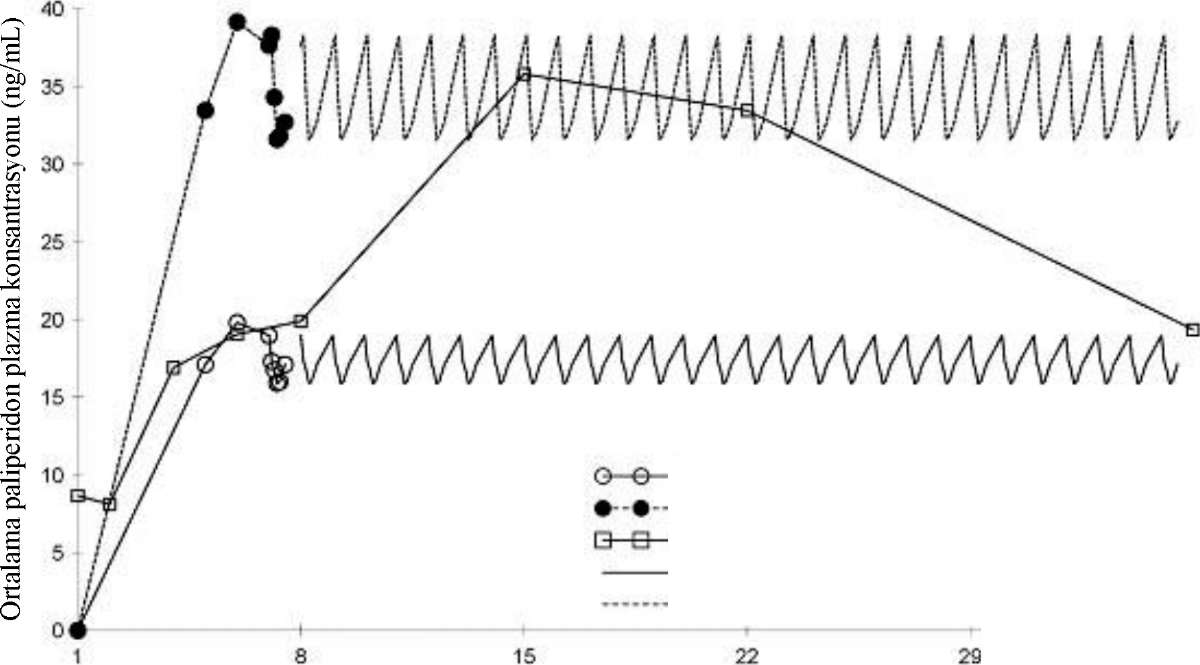 >Oral 6 mg paliperidon Oral 12 mg paliperidon QXEPL1ON
>Oral 6 mg paliperidon Oral 12 mg paliperidon QXEPL1ON- Hesaplanan oral 6 mg kararlı durum ' Hesaplanan oral 12 mg kararlı durum 36Zaman (gün) Şekil 1.Oral uzatılmış salımlı tabletin (6 mg veya 12 mg) günlük uygulaması ile karşılaştırmalı olarak önerilen başlangıç rejimi kullanılarak (1.gün/8.günde deltoid kas içine 150 mg/100 mg paliperidona eşdeğer paliperidon palmitat ile başlangıç) XEPLION'un uygulamasını takiben 5 hafta süre ile paliperidon için ortalama farmakokinetik profillerini takiben ortalama plazma konsantrasyonu-zaman profilleri.Genel olarak, XEPLION ile gözlenen genel başlangıç plazma düzeyleri, 6 mg-12 mg uzatılmış salımlı oral paliperidon ile gözlenen maruziyet sınırları içinde bulunmuştur. XEPL1ON başlangıç rejiminin kullanılması, en düşük değerlerin görüldüğü doz öncesi günlerde bile (8. gün ve 36. gün) hastaların, 6 mg-12 mg uzatılmış salımlı oral paliperidonun bu maruziyet penceresinde kalmalarını sağlamıştır. XEPL1ON uygulamasını takiben paliperidon farmakokinetiği için gönüllüler arasında değişkenlik, uzatılmış salımlı oral paliperidon tabletlerinde belirlenen değişkenliğe göre daha az bulunmuştur. İki ürün arasındaki ortanca farmakokinetik profillerindeki fark nedeni ile farmakokinetik özelliklerini direkt olarak karşılaştırılırken dikkatli olmak gerekir. Hastalardaki karakteristik özelliklerKaraciğer yetmezliği:Paliperidon, karaciğerde yaygın şekilde metabolize edilmemektedir. XEPLION, karaciğer yetmezliği olan hastalarda incelenmemiş olmasına rağmen, hafif veya orta derece karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Orta derecede karaciğer yetmezliği olan (Child-Pugh sınıf B) hastalarda oral paliperidon ile yapılan bir çalışmada, serbest paliperidonun plazma konsantrasyonu, sağlıklı deneklerle benzerdir. Paliperidon, ağır karaciğer yetmezliği olan hastalarda incelenmemiştir. Böbrek yetmezliği:Hafif böbrek yetmezliği olan hastalarda XEPLION dozu azaltılmalıdır. XEPLION'un, orta veya ağır böbrek yetmezliği olan hastalarda kullanılması önerilmez (Bkz. Bölüm 4.2). Değişik derecelerde böbrek yetmezliği olan deneklerde, tek bir oral 3 mg uzatılmış salımlı tablet paliperidon dozunun dağılımı incelenmiştir. Paliperidon eliminasyonu, azalan kreatinin klerensi ile birlikte azalmıştır. Paliperidonun toplam klerensi, bozulmuş böbrek fonksiyonu olan hastalar arasında hafif böbrek yetmezliğinde (CrCl =50 - <80 ml/dak) ortalama %32, orta böbrek yetmezliğinde (CrCl= 30 - <50 ml/dak) ortalama %64 ve ağır böbrek yetmezliğinde (CrCl=10 - <30 ml/dak) ortalama %71 azalmıştır. Bu durum sağlıklı deneklerle karşılaştırıldığında, maruziyette (EAAinf) sırası ile 1.5, 2.6 ve 4.8 kat ortalama artışa denk düşer. Hafif böbrek yetmezliği olan deneklerde XEPLION ile sınırlı sayıda gözleme ve farmakokinetik simülasyonlara göre, hafif böbrek yetmezliği olan hastalarda önerilen XEPLION başlangıç dozu tedavinin birinci gününde 100 mg'lık doz ve bir hafta sonra 75 mg'dır; daha sonra ayda bir (4 haftada bir) 50 mg'lık enjeksiyonlarla devam edilir (Bkz. Bölüm 4.2). Yaşlılarda:Sadece yaşa bağlı dozaj ayarlaması önerilmez. Ancak, kreatinin klerensinde yaşla ilgili azalma nedeni ile doz ayarlaması gerekli olabilir (Bkz. Bölüm 5.2 ve Bölüm 4.2). Irk:Oral paliperidon ile yapılan çalışmaların popülasyon farmakokinetiği analiz verileri, XEPLION uygulamasını takiben paliperidonun farmakokinetiğinde ırka bağlı farklılıkların kanıtını göstermemiştir. Cinsiyet:Erkekler ve kadınlar arasında klinik olarak anlamlı fark gözlenmemiştir. Sigara kullanım durumu:İnsan karaciğer enzimleri kullanılan in vitroin vitrobulgularla uyumlu olarak popülasyon farmakokinetik değerlendirmesi, sigara kullananlar ile kullanmayanlar arasında herhangi bir fark ortaya koymamıştır.5.3. Klinik öncesi güvenlilik verileriToksikolojiOral uygulanan paliperidonun yanı sıra, dopamin D2 reseptörlerini antagonize eden diğer ilaçlarda olduğu gibi intramüsküler olarak uygulanan paliperidon palmitat tekrarlanan-doz toksisitesi çalışmalarında serum prolaktin düzeylerini yükseltmiştir. Karsinojenisite İntramüsküler olarak enjekte edilen paliperidon palmitatın karsinojenik potansiyeli sıçanlarda değerlendirilmiştir. 10, 30 ve 60 mg/kg/ay'lık dozlarda dişi sıçanlarda meme bezi adenokarsinomlarında istatistiksel olarak anlamlı bir artış olmuştur. Erkek sıçanlarda, XEPLION'un mg/kg esas alınarak 150 mg'lık maksimum önerilen insan dozunun 1.2 ve 2.2 katı olan 30 ve 60 mg/kg/ay'lık dozlarda meme bezi adenomları ve karsinomlarında istatistiksel olarak anlamlı bir artış görülmüştür. Risperidonun aktif bir metaboliti olan oral paliperidonun karsinojenik potansiyeli, farelerde ve sıçanlarda yürütülen risperidon çalışmalarına göre değerlendirilmiştir. Risperidon, farelere 18 ay süre ile ve sıçanlara 25 ay süre ile 10 mg/kg/gün şeklinde uygulanmıştır. Hipofiz bezi adenomları, endokrin pankreas adenomları ve meme bezi adenokarsinomlarında istatistiksel olarak anlamlı artışlar olmuştur. Diğer antipsikotik ilaçların kronik olarak uygulanmasından sonra, kemirgenlerde meme, hipofiz ve endokrin pankreas tümörlerinde bir artış saptanmış ve bu artışın uzatılmış dopamin D2 antagonizmasına bağlı olduğu düşünülmüştür. Kemirgenlerde bu tümör bulgularının insan riski ile ilişkisi bilinmemektedir. Mutajenisite Ames ters mutasyon testinde, fare lenfoma tayininde ve sıçan mikronükleus testinde paliperidonun mutajenik potansiyeli ile ilgili bulgu saptanmamıştır. Paliperidon palmitat, Ames ters mutasyon testinde veya fare lenfoma tayininde genotoksik özellikler göstermemiştir. Fertilitede bozukluk Oral paliperidon tedavisi, prolaktin- ve santral sinir sistemi- aracılı etkiler ile sonuçlanmış olmasına rağmen, erkek ve dişi sıçanların fertilitesi etkilenmemiştir. Maternal olarak toksik bir dozda, dişi sıçanların canlı embriyo sayısında hafif bir düşüş göstermiştir. 6. FARMASÖTİK ÖZELLİKLER6.1.Yardımcı maddelerin listesiPolisorbat 20Polietilen glikol 4000 Sitrik asit monohidrat Anhidr disodyum hidrojen fosfat Sodyum dihidrojen fosfat monohidrat Sodyum hidroksit Enjeksiyonluk su 6.2.GeçimsizliklerGeçimlilik ile ilgili çalışma yapılmadığından, bu tıbbi ürün başka tıbbi ürün veya seyreltici ile karıştırılmamalı, intramüsküler uygulama direk olarak kit içindeki enjektörden yapılmalıdır.6.3.Raf ömrü24 ay6.4.Saklamaya yönelik özel tedbirler25°C altındaki oda sıcaklığında saklayınız.6.5.Ambalajın niteliği ve içeriği 150 mg (1,50 ml) paliperidon (234 mg paliperidon palmitata eşdeğer) süspansiyonu ile kullanıma hazır piston tıpalı ve uç başlıklı (bromobutil lastik) bir enjektör (siklik-olefin-kopolimeri), merkezi mavi renkli bir güvenlik iğnesi ve merkezi gri renkli bir güvenlik iğnesi içeren kit6.6.Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj Atıklarının Kontrolü Yönetmelik"lerine uygun olarak imha edilmelidir.Kit, intramüsküler enjeksiyon için kullanıma hazır enjektör ve 2 güvenlik iğnesi içerir. Kullanıma hazır enjektör
M
ö
Uç başlığı
1. Homojen bir süspansiyon sağlamak için enjektörü en az 10 saniye kuvvetli bir şekilde çalkalayınız.  2. Uygun iğneyi seçiniz.
2. Uygun iğneyi seçiniz.DELTOİD enjeksiyon için hasta 90 kg'dan hafif ise merkezi mavi renkli iğne; hasta 90 kg veya daha ağır ise merkezi gri renkli iğne seçilir. GLUTEAL enjeksiyon için merkezi gri olan iğne kullanınız. 3. Enjektörü dik olarak tutarken lastik uç başlığını saat yönünde çevirerek çıkarınız.  4. Güvenlik iğnesinin kabını yarıya kadar sıyırınız. Plastik sıyırma kabını kullanarak iğne kılıfını kavrayınız. Güvenlik iğnesini enjektörün cam şırınga bağlantısına saat yönünde çevirerek takınız.
4. Güvenlik iğnesinin kabını yarıya kadar sıyırınız. Plastik sıyırma kabını kullanarak iğne kılıfını kavrayınız. Güvenlik iğnesini enjektörün cam şırınga bağlantısına saat yönünde çevirerek takınız.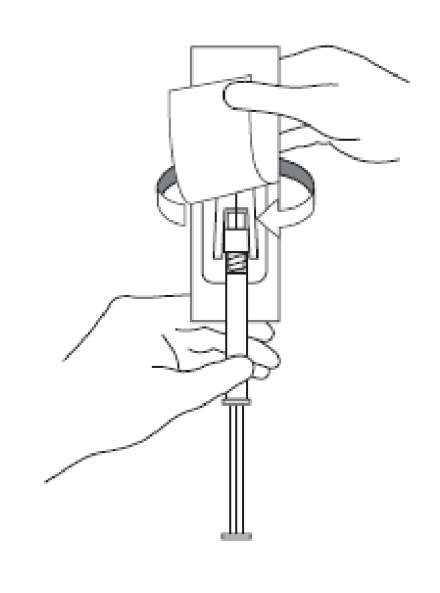 5. İğnenin kılıfını düz bir şekilde çekerek iğneden ayırınız. İğne gevşeyerek enjektörden çıkabileceği için kılıfı bükmeyiniz.
5. İğnenin kılıfını düz bir şekilde çekerek iğneden ayırınız. İğne gevşeyerek enjektörden çıkabileceği için kılıfı bükmeyiniz.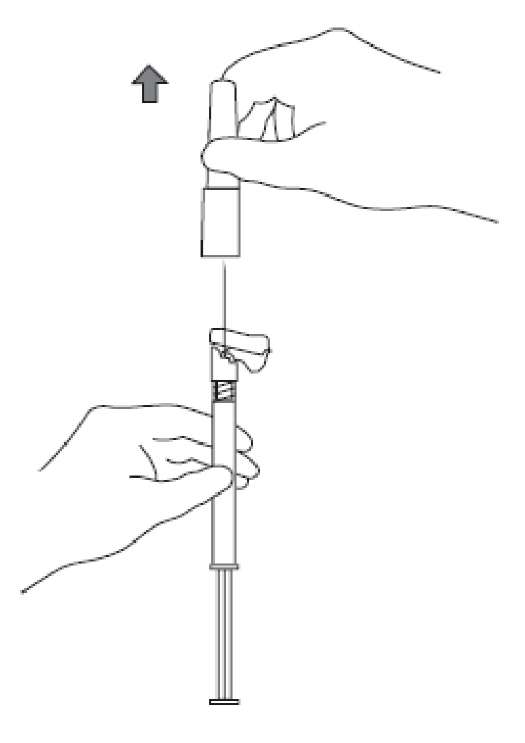 6. Havasını gidermek için, takılmış olan iğne ile birlikte enjektörü dik pozisyona getiriniz. Piston çubuğunu dikkatli bir şekilde ileri iterek enjektörün havasını gideriniz.
6. Havasını gidermek için, takılmış olan iğne ile birlikte enjektörü dik pozisyona getiriniz. Piston çubuğunu dikkatli bir şekilde ileri iterek enjektörün havasını gideriniz.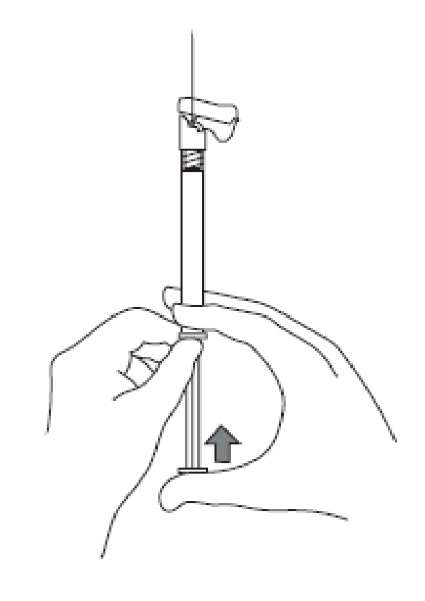 7. Enjektör içeriğinin tamamını hastanın seçilen deltoid veya gluteal kası içine intramüsküler olarak enjekte ediniz.
7. Enjektör içeriğinin tamamını hastanın seçilen deltoid veya gluteal kası içine intramüsküler olarak enjekte ediniz.İntravasküler veya subkutan olarak uygulamayınız.Enjeksiyon tamamlandıktan sonra iğne koruma sistemini etkinleştirmek için baş parmağınızı veya bir parmağınızı (8a, 8b) veya düz bir yüzeyi kullanınız. 'Klik' sesi duyulduğu zaman iğne koruma sistemi tam olarak etkinleşmiştir. İğne ile birlikte enjektörü uygun şekilde atınız.8a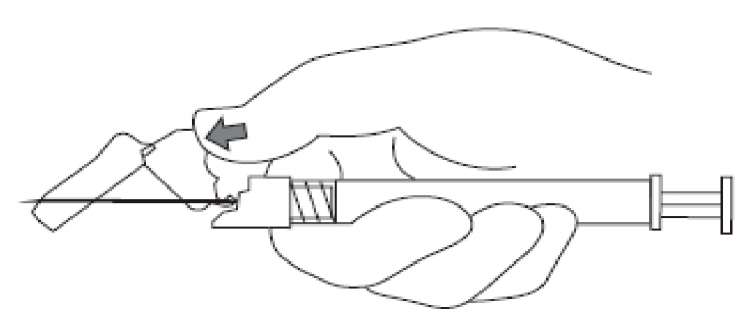
8b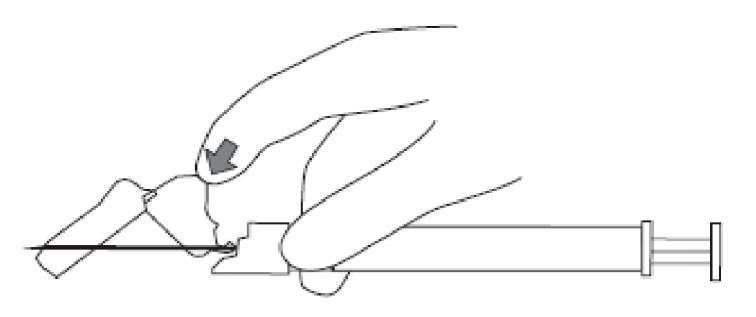
8c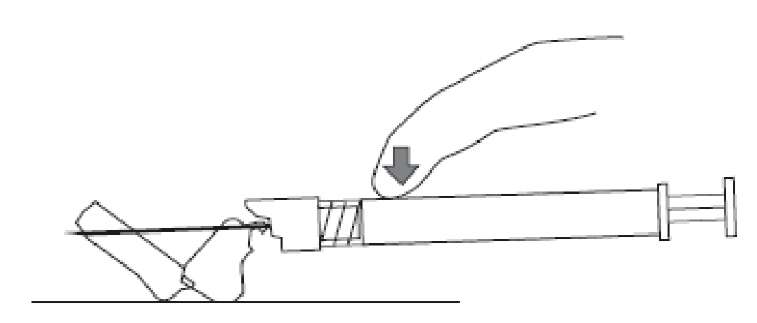
7. RUHSATSAHİBIJohnson and Johnson Sıhhi Malzeme San. ve Tic. Ltd. Şti., Kavacık Mahallesi Ertürk Sokak Keçeli Plaza No:13 Kavacık, Beykoz-İstanbul Tel: 0 216 538 20 00 Faks: 0 216 538 23 698.RUHSAT NUMARASI131/929.İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 11.08.2011 Ruhsat yenileme tarihi:10.KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriXeplion 150mg/1.5ml IM Uzun Salımlı Süspansiyon İçeren Kullanıma Hazır EnjektörEtken Maddesi: Paliperidon palmitat Atc Kodu: N05AX13 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.