Prosalid 5mg/ml subkütan enjeksiyon için çözelti içeren Flakon Kısa Ürün BilgisiAntineoplastik ve İmmünomodülatör Ajanlar » Hormonal Tedavi İlaçları » Hormonlar » Gonadotropin Salgılatıcı Hormon Analogları » Leuprorelin Asetat KISA URUN BILGISI1. BEŞERİ TIBBİ ÜRÜNÜN ADIPROSALİD 5 mg/ml subkütan enjeksiyon için çözelti içeren flakon2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:PROSALİD subkütan enjeksiyon için çözelti, her 0.2 ml'de 1 mg leuprolide asetat içerir.Yardımcı maddeler:Tonisite ayarı için sodyum klorür, koruyucu olarak 6.30 mg/ml benzil alkol, sodyum hidroksit ve asetik asit, enjeksiyonluk su3. FARMASÖTİK FORMSubkütan enjeksiyon için çözelti içeren flakon.Renksiz, kokusuz, partikül içermeyen, pH değeri 5,0 - 7,0 aralığmda, berrak çözelti. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarıLeuprolide Asetat Enjeksiyonu, yardımla üreme teknikleri uygulamaları sırasında yumurtalıkların kontrollü olarak uyarılmasında ve hormonal müdahaleye uygun prostat kanserinde kullanılır.Prostat kanseriLeuprolide asetatın subkütan 1 mg/gün dozunun; 3 mg/gün dozundaki DES (dietilstilbestrol) ile karşılaştınidığı, kontrollü bir klinik çalışmada, 2 yıllık tedavi sonrasında, yaşama oranlan her iki grup için benzerdir. Tedaviye alınan objektif yanıt da, her 2 grupta benzer bulunmuştur. 4.2 Pozoloji ve uygulama şekli GenelBaşlangıç dozu genel olarak 0.5-1 mg/gün arasında değişmektedir.Prostat kanseriÖnerilen doz, günde bir defa subkütan olarak uygulanan 1 mg'dır (0.2 mİ). Yardımla üreme teknikleri uygulamasıBaşlangıç dozu genel olarak 0.5-1 mg/gün arasında değişmektedir. Uzun protokol:Leuprolide asetata tedavi siklusundan bir önceki siklusun midluteal fazında veya tedavi siklusunun erken foliküler fazında, her hastanın ihtiyacına göre subkütan 0.5 - 1.0 mg/gün dozunda başlanır. 10-14 günde pitütier desensitizasyon sağlanır. Östradiaol seviyelerinde gereken düşme (< 30 pg/ml) sağlandıktan sonra gonadotropinlerle birlikte hCG enjeksiyonu yapılacak güne kadar devam edilir. Tedavinin süresi yumurtalıkların eksojen gonadotropinler ile uyarılmaya verdiği cevaba bağlı olarak 24 ile 28 gün arasında değişebilir.Kısa protokol (flare up protokolü):Leuprolide asetata tedavi siklusunun erken foliküler fazında, her hastanın ihtiyacına göre genel olarak subkütan 0.5 -1.0 mg/gün dozunda başlanır. 3. günde tedaviye gonadotropinler eklenir ve leuprolide asetata hCG enjeksiyonu yapılacak güne kadar devam edilir.Tedavinin süresi eksojen gonadotropinler ile uyanimaya yumurtalıkların verdiği cevaba bağlı olarak 12 ile 14 gün arasında değişebilir. Her iki protokolde de eksojen gonadotropinler ile uyanya başlandığında, leuprolide asetat dozu yarıya indirilebilir. Ultra kısa protokol:Leuprolide asetat adet siklusunun 2, 3, ve 4. günlerinde olamk üzere sadece 3 gün verilir.Enjeksiyon yeri periyodik olarak değiştirilmelidir. KULLANMA TALİMATI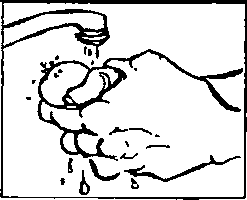 . Elinizi sabun ve su ile iyice yıkayınız.
. Elinizi sabun ve su ile iyice yıkayınız.2. Yeni bir flakonu ilk defa kullanıyorsanız, plastik kapağı çıkartınız. Flakonu her kullanışınızda kauçuk tıpa ve metal kapağı alkolle siliniz. Flakonun içindeki çözeltiyi kontrol ediniz. Berrak değilse veya içinde partiküller varsa, KULLANMAYINIZ. Eczanenizden yeni bir flakonla değiştiriniz. 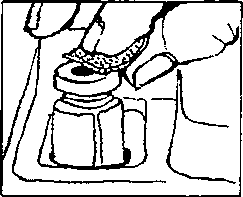 3. Enjektörü ambalajından çıkartınız. 1 mg için pistonu, pistonun ucu 0.2 mİ işaretinde oluncaya kadar geri çekiniz. 0.5 mg için pistonu, pistonun ucu 0.1 mİ işaretinde oluncaya kadar geri çekiniz. 4. İğnenin kılıfını çıkartınız ve iğneyi şişenin kauçuk tıpasının ortasından sokup, itiniz.  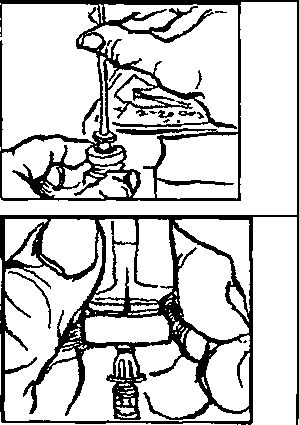 5. Şişeye hava verecek şekilde, pistonu itiniz. 6. İğneyi flakonda tutarak, flakonu ters çeviriniz. İğnenin ucunun sıvının içinde olduğundan emin olunuz. Enjektör doluncaya kadar, pistonu yavaş yavaş çekiniz. 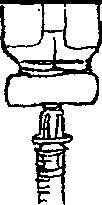 7. İki haftalık sürenin sonuna doğru, flakondaki ilaç miktarı azalmış olacaktır. Flakonu düz tutmaya ve ilacı çekerken iğnenin çözelti içinde olmasına özen gösteriniz. 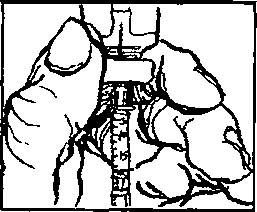 8. İğneyi flakonda ve flakonu ters vaziyette tutarken, enjektörde hava kabarcığı olup olmadığını kontrol ediniz. Eğer varsa, pistonu yavaşça iterek, hava kabarcıklarını gideriniz. İğnenin ucunu sıvıda tutarken, pistonu tekrar geri çekerek doldurunuz. 9. Hava kabarcıklannı gidermek için, gerekirse aynı işlemi tekrarlayınız. İğneyi şişeden çıkartınız ve enjektörü enjektör kutusuna koyunuz. İĞNEYE DOKUNMAYINIZ VE İĞNEYİ HİÇ BİR YERE DEĞDİRMEYİNİZ. 10. Cildin korunması için, her gün başka bir yere enjeksiyon yapınız. 11. Enjeksiyon yerini alkollü tamponla siliniz. 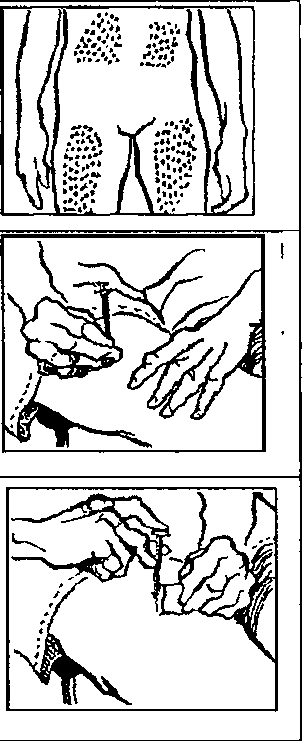 12. Enjektörü bir kalem gibi tutarak, 90°'lik açı ile size öğretilen şekilde enjeksiyonu yapınız. 13. İğnenin girdiği yeri alkollü pamukla bastırarak, iğneyi aynı açı ile geri çekiniz. 14. Enjektörler bir defalık kullanıma mahsustur. Her defasında yeni bir enjektör kullanınız. 4IÇB1R ZAMAN ENJEKTÖRÜ, İĞNELERİ VE İLACI ÇOCUKLARIN ULAŞABİLECEĞİ YERLERDE BIRAKMAYINIZ. Özel popülasyoniara ilişkin ek bilgiler Böbrek/karaciğer yetmezliği Böbrek ve karaciğer yetmezliğinde kullanımı için herhangi bir veri yoktur. Geriyatrik popülasyon Yaşlı hastalarda kullanımına dair herhangi bir veri yoktur. 4.3 Kontrendikasyonlar PROSALİD Enjeksiyonu, leuprolide asetat veya benzer nonapeptidlere, ya da yardımcı maddelerden herhangi birine karşı bilinen aşın duyarlılığı olan kişilerde kontrendikedir. İzole anaflaksi vakaları rapor edilmiştir. Leuprolide asetat, gebelerde veya ilacı alırken gebe kalabilecek kadınlarda kontrendikedir. Kesin tanısı konulmamış vajinal kanamalı hastalarda leuprolide asetat kullanılmamalıdır. 4.4 Özel kullanım uyarıları ve önlemleri GenelTedavinin başlangıcında, ilacın doğal uyancı etkisinden dolayı gonadotropin ve seks streiodleri başlangıç noktasının üstüne çıkar. Bu yüzden belirtilerdeki artışlar yakından takip edilmelidir.( bknz bölüm 5.1)Tedavinin ilk haftalarında önceden mevcut semptom ve belirtilerde kötüleşme olabilir. Semptomların kötüleşmesi ölümcül komplikasyonla birlikte olan ya da olmayan bir paraliziye katkıda bulunabilir. Leuprolide asetatın gebelikte emniyetli kullanımı klinik olarak tespit edilmemiştir. Leuprolide asetat tedavisine başlamadan önce, hastanın gebe olup olmadığının tespit edilmesi önerilir. Leuprolide asetat kontraseptif (gebelik önleyici) değildir. Hamileliğin önlenmesi gerekiyorsa, hormonal olmayan bir metodla korunma sağlanmalıdır. Kemik mineral yoğunluğu:Kadınlarda her türlü hipoöströjenik durum sırasında ve erkeklerde prostat kanserinde uzun süreli kullanımda kemik mineral yoğunluğu değişiklikleri görülebilir. Erkeklerde, leuprolide asetatın kesilmesinden sonra geri dönüşüm ile ilgili herhangi bir veri yoktur. Kadınlarda, kemik mineral yoğunluğu kaybı leuprolide asetatın kesilmesinden sonra geri dönüşümlü olabilirKonvülsiyonlar:Kadın:Yardımla üreme teknikleri uygulamasıÖver kist stimülasyonu:Polikistik över sendromu: Polikistik över sendromu bulunan hastalarda serum östradiol seviyeleri 35 pg/ml altına düşecek şekilde hipofız baskılandığı sürece, çapı 20mm'den büyük kistlerin leuprolide asetat tedavisi için bir kontrendikasyon teşkil etmediği bulunmuştur. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Kadmlardaki yan etkilerin özeti | ||
Sistem, Organ Smıfı |
Sıklık |
Yan etkiler |
|
Enfeksiyonlar |
Yaygın |
Vajinit |
|
Psikiyatrik rahatsızlıklar |
Yaygın |
Depresyon Libido azalması |
|
Üreme sistemi ve göğüs rahatsızlıkları |
Yaygın Seyrek |
Göğüs ağrısı Göğüs hassasiyeti Göğüs boyutlannda küçülme Vajinal kuruluk Cinsel ilişki sırasında ağrı |
|
Genel rahatsızlıklar ve uygulama bölgesi sorunları |
Seyrek |
Tahriş |
Prostat kanseri
|
Erkeklerdeki yan etkilerin özeti | ||
|
Sistem, Organ Sınıfı |
Sıklık |
Van etkiler |
|
Psikiyatrik rahatsızlıklar |
Seyrek |
Libido a/alması |
|
Üreme sistemi ve göğüs rahatsızlıkları |
Yaygın Seyrek |
Testis atrofısi Erektil disfonksiyon Jinekomasti |
|
Genel yan etkilerin özeti | ||
|
Sistem, Organ Sınıfı |
Sıklık |
Yan etkiler |
|
Kan ve lenf sistemi rahatsızlıkları |
Seyrek |
Lökopeni Anemi Trombositopeni Eritrositoz |
|
Bağışıklık sistemi rahatsızlıkları |
Seyrek |
Anafılaktik reaksiyon |
|
Metabolizma ve beslenme rahatsızlıkları |
Seyrek |
Şeker hastalığı Hiperkalemi Anoreksi Yeme bozuklukları |
|
Psikiyatrik rahatsızlıklar |
Yaygın Seyrek |
Ruh hali değişiklikleri Uykusuzluk |
|
Sinir sistemi rahatsızhklan |
Yaygın Seyrek |
Baş ağrısı Baş dönmesi Parestezi Zihinde kanşıkhk |
|
Kulak ve labirent rahatsızhklan |
Seyrek |
İşitme kaybı Çınlama |
|
Kalp rahatsızlıkları |
Seyrek |
Anjina pektoris Taşikardi Aritmi |
|
Vasküler rahatsızlıklar |
Yaygın Seyrek |
Sıcak basması İskemi Hipertansiyon |
|
Solunum, torasik ve mediastinal rahatsızlıklar |
Yaygın |
Dispne |
|
Mide ve barsak rahatsızlıkları |
Yaygın Seyrek |
Kusma Bulantı İshal Kabızlık Stomatit Ağızda kuruluk |
|
Karaciğer ve safra rahatsızlıkları |
Seyrek |
Sanlık |
|
Deri ve deri altı doku rahatsızlıkları |
Yaygın Seyrek |
Döküntü Akne Terleme Dermatit Kaşıntı Hirsutizm Alopesi Tırnak bozuklukları |
|
Müsküloskeletal, bağ dokusu ve |
Yaygın |
Miyalji |
|
kemik rahatsızlıkları |
|
Artropati |
|
|
Seyrek |
Müsküloskeletal ağrı Bel ağnsı Kemik ağnsı Eklem ağnsı Kas sertleşmesi |
|
Renal ve üriner rahatsızlıklar |
Seyrek |
Miktürisyon bozuklukları Sık idrara çıkma Hematüri |
|
Genel rahatsızlıklar ve uygulama |
Yaygın |
Ağn |
|
bölgesi sorunları |
|
Ödem Halsizlik Yorgunluk Enjeksiyon bölgesinde ağn, iltihap, steril apse, skleroz ve hematom gibi lokal reaksiyonlar |
|
|
Seyrek |
Göğüste baskı hissi Ateş Üşüme Susama |
|
Diğer |
Seyrek |
EKG değişiklikleri Hepatik değerlerde transaminaz ve fosfataz artışı gibi değişiklikler Bilirubin, trigliserid ve ürik asid değerlerinde artış Kilo alma |
I
Pazarlama Sonrası Gözlem
Leuprolide asetat enjeksiyonun bu ya da başka formulasyonlan ile aşağıdaki yan etkiler gözlenmiştir Leuprolide birden çok endikasyonu, dolayısıyla birden çok hasta popülasyonu olduğu için, bu yan etkilerin tümü her hastada görülmeyebilir. Bu yan etkilerin çoğunluğu kullanılan ilaç ile ilişkilendirilmiştir.Tüm vücut:Kardiyovasküler sistem:
Anjina, bradikardi, kalp ritim bozukluğu, konjestif kalp yetersizliği, EKG değişiklikleri/ iskemi, hipertansiyon, hipotansiyon, üfürüm, miyokard enfarktüsü, flebit, akciğer embolisi, inme/geçici hafıza kaybı, taşikardi, trombosis, geçici iskemik atak, varisSindirim sistemi:
Kabızlık, diyare, ağız kuruluğu, duodenum ülseri, disfaji, gastrointestinal kanama, gastrointestinal bozukluk, hepatik disfonksiyon, iştah artışı, anormal karaciğer fonksiyon testleri, bulantı, peptik ülser, rektal polipler, susama, kusmaEndokrin sistem:
Diyabet, tiroid büyümesiKan ve lenf sistemi:
Anemi, ekimoz, lenf ödem, protrombin zamanı artışı, parsiyel tromboplastin zamanı artışı, trombositopeni, lökopeni, lökositozMetabolizma ve beslenme:Kas ve iskelet sistemi:
Ankilozan spondilit, eklem bozuklukları, eklem ağrısı, miyalji, pelvik fıbroz, omurga kırıkları, felç, tenosmovit semptomlarıSinir sistemi:
Anksiyete, delüzyonlar, depresyon, sersemlik, hipoestezi, uykusuzluk, letarji, libido artışı, baş dönmesi, hafıza bulanıklığı, ruh hali değişiklikleri, sinirlilik, nöromüsküler bozukluklar, uyuşukluk, parestezi, periferal nöropati, uyku bozukluklan, konvülsiyonSolunum sistemi:
Öksürük, dispne, burun kanaması, hemoptizi, farenjit, plevral efüzyon, plevral friksiyon, pnömoni, akciğer fibrozu, akciğer infiltrasyonu, solunum bozuklukları, sinüs konjesyonu, İntersitisyel akciğer hastalığıDeri ve ekleri:Duyu organları:
Anormal görme, ambliyopi, bulanık görme, göz kuruluğu, duyma bozukluğu, oftalmolojik bozukluklar, tat alma bozukluklan, kulak çınlamasıÜrogenital sistem:
Mesane spazmları, göğüs ağrısı, göğüs hassasiyeti, jinekomasti, hematüri, inkontinans, anormal ve sürekli vajinal kanama dahil olmak üzere menstrual bozukluklar, penis şişmesi, penis bozuklukları, prostat ağnsı, testis atrofisi, testis ağnsı, testis boyutunda azalma, üriner bozukluklar, sık idrar yapma, üriner obstrüksiyon, üriner kanal enfeksiyonu, aciliyet İzole anafılaksi vakalan raporlanmıştır.Ağrı, enflamasyon, steril apse, endurasyon ve hematom dahil olmak üzere enjeksiyon yeri reaksiyonları görülmüştür.
GnRH analogları ile prostat kanseri tedavisi gören hastalarda çok seyrek olarak intihar düşüncesi ve girişimleri raporlanmıştır.
Bu sınıftaki diğer ajanlar gibi, pitüiter adenomu olan hastalarda ilk kullanım sonrasında çok seyrek de olsa pitüiter apopleksi raporlanmıştır.
Kadınlar:
Derin ven trombozu, pulmoner emboli, miyokard enfarktüsü, inme ve geçici iskemik atak vakaları da dahil olmak üzere çeşitli ciddi venöz ve arteriyal tromboemboli vakalan bildirilmiştir. Bazı vakalarda zamansal ilişkiler bildirilmiş olsa da, vakaların çoğuna risk faktörleri ya da eşzamanlı ilaç kullanımı konunun karmaşıklaşmasına neden olmaktadır. GnRH agonistlerinin kullanımıyla bu olaylar arasında bir neden-sonuç ilişkisi olup olmadığı bilinmemektedir.
4.9 Doz aşımı ve tedavisi
Klinik uygulamada, leuprolide asetat depo süspansiyonu ile doz aşımı görülmemiştir. Tavsiye edilen tedavi dozunun yaklaşık 133 katma kadar dozların uygulandığı hayvan çalışmalarında, dispne, aktivite azalması ve enjeksiyon yerinde lokal iritasyon görülmüştür. Doz aşımı durumunda hasta yakından izlenmeli ve semptomatik ve destekleyici tedavi uygulanmalıdır.5. FARMAKOLOJİK ÖZELLİKLER
PROSALİD enjeksiyonu, günde bir defa subkütan enjeksiyon yoluyla kullanılmak üzere hazırlanmış, steril, akıcı bir çözeltidir.Leuprolide asetat, doğal olarak var olan gonadotropin serbestleştirici hormonun (GnRH veya LH-RH) sentetik bir nonapeptid analogudur. Kimyasal yapı olarak steroidlerle ilişkili değildir ve doğal hormondan daha büyük bir potense sahiptir.
5.1 Farmakodinamik özellikleri
Farmakoterapötik grup: Gonadotropin serbestleştirici hormon (GnRH) analogları ATC Kodu: L02AE02Bir GnRH agonisti olan leuprolide asetat, sürekli ve terapötik dozlarda verildiğinde gonadotropin sekresyonunun güçlü bir inhibitörüdür. Hayvanlar ve insanlardaki çalışmalar kronik leuprolide asetat uygulamasmm, bir başlangıç stimülasyonunun ardından överler ve testislerlerdeki steroidogenezin supresyonu ile sonuçlandığını göstermiştir. Bu etki, ilaç tedavisi kesildiğinde geri dönüşümlüdür. Leuprolide asetat uygulaması üreme organlarının atrofısi ve bazı hormona bağımlı tümörlerin büyümesinin (Noble ve Dunning erkek sıçanlarda prostat tümörleri ve dişi sıçanlarda DMBA'ya bağlı meme tümörleri) inhibisyonu ile sonuçlanmıştır.
Sıçanlarda leuprolide asetat başlangıçta doğal GnRH'tan 70-80 kat daha etkilidir. Bununla birlikte, tekrarlanan uygulamalarla, testosteron ve östradiol üretimini inhibe eder ve normal fonksiyonlarını sürdürmek için bu steroidlere gereksinimi olan üreme organlan ve ilişkili organların involüsyonuna sebep olur. Çoğu prostat tümörleri, normal prostat ve erkek üreme sisteminin diğer organları gibi androjene bağımlıdır. İnsanlarda, tekrarlanan leuprolide asetat uygulamaları, androjen seviyelerini düşürür ve dolayısıyla, androjen-bağımlı prostat kanserinin tedavisinde orşiektomiye karşı bir alternatif sağlar. İnsanlarda günde subkütan tek doz şeklinde leuprolide asetat uygulaması, luteinizan hormon (LH) ve folikül stimülan hormonun (FSH) dolaşımdaki düzeylerinde, başlangıçta bir artışla sonuçlanır ve gonadal steroidlerin (erkeklerde testosteron ve dihidrotestosteron ve premenopoz dönemindeki kadınlarda östron ve östradiol) düzeylerinde geçici artışa yol açar. Bununla birlikte sürekli günlük leuprolide asetat uygulaması, tüm hastalarda LH ve FSH azalmasıyla sonuçlanır. Erkeklerde testosteron kastrasyon düzeylerine düşer. Premenopoz dönemindeki kadınlarda, östrojenler post-menopoz düzeylerine düşer. Bu hormonal değişiklikler, tavsiye edilen dozlardaki ilaç tedavisinin başlamasından itibaren 2-4 hafta içinde oluşur ve prostat kanserli hastalardaki testosteronun kastrasyon seviyelerinin 5 yıllık periyodlara kadar sürdüğü gösterilmiştir.
5.2 Farmakokinetik özellikler
Leuprolide asetat oral olarak verildiğinde etkili değildir. Subkütan uygulamadaki biyoyararlanım intravenöz uygulamadakine benzerdir. Leuprolide asetatın yaklaşık 3 saatlik plazma yarı ömrü vardır.Dağılım
Sağlıklı erkek gönüllülerde intravenöz bolus uygulamasından sonra leuprolide asetatın ortalama kararlı durum dağılım hacmi, 27 l'dir. in vitro ortamda insan plazma proteinlerine %43 ile %49 oranlarında bağlanır.
İntravenöz uygulanan 1 mg leuprolide bulusundan sonra ortalama sistemik klirens 7.6 1/saat'tir. Terminal eliminasyon yan ömrü, iki kompartmanlı bir model temelinde, yaklaşık üç saattir.
Hayvan çalışmalannda '''C işaretli leuprolide asetatın, daha küçük inaktif peptidlere metabolize olduğu ve bir pentapeptid (Metabolit I), tripeptidler (Metabolit II ve III) ve bir dipeptid (Metabolit IV) oluşturduğu görülmüştür. Bu fragmanlar daha ileri metabolizmaya uğrayabilirler.
Leuprolide asetat depo süspansiyonu verilen prostat kanseri hastalannda majör metabolitin (M-I) plazma konsantrasyonları, doz uygulamasından yaklaşık iki ile altı saat içinde maksimuma ulaşır ve doruk ana ilaç konsantrasyonunun %6'sı civanndadır. Doz uygulamasından bir hafta sonra, plazma ortalama M-I konsantrasyonlan, ortalama leuprolide konsantrasyonlarının yaklaşık %20'sidir.
Hastalara Leuprolide asetat depo süspansiyonu 3.75 mg uygulamasını izleyerek, 27 gün içinde idrarda dozun %5'ten daha azı miktarında ana ilaç ve M-I metaboliti elde edilmiştir.
Hastalardaki karakteristik özelliklerBöbrek/karaciğer yetmezliği
İlacın böbrek yetmezliği olan hastalardaki farmakokinetiği belirlenmemiştir.
İlacın karaciğer yetmezliği olan hastalardaki farmakokinetiği belirlenmemiştir.
5.3 Klinik öncesi güvenlilik verileri
Sıçanlar ve farelerde iki yıllık bir karsinojenisite çalışması yürütülmüştür. İlaç subkütan yoldan yüksek dozlarda uygulandığında (0.6-4.0 mg/kg), 24 ayda benign pitüiter hiperplazi ve benign pitüiter adenomalarda doza bağlı bir artış görülmüştür. Dişilerde pankreas adacık hücresi adenomalarında ve erkeklerde testislerde interstisyel hücreli adenomalarda anlamlı, ancak doza bağlı olmayan bir artış vardı (en yüksek insidans düşük doz grubunda). Farelerde iki yıl süreli 60 mg/kg'a kadar yüksek dozlarda pitüiter anormallik gözlenmemiştir. Hastalar, saptanabilir pitüiter anormallikler bulunmaksızın, üç yıla kadar 10 mg/gün, ve 2 yıl süreyle 20 mg/gün gibi yüksek dozlarla tedavi edilmiştir.
Leuprolide asetat ile bakteriyel ve memeli sistemleri kullanılarak mutajenisite çalışmalan yürütülmüştür. Bu çalışmalarda mutajenik potansiyele yönelik veri bulunmamıştır.
Leuprolide asetatın sıçanlarda ve tavşanlardaki teratojenisitesi değerlendirilmiştir. Gebe sıçanlara, gebeliğin 6. gününden 15. gününe kadar, subkütan enjeksiyon yoluyla serum fizyolojik veya 1, 3, ya da 10 mcg/kg leuprolide asetat uygulandı. En yüksek doz grubundaki hayvanlarda fetal rezorpsiyonlarda dört kat artış bulunurken, kontrol hayvanlannda ve en düşük dozaj grubundakilerde benzer bir insidans bulundu. Yaşayan bütün fetuslar normaldi. Gebe tavşanlara günlük subkütan enjeksiyonlar şeklinde, gebeliğin 6. gününden 18. gününe kadar, serum fizyolojik veya 0.1, 0.3, ya da 1.0 mcg/kg leuprolide asetat uygulandı. İlaç verilen hayvanlarda fetal rezorpsiyon insidansı, kontrol hayvanlarındakinden daha yüksekti, ama yaşayan tüm fetuslar normaldi. Böylelikle, leuprolide asetatın embriyotoksik olduğu, ancak teratojen olmadığı gösterilmiş oldu.
Üreme yeteneği (fertilite):
Erişkinlerde leuprolide asetat ve benzeri analoglar ile yürütülen klinik ve farmakolojik çalışmalarda, 24 haftalık periyodlara kadar sürekli uygulamayı izleyerek ilaca son verildiğinde, fertilite üzerindeki supresyonun tamamen geri dönüşümlü olduğu gösterilmiştir.
6. FARMASÖTİK ÖZELLİKLER
6.L Yardımcı maddelerin listesi
Benzil alkol Sodyum klorür Sodyum hidroksit*
Asetik asit*
Enjeksiyonluk su *pH ayarı için kullanılır.
6.2. Geçimsizlil<lcr
Bilinen bir geçimsizliği yoktur.
6.3 Raf ömrü
Raf ömrü 24 aydır.
6.4. Saklamaya yönelik özel uyanlar
25°C'nin altındaki oda sıcaklığında saklanmalıdır. Donmaya karşı korunmalıdır. Işıktan koruyunuz. Kullanıncaya kadar kutusunda saklayınız.
Açıldıktan sonraki raf ömrü 2 - 8°C de 14 gündür.
6.5. Ambalajın niteliği ve içeriği
Tip 1 cam, renksiz, gri bromobütil lastik tapa, alüminyum başlıklı ve kırmızı flip- off kapaklı 5 mİ' lik flakon.
PROSALİD Enjeksiyonu 2.8 ml'lik çok dozlu flakonlarda satışa sunulmuştur. Her 0.2 mİ, 1 mg leuprolide asetat içerir. Kutunun içinde 14 günlük kullanım için 14 enjektör ve 14 alkollü tampon bulunur.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Özel bir gereklilik yoktur.
Tüm kullanılmayan ürün veya atık maddeler ulusal mevzuat doğrultusunda imha edilmelidir.
Uygulama talimatları için Madde 4.2'ye bakınız.
7. RUHSAT SAHİBİ
Deva Holding A.Ş.
Halkalı Merkez Mah. Basın Ekspres Cad. No:l 34303
Küçükçekmece/İSTANBUL
Tel: 0212 692 92 92
Fax: 0212 697 00 24
8. RUHSAT NUMARASI (LARI)
234/37
9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİ
İlk ruhsatlandırma tarihi: 12.08.2011 Son yenileme tarihi:
10. KÜB'ÜN YENİLENME TARİHİ
İlaç Bilgileri
Prosalid 5mg/ml subkütan enjeksiyon için çözelti içeren Flakon
Etken Maddesi: Leuprolide asetat
Atc Kodu: L02AE02
Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.