Miacalcic nazal sprey Kısa Ürün BilgisiEndokrin Sistem » Kalsiyum Metabolizması » Paratiroid Yüksekliği » Kalsitonin Hormonu » Kalsitonin (Salmon Kalsitonin) KISA URUNBILGISI1.BEŞERI TıBBı ÜRÜNÜNADIMİACALCİC 200 lU nazal sprey2.KALITATIF VE KANTİTATIF BİLEŞİMEtkin madde:Sentetik salmon kalsitonini2200 lU/mlBir Uluslararası Birim (= IU) yaklaşık 0.2 mcg sentetik salmon kalsitoninine karşılık gelir. Her sprey şişesi en az 14 ölçülü doz içerir; her sıkım 200 IU'lik dozlara tekabül eder. Yardımcı maddeler:Yardımcı maddeler için 6.1'e bakınız.3.FARMASÖTIK FORMNazal sprey çözeltisi.Her sıkımda 200 IU salmon kalsitonini uygulayan, bir ölçme pompası takılı, en az 14 ölçülü doz içeren nazal sprey çözeltisi. 4.KLİNİK ÖZELLIKLER4.1.Terapötik endikasyonlarMİACALCİC,Postmenapozal osteoporoz tedavisi, Sudek hastalığı veya Algodistrofi tedavisinde endikedir. 4.2.Pozoloji ve uygulama şekliMİACALCİC nazal spreyin her sıkımda farklı bir burun deliğine uygulanması önerilir. Doktor tarafından başka şekilde tavsiye edilmediği takdirde aşağıdaki dozlar uygulanır:Osteoporoz tedavisinde pozoloji:MİACALCİC nazal spreyinin osteoporoz tedavisinde önerilen dozu günde 200 lU'dir. İlerleyen kemik kütle kaybını önlemek için MİACALCİC'in yeterli kalsiyum ve D vitamini alımı ile birlikte uygulanması önerilir.Uygulama sıklığı ve süresi:Postmenopozal osteoporoz tedavisinde MİACALCİC'le tedavi uzun süreli olarak uygulanmalıdır (Bkz. Bölüm 5.1. Farmakodinamik özellikler).Osteoliz ve/veya osteopeniye bağlı kemik ağrılarının tedavisinde pozoloji:Osteoliz ve/veya osteopeniye bağlı kemik ağrılarında önerilen doz günde 200-400 lU'dur. 200 IU'ye kadar tek doz halinde uygulanabilir. Daha yüksek doz gerektiğinde bölünmüş dozlar halinde uygulanmalıdır. Doz, her hastanın ihtiyacına göre bireysel olarak ayarlanmalıdır.Uygulama sıklığı ve süresi:Analjezik etki tamamen görülmeye başlayıncaya kadar belli bir süre gerekebilir. İdame tedavisi için başlangıç dozu genellikle azaltılabilir ve/veya uygulama aralıkları uzatılabilir.Sudek hastalığı veya Algodistrofi tedavisinde pozoloji:Sudek hastalığı veya algodistrofinin erken teşhisi önemli olup, tedaviye teşhiskonulduktan hemen sonra başlanmalıdır. Önerilen doz 2-4 hafta boyunca günlük 200 lU tek dozdur. Uygulama sıklığı ve süresi:Klinik tablodaki gelişmeye göre 6 haftaya kadar her iki günde bir 200 lU ilave olarak uygulanabilir.Uygulama şekli:Kutunun içinden çıkan cihaz aracılığı ile burundan nefesle çekmek suretiyle kullanılır. Damlatma tüpüne hava kabarcığının kaçmasını engellemek için nazal sprey şişesi daima dik olarak tutulmalıdır.Uzun süreli tedaviUzun süreli tedavi gören hastalarda kalsitoninlere karşı antikor oluşabilirse de bu durum genellikle klinik etkinliği etkilemez.Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği :Böbrek ya da karaciğer yetmezliği olan hastalarda, hiçbir resmi çalışma yapılmamış olmasına rağmen, MİACALCİC'in uygulanması ile ilgili geniş deneyime göre bu hasta popülasyonlarında tolerabilitenin azaldığına ya da doz ayarına gerek duyulduğuna dair herhangi bir kanıt saptanmamıştır.Pediyatrik popülasyon:Çocuklarda MİACALCİC'in kullanımına ait sınırlı deneyim olduğundan bu hasta grubu için hiçbir öneride bulunulamamaktadır.Geriyatrik popülasyon:MİACALCİC'in yaşlılarda uygulanması ile ilgili geniş deneyim ile bu hasta popülasyonunda tolerabilitenin azaldığına ya da doz ayarına gerek duyulduğuna dair herhangi bir kanıt saptanmamıştır.4.3.KontrendikasyonlarEtkin madde sentetik salmon kalsitonine ya da yardımcı maddelerinden herhangi birine karşı bilinen aşırı duyarlılıkta kontrendikedir (Bkz. Bölüm 4.4. Özel kullanım uyarıları ve önlemleri, Bölüm 4.8. İstenmeyen Etkiler ve Bölüm 6.1. Yardımcı maddelerin listesi.).4.4.Özel kullanım uyarıları ve önlemleriSalmon kalsitonininin peptid yapısında olmasından dolayı sistemik alerjik reaksiyonların oluşma olasılığı vardır ve MİACALCİC uygulanan hastalarda, izole anaflaktik şok vakaları da dahil olmak üzere, alerjik tipte reaksiyonlar bildirilmiştir. Salmon kalsitoninine duyarlı olduğundan şüphelenilen hastalarda MİACALCİC tedavisine başlanmadan önce MİACALCİC'in ampul formundan alınan seyreltilmiş steril çözelti ile deri testi yapılması düşünülmelidir.4.5.Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriKalsitonin ve lityumun eş zamanlı kullanımı plazma lityum konsantrasyonlarının düşmesine yol açabilir. Lityum dozunun ayarlanması gerekebilir.Özel popülasyonlara ilişkin ek bilgiler:Özel popülasyonlara ilişkin hiçbir klinik etkileşim çalışması yürütülmemiştir.4.6.Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)MİACALCİC'in gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/ embriyonal/fetal gelişim /ve-veya/ doğum /ve-veya/ doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.MİACALCİC, gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Gebelik dönemiGebe kadınlarda çalışma yapılmadığından, MİACALCİC gerekli olmadıkça gebelik döneminde kullanılmamalıdır.Laktasyon dönemiEmziren annelerde çalışma yapılmadığından ve salmon kalsitonininin anne sütüne geçip geçmediği bilinmediğinden, tedavi sırasında annenin bebeğini emzirmesi tavsiye edilmemektedir.Üreme yeteneği / FertiliteHayvan çalışmaları MİACALCİC'in embriyotoksik ve teratojenik potansiyel taşımadığını göstermiştir. Salmon kalsitonini hayvanlarda plasenta bariyerini geçmediği görünmektedir (bkz. bölüm 5.3).4.7.Araç ve makine kullanımı üzerindeki etkilerMİACALCİC'in araç ve makine kullanımı üzerindeki etkisine ilişkin hiçbir veri bulunmamaktadır. MİACALCİC, yorgunluk, baş dönmesi ya da görme bozukluğuna yol açabilir (bkz. Bölüm 4.8. İstenmeyen etkiler), bu da hastanın tepkilerini zayıflatabilir. Bu nedenle, hastalar, bu etkilerin meydana gelebileceği ve böyle durumlarda araç ya da makine kullanmamaları konusunda uyarılmalıdır.4.8.İstenmeyen etkilerLokal advers olaylar, genellikle hafif (raporların yaklaşık %80'inde) olmakla birlikte tedavinin kesilmesine vakaların %5'ten azında gerek duyulmaktadır.Advers ilaç reaksiyonları, en sık görülen advers reaksiyon ilk sırada olacak şekilde sıklıklarına göre aşağıda sıralanmıştır. Her sıklık grubunda advers reaksiyonlar azalan ciddiyet derecesine göre sıralanmıştır. Çok yaygın (> 1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (> 1/10.000 ila < 1/1.000); çok seyrek (< 1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Bağışıklık sitsemi hastalıklarıSeyrek: Aşırı duyarlılık.Çok seyrek: Anafilaktik ve anafilaktoid reaksiyonlar, anafilaktik şok. Sinir sistemi hastalıklarıYaygın: Baş ağrısı, baş dönmesi, disgözi (tat alma duyusunda bozukluklar).Göz hastalıklarıYaygın olmayan: Görme bozukluğu.Vasküler hastalıklarYaygın: Ateş basması, ciltte kızarıklık. Yaygın olmayan: Hipertansiyon.Solunum, göğüs bozuklukları ve mediastinal hastalıklarıÇok yaygın: Burunda rahatsızlık, burun tıkanıklığı, burunda ödem, hapşırma, rinit,burunda kuruluk, alerjik rinit, burun iritasyonu, burunda koku, burun mukozasında eritem, mukoza eskoriasyonu. Yaygın: Epistaksis, sinüzit, ülseratif rinit, farenjit. Yaygın olmayan: Öksürük. Gastrointestinal hastalıklarYaygın: Bulantı, diyare, karın ağrısı. Yaygın olmayan: Kusma.Deri ve deri altı doku hastalıklarıSeyrek: Yaygın döküntü.Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın: Artralji.Yaygın olmayan: Kas-iskelet ağrısı. Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın: Yorgunluk.Yaygın olmayan: Grip benzeri semptomlar, ödem (yüzde, ekstremitelerde ve yaygın) Seyrek: Pruritus 4.9. Doz aşımı ve tedavisiMİACALCİC parenteral uygulandığında bulantı, kusma, sıcak basması ve baş dönmesi doza bağlı bilinen etkilerdir. Bu olayların MİACALCİC nazal sprey aşırı kullanımı ile görülmesi beklenebilir. Bununla beraber, MİACALCİC nazal sprey tek doz olarak 1600 lU'ye kadar ve günde 800 lU'ye kadar üç gün uygulanmış ve ciddi advers etki görülmemiştir. Aşırı doz alan izole vakalar bildirilmiştir. Tedavi semptomatiktir.5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Kalsiyum homeostaz düzenleyici ATC kodu: H05B A01Etki mekanizması:Bütün kalsitonin yapıları, dizilim açısından türden türe farklılık gösteren N-terminalinde yedi aminoasit kalıntısından oluşmuş bir halka içeren tek zincir halinde 32 aminoasitten oluşmaktadır. Salmon kalsitonini, reseptör bağlantı bölgelerine, memelilerden elde edilen kalsitoninlerden daha çok afinite gösterdiğinden daha güçlü ve daha uzun etkilidir. Spesifik reseptörleri üzerinden osteoklast aktivitesini inhibe eden salmon kalsitonini, kemik rezorpsiyon hızının arttığı osteoporoz gibi durumlarda kemik yıkımını belirgin olarak azaltarak normal bir düzeye indirir. Hem hayvan modellerinde hem de insanda salmon kalsitoninin, muhtemelen özellikle merkezi sinir sistemine doğrudan bir etki yolu ile analjezik aktivite gösterdiği saptanmıştır. Farmakodinamik etkiler:MİACALCİC, tek bir dozun ardından insanda, kalsiyum, fosfor ve sodyumun idrarla atımında (tübüler geri emilimlerini azaltarak) artış ve hidroksiprolinin idrarla atımında azalma ile görülen, klinik açıdan anlamlı bir biyolojik yanıt oluşturur. MİACALCİC'in uzun süreli uygulanması kemik yıkımının biyokimyasal göstergeleri olan serum C-telopeptidleri (sCTX) ve alkalen fosfatazın iskelet izoenzimlerini 5 yıla kadar tedavide anlamlı olarak suprese eder. MİACALCİC, lomber omurga Kemik Mineral Dansitesinde (KMD) 1 yıldan başlayarak ve 5 yıla kadar istatistiksel olarak anlamlı %1.0-2.0 artış sağlar. Kalça KMD'si korunur. MİACALCİC, günde 200 lU uygulandığında, D vitamini ve tek başına kalsiyumla (plasebo) tedaviye göre, yeni vertebral kırık gelişme riskini ve istatistiksel ve klinik olarak anlamlı (%36) azaltır. Ek olarak multipl vertebral kırık insidansı yine "plasebo" ile karşılaştırıldığında %35 azalır. Kalsitonin, gastrik ve ekzokrin pankreatik salgıyı azaltır. 5.2. Farmakokinetik özellikler Genel özelliklerEmilim:MİACALCİC, nazal mukozadan hızlı emilir ve uygulamadan sonraki bir saat içinde (medyan süre yaklaşık 10 dakika) en yüksek plazma konsantrasyonlarına erişilir. Dağılım:Diğer polipeptid hormonlarda olduğu gibi salmon kalsitoninin de plazma değerleri terapötik yanıtın doğrudan göstergesi olmadığından salmon kalsitoninin plazma düzeylerinin izlenmesinin yararı çok azdır. Bu nedenle MİACALCİC aktivitesi, klinik etkililik parametreleri kullanılarak değerlendirilmelidir. Biyotransformasyon:200 lU dozun parenteral uygulamaya göre biyoyararlanımı %3 - 5'dir. Önerilenden daha yüksek olarak uygulanan doz kan düzeylerinin yükselmesine (EAA'da bir artma ile görülen) neden olur ancak, bağıl biyoyararlanım artmaz. Eliminasyon:Eliminasyon yarı ömrü yaklaşık 20 dakika olarak hesaplanmıştır ve çoklu doz uygulamasında herhangi bir birikme kanıtına rastlanmamıştır. Doğrusallık/doğrusal olmayan durum:Doğrusallık / doğrusal olmayan durum hakkında herhangi bir veri bulunmamaktadır. Hastalardaki karakteristik özelliklerBöbrek / karaciğer yetmezliği:Böbrek ya da karaciğer yetmezliği olan hastalarda, hiçbir resmi çalışma yapılmamış olmasına rağmen, MİACALCİC'in uygulanması ile ilgili geniş deneyime göre bu hasta popülasyonlarında tolerabilitenin azaldığına ya da doz ayarına gerek duyulduğuna dair herhangi bir kanıt saptanmamıştır (bkz. bölüm 4.2.). Pediyatrik popülasyon:Çocuklarda MİACALCİC'in kullanımına ait sınırlı deneyim olduğundan bu hasta grubu için hiçbir öneride bulunulamamaktadır. Geriyatrik popülasyon:MİACALCİC'in yaşlılarda uygulanması ile ilgili geniş deneyim ile bu hasta popülasyonunda tolerabilitenin azaldığına ya da doz ayarına gerek duyulduğuna dair herhangi bir kanıt saptanmamıştır. 5.3. Klinik öncesi güvenlilik verileriLaboratuvar hayvanlarında geleneksel uzun-süreli toksisite, üreme, mutajenite ve karsinojenite çalışmaları yapılmıştır.%0.01 benzalkonyum klorür içeren bir plasebonun ya da %0.01 benzalkonyum klorür içeren yüksek dozlardaki kalsitonin formülasyonunun 26 hafta boyunca günlük olarak intranazal yolla uygulanması maymunlarda iyi tolere edilmiştir. Solunum yollarında tedaviyle ilgili herhangi bir değişiklik gözlenmemiştir. 4 hafta boyunca intranazal yolla %0.01 benzalkonyum klorür içeren salmon kalsitonini verilen köpeklerde burun boşluğunda ve üst solunum yollarında herhangi bir anormal bulguya rastlanmamıştır. Toksisite çalışmalarındaki minör etkiler, salmon kalsitoninin farmakolojik etkisine bağlanmaktadır. Salmon kalsitonini embriyotoksik, teratojenik ve mutajenik potansiyel göstermez. Toksisite ve karsinojenite çalışmaları salmon kalsitonininin klinik kullanımdan daha düşük miktarlarda, sıçanlarda hipofiz tümörlerinin insidansını artırdığını göstermiştir. Bununla birlikte, yapılan diğer klinik öncesi çalışmalar, özellikle de farede yapılan ve maksimum maruziyetin insanda 200 lU dozu takiben oluşan maruziyetin 7000 katından fazla olduğu bir karsinojenite çalışması, hipofiz tümörü indüklenmesinin sıçanlara özgü bir durum olduğunu düşündürmüştür. Eşleştirilmiş kontrollerle yapılan bir çalışmada 24 aya kadar tedavi edilen hastalarda elde edilenler de dahil olmak üzere klinik verilerde hipofizle ilgili herhangi bir değişiklik saptanmamıştır. Bunun yanında, insan hipofizinde kalsitonin reseptörlerinin sayıca çok az olduğu ya da hiç bulunmadığı gösterilmiştir. Ayrıca, hastalarda hipofiz tümörleriyle ilgili hiçbir advers vaka bildirilmemiştir. Dolayısıyla, hipofiz tümörü indüksiyonunun sıçana özgü bir vaka olduğu ve sıçanlardaki hipofiz tümörlerinin MİACALCİC'in klinik kullanımı ile ilgili olmadığına dair yeterli kanıtın olduğu sonucuna varılmıştır. 6. FARMASOTIK ÖZELLİKLER6.1.Yardımcı maddelerin listesiBenzalkonyum klorür0.1 mgSodyum klorür8.5 mg Hidroklorik asity.m. (pH ayarlaması için) Deminarilize suy.m. 6.2.GeçimsizliklerGeçerli değil.6.3.Raf ömrüÜrün açılmamış ise 36 ay. Ürün açıldıktan sonra 1 ay.6.4.Saklamaya yönelik özel tedbirlerKullanmaya başlayıncaya kadar buzdolabında 2 - 8oC' de saklayınız. Dondurmayınız.MİACALCİC nazal sprey şişeleri bir kez açıldıktan sonra (Bkz. Bölüm 6.6 Beşeri tıbbi üründen arta kalanların imhası ve diğer özel önlemler) oda sıcaklığında (25oC'den yukarı olmayan) saklanmalıdır ve en fazla dört hafta içinde kullanılmalıdır. 6.5.Ambalajın niteliği ve içeriğiCihaz saydam, renksiz bir cam şişeden (tip I cam) ve entegre, otomatik bir doz sayma mekanizmasıyla yerleşik bir mekanik durdurucu içeren bir sprey mekanizmasından oluşmaktadır.Ambalaj içerisinde, 2 ml nazal sprey çözelti içeren ve 200 lU'luk en az 14 doz uygulayan ölçme pompası takılı bir şişe ya da 2 ml nazal sprey çözelti içeren 200 lU'luk en az 14 doz uygulayan ölçme pompası takılı iki şişe bulunmaktadır. 6.6.Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği"ne uygun olarak imha edilmelidir.MİACALCİC Nazal Sprey ilk kez kullanılmadan önce, spreyin kullanımı ve kullanıma hazırlanmasıyla ilgili olarak "Kullanma Talimatı"nda yer alan adımlar dikkatle okunmalıdır. İlk kullanımdan önce pompa kullanıma hazırlanmalıdır: Koruyucu kapak çıkarılır, şişe dik tutularak üst kısma "tık" sesi çıkarıncaya kadar basılır. Bu işlem iki kez tekrarlanır. İlk seferden sonra doz gösterge penceresinde beyaz ve kırmızı çizgiler, ikinci seferden sonra beyaz çizgi, üçüncü seferden sonra ise yeşil çizgi görünecektir. Sprey bu şekilde kullanıma hazır hale gelir. Kullanma TalimatıNazal spreyin nasıl kullanılacağını öğrenmek için bu talimatların tamamını dikkatlice okuyunuz. Bu talimatlar sizi:Nazal spreyin bölümleri Yeni bir nazal spreyin kullanıma hazırlanması Nazal spreyin kullanılması konusunda bilgilendirir. Eğer sprey mekanizması tıkanırsa, bu pompaya kuvvetle basılarak çözümlenebilir, ancak hasaryaratabileceğinden kesinlikle sivri uçlu objelerle tıkanıklığı açmaya çalışmayınız. Nazal spreyinizin uygun şekilde çalışmadığını düşünüyor iseniz eczacınıza iade ediniz. Aslakendiniz tamir etmeye ya da parçalara ayırmaya kalkmayınız. Bu hareketler alınan dozu etkilemektedir.Dozla ilgili doktorunuzun talimatlarına dikkatle uyunuz. Tekrar kullanabilmek için kullanmatalimatını kaybetmeyecekşekilde saklayınız. Koruyucu kapak:Püskürtücü uç:Burunluk:Pompa:Gösterge:Yeni bir nazal spreydeki doz gösterge penceresi resimde görüldüğü gibi B pozisyonundadır. Pompayı her basışınızda göstergede sayı değişir.(Bkz. Göstergenin kontrolü)Damlatma tüpü:Pompayı bastırdığınızda spreyşişesinin içindeki ilacı alan tüp. Şişe:En az 14 ölçülü doza yeterli ilaç içerir.Nazal spreyin bölümleri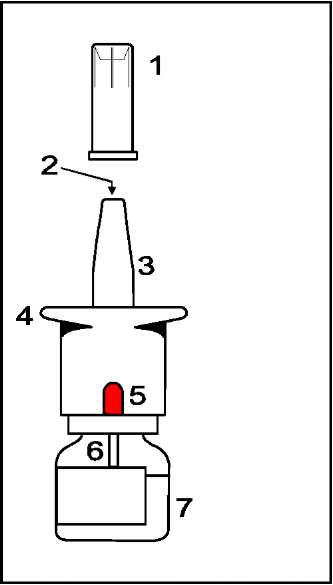 1.2.3.4.5.6.7.Yeni bir nazal sprey şişesinin hazırlanmasıNazal sprey şişesiniASLA ÇALKALAMAYINIZ,oluşan hava kabarcıkları dozunuzu etkileyebilir.Yeni bir nazal sprey şişesinin doz gösterge penceresi resimde görüldüğü gibi B pozisyonundadır.
i
mİlk olarak koruyucu kapağı çıkarınız 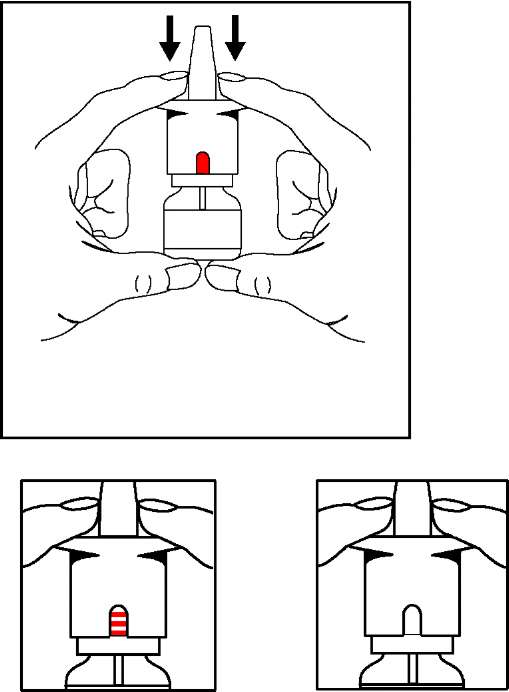
¦ Nazal spreyi dik olarak bir ya da iki elinizle tutunuz ve pompanın üzerine
Pompayı bastırırken doz gösterge penceresindeki değişiklikleri seyrediniz.3 kezbasınız.Bu sayede damlatma tübündeki hava dışarı atılacak ve yeni spreyin kullanımına hazır hale gelmesinde ilk aşama tamamlanacaktır. Bu işlem sadece bir kez ve yenibir şişe kullanmaya başlamadan önce yapılmalıdır.Az miktarda ilaç spreyle atılırsa endişelenmeyiniz, bu normaldir. ^Â ^ N ^ N
Doz gösterge penceresi yeşil olduğunda yeni nazal spreyiniz kullanıma hazırdır.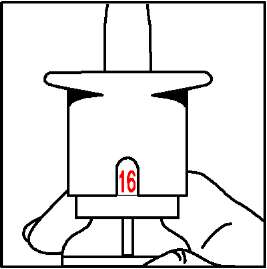 7. |
İlaç BilgileriMiacalcic nazal spreyEtken Maddesi: Salmon kalsitonin Atc Kodu: H05BA01 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.
