RhoGAM Ultra-Filtered Plus 300 µg (1500 IU) IM Enjeksiyon İçin Çözelti İçeren Kullanıma Hazır Şırınga Kısa Ürün BilgisiEnfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar » İmmün Serum ve İmmünoglobülinler » İmmünoglobülinler » Spesifik İmmünoglobülinler » AntiD (rh) İmmunoglobulin KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIRhoGAM Ultra-Filtered PLUS 300 ^g (1500 lU) IM enjeksiyon için çözelti içeren kullanıma hazır şırınga.2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:İnsan Anti-D immünoglobuliniBir doz RhoGAM Ultra-Filtered PLUS, 15 mL (veya daha az) Rh(D)-pozitif kırmızı kan hücrelerine karşı immün yanıtı baskılamak için yeterli miktarda insan plazma anti-D immünoglobulini (300 ^g, 1500 IU1) içerir. *RhoGAM içerisindeki anti-D içeriği her doz için ^g veya Uluslararası Birim (IU) cinsinden ifade edilir. Değişim faktörü 1 ^g, 5 IU'dur. RhoGAM Ultra-Filtered PLUS, doz başına 15 ^g'dan az miktarda IgA içermektedir. İnsan plazma protein miktarı 50 mg/mL ± 10 mg/mL'dir. Plazma proteinlerinin en az %98'i IgG'dir. Yardımcı maddeler:Sodyum klorür: 2.9 mg/mLSodyum hidroksit: pH ayarlama için yeterli miktarda Yardımcı maddelerin tam listesi için 6.1'e bakınız 3. FARMASÖTİK FORMİntramüsküler uygulama için kullanıma hazır enjektörde enjeksiyonluk çözelti. Çözelti berrak veya hafif opelasandır.4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlar4.2. Pozoloji ve uygulama şekli Pozoloji:RhoGAM Ultra-Filtered PLUS sadece intramüsküler uygulama içindir.Enjektör içeriği tamamen enjekte edilmelidir. Tek kullanım içindir (Bakınız Bölüm 4.3, 4.4 ve 4.5). RhoGAM Ultra-Filtered PLUS doğumu veya kırmızı kan hücrelerine maruziyeti izleyen 72 saat içinde uygulanmalıdır. 72 saatlik dönemden sonra verilen Rh0(D) İmmünglobulin (İnsan) etkinliği hakkında çok az bilgi bulunmaktadır. Pasif olarak kazanılmış olan anti-D düzeyinin korunması için ilk enjeksiyondan başlayarak her 12 haftada bir uygulanmalıdır. Doğum öncesi uygulanan son dozdan sonraki 3 hafta içinde doğum gerçekleşmişse, doğum sonrası doz uygulanmayabilir, ancak 15 mL'den fazla kırmızı kan hücrelerine maruziyeti belirlemek için fetomaternal kanama (FMK) testi yapılmalıdır.
Maruziyeti izleyen 3 gün içinde toplam doz uygulanmış olması koşulu ile çoklu dozlar aynı zamanda veya belirli aralıklarla uygulanabilir.
' > 15.0 mL Rh-pozitif kırmızı kan hücreleri
300 ^g (1500 IU çoklu enjektörler)
Uygulama şekli:Her bir tek doz kullanıma hazır RhoGAM Ultra-Filtered PLUS enjektörü 300 ^g (1500 IU)) Rh0(D) İmmünglobulin (İnsan) içermektedir. Bu doz, 15 mL üzerinde Rh pozitif kırmızı kan hücrelerinin söz konusu olduğu fetomaternal kanamaya (FMK) ait klinik ya da laboratuvar kanıtı olmadıkça, hamileliğin 13.haftası veya daha sonraki haftalarla ilişkili endikasyonlar için dozdur.Çoklu UygulamalarHamileliğin üçüncü üç aylık dönemi öncesinde görülmesi mümkün ancak pek muhtemel olmayan fakat sonraki dönemde ve çoğunlukla da doğum sırasında görülen bir olay olarak fetomaternal kanamanın 15 mL'yi aşması halinde çoklu RhoGAM Ultra-Filtered PLUS doz uygulaması gerekli olabilir. Fetomaternal kanama riskinin arttığı bilinen veya şüphelenilen hastalar kalitatif ve kantitatif metotlarla açısından test edilmelidir. Etkinlik çalışmalarında, RhoGAM Ultra-Filtered PLUS'ın Rh-pozitif kırmızı kan hücrelerinin mL'si başına >20 ^g doz uygulandığında bütün deneklerde Rh immünizasyonunu baskıladığı gösterilmiştir. Dolayısı ile tek doz RhoGAM Ultra-Filtered PLUS, <15 mL Rh-pozitif kırmızı kan hücrelerine maruziyet sonrası immün yanıtı baskılayacaktır. Ancak, klinik uygulamada maruziyet miktarını (transfüzyon hacmi veya fetomaternal kanama) belirlemede kullanılan laboratuvar test metotları kesin değildir. Bu nedenle fazla miktarda fetomaternal kanama veya kırmızı kan hücrelerine maruziyet şüphesi varsa ya da dokümante edilmişse Rh-pozitif kırmızı kan hücrelerinin mL'si başına 20 ^g'dan fazla RhoGAM Ultra-Filtered PLUS uygulaması düşünülmelidir. Maruziyeti izleyen 3 gün içinde toplam doz uygulanmış olması koşulu ile çoklu doz aynı anda veya aralıklı olarak uygulanabilir. Uygulama sıklığı ve süresiYeterli anti-D düzeyinin korunması için RhoGAM Ultra-Filtered PLUS 12 haftalık aralıklarla uygulanmalıdır. Enjeksiyon için kesin zaman, ilk enjeksiyon uygulamasından başlayarak 12 haftalık aralıklara dayanır. Standart doğum öncesi dozdan (28 - 32. haftalarda) 12 hafta sonra doğum gerçekleşmemişse, doğum öncesi korumayı maksimize etmek için ikinci bir doz önerilir. Doğum öncesi uygulanan son dozdan sonraki 3 hafta içinde doğum gerçekleşmişse, doğum sonrası doz uygulanmayabilir. Ancak 15 mL'den fazla kırmızı kan hücrelerine maruziyetini belirlemek için fetomaternal kanama testi yapılmalıdır.Koruma düzeneğini iğne üzerinden kaydırın.Enjeksiyondan sonra serbest olan eliniz ile koruma düzeneğini iğne üzerine kaydırın. İşitilebilen "klik" sesi uygun hareketi gösterir.Eller daima iğnenin arkasında tutulmalıdır.Atıklar "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği"ne uygun olarak imha edilmelidir.Özel popülasyonlara ilişkin ek bilgiler:Böbrek - karaciğer yetmezliği:Veri bulunmamaktadır. Herhangi bir yan etki bildirimi yoktur.Pediyatrik popülasyon:Geriyatrik popülasyon:Bu popülasyonda kullanılmamaktadır.4.3.Kontrendikasyonlarİnsan immünglobulinlerine ve bileşenlerden birine karşı duyarlılığı olanlarda kontrendikedir. Rh-pozitif bireylerde RhoGAM Ultra-Filtered PLUS uygulaması kontrendikedir.Rh Kan tipi:RhoGAM Ultra-Filtered PLUS Rho(D) İmmünglobulin (insan), sadece Rh-pozitif kırmızı kan hücrelerine maruz kalmış veya maruziyet olasılığı olan Rh-negatif hastalarda Rh immünizasyonunu önlemek için kullanılmalıdır. 4.4.Özel kullanım uyarıları ve önlemleri Viral Güvenlilik:RhoGAM Ultra-Filtered PLUS insan plazmasından üretilmektedir ve virüsler, ve teorik olarak Creutzfeldt-Jakob Disease (CJD) ajanı gibi enfeksiyon ajanlarını bulaştırma riski taşıyabilirler. Böyle bir ürünün bir enfeksiyöz ajan bulaştırma riski, plazma donörlerinin belirli virüse önceden maruziyetini saptamak üzere taranması, plazmanın belirli virüs enfeksiyonlarının varlığına dair test edilmesi ve üretim prosesi sırasında patojen uzaklaştırma ve inaktivasyon tekniklerinin kullanılması ile azaltılmıştır. Bu önlemlere rağmen bu tip ürünler hala potansiyel olarak hastalık bulaştırabilirler. Ayrıca bu tip ürünlerde bilinmeyen enfeksiyöz ajanların bulunma olasılığı da vardır. Bu ürün yolu ile bulaşma olasılığını düşündüren tüm enfeksiyonlar hekim tarafından Hemat İlaç Sanayi İth. ve İhr. Şti'ne bildirilmelidir. Hekim bu ürünün yarar ve risklerini hasta ile tartışmalıdır.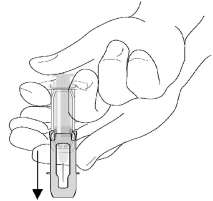 Uygulama yöntemi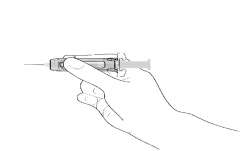
Enjeksiyonu standart protokole göre uygulayınız.
RhoGAM Ultra-Filtered PLUS yalnızca intramüsküler uygulama içindir, intravenöz uygulanmamalıdır.Not:Enjeksiyon yaparken koruma düzeneğinin zamanından önce harekete geçmesini engellemek için, parmaklarınızı koruyucu içindeki pencereden enjektör gövdesine temas edecek şekilde yerleştirinDoğum sonrası kullanılması halinde ürün anneye uygulanır. Yeni doğan bebeğe enjekte edilmez. Hastalar, uygulamadan sonra en az 20 dakika gözlenmelidir. Daha önceden insan immünglobulinine karşı şiddetli sistemik alerjik reaksiyonları olan hastalara dikkatle uygulanmalıdır. RhoGAM Ultra-Filtered PLUS düşük miktarda IgA içerir. IgA eksikliği olan hastalarda potansiyel aşırı duyarlılık reaksiyon riski bulunmaktadır. Rh-uyumsuz transfüzyon nedeniyle tedavi gören hastalar, hemolitik reaksiyonun belirtileri ve semptomlarına karşı klinik olarak ve laboratuvar testleri ile izlenmelidir. RhoGAM Ultra-Filtered PLUS için plazma genel olarak Ortho-Clinical Diagnostics'in sahip olduğu ve işlettiği donör merkezinden sağlanır. Bütün donörler enfekte donörlerden kan kaynaklı patojenlerin bulaşma riskini azaltmak için geçmişe ait bilgileri ve laboratuvar testleri ile çok dikkatle taranmaktadırlar. Plazma donasyonlarının her biri test edilmiş ve hepatit B yüzey antijeni (HBsAg) ve Hepatit C antikoru (HCV) ve insan immün yetmezlik virüsü (HIV) 1 ve 2 antikoru yönünden non-reaktif bulunmuştur. Buna ek olarak, plazma HCV ve HIV-1 için FDA tarafından onaylı Nükleik Asit Testi (NAT) ile test edilir ve sonuçlar mutlaka negatif olmalıdır. Plazma ayrıca araştırma olarak NAT ile hepatit B (HBV) için test edilir ve non-reaktif bulunmalıdır. Bununla birlikte negatif sonucun önemi belirlenmemiştir. Plazma in proses NAT prosedürleri ile hepatit A virüsü (HAV) ve parvovirüs B19 (B19) için mini havuz formatında test edilmiştir. Üretim için sadece virüs taramasından geçen plazma kullanılır. B19 için uygulanan prosedür, bilinen virüs izolatlarının sekans dizilimlerine dayanarak üç genotipin hepsini tespit eder. B19 için üretim havuzundaki limiti 104IU/mL'yi geçmeyecek şekilde ayarlanır. Plazma fraksinasyonu, viral titreleri anlamlı derecede azalttığı gösterilen modifiye edilmiş soğuk alkol prosedürü ile gerçekleştirilir. Plazma fraksinasyonunu takiben, zarflı ve zarfsız virüsleri uzaklaştımak için gözenek büyüklüğü dağılımı 12-18 nanometre olan patentli Viresolve 180 ultrafiltrasyon membranın kullanıldığı büyüklük-dışlama (size-exclusion) mekanizması ile viral klirens basamağı virüsleri uzaklaştırır. Viral filtrasyondan sonra, filtre bütünlüğünü sağlamak için Viresolve 180 ultrafiltrasyon membranında kalite kontrol testleri (Corr Testi ve difüzyon testleri) gerçekleştirilir. Viral inaktivasyon basamağında, HCV, HIV ve Batı Nil Virüsü (WNV) gibi zarflı virüsleri inaktive etmek için Triton X-100 ve tri-n-bütil fosfat(TNBP) kullanılır. Donör seçme prosesi, fraksinasyon prosesi, viral filtrasyon basamağı ve viral inaktivasyon prosesi, zarflı ve zarfsız virüslerin geçiş riskini azaltarak ürün güvenliliğini arttırır. Rho(D) İmmünglobulini (İnsan) kas içi kullanım içindir ve soğuk alkol fraksinasyonu ile hazırlanır, hepatit ve diğer enfeksiyöz hastalıkları bulaştırdığı görülmemiştir. RhoGAM Ultra-Filtered PLUS ile enfeksiyöz hastalıkların bulaştığına dair belgelenmiş herhangi bir vaka bulunmamaktadır. Laboratuvar etiketleme (spiking) çalışmaları, RhoGAM Ultra-Filtered PLUS üretim prosesinin kümülatif viral uzaklaştırma ve inaktivasyon kapasitesini şu şekilde göstermiştir:
HIV: İnsan İmmün Yetmezlik Virüsü, HIV-1 ve 2 üe İnsan T-hücre Lenfotropik Virüs (HTLV) 1 ve 2 için model BVDV: Bovin Viral Diarrhea Virus, Hepatit C Virüsü için model PRV: Pseudorabies Virus, Herpes virsleri için model PPV: Porcine Parvovirus, Parvovirus B19 için model WNV: Batı Nil Virüsü HAV: Hepatit A Virüsü Rho(D) İmmünglobulininin (İnsan) güvenliliği Amerika Birleşik Devletlerinde kadın kan donörlerindeki viral göstergelerin ampirik çalışmasında gösterilmiştir. Bu çalışma yaklaşık % 55-60'ımn hamileliğe ilişkin endikasyon için Rho(D) İmmünglobulin (İnsan) aldığı Rh-negatif donörlerin Rho(D) İmmünglobulin (İnsan) almayan Rh pozitif kadın donörlerinki ile benzer yüksek prevalans ve insidans viral belirteç oranlarına sahip olduğunu göstermiştir. RhoGAM Ultra-Filtered PLUS veya diğer Rho(D) İmmünglobulin (İnsan) ürünlerinin enjeksiyonundan sonra plazma veya serumdaki anti-D'nin geri kazanımı bireylere bağlı olarak oldukça değişkendir. Bir hastanın plazmasında anti-D tespiti, tayin yönteminin duyarlılığına ve enjeksiyon sonrasında toplanan numunenin zamanına bağlıdır. Şu anda, RhoGAM Ultra-Filtered PLUS enjeksiyonunu takiben dozun yeterliliğini ve etkinliğini saptamak için anti-D mevcudiyetinin test edilmesine yönelik bir gereklilik veya uygulama standardı bulunmamaktadır Maternal serumda pasif olarak kazanılmış anti-D oluşumu, pozitif antikor tarama testine neden olabilir. Bu, sonraki doğum öncesi ve doğum sonrası proflaksiyi önlemez. Doğum öncesinde annelerine Rho (D) immünglobulin (insan) verilen bazı bebekler, doğumda direkt antiglobülin (Coombs) testlerine zayıf pozitiftir. Fetomaternal hemoraji annede yanlış kan tipi sonuçlarına yol açabilir. Gebeliğin sonuna doğru veya doğumdan sonra Rh-negatif annenin dolaşımında zayıf D (Du) için pozitif antiglobulin testine neden olabilecek düzeyde fetal Rh-pozitif kırmızı kan hücresi bulunabilir. Bu bağlamda eğer hastanın Rh tipi açısından bir şüphe varsa RhoGAM Ultra-Filtered PLUS kullanılmamalıdır. Bu tıbbi ürün beher dozda 1 mmol (23 mg)'dan daha az sodyum (1.14 mg/mL) ihtiva eder; Dolayısıyla sodyuma bağlı herhangi bir yan etki beklenmemektedir. 4.5.Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriRho(D) İmmünglobulin (İnsan) dahil immünglobulin preparatları kızamık, kabakulak ve suçiçeği gibi canlı aşıların etkisini azaltabilir. Canlı aşıların uygulaması genellikle immünglobulinin son dozundan sonra 12 haftaya kadar geciktirilmelidir. Eğer immünglobulin kullanımı canlı aşı uygulamasından sonraki 14 gün içinde yapılırsa, aşılamaya karşı immün yanıt engellenebilir.Doğurma yaşındaki kadınlarda kızamıkçık immünitesi önemli olduğundan, kızamıkçık olma olasılığı bulunan kadınlarda hamileliğin son üç ayında veya doğum sırasında alınan Rho(D) İmmünglobulini (İnsan) yüzünden kızamıkçık veya MMR aşısı ile doğum sonrası aşılama geciktirilmemelidir. Aşılama doğumdan hemen sonra yapılmalıdır ve mümkünse 3 ay veya daha fazla süre sonrasında kızamıkçığa ve eğer gerekliyse kızamığa karşı immüniteyi sağlamak için test yapılmalıdır. 4.6.Gebelik ve laktasyonGenel TavsiyeGebelik kategorisi: CÇocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Bu tıbbi ürün gebelikte kullanılır. RhoGAM Ultra-Filtered PLUS ile hayvanlarda üreme çalışmaları yapılmamıştır.Mevcut kanıtlar Rho (D) immün globulin (insan)'in fetuse zarar vermediğini veya alıcı annenin gelecekteki gebeliklerine ya da üreme kapasitesine etkisi bulunmadığını ortaya koymaktadır. Gebelik dönemiİyi yönetilmiş epidemiyolojik çalışmalar İnsan Anti-D immünoglobulini'nin gebelik üzerinde ya da fetusun/yeni doğan çocuğun sağlığı üzerinde advers etkileri olduğunu göstermemektedir.RhoGAM Ultra-Filtered PLUS gebelik döneminde kullanılabilir. Laktasyon dönemiRhoGAM Ultra-Filtered PLUS anne sütü ile atılmamaktadır. RhoGAM Ultra-Filtered PLUS emzirme döneminde kullanılabilir.Üreme yeteneği /FertiliteMevcut veriler RhoGAM Ultra-Filtered PLUS'ın alıcı annenin gelecekteki gebeliklerini ve üreme kapasitesini etkilemediğini göstermiştir.4.7.Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanma yeteneği üzerine herhangi bir etkisi gözlenmemiştir.4.8.İstenmeyen etkilerRhoGAM Ultra-Filtered PLUS'ın uygulamasından sonraki advers olaylar nadirdir.RhoGAM Ultra-Filtered PLUS için yapılan klinik çalışmalarda ve ürünün pazara verilmesinden sonra hastalar tarafından bildirilen istenmeyen yan etkiler aşağıda verilmektedir. RhoGAM Ultra-Filtered PLUS için istenmeyen etkilerin değerlendirilmesinde şu terimler ve sıklık dereceleri kullanılmıştır: Çok yaygın (>1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (>1/1000 ila <1/100), seyrek (>1/10000 ila <1/1000); çok seyrek (<1/10000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Bağışıklık sistemi hastalıklarıSeyrek:Hipersensitivite, dispne ve şok dahil anaflaktik reaksiyonlar Sinir sistemi hastalıklarıYaygın olmayan: BaşağrısıKardiyak hastalıklarSeyrek: TaşikardiVasküler hastalıklarSeyrek: HipotansiyonGastrointestinal hastalıklarSeyrek:Bulantı, kusma Deri ve derialtı doku hastalıklarıYaygın olmayan: Döküntü, eritem, kaşıntı, pruritKas-iskelet bozuklukları, bağ doku-ve kemik hastalıklarıBilinmiyor: ArtraljiGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarıYaygın olmayan: Ateş, halsizlik, üşümeBilinmiyor: Uygulama yerinde: şişme, ağrı, eritem, sertleşme, sıcaklık, prurit, döküntü, kaşınma Enjeksiyon yerinde lokal ağrı ve hassasiyet görülebilir, büyük dozları farklı yerlere enjekte ederek dağıtmak suretiyle bu önlenebilir. RhoGAM Ultra-Filtered PLUS uygulaması ile ilgili olarak anaflaksi veya başka bir nedene bağlı ölüm olgusu rapor edilmemiştir. Viral güvenlilik için 4.4'e bakınız. 4.9. Doz aşımı ve tedavisiRh negatif bireylerde tekrar eden uygulamalar veya yükseltilmiş dozlar normal dozlardan daha şiddetli veya daha sık advers reaksiyonlara yol açmaz. Rh-uyumsuz transfüzyonlar için RhoGAM alan hastalar hemolitik reaksiyon riskinden dolayı klinik olarak ve laboratuvar testleri ile izlenmelidir.5. FARMAKOLOJİK ÖZELLİKLER5.1.Farmakodinamik özelliklerFarmakoterapötik grup: İmmün serum ve immünglobulinler: Anti-D (Rh) immünglobulin ATC kodu: J06BB01Anti-D immünoglobulin insan eritrositlerinin Anti-D(Rh) antijenine karşı spesifik antikorlar içerir. Hamilelik sırasında ve özellikle doğum esnasında, fetal kırmızı kan hücreleri annenin sirkülasyonuna girebilir. Eğer kadın Rh(D)-negatif ise ve fötus Rh(D)-pozitif ise, kadın Rh(D) antijenlerine karşı bağışıklanır ve plasentaya geçen anti-Rh(D) antikorları üreterek yeni doğanın hemolitik hastalığına neden olabilir. Rh(D)-pozitif fetal kırmızı kan hücrelerine maruziyetten sonra yeterince çabuk olarak ve yeterli dozda anti-D immünglobulini uygulanması yapılan vakaların %99'dan daha fazlasında anti-D immünglobulinleri ile pasif immünizasyon Rh(D) immünizasyonunu önler. Hangi anti-D immunglobulininin Rh(D)-pozitif kırmızı kan hücrelerine karşı immünizasyonu baskıladığına ilişkin mekanizma bilinmemektedir. Baskılama belki kırmızı hücrelerin immünokompetan yerlere ulaşmadan önce sirkülasyondan temizlenmesi ile ilgili olabilir, veya antikor bulunması veya bulunmaması durumunda uygun yerlerde uygun hücrelerle yabancı antijen ve antijen sunumunun tanınması ile ilgili çok daha kompleks bir mekanizmaya bağlı olabilir. 28. haftada ve doğumdan sonra 72 saat içinde uygulanan Rho(D) İmmünglobulinin (İnsan) ile Rh immünizasyon hızının yaklaşık %0.1 - 0.2'ye düştüğü gösterilmiştir. 5.2.Farmakokinetik özelliklerEmilimİntramüsküler enjeksiyon için insan anti-D immünoglobulin kan dolaşımına yavaşça absorbe olur. DağılımUygulamadan 5 gün sonra pik seviyeye ulaşır. BiyotransformasyonIgG ve IgG kompleksleri retikülo-endoteliyal sistem hücrelerinde yıkılır Eliminasyonİnsan anti-D immünoglobulin eliminasyon yarı-ömrü yaklaşık 3 - 4 haftadır. Bu yarı-ömür hastaya göre değişebilir. 5.3. Klinik öncesi güvenlilik bilgileriİmmunglobulinler insan vücudunun normal bileşenleridir. Anti-D immünglobulin için pre-klinik veri yoktur. Tekrarlayan doz testi toksisite çalışmaları, insan proteinine karşı gelişen antikorların interferansından dolayı pratik olarak uygulanamamaktadır.6. FARMASÖTİK ÖZELLİKLER6.1.Yardımcı maddelerin listesiGlisinSodyum klorür Polisorbat 80 (hayvansal olmayan) Hidroklorik asit Sodyum hidroksit Enjeksiyonluk su 6.2.GeçimsizliklerBu ürün diğer tıbbi ürünlerle karıştırılmamalıdır.Parenteral ilaçlar uygulanmadan önce, partiküler madde, renk değişimi veya enjektör hasarı açısından görsel olarak kontrol edilmelidir. Partiküler madde ve/veya renk değişimi görülmesi halinde ürünü kullanmayınız. 6.3.Raf ömrü24 aydır6.4.Saklamaya yönelik özel tedbirler2-8oC'de saklayınız. Dondurmayınız. Donmuş ürünleri çözüp kullanmayınız. Enjektörün üzerinde basılı olan son kullanma tarihinden sonra kullanmayınız.6.5.Ambalajın niteliği ve içeriğiRhoGAM Ultra-Filtered PLUS 300 ^g (1500 IU) içeren kullanıma hazır tek doz enjektör ambalajı, 1 enjektör içermektedir.RhoGAM Ultra-Filtered PLUS lateks içermeyen bir dağıtım sistemine sahiptir. 6.6.Beşeri ve tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler veya atık materyal "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği"ne uygun olarak imha edilmelidir.7.RUHSATSAHIBIBIHemat İlaç Sanayi İth. ve İhr. Ltd. Şti. Koşuyolu Cad. Cenap Şahabettin Sok. No:73 34718 Kadıköy - İSTANBULTel: + 90 216 428 97 90 (pbx) Faks: + 90 216 428 97 93 8.RUHSAT NUMARASI219.İLK RUHSAT TARIHI/RUHSAT YENILEME TARIHIİlk ruhsat tarihi: 07 /08/ 2007 Ruhsat yenileme tarihi:-10. KÜB'ÜNYENILENME TARıHıHı1Babanın ve bebeğin Rho (D) (-) olduğunun kesinlikle bilindiği durumlar hariç olmak üzere; Rho (D) (-) kadına, Rho (D) (+) bebek doğumundan sonraki ilk 72 saat içinde uygulanır.Babanın Rho (D) (-) olduğunun kesinlikle bilindiği durumlar hariç Rho (D) (-) gebelerde şüphelenilen ya da kanıtlanmış fetomaternal kanama, annenin geçirdiği karın travmaları, fetal invaziv işlemler (koryon villus biopsisi, amniosentez, fetal kan örneklemesi, fetal cerrahi vb.) eksternal sefalik versiyon, antepartum kanama, dış gebelik, düşük tehdidi ya da düşükler ve mol gebelikleri sonrasında kullanılır. Antenatal proflaksi amacı ile 28-32. haftalar arası endikedir. Herhangi bir Rho (D) (-) kişide kan ve kan ürünlerinin uyumsuz transfüzyonu sonrası uygulanır. |
İlaç BilgileriRhoGAM Ultra-Filtered Plus 300 µg (1500 IU) IM Enjeksiyon İçin Çözelti İçeren Kullanıma Hazır ŞırıngaEtken Maddesi: İnsan Anti-D immünoglobulini Atc Kodu: J06BB01 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.