Salofalk Lavman Kısa Ürün BilgisiSindirim Sistemi ve Metabolizma » İshal İlaçları, Barsak Antienflamatuar ve Antienfektifleri » Barsak Antienflamatuarları » Aminosalisilik Asit ve Benzerleri » Mesalazin KISA URUN BILGISI 1. BEŞERI TIBBI URUNUN ADISALOFALK® 4 g/60 ml lavman2. KALITATIF VE KANTİTATIF BILEŞIM ETKIN MADDE:Her bir lavman (60 g süspansiyon), etkin madde olarak 4 g mesalazin içerir.Yardımcı madde(ler):Sodyum benzoat (E 211)..................0.06 gSodyum edetat.............................0.06 gPotasyum metabisülfit (E 224)...........0.2808 gPotasyum asetat........................... 0.246 gYardımcı maddeler için 6.1'e bakınız.3. FARMASÖTIK FORMSüspansiyonSALOFALK®, açık - mat kahverengiye yakın krem renkte homojen süspansiyondur.4. KLİNIK ÖZELLIKLER4.1. Terapötik endikasyonlarÜlseratif kolitin akut ataklarının tedavisinde endikedir.4.2. Pozoloji ve uygulama şekli Pozoloji/ uygulama sıklığı ve süresi:Yetişkinler:Başka bir biçimde önerilmedikçe, bir şişe lavman (60 g süspansiyon) içeriği yatmadan önce bir defada bağırsağa uygulanır.En iyi sonuç SALOFALK®Genellikle, ülseratif kolitin akut atakları 8-12 hafta içinde yatışır. Tedavi süresi, doktor tarafından belirlenir.6 yaş üzerindeki çocuklar ve ergenler:Uygun dozaj, kalın bağırsaktaki hastalığın şiddetine, derecesine ve 6 yaş üzerindeki çocukların/ergenlerin vücut ağırlıklarına bağlı olarak seçilir.Genel olarak 40 kg'a kadar olan çocuklara yetişkin dozunun yarısı, 40 kg üzerindeki çocuklara ise yetişkin dozu verilebilir.Uygulama şekli: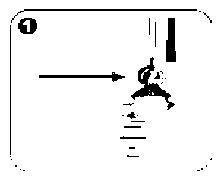 Hazırlanışı:¦ 30 saniye boyunca şişe çalkalanır.¦ Aplikatörün koruyucu kapağı çıkarılır.¦ Şişe yanından dik tutulur.Uygulama için doğru pozisyon:¦ Hasta sol tarafının üzerine sol bacağını uzatıp sağ bacağını karnına doğru çekerek uzanır. Bu pozisyonla SALOFALK® daha kolay uygulanır ve daha etkili olur.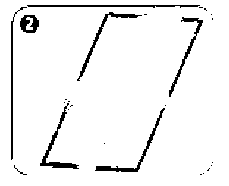 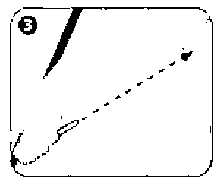
Uygulanması:¦ Aplikatörün ucu rektumun içene sokulur.¦ Şişenin ucu karın boşluğuna bakacak yönde tutulur ve yavaşça sıkılır.¦ Kullanıldıktan sonra boş şişenin aplikatör ucu yavaşça rektumdan çıkarılır.¦ İlacın barsakta dengeli bir şekilde dağılımı sağlanması için ilacın uygulandığı yatar pozisyon, 30 dakika süre ile korunmalıdır.¦ Mümkünse, lavmanın gece boyunca etki sağlamasına izin verilmelidir.   Özel popülasyonlara ilişkin ek bilgiler:Böbrek/ Karaciğer yetmezliği:Karaciğer fonksiyon bozukluğu olan hastalarda dikkatli kullanılmalıdır.Böbrek fonksiyonları bozuk olan hastalarda kullanılması önerilmez. Tedavi sırasında böbrek fonksiyonları bozulursa, mesalazinin yol açtığı renal toksisite düşünülmelidir.Şiddetli böbrek ve karaciğer yetmezliği olan hastalarda kontrendikedir.Pediyatrik popülasyon:SALOFALK®, 6 yaşın altındaki yaş grubu ile çok fazla deneyim olmadığından bu yaş grubundaki çocuklarda kullanılmamalıdır.Geriyatrik popülasyon:Yetişkinler için verilen pozoloji ve uygulama şekli geriyatrik popülasyon için de geçerlidir.4.3. Kontrendikasyonlar SALOFALK®- Daha önceden salisilik asit ve türevlerine, potasyum metabisülfit, sodyum benzoat ya da diğer bileşenlerine karşı duyarlılığı olanlarda,- Şiddetli karaciğer veya böbrek fonksiyonu bozukluklarında,- Daha önceden var olan gastrik veya duodenal ülserlerde,- Hemorajik diyatezi olanlarda kontrendikedir.4.4. Özel kullanım uyarıları ve önlemleriTedaviye başlamadan önce ve tedavi sırasında hekimin isteğine göre kan testleri (diferansiyel kan sayımı; ALT veya AST gibi karaciğer fonksiyon testleri; serum kreatinin) ve idrar muayenesi (test çubukları/dip çubukları) yapılmalıdır.Kontroller tedaviye başlandıktan 14 gün sonra yapılmalı ve 4 haftalık aralarla 2-3 kez tekrarlanmalıdır.Bulgular normal ise, kontroller 3 aylık aralarla yapılabilir. Eğer ilave belirtiler gelişirse, kontrol muayeneleri hemen yapılmalıdır.Özellikle astım olmak üzere akciğer hastalığı olan hastalar SALOFALK®Sülfasalazin içeren ilaçlarla yan etki görülme öyküsü olan hastalarda, SALOFALK®SALOFALK®, birim miktar başına 0.2808 g potasyum metabisülfit içerir. Bu nedenle nadir olarak şiddetli aşırı duyarlılık reaksiyonları ve bronkospazma neden olabilir.SALOFALK®SALOFALK®, toplam 0,03 g sodyum içerir. Bu miktar eşik değerin (1 mol= 23 g sodyum) altında olduğundan hiçbir olumsuz etki beklenmez. Günlük tedavi dozlarında alınmak kaydıyla güvenlidir.SALOFALK®, toplam 0,20 g potasyum içerir. Bu miktar eşik değerin (1 mol= 39 g potasyum) altında olduğundan hiçbir olumsuz etki beklenmez. Günlük tedavi dozlarında alınmak kaydıyla güvenlidir.4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriKarşılıklı etkileşime ilişkin özel araştırmalar yapılmamıştır.SALOFALK®- Kumarin tipi antikoagülanlar: Antikoagülan etkinin artma olasılığı vardır (gastrointestinal kanama riskini artırır)- Glukokortikoidler: İstenmeyen gastrik yan etkilerin artma olasılığı vardır.- Sülfonilüre: Kan şekerini düşürücü etkinin artma olasılığı vardır.- Metotreksat: Metotreksatın toksik potansiyelinin artma olasılığı vardır.- Probenesid/sülfinpirazon: Ürikozürik etkinin azalma olasılığı vardır.- Spironolaktan/furosemid: Diüretik etkinin azalma olasılığı vardır.- Rifampisin: Tüberkülostatik etkinin azalma olasılığı vardır.Azatiyoprin ya da 6-merkaptopürin ile tedavi görmekte olan hastalarda mesalazinin bu ilaçların miyelosupresif etkilerinin artırabileceği düşünülmelidir.Özel popülasyonlara ilişkin ek bilgilerPediyatrik popülasyon:6 yaşın altındaki çocuklarda yeterli deneyim olmadığından SALOFALK® bu yaş grubunda kullanılmamalıdır.4.6. Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi B'dir.Çocuk doğurma potansiyeli bulunan kadınlar/ Doğum kontrolü (Kontrasepsiyon)SALOFALK®'ın çocuk doğurma potansiyeli bulunan kadınlara herhangi bir etkisi veya doğum kontrolü (kontrasepsiyon) için kullanılan ilaçlarla herhangi bir etkileşimi bildirilmemiştir.Gebelik dönemiSınırlı sayıda gebelikte maruz kalma olgularına ilişkin veriler, SALOFALK®'ın gebelik üzerinde ya da fetüsün/yeni doğan çocuğun sağlığı üzerinde advers etkileri olduğunu göstermemektedir. Bugüne kadar herhangi önemli bir epidemiyolojik veri elde edilmemiştir.Oral yol ile alınan mesalazinde hayvanlar üzerinde yapılan çalışmalar, gebelik/embriyonal/fetal gelişim/doğum ya da doğum sonrası gelişim ile ilgili olarak doğrudan ya da dolaylı zararlı etkiler olduğunu göstermemektedir (bkz. Bölüm 5.3).Gebe kadınlara verilirken tedbirli olunmalıdır.İzole tek bir vakada gebelik sırasında yüksek mesalazin dozunun uzun süreli uygulanması neticesinde (2 - 4 g/gün, oral) yeni doğan bebekte böbrek yetmezliği bildirilmiştir.SALOFALK®Laktasyon dönemiMesalazinin insan ya da hayvan sütü ile atılmasına ilişkin sınırlı bilgi mevcuttur. Memedeki çocuk açısından bir risk olduğu göz ardı edilemez. Emzirmenin durdurulup durdurulmayacağına ya da SALOFALK®N-asetil-5 amino salisilik asit ve az miktarda mesalazin anne sütüne geçmektedir. Diyare gibi aşırı duyarlılık reaksiyonları emzirilen bebeklerde göz ardı edilemez. Emzirilen bebekte diyare gelişirse emzirmeye son verilmelidir.Üreme yeteneği/Fertiliteİnsanlarda üreme yeteneği/fertilite üzerine etkisi bilinmemektedir.4.7. Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanma yeteneği üzerinde hiçbir etki görülmemiştir.4.8. İstenmeyen etkilerAşağıdaki sıklık verilerine göre yan etkiler değerlendirilmiştir:Çok yaygın: ( >1/10)Yaygın: ( >1/100 - <1/10)Yaygın olmayan: ( >1/1000 - 1/100)Seyrek: ( >1/10,000 - 1/1000)Çok seyrek: ( <1/10,000) (istisnai raporlar dahildir)Kan ve lenf sistemi hastalıklarıÇok seyrek: Bozulan kan sayımı (aplastik anemi, agranülositoz, pansitopeni, nötropeni, lökopeni, trombositopeni)Bağışıklık sistemi hastalıklarıÇok seyrek: Alerjik egzantem, ilaç ateşi, bronkospazm, perikardit, miyokardit, akut pankreatit, alerjik alveolit, lupus eritomatozus sendromu, pankolit gibi hipersensitivite reaksiyonları.Sinir sistemi hastalıklarıSeyrek: Baş ağrısı, sersemlik Çok seyrek: Periferal nöropatiGastrointestinal hastalıklarSeyrek: Karın ağrısı, diyare, gaz, bulantı, kusmaHepato-bilier hastalıklarıÇok seyrek: Karaciğer fonksiyon testlerinde değişiklikler (transaminazlarda ve kolestaz parametrelerinde artış), hepatit, kolestatik hepatitDeri ve deri altı doku hastalıklarıÇok seyrek: AlopesiKas-iskelet bozukluklar, bağ doku ve kemik hastalıklarıÇok seyrek: Miyalji, artraljiBöbrek ve idrar hastalıklarıÇok seyrek: Akut ve kronik intersitisyel nefrit ve böbrek yetmezliğini içeren böbrek fonksiyon bozukluklarıGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarıÇok seyrek: Oligospermi (geri dönüşümlü)4.9. Doz aşımı ve tedavisiBugüne dek bildirilen bir aşırı doz olgusu bulunmamaktadır. Bilinen özgün bir antidotu yoktur.Eğer gerekliyse, aşırı doz olgularında elektrolitlerin infüzyonu (zorlu diürez) düşünülmelidir.5. FARMAKOLOJIK ÖZELLIKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: İntestinal Antienflamatuvar Ajanı ATC kodu: A07 EC 02Antienflamatuvar etki mekanizması bilinmemektedir. İn vitro çalışmaların sonuçları lipoksijenaz inhibisyonunun etkili olabileceğini göstermektedir.Bağırsak mukozasındaki prostaglandin konsantrasyonları üzerine etkisi de gösterilmiştir. Mesalazin (5-Aminosalisilik asit/5-ASA) reaktif oksijen bileşenlerin radikal tutucusu olarak da etki göstermektedir.Rektal yol ile uygulanan mesalazin, bağırsakta lokal olarak etkilidir ve kalın bağırsağın luminal bölümünün mukoza ve submokozasında etki gösterir. Mesalazinin inflamasyon bölgesinde bulunması önemlidir. Bu nedenle mesalazinin sistemik biyoyararlanım/plazmakonsantrasyonları, terapötik etkinlik ile değil güvenlilik ile ilişkili bir faktördür.5.2. Farmakokinetik özelliklerEmilim:Mesalazin emilimi en yüksek oranda bağırsağın proksimal bölgelerinde, en düşük oranda da bağırsağın distal bölgelerinde gerçekleşir.Kararlı durum koşulları altında remisyondaki ülseratif kolitli hastaların üzerinde yapılan bir çalışmada, pik plazma konsantrasyonlarına (0.92 ^g/ml 5-ASA ve 1.62 ^g/ml N-Ac-5-ASA) yaklaşık 11 - 12 saat sonra ulaşılmıştır.SALOFALK®Dağılım:Hafif - orta dereceli akut ülseratif kolitli hastalarda yapılan bir görüntüleme çalışması, tedavinin başlangıcında ve 12 hafta sonra remisyonunda lavman sıvısının çoğunlukla rektum, sigmoid kolon ve daha az olmak üzere kolonun geri kalanına dağıldığını göstermiştir.Biyotransformasyon:Mesalazin presistemik olarak bağırsak mukozasında ve karaciğerde farmakolojik açıdan inaktif metaboliti olan N-asetil-5-aminosalisilik asite (N-Ac-5-ASA) dönüşür. Asetilasyon, hastanın asetilatör fenotipinden bağımsız olarak gerçekleşmektedir. Bazı asetilasyon işlemi kalın bağırsak bakterileri tarafından oluşmaktadır. Mesalazin ve N-asetil-5-aminosalisilik asidin proteine bağlanma oranları sırasıyla % 43 ve % 78'dir.Eliminasyon:Mesalazin ve metaboliti olan N-Ac-5-ASA feçes (asıl kısmı) ile birlikte renal (miktarı uygulama şekline, farmasötik formuna ve mesalazinin salınma yoluna bağlı olarak %20 - % 50 arasında değişir) ve biliyer (küçük bir kısmı) yollarıyla atılmaktadır. Renal atılım temelde N-Ac-5-ASA şeklinde gerçekleşir. Ağız yoluyla toplam uygulanan mesalazin dozunun yaklaşık % 1'i temelde N-Ac-5-ASA şeklinde anne sütüne geçer. Mesalazinin eliminasyon oranı; en çok elimine edilen (yaklaşık %85) metabolit formundaki N-Ac-5-ASA ile yaklaşık % 13'tür (45 saatlik değer).5.3. Klinik öncesi güvenlilik verileriGüvenlilik farmakolojisi, genotoksisite, karsinojenite (sıçanlarda) veya üreme toksisitesi çalışmalarından elde edilen preklinik veriler, insanlar için özellikli bir tehlike göstermemiştir.Toksisite çalışmalarında, mesalazinin oral olarak yüksek dozda tekrarlı uygulanmasından sonra böbrek toksisitesi (böbrek papiller nekrozu ve tüm nefron veya proksimal kıvrumlı böbrek tübullarının epitelyal hasarı) gözlenmiştir. Bu bulguların klinik önemi belirsizdir.6. FARMASÖTIK ÖZELLIKLERI6.1. Yardımcı maddelerin listesiKarbomer 974 P Potasyum asetatPotasyum metabisülfit (E 224) [maksimum 0.28 g = maksimum 0.16 g SO'ye eşdeğer] Sodyum benzoat (E 211)Sodyum edetat Saf suKsantan gam6.2. GeçimsizliklerGeçerli değil.6.3. Raf ömrü24 ay6.4. Saklamaya yönelik özel tedbirler25o6.5. Ambalajın niteliği ve içeriği7 adet yeşil koruyucu LDPE kapak ile yuvarlak beyaz akordeon biçimli LDPE şişe içeren karton kutuda.6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller 'Tıbbi atıkların kontrolü yönetmeliği' ve 'Ambalaj ve Ambalaj Atıklarının Kontrolü yönetmelikleri'ne uygun olarak imha edilmelidir.7. RUHSAT SAHİBIALİ RAİF İLAÇ SAN. AŞ.Eski Büyükdere Caddesi Dilaver Sokak No:434418 Oto Sanayi - 4. Levent/İSTANBUL Tel: 0212 316 78 00 Faks: 0212 316 78 788. RUHSAT NUMARASI(LARI)08.08.1990 - 89/729. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 08.08.1990 Ruhsat yenileme tarihi: 22.10.200910. KÜB'ÜN YENİLENME TARİHİ10.10.2011 |
İlaç BilgileriSalofalk LavmanEtken Maddesi: Mesalazin Atc Kodu: A07EC02 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.