Tasigna 150mg Kapsül Kısa Ürün BilgisiAntineoplastik ve İmmünomodülatör Ajanlar » Antineoplastik İlaçlar (Kanser İlaçları) » Diğer Kanser İlaçları » Protein Kinaz İnhibitörleri » Nilotinib KISA URUNBILGİSİ1.BEŞERI TIBBI URUNUN ADITASIGNA 150 mg kapsül2.KALITATIF VE KANTİTATIF BİLEŞİMEtkin madde :Nilotinib (hidroklorür monohidrat olarak)150 mgYardımcı maddeler:Laktoz monohidrat117.08 mgYardımcı maddeler için, 6.1'e bakınız. 3.FARMASÖTlK FORMKapsülÜzerinde boylamasına siyah renkli "NVR/BCR" baskısı olan 1 boyutunda açık kırmızı opak sert jelatin kapsül içerisinde beyaz ila sarımsı toz. 4.KLİNİK ÖZELLIKLER4.1.Terapötik endikasyonlarTASIGNA,-Yeni tanı konmuş Philadelphia kromozomu pozitif kronik miyeloid lösemili (Ph+ KML) yetişkin hastalarda kronik evre tedavisinde endikedir. 4.2.Pozoloji ve uygulama şekliTedavi, KML hastalarının tedavisinde deneyimli bir hekim tarafından başlatılmalıdır.Pozoloji :TASIGNA için önerilen doz günde iki kez 300 mg'dır.Klinik olarak endike olduğu takdirde, TASIGNA eritropoietin ya da G-CSF gibi hematopoietik büyüme faktörleriyle kombinasyon halinde verilebilir. Klinik olarak endike olduğu takdirde, TASIGNA hidroksiüre ya da anagrelid ile birlikte verilebilir. Uygulama sıklığı ve süresi:TASIGNA günde iki kez yaklaşık 12 saat aralıklarla, aç karnına alınmalıdır. Tedavi, hastaya faydalı olduğu sürece devam ettirilmelidir.Uygulama şekli:Sadece ağızdan kullanım içindir. Kapsüller suyla yutulmalıdır. İlaç alınmadan en az 2 saat öncesine kadar ve ilaç alındıktan sonra en az 1 saat herhangi bir gıda tüketilmemelidir.Doz ayarlamaları ya da doz değişiklikleri:TASIGNA başlamadan önce bazal ve başladıktan sonra 2 haftada 1 en az 2 kez daha EKG çekilmesi tavsiye edilir.TASIGNA uygulamasından önce hipokalemi veya hipomagnezemi düzeltilmeli ve özellikle bu elektrolit düzeylerinde anormallik riski altında olan hastalarda kandaki potasyum ve magnezyum düzeyleri tedavi sırasında düzenli olarak takip edilmelidir (bkz. 4.4 Özel kullanım uyarıları ve önlemleri). Temelde yatan lösemi ile ilişkili olmayan hematolojik toksisiteler (nötropeni, trombositopeni) nedeniyle TASIGNA tedavisinin geçici olarak kesilmesi ve/veya dozunun azaltılması gerekebilir (bkz. Tablo 1). Tablo 1: Nötropeni ve Trombositopeni için Doz Ayarlamaları1.TASIGNA kesilir ve kan sayımı izlenir. 2.ANC >1 x 109/L ve/veya trombosit >50 x 109/L ise 2 hafta içinde önceki dozdan başlanır 3.Kan sayımı düşük olmaya devam ederse, dozun günde bir kez 400 mg olacak şekilde azaltılması gerekebilir._
Yeni tanı konmuş KML kronik evre 300 mg 2x1 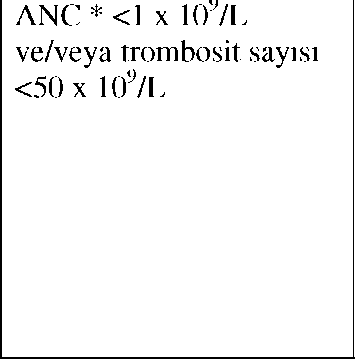
*ANC : Mutlak nötrofil sayısı
Klinik olarak anlamlı, orta dereceli ya da şiddetli hematolojik olmayan toksisite geliştiği takdirde tedaviye ara verilmesi gerekebilir, toksisite ortadan kalktıktan sonra tedaviye günde bir kez 400 mg'lık dozda devam edilebilir. Klinik açıdan uygunsa, dozun yeniden günde iki kez 300 mg'a çıkarılması denenmelidir.Serum lipaz düzeyinde yükselme: Derece 3 ya da 4 lipaz yükselmeleri için, dozlar günde bir kez 400 mg'a indirilmelidir veya kesilmelidir. Serum lipaz düzeyleri ayda bir kez ya da klinik olarak endike olduğu şekilde takip edilmelidir (bkz. Bölüm 4.4 ve Bölüm 4.8). Bilirubin ve hepatik transaminazlarda yükselme: Derece 3 ya da 4 bilirubin veya hepatik transaminaz yükselmeleri için, dozlar günde bir kez 400 mg'a indirilmelidir veya kesilmelidir (bkz. Bölüm 4.8). Ayda bir kez veya klinik olarak uygun olduğu durumlarda bilirubin ve serum hepatik transaminazlar ölçülmelidir. Bir dozun atlanması durumunda, hasta ilave bir doz almayıp, reçete edilen bir sonraki doz ile devam etmelidir. Özel popülasyonlara ilişkin ek bilgiler : Böbrek yetmezliği:Böbrek fonksiyonu bozulmuş hastalarda klinik çalışmalar gerçekleştirilmemiştir. Klinik çalışmalara, serum kreatinin konsantrasyonu normal aralığın üst sınırının (1.2 mg/dl) 1.5 mislinden fazla olan hastalar dahil edilmemiştir.Nilotinib ve metabolitleri böbrekler aracılığıyla atılmadığı için, böbrek yetmezliği olan hastalarda toplam vücut klerensinde bir azalma beklenmemektedir. Karaciğer yetmezliği:Karaciğer yetmezliği nilotinibin farmakokinetiği üzerinde hafif derecede etki gösterir. Karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli görülmemekle birlikte, karaciğer yetmezliği olan hastalarda dikkatli kullanılmalıdır. (bkz. Bölüm 4.4).Kalp rahatsızlıkları:Klinik çalışmalara, kontrol altında olmayan ya da anlamlı kalp hastalığı (yakın zamanda geçirilmiş miyokard infarktüsü, konjestif kalp yetmezliği, stabil olmayan anjina ya da klinik olarak anlamlı bradikardi dahil olmak üzere) olan hastalar dahil edilmemiştir. Kalp rahatsızlığı olan hastalarda dikkatli kullanılmalıdır (bkz. Bölüm 4.4).Pediyatrik popülasyon:18 yaşından küçük çocuklarda ve adolesanlarda klinik çalışmalar gerçekleştirilmemiştir. Kullanılmamalıdır.Geriyatrik popülasyon:Klinik çalışmalara katılan deneklerin yaklaşık %12'sini 65 yaş ve üzeri hastalar oluşturmuştur. 18 ila 65 yaş arası yetişkinlere kıyasla 65 yaş ve üzeri hastalarda güvenlilik ve etkinlik açısından herhangi bir farklılık gözlenmemiştir.4.3.KontrendikasyonlarTASIGNA, nilotinibe ya da yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olan hastalarda kullanılmamalıdır.TASIGNA QT intervalini uzatmaktadır. Bu nedenle TASIGNA, hipokalemi, hipomagnezemi veya uzun QT sendromlu hastalarda kullanılmamalıdır. 4.4.Özel kullanım uyarıları ve önlemleri QT Uzaması:In vitro veriler nilotinibin kardiyak ventriküler repolarizasyonu (QT aralığı) uzatma potansiyeline sahip olduğunu düşündürmektedir.Faz III çalışmasında yeni tanı konmuş Ph+ KML kronik faz hastalarında kararlı durumda başlangıca göre ortalama QTcF aralığı ortalama zamanı günde 2 kez nilotinib 300 mg grubunda 6 milisaniye olmuştur. Günde 2 kez 300 mg olan önerilen dozda hiçbir hastada mutlak QTcF 480 milisaniye üzerine çıkmamıştır ve torsade de pointes (geçici ya da uzun süreli) gözlenmemiştir.Hastalardakilere benzer maruziyetlerin gözlendiği bir sağlıklı gönüllü çalışmasında, başlangıca göre plasebonun çıkarıldığı ortalama QTcF değişimi 7 milisaniye (CI±4 milisaniye) olarak bulunmuştur. Hiçbir denekte 450 milisaniyenin üzerinde bir QTcF gözlenmemiştir. Ilave olarak, çalışma sırasında klinik olarak anlamlı bir aritmi vakası meydana gelmemiştir. Özellikle de, hiçbir torsade de pointes (geçici ya da uzun süreli) epizodu gözlenmemiştir.TASIGNA besinlerle ve/veya güçlü CYP3A4 inhibitörleri ve/veya QT'yi uzatma potansiyeli olduğu bilinen tıbbi ürünlerle birlikte yanlış biçimde alındığında QT aralığı anlamlı ölçüde uzar. Bu nedenle, besinlerle birlikte uygulamaktan ve güçlü CYP3A4 inhibitörleri ve/veya QT'yi uzatma potansiyeli olduğu bilinen tıbbi ürünlerle birlikte kullanımdan kaçınılmalıdır (bkz. Bölüm 4.4 ve Bölüm4.5). Hipokalemi ve hipomagnezeminin varlığı da bu etkiyi arttırabilir (bkz. Bölüm 4.2). QT aralığı uzaması hastalarda ölümcül sonuç riski ortaya çıkarabilir.QT aralığında uzama görülen veya uzama riski olan aşağıdaki hastalarda TASIGNA kullanılmamalıdır:-uzun QT sendromu olanlar,-yakın zamanda myokardiyal enfarktüs geçirenler, konjestif kalp yetmezliği, kararsız anjina veya klinik olarak anlamlı bradikardisi olanlar,-antiaritmik ürünlerin veya QT aralığının uzamasına neden olan diğer ürünlerin alınması.QTc aralığının etkilenip etkilenmediğinin yakından takip edilmesi önerilir. Nilotinib başlamadan önce bazal ve başladıktan sonra 2 haftada bir en az 2 kez daha EKG çekilmesi tavsiye edilir. TASIGNA uygulamasına başlanmadan önce hipokalemi veya hipomagnazemi düzeltilmeli ve tedavi sırasında periyodik olarak kontrol edilmelidir.Miyelosupresyon:TASIGNA tedavisinin genellikle trombositopeni, nötropeni ve anemi ile ilişkisi olabilir (Ulusal kanser enstitüsü, Genel toksisite kriteri Derece 3/4). Akselere Faz (AF) KML hastalarında bu durumlar daha sık meydana gelmektedir. Tedavinin ilk 2 ayı süresince 2 haftada bir ve daha sonra ayda bir ya da klinik olarak endike olduğu şekilde tam kan sayımı yapılmalıdır. Miyelosupresyon genellikle geri dönüşümlü olup, çoğunlukla tedaviye geçici olarak ara verilerek ya da doz azaltılarak kontrol altına alınmıştır (bkz. Bölüm 4.2). Ani Ölüm: Kalp hastalığı öyküsü veya anlamlı kardiyak risk faktörleri bulunan imatinib dirençli veya intolore kronik ve akselere faz KML hastalarında, TASIGNA kullanımı ile nadiren (%0.1-1) ani ölüm vakaları bildirilmiştir.Bu hastalarda sıklıkla altta yatan maligniteye ek olarak komorbiditelerin de mevcut olduğu görülmüş ve eş zamanlı ilaç kullanımı tespit edilmiştir. Ventriküler repolarizasyon anomalilerinin de katkı sağlayan faktörler olabileceği düşünülmüştür. Yeni tanı konmuş Ph+ KML kronik fazda, Faz III çalışmasında ani ölüm bildirilmemiştir.İlaç Etkileşimleri: TASIGNA'nın güçlü CYP3A4 inhibitörleri (ketokonazol, itrakonazol, vorikonazol, klaritromisin, telitromisin ve ritonavir dahil olmakla birlikte bunlarla sınırlı değildir) ve anti-aritmik ilaçlar gibi QT aralığını uzatabilen ilaçlar ile birlikte kullanımından kaçınılmalıdır (bkz Bölüm 4.2 ve Bölüm 4.5). Bu ilaçlardan herhangi biriyle tedavi gerekli olduğunda, mümkünse TASIGNA tedavisine ara verilmesi önerilmektedir (bkz. Bölüm 4.5). TASIGNA tedavisine geçici olarak ara verilmesi mümkün değilse, hastanın QT aralığının uzaması açısından yakından izlenmesi gereklidir (bkz. Bölüm 4.2, Bölüm 4.5 ve Bölüm 5.2). TASIGNA'nın potent CYP3A4 indükleyicileri olan tıbbi ürünlerle (fenitoin, rifampisin, karbamazepin, fenobarbital ve St. John's Wort vb.) eş zamanlı olarak uygulanması, nilotinibe maruziyeti klinik olarak anlamlı bir dereceye kadar düşürebilir. Bu nedenle, TASIGNA alan hastalarda CYP3A4 indükleme potansiyeli daha düşük olan alternatif terapötik ajanların eş zamanlı kullanımı tercih edilmelidir (bkz. Bölüm 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri). Besin Etkisi: Nilotinibin biyoyararlanımı gıdalarla artmaktadır. TASIGNA yemekle birlikte alınmamalıdır ve öğünden 2 saat sonra alınmalıdır (bkz. Bölüm 4.2, Bölüm 4.5). Doz alındıktan sonra en az bir saat yemek yenmemelidir. Greyfurt suyu ya da CYP3A4'ü inhibe ettiği bilinen diğer besinler hiçbir zaman tüketilmemelidir. Karaciğer Yetmezliği: Karaciğer yetmezliği nilotinibin farmakokinetiği üzerinde hafif derecede bir etki gösterir. Tek dozluk nilotinib uygulaması, hafif, orta ve şiddetli karaciğer yetmezliği olan hastalarda EAA değerinde, hepatik fonksiyonu normal olan bir kontrol grubuna karşı sırasıyla %35, %35 ve %19 artışa neden olmuştur. Nilotinibin öngörülen kararlı durum Cmaks değeri sırasıyla %29, %18 ve %22 artış göstermiştir. Klinik çalışmalara ALT ve/veya AST düzeyi normal aralığın üst sınırının 2.5 mislinden fazla (ya da hastalığa bağlı ise 5 mislinden fazla) ya da toplam bilirubin düzeyi normal aralığın üst sınırının 1.5 mislinden fazla olan hastalar dahil edilmemiştir. Klinik çalışmalarda, hastalarda gözlenen bilirubin ve hepatik transaminaz laboratuvar anormalliklerinin çoğu, dozun azaltılmasını ya da doza ara verilmesini gerektirmeyen düşük dereceli bir toksisite ortaya koymuştur. Yalnızca bir hastada yükselmiş serum bilirubin düzeyine bağlı olarak tedavi kesilmiştir (%0.3). Nilotinib çoğunlukla karaciğer aracılığıyla metabolize edilmektedir. TASIGNA karaciğer yetmezliği olan hastalarda dikkatle kullanılmalıdır (bkz. Bölüm 4.2). Serum Lipaz : Serum lipaz düzeylerinde yükselme gözlenmiştir. Pankreatit öyküsü olan hastalarda dikkatli olunması önerilmektedir. Abdominal semptomlarla birlikte izlenen lipaz yükselmesi olgularında doza ara verilmemeli ve pankreatit tanısını dışlamak için uygun tanı yöntemlerine başvurulmalıdır. Elektrolit Anormallikleri: TASIGNA uygulamasına başlanmadan önce hipokalemi veya hipomagnazemi düzeltilmeli ve tedavi sırasında periyodik olarak kontrol edilmelidir. Hipokalemi ve hipomagnezemisi olan hastalarda kullanılmamalıdır (bkz. Bölüm 4.3). Total Gastrektomi: Total gastrektomi geçiren hastalarda nilotinibin biyoyararlanımı azalabilir (bkz. Bölüm 5.2). Bu hastaların daha sık takip edilmesi düşünülmelidir Tümör Lizis Sendromu: Tümör lizis sendromunun (TLS) meydana gelme olasılığı nedeniyle, TASIGNA ile tedavi başlatılmadan önce klinik açıdan anlamlı dehidrasyonun düzeltilmesi ve yüksek ürik asit düzeylerinin tedavi edilmesi önerilmektedir (bkz. bölüm 4.8 İstenmeyen etkiler). Laktoz: Kapsüller laktoz içerdiği için, nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriNilotinibin serum konsantrasyonlarını arttırabilecek aktif maddeler: Nilotinib çoğunlukla karaciğerde metabolize edilmekte olup, ayrıca çoklu ilaç dışarı atım pompası, P-glikoprotein (Pgp) için de bir substrattır. Bu nedenle, sistemik olarak emilen nilotinibin absorpsiyonu ve takiben eliminasyonu CYP3A4 ve/veya Pgp üzerinde etkisi olan ilaçlardan etkilenebilir.İmatinib (P-gp ve CYP3A4'ün bir substratı ve moderatörü) ile kombinasyon halinde verilen nilotinib ile yapılan bir Faz I çalışmada her iki ilaç da CYP3A4 ve/veya PgP üzerinde hafif bir inhibitör etki göstermiştir. Bu iki ilaç eş zamanlı olarak uygulandığında, imatinibin EAA değeri %18 artarak %39, nilotinibin EAA değeri ise %18 artarak %40 olmuştur. Sağlıklı deneklerde güçlü CYP3A4 inhibitörü ketokonazol ile birlikte uygulandığında nilotinibin biyoyararlanımı 3 misli artmıştır. Bu nedenle güçlü CYP3A4 inhibitörleri (ketokonazol, itrakonazol, vorikonazol, ritonavir, klaritromisin ve telitromisin dahil olmakla birlikte bunlarla sınırlı değildir) ile eş zamanlı tedaviden kaçınılmalıdır (bkz. Bölüm 4.2 ve Bölüm 4.4). CYP3A4 inhibisyonuna yol açmayan ya da minimum düzeyde yol açan alternatif ilaçlarla eşzamanlı tedavi düşünülmelidir. Nilotinibin serum konsantrasyonlarını azaltabilecek aktif maddeler: CYP3A4 aktivitesini indükleyen ilaçlar nilotinibin metabolizmasını artırmak suretiyle plazma konsantrasyonlarını azaltabilir. CYP3A4'ü indükleyen ilaçların (örneğin; fenitoin, rifampisin, karbamazepin, fenobarbital ve St. John's Wort) eşzamanlı kullanımı nilotinibe olan maruziyeti azaltabilir. CYP3A4 indükleyicilerinin endike olduğu hastalarda, nispeten düşük bir indüksiyon potansiyeline sahip alternatif ajanların kullanımı düşünülmelidir. CYP3A4 indükleyicisi rifampisini 12 gün boyunca günde 600 mg dozda alan sağlıklı gönüllülerde nilotinibe sistemik maruziyet (EAA) yaklaşık % 80 azalmıştır. Rifampisin ve nilotinib beraber kullanılmamalıdır. Nilotinibin çözünürlüğü pH'a bağlıdır ve yüksek pH'da daha az çözünür. 5 gün boyunca günde bir kere 40 mg esomeprazol alan sağlıklı gönüllülerde, gastrik pH belirgin biçimde artmış, fakat nilotinibin emilimi sadece orta düzeyde bir düşüş göstermiştir (Cmaks'ta %27 düşüş ve EAA0_»'da %34 düşüş). TASIGNA ihtiyaca göre esomeprazolle ve diğer proton pompası inhibitörleri ile eş zamanlı olarak kullanılabilir. Sistemik konsantrasyonları nilotinib tarafından değiştirilebilecek aktif maddeler: Nilotinib CYP3A4, CYP2C8, CYP2C9, CYP2D6 ve UGT1A1'in in vitro olarak yarışmalı inhibitörü olup, en düşük Ki değeri CYP2C9 içindir (Ki=0.13 mikroM). Sağlıklı gönüllülerde, klinik olarak anlamlı konsantrasyonlarda nilotinibin hassas bir CYP2C9 substratı olan varfarinin farmakokinetiğini veya farmakodinamiğini tek doz uygulamada değiştirmediği saptanmıştır. Kararlı durum verisi olmaması nedeniyle, nilotinib tedavisine başlandıktan sonra (en az ilk 2 hafta boyunca) varfarinin farmakodinamik göstergelerinin (INR veya PT) kontrol edilmesi önerilmektedir. Ayrıca, TASIGNA'nın sağlıklı deneklerde midazolam ile tek doz olarak uygulanması midazolam maruziyetini %30 oranında artırmıştır, ancak 1-hidroksi-midazolamın midazolama metabolik oranı değişmemiştir. TASIGNA'nın, dar terapötik indekse sahip bu enzimlerin substratlarıyla (örn. astemizol, terfenadin, sisaprid, pimozid, kinidin, bepridil veya ergot alkaloidleri (ergotamin, dihidroergotamin)) eşzamanlı kullanımı esnasında dikkatli olunmalıdır. Anti-aritmik ilaçlar ve QT uzamasına neden olabilecek diğer aktif maddeler: Nilotinibin, anti-aritmik ilaçlar (amiodaron, disopramid, prokainamid, kinidin ve sotalol dahil, fakat bunlarla sınırlı olmamak üzere) ve QT uzamasına yol açabilecek diğer ilaçlar (klorokin, halofantrin, klaritromisin, haloperidol, metadon, moksifloksasin, bepridil ve pimozid dahil, fakat bunlarla sınırlı olmamak üzere) ile eş zamanlı olarak kullanımından kaçınılmalıdır. (bkz. Bölüm 4.4). Serum konsantrasyonlarını etkileyebilecek diğer etkileşmeler: TASIGNA'nın emilimi, yemekle birlikte alındığında artarak, daha yüksek bir serum konsantrasyonuna yol açmaktadır (bkz. Bölüm 4.2, Bölüm 4.4 ve Bölüm 5.2). TASIGNA yemekle birlikte değil, öğünden 2 saat sonra alınmalıdır. Doz alındıktan sonra en az bir saat yemek yenmemelidir. Greyfurt suyu ya da CYP3A4'ü inhibe ettiği bilinen diğer besinler tüketilmemelidir. Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlara ilişkin hiçbir klinik etkileşim çalışması yürütülmemiştir.Pediyatrik popülasyon:Pediyatrik popülasyona ilişkin hiçbir klinik etkileşim çalışması yürütülmemiştir.4.6. Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi D'dir.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Nilotinib'in gebelik ve/veya fetus/yeni doğan üzerinde zararlı farmakolojik etkileri bulunmaktadır.TASIGNA gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Çocuk doğurma potansiyeli olan kadınlara, TASIGNA tedavisi sırasında etkili bir doğum kontrol yöntemi uygulamaları tavsiye edilmelidir. Gebelik dönemiNilotinib'in gebelik ve/veya fetus/yeni doğan üzerinde zararlı farmakolojik etkileri bulunmaktadır. TASIGNA gerekli olmadıkça gebelik döneminde kullanılmamalıdır.Laktasyon dönemiNilotinibin insan sütüyle atılıp atılmadığı bilinmemektedir. Hayvanlar üzerinde yapılan çalışmalar, nilotinibin sütle atıldığını göstermektedir. Emzirmenin durdurulup durdurulmayacağına ya da TASIGNA tedavisinin durdurulup durdurulmayacağına / tedaviden kaçınılıp kaçınılmayacağına ilişkin karar verilirken, emzirmenin çocuk açısından faydası ve TASIGNA tedavisinin emziren anne açısından faydası dikkate alınmalıdır. Bebekle ilgili risk olasılık dışı bırakılamayacağından, kadınlar TASIGNA tedavisi sırasında emzirmemelidir.Üreme yeteneği /Fertiliteİnsanlar için önerilen dozun yaklaşık 5 katı olan test edilen en yüksek doza kadar, erkek ya da dişi sıçanlarda sperm miktarı/motilitesi ve doğurganlık üzerinde herhangi bir etki gözlenmemiştir. TASIGNA kullanan, cinsel olarak aktif erkek ya da kadın hastalar etkili bir doğum kontrol yöntemi kullanmalıdır (bkz. Bölüm 5.3).4.7.Araç ve makine kullanımı üzerindeki etkilerNilotinibin araç ve makine kullanma etkisini inceleyen herhangi bir çalışma gerçekleştirilmemiştir. Baş dönmesi, görme bozukluğu ya da güvenli taşıt kullanma ya da makine kullanma yeteneği üzerinde potansiyel bir etkiye sahip diğer istenmeyen yan etkiler yaşayan hastalar, bu yan etkiler devam ettiği sürece bu aktiviteleri gerçekleştirmemelidir (bkz. Bölüm 4.8).4.8.İstenmeyen etkilerAşağıdaki veriler bir randomize Faz III çalışmasında yeni tanı konmuş Ph+ KML kronik evresinde önerilen doz ile (günde iki kez 300 mg) tedavi edilen hastaların (n=279) maruziyetini yansıtmaktadır. Bu çalışmada günde iki kez 300 mg nilotinib ile tedavi edilen hastaların %64'ü 12 ay ve %16.5'i 18 aydan uzun sure tedavi görmüştür. Medyan tedavi süresi 14 ay olmuştur.En sık bildirilen ve hematolojik olmayan ilaca bağlı advers olaylar döküntü, kaşıntı, baş ağrısı, bulantı, halsizlik ve miyalji olmuştur. Çoğu ilaca bağlı advers olaylar hafif ve orta şiddette (Derece 1 ya da 2) gözlenmiştir. Üst abdominal ağrı, alopesi, konstipasyon, diyare, deride kuruluk, kas spazmları, artralji, abdominal ağrı, periferik ödem ve kusma daha az gözlenmiş (<%10 ve >%5) ve hafif/orta şiddette olup genel olarak doz azaltmasına gerek kalmadan tedavi edilmiştir. Plevral ve perikardiyal effüzyon TASIGNA kullanan hastaların %1'inden azında ortaya çıkmıştır. Gastrointestinal hemoraji de hastaların %1'inden azında bildirilmiştir. Kararlı durumda başlangıca göre ortalama QTcF aralığı ortalama zamanı günde 2 kez nilotinib 300 mg grubunda 6 milisaniye olmuştur. Nilotinib günde iki kez 400 mg ve imatinib günde bir kez 400 mg imatinib gruplarında ortalama QTcF aralığı ortalama zamanı sırasıyla 6 milisaniye ve 3 milisaniye bulunmuştur. Tedavi gruplarının hiçbirinde mutlak QTcF aralığı 500 milisaniye üzerinde olan hasta ya da torsade de pointes olayı gözlenmemiştir. Başlangıca göre QTcF artışı 3 hastada 60 milisaniye üzerine çıkmıştır (bir hasta günde 2 kez 300 mg ve iki hasta günde iki kez 400 mg tedavi gruplarında). Tedavi gruplarının hiçbirinde tedavi sırasında herhangi bir zamanda başlangıca göre ortalama left ventricular ejection fraction (LVEF) değerinde azalma gözlenmemiştir. Tedavi gruplarında tedavi sırasında LVEF <%45 olan ve mutlak LVEF değeri düşüşü >%15 olan hasta olmamıştır. Ani ölüm bildirilmemiştir. Hematolojik advers ilaç reaksiyonları miyelosupresyon; trombositopeni (%17), nötropeni (%14) ve anemi (%6) olmuştur. bkz Tablo 3: derece 3/4 laboratuvar anormallikleri. Nedenselliğe bakılmaksızın advers olay nedeniyle hastaların %6.8'i tedaviyi bırakmıştır. TASIGNA klinik çalışmalarında hastaların en az %5'inde bildirilen ve hematolojik olmayan advers ilaç reaksiyonları (laboratuvar anormallikleri dışında) Tablo 2'de gösterilmektedir. Bu olaylar, aşağıdaki sistem kullanılarak, en sık gözlenen ilk sırada yer almak üzere görülme sıklıklarına göre sıralanmıştır: çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Tablo 2: Hematolojik olmayan Advers Reaksiyonlar (yeni tanı kronik faz KML hastalarında 300 mg BID dozu ile gözlenen advers reaksiyonlar, n:279 tüm hastaların% 5'i)
Sistem Organ SınıfıSıklıkAdvers ReaksiyonTüm dereceler Derece %
Klinik çalışmalardan elde edilen ilave verilerAşağıdaki advers ilaç olayları, TASIGNA ile gerçekleştirilen klinik çalışmalarda %5'den düşük bir sıklıkta bildirilmiştir (çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor kategorisindedir). "Araştırmalar" altında listelenen advers ilaç olayları için, Tablo 2'ye dahil edilmeyen çok yaygın olaylar da (>1/10) bildirilmektedir. Bu advers reaksiyonlar, klinik anlamlılığa dayalı olarak dahil edilmiş ve her bir kategoride azalan bir sıklık sırasına göre listelenmiştir .Enfeksiyonlar ve enfestasyonlarYaygın: FollikülitYaygın olmayan: Üst solunum sistemi enfeksiyonu, pnömoni, üriner sistem enfeksiyonu, gastroenterit, farenjit. Sıklığı bilinmeyen: Sepsis, bronşit, herpes virüsü enfeksiyonu, kandidiyazis, subkutan apse, anal apse,solunum sistemi enfeksiyonu, nazofarenjit, rinit, furonkül, tinea pedis. Kist ve polipler de dahil olmak üzere iyi huylu ve kötü huylu neoplazmalarYaygın: Deri papilloması. Sıklığı bilinmeyen: Papilloma.Kan ve lenf sistemi hastalıklarıYaygın: Ateşli nötropeni, lenfopeni, pansitopeni. Sıklığı bilinmeyen: Trombositemi, lökositoz.Bağışıklık sistemi hastalıkları:Sıklığı bilinmeyen: HipersensitiviteEndokrin hastalıklarıYaygın olmayan: Hipertiroidizm.Sıklığı bilinmeyen: Hipotiroidizm, sekonder hiperparatiroidizm ,tiroidit. Metabolizma ve beslenme hastalıklarıYaygın: Hipokalemi, diyabet, hiperkolesterolemi, hiperlipidemi, hiperkalemi, hipomagnezemi, hiperglisemi.Yaygın olmayan: Hiponatremi, hipokalsemi, hipofosfatemi, dehidratasyon, iştahta azalma, iştahta artış. Sıklığı bilinmeyen: Hiperkalsemi, hiperfosfatemi, hiperürisemi, gut, hipoglisemi, dislipidemi Psikiyatrik hastalıklarYaygın: Uykusuzluk.Yaygın olmayan: Depresyon, anksiyete. Sıklığı bilinmeyen: Konfüzyon durumu, desoryantasyon, amnezi,disforia. Sinir sistemi hastalıklarıYaygın: Baş dönmesi, hipoestezi, parestezi.Yaygın olmayan: İntrakraniyal kanama, migren, tremor, hiperastezi. Sıklığı bilinmeyen: Beyin ödemi, periferik nöropati, optik nörit, senkop, letarji, disastezi Göz hastalıklarıYaygın: Göz kaşıntısı, konjonktivit,kuru göz.Yaygın olmayan:G kanaması, görme keskinliğinde azalma, göz tahrişi, periorbital ödem, göz kapağı ödemi, fotopsi Sıklığı bilinmeyen: Papilla ödemi, diplopi, bulanık görme, gözde şişme, fotofobi, blefarit, göz ağrısı, koriyoretinopati, konjonktival hemoraji, konjonktivit allejik, konjonktival hiperemi, okular hiperemi, okular yüzey hastalığı, skleral hiperemi. Kulak ve iç kulak hastalıklarıYaygın: VertigoSıklığı bilinmeyen: İşitme bozukluğu, kulak ağrısı. Kardiyak hastalıklarYaygın: Elektrokardiyogramda QT uzaması, çarpıntı, aritmi (taşikardi, atrial fibrilasyon, ventriküler ekstrasistol, sinüs bradikardisi dahil)Yaygın olmayan: Kalp yetmezliği, anjina pektoris, atriyal fibrilasyon, perikardiyal efüzyon, koroner arter hastalığı, siyanoz, kardiyomegali, üfürüm, bradikardi. Sıklığı bilinmeyen: Miyokard infarktüsü, perikardit, ventriküler fonksiyon bozukluğu, kalp çarpıntısı, ekstrasistol, aritmi, ejeksiyon fraksiyonun azalması. Vasküler hastalıklarYaygın: Yüz kızarıklığı, hipertansiyon.Yaygın olmayan: Hipertansif kriz, hematom. Sıklığı bilinmeyen: Hemorajik şok, hipotansiyon, tromboz. Solunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın: Dispne, eforlu dispne, öksürük, disfoni.Yaygın olmayan: Pulmoner ödem, plevral efüzyon, interstisyel akciğer hastalığı, plevra ağrısı, burun kanaması, yutak-gırtlak ağrısı, plörezi, boğaz tahrişi. Sıklığı bilinmeyen: Pulmoner hipertansiyon. Gastrointestinal hastalıklarYaygın: Karında rahatsızlık, karında şişkinlik, gaz.Yaygın olmayan: Karında şişkinlik, gastrointestinal kanama, pankreatit, gastroözofageal reflü, melena, ağız ülserasyonu, stomatit, ağız kuruluğu, özofageal ağrı, disguzi Sıklığı bilinmeyen: Gastrik ülser, gastrointestinal ülser perforasyonu, retroperitoneal kanama, hematemez, ülseratif özofajit, subileus, gastrit, hemoroid, hiatus hernisi, rektal hemoraji, dişlerde duyarlılık, jinjivit. Hepato-bilier hastalıklarYaygın: Hepatik işlevlerde anormallik.Yaygın olmayan: Hepatit, sarılık Sıklığı bilinmeyen: Hepatotoksisite, hepatomegali. Deri ve deri altı doku hastalıklarıYaygın: Gece terlemeleri, hiperhidroz, egzema, ürtiker, eritem, kontüzyon, akne, dermatitYaygın olmayan: Eksfolyatif döküntü, ilaç erüpsiyonu, deride ağrı, ekimoz, yüzde şişme. Sıklığı bilinmeyen: Eritema nodosum, deri ülseri, peteşi, fotosensitivite, soyulma, dermal kist, sebasöz hiperplazi, deri atrofisi, deride renk değişikliği, deride ekfoliyasyon, deride hiperpigmentasyon, deride hipertrofi. Kas-iskelet bozukluklar, bağ doku ve kemik hastalıklarıYaygın: Kas-iskelet göğüs ağrısı, sırt ağrısı, kas-iskelet ağrısı.Yaygın olmayan: Ağrı, kas zayıflığı. Sıklığı bilinmeyen: Artrit, eklem şişkinliği, kalça ağrısı Böbrek ve idrar hastalıklarıYaygın olmayan: Dizüri, idrar sıkışması, noktüri, pollakiüri.Sıklığı bilinmeyen: Böbrek yetmezliği, hematüri, üriner enkontinans,kromatüri Üreme sistemi ve meme hastalıklarıYaygın olmayan: Meme ağrısı, erektil fonksiyon bozukluğu, jinekomasti. Sıklığı bilinmeyen: Memede indurasyon, menoraji, meme başında şişlik.Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın: Pireksi, göğüs ağrısı, göğüste sıkıntıYaygın olmayan: Grip benzeri hastalık, titremeler, yüzde ödem, yerçekimine bağlı ödem, kırıklık. Sıklığı bilinmeyen: Sıcak basması, lokalize ödem. AraştırmalarÇok yaygın: Lipaz düzeyinde artış.Yaygın: Trombosit sayısında azalma, kan amilaz düzeyinde artış, alanin aminotransferaz düzeyinde artış, aspartat aminotransferaz düzeyinde artış, kan bilirubin düzeyinde artış, kan alkalin fosfataz düzeyinde artış, gama-glutamiltransferaz düzeyinde artış, kan kreatinin fosfokinaz düzeyinde artış, kan glukoz düzeyinde artış, vücut ağırlığında artış, vücut ağırlığında düşüş. Yaygın olmayan: Hemoglobinde azalma, nötrofil sayısında azalma, kan laktat dehidrojenaz düzeyinde artış, kan glukoz düzeyinde azalma, kan kreatinin düzeyinde artış, kan üre düzeyinde artış. Sıklığı bilinmeyen: Troponin düzeyinde artış, kan potasyumu düzeyinde azalma, kanda konjuge olmayan bilirubin düzeyinde artış, kanda insülin artışı, çok düşük yoğunluklu lipoprotein artışı, kanda paratiroit hormon artışı, kanda fosfor azalması, kanda potasyum artışı, kan basıncı artışı, beyaz kan hücre sayısında azalma. Laboratuar anormallikleri Rutin hematolojik ya da biyokimyasal laboratuar değerlerindeki klinik olarak anlamlı ya da şiddetli anormallikler Tablo 3'de gösterilmiştir:
4.9. Doz aşımı ve tedavisiNilotinible, belirtilmeyen sayıda TASIGNA kapsülün alkol veya diğer ilaçlarla birlikte içildiği kasıtlı doz aşımına ilişkin münferit raporlar alınmıştır. Advers olaylar nötropeni, kusma ve sersemlik olmuştur. EKG değişiklikleri veya hepatoksisite bildirilmemiştir. Bildirilen sonuçlar olayların ortadan kalktığı yönündedir.Doz aşımı durumunda, hasta gözlem altında tutulmalı ve uygun destekleyici tedavi uygulanmalıdır. 5.FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Antineoplastik ajan: Protein-tirozin kinaz inhibitörü ATC Kodu: L01XE08Etki mekanizması: TASIGNA, hem hücre dizilerinde hem de Philadelphia-kromozomu pozitif primer lösemi hücrelerinde, Bcr-Abl onkoproteininin Abl tirozin kinaz aktivitesinin güçlü ve selektif bir inhibitörüdür. İlaç, ATP bağlanma yerine son derece yüksek bir afinite ile bağlanarak, vahşi-tip Bcr-Abl'yi güçlü bir şekilde inhibe etmekte ve Bcr-Abl'nin imatinibe karşı dirençli 32/33 mutant formuna karşı etkinlik sağlamaktadır. Bu biyokimyasal etkinliğin bir sonucu olarak, nilotinib KML hastalarından alınan Philadelphia-kromozomu pozitif primer lösemi hücrelerinde ve hücre dizilerinde selektif olarak proliferasyonu inhibe etmekte ve apopitozu indüklemektedir. KML sıçan modellerinde, nilotinib monoterapi olarak oral uygulamayı takiben tümör yükünü azaltmakta ve sağ kalımı uzatmaktadır. TASIGNA'nın, KML tedavisi için önerilen terapötik dozlarda oral uygulamayı takiben elde edilen aralıktaki konsantrasyonlarda inhibe ettiği PDGF, Kit CSF-1R, DDR ve Efrin reseptör kinazları dışında, Src de dahil olmak üzere incelenen diğer protein kinazların çoğuna karşı hiçbir etkisi yoktur ya da çok küçük bir etkisi vardır (bkz. Tablo 4). Tablo 4: Nilotinibin Kinaz Profili (Fosforilasyon IC50 nM)
Sitogenetik olarak doğrulanmış yeni tanı konmuş yetişkin Ph+ KML-KF (kronik faz) hastalarında TASIGNA ve Glivec etkinliklerinin karşılaştırılması amacıyla açık etiketli, çok merkezli, randomize bir Faz III çalışması yürütülmüştür. Hastalar tanı konulduktan sonra 6 ay içinde hidroksiüre ve/veya anagrelid dışında KML-KF tedavisi görmemiştir. Ek olarak, hastalar tanı zamanında Sokal risk skoruna göre tabakalandırılmıştır. Etkinlik toplam 846 hastada değerlendirilmiştir (günde bir kez 400 mg imatinib grubunda 283 hasta, günde iki kez 300 mg nilotinib grubunda 282 hasta, günde iki kez 400 mg nilotinib grubunda 281 hasta). Başlangıç özellikleri üç grup arasında iyi dengelenmiştir. Medyan yaş imatinib grubunda 46 ve nilotinib gruplarında 47 olup; imatinib, günde iki kez 300 mg nilotinib ve günde iki kez 400 mg nilotinib gruplarında >65 yaşındaki hasta oranı sırasıyla %12.4, %12.8 e %10.0 olmuştur. Üç grupta da erkek sayısı kadın sayısından biraz daha fazladır (%55.8, %56.0 ve %62.3; imatinib, günde iki kez nilotinib 300 mg ve günde iki kez 400 mg nilotinib). Hastaların %60'ı Beyaz ve %25'i Asyalıdır. Birincil veri analizi noktası 846 hastanın 12 aylık tedaviyi tamamlama (ya da daha erken bırakma) zamanı olmuştur. Üç tedavi grubunda da medyan tedavi süresi 14 ay olmuştur. Her tedavi kolunda hastaların %60'ı 12 aydan daha uzun süre tedavi görmüştür. Medyan doz yoğunluğu imatinib grubunda 400 mg/gün, günde iki kez 300 mg nilotinib grubunda 592.2 mg/gün ve günde iki kez 400 mg nilotinib grubunda 778.8 mg/gün olmuştur. Bu çalışma sürmektedir. Majör moleküler yanıt (MMY) Birincil etkinlik değişkeni çalışma ilacına başladıktan sonra 12. ayda MMY olmuştur. MMY RQ-PCR ile ölçülen uluslararası ölçekte<%0.1 BCR-ABL/ABL olarak tanımlanmış ve başlangıç göre BCR-ABL transkriptinde >3 log azalmasına karşılık gelmiştir. Birincil etkinlik değişkeni 12. ayda Majör Moleküler Yanıt (MMY) günde iki kez 300 mg nilotinib grubunda günde bir kez 400 mg imatinib grubuna göre istatistiksel olarak anlamlı derecede daha yüksek bulunmuştur (%44.3 vs %22.3, p<0.0001). 12 ayda MMY oranı günde iki kez 400 mg nilotinib grubunda da günde bir kez 400 mg imatinib grubuna göre istatistiksel olarak anlamlı derecede daha yüksek bulunmuştur (%42.7 vs %22.3, p<0.0001), Tablo 5. Nilotinib için önerilen günde iki kez 300 mg dozda 3, 6, 9 ve 12 ayda MMY oranları %8.9, %33.0, %43.3 ve %44.3 bulunmuştur. Günde iki kez 400 mg nilotinib grubunda 3, 6, 9 ve 12 ayda MMY oranları %5.0, %29.5, %38.1 ve %42.7 bulunmuştur. Günde tek doz 400 mg imatinib grubunda 3, 6, 9 ve 12 ayda MMY oranları %0.7, %12.0, %18.0 ve %22.3 olmuştur. Tüm hastalarda ilk MMY görülme zamanı Kaplan-Meier analizinin grafiği Şekil 1'de görülmektedir. Farklı zaman noktalarında MMY olasılığı her iki nilotinib grubunda imatinib grubuna göre daha yüksek bulunmuştur (HR=2.6 ve tabakalandırılmış log-rank p<0.0001 günde iki kez nilotinib 300 mg ve imatinib, HR=1.6 ve tabakalandırılmış log-rank p<0.0001 günde iki kez nilotinib 400 mg ve imatinib). 12. ayda BCR-ABL oranı <%0.01 (4-log azalma) ve <%0.0032 (4.5 log azalma) olan hasta oranı nilotinib gruplarında (%11.7/%4.3 ve %8.5/%4.6) imatinib grubuna (%3.9/%0.4) göre istatistiksel olarak daha yüksek olmuştur. Tüm Sokal risk gruplarında yanıt oranı iki nilotinib grubunda da imatinib grubundan daha yüksek olmuştur. Tablo 5 12 ayda MMY oranı
Şekil 1- İlk MMY zamanı Kaplan-Meier hesaplaması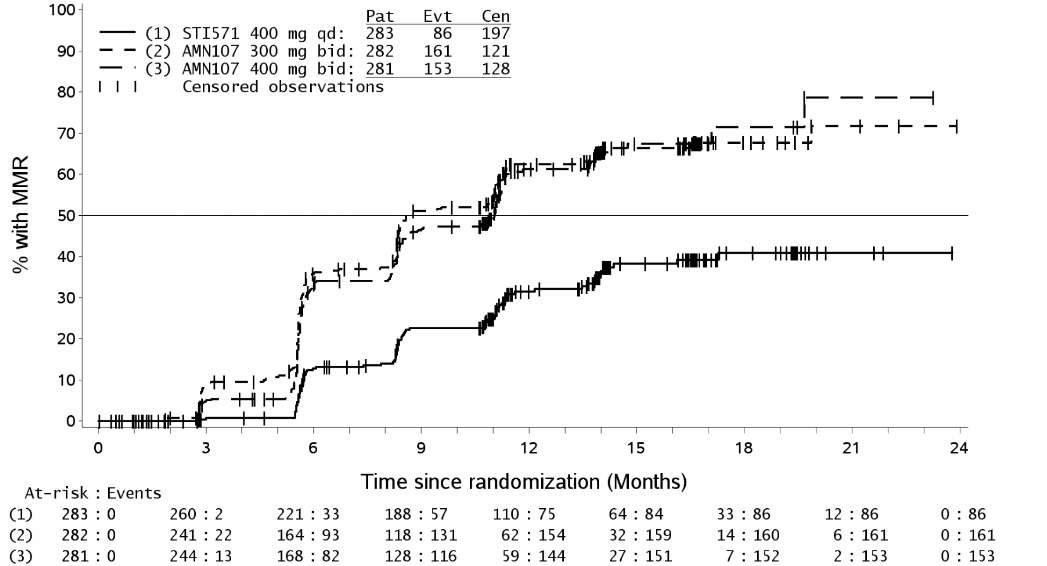 Tam sitogenetik yanıt (TSY)
Tam sitogenetik yanıt (TSY)TSY en az 20 metafaz değerlendirmesinde kemik iliğinde %0 Ph+ metafaz olarak tanımlanır. 12 ayda en iyi TSY oranı (12 ay ve öncesinde TSY sağlanan ve yanıt veren kabul edilen hastaları da içerir) günde iki kez nilotinib 300 mg ve günde iki kez 400 mg nilotinib grubunun, günde bir kez 400 mg imatinib grubuna göre istatistiksel olarak daha yüksek bulunmuştur, Tablo 6. Tablo 612 ayda en iyi TSY oranı
Tedavide 14 hastada AF ya da BK ilerlemesi saptanmıştır (günde iki kez nilotinib 300 mg grubunda 2, günde iki kez nilotinib 400 mg grubunda 1 ve günde tek doz 400 mg imatinib grubunda 11). Progresyon görülen hastalarda MMY sağlanamamıştır. Bununla birlikte TSY 3 hastada sağlanmıştır (tümü imatinib grubunda). 12 ayda AF ya da BK ilerlemesi görülmeyen hasta oranı %99.3, %99.6 ve % 96.5 olarak hesaplanmıştır. AF ya da BK ilerlemesi açısından günde iki kez nilotinib 300 mg ve imatinib (p=0.0095); günde iki kez nilotinib 400 mg ve imatinib (p=0.0037) grupları arasında istatistiksel olarak anlamlı fark saptanmıştır. 5.2. Farmakokinetik özelliklerGenel özelliklerTASIGNA(nilotinib) tirozin kinaz inhibitörüdür ve antineoplastik bir ajandır. Nilotinib beyaz ila hafif sarımsı renkte tozdur. Nilotinibin sulu çözeltilerdeki çözünürlüğü pH'nın yükselmesi ile azalır. Nilotinib optik olarak aktif değildir. pKa'sı 2.1'dir.Emilim:Oral uygulamadan 3 saat sonra nilotinibin doruk konsantrasyonlarına ulaşılmaktadır. Oral uygulamayı takiben nilotinibin emilimi yaklaşık %30 olarak belirlenmiştir. Sağlıklı gönüllülerde TASIGNA yemekle birlikte verildiğinde, nilotinibin Cmaks değeri ve plazma konsantrasyonu-zaman eğrisinin altında kalan alanı (EAA), aç karnına alınmasına kıyasla sırasıyla %112 ve %82 oranında artmıştır. TASIGNA'nın yemekten 30 dakika ya da 2 saat sonra alınması nilotinibin biyoyararlanımını sırasıyla %29 ve %15 oranında artırmıştır (bkz. Bölüm 4.2, Bölüm 4.4, Bölüm 4.5). Nilotinibin emilimi (bağıl biyoyararlanım) sırasıyla total gastrektomi ve kısmi gastroktemi geçirmiş hastalarda yaklaşık %48% ve %22 azalabilir. Dağılım:Nilotinibin kan-plazma oranı 0.68'dir. Plazma proteinlerine bağlanma, in vitro deneylere dayalı olarak yaklaşık %98 oranındadır. Biyotransformasyon:Sağlıklı deneklerde tanımlanan ana metabolik yollar karaciğerde oksidasyon ve hidroksilasyondur. Nilotinib, serumdaki başlıca dolaşan bileşendir. Metabolitlerin hiçbiri nilotinibin farmakolojik aktivitesine anlamlı bir katkıda bulunmamaktadır. Eliminasyon:Sağlıklı gönüllülerde radyoaktif madde ile işaretlenmiş nilotinibin tek bir dozunun uygulanmasından sonra, dozun %90'ımndan fazlası 7 gün içerisinde çoğunlukla feçesten atılmıştır. Ana ilaç, dozun %69'unu teşkil etmiştir. Doğrusallık / doğrusal olmayan durum:Kararlı durumda nilotinib maruziyetinin, günde bir kez 400 mg'ın üzerindeki doz düzeylerinde sistemik maruziyette doz ile orantılı artıştan daha az bir artış olmak üzere, doza bağımlı olduğu gözlenmiştir. Kararlı durumda, günde iki kez 400 mg'lık dozda uygulanan nilotinibe olan günlük serum maruziyetinin, günde bir kez 800 mg'lık doza kıyasla %35 daha yüksek olduğu görülmüştür.Günde iki kez nilotinib 400 mg ile kararlı durumdaki sistemik maruziyet (EAA) günde iki kez 300 mg doza göre yaklaşık %13.4 daha yüksek bulunmuştur. 12 ayda nilotinib vadi ve tepe ortalama konsantrasyonu günde iki kez 400 mg ile günde iki kez 300 mg doza göre sırasıyla %15.7 ve %14.8 daha yüksek bulunmuştur. Doz, günde iki kez 400 mg'dan günde iki kez 600 mg'a çıkarıldığında, nilotinib maruziyetinde anlamlı bir artış olmamıştır. Hastalardaki karakteristik özelliklerPediyatrik hastalar:18 yaşından küçük çocuklarda ve adolesanlarda nilotinibin farmakokinetiği ile ilgili çalışmalar gerçekleştirilmemiştir. Yaşlılarda:65 yaş ve üzeri hastalarda farmakokinetik açıdan herhangi bir farklılık gözlenmemiştir. Yaşlı hastalarda doz ayarlamasına gerek yoktur. Böbrek yetmezliği:Böbrek fonksiyonu bozulmuş hastalarda nilotinibin farmakokinetiği ile ilgili çalışmalar gerçekleştirilmemiştir. Klinik çalışmalara, serum kreatinin konsantrasyonu normal aralığın üst sınırının (1.2 mg/dl) 1.5 mislinden fazla olan hastalar dahil edilmemiştir. Karaciğer yetmezliği:Karaciğer yetmezliği olan hastalarda nilotinibin farmakokinetiği incelenmemiştir. Klinik çalışmalara ALT (40 U/L) ve/veya AST (40 U/L) düzeyi normal aralığın üst sınırının 2.5 mislinden fazla (ya da hastalığa bağlı ise 5 mislinden fazla) ya da toplam bilirubin (1.2 mg/dl) düzeyi normal aralığın üst sınırının 1.5 mislinden fazla olan hastalar dahil edilmemiştir. Nilotinib çoğunlukla karaciğer aracılığıyla metabolize edilmektedir. Bu nedenle, karaciğer yetmezliği olan hastalarda dikkatli kullanılmalıdır. Bireyler arası değişkenlik:Sekizinci günde kararlı durum konsantrasyonu elde edilmiştir. İlk doz ile kararlı durum arasında serum nilotinib maruziyetindeki artışın günde bir uygulama için yaklaşık 2 misli ve günde iki kez uygulama için 3.8 misli olduğu gözlenmiştir. Günde bir uygulama ile çoklu doz farmakokinetiğinden hesaplanan eliminasyon yarı ömrü yaklaşık 17 saat olarak tayin edilmiştir. Nilotinibin farmakokinetiğinde hastalar arası değişkenlik orta ila yüksek dereceli bulunmuştur. 5.3. Klinik öncesi güvenlilik verileriNilotinib güvenilirlik farmakolojisi, tekrarlanan doz toksisitesi, genotoksisite, üreme sistemi toksisitesi ve fototoksisite çalışmalarında değerlendirilmiştir.Nilotinibin MSS ya da solunum fonksiyonları üzerinde herhangi bir etkisi olmamıştır. İn vitro kardiyak güvenirlilik çalışmaları QT uzaması için preklinik bir belirti ortaya koymuştur. 39 haftaya kadar tedavi edilen köpeklerde ya da maymunlarda gerçekleştirilen özel bir telemetri çalışmasında EKG ölçümlerinde herhangi bir etki görülmemiştir. 4 haftalık bir süreye kadar köpeklerde ve 9 aylık bir süreye kadar sinomolog maymunlarında gerçekleştirilen tekrarlanan doz toksisite çalışmaları karaciğerin, nilotinibin toksisitesi için başlıca hedef organ olduğunu göstermiştir. Değişimler artmış alanin aminotransferaz ve alkalin fosfataz aktivitesini ve histopatoloji bulgularını (çoğunlukla sinüzoidal hücre ya da Kupffer hücresi hiperplazisi/hipertrofisi, safra kanalı hiperplazisi ve periportal fibrozit) kapsamıştır. Genelde, klinik kimyadaki değişiklikler 4 haftalık bir iyileşme döneminden sonra tamamen düzelirken, histolojik değişiklikler yalnızca kısmi bir tersinirlik ortaya koymuştur. Karaciğer etkilerinin görüldüğü en düşük doz düzeylerindeki maruziyetlerin, insanlarda 800 mg/gün'lük bir dozdaki maruziyetten daha düşük olduğu gözlenmiştir. 26 haftaya kadar tedavi edilen farelerde ya da sıçanlarda yalnızca küçük karaciğer değişiklikleri gözlenmiştir. Sıçan, köpek ve maymunlarda kolesterol düzeylerinde çoğunlukla geri dönüşümlü artışlar gözlenmiştir. Bakteriyel in vitro sistemlerde ve in vitro ve in vivo memeli sistemlerinde metabolik aktivasyonla ve metabolik aktivasyon olmaksızın gerçekleştirilen genotoksisite çalışmaları, nilotinibin mutajenik potansiyeline ilişkin herhangi bir kanıt ortaya koymamıştır. Nilotinib teratojeniteyi indüklememiş, fakat maternal toksisiteye de yol açan dozlarda embriyo- ve fetotoksisiteye yol açmıştır. Hem erkeklerin hem de kadınların tedavi edildiği fertilite çalışmasında da, kadınların tedavi edildiği embriyotoksisite çalışmasında da artmış bir postimplantasyon kaybı gözlenmiştir. Embriyotoksisite çalışmalarında, sıçanlarda embriyo-letalite ve fötal etkiler (çoğunlukla azalmış fetus ağırlıkları, viseral ve iskeletsel değişimler) ve tavşanlarda ise artmış fetus rezorpsiyonu ve iskeletsel değişimler gözlenmiştir. Dişilerde Advers Etki Gözlenmeyen Düzeylerdeki nilotinib maruziyetinin genellikle, insanlarda 800 mg/gün ile elde edilenden daha düşük ya da buna eşit olduğu gözlenmiştir. Bir prenatal ve postnatal çalışmada, nilotinibin dişi sıçanlara 60 mg/kg dozda gebeliğin 6. gününden post partum 21. veya 22. güne kadar oral yoldan uygulanması maternal etkilere (besin tüketiminde azalma ve kilo artışında düşüş) ve gebelik döneminin daha uzun sürmesine neden olmuştur. 60 mg/kg'lık maternal doz yavruların vücut ağırlığında azalma ve bazı fiziksel gelişim parametrelerindeki değişimlerle (pinnanın açılması, dişlerin çıkması ve gözlerin açılması daha erken gerçekleşmiştir) ilişkilendirilmiştir. Annelerde ve yavrularda advers etki gözlenmeyen düzey 20 mg/kg maternal dozdur. Nilotinibin UV-B ve UV-A aralığında ışığı absorbe ettiği ve deriye dağılarak in vitro olarak fototoksik bir potansiyel gösterdiği ortaya konmuştur. Bununla birlikte, in vivo ortamda bu tip etkiler görülmemiştir. Bu nedenle, nilotinibin hastalarda fotosensitizasyona yol açma riski çok düşük kabul edilmektedir. Nilotinib ile karsinojenite çalışması gerçekleştirilmemiştir. 6. FARMASÖTİK ÖZELLİKLER6.1.Yardımcı maddelerin listesiLaktoz monohidrat 117.08 mgKrospovidon Poloksamer 188 Susuz koloidal silika/Koloidal silikon dioksit Magnezyum stearat Jelatin Titanyum dioksit (E171) Demir oksit, sarı (E 172) Demir oksit, kırmızı (E 172) Demir oksit, siyah (E172) 6.2.GeçimsizliklerBilinen geçimsizliği yoktur.6.3.Raf ömrü24 aydır.6.4.Saklamaya yönelik özel tedbirler30°C'nin altındaki oda sıcaklığında ve orijinal ambalajında saklayınız.6.5.Ambalajın niteliği ve içeriğiPVC/PVDC blisterler.28 ve 112 kapsül içeren blister ambalaj. 6.6.Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj ve Ambalaj Atıklar Kontrolü Yönetmeliği"'ne uygun olarak imha edilmelidir.7.RUHSATSAHİBINovartis Ürünleri 34912 Kurtköy - İstanbul Tel: 0 216 560 10 00 Faks: 0 216 482 64 088.RUHSAT NUMARASI132/259.İLK RUHSAT TARIHI/RUHSAT YENİLEME TARIHIİlk ruhsat tarihiRuhsat yenileme tarihi:10.KUB'UN YENİLENME TARİHİ |
İlaç BilgileriTasigna 150mg KapsülEtken Maddesi: Nilotinib Atc Kodu: L01XE08 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.