EMOCLOT 500 IU Kısa Ürün BilgisiKan ve Kan Yapıcı Organlar » Kanama Durdurucu İlaçlar » K Vitamini ve Diğer Hemostatikler » Kan Koagülasyon (pıhtılaşma) Faktörleri » Koagülasyon Faktörü 8 KISA ÜRÜN BİLGİSİ1.BEŞERİ TIBBİ ÜRÜNÜN ADIEMOCLOT 500 IU/10 mL IV infüzyon için liyofilize toz içeren flakon2.KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:Dondurularak kurutulmuş insan plazma kaynaklı pıhtılaşma Faktör VIII 500 IU, Emoclot 500 IU'nun spesifik aktivitesi yaklaşık 80 IU/mg proteindir.Yardımcı madde(ler):Sodyum klorür 66.0 mg Tribazik sodyum sitrat 29.4mgYardımcı maddeler için bölüm 6.1' e bakınız. 3.FARMASÖTİK FORMİnfüzyonluk çözelti için toz ve çözücü.Tıbbi ürün beyaz veya açık sarı, higroskopik toz veya ufalanabilen katı. 4.KLİNİK ÖZELLİKLER4.1.Terapötik EndikasyonlarHemofili A hastalarında (konjenital Faktör VIII yetmezliği) kanamanın profilaksi ve tedavisinde,Edinilmiş Faktör VIII yetmezliğinde, Faktör VIII'e karşı antikor gelişmiş hemofili hastalarının tedavisinde kullanılır. Von Willebrand hastalığında Emoclot 500 IU'nun etkisi spesifik bir klinik çalışma ile kanıtlanmamıştır. Bundan dolayı von Willebrand hastalığında endike değildir. 4.2.Pozoloji ve uygulama şekli Pozoloji / uygulama sıklığı ve süresi:Tedavi hemofili tedavisinde deneyimli bir uzman tarafından başlatılmalıdır. Ürün, intravenöz yoldan enjeksiyon veya yavaş infüzyon şeklinde uygulanır. Yerine koyma tedavisinin dozu ve süresi; Faktör VIII eksikliğinin şiddetine, kanamanın yeri ve önemi ile hastanın klinik durumuna bağlıdır.Uygulanan Faktör VIII ünitesinin sayısı, Faktör VIII ürünleri için Güncel olan WHO standartlarına bağlı olarak Uluslararası Birimler'de belirtilmiştir. Plazmadaki Faktör VIII aktivitesi yüzde olarak (normal insan plazmasına göre) ya da Uluslararası Birimde (Plazmadaki Faktör VIII için Uluslararası Standart'a göre) belirtilmiştir. Bir ünite (IU) Faktör VIII aktivitesi 1 mL normal insan plazmasında bulunan Faktör VIII miktarına eşdeğerdir. Gerekli Faktör VIII dozu 1 IU/kg Faktör VIII'in plazma Faktör VIII düzeyini % 1.5-2 yükselttiği şeklindeki ampirik bilgi esas alınarak hesaplanır. Gerekli doz aşağıdaki formül kullanılarak tayin edilir: Gerekli Ünite = Vücut ağırlığı (kg) x istenen Faktör VIII artışı (%) x (karşılıklı gözlenen geri alınım) Uygulanacak miktar ve uygulama sıklığı her vakada daima klinik etkinliğe göre izlenmelidir. Aşağıdaki kanama şekillerinde Faktör VIII aktivitesi, ilgili dönem süresince belirtilen plazma aktivite seviyelerinin (normalin yüzdesi olarak) altına düşmemelidir: Aşağıdaki tablo episodlar ve ameliyat kanamalarında dozlama kılavuzu olarak kullanılabilir. Kanama Derecesi/Cerrahi prosedür tipiGerekliplazma Faktör VIII aktivitesi (%)(IU/dL)Dozların sıklığı (saat) / Tedavinin süresi (gün)KanamaErken hemartrozis,Kas kanaması ya da oral kanama 20-40 Daha büyük hemartrozis,30-60 Kas kanaması yad a hematom çözülünceye Hayatı tehdit eden kanamalar60-100 Her 12-24 saatte tekrarlanır. En az 1 gün, ağrı ile oluşan kanama çözülünceye ya da iyileşme sağlanıncaya kadar İnfüzyon 3-4 gün ya da daha fazla süreyle, ağrı ve akut yetersizlik kadar her 12-24 saatte bir tekrarlanmalı İnfüzyon her 8-24 saatte bir tehlike geçinceye kadar tekrarlanmalıdır. AmeliyatMinörDiş çekimi dahil Majör30-60 80-100 (pre ve post operatif) 24 saatte bir, iyileşme gerçekleşinceye kadar, en az 1 gün süresince. İnfüzyon, yeterli yara iyileşmesi oluncaya kadar her 8-24 saatte bir tekrarlanmalıdır, daha sonra Faktör VIII aktivitesi %30 dan %60(30 IU/dL - 60 IU/dL) değişinceye kadar en az 7 gün süresince tedaviye devam edilir. Tedavi süresince, uygulanacak dozun ve tekrarlayan infüzyonların sıklığının belirlenmesi için yeterli Faktör VIII seviyesinin belirlenmesi önerilir. Majör ameliyat durumunda, yerine koyma tedavisinin pıhtılaşma analizi (plazma Faktör VIII analizi) yoluyla tam olarak takibi şarttır. Her bir hastanın farklı seviyelerde in vivo geri alınım ve farklı yarı-ömürler gösterecek şekilde Faktör VIII'e cevabı farklı olabilir. ProfilaksiAğır hemofili A hastalarında kanamaya karşı uzun vadeli profilaksi için vücut ağırlığı kilo başına 20-40 IU Faktör VIII doz, 2-3 gün arayla verilmelidir. Bazı vakalarda ve bilhassa genç hastalarda, araların daha kısa yada dozların daha yüksek tutulması gerekebilir. EMOCLOT'ın 6 yaşından küçük çocuklarda kullanımına dair mevcut veriler yeterli değildir. Hastalar Faktör VIII inhibitörü gelişimi ihtimaline karşı takip edilmelidir. Eğer beklenen Faktör VIII aktivitesi plazma seviyelerine ulaşılmazsa, ya da kanama uygun bir doz ile kontrol altına alınamazsa, bir Faktör VIII inhibitörünün olup olmadığını saptamak için bir test yapılmalıdır. Yüksek inhibitör seviyeli hastalarda Faktör VIII tedavisi etkili olmayabilir ve diğer terapötik tercihler düşünülmelidir. Bu gibi hastaların tedavisi, hemofili hastalarının tedavisinde deneyimli uzmanlara yönlendirilmelidir. Bkz. 4.4. Uygulama şekli:Flakon içeriğindeki toz haldeki etken madde Bölüm 6.6'da anlatıldığı şekilde çözündürülür.Ürün, intravenöz yoldan enjeksiyon veya yavaş infüzyon şeklinde uygulanır. İntravenöz enjeksiyon yapılıyorsa, nabız hızlandığı takdirde enjeksiyonu yavaşlatmak ya da durdurmak suretiyle uygulamanın başında 3-5 dakika süre ile hastanın nabzının takip edilmesi önerilir. Uygulamanın hızı her bir hasta için değerlendirilmelidir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Mevcut veri bulunmamaktadır.Pediyatrik popülasyon:6 yaşından daha küçük çocuklarda EMOCLOT 500 IU kullanımının önerilmesi ile ilgili yeterli veri bulunmamaktadır.Geriyatrik popülasyon:Mevcut veri bulunmamaktadır.4.3. KontrendikasyonlarEtkin maddeye veya herhangi bir yardımcı maddeye karşı aşırı duyarlılığı olanlarda kontrendikedir.4.4. Özel kullanım uyarıları ve önlemleriVirüs güvenliğiEMOCLOT, insan plazmasından elde edilmektedir. İnsan plazmasından elde edilen ilaçlar, virüsler ve teorik olarak varyant Creutzfeldt-Jacob (v-CJD) gibi, çeşitli hastalıklara yol açabilen enfeksiyon yapıcı ajanlar içerebilirler. EMOCLOT'da Varyant Creutzfeldt-Jacob hastalığının bulaşma riski teorik olarak minimumken, klasik Creutzfeldt-Jacob hastalığının bulaşma riski hiçbir kanıtla desteklenmez. Alınan önlemlere rağmen, bu tür ürünler halen potansiyel olarak hastalık bulaştırabilir.Bu tip ürünlerin enfeksiyon yapıcı ajanları bulaştırma riski, plazma verenlerin belirli virüslere önceden maruz kalıp kalmadığının izlenmesi, belirli virüs enfeksiyonlarının hâlihazırda varlığının test edilmesi ve belirli virüslerin yok edilmesi ve/veya inaktivasyonu ile azaltılmıştır. Bütün bu önlemlere rağmen, bu ürünler hala potansiyel olarak hastalık bulaştırabilirler. Ayrıca, henüz bilinmeyen enfeksiyon yapıcı ajanların bu ürünlerin içerisinde bulunma ihtimali mevcuttur.HIV, HBV ve HCV gibi zarflı virüsler ve HAV gibi zarflı olmayan virüslerin etkisi için önlemlerin alınmasına dikkat edilmelidir. Parvovirus B19 gibi zarflı olmayan virüslere karşı alınan tedbirler sınırlı sayıda olabilir. Parvovirüs B19 enfeksiyonu, gebelikte (fetal infeksiyon) ve immün yetmezlik ya da kırmızı kan hücre üretiminde artış olan hastalarda tehlikeli olabilir (hemolitik anemi gibi).Doktor, bu ilacı hastaya reçete etmeden veya uygulamadan önce hastası ile risk veyararlarını tartışmalıdır._İnsan plazma koagülasyon Faktör VIII tedavisi alan hastalarda uygun aşılama (Hepatit A, B) yapılmalıdır.Hasta ve ürün serisi arasındaki linkin devam etmesi için hastaya uygulanan EMOCLOT 500 IU'nun adı ve seri numarasının her zaman kaydedilmesi kesinlikle önerilir. Herhangi bir intravenöz protein ürünü ile, alerjik türde aşırı duyarlılık reaksiyonları mümkündür. Ürün, Faktör VIII dışındaki insan proteinlerini eser miktarda içerir. Hastalar, ürtiker, genel ürtiker, göğüs sıkışması, hırıltı, hipotansiyon ve anafilaksi gibi aşırı duyarlılık reaksiyonlarının erken belirtileri konusunda bilgilendirilmelidir. Eğer bu semptomlar oluşursa, ürünün kullanımı derhal durdurulmalı ve hekime danışılması önerilir. Şok durumunda şok tedavisinin mevcut spesifik kurallarına uyulmalıdır. Faktör VIII' e karşı nötralize edici antikorların (inhibitörler) şekillenmesi Hemofili A hastalarının tedavisinde bilinen bir komplikasyondur. Bu inhibitörler genellikle IgG immünglobülinlerdir. Bu inhibitörler modifiye analiz kullanılarak plazmanın her mL'sinde Bethesda Units (BU) olarak hesaplanan Faktör VIII prokoagülant aktivitesine karşı yönlendirilen IgG immünglobülinleridir. İnhibitörlerin gelişme riski, anti hemofilik Faktör VIII korunmasızlığı ile koreledir, ilk 20 korunmasızlık günü süresince risk en yüksek seviyedir. İnhibitörler nadiren ilk 100 korunmasızlık gününden sonra gelişebilir. İnsan pıhtılaşma Faktör VIII ile tedavi edilen hastalar uygun klinik gözlemler ve laboratuar testi ile inhibitörlerin gelişimi açısından dikkatlice takip edilmelidir. (Bkz ayrıca 4.8 İstenmeyen Etkiler). Bu tıbbi ürün her bir dozunda 1.43 mmol sodyum ihtiva eder. Bu durum kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır. 4.5.Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriBugüne kadar insan plazma kaynaklı Faktör VIII konsantratının diğer ilaçlarla etkileşimleri bildirilmemiştir.Özel popülasyonlara ilişkin ek bilgiler: Böbrek/Karaciğer yetmezliği:Mevcut veri bulunmamaktadır.Geriyatrik popülasyon:Mevcut veri bulunmamaktadır.Pediyatrik popülasyon:6 yaşından daha küçük çocuklarda EMOCLOT 500 IU kullanımının önerilmesi ile ilgili yeterli veri bulunmamaktadır.4.6.Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi C'dir.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü(Kontrasepsiyon)EMOCLOT'ın çocuk doğurma potansiyeli bulunan kadınlarda üreme kapasitesini etkileyip etkilemediği bilinmemektedir. Hasta hamile kaldığında veya hamilelik kararı aldığında doktorunu bilgilendirmesi gerektiği hususunda uyarılmalıdır.Gebelik dönemiHayvanlar üzerinde yapılan çalışmalar, gebelik/ve-veya, embriyonal/fetal gelişim /ve-veya/, doğum /ve-veya/ doğum sonrası gelişim ve etkiler bakımından yetersizdir. İnsanlara yönelik potansiyel risk bilinmemektedir. EMOCLOT gerekli olmadıkça (sadece açıkça gereksinim duyulan durumlarda, yarar/risk oranı dikkate alınmak suretiyle) gebelik döneminde kullanılmamalıdır.Laktasyon dönemiEMOCLOT'ın insan sütüyle atılıp atılmadığı bilinmemektedir. İnsan plazma kaynaklı pıhtılaşma Faktör VIII'in süt ile atılımı hayvanlar üzerinde araştırılmamıştır. Emzirmenin durdurulup durdurulmayacağına ya da EMOCLOT tedavisinin durdurulup durdurulmayacağına/ tedaviden kaçınılıp kaçınılmayacağına ilişkin karar verilirken, emzirmenin çocuk açısından faydası ve EMOCLOT tedavisinin emziren anne açısından faydası dikkate alınmalıdır.Üreme yeteneği/ FertiliteHayvan üreme çalışmaları yürütülmemiştir. İnsanlardaki üreme yeteneği / fertiliteyi etkileyip etkilemediği bilinmemektedir.4.7.Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanımı üzerine etkileri bilinmemektedir. Araç ve makine kullanırken dikkatli olunmalıdır.4.8.İstenmeyen etkilerHemofili A hastaları, Faktör VIII karşı nötralize edici antikor geliştirebilir. Böyle bir inhibisyon meydana gelirse, bu durum yeterli olmayan klinik yanıtla kendini gösterecektir. Böyle vakalarda, özel bir Hemofili merkezi ile irtibata geçilmesi önerilir.Rapor edilen istenmeyen etkiler aşağıdaki sıklık derecesine göre listelenmiştir. Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Kardiyak BozukluklarSeyrek: TaşikardiKan ve Lenf Sistem HastalıklarıBilinmiyor: Faktör VIII inhibitörlerin gelişimi (Faktör VIII inhibisyon)Sinir Sistemi HastalıklarıSeyrek: Letarji, karıncalanma hissi, baş ağrısıSolunum, Torasik ve Mediyastinal HastalıklarSeyrek: Hırıltılı solunumGastrointestinal HastalıklarSeyrek: Bulantı, kusmaDeri ve Subkutan Doku HastalıklarıSeyrek: Anjiyoödem, ürtikerVasküler HastalıklarSeyrek: Kızarma, hipotansiyonGenel Hastalıklar ve Uygulama Yeri DurumlarıSeyrek: İnfüzyon yerinde yanma ve kaşıntı (infüzyon yerinde ağrı), titreme, göğüs sıkışması (göğüs rahatsızlığı), ateş (yüksek ateş)İmmün Sistem HastalıklarıSeyrek: Hipersensitivite veya allerjik reaksiyonlar, şiddetli anaflaksi, şok.Psikiyatrik BozukluklarSeyrek: Huzursuzluk4.9. Doz aşımı ve tedavisiBugüne kadar insan plazma kaynaklı pıhtılaşma Faktör VIII konsantratı için aşırı doz belirtileri bildirilmemiştir.5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Antihemorajikler, Kan koagülasyon Faktör VIII ATC kodu:B02BD02Faktör VIII/von Willebrand faktörü kompleksi farklı fizyolojik işlevlere sahip iki molekülden (Faktör VIII ve vWF) oluşur. Bir hemofili hastasına uygulandığında, Faktör VIII hastanın kan dolaşımında von Willebrand faktöre bağlanır. Aktif Faktör VIII, Faktör X'un aktif Faktör X'a dönüşmesini hızlandırarak, aktif Faktör IX için bir kofaktörü olarak hareket eder. Aktif Faktör X protrombini trombine dönüştürür. Ardından trombin, fibrinojen'i fibrine dönüştürür ve pıhtı oluşur. Hemofili A, azalan Faktör VIII kompleksi seviyesi sebebiyle, cinsiyete bağlı kalıtsal bir kan pıhtılaşma hastalığıdır ve eklemlerde, kaslarda, ya da iç organlarda ya kendiliğinden ya da kaza ya da cerrahi travmanın sonucu olarak şiddetli kanama ile sonuçlanır. Yerine koyma tedavisi ile, Faktör VIII plazma seviyesi artar, böylece geçici olarak Faktör VIII eksikliğinin giderilmesi ve kanama eğiliminin giderilmesi sağlanır. Faktör VIII koruma proteini görevine ilave olarak, von Willebrand faktör, vasküler hasar bölgelerine trombositlerin adhezyonunu uyarır ve trombosit agregasyonunda rol oynar. 5.2. Farmakokinetik özellikler Genel özelliklerEmilim:Ürünün enjekte edilmesinden sonra tamamına yakını emilir. Faktör VIII'in yaklaşık üçte ikisi ile dörtte üçü kan dolaşımında kalır. Dağılım:Plazmada ulaşılan Faktör VIII aktivitesi düzeyi önceden tahmin edilenin %80 ile %120'si arasında değişir. Başlangıç fazında, damar içi kompartıman ve diğer vücut sıvıları arasında dağılımı söz konusudur. Biyotransformasyon:Mevcut veri bulunmamaktadır.Eliminasyon:Plazmadan eliminasyon yarı-ömrü 3-6 saattir. Daha yavaş olan sonraki fazda ise (muhtemelen Faktör VIII tüketimini gösterir) yarı-ömür 8-20 saat arasında değişir, ortalama 12 saat. Bu bakımdan ikinci faz gerçek biyolojik yarı-ömür karşılığı olmaktadır. Faktör VIII aktivitesinin in vivo geri alınımı %104,7± %18,4 dir. Doğrusallık/doğrusal olmayan durum:Plazma Faktör VIII aktivitesi iki fazlı üstel fonksiyon eğrisi şeklinde azalır. 5.3. Klinik öncesi güvenlilik verileriİnsan plazma kaynaklı pıhtılaşma Faktör VIII konsantratı, insan plazmasının normal bir bileşenidir ve endojenik Faktör VIII gibi hareket eder. Yüksek doz aşırı yükleme ile sonuçlandığı için tek doz toksisite testi bağımsızdır. Tekrarlanan doz toksisite testi heterolog proteinlere karşı hayvansal örneklerde antikor gelişmesi sebebiyle uygulanamaz. Vücut ağırlığının kg'ı başına önerilen insan dozajı laboratuar hayvanları üzerinde birkaç kere uygulanmasına rağmen, hiçbir toksik etki göstermemiştir. İnsan plazma kaynaklı pıhtılaşma Faktör VIII'in onkojenik ve mutajenik endikasyonu olmadığından, özellikle heterolog türler üzerindeki klinik çalışmalar gerekli görülmemiştir.6. FARMASÖTİK ÖZELLİKLER6.1.Yardımcı maddelerin listesiTribazik sodyum sitrat Sodyum klorür GlisinKalsiyum klorür Enjeksiyonluk su 6.2.GeçimsizliklerEMOCLOT 500 IU diğer ilaçlarla karıştırılmamalıdır.Sadece ambalajı içinde sunulan onaylı enjeksiyon/infüzyon seti kullanılmalıdır. Çünkü bazı infüzyon ekipmanlarının iç yüzeylerinde insan plazma pıhtılaşma Faktör VIII'in emilimi sonucu tedavi başarısız olabilir. 6.3.Raf ömrü36 ay6.4.Saklamaya yönelik özel tedbirlerBuzdolabında saklayınız (2°C- 8°C).Tıbbi ürün sulandırıldıktan sonra derhal kullanılmalıdır. Rekonstitüe edilen ürün hemen kullanılmalıdır, rekonstitüe edildikten sonra kullanılmamış olan ürün atılmalıdır. Son kullanma tarihinden sonra kullanmayınız. Dondurmayınız. Donmuş ürünü çözüp tekrarkullanmayınız. Flakonu ışıktan korumak için dış ambalajın içinde saklayınız. 6.5. Ambalajın niteliği ve içeriğiEMOCLOT 500 IU/10 mL infüzyonluk çözelti için toz ve çözücü. Bir flakon toz + bir flakon çözücü + sulandırma ve uygulama için set.Toz içeren tip I elastomer kapaklı nötral tip I cam flakon; çözücü içeren tip I elastomer kapaklı nötral tip I cam flakon; pirojensiz, steril, tek kullanımlık set, sulandırma için üç yollu tıbbi cihaz, enjeksiyon için bir şırınga ve PVC tüplü kelebek iğnesi içerir. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerTozun çözücü ile rekonstitüe edilmesi,1.Toz halde etken madde içeren flakon ve çözücüyü oda sıcaklığına getirin; 2.Toz etken madde içeren flakon ve çözücü flakonun kabını çıkartın; 3.İki flakon tıpasının yüzeyini alkol ile temizleyin; 4.Başlığı sıyırarak aparatın ambalajını açın; iç kısma dokunmamaya dikkat edin (Şekil A); 5.Aparatı ambalajından çıkarmayın; 6.Aparat kutusunu baş aşağı çevirin ve çözücü flakon tıpasına doğru plastik sivri ucu yerleştirin ( Şekil B); 7.Aparatı serbest bırakmak için aparat kutusunun kenarını tutun ve çekin ( Şekil C); 8.Aparatı çözücü flakonuna bağlı bırakın; sistemi ters çevirin böylece çözücü flakonu aparatın üstünde olur; 9.Toz flakon tıpasına doğru diğer sivri uçlu plastiği yerleştirin; toz flakondaki vakum, çözücüyü toz flakonun içine çekecektir ( Şekil D); 10.Çözünme tamamlanıncaya kadar yavaşça çalkalayınız ( Şekil E); ürünün tamamen çözündüğünden emin olun, diğer türlü etken madde aparatın filtresinden geçmeyecektir. Şekil AŞekil B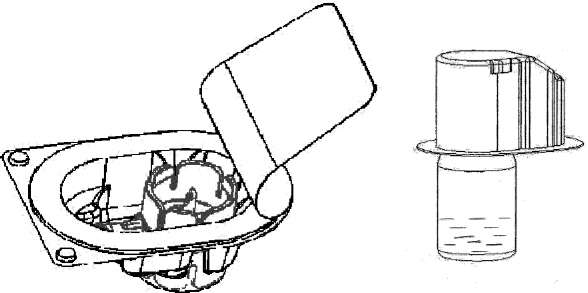 Şekil C Şekil DŞekil E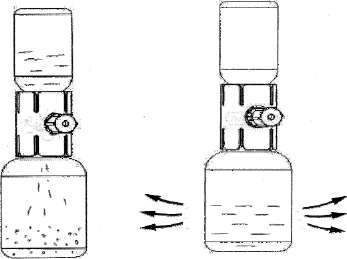 Çözücü sıcak su banyosu içinde ısıtılarak, flakonu sulandırdıktan sonra 37°C'nin üstünde olmamak kaydıyla ısıtmaya devam ederek liyofilize maddenin daha çabuk çözülmesi sağlanabilir. Eğer toz tamamen çözülmezse filtrasyon sırasında aktivite kaybı olur. Flakonun iç yüzeylerine çözücünün yavaşça akması sağlanarak köpük oluşumu önlenir.
değişip
Çözeltinin uygulanmasıÇözelti berrak veya hafif opelesan.Ürün sulandırmadan sonra az miktarda küçük tanecik veya partikül içerebilir. Çözeltide katı parçacık olup olmadığını veya uygulamadan önce değişmediğini inceleyin. Bulanık veya tortu olan çözeltileri kullanmayınız. 1.Rekonstitüe çözeltiyi içeren toz flakona doğru aparat kapağını çekin ve onu kaplayan kabı uzaklaştırın ( Şekil F); 2.Şırıngayı hava ile doldurun, pistonu geri çekin, aparata tutturun ve havayı rekonstitüe çözeltiyi içeren toz flakonun içine enjekte ediniz ( Şekil G); 3.Pistonu bırakın, sistemi ters çevirin böylece toz flakonu aparatın üstündedir ve yavaşça piston geri çekilerek konsantre şırınganın içine çekilir ( Şekil H); 4.Kapağı yavaşça orijinal durumuna çevirin ve şırıngayı çıkartın. 5.Şırıngaya kelebek iğnesini yerleştirin ve intravenöz olarak infüze veya yavaşça enjekte edilir. Şekil GŞ^kil F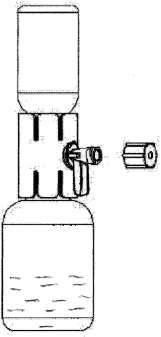 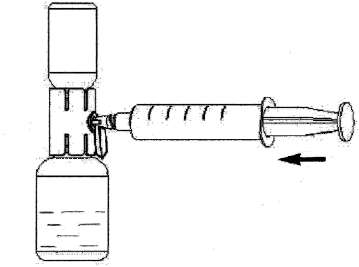 Şekil H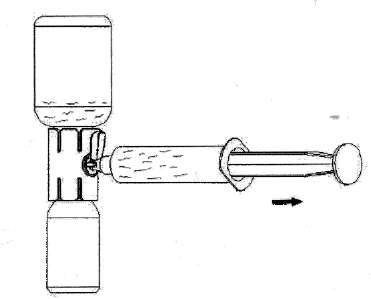 Flakonlar bir kere açıldıktan sonra, içerik derhal kullanılmalıdır. Sulandırılan çözelti ve şırınganın içine transfer edilen derhal kullanılmalıdır. Flakon içeriği tek bir uygulama için kullanılmalıdır. Etikette yer alan son kullanma tarihinden sonra bu ürünü kullanmayınız. Kullanılmayan ürün veya atık materyal yerel şartlara uygun olarak atılmalıdır.
Flakonlar bir kere açıldıktan sonra, içerik derhal kullanılmalıdır. Sulandırılan çözelti ve şırınganın içine transfer edilen derhal kullanılmalıdır. Flakon içeriği tek bir uygulama için kullanılmalıdır. Etikette yer alan son kullanma tarihinden sonra bu ürünü kullanmayınız. Kullanılmayan ürün veya atık materyal yerel şartlara uygun olarak atılmalıdır.Tüm kullanılmayan ürün ve atık maddeler "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikleri" ne uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİOnko İlaç San. ve Tic. A.Ş.Koşuyolu Cad. No: 34, 34718 Kadıköy/İSTANBUL Tel: (0216) 544 90 00 Faks: (0216) 545 59 92 e-mail: [email protected] 8. RUHSAT NUMARASI(LARI)9.İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 14/08/2009 Ruhsat yenileme tarihi:10.KÜB'ÜN YENİLENME TARİHİ |
İlaç BilgileriEMOCLOT 500 IUEtken Maddesi: Faktör VIII Atc Kodu: B02BD02 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.