Lucentis 10mg/ml Enjeksiyonluk Çözelti İçeren Flakon Kısa Ürün BilgisiDuyu Organları » Göze Uygulanan İlaçlar » Oküler Damar Bozukluğu Ajanları » Antineovascularisation Ajanlar » Ranibizumab KISA CRC\ BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADILUCENTİS 10 mg/ml enjeksiyonluk çözelti içeren flakon2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:1 flakon (0.23 mİ) içinde:Ranibizumab..............................2.3 mg Ranibizumab, rekonnbinan DNA teknolojisiyle Escherichia coiihücrelerinde üretilmiş insanlara uyarlanmış bir monoklonal antikor parçasıdır.Yardımcı maddeler:Yardımcı maddeler için 6. Te bakınız.3. FARMASÖTİK FORMEnjeksiyonluk çözelti.Steril, koruyucu içermeyen, berrak, renksiz ile soluk sarı arasında sulu çözelti. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarLUCENTİS,- Neovasküler (yaş tip) yaşa bağlı makula dejenerasyonu (YBMD) tedavisinde, - Diyabetik maküler ödem (DMÖ)'den kaynaklanan görme bozukluğunun tedavisinde, - Retinal ven tıkanıklığına (RVT) bağlı maküler ödemden kaynaklanan görme bozukluğunun tedavisinde endikedir. 4.2 Pozoloji ve uygulama şekli Pozoloji:Sadece intravitreal uygulama için tek kullanımlık flakondur. Bir flakonun birden fazla uygulama için kullanılması kontaminasyona ve buna bağlı enfeksiyona yol açabilir.LUCENTİS, deneyimli bir göz hastalıkları uzmanı tarafından uygulanmalıdır. LUCENTİS için önerilen doz, tek bir intravitreal enjeksiyon halinde uygulanacak olan ayda bir 0.5 mg'dır. Bu doz 0.05 mİ Tik bir enjeksiyon hacmine denk gelmektedir. İki uygulama arasında geçen süre 1 aydan kısa olmamalıdır. Hastalar ayda bir görme keskinliği açısından kontrol edilmelidir. Uygulama sıklığı ve süresi:Yaşa bağlı makula dejenerasyon tedavisiTedavi ayda bir uygulanır ve LUCENTİS tedavisi süresince yapılan üç ardışık ayhk değerlendirmede görme keskinliğinin stabil olmasıyla teyit edilmek üzere, maksimum görme keskinliğine ulaşılana kadar tedaviye devam edilir.Takip sırasında yaş tip YBMD nedeniyle görme Iceskiniiği kaybı saptandığı durumlarda tedavi aylık olarak tekrar başlatılır ve yine üç ardışık aylık değerlendirme boyunca stabil görme keskinliği elde edilene kadar devam ettirilir. DMÖMen kaynaklanan görme bozukluğunun tedavisiTedavi ayda bir uygulanır ve LUCENTİS tedavisi süresince yapılan üç ardışık aylık değerlendirmede görme keskinliğinin stabil olmasıyla teyit edilmek üzere, maksimum görme keskinliğine ulaşılana kadar tedaviye devam edilir.Takip sırasında DMÖ nedeniyle görme keskinliği kaybı saptandığı durumlarda tedavi aylık olarak tekrar başlatılır ve yine üç ardışık aylık değerlendirme boyunca stabil görme keskinliği elde edilene kadar devam ettirilir. DMÖ'de LüCENTİS ve lazer fotokoagülasyon:LUCENT!S, klinik çalışmalarda lazer fotokoagülasyonla eşzamanlı olarak uygulanmıştır. Aynı gün verilmesi durumunda LüCENTİS lazer fotokoagülasyondan en az 30 dakika sonra uygulanmalıdır. LÜCENTİS, önceden lazer fotokoagülasyonu yapılmış olan hastalara uygulanabilir.RVT'na bağlı maküler ödemden kaynaklanan görme bozukluğunun tedavisiTedavi ayda bir uygulanır ve LÜCENTİS tedavisi süresince yapılan üç ardışık aylık değerlendirmede görme keskinliğinin stabil olmasıyla teyit edilmek üzere, maksimum görme keskinliğine ulaşılana kadar tedaviye devam edilir.Takip sırasında RVT'na bağlı maküler ödemden kaynaklanan görme keskinliği kaybı saptandığı durumlarda tedavi aylık olarak tekrar başlatılır ve yine üç ardışık aylık değerlendirme boyunca stabil görme keskinliği elde edilene kadar devam ettirilir. Dal RVT'ndave lazer fotokoagülasyonLÜCENTİS, klinik çalışmalarda lazer fotokoagülasyonla eşzamanlı olarak uygulanmıştır. Aynı gün verildiğinde, LÜCENTİS lazer fotokoagülasyondan en az 30 dakika sonra uygulanmalıdır. LÜCENTİS, önceden lazer fotokoagülasyonu uygulanmış olan hastalara verilebilir.Uygulama şekli:Parenteral kullanımlı bütün tıbbi ürünlerde olduğu gibi, uygulamadan önce LÜCENTİS'in partiküllü madde ve renk değişimi açısından görsel olarak incelenmesi gerekmektedir.Enjeksiyon prosedürü cerrahi el dezenfeksiyonu, steril eldiven, bir steril örtü ve bir steril göz kapağı spekulumu (ya da eşdeğeri) ve steril parasentez mevcudiyetini (gerektiğinde) içeren steril koşullar altında yürütülmelidir. İntravitreal prosedür uygulanmadan önce hastanın aşırı duyarlılık reaksiyonları açısından tıbbi geçmişi dikkatle değerlendirilmelidir (Bkz. Bölüm 4.3 Kontrendikasyonlar). Perioküler cilt, göz kapağı ve oküler yüzey steril edilmelidir. Enjeksiyondan önce yeterli anestezi uygulanmalı ve steril ortam sağlanmalıdır. Klinik çalışmalarda hastalara her bir enjeksiyondan önce ve sonra 3 gün boyunca günde 4 kere antimikrobiyal göz damlası uygulanmıştır. Ancak doktorun önerisi ile enjeksiyon öncesinde steril şartların sağlanması halinde antimikrobiyal damla enjeksiyon sonrasında uygulanabilir. LÜCENTİS'i intravitreal uygulamaya hazırlamak için aşağıdaki talimatları uygulaymız: 1. İlacı çekmeden önce flakonun lastik tıpasının dış kısmı dezenfekte edilmelidir. 2. 5 mikrometrelik filtreli iğneyi (verilmiştir) İmPlik şırıngaya (verilmiştir) aseptik teknikle takınız. Küt uçlu iğneyi flakon tıpasının ortasına sokarak flakonun tabanına dokununcaya kadar itiniz.
A. 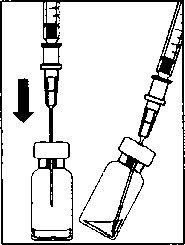 3. Flakondaki tüm sıvıyı flakonu dik pozisyonda tutarak çekiniz, sıvının tamamının çekilmesini kolaylaştırmak için flakonu hafifçe eğiniz. B. 4. Flakonu boşaltırken iğne ucunun tamamen boşaltmak amacıyla piston çubuğun yeteri kadar geri çekildiğinden emin olun. 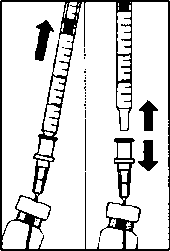 m5. Küt uçlu filtreli iğneyi flakon içinde bırakınız ve şırıngayı küt uçlu filtreli iğneden ayırınız. Filtreli iğne flakon içeriğinin çekilmesinden sonra atılmalı ve intrevitreal enjeksiyon için kullanılmamalıdır. C. 6. Enjeksiyon iğnesini (verilmiştir) aseptik ve sıkı bir şekilde şırıngaya takınız. 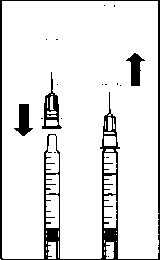 7. Şırıngadan enjeksiyon iğnesini ayırmadan dikkatlice enjeksiyon iğnesinin başlığını çıkarınız. Not: Başlığı çıkarırken enjeksiyon iğnesinin sarı göbek kısmından sıkıca tutunuz. D. 8. Şırıngadaki havayı dikkatle çıkarınız ve dozu şırınga üzerindeki 0.05 mİ işaretine ayarlayınız. Şırınga enjeksiyon için hazırdır. 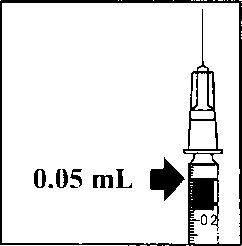 Not: Enjeksiyon iğnesini silmeyiniz. Pistonu geri çekmeyiniz. Enjeksiyon iğnesi yatay meridyenden kaçınılarak, gözün merkezi hedeflenerek ve gözün aksiyal uzunluğu göz önünde bulundurularak vitreus boşluğuna doğru limbusun 3.5-4.0 mm açığma batın İmalı dır. Sonra 0.05 ml'lik enjeksiyon hacmi verilmelidir. Daha sonraki enjeksiyonlar farklı sklera kadranına enjekte edilmelidir. Özei popülasyoniara ilişkin ek bilgiler:Böbrek yetmezliği:Böbrek yetmezliği olan hastalarda doz ayarlaması gerekmemektedir (Bkz. Bölüm 5.2 Farmakokinetik özellikler).Karaciğer yetmezliği:Karaciğer yetmezliği olan hastalarda çalışma yapılmamıştır. Ancak, sistemik maruziyet dikkate değer olmadığı için bu popülasyonda özel önlemler gerekli görülmemiştir.Pediyatrik popülasyon:18 yaşın altındaki popülasyonda güvenlilik ve etkililik verilerindeki eksiklik nedeniyle LUCENTİS'in çocuk ve adölesanlarda kullanımı önerilmemektedir.Geriyatrik popülasyon:Yaşlılarda herhangi bir doz ayarlaması gerekmemektedir. 75 yaş üzerindeki DMÖ'li hastalar üzerinde deneyim kısıtlıdır.4.3 Kontrendikasyonlar- Etkin maddeye ya da ilaç içindeki herhangi bir yardımcı maddeye karşı aşırı duyarlılık (Bkz. Bölüm 6.1 Yadımcı maddelerin listesi),- Aktif ya da şüpheli oküler ya da perioküler enfeksiyonlu hastalar, - Aktif şiddetli göz içi inflamasyonlu hastalarda kullanımı kontrendikedir. 4.4 Özel kullanım uyarıları ve önlemleriLUCENTİS tedavisi sadece intravitreal enjeksiyon ile yapılır.LüCENTİS ile olanları da içeren intravitreal enjeksiyonlar endoftalmi, göz içi inflamasyonu, yırtıklı retina dekolmanı, retina yırtılması ve iyatrojenik travmatik katarakt ile ilişkili olmuştur (Bkz. Bölüm 4.8 İstenmeyen etkiler). LUCENTİS uygulanırken her zaman uygun steril enjeksiyon teknikleri kullanılmalıdır. Ayrıca, bir enfeksiyon oluştuğunda erken tedaviye olanak sağlamak için hastalar enjeksiyonu takip eden hafta sırasında izlenmelidir. Hastalara endoftalmi ya da yukarıda sözü edilen vakaları çağrıştıracak herhangi bir semptomu gecikmeden bildirmeleri öğütlenmelidir. LUCENTİS enjeksiyonundan sonra 60 dakika içinde göz içi basıncında (GİB) geçiçi artışlar, görülmüştür (Bkz. Bölüm 4.8 İstenmeyen etkiler). Kalıcı GİB artışları da bildirilmiştir. Hem göz içi basıncı hem de optik sinir başının perfüzyonu izlenmeli ve uygun şekilde tedavi edilmelidir. Her iki göze aynı anda uygulanan LUCENTİS tedavisinin güvenlilik ve etkinliliği çalışılmamıştır. Aynı anda her iki göze tedavi uygulanması, artmış sistemik maruziyete yol açabilir ve sonuçta sistemik advers olayların riski artabilir. Vasküler endotelyal büyüme faktörü (VEBF) inhibitörlerinin intravitreal kullanımını takiben arteriyel tromboembolik olayların ortaya çıkması açısından potansiyel risk söz konusudur. Faz 3 çalışmalarda, arteriyel tromboembolik olayların genel sıklığı ranibizumab ile kontrol arasında benzer bulunmuştur. Ranibizumab 0.5 mg ile tedavi edilen hastalarda inme oranları ranibizumab 0.3 mg ya da kontrol ile tedavi edilen hastalara kıyasla sayısal olarak daha yüksek olmuş; ancak farklar istatislikscl olarak anlamlı bulunmamıştır. İnme oranlarındaki farklılık gcçici iskemik atak veya inme öyküsü dahil olmak üzere inme için bilinen risk faktörleri olan hastalarda daha yüksek olabilir. Bu yüzden bu hastaların LUCENTİS tedavisine uygunluğu ve faydanın potansiyel riske göre ağır basıp basmadığı doktorları tarafından dikkatle değerlendirilmelidir. LUCENTİS diğer sistemik veya oküler anti-VEBF ilaçlar ile birlikte kullanılmamalıdır. Bütün terapötik proteinlerde olduğu gibi, LUCENTİS ile immünojenisite için bir potansiyel bulunmaktadır. LUCENTİS aktif sistemik enfeksiyonları olan hastalarda veya retinal dekolman veya maküla deliği gibi eşzamanlı göz hastalıkları olan hastalarda çalışılmamıştır. Önceden RVT epizodları olan hastaların ve iskemik dal RVT'su (DRVT) ile santral RVT'li (SRVT) olan hastaların tedavisi ile ilgili sınırlı deneyim mevcuttur. Geri dönüşümsüz iskemik görme işlevi kaybına dair klinik belirtiler ile başvuran RVT hastalarında tedavi önerilmez. Kısıtlı verilere sahip popülasyonlar Tip I diyabete bağlı DMÖ'i olan gönüllülerin tedavisinde sadece kısıtlı deneyim söz konusudur. LUCENTİS, daha önce intravitreal enjeksiyon uygulanmış hastalarda, aktif sistemik infeksiyonları olan hastalarda, proliferatif diyabetik retinopatili hastalarda veya retina dekolmanı ya da makula deliği gibi eşzamanlı göz hastalıkları olan hastalarda araştırılmamıştır. Ayrıca HbAlc değeri %12'nin üzerinde olan ve kontrol edilemeyen hipertansiyon görülen diyabetik hastalarda LUCENTİS ile tedavi deneyimi yoktur. Bu tip hastaların tedavisinde hekim bu bilgi eksikliğini akılda bulundurmalıdır. Geçirilmiş inme veya geçici iskemik atak öyküsü İnme ya da geçici iskemik atak öyküsüne sahip DMÖ veya RVT'ye bağlı makuler ödemi olan hastaların tedavisinde güvenlilikle ilgili veriler kısıtlıdır. İntravitreal VEBF (vasküler endotelyal büyüme faktörü) inhibitörİerinin kullanımını takiben arteriyel tromboembolik olaylar açısından bir risk söz konusu olduğundan, bu tip hastalar tedavi edilirken dikkat gösterilmelidir (Bkz. Bölüm 4.8 İstenmeyen etkiler). 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriHerhangi bir klinik etkileşim çalışması yürütülmemiştir.Neovasküler (yaş tip) yaşa bağlı makula dejenerasyonu (YBMD)'nda LUCENTİS ve verteporfm fotodinamik terapinin (FDT) birlikte kullanımı için bölüm 5.1 Farmakodinamik özellikler başlığım inceleyiniz. DMÖ ve DRVT'de lazer fotokoagülasyon ve LUCENTİS'in birlikte kullanımı için bölüm 5.1 Farmakodinamik özellikler ve 4.2 Pozoloji ve uygulama şekli başlığını inceleyiniz. Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlara ilişkin herhangi bir klinik etkileşim çalışması yürütülmemiştir.Pediyatrik popülasyon:Pediyatrık popülasyona ilişkin herhangi bir klinik etkileşim çalışması yürütülmemiştir.4.6 Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi: CÇocuk doğurma potansiyeli bulunan kadmlar / Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli olan kadmlar tedavi süresince etkili bir doğum kontrol yöntemi kullanmalıdır.Gebelik dönemiRanibi/umabın gebelerde kullanımına ilişkin herhangi bir klinik veri mevcut değildir.Sinomolgus maymunlarında yapılan çalışmalar gebelik veya embriyonal/fötal gelişim açısından doğrudan ya da dolaylı herhangi bir zararlı etkiyi göstermemektedir (Bölüm 5.3 Klinik öncesi güvenlilik verileri'ne bakınız). Ranibizumaba sistemik maruziyet oküler uygulamanın ardından düşüktür fakat etki mekanizması nedeniyle ranibizumab, potansiyel olarak teratojenik ve embriyo/fetotoksik kabul edilmelidir. Bu nedenle, beklenen fayda, fetüse potansiyel riske ağır basmadığı sürece gebelik sırasında ranibizumab kullanılmamalıdır. Gebe kalmak isteyen ve ranibizumab tedavisi almış kadınların, hamile kalmadan önce, ranibizumabm son dozundan sonra en az 3 ay beklemeleri tavsiye olunur. Laktasyon donemiRanibizumab'm insan sütüyle atılıp atılmadığı bilinmemektedir. Ranibizumab'ın süt ile atılımı hayvanlar üzerinde araştırılmamıştır. Tedavi sırasında emzirme önerilmemektedir.Üreme yeteneği / FertiliteÜreme yeteneği üzerine etkileri hakkında çalışma yapılmamıştır.4.7 Araç ve makine kullanımı üzerindeki etkilerLUCENTİS tedavi prosedürü araç ya da makine kullanmayı etkileyebilecek geçici görme bozukluklarını indükleyebilir (Bkz. Bölüm 4.8 İstenmeyen etkiler). Bu belirtileri yaşayan hastalar bu geçici görme bozuklukları geçene kadar araç ya da makine kullanmamalıdır.4.8 İstenmeyen etkilerLUCENTİS uygulamasını takiben bildirilen istenmeyen etkilerin çoğunluğu intravitreal enjeksiyon prosedürü ile ilişkilidir.LUCENTİS enjeksiyonunu takiben en sık bildirilen oküler istenmeyen reaksiyonlar şunlardır: göz ağrısı, oküler hiperemi, artmış intraoküler basınç, vitrit, vitreus dekolmanı, retinal hemoraji, görme bozukluğu, vitreusta uçuşan cisimler, konjonktival hemoraji, göz irritasyonu, gözlerde yabancı cisim hissi, artmış lakrimasyon, blefarit, göz kuruluğu ve göz kaşıntısı. En sık bildirilen oküler olmayan istenmeyen olaylar baş ağrısı, nazofarenjit ve eklem ağrısıdır. Daha seyrek olarak bildirilen ancak daha ciddi istenmeyen reaksiyonlar endoftalmi, körlük, retina dekolmanı, retina yırtığı ve iyatrojenik travmatik kataraktı içermektedir (Bkz. Bölüm 4.4 Özel kullanım uyarıları ve önlemleri). Hastalar bu potansiyel istenmeyen reaksiyonların semptomları hakkında bilgilendirilmeli ve göz ağrısı ya da artmış rahatsızlık, kötüleşen göz kızarıklığı, bulanık veya zayıflamış görme, görüşlerinde artmış sayıda küçük partiküller veya ışığa artmış duyarlılık gibi semptomların gelişmesi durumunda hekimlerine haber vermeleri söylenmelidir. Klinik çalışmalarda LUCENTİS uygulamasını takiben yaşanan istenmeyen reaksiyonlar aşağıda özetlenmektedir. İstenmeyen etkiler, kontrol tedavisi (sham veya verteporfın FDT) görenlere kıyasla LUCENTİS 0.5 mg ile tedavi gören hastalarda daha yüksek (en az yüzde 2) bir oranda meydana gelen istenmeyen olaylar (hastaların en az yüzde 0.5'inde) şeklinde tanımlanır. Klinik çalışmalardan bildirilmiş olan istenmeyen etkiler MedDRA sistemi organ sınıfına göre listelenmektedir. Her sistem organ sınıfı içerisinde istenmeyen etkiler sıklıklarına göre sıralanmakta olup en sık reaksiyonlar ilk başta verilmektedir. Her sıklık grubu içerisinde istenmeyen etkiler azalan ciddiyct sırasına göre sunulmaktadır. Ayrıca, her istenmeyen etkiye karşılık belirtilen sıklık kategorisi aşağıdaki sisteme dayanmaktadır (CIOMS III): çok yaygın (> 1/10), yaygın (> 1/100 ila <1/10), yaygın olmayan (> 1/1.000 İla <I/IOO), seyrek (> 1/10.000 ila <1/1.000) ve çok seyrek (< 1/10.000). Enfeksiyon ve enfestasyonlarÇok yaygın: NazofarenjitYaygın; Influenza, idrar yolu enfeksiyonu* Kan ve lenf sistemi hastalıklarıPsikiyatrik hastalıklarSinir sistemi hastalıklarıGöz hastalıklarıÇok yaygın: Göz ağrısı, göz iritasyonu, gözlerde yabancı cisim hissi, göz kanlanması, konjunktiva kanaması, blefarit, göz kuruluğu, görme bozukluğu, vitreusta uçuşan noktalar, göz içi inflamasyonu, vitreus dekolmanı, vitritis, retina kanaması, göz yaşı artması, göz kaşıntısı.Yaygın: Gözde rahatsızlık, konjonktiva hiperemisi, konjuktivit, alerjik konjuktivit, arka kapsülde opaklaşma, retina pigment epitel dekolmanı, retina pigment epitelinin yırtılması, retina dejenerasyonu, retina dekolmanı, retina yırtığı, retinal bozukluklar, görme keskinliğinde azalma, vitreal kanama, vitreal bozukluklar, uveit, iritis, iridosiklitis, katarakt, subkapsüler katarakt, punktat keratit, kornea abrazyonu, ön kamarada flare, bulanık görme, enjeksiyon yerinde kanama, göz kanaması, göz akıntısı, fotopsi, fotofobi, göz kapağı ödemi, göz kapağında ağrı. Yaygın olmayan: göz kapağı irritasyonu, keratopati, korneal stria, kornea ödemi, hipopion, endoftalmi, körlük, enjeksiyon yerinde ağrı, enjeksiyon yerinde rahatsızlık, gözde anormallik hissi, iris adezyonu, korneal deposit, hifemi. Solunum, göğüs hastalıkları ve mediastinal hastalıklarYaygın: ÖksürmeGastrointestinal hastalıklarYaygın: BulantıDeri ve deri altı doku hastalıklarıYaygın: Alerjik reaksiyonlar (kızarıklık, ürtiker, pruritus, eritema)Kas-iskelet bozukluklar, bağ doku ve kemik hastahklarıLaboratuvar bulgularıÇok yaygın: Göz içi basıncının yükselmesi* Yalnızca Diyabetik Makülcr Ödem (DMÖ) hasta popülasyonunda gözlenmiştir. 4. 9 Doz aşımı ve tedavisiKlinik çalışmalarda ve pazarlama sonrası verilerde kazayla ortaya çıkan doz aşımı vakaları bildirilmiştir. Rapor edilen bu vakalarla ilişkilendirilebilen en sık görülen advers etkiler göz içi basıncının yükselmesi, geçici körlük, görme keskinliğinin azalması, komeal ödem, komeal ağrı ve gözde ağrı hissidir. Eğer bir doz aşımı oluşursa, ilgili hekim tarafından gerekli görülmesi durumunda intraoküler basınç takip edilmeli ve tedavi edilmelidir.5. FARMAKOLOJİK ÖZELLİKLER5.1 F armakodinamik özelliklerFarmakoterapötik grubu: Antineovaskülarizasyon ilaçları ATC kodu: S01LA04Ranibizumab insan vasküler endotelyal büyüme faktörü A'yı (VEBF-A) hedef alan bir insan rekombinan monoklonal antikor parçasıdır. VEBF-A izoformlarına (VEBFno, VEBF121 ve VEBF165) yüksek afıniteyle bağlanarak, VEBF-A'nın reseptörleri olan VEBFR-1 ve VEBFR-2'ye bağlanmasını önlemektedir. VEBF-A nm reseptörlerine bağlanması, neovasküler tip yaşa bağlı makula dejenerasyonun ve diyabet ile retinal ven oklüzyonunda görme kaybına yol açan maküler ödemin progresyonuna yol açtığı düşünülen endotel hücre proliferasyonu ve neovaskülarizasyonuna ve bunların yanı sıra damar geçirgenliğinde artışa yol açmaktadır. Klinik Araştırmalar:Yaşa bağlı makula dejenerasyonu tedavisiLUCENTİS'in klinik güvenlilik ve etkililiği randomize, çift-kör, sham ya da aktif kontrollü pivotal çalışmalarda neovasküler YBMD'li hastalarda değerlendirilmiştir.FVF2598g (MARINA) çalışmasında minimal klasik ya da klasik komponenti olmayan okült KNV'li hastalara aylık 0.3 ya da 0.5 mg LUCENTİS veya sham intravitreal enjeksiyonlar verilmiştir. Bu çalışmaya toplam 716 hasta alınmıştır. FVF2587g (ANCHOR) çalışmasında baskın klasik KNV lezyonlu hastalara aylık 0.3 ya da 0.5 mg LUCENTİS veya aktif verteporfın/PDT verilmiştir. Bu çalışmaya toplam 423 hasta alınmıştır. Tablo 5-1 FVF2598g (MARINA) çalışmasmda 12. ve 24. aydaki sonuçlar
DMÖMen kaynaklanan görme bozukluğunun tedavisiDiyabetik maküler ödeme sekonder görme bozukluğu olan hastalarda LUCENTİS'in klinik güvenlilik ve etkililiği randomize, çift kör, kontrollü pivotal çalışmalar olan D2301 (RESTORE) ve D2201'de (RESOLVE) değerlendirilmiştir.Çalışma D2301'de (RESTORE) maküler ödem nedeniyle görme bozukluğu olan toplamda 345 hasta kaydedilmiştir. Hastalar, tek başına ya da laserle kombine olarak 0.5 mg intravitreal ranibizumab veya tek başına lazer olmak üzere üç ayrı kola randomize edilmiştir. Başlıca bulgular aşağıdaki Tablo 5-3'te özetlenmiştir. Tablo 5-3 Çalışma D2301'de (RESTORE) 12. aydaki sonuçlar
*EDGK: En iyi düzeltilmiş görme keskinliği RVO'ya bağlı maküler ödemden kaynaklanan görme bozukluğunun tedavisiRVO'ya bağlı maküler ödemden kaynaklanan görme bozukluğu olan hastalarda LUCENTİS'in klinik güvenlilik ve etkililiği randomize, çift kör, kontrollü pivotal çalışmalar BRAVO ve CRUISE'da (sırasıyla BRVO (n; 397) ve CRVO (n: 392) denek katılmıştır.) değerlendirilmiştir. İki çalışmada da hastalara ya 0.3 mg veya 0.5 mg intravitreal ranibizumab ya da sham** enjeksiyonları uygulanmıştır. Altı ay sonrasında sham-kontrol kollarındaki hastalar 0.5 mg ranibizumab koluna aktarılmıştır. BRAVO çalışmasında kurtarma tedavisi olarak lazer fotokoagülasyona 3. aydan itibaren tüm kollarda izin verilmiştir.BRAVO ve CRUISE için başlıca bulgular Tablo 5-5'te özetlenmiştir. Tablo 5-5 6. ve 12. aydaki bulgular (BRAVO - CRUISE)
5.2 Farmakokinetik özellikler Genel özelliklerHmilim:Neovasküler YBMD'li hastalara aylık intravitreal LUCENT!S uygulamasını takiben serum ranibizumab konsantrasyonları, genellikle VEBF'nin biyolojik aktivitesini %50 inhibe etmesi için gerekli ranibizumab konsantrasyonlarının altındaki en yüksek değerlerden (Cmaks) düşüktür {in vitrohücre proliferasyonu tayininde değerlendirildiği gibi 11-27 ng/ml). Cmaks 0.05 ila 1.0 mg/göz doz aralığında dozla orantılıdır. Aylık LÜCENTİS 0.5 mg/göz intravitreal uygulaması üzerine dozdan yaklaşık 1 gün sonra ulaşılan serum ranibizumab Cmaks'unun genellikle 0.79 ila 2.90 ng/ml aralığında ve Cmm'unun genellikle 0.07 ila 0.49 ng/ml aralığında olduğu tahmin edilmektedir. RVT ve DMÖ hastalarında serum ranibizumab konsantrasyonları neovasküler YBMD hastalarında gözlenene benzer bulunmuştur.Dağılım:intravitreal yolla uygulandığından dağılım bilgisi mevcut değildir. Bivotransformasvon:İntravitreal yolla uygulandığından biyotransformasyon bilgisi mevcut değildir. Eliminasvon:Popülasyon farmakokinetik analizine ve 0.5 mg dozla tedavi edilen, neovasküler YBMD hastalarında, ranibizumabm serumdan kaybolmasına göre, ranibizumabm vitreusta ortalama eliminasyon yarılanma ömrü yaklaşık 9 gündür. Serum ranibizumab maruziyetinin vitreal ranibizumab maruziyetinden yaklaşık 90,000 kat düşük olduğu tahmin edilmektedir. Doğrusallık / doğrusal olmavan durum:intravitreal yolla uygulandığından bu bilgi mevcut değildir. Hastalardaki karakteristik özelliklerBöbrek yetmezliği:Böbrek yetmezliği olan hastalarda LÜCENTİS'in farmakokinetiğini incelemek için herhangi bir klinik çalışma yürütülmemiştir. Neovasküler YBMD hastalarına ilişkin bir popülasyon farmakokinetiği analizinde, hastaların %68'inde (136/200) böbrek yetmezliği (%46.5 hafif [50-80 ml/dakika], %20 orta [30-50 ml/dakika] ve %1.5 şiddetli [< 30 ml/dakika]) bulunmuştur. RVT hastalarının % 48.2'sinde (253/525) renal bozukluk (% 36.4 hafif, % 9.5 orta şiddette ve % 2.3 şiddetli) tespit edilmiştir. Sistemik klerens, hafif düşük olup klinik açıdan anlamlı değildir.Karaciğer yetmezliği:Karaciğer yetmezliği olan hastalarda LÜCENTİS'in farmakokinetiğini incelemek için herhangi bir klinik çalışma yürütülmemiştir.Pedivatrik hastalar:Yaşlılar:Yaşlı hastalarda doz ayarlamasına gerek yoktur.Cinsiyet:Cinsiyet baz alınarak doz ayarlamasına gerek yoktur.Etnik köken:Beyaz ırk mensubu dışındaki gruplarda tedavi ile ilgili deneyimler kısıtlıdır.5.3 Klinik öncesi güvenlilik verileriSinomolgus maymunlarına 26 haftaya kadar iki haftada bir 0.25 mg/göz ve 2.0 mg/göz arasındaki dozlarda uygulanan iki taraflı intravitreal ranibizumab doza bağlı oküler etkilerle sonuçlanmıştır.İntraokülcr enjeksiyondan 2 gün sonra tepe noktasına ulaşan ön kamarada flare ve hücrelerde doza bağlı artışlar saptanmıştır. İntlamatuar yanıtın şiddeti genellikle takip eden enjeksiyonlarla ya da iyileşme sırasında azalmıştır. Arka bölmede doza bağlı azalma eğiliminde olan ve genellikle tedavi süresinin sonuna kadar süren vitreus hücre infiltrasyonu ve uçuşan noktalar saptanmıştır. 26 haftalık çalışmada vitreus inflamasyonunun şiddeti enjeksiyon sayısıyla artmıştır. Ancak bunun geri dönüşümlü olduğu ve iyileşmeden sonra ortadan kalktığı gözlenmiştir. Arka kamara inflamasyonunun yapısı ve zamanlaması klinik açıdan önemli olmayabilen bir immün aracılı antikor yanıtını düşündürmektedir. Bazı hayvanlarda nispeten uzun olan şiddetli inflamasyon döneminden sonra, lensteki değişikliklerin şiddetli inflamasyona ikincil olduğunu gösteren katarakt oluşumu gözlenmiştir. İntravitreal enjeksiyonları takiben dozdan bağımsız olarak doz sonrası göz içi basıncında geçici bir yükselme gözlenmiştir. Mikroskopik göz değişiklikleri inflamasyonla ilişkili olmuş, dejeneratif süreç göstermemiştir. Bazı gözlerin optik diskinde granülomatöz inflamatuar değişiklikler kaydedilmiştir. İyileşme dönemi sırasında bu arka bölme değişiklikleri azalmış ve bazı vakalarda kaybolmuştur. İntravitreal uygulamayı takiben herhangi bir sistemik toksisite belirtisi saptanmamıştır. Uygulama yapılan hayvanların bir alt grubunda ranibizumaba karşı serum ve vitreus antikorları bulunmuştur. Herhangi bir karsinojenisite veya mutajenisite verisi bulunmamaktadır. Gebe maymunlarda intravitreal ranibizumab tedavisi gelişimle ilgili toksisite veya teratoj eni siteye yol açmamış ve plasentanın ağırlığı veya yapısı üzerinde bir etki göstermemiştir, ancak farmakolojik etkisine dayalı olarak ranibizumab potansiyel olarak teratoj enik ve embri-fototoksik olarak kabul edilmelidir. Diğer yandan, intravitreal uygulama yolunun ortaya koyduğu kısıtlamalar nedeniyle, bu çalışmada kullanılan uygulanabilir dozlar maternal toksisiteye ulaşmamış, yalnızca insandaki sistemik maruziyetin belirli bir katı kadar maruziyet görülmüştür. Embriyo-fötal gelişim üzerinde ranibizumab aracılı etkilerin olmaması büyük olasılıkla Fab parçasının plasentayı geçememesi ile bağlantılıdır. Bununla birlikte yüksek maternal ranibizumab serum düzeyleri ve fötal serum ranibizumab varlığı ile bir vaka tanımlarmıış olup, bu durum anti-ranibizumab antikorların ranibizumab için taşıyıcı bir protein olarak davrandığını (Fc bölgesini içeren) böylece maternal serum klirensini azaltarak, plasental aktarıma yol açtığını düşündürmektedir. Embriyo-fötal geliştirme araştırmaları sağlıklı gebe hayvanlarda yürütüldüğünden ve hastalık (diyabet gibi) plasentanın bir Fab parçacığına geçirgenliğini etkileyebileceğinden bu vakanın sonuçları dikkatle yorumlanmalıdır. (Bkz. Bölüm 4.6 Gebelik ve laktasyon) 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesia,a-trehaloz dihidratHistidin hidroklorür monohidrat Histidin Polisorbat 20 Enjeksiyonluk su 6.2 GeçimsizliklerGeçimlilik araştırmaları bulunmadığından, bu tıbbi ürün başka tıbbi ürünlerle karıştırılmamalıdır,6.3 Raf ömrüRaf ömrü 36 aydır.6.4 Saklamaya yönelik özel tedbirlerBuzdolabında (2-8°C) saklayınız.Crün kesinlikle dondurulmamalıdır. Ürün donmuş ise çözüp kullanılmamalıdır. Bu ürün veya ambalajı herhangi bir bozukluk içeriyorsa kullanılmamalıdır. Flakonu ışıktan korumak için dış karton ambalajında saklayınız. 6.5 Ambalajın niteliği ve içeriğiKlorobutil kauçuk tapalı bir cam flakon (renksiz tip 1 cam) içinde 0.23 ml enjeksiyonluk LUCENTİS çözeltisi. Bir ambalaj; bir flakon, şişe içeriğinin çekilmesi için bir filtreli iğne, intravitreal enjeksiyon için bir iğne, şişe içeriğinin çekilip intravitreal enjeksiyonu için bir şırınga içermektedir.6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerFlakonlar sadece tek kullanım içindir (Bölüm 4.2 Pozoloji ve uygulama şekli'ne bakınız).Geçerli olduğu takdirde kullanılmamış olan ürünler ya da atık materyaller 'Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİNovartis Ürünleri 34912 Kurtköy-istanbul8. RUHSAT NUMARASI124/449. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİilk ruhsat tarihi: 27.03.2008Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ1EDGK: En iyi düzeltilmiş görme keskinliği Çalışma D2201'e (RESOLVE) görme bozukluğuna neden olan maküler merkezi tutulumun görüldüğü toplam 151 hasta kaydedilmiş olup bu hastalara şu tedaviler uygulanmıştır; Hastalar 0.3 mg veya 0.5 mg LUCENTİS ya da sham kollarına randomize edilmiştir. Başlangıç ranibizumab dozu (0.3 mg veya 0.5 mg) çalışma sırasında ilk enjeksiyondan sonra araştırıcının tedaviye yanıtın yeterli olmadığına karar vermesi durumunda iki katma çıkarılabilmiştir. Çalışmanın 3. ayından sonra her iki tedavi kolunda lazer fotokoagülasyon kurtarma tedavisine izin verilmiştir. Çalışma 2 fazdan oluşmaktadır; araştırma fazı (6. ayda analizi yapılmış 42 hasta) ve destekleyici faz (12. ayda analizi yapılmış geri kalan 109 hasta). Çalışmanın destekleyici kısmının (hastaların 2/3) başlıca bulguları Tablo 5-4 özetlenmiştir. |
İlaç BilgileriLucentis 10mg/ml Enjeksiyonluk Çözelti İçeren FlakonEtken Maddesi: Ranibizumab Atc Kodu: S01LA04 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.