Kemidat 6 mg / 6 ml İ.V. İnfüzyon İçin Konsantre Çözelti İçeren Flakon Kısa Ürün BilgisiKas İskelet Sistemi » Kemik » Kemik İlaçları » Bisfosfonatlar » İbandronik Asit KISA URUN BILGISIoy1. BEŞERİ TIBBİ ÜRÜNÜN ADI KEMİDAT 6 mg/6 mL i.v. infüzyon için konsantre çözelti içeren flakon 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Bir flakon, 6 mL infüzyon için konsantre çözelti içinde, 6 mg ibandronik aside eşdeğer miktarda 6.75 mg ibandronik asit, monosodyum tuzu, monohidrat içerir. Yardımcı maddeler: Sodyum klorür: 52.659 mg Sodyum asetat trihidrat: 8.334 mg Yardımcı maddeler için, 6.1'e bakınız. 3. FARMASÖTİK FORM İnfıizyon için konsantre çözelti içeren flakon Berrak ve renksiz çözelti 4. KLİNİK ÖZELLİKLER 4.L Terapötik endikasyoniar - KEMİDAT kemik metastazlı meme kanseri hastalarmdaki iskelet ile ilgili olayların (radyoterapi ve cerrahiyi gerektiren komplikasyonlar ve patolojik fraktür) önlenmesinde, - Metastazlı veya metastazlı olmayan tümör kaynaklı hiperkalsemi tedavisinde endikedir. 4.2. Pozoloji ve uygulama şekli KEMİDAT tedavisi sadece kanser tedavisinde deneyimli doktorlar tarafindan başlatılmalıdır. Pozoloji/uygulama sıklığı ve süresi: Kemik Metastazlı Meme Kanseri Hastalarmdaki İskelet ile İlgili Olayların Önlenmesi Kemik metastazlı meme kanseri hastalarındaki iskelet ile ilgili olayların önlenmesi için tavsiye edilen doz, her 3-4 haftada bir verilen 6 mg intravenöz infiizyondur. Doz en az 15 dakikada infiize edilmelidir. İnfüzyon için, flakon içeriği, izotonik sodyum klorür solüsyonuna veya %5'lik dekstroz solüsyonuna eklenmelidir. Daha kısa infıizyon zamanı (örn. 15 dak) yalnızca normal böbrek fonksiyonu veya hafif böbrek yetmezliği olan hastalar için kullanılmalıdır. Kreatin klerensi 50 mL/dak'nın altında olan hastalar için kısa infuzyon zamanını tanımlayacak hiçbir veri bulunmamaktadır. Hekimler, dozlama hakkında tavsiye ve hasta gruplarında kullanım için Böbrek Yetmezliği Olan Hastalar bölümüne bakmalıdır. Tümöre bağlı olarak gelişen hiperkalsemi tedavisi KEMİDAT ile tedaviye başlamadan önce, hasta %0.9 sodyum klorürle yeterli rehidrate edilmelidir. Tümörün tipi ile birlikte, hiperkalseminin şiddeti de dikkate alınmalıdır. Genel olarak, osteolitik kemik metastazı olan hastalar, hümoral tipte hiperkalsemisi olan hastalara göre daha düşük dozlara gereksinim duymaktadırlar. Şiddetli hiperkalsemisi (albümine göre düzeltilmiş serum kalsiyumu* >3 mmol/L veya >12 mg/dL) olan çoğu hastada 4 mg'lık tek doz yeterlidir. Orta derecede hiperkalsemisi olan hastalarda (albümine göre düzeltilmiş serum kalsiyumu <3 mmol/L veya <12 mg/dL) 2 mg etkili bir dozdur. Klinik çalışmalarda kullanılan en yüksek doz 6 mg olmuştur ancak bu doz etkinlik açısından ek bir fayda getirmez. * Albümine göre düzeltilmiş serum kalsiyumu konsantrasyonlan aşağıdaki gibi hesaplanmaktadır: Albümine göre düzeltilmiş serum = serum kalsiyumu (mmol/L) -[0.02 x albümin (g/L)]+0.8 kalsiyumu (mmol/L) veya Albümine göre düzeltilmiş serum = serum kalsiyumu (mg/dL)+ 0.8 x [4-albümin (g/dL)] kalsiyumu (mg/dL) Albümine göre düzeltilmiş serum kalsiyumunu, mmol/L'yi mg/dL'ye çevirmek için 4 ile çarpınız. Çoğu vakada yüksek serum kalsiyum düzeyi normal sınırlara 7 günde indirilebilir. Nükse kadar geçen medyan süre (albümine göre düzeltilmiş serum kalsiyum düzeyinin 3 mmol/L'nin üzerine yeniden çıkması) 2 mg ve 4 mg dozlarda 18-19 gündür. Nükse kadar geçen medyan süre 6 mg'lık dozda 26 gündür. Sınırlı sayıda hasta (50 hasta) hiperkalsemi için ikinci bir infuzyon almıştır. Tekrarlayan hiperkalsemi durumunda veya yeterli etkinlik sağlanamadığında, tedavinin tekrarı düşünülmelidir. Uygulama şekli: KEMİDAT, intravenöz infuzyon yoluyla uygulanmalıdır. Bu amaçla, flakonların içeriği 500 mL izotonik sodyum klorür solüsyonuna (veya 500 mL %5Mik dekstroz solüsyonu) eklenmeli ve 1-2 saat süresince infiize edilmelidir. Hazırlanan solüsyonun dikkatsizce arter-içi uygulaması tavsiye edilmediği gibi, paravenöz uygulama da doku hasarına neden olabilir, KEMİDAT'm intravenöz olarak uygulandığından emin olmaya özen gösterilmelidir. Böbrek/Karaciğer yetmezliğiHafif derecede böbrek yetmezliği (KIkr >50 ve <80 mL/dak) olan hastalarda doz ayarlaması gerekli değildir. Meme kanseri ve metastatik kemik hastalığı olan hastalardan, iskelet olaylarının önlenmesi için tedavi edilen ve orta derecede böbrek yetmezliği olan hastalarda (KIkr >30 ve <50 mL/dak) veya ciddi böbrek yetmezliği olan hastalarda (KIkr <30 mL/dak) aşağıdaki dozlama önerilerine uyulması gerekir (bkz. bölüm 5).
Kreatinin klerensi <50 mL/dak olan kanser hastalarında 15 dakikalık inflizyon zamanı araştırılmamıştır. Karaciğer yetmezliği olan hastalarda doz ayarlamasının gerekli olmadığı beklenmektedir (bkz. bölüm 5.2). Pediyatrik popülasyon:Güvenlilik ve etkinlik üzerine yeterli veri bulunmadığından, KEMİDAT 18 yaşın abındaki hastalar için tavsiye edilmemektedir.Geriyatik popülasyon:Doz ayarlaması gerekli değildir.4.3. Kontrendikasyonlar KEMİDAT hipokalsemide kontrendikedir (bkz. bölüm 4.4) KEMİDAT ibandronik aside veya ilacın içerdiği diğer maddelerden herhangi birine aşırı duyarlılığı olduğu bilinen hastalarda kontrendikedir. Diğer bisfosfonatlara duyarlılığı olduğu bilinen hastalarda önlem alınmalıdır. KEMİDAT çocuklarda kullanılmamalıdır. 4.4. Özel kullanım uyanları ve önlemleriKlinik deneyim yokluğu nedeniyle ibandronik asit çocuklarda kullanılmamalıdır.Meme kanserine bağlı kemik metastazı olan hastalarda yapılan randomize plasebo kontrollü klinik çalışmalar, uzun süreli ibandronik asit tedavisi ile böbrek fonksiyonlarında herhangi bir bozulma belirtisi göstermemiştir. Bununla birlikte, her bir hastanın klinik değerlendirmesine bağlı olarak, ibandronik asit ile tedavi edilen hastalarda böbrek fonksiyonu, serum kalsiyum, fosfat ve magnezyum seviyelerinin izlenmesi tavsiye edilir. Klinik veri bulunmadığından, ağır karaciğer yetmezliği olan hastalar için doz önerisi yapılamamaktadır. Kalp yetmezliği riski bulunan hastalarda aşırı hidratasyondan kaçınılmalıdır. Oral yoldan uygulanan bisfosfonatlar üst gastrointestinal mukozada lokal iritasyona neden olabilirler. Tahriş edici olabilecek bu etkiler ve altta yatan hastalığın kötüleşme potansiyeli nedeniyle, KEMİDAT aktif üst gastrointestinal sorunları (örn. bilinen Barrett özofagusu, disfaji, diğer özofajiyal hastalıklar, gastrit, duodenit veya ülserler) olan hastalara verilirken dikkatli olunmalıdır. Oral bisfosfonatlarla tedavi gören hastalarda, bazıları ciddi olan ve hastaneye yatırılmayı gerektiren, nadiren kanamayla veya ardından özofagus darlığı veya yırtılmasıyla seyreden, özofajit, özofagus ülseri ve özofagus erozyonu gibi advers olaylar bildirilmiştir. Ciddi özofagus advers olay yaşama riskinin, doz talimatlarına uymayan ve/veya özofagus iritasyonunu düşündürecek semptomlar geliştirdikten sonra oral bisfosfonatlar almaya devam eden hastalarda daha yüksek olduğu görülmektedir. Hastaların doz talimatlarına özellikle dikkat etmesi ve bunlara uyabilmesi gerekir (bkz. bölüm 4.2). Hekimler olası özofagus reaksiyonuna işaret eden belirti ve semptomlara karşı dikkatli olmalıdır, hastalara da disfaji, odinofaji, retrostemal ağrı veya yeni ya da kötüleşen mide yanması olursa KEMİDAT tedavisini kesip tıbbi yardım almaları gerektiği belirtilmelidir. Kontrollü klinik çalışmalarda artan risk gözlenmemiş olsa da, pazarlama sonrasında oral bisfosfonat kullanımıyla bazıları ciddi ve komplikasyonla birlikte seyreden gastrik ve duodenal ülserler rapor edilmiştir. NSAİİ'lar (Non-steroid Antiinflamatuvar İlaçlar) gastrointestinal tahriş ile ilişkilidirler. Bu nedenle, KEMİDAT ile birlikte başka bir oral ilaç tedavisi uygulandığında dikkatli olunmalıdır. Metastatik kemik hastalığı için KEMİDAT tedavisine başlanmadan önce, hipokalsemi ve diğer kemik ve mineral metabolizması bozuklukları etkin şekilde tedavi edilmelidir. Tüm hastalar için, yeterli miktarda kalsiyum ve D vitamini alımı önemlidir. Günlük alımın yetersiz olduğu durumlarda, hastalar kalsiyum ve D vitamini desteği almalıdırlar. Hipokalsemi gelişebilir ve hastanın serum kalsiyum düzeyleri buna göre ayarlanmalıdır. Primer olarak intravenöz uygulanan bisfosfonatlar dahil çeşitli tedavi rejimleri gören kanserli hastalarda, genellikle diş çekimi ve/veya lokal infeksiyonla (osteomiyelit dahil) ilişkili çene osteonekrozu vakaları bildirilmiştir. Bu hastaların büyük çoğunluğu aynı zamanda kemoterapi ve kortikosteroidler de almıştır. Çene osteonekrozu, aynca oral bisfosfonatlarla tedavi edilen osteoporoz hastalarında da rapor edilmiştir. Beraberinde gelen risk faktörleri (örn. kanser, kemoterapi, radyoterapi, kortikosteroidler, zayıf oral hijyen) bulunan hastalarda, bisfosfonatlarla tedavi öncesinde uygun koruyucu diş hekimliği ile dental bir kontrol düşünülmelidir. Bu hastalar tedavi süresince, invaziv dental prosedürlerden eğer mümkünse kaçınmalıdır. Bisfosfonat tedavisi sırasında çene osteonekrozu gelişen hastalarda, dental ameliyat durumu kötüleştirebilir. Dental prosedürlere ihtiyaç duyan hastalar için bisfosfonat tedavisinin kesilmesinin çene osteonekrozu riskini azalttığına dair veri bulunmamaktadır. Tedaviyi yapan hekimin klinik kararı, tek tek yarar/risk değerlendirmesine dayanarak her hastanın tedavisine yol göstermelidir. Bu tıbbi ürün her mL'sinde 1 mmol (23 mg)'dan daha az sodyum ihtiva eder. Herhangi bir olumsuz etki beklenmez. . 4.5. Diğer tıbbi ürünler ile etkileşim ve diğer etkileşim şekilleriKEMİDAT kalsiyum içeren solüsyonlarla karıştırılmamalıdır.İlaç-gıda etkileşimleri Süt ve yiyecekler dahil olmak üzere, kalsiyum ve diğer çok değerli katyonlar (aluminyum, magnezyum, demir gibi) içeren ürünler, ibandronik asit tabletlerinin absorbsiyonu ile etkileşebilirler. Bu nedenle, bu gibi ürünler (yiyecekler dahil) ilaç alındıktan en az yarım saat sonra alınmalıdırlar. İbandronik asit tabletleri standart bir öğünün 2 saat sonrasında alındığında biyoyararlanım yaklaşık % 75 oranında düşer. Bu nedenle, tabletler gece boyunca süren açlıktan sonra sabah aç kamına alınmalı (en az 6 saat) ve tabletler alındıktan sonra en az yarım saat bir şey yenilip içilmemelidir (bkz. bölüm 4.2). Muhip! miyelomlu hastalarda, melfalan/prednizolon ile birlikte uygulandığında hiçbir etkileşim gözlenmemiştir. Post menopozal kadınlarda yapılan diğer etkileşme çalışmaları, tamoksifen veya hormon replasman tedavisi (östrojen) ile etkileşim potansiyeli olmadığını göstermiştir. Sağlıklı erkeklerde ve postmenopozal kadınlarda ranitidinin intravenöz uygulaması, muhtemelen azalan gastrik asidite sebebiyle, ibandronik asidin biyoyararlanımmda %20 oranında artışa neden olmuştur. Ancak bu artış ibandronik asidin biyoyararlanımmda normal değişkenlik sınırları içinde olduğundan, KEMİDAT'm H2-antagonistleri ya da gastrik pH'yı artıran diğer ilaçlarla beraber kullanımı sırasında doz ayarlaması yapılmasına gerek görülmemiştir. Dispozisyonla ilişkili klinik olarak anlamlı bir ilaç etkileşimi bulunmamaktadır. İbandronik asit sadece renal sekresyon ile elimine edilir ve biyotransformasyona uğramaz. Sekresyon yollarının, diğer etkin maddelerin atılımında rol alan, bilinen asidik veya bazik transport sistemlerini içermediği gözlenir. Ayrıca, ibandronik asit majör insan hepatik P450 izoenzimlerini inhibe etmez ve sıçanlarda hepatik sitokrom P450 sistemlerini uyarmaz. Terapötik konsantrasyonlarda plazma proteinlerine bağlanma oranı yaklaşık %87'dir, bu nedenle ibandronik asidin diğer etkin maddelerin yerini alma olasılığı düşüktür. Her iki ilaç da serum kalsiyum seviyelerini uzun süreli olarak düşürdüğünden, bisfosfonatlar aminoglikozidlerle birlikte uygulandığında önlem alınması tavsiye edilir. Olası simültane hipomagnezemi varlığına karşı ayrıca dikkat edilmelidir. Klinik çalışmalarda KEMİDAT, genel olarak kullanılan antikanser ilaçları, diüretikler, antibiyotikler ve analjezik ilaçlar ile birlikte klinik bir etkileşim meydana gelmeden uygulanmıştır. Etkileşme çalışmaları yalnızca yetişkinlerde yapılmıştır. Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlara ilişkin hiçbir etkileşim çalışması yürütülmemiştir.Pediyatrik popülasyon:Pediyatrik popülasyona ilişkin hiçbir etkileşim çalışması yürütülmemiştir.4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi; CÇocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlarda ve doğum kontrolü (kontrasepsiyon) uygulayanlarda ilacm kullanımı yönünden bir öneri bulunmamaktadır.Gebelik dönemiİbandronik asidin gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Fareler üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.KEMİDAT gebelik döneminde kullanılmamalıdır. Laktasyon dönemiİbandronik asidin anne sütüne geçip geçmediği bilinmemektedir. Emziren sıçanlarda gerçekleştirilen çalışmalar, intravenöz uygulama sonrasında sütte düşük miktarlarda ibandronik asit varlığını göstermiştir.KEMİDAT emziren annelerde kullanılmamalıdır. Üreme yeteneği/ FertiliteKlinik dışı çalışmalarda, KEMİDAT verildiğinde, üreme performansı ve doğurganlık değerlendirme parametreleri etkilenmiştir (bkz. bölüm 5.3).4.7. Araç ve makine kullanımı üzerindeki etkilerKEMİDAT'ın araç ve makine kullanımı üzerine etkisi ile ilgili yapılmış herhangi bir çalışma bulunmamaktadır.4.8. İstenmeyen etkilerYan etkiler sıklık başlığı altında en sıktan başlayarak takip eden şekilde sıralanmıştır: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1000 ila <1/100); seyrek (>1/10000 ila <1/1000); ve çok seyrek (<1/10000).Tümör kaynaklı hiperkalsemi tedavisiTümör kaynaklı hiperkalsemide ibandronik asit güvenlilik profili bu endikasyonda yapılan kontrollü klinik çalışmalardan ve tavsiye edilen dozlarda ibandronik asit uygulanması sonrasında elde edilmiştir. Tedavi, çok yaygın olarak vücut ısısında artış ile ilişkilendirilmiştir. Zaman zaman, ateş, titreme, kemik ve/veya kas ağrısı benzeri ağrıdan ibaret olan grip benzeri sendrom bildirilmiştir. Çoğu vakada özel bir tedaviye gerek kalmadan birkaç saat veya gün sonra belirtiler kaybolmuştur.Çalışmalarda kaydedilen advers reaksiyonlar aşağıda listelemektedir (olaylar sebep sonuç ilişkisinin belirlenmesinden bağımsız olarak kaydedilmiştir). Yapılan kontrollü çalışmalarda tümöre bağlı olarak gelişen hiperkalseminin KEMİDAT ile tedavi edilmesi sonrasında bildirilen yan etkiler; Bağışıklık sistemi hastalıklarıÇok seyrek: Aşın duyarlılık.Metabolizma ve beslenme hastalıklarıYaygın: HipokalsemiSolunum, göğüs bozuklukları ve mediastinal hastalıklarÇok seyrek: Bronkospazm. Asetilsalisilik aside duyarlı astım hastalarında diğer bisfosfonatlann uygulanması bronkokonstrüksiyon ile ilişkilendirilmiştir.Deri ve deri altı doku hastalıklarıÇok seyrek: Anjiyonörotik ödemKas-iskelet bozuklukları, bağ dokusu ve kemik hastalıklarıYaygın: Kemik ağrısı Yaygın olmayan: MiyaljiGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarÇok yaygın: AteşYaygın olmayan: İnfluenza benzeri hastalık, rigor AraştırmalarYaygın: Azalan renal kalsiyum atılımına terapötik ölçüm gerektirmeyen serum fosfat seviyelerinde düşüş eşlik eder. Serum kalsiyum seviyesi hipokalemik değerlere düşebilir.Kemik metastazlı meme kanseri hastalarında iskelet ile ilgili olayların önlenmesiİbandronik asidin kemik metastazlı meme kanseri hastalarındaki güvenlilik profili, tavsiye edilen dozda i.v. ibandronik asit uygulaması sonrasında ve bu endikasyon için yapılan kontrollü klinik çalışmayla saptanmıştır.Tablo 1 'de plaseboya oranla aktif ilaç tedavisi gören grupta çalışma ilacıyla uzak, muhtemel veya olası ilişkisi olan yaygın ve çok yaygın görülen yan etkiler sıralanmıştır. Tablo 1 Meme kanserine bağlı olarak gelişen metastatik kemik hastalığı olan ve ibandronik asit 6 mg i.v. tedavisi gören hastalarda yaygın görülen ve plasebodan fazla görülen yan etkiler.
Enfeksiyonlar ve enfestasyonlarYaygın olmayan: Sistit, vajinit, oral kandidiaz« iyi huylu ve kötü huylu neoplazmlar (kist ve polipler dahil)Yaygın olmayan: Benign deri neoplazmasıKan ve lenf sistemi hastalıklarıYaygın olmayan: Anemi, kan diskrazisiMetabolizma ve beslenme hastahklarıYaygın olmayan: Hipofosfatemi, kilo kaybı.Psikiyatrik hastalıklarYaygın olmayan: Uyku bozukluğu, anksiyete, duygu durum etkilenmesiSinir sistemi hastalıklarıYaygın olmayan: Serebrovasküler bozukluklar, sinir kökü lezyonu, amnezi, migren, nöralji, hipertoni, hiperestezi, ağız çevresinde uyuşukluk, koku duyusunun bozulmasıKulak ve iç kulak hastalıklarıYaygın olmayan: SağırlıkKardiyak hastalıklarYaygın olmayan: Miyokard iskemisi, kardiyovasküler bozukluklar, çarpıntıVasküler hastalıklarYaygın olmayan: Hipertansiyon, lenfoödem, varisli damarlarSolunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın olmayan: Akciğer ödemi, hırıltılı nefesGastrointestinal hastalıklarYaygın olmayan: Gastroenterit, yutma güçlüğü, gastrit, ağızda ülserasyon, dudak iltihabıHepato-bilier hastalıklarYaygın olmayan: KolelitiyazisDeri ve deri altı doku hastalıklarıYaygın olmayan: Döküntü, alopesiBöbrek ve idrar hastalıklarıYaygın olmayan: Üriner retansiyon, renal kistGebelik, pueperiyum durumları ve perinatal hastalıklarYaygın olmayan: Pelvik ağrıGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın olmayan: HipotermiAraştırmalarYaygın olmayan: Kanda alkalen fosfataz artışı.Yaralanma ve zehirlenmeYaygın olmayan: Yara, enjeksiyon bölgesi ağrısıPazarlama Sonrası Deneyim Kas-iskelct bozuklukları, bağ dokusu ve kemik hastalıklarıÇok seyrek: Çene osteonekrozu (bkz. bölüm 4.4).Bisfosfonatlarla tedavi edilen hastalarda çene osteonekrozu vakalan rapor edilmiştir. Bu vakalar çoğunlukla kanser hastalarmda görülmekle birlikte, bazıları da postmenopozal osteoporoz hastalarında görülmüştür. Çene osteonekrozu genellikle diş çekimi ve/veya lokal infeksiyonla (osteomiyelit dahil) ilişkilidir. Kanser teşhisi, kemoterapi, radyoterapi, kortikosteroidler ve zayıf oral hijyen de bilinen risk faktörleridir (bkz. bölüm 4.4). 4.9. Doz aşımı ve tedavisiİbandronik asit ile hiçbir doz aşımı vakası bildirilmemiştir.İbandronik asit doz aşımı tedavisi ile ilgili spesifik bir bilgi yoktur. Ancak oral doz aşımı, mide rahatsızlığı, mide ekşimesi, ösofajit, gastrit veya ülser gibi üst gastrointestinal advers olaylar ile sonuçlanabilir. Süt veya antiasidler ibandronik aside bağlanması için verilmelidirler. Özofajiyal tahriş riski nedeniyle hasta kusturulmamalı ve tamamen dik konumda kalmalıdır. Standart hemodiyaliz prosedürleri ibandronik asidin belirgin şekilde klerensiyle sonuçlanır. 5. FARMAKOLOJİK ÖZELLİKLER5.L Farmakodinamik özelliklerFarmakoterapötik grubu: Bisfosfonatlar ATC kodu: M05BA06İbandronik asidin farmakodinamik etkisi, kemik rezorpsiyonunun inhibisyonudur. Deneysel in-vivo çalışmalarda ibandronik asit, gonadal fonksiyonun durması, retinoidler ve tümör ya da tümör kaynaklı ürünlerin sebep olduğu deneysel uyarımlı kemik hasarını engellemiştir. Genç (hızlı büyüyen) sıçanlarda da endojen kemik rezorpsiyonu inhibe edilmiştir, bu da tedavi edilmeyen hayvanlara kıyasla artan normal kemik kütlesiyle sonuçlanmıştır. Hayvan modelleri, ibandronik asidin osteoklastik etkinliğin son derecede güçlü bir inhibitörü olduğunu doğrulamaktadır. Gelişmekte olan sıçanlarda, tümörle ilgili osteoliz tedavisinin gerektirdiği dozun 500 katı olan dozlarda bile mineralizasyon bozulmamıştır. Metastatik kemik hastalığının hayvan modellerinde ibandronik asit, yeni kemik metastazlarının gelişmesini önlemenin yanı sıra, insan meme kanseri hücreleri tarafindan başlatılan henüz oluşmuş metastazların progresyonunu da baskılamıştır. Direkt anti tümör etki in vitro olarak ve immün sistemi baskılanmış sıçanlarda da gösterilmiştir. İntraossöz Walker tümör modelinde, ibandronik asit ile trabeküler bütünlüğün ve kortikal kemiğin dramatik rezorpsiyonu tamamen inhibe edilmektedir. İbandronik asit ayrıca subkutan modelde, hiperkalsüriyi inhibe etmiştir. Bu etkiler direkt olarak osteoklast sayısındaki değişiklikler ve üriner kemik rezorpsiyonu belirteçleri ile korelasyon halindedir. MCF-7 fare modelinde osteosklerotik metastazların azalması ile de gösterildiği gibi, tüm modellerde tedavi ne kadar erken başlatılırsa tüm faydalı etkiler o kadar belirgin olmaktadır. Anti metastatik özellikler, kemik matriksinden salınan osteoklast kaynaklı tümör büyüme faktörlerinin azalması ile açıklanabilir. Yapılan in vitro çalışmalarda kemik parçalarının ibandronik asit ile ön tedavisinin, tümör hücrelerinin bağlanması ve yayılması kadar invazyonlannı da inhibe ettiği görülmüştür. Tedavi edilmemiş kemik parçalarına tümör hücreleri ile birlikte eklendiğinde ibandronik asit, taksoidler gibi sitotoksik ajanlarla birlikte ilave etkinlik göstermiştir. Metastatik kemik hastalığı olan hastalarla yapılan çalışmalar, kemik rezorpsiyonu markerleri ile kendini gösteren kemik osteolizi üzerine doza bağlı bir inhibitör etkinin ve iskelet komplikasyonları üzerinde de doza bağlı bir etkinin olduğunu göstermektedir. Tümör kaynaklı hiperkalsemisi bulunan hastalarla yapılan çalışmalar, ibandronik asidin tümör kaynaklı osteoliz ve özellikle tümör kaynaklı hiperkalsemi üzerine olan inhibitör etkisinin, serum kalsiyumundaki düşüş ve üriner kalsiyum atılımı ile karakterize olduğunu göstermektedir. Etki Mekanizmasıİbandronik asit, kemik dokusu üzerinde etkili olan ve spesifik olarak osteoklast etkinliğini inhibe eden, bisfosfonatların azot içeren grubuna ait olan çok güçlü bir bisfosfonattır. Osteoklastların toplanmasını etkilemez. İbandronik asidin kemik dokusu üzerindeki seçici etkisi, bu bileşiğin kemiğin mineral matriksini temsil eden hidroksiapatit için olan yüksek afmitesine dayanmaktadır.İbandronik asit kemik oluşumu üzerinde doğrudan bir etkisi olmaksızın kemik rezorpsiyonunu azaltır. Malign hastalığa bağlı olarak gerçekleşen kemik rezorpsiyonu, uygun kemik oluşumu ile dengelenemeyen aşırı kemik rezorpsiyonu ile karakterizedir. İbandronik asit osteoklast aktivitesini selektif olarak inhibe ederek kemik rezorpsiyonunu azaltır ve böylece malign hastalığa bağlı olarak görülen iskelet komplikasyonlarını azahır. Klinik/ etkinlik çalışmalarıKemik metastazlı meme kanseri hastalarındaki iskelet ile ilgili olayların önlenmesinde yapılan klinik çalışmalarMeme kanseri olan hastalardaki metastatik kemik hastalığının ibandronik asit ile tedavisi 96 haftalık randomize plasebo kontrollü faz III çalışma ile değerlendirilmiştir. Meme kanserli ve radyolojik olarak kanıtlanmış kemik metastazı olan kadın hastalar, plasebo (158 hasta) veya 6 mg i.v. ibandronik asit (154 hasta) alacak şekilde randomize edilmişlerdir. Çalışmanın birincil sonlanım noktası, periyodik iskelet ile ilişkili olay oranıdır (SMPR) ve bu da, çalışmanın alt kollarından olan aşağıdaki iskelet ile ilgili olayları (SRE) içeren bir bileşik sonlanım noktasıdır; - Kemiğe radyoterapi - Kırıkların tedavisi için kemik ameliyatı - Vertebral kırıklar - Vertebral olmayan kırıklar SMPR analizleri zamana bağlı olup 12 haftalık tek bir periyot içinde oluşan bir veya daha fazla olayın potansiyel olarak birbiriyle ilgili olabileceği düşüncesinden kaynaklanmaktadır. Bu nedenle verilen herhangi bir 12 haftalık periyot içinde gerçekleşen birden fazla sayıdaki olaylar, tek bir olay olarak hesaplanmıştır. Bu çalışmadan elde edilen veriler 6 mg ibandronik asit i.v.' nin plaseboya oranla zamana bağlı iskelet hasarlanma oranı (SMPR) ile ölçülen iskeletle ilgili olayların (SR£) azalmasında önemli bir avantaj sağladığını göstermiştir (p= 0.004). Ayrıca iskeletle ilgili olay sayısı da ibandronik asit ile anlamlı bir düşüşe neden olmuştur ve plaseboya oranla iskelet ilgili olay riskinde %40 azalma meydana gelmiştir (ilgili risk 0.6, p= 0.003). Etkinlik sonuçları Tablo-2'de özetlenmiştir. Tablo 2 Etkinlik sonuçları (Metastatik kemik hastalığı olan meme kanserli hastalar)İskelet ile ilişkili olay oram SMPR _(hasta başına)_
İskelet ile ilgili olaylar (SRE)
Tedavi
p değeri
Plasebo ile karşılaştırıldığında risk azalması (%)
p değeri
Plasebo ile karşılaştırıldığında oranda düşüş
40
0.003
0.004
0.29
İbandronik asit intravenöz infuzyon (6 mg, her 3-4 haftada bir)_İkincil sonlanım noktaları, kemik ağrısı ölçümü, yaşam kalitesi ve idrardaki kemik rezorpsiyonu belirteçlerinin ölçülmesini içermektedir. Plasebo ile karşılaştırıldığında, 6 mg i.v. ibandronik asit uygulamasının kemik ağrılarında istatistiksel olarak belirgin bir iyileşme sağladığı gösterilmiştir. Tüm çalışma boyunca ağrı alt sınırın altına düşmüştür ve bu düşüşe analjezik ihtiyacında anlamlı bir azalma eşlik etmiştir. Plasebo ile karşılaştırıldığında, ibandronik asit ile tedavi edilen hastalarda yaşam kalitesindeki kötüleşme de belirgin olarak azalmıştır. Bu ikincil etkinlik sonlanım noktalarının sonuçları Tablo-3'de özetlenmiştir.
Metastatik meme kanserli 130 hastanın katıldığı bir çalışmada, 1 saat veya 15 dakika infiize edilen ibandronik asidin güvenliliği karşılaştırılmıştır. Renal fonksiyon göstergelerinde herhangi bir değişiklik gözlenmemiştir. 15 dakikalık infuzyon sonrası ibandronik asidin genel advers olay profili, uzun süreli infuzyon zamanlarında bilinen güvenlilik profili ile tutarlıdır ve 15 dakikalık infuzyon zamanının kullanımı ile ilgili herhangi bir yeni güvenlilik konusu tespit edilmemiştir. Kreatinin klerensi 50 mL/dak'nın altında olan kanser hastalarında, 15 dakikalık infuzyon zamanı araştırılmamıştır. Tümöre bağlı oluşan hiperkalsemi tedavisinde yapılan klinik çalışmalar Malign hiperkalsemide tümöre bağlı oluşan hiperkalsemi hastalarında yapılan klinik çalışmalarda, tümöre bağlı oluşan osteoliz ve spesifik olarak tümöre bağlı oluşan hiperkalsemiye karşı ibandronik asidin inhibitör etkisinin, serum kalsiyumunda ve üriner kalsiyum atılımında düşüşle karakterize olduğu görülmüştür. Tedavi için önerilen doz aralığında, yeterli rehidratasyon sonrası, albumine göre düzeltilmiş serum kalsiyum alt sınırı >3 mmol/L olan hastalarda yapılan çalışmalarda gözlenen güven aralıkları ile birlikte yanıt oranları aşağıda açıklanmıştır: 100 (O İS 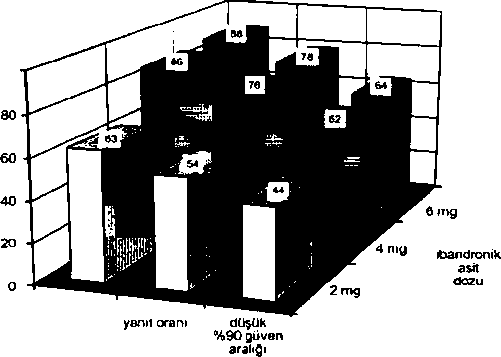 yüksek %Ö0 güvon aralığı
yüksek %Ö0 güvon aralığıBu hastalar ve dozlarla, normokalsemiye ulaşmak için gereken medyan süre 4-7 gündür. Nükse kadar geçen ortalama süre (albumine göre düzeltilmiş serum kalsiyumunun tekrar 3 mmol/L üstüne çıkması) ise 18-26 gündür. 5.2. Farmakokinetik özelliklerGenel özelliklerİki saat boyunca süren 2, 4 ve 6 mg ibandronik asit infuzyonu sonrasında farmakokinetik özellikler dozla orantılı olmuştur.Dağılım:İlk sistemik maruziyet sonrası, ibandronik asit hızla kemiğe bağlanır veya idrarla atılır. İnsanlarda görülen terminal dağılım hacmi en az 90 L'dir ve kemiğe ulaşan dozun, dolaşımdaki dozun %40-50'si olduğu tahmin edilmektedir. İnsan plazmasındaki proteinlere bağlanma oranı terapötik konsantrasyonlarda yaklaşık %87'dir ve bu nedenle yer değiştirmeye bağlı olarak ortaya çıkan ilaç-ilaç etkileşmesi potansiyeli düşüktür. Bivotransformasvon:İbandronik asidin hayvanlarda veya insanlarda metabolize olduğuna dair bir kanıt bulunmamaktadır. Eliminasvon:İbandronik asidin sistemik dolaşımdaki kısmı dolaşımdan kemik dokusuna absorbe edilerek dolaşımdan uzaklaştırılır (%40-50). Geri kalan kısmı değişmemiş olarak böbrek yoluyla atılır. İbandronik asidin absorbe edilmeyen kısmı feçes ile değişmemiş olarak atılır. Gözlenen yarı ömür aralığı geniştir ve doz ile kişinin duyarlılığına bağlıdır; ancak görünen terminal yarı ömür genellikle 10-60 saat aralığındadır. Bununla birlikte, başlangıçtaki plazma seviyeleri hızla düşerek, intravenöz veya oral uygulamadan sonra sırasıyla 3 ila 8 saat içinde doruk değerlerin %10'una ulaşır. Metastatik kemik hastalığı olan hastalara, 48 hafta boyunca, 4 haftada bir ibandronik asit intravenöz infüzyon uygulandığında, sistemik akümülasyon gözlenmemiştir. İbandronik asidin total klerensi düşüktür ve ortalama değerleri 84-160 mL/dak aralığındadır. Renal klerens (postmenopozal sağlıklı kadınlarda yaklaşık 60 mL/dak), total klerensin %50-60'ı kadardır ve kreatinin klerensi ile ilişkilidir. Görünen total ve renal klerens arasındaki farkın, kemik tarafından alınan miktarı yansıttığı düşünülmektedir. Do&rusallık/doğrusal olmayan durum:100 mg'lık oral doz ve 6 mg'lık intravenöz doza kadar, ibandronik asidin plazma konsantrasyonları doza bağlı olarak artar. Hastalardaki karakteristik özelliklerCinsiyet:İbandronik asidin erkekler ve kadınlardaki biyoyararlanımı ve farmakokinetiği benzerdir. İrk:Asyalılar ve beyaz ırk arasında ibandronik asidin dağılımında klinik olarak ilişkili interetnik farklılıklarla ilgili bir kanıta rastlanmamıştır. Afrika kökenli hastalarla ilgili çok az veri mevcuttur. Böbrek yetmezliği olan hastalar:Farklı derecelerde böbrek yetmezliği olan hastalarda, ibandronik asit maruziyeti kreatinin klerensi (KIkr) ile ilişkilidir. Ciddi böbrek yetmezliği olan (ortalama tahmini KIkr = 21.2 mL/dak) ve 2 mg tek doz (15 dakika infüzyon süresi) alan hastalarda ortalama EAAo-24h, sağlıklı gönüllülere kıyasla %110 artmıştır. Tek doz 6 mg intravenöz uygulamadan (15 dakika infüzyon süresi) sonra, hafif (ortalama tahmini KIkr = 68.1 mL/dak) ve orta derede (ortalama tahmini KIkr = 41.2 mL/dak) böbrek yetmezliği olan hastalarda ortalama EAAo-24h, sağlıklı gönüllülere (ortalama tahmini KIKR =(KIKR(KIKR(KIKR<30 mL/dak) dozda ayarlama yapılması önerilir (bkz. bölüm 4.2).Standart 4 saatlik bir hemodiyaliz prosedüründe ibandronatm yaklaşık %37'si vücuttan temizlenmiştir. KaraciSer yetmezliği olan hastalar:Karaciğer yetmezliği olan hastalarda, ibandronik asidin farmakokinetiğine dair veri bulunmamaktadır. İbandronik asit metabolize olmadığı, fakat renal atılım ve kemiğe alım yolu ile temizlendiği için, karaciğerin ibandronik asidin klerensinde belirgin bir rolü bulunmamaktadır. Bu nedenle, karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Terapötik konsantrasyonlarda ibandronik asidin proteine bağlanma oranı yaklaşık %87'dir, bu sebeple şiddetli karaciğer hastalığında gözlenen hipoproteineminin, serbest plazma konsantrasyonlannda klinik olarak anlamlı artışlara yol açması mümkün değildir. Geriyatrik popülasvon:Çok değişkenli bir analizde yaşın, çalışılan farmakokinetik parametrelerin herhangi birinin bağımsız bir faktörü olduğu bulunmamıştır. Renal fonksiyon yaşla birlikte zayıfladığından dikkate alınması gereken tek faktör budur. Pedivatrik popülasvon:18 yaşından küçük hastalarda, ibandronik asidin kullanımına ilişkin veri bulunmamaktadır. 5.3. Klinik öncesi güvenlilik verileri Klinik dışı çalışmalarda klinik kullanımla düşük bağlantı olasılığını işaret eder şekilde, hayvanlardaki toksik etki maksimum insan maruziyetinin aşıldığı dozlarda görülmüştür. Diğer bisfosfonatlarla olduğu gibi, sistemik toksisitenin ilk hedef organı böbrek olarak tespit edilmiştir. Karsinojenisite Karsinojenik potansiyele dair hiçbir belirti görülmemiştir. Mutajenite Genototoksisite testleri sonucunda ibandronik asidin genotoksik potansiyeli olduğuna dair kanıt bulunamamıştır. Üreme toksisitesi Fertilite çalışmalarında, 1.2 mg/kg/gün i.v. ibandronik asit dişi sıçanlarda üreme yeteneğini bozacak etkiler göstermiş, 1.0-16.0 mg/kg/gün oral dozlarda ve 1.2 mg/kg/gün i.v. dozlarda da implantasyon bölgelerinin sayısında düşüşe neden olmuştur. Teratojenite Oral veya intravenöz olarak tedavi edilen sıçan ve tavşanlarda ibandronik asit için direkt fetal toksisite veya teratojenik etki gözlenmemiştir. Diğer İbandronik asidin, üreme toksisitesi çalışmalarında sıçanlarda görülen yan etkileri, bisfosfonatlar sınıfında beklenen yan etkilerdir. Bunlar Fİ yeni doğan sıçanlarda, implantasyon bölgelerinin sayısında düşüş, normal doğum güçlüğü (distosi), viseral varyasyonlarda artış (renal pelvis üreter sendromu) ve diş anormalliklerini içermektedir. 6. FARMASÖTİK ÖZELLİKLERİ 6.L Yardımcı maddelerin listesi Sodyum Klorür Sodyum Asetat Trihidrat Asetik Asit (%99) Enjeksiyonluk Su 6.2. Geçimsizlikler Potansiyel geçimsizlikleri önlemek için, KEMİDAT infüzyon konsantresi yanlızca izotonik sodyum klorür solüsyonu veya %5'lik dekstroz solüsyonu ile seyreltilmelidir. KEMİDAT kalsiyum içeren solüsyonlarla karıştırılmamalıdır. 6.3. Raf ömrü 24 ay Ürün kullanıma hazır hale getirildikten sonra hemen kullanılmalıdır, hemen kullanılmayacak ürün buzdolabı sıcaklığında (2-8°C'de) en fazla 24 saat bekletilmelidir. Mikrobiyolojik açıdan, intravenöz infüzyon solüsyon anında kullanılmalıdır. Hemen kullanılamadığı durumlarda, kullanımdan önceki saklama koşulu ve zamanı, kullanan kişinin sorumluluğundadır. Seyreltme kontrollü ve valide edilmiş aseptik şartlarda gerçekleşmediği sürece, kullanıma kadar geçen süre 2-8C'de'de 24 saatin üzerinde olmamalıdır. 6.4. Saklamaya yönelik özel tedbirler 25°C'nin altındaki oda sıcaklığında saklayınız. Kullanıma hazır hale getirilen ürünün saklama koşulu için 6.3'e bakınız. 6.5. Ambalajm niteliği ve içeriği KEMİDAT 6 mg/6 mL i.v. infüzyon için konsantre çözelti içeren flakon, teflon kaplı gri bromobutil lastik tıpalı, flip-off aluminyum başlıklı renksiz. Tip I çekme cam flakonlar içerisinde 1 ve 5 adet olarak ambalajlanmıştır. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler KEMİDAT sadece tek kullanım içindir. Yalnızca partikülsüz, berrak çözeltiler kullanılmalıdır. KEMİDAT'ın intravenöz kullanma talimatlarına sıkı bir şekilde uyulmalıdır. Kullanılmayan çözelti atılmalıdır. Farmasötik ürünlerin çevreye bırakılmasından kaçınılmalıdır. İlaçlar, atık suları ve evsel atık ile imha edilmemelidir. Varsa bulunduğunuz yerdeki donanımlı atık toplama sistemlerini kullanınız. Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Ürünlerin Kontrolü Yönetmeliği' ve 'Ambalaj Atıklarının Kontrolü Yönetmelikleri'ne uygun olarak imha edilmelidir. . 7. RUHSAT SAHİBİMustafa Nevzat İlaç Sanayii A.Ş.Adres: Prof. Dr. Bülent Tarcan Sok., Pak İş Merkezi No: 5/1 34349 Gayrettepe/İstanbul Tel: O 212 337 38 00 Fax: O 212 337 38 01 e-mail: [email protected] 8. RUHSAT NUMARASI(LARI)237/399. ILK RUHSAT TARIHI/RUHSAT YENILEME TARIHIilk ruhsat tarihi: 25.11.2011 Ruhsat yenileme tarihi:10. KUB'UN YENILENME TARİHİ |
İlaç BilgileriKemidat 6 mg / 6 ml İ.V. İnfüzyon İçin Konsantre Çözelti İçeren FlakonEtken Maddesi: İbandronat Sodyum Monohidrat Atc Kodu: M05BA06 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.