Desferal 0.5g Flakon Kısa Ürün BilgisiÇeşitli İlaçlar » Diğer Tüm Terapötik İlaçlar » Diğer Tüm İlaçlar » Demir Şelatörleri » Deferoksamin KISA ÜRÜN BİLGİLERİ1.BEŞERİ TIBBİ ÜRÜNÜN ADIDESFERAL 0,5 g flakon2.KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:Desferoksamin metansülfonat500 mgYardımcı maddeler:Yardımcı madde içermemektedir.3.FARMASÖTİK FORMUEnjeksiyonluk kuru etkin madde içeren flakon.Beyaz/kirli beyaz liyofilizat şeffaf, renksiz cam flakonlarda bulunur. 4.KLİNİK ÖZELLİKLERİ4.1.Terapötik Endikasyonlar1-Tedavi amacıylaKronik demir birikiminde demir şelasyonu monoterapisi için örneğin; transfüzyonel hemosideroz, talasemi major, sideroblastik anemi, otoimmün hemolitik anemi ve diğer kronik anemilerde; flebotomiyi engelleyen hastalıkların (şiddetli anemi, kalp hastalıkları, hipoproteinemi gibi) eşlik ettiği idyopatik (primer) hemokromatozda; flebotomiyi tolere edemeyen hastalarda porfiria kutanea tarda ile bağlantılı demir birikiminde. Akut demir zehirlenmesinin tedavisinde. Son dönem böbrek yetersizliği olan (idame diyaliz uygulanan) alüminyumla ilişkili kemik hastalığı, diyaliz ensefalopatisi veya alüminyumla ilişkili anemisi olan hastalardaki kronik alüminyum birikimi tedavisinde. 2-Tanı amacıyla Demir ve alüminyum birikiminin tanısında kullanılır. 4.2.Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:Kronik demir birikiminin tedavisinde iyi kontrol edilen hastalarda şelasyon tedavisinin ana amacı, demir dengesini sağlamak ve hemosiderozu önlemektir. Oysa aşırı yüklenmiş hastalarda artmış demir depolarının azalması ve demirin toksik etkilerini önlemek için negatif bir demir dengesi istenir.Dozaj ve uygulama şekli, her hastada ayrı ayrı belirlenmeli ve tedavinin seyri sırasında, hastadaki demir birikiminin ağırlığına göre ayarlanmalıdır. Etkili en düşük doz kullanılmalıdır. Şelasyon tedavisine alınan cevabı değerlendirebilmek için, 24-saatte idrara çıkan demir miktarı başlangıçta her gün izlenmeli ve artan DESFERAL dozlarına alınan cevap saptanmalıdır. Uygun dozaj saptandıktan sonra, idrarda demir miktarı birkaç haftada bir değerlendirilebilir. Alternatif olarak ortalama günlük doz terapötik indeksi 0.025'in (günlük ortalama DESFERAL dozunun (mg/kg) serum ferritinine (mikrogram/L) oranı 0.025'den az) altında tutacak şekilde ferritin değerine göre uyarlanabilir. Hastayı aşırı şelasyondan korumak açısından terapötik indeks değerli bir araçtır ancak dikkatli klinik izlemin yerini tutamaz. DESFERAL'in ortalama günlük dozu 20-60 mg/kg arasındadır. Serum ferritin düzeyleri 2000 ng/ml'nin altında olan hastalarda genellikle günde yaklaşık 25 mg/kg; 2000-3000 ng/ml arasında olanlarda ise, günde yaklaşık 35 mg/kg'a ihtiyaç vardır. Daha yüksek serum ferritini 55 mg/kg/gün'e kadar dozları gerektirebilir. Düzenli uygulamada, büyümesi tamamlanmış ve yoğun şelasyon gereksinimi olan hastalar dışında ortalama olarak günlük 50 mg/kg dozların aşılması önerilmez. Ferritin düzeyleri 1000 ng/ml'nin altına düştüğünde DESFERAL toksisite riski artar; bu hastalar özel itina ile izlenmeli ve belki de toplam haftalık dozun azaltılması değerlendirilmelidir. Verilen dozlar ortalama günlük dozlardır. Hastaların çoğu ilacı haftada 7 günden daha kısa süre aldıklarından gerçek infüzyon dozu ortalama günlük dozdan farklıdır; örneğin günlük ortalama 40 mg/kg doz gerekli iken hasta pompayı haftada 5 gece takıyor ise her bir infüzyon 56 mg/kg içermelidir. DESFERAL ile düzenli şelasyonun talasemi hastalarında yaşam beklentisini uzattığı gösterilmiştir. Birlikte C vitamini kullanılması: Aşırı demir birikimi olan hastalarda, genellikle, muhtemelen demirin bu vitamini oksitlemesine bağlı olarak C vitamini eksikliği vardır. Şelasyon tedavisine ek olarak günde 200 mg'a kadar C vitamini, bölünmüş dozlarla verilebilir. Bu uygulamaya, düzenli bir aylık DESFERAL tedavisinden sonra başlanmalıdır (bkz. 4.4 Özel kullanım uyarıları ve önlemleri). C vitamini demirin şelasyonunu kolaylaştırır. Genellikle, 10 yaşından küçük çocuklarda 50 mg, daha büyük çocuklarda ise 100 mg yeterlidir. Daha yüksek C vitamini dozları, demir kompleksinin daha fazla uzaklaştırılmasını sağlamaz. Akut demir zehirlenmesinde tedavi: DESFERAL, akut demir zehirlenmesinde genellikle uygulanan standart yaklaşımlara yardımcıdır. Aşağıdaki durumlarda DESFERAL tedavisi endikedir: geçici minör semptomlardan (örn. bir kezden fazla kusma ya da bir kez yumuşak dışkı) fazlasının görüldüğü tüm semptomatik hastalar, letarji, belirgin karın ağrısı, hipovolemi ya da asidozu olan hastalar, radyografik batın tetkikleri çoklu radyoopasitelerle pozitif olan hastalar (bu hastaların büyük çoğunluğunda daha sonra demir zehirlenmesi belirtileri görülür), toplam demir bağlama kapasitesi (TIBC) ne olursa olsun serum demir düzeyi 3000-3500 mikrogram/L'nin üzerinde olan semptomatik hastalar. Serum demir düzeyleri 3000-5000 mikrogram/L aralığındaki asemptomatik hastalarda ve sınırlı, kansız kusma ya da diyaresi olup başka belirtisi olmayanlarda DESFERAL'siz konservatif yaklaşım ya da uygulama değerlendirilmelidir. DESFERAL'in sürekli intravenöz uygulanması tercih edilen bir yoldur ve önerilen infüzyon hızı saatte 15 mg/kg olmalı ve durum elverdiğinde hemen azaltılmalıdır, bu genellikle 4-6 saat sonra mümkün olur böylece toplam intravenöz doz önerilen 80 mg/kg'ı hiç bir 24-saatlik dönemde geçmez. Aşağıda önerilen kriterler DESFERAL'in kesilmesi için uygun gerekçelerdir. Bu kriterlerin hepsi karşılanıncaya kadar şelasyon tedavisi sürdürülmelidir: hastada sistemik demir zehirlenmesinin belirti ve bulguları olmamalıdır (örn. asidoz, kötüleşen hepatotoksisite olmamalıdır), ideal olarak, düzeltilen serum demir düzeyi ya normal ya da düşük olmalıdır (demir düzeyinin 1000 mikrogram/L'nin altına inmesi). Laboratuvarların DESFERAL varlığında serum konsantrasyonlarını kesin saptayamamaları gözönüne alınarak, ölçülen serum demir konsantrasyonu yüksek olmadığında eğer diğer kriterlerin tamamı karşılanmış ise DESFERAL tedavisi kesilmesi kabul edilebilir, başlangıçta çoklu radiopasite görülen hastalarda, bunlar demir emiliminin devam etmekte olduğunun göstergeleri olduğundan, DESFERAL tedavisinin kesilmesinden önce batın radyografik tetkiki tekrarlanmalıdır, hastada başlangıçta DESFERAL tedavisi ile roze renkte idrar görülürse DESFERAL tedavisi kesilmeden önce idrarın normal rengine dönmesinin beklenmesi mantıklıdır (ancak sadece idrarın roze renginin kaybolması DESFERAL'i kesme nedeni olarak yetersizdir). Demir kompleksi ferrioksaminin vücuttan uzaklaştırılmasını garantilediğinden tedavinin etkinliği yeterli idrar çıkarma ile ilişkilidir. Oligüri ya da anüri gelişmesi halinde periton diyalizi, hemodiyaliz ya da hemofiltrasyon gerekebilir. Son dönem böbrek yetmezliği hastalarında kronik alüminyum birikiminin tedavisi: DESFERAL'in demir ve alüminyum kompleksleri böbrek yetmezliği olan hastalarda diyalizle uzaklaştırılabilir. Bu komplekslerin vücuttan atılması, diyaliz yoluyla artırılabilir. Alüminyum birikimine bağlı semptomlar veya organ disfonksiyonu olan hastalarda DESFERAL tedavisi uygulanmalıdır. Asemptomatik hastalarda bile, serum alüminyum düzeylerinin devamlı 60 ng/ml'nin üzerinde ve DESFERAL infüzyon testi sonucunun pozitif olması, özellikle kemik biyopsisinde alüminyumla bağlantılı kemik hastalığı bulgularının varlığı durumunda, DESFERAL tedavisinin uygulanması düşünülmelidir. DESFERAL, haftada bir 5 mg/kg dozda (bkz. Uygulama şekli) uygulanmalıdır. Desferoksamin testinden sonra serum alüminyum düzeyleri 300 ng/ml'ye kadar olan hastalarda DESFERAL, diyaliz seansının son 60 dakikası sırasında, yavaş intravenöz infüzyonla uygulanmalıdır. Desferoksamin testinden sonra serum alüminyum düzeyleri 300 ng/ml'den yüksek olan hastalarda DESFERAL, diyaliz seansından 5 saat önce yavaş i.v. infüzyonla uygulanmalıdır. İlk 3 aylık DESFERAL tedavisini 4 haftalık bir arınma dönemi izlemeli ve sonra bir DESFERAL infüzyon testi yapılmalıdır. 1 ay arayla yapılan ardarda iki DESFERAL infüzyon testinin sonuçlarında serum alüminyum düzeyleri başlangıç değeri baz alındığında 50 ng/ml'den düşük ise DESFERAL tedavisine devam edilmesi önerilmez. Daimi ayaktan periton diyalizi (CAPD) veya daimi siklik periton diyalizi (CCPD) uygulanan hastalarda DESFERAL haftada bir defa 5 mg/kg dozda ve günün en son değiştirme işleminden önce verilmelidir. Bu hastalarda intraperitoneal yolun kullanılması önerilir. Ancak DESFERAL i.m. yavaş intravenöz veya subkütan infüzyonla da uygulanabilir. DESFERAL testi Bu test, DESFERAL'in normalde idrarla atılan demir ve alüminyum miktarını belirli bir sınırın üzerine yükseltmemesi ilkesine dayanır. 1.Böbrek fonksiyonu normal olan hastalarda aşırı demir birikiminin ortaya çıkarılması amacıyla DESFERAL testi: İntramüsküler olarak 500 mg DESFERAL enjekte edilmelidir. Daha sonra 6 saat süreyle toplanan idrardaki demir içeriği tayin edilir. Bu 6 saat içerisinde idrara 1-1.5 mg (18-27 mikromol) demir atılması demir birikimini düşündürür; 1.5 miligramın (27 mikromol) üzerindeki değerler, patolojik kabul edilebilir. Bu test yalnızca böbrek fonksiyonu normal olan hastalarda güvenilir sonuç verir. 2.Son dönem böbrek yetmezliği hastalarında aşırı alüminyum birikiminin ortaya çıkarılması amacıyla DESFERAL infüzyon testi: Serum alüminyum düzeyleri 60 ng/ml'nin ve buna eşlik eden 100 ng/ml'nin üzerinde serum ferritin düzeyleri olan hastalarda DESFERAL infüzyon testi önerilir. Hemodiyaliz seansına başlamadan hemen önce, kan örneği alınarak serumda alüminyum başlangıç düzeyi saptanır. Hemodiyaliz seansının son 60 dakikasında 5 mg/kg dozda DESFERAL (bkz. Pozoloji ve uygulama şekli), yavaş intravenöz infüzyonla uygulanır. Bir sonraki hemodiyaliz seansının başlangıcında (yani yukarıda bahsedilen DESFERAL infüzyonundan 44 saat sonra) ikinci bir kan örneği alınarak serum alüminyum düzeyi bir defa daha tayin edilir. Serum alüminyum düzeylerinin, başlangıç değerinden 150 ng/ml'den daha fazla artması, DESFERAL testinin pozitif olduğu şeklinde yorumlanır. Ancak testin negatif sonuçlanması, aşırı alüminyum birikiminin varlığını kesin olarak göz ardı etmez. Uygulama Şekli:Yavaş subkutan infüzyon:Portatif, hafif bir infüzyon pompası ile 8-12 saatte olabildiği gibi 24 saatlik de uygulanabilen yavaş subkütan infüzyonun etkili ve ayaktaki hastalarda özellikle kolay olduğu bilinir. DESFERAL pompa ile haftada 5-7 kez uygulanabilir. DESFERAL'in formülasyonu subkütan bolus enjeksiyona uygun olarak geliştirilmemiştir. Kan transfüzyonu sırasında intravenöz infüzyon: Kan transfüzyonları sırasında damar yolunun hazır olması, hastaya ek bir zahmet vermeksizin intravenöz infüzyona da olanak tanır. Bu özellikle, subkütan infüzyonla uyumu iyi olmayan ve/veya tolere edemeyen hastalarda yararlıdır. DESFERAL solüsyonu doğrudan kan torbasına konmamalı, bir "Y" adaptörü ile enjekte edilen vene yakın bir yerden kan setine eklenmelidir. DESFERAL hastanın uygulama için kullanmakta olduğu pompadan verilmelidir. Kan transfüzyonu sırasında IV infüzyonu ile uygulanabilecek ilaç miktarı sınırlı olduğundan, bu uygulama yolunun klinik faydası da sınırlıdır. DESFERAL'in intravenöz bolus uygulanması kolapsa neden olabildiğinden hastaların ve hemşirelerin infüzyonu hızlandırmamaları konusunda uyarılmaları gerekir (bkz. 4.4 Özel kullanım uyarıları ve önlemleri). Sürekli intravenöz infüzyon: Yoğun şelasyon uygulamasında implante intravenöz sistemler kullanılabilir. Subkütan infüzyonlara devam edemeyecek durumda olan hastalarda ve aşırı demir yüküne ilaveten sekonder kardiyak sorunları olan hastalarda sürekli intravenöz infüzyon uygulanır. Kullanılacak DESFERAL dozu, hastadaki aşırı demir yüküne bağlıdır. Yoğun şelasyon (i.v) gereksiniminde 24 saatte idrarla atılan demir miktarı düzenli olarak ölçülmeli ve doz, buna göre uyarlanmalıdır. Setin yıkanması sırasında, ölü boşluktaki DESFERAL kalıntısının ani infüzyonla dolaşım yetersizliği sonucu kolapsa neden olmasını engellemek için özenli davranılmalıdır (4.4 Özel kullanım uyarıları ve önlemleri). İntramusküler uygulama: Subkütan infüzyonlar daha etkili olduğundan intramusküler enjeksiyonlar ancak, subkütan infüzyona olanak bulunmadığında kullanılır. DESFERAL hangi yoldan verilirse verilsin, bireysel idame dozunun, hastanın vücuttan demiri idrarla atma hızına göre seçilmesi gerekir. Özel popülasyonlara ilişkin ek bilgiler: Böbrek yetmezliği:Normal renal fonksiyonu ve demir birikimi olan hastalarda metal komplekslerinin yaklaşık yarısı böbreklerden atılır. Ciddi böbrek yetmezliği olan hastalarda DESFERAL dikkatle kullanılmalıdır.Karaciğer yetmezliği:Karaciğer yetmezliği bulunan hastalarda kullanımı ile ilgili veri bulunmamaktadır.Pediyatrik popülasyon:DESFERAL tedavisine ilk 10-20 kan transfüzyonundan sonra veya serum ferritin düzeyi 1000 ng/ml'ye ulaştığında başlanması önerilir. Demir birikimi ya da aşırı DESFERAL dozları büyüme geriliği ile sonuçlanabilir. Şelasyona 3 yaşın altında başlanırsa büyüme dikkatle izlenmeli ve ortalama günlük doz 40 mg/kg'ı aşmamalıdır.Geriyatrik popülasyon:Yaşlı hastalarda artmış demir depolarının yavaşça azalması ve demirin toksik etkilerini önlemek için negatif bir demir dengesi istenir.DESFERAL'e yönelik klinik çalışmalarda, daha genç gönüllülerden farklı yanıtlar verip vermediklerinin belirlenebilmesi için yeterli sayıda 65 ve yaş üzeri hasta yer almaktadır. Genel olarak, yaşlılarda doz seçiminde dikkatli olunmalı, genellikle hepatik, renal veya kardiyak fonksiyonda daha az oranda azalmaya, daha düşük oranda eşzamanlı hastalığa ve yine daha düşük oranda ek ilaç tedavisine yol açan doz aralığının düşük doz ucuyla başlanmalıdır (bkz. 4.4 Özel kullanım uyarıları ve önlemleri ve 4.8 İstenmeyen etkiler). 4.3.KontrendikasyonlarBaşarılı desensitizasyonun tedaviyi mümkün kıldığı vakalar dışında etkin maddeye karşı bilinen aşırı duyarlığı olan hastalarda kontrendikedir.4.4.Özel kullanım uyarıları ve önlemleriHızlı intravenöz infüzyon:Hızlı intravenöz infüzyon hipotansiyon ve şoka (örn. deride kızarma, taşikardi, kollaps ve ürtiker gibi) yol açabilir. Görsel ve işitsel bozukluk: Yüksek DESFERAL dozları, özellikle plazma ferritin düzeyleri düşük olan hastalarda görme ve işitme bozukluklarına yol açabilir (bkz. 4.8 İstenmeyen Etkiler). Böbrek yetersizliği nedeni ile idame diyalizi uygulanan ve ferritin düzeyleri düşük olan hastalar advers reaksiyonlara özellikle yatkın olabildiklerinden bir tek DESFERAL dozu ile bile görme bozukluğu belirtileri bildirilmiştir. Tedavi düşük dozda uygulandığında yan etki riski azaltılır. Görsel veya işitsel bozukluklar görüldüğünde, ilacın kullanılmasına hemen son verilmelidir. DESFERAL'in neden olduğu değişiklikler, erken tanınması halinde genellikle geri dönüşümlüdür. Daha sonra DESFERAL tedavisine daha düşük dozla, görme ve işitme işlevleri yakından izlenerek yeniden başlanabilir. DESFERAL tedavisine başlanmadan önce ve başlandıktan sonra düzenli aralıklarla (3 ayda bir) uzman oftalmolojik ve işitme testlerinin yapılması, özellikle de ferritin düzeyleri düşükse önerilir. Talasemi hastalarında odyometrik anomali riski, ortalama günlük DESFERAL dozunun (mg/kg) serum ferritine (mikrogram/L) oranının 0.025 altında tutulmasıyla düşürülebilir. Böbrek bozukluğu: Metal kompleksin yaklaşık yarısı, böbrek işlevi normal olan aşırı demir yüklü hastalarda böbrekler yoluyla atılır. Bu nedenle, ciddi böbrek yetmezliği olan hastalarda dikkatli olmak gerekir. Desferoksaminin demir ve alüminyum kompleksleri vücuttan diyalizle uzaklaştırılabilir; böbrek yetmezliği olan hastalarda bunların vücuttan uzaklaştırılması, diyaliz yoluyla arttırılabilir. Nadiren akut böbrek yetmezliği vakaları rapor edilmiştir (ayrıca bkz. 4.8 İstenmeyen etkiler). Hastaların, renal fonksiyondaki (örn. serum kreatinin artışı) değişiklikler açısından izlenmesi düşünülmelidir. Pediyatrik popülasyon - Büyüme geriliği: Yüksek DESFERAL dozları ile ferritin düzeyleri düşük olan, ya da genç yaştaki (tedavi başlangıcında 3 yaşın altındaki) hastalarda büyüme geriliği ile ilişki bulunmuştur (Bkz.4.2 Pozoloji ve uygulama şekli: Kronik demir birikiminin tedavisi). Büyüme geriliği eğer DESFERAL'in aşırı dozları ile ilişkili ise bunun aşırı demir yüklemesi ile ilişkili olandan ayırıcı tanısı yapılmalıdır. Doz 40 mg/kg'ın altında tutulabilirse DESFERAL ile büyüme geriliği çok nadirdir; büyüme geriliği bu değerin üzerindeki dozlarla ilişkilendirilmiş ise dozun azaltılmasından sonra büyüme hızı, bazı hastalarda tedavi öncesi düzeylere dönebilir, ancak beklenen erişkin boyuna ulaşılamaz. DESFERAL alan pediyatrik hastalar vücut ağırlığı ve boy uzaması açısından her 3 ayda bir izlenmelidir. Akut respiratuvar distres sendromu: Akut demir zehirlenmesi olan hastalarda ve talasemi hastalarında da intravenöz yoldan çok yüksek DESFERAL dozları ile tedaviyi takiben akut respiratuvar distres sendromu bildirilmiştir. Bu nedenle önerilen günlük dozlar aşılmamalıdır. Enfeksiyonlar: Aşırı demir yüklemesi olan hastalarda DESFERAL'in, özellikle Yersinia enterocolitica ve Yersinia pseudotuberculosis ile olan enfeksiyonlara duyarlılığı arttırabileceği bildirilmiştir. DESFERAL tedavisindeki bir hastanın ateşi akut enterit/enterokolit, yaygın abdominal ağrı veya farenjitle birlikte yükselirse, tedavi geçici olarak kesilmeli, bakteriyolojik testler yapılmalı ve uygun antibiyotik tedavisine bir an önce başlanmalıdır. Enfeksiyon iyileştikten sonra, DESFERAL tedavisine tekrar başlanabilir. Demir ve/veya alüminyum birikimi nedeniyle DESFERAL alan hastalarda, bazıları ölümle sonuçlanabilen mukormikoz vakaları çok nadiren bildirilmiştir. Enfeksiyon şüphesi doğuran herhangi bir belirti veya semptom karşısında DESFERAL tedavisi durdurulmalı, mikolojik testler yapılmalı ve hemen gerekli tedaviye başlanmalıdır. Mukormikozun DESFERAL kullanmayan hastalarda da görülebilmesi, bu enfeksiyonun gelişmesinde diyaliz, diabetes mellitus, asit-baz dengesi bozuklukları, hematolojk maligniteler, immünosupressif ilaçlar veya diğer faktörler nedeniyle bağışıklık sisteminin yetersizliği gibi daha başka etmenlerin de rol oynayabileceğini göstermektedir. C vitamininin birlikte kullanılması ile kalp fonksiyon bozukluğu: Şiddetli kronik demir birikimi olan hastalarda, DESFERAL ve yüksek dozlarda (günde 500 mg'ın üzerinde) C vitamininin birlikte kullanılması ile kalp fonksiyon bozukluğu bildirilmiştir. Kalpte fonksiyon bozukluğu C vitamininin kesilmesi ile geri dönüşümlüdür. DESFERAL ve C vitamininin birlikte kullanılması gereğinde şu noktalara dikkat edilmelidir: Kalp yetmezliği olan hastalara C vitamini takviyesi verilmemelidir. C vitamini ile tedaviye, ancak 1 aylık düzenli DESFERAL tedavisinden sonra başlanmalıdır. C vitamini yalnızca DESFERAL'i düzenli olarak kullanan hastalara ve ideal olarak da pompanın hazırlanmasından hemen sonra verilmelidir. Günlük C vitamini, bölünmüş dozlarda toplam 200 mg'ı aşmamalıdır. Bu gibi kombinasyon tedavisi sırasında kalp fonksiyonunun izlenmesi önerilir. Alüminyumla bağlantılı ensefalopati: Alüminyumla bağlantılı ensefalopatisi olan hastalarda yüksek DESFERAL dozları, muhtemelen dolaşımdaki alüminyum miktarının birdenbire artması nedeniyle nörolojik fonksiyon bozukluğunu (konvülziyon) şiddetlendirebilir. (bkz. bölüm 4.8 İstemeyen etkiler) DESFERAL, diyaliz demansının başlamasına zemin hazırlayabilir. Klonazepam ile ön tedavinin, bu nörolojik kötüleşmeye karşı koruma sağladığı bildirilmiştir. Alüminyum birikiminin tedavisi, hipokalsemiye ve hiperparatiroidinin şiddetlenmesine yol açabilir. İdrarda renk değişikliği: Demir kompleksi atılırken, idrarın kırmızımsı-kahverengi olmasına yol açabilir. DESFERAL önerileni aşan dozlarda uygulanmamalıdır. İlaç 95 mg/ml'yi aşan konsantrasyonlarda lokal reaksiyonlarda artış sebebiyle subkütan olarak (bkz.4.2 Pozoloji ve uygulama şekli). İntramusküler uygulamanın yegane seçenek olması halinde enjeksiyonu kolaylaştırmak için daha yüksek konsantrasyonların uygulanması gerekebilir. Önerilen 95 mg/ml'lik konsantrasyonlarda hazırlanmış solüsyon berrak, veya renksiz ya da hafif sarımsı olabilir. Sadece berrak olan solüsyonlar uygulanabilir. Opak ya da bulanık solüsyonlar atılmalıdır. Enjeksiyon tekniğine çok dikkat edilmelidir. Subkütan infüzyon uygulamada iğne dermise çok yakın sokulmamalıdır. 4.5.Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriDESFERAL ve bir fenotiyazin türevi olan proklorperazinin birlikte kullanımı geçici bilinç bozukluklarına neden olabilir.Şiddetli kronik demir depolama hastalığı olan, DESFERAL ve yüksek doz C vitamini (günde 500 mg'ın üzerinde) ile kombine tedavi uygulanan hastalarda kalp fonksiyon bozukluğuna rastlanmıştır (bkz. 4.4 Özel kullanım uyarıları ve önlemleri). C vitamini kesildiğinde bu bozukluk düzelmiştir. DESFERAL'e bağlı galyum-67 izotopunun hızla idrarla atılması nedeniyle galyum-67 görüntüleme sonuçları bozulabilir. Sintigrafiden 48 saat önce DESFERAL tedavisinin kesilmesi önerilir. Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlara ilişkin veri bulunmamaktadır.Pediyatrik popülasyon:Pediyatrik popülasyona ilişkin veri bulunmamaktadır.4.6.Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi C'dir.Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)DESFERAL için gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. 5.3 Klinik öncesi güvenlilik verileri). İnsanlara yönelik potansiyel risk bilinmemektedir.Gebelik dönemiGebelik sırasında DESFERAL, özellikle ilk 3 aylık dönemde, ancak zorunlu ise kullanılmalıdır. DESFERAL, gerekli olmadıkça gebelik döneminde kullanılmamalıdır.Laktasyon dönemiDesferoksaminin insan sütüyle atılıp atılmadığı bilinmemektedir. Desferoksaminin süt ile atılımı hayvanlar üzerinde araştırılmamıştır. Emzirmenin durdurulup durdurulmayacağına ya da DESFERAL tedavisinin durdurulup durdurulmayacağına/tedaviden kaçınılıp kaçınılmayacağına ilişkin karar verilirken, emzirmenin çocuk açısından faydası ve DESFERAL tedavisinin emziren anne açısından faydası dikkate alınmalıdır.Üreme yeteneği / FertiliteÜreme yeteneği / fertilite konusunda veri bulunmamaktadır.4.7.Araç ve makine kullanımı üzerindeki etkilerSersemlik veya diğer merkezi sinir sistemi bozuklukları gelişen ya da görme/işitme bozuklukları ortaya çıkan hastalar, araç ve makine kullanmaktan kaçınmalıdır (bkz. 4.8 İstenmeyen etkiler).4.8. İstenmeyen etkilerAdvers ilaç reaksiyonları, aşağıdaki tanımlama uyarınca, en sık görülenden en az görülene doğru sıralanmıştır:Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek >.1/10.000 ila <1/1000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor. Raporlar bilinmeyen bir büyüklüğe sahip popülasyondan elde edildiğinden, pazarlama sonrası deneyimlerden rapor edilen advers reaksiyon sıklığını güvenilir bir şekilde hesaplamak mümkün olmadığında). Advers etki olarak bildirilen bulgu ve belirtilerin bazıları mevcut hastalığa (demir ve/veya alüminyum yüklemesi) bağlı olabilir. Enfeksiyonlar ve enfestasyonlarSeyrek: Mukormikoz (bkz. 4.4 Özel kullanım uyarıları ve önlemleri)Çok seyrek: Gastroenterit Yersinia (bkz. 4.4 Özel kullanım uyarıları ve önlemleri) Kan ve lenf sistemi hastalıklarıÇok seyrek: Kan hastalığı (trombositopeni, lökopeni)Bağışıklık sistemi hastalıklarıÇok seyrek: Anaflaktik şok, anaflaktik reaksiyon, anjionörotik ödemSinir sistemi hastalıklarıYaygın: BaşağrısıÇok seyrek: Nörolojik bozukluklar (sersemlik, alüminyumla ilişkili diyaliz ensefalopatisinin hızlanması veya alevlenmesi, periferal nöropati, parestezi) (bkz. 4.4 Özel kullanım uyarıları ve önlemleri) Bilinmeyen: Konvülziyon (bkz. aşağıda belirtilen özel notlar) Göz hastalıklarıSeyrek: Görme kaybı, skotom, retinal dejenerasyon, optik nevrit, katarakt, görme keskinliğinin azalması, bulanık görme, gece körlüğü, görme alanı bozuklukları, kromatopsi(renk görme bozukluğu), korneal opasiteler, (bkz. 4.4 Özel kullanım uyarıları ve önlemleri ve aşağıda belirtilen özel notlar)Kulak ve iç kulak hastalıklarıYaygın olmayan: Nörosensoral işitme kaybı, tinnitus (bkz. 4.4 Özel kullanım uyarıları ve önlemleri aşağıda belirtilen özel notlar)Vasküler hastalıklarıSeyrek: DESFERAL'in uygulanması ile ilgili önlemlere dikkat edilmemesi durumunda hipotansiyon, taşikardi ve şok gelişebilir (bkz. 4.2 Pozoloji ve uygulama şekli ve 4.4 Özel kullanım uyarıları ve önlemleri)Solunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın olmayan: AstımÇok seyrek: Akut respiratuvar distres, akciğer infiltrasyonu (bkz. 4.4 Özel kullanım uyarıları ve önlemleri) Gastrointestinal hastalıklarYaygın: BulantıYaygın olmayan: Kusma, karın ağnsı Çok seyrek: Diyare Deri ve deri altı doku hastalıklarıYaygın: ÜrtikerÇok seyrek: Yaygın döküntü Kas-iskelet bozukluklar , bağ doku ve kemik hastalıklarıÇok Yaygın: Artralji, miyaljiYaygın: Yüksek dozlarda ve küçük çocuklarda büyüme geriliği ve kemik hastalığı (örn. metafiz displazisi) (bkz. 4.4 Özel kullanım uyarıları ve önlemleri ve aşağıda belirtilen Özel Notlar) Bilinmeyen: Kas spazmları Böbrek ve idrar hastalıklarıBilinmeyen: Akut böbrek yetmezliği, böbrek tubular bozukluk, kan kreatinin yükselmesi (bkz. 4.4 Özel kullanım uyarıları ve önlemleri ve 4.9 Doz aşımı ve tedavisi )Genel bozukluklar ve uygulama bölgesine ilişkin sorunlarÇok yaygın: Ağrı ile birlikte enjeksiyon bölgesinde reaksiyon, şişlik, sertleşme, eritem, kaşıntı, kabuk (bkz. aşağıda belirtilen özel notlar), eskar Yaygın: PireksiYaygın olmayan: Kabarcıklar ile birlikte enjeksiyon bölgesinde reaksiyon, ödem, yanma (bkz. aşağıda belirtilen özel notlar) Özel Notlar Dozlar önerilen sınırlar içinde tutulursa ve ferritin düzeylerinin düşmesi (DESFERAL'in ortalama günlük dozunun serum ferritinine oranı 0.025'in altında olmalıdır) halinde dozlar da azaltılırsa, nörosensorik işitme kaybı ve tinnitus seyrektir. Yüksek dozlar verilmediği takdirde çeşitli göz bozuklukları ender görülmektedir. (bkz. 4.4 Özel kullanım uyarıları önlemleri) Büyüme geriliği ve kemik hastalığı (örn. metafiz displazisi) 60 mg/kg'ın üzerinde doz uygulanan şelasyon hastalarında, özellikle demir şelasyonuna yaşamın ilk üç yılında başlananlarda sık rastlanır. Dozların 40 mg ve altında tutulması ile risk belirgin olarak azaltılabilir. Enjeksiyon yerinde ağrı, şişlik, sertleşme, eritem, kaşıntı, eskar ve kabuk çok yaygın görülen; kabarcıklar, lokal ödem ve yanma ise yaygın olmayan reaksiyonlardır. Lokal reaksiyonlara çok yaygın olarak artralji/miyalji; yaygın olarak başağrısı, ürtiker, bulantı, ateş; yaygın olmayan kusma, karın ağrısı veya astım gibi sistemik reaksiyonlar eşlik edebilir: Demir kompleksinin atılımı, idrarda kırmızımsı-kahverengi renklenmeye neden olabilir. Konvülziyon çoğunlukla aşırı alüminyum yükü olan diyaliz hastalarında rapor edilmiştir.(bkz. 4.4 Özel kullanım uyarıları ve önlemleri) DESFERAL ile tedavi edilen hastalarda nadir artmış transaminaz vakaları rapor edilmekle birlikte ilaçla bir nedensellik ilişkisi kurulamamıştır. Kronik aşırı alüminyum yüklenmesi için tedavi edilen hastalar: Alüminyum aşırı yüklenmesine yönelik DESFERAL şelasyon tedavisi hipokalsemiye ve hiperparatiroidizmde kötüleşmeye neden olabilir (bkz. 4.4 Özel kullanım uyarıları ve önlemleri). 4.9. Doz aşımı ve tedavisiBelirti ve semptomlar: DESFERAL'in kazara yüksek dozda kullanılması ya da intravenöz bolus uygulama/hızlı intravenöz infüzyon hipotansiyon, taşikardi ve gastrointestinal şikayetlerle ilişkilidir; akut ancak geçici görme kaybı, afazi, ajitasyon, baş ağrısı, bulantı, bradikardi ve akut böbrek yetersizliği (bkz. 4.8 İstenmeyen etkiler) bildirilmiştir.Akut demir intoksikasyonu olan hastalarda ve ayrıca talasemi hastalarında aşırı yüksek i.v. DESFERAL dozları ile tedavi sonrasında akut respiratuvar distres sendromu tarif edilmiştir (ayrıca bkz. 4.4 Özel kullanım uyarıları ve önlemleri). Tedavi: Spesifik bir antidotu yoktur. DESFERAL kesilmeli ve uygun semptomatik yaklaşımlar uygulanmalıdır. DESFERAL diyalize uygundur. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grubu: Demir şellatör ajanlar ATC kodu: V03AC01Etki mekanizması: Desferoksamin daha çok demir ve 3-değerlikli alüminyum iyonlarıyla kompleksler oluşturan bir maddedir; kompleks oluşturma sabiteleri sırası ile 1031 ve 1025 ' tir. Desferoksaminin Fe+2, Cu+2, Zn+2 ve Ca+2 gibi 2-değerlikli iyonlara ilgisi çok daha azdır (kompleks oluşturma sabiteleri 1014 veya daha düşük). Şelasyon 1:1 molar bazda gerçekleştiğinden 1 g Desferoksamin teorik olarak 85 mg ferri iyonunu veya 41 mg Al+3 bağlayabilir. Şelat oluşturma özelliği nedeniyle, Desferoksamin plazma ya da hücrelerde bulunan serbest demiri alarak ferrioksamin kompleksi oluşturabilir. İdrarda ferrioksamin demir atımı plazmadaki demiri yansıtırken feçesteki demir başlıca intrahepatik demir şelasyonunu yansıtır. Demir, ferritin ve hemosiderinden de şelatlanabilir ise de bu Desferoksaminin klinikte geçerli konsantrasyonlarında göreceli olarak daha yavaştır. Ancak Desferoksamin, transferrindeki, hemoglobindeki veya hemin-içeren diğer maddelerdeki demiri uzaklaştırmaz. Desferoksamin dokuya bağlı alüminyumu, alüminoksamin kompleksi meydana getirerek bağlayabilir ve mobilize edebilir. Her iki kompleks, ferrioksamin ve alüminoksamin, tamamen atıldıkları için Desferoksamin demir ve alüminyumun idrar ve gaita ile atılmasını artırır ve böylece organlardaki patolojik demir ve alüminyum birikintilerini azaltır. Klinik çalışmalar: Beta-talasemi ve transfüzyona bağlı hemosideroz hastalarında başka bir demir şelatörünün (deferasiroks) kullanımının araştırıldığı randomize bir 1 yıllık klinik çalışmada desferrioksamin karşılaştırma ürünü olarak kullanılmıştır. Toplam 290 hasta, haftada 5 gün, 20 ila 60 mg/kg'lık başlangıç dozlarındaki subkutan desferrioksamin ile tedavi edilmiştir. Çalışma, serum ferritin düzeyleri, karaciğer demir konsantrasyonu ve demir atılımı oranında desferrioksaminin doza bağlı bir etkisi olduğunu göstermiştir. Desferrioksamin ayrıca orak hücre hastalığı ve transfüzyona bağlı hemosiderozu olan hastalarda deferasiroksun kullanımının incelendiği ikinci bir açık etiketli, randomize, 1 yıllık çalışmada kullanılmıştır. Toplam 63 hasta, haftada 5 gün, 20 ila 60 mg/kg'lık başlangıç dozlarındaki subkutan desferrioksamin ile tedavi edilmiştir. Çalışmanın sonunda karaciğer demir konsantrasyonundaki (LIC) ortalama değişiklik yaklaşık 0.7 mg Fe/g kuru ağırlık değerinde olmuştur. 5.2. Farmakokinetik özellikler Genel özelliklerDesferoksamin metansülfonat, beyaz ila kirli beyaz renkte tozdur. Suda kolayca çözünür, metanolde ise çok az çözünür. Moleküler ağırlığı 656.79'dur.Emilim:Desferoksamin, intramusküler bolus enjeksiyon veya subkütan yavaş infüzyondan sonra hızla emilir, buna karşılık mukoza sağlam olduğu takdirde gastrointestinal kanaldan emilim, pek azdır. Oral uygulanan 1g Desferoksaminin mutlak biyoyararlanımı % 2'den azdır. Periton diyalizi sırasında, Desferoksamin, diyaliz sıvısı içinde verildiği takdirde emilir. Dağılım:Sağlıklı gönüllülerde 10 mg/kg Desferoksamin i.m. enjeksiyonundan 30 dakika sonra 15.5 mikromol/L (8.7 mikrogram/ml ) olan doruk plazma konsantrasyonları ölçülmüştür. Enjeksiyondan 1 saat sonraki ferrioksamin doruk konsantrasyonu 3.7 mikromol/L (2.3 mikrogram/ml) olarak bulunmuştur. Sağlıklı gönüllülere, 2 g ( yaklaşık 29 mg/kg) Desferoksaminin, 2 saatlik intravenöz infüzyonundan sonra ortalama kararlı durum 30.5 mikromol/L Desferoksamin konsantrasyonlarına ulaşılır. Deferoksiminin dağılımı son derece hızlıdır. Ortalama dağılım yarı ömrü 0.4 saattir. Desferoksaminin %10'dan daha azı in vitro serum proteinlerine bağlanır. Biyotransformasyon:Demir yüklenmesi olan hastaların idrarlarından 4 Desferoksamin metaboliti izole edilip tanımlanmıştır. Desferoksamin ile aşağıdaki biyotransformasyon reaksiyonlarının oluştuğu bulunmuştur: asit bir metabolit oluşturan transaminasyon ve oksidasyon, yine asit bir metabolit oluşturan beta-oksidasyon ve nötr metabolitlerin oluşumuyla sonuçlanan dekarboksilasyon ve N-hidroksilasyon. Eliminasyon:Sağlıklı gönüllülerde intramusküler enjeksiyondan sonra hem Desferoksamin, hem de ferrioksamin, vücuttan bifazik olarak uzaklaştırılır; sanal dağılım yarılanma ömürleri Desferoksamin için 1, ferrioksamin için 2.4 saattir. Sanal terminal yarılanma ömürleri ise her iki bileşik için de 6 saattir. Enjeksiyonu izleyen 6 saat içerisinde idrara, verilen dozun % 22'si Desferoksamin, % 1'i ferrioksamin olarak çıkar. Doğrusallık/doğrusal olmayan durum:Uygulama metodu nedeniyle geçerli değildir.Hastalardaki karakteristik özelliklerBöbrek yetmezliği: Böbrek yetmezliği nedeniyle diyaliz uygulanan hastalarda diyaliz seansları arasında 1 saat içinde intravenöz 40 mg/kg Desferoksamin infüzyonu uygulandıktan sonra infüzyon tamamlandığı zamandaki plazma konsantrasyonu, 152 mikromol/L (85.2 mikrogram/ml) bulunmuştur. İnfüzyon diyaliz sırasında uygulandığı zamanda ise plazma Desferoksamin konsantrasyonları %13-27 daha düşük olmuştur. Bütün vakalarda ferrioksamin konsantrasyonu yaklaşık 7.0 mikromol/L (4.3 mikrogram/ml), alüminoksamin konsantrasyonu 2-3 mikromol/L (1.2-1.8 mikrogram/ml) olmuştur. İnfüzyon sona erdikten sonra, plazmada Desferoksamin konsantrasyonu 20 dakikalık bir yarılanma ömrüyle hızla azalmıştır. Dozun daha küçük bir kısmı daha uzun bir yarılanma ömrü (14 saat) ile vücuttan uzaklaştırılmıştır. Plazmadaki alüminoksamin konsantrasyonları infüzyondan sonra 48. saate kadar yükselmeye devam etmiş ve yaklaşık 7 mikromol/litre (4 mikrogram/ml) değerlere ulaşmıştır. Diyalizden sonra ise plazma alüminoksamin düzeyleri,2.2 mikromol/L (1.3 mikrogram/ml)'ye düşmüştür.Hemokromatozlu hastalarda: 10 mg/kg Desferoksaminin intramusküler enjeksiyonundan 1 saat sonra ölçülen doruk plazma düzeyleri Desferoksamin için 7.0 mikromol/L (3.9 mikrogram/ml), ferrioksamin için 15.7 mikromol/L (9.6 mikrogram/ml) olmuştur. Bu hastalar Desferoksamin ve ferrioksamini sırası ile 5.6 ve 4.6 saatlik yarı-ömür ile elimine etmişlerdir. Enjeksiyondan 6 saat sonra idrarda dozun %17'si Desferoksamin, %12'si ferrioksamin olarak atılmıştır.Talasemili hastalarda:Desferoksaminin 50 mg/kg/24 saat sürekli intravenöz infüzyonunda Desferoksamin plazma kararlı durum düzeyleri 7.4 mikromol/L (4.1mikrogram/ml) bulunmuştur. Plazmadan Desferoksamin atılımı bifazik ve ortalama dağılım yarılanma ömrü 0.28 saat ve sanal terminal yarılanma ömrü 3.0 saat olmuştur. Toplam plazma klerensi 0.5 L/s/kg ve kararlı durumda dağılım hacmi 1.35 L/kg olarak hesaplanmıştır. Eğri altında kalan alan açısından başlıca demir bağlayıcı metabolite maruz kalma Desferoksaminin % 54'ü civarında olmuştur. Metabolitin sanal monoeksponansiyel atılım yarılanma ömrü 1.3 saatti.5.3. Klinik öncesi güvenlilik verileriYüksek doz Desferoksaminin sıçan, köpek ve kedilere haftalarca uygulanması gözde lens opaklaşması ile katarakt oluşmasına sebep olmuştur.Desferoksamin ile in vitro denemelerde (Ames testi) ve in vivo denemelerde (sıçanda mikronukleus testi) genotoksisite/mutajenik etkiler görülmemiştir. Uzun süreli karsinojenite testleri yapılmamıştır. Desferoksamin sıçan ve farelerde teratojenik değildir. Anneye toksik dozlarda uygulama sonrasında tavşan fetuslarında aksiyal iskelette bazı malformasyonlar görülmüştür. Bu çalışmanın sonuçları henüz ön çalışma halinde ise de, tavşanda, uygulanan deneysel koşullarda, Desferoksamin ile teratojenitenin indüklenebileceği göz ardı edilmemelidir. FARMASÖTİK ÖZELLİKLER6.1.Yardımcı maddelerin listesiYardımcı madde içermemektedir.6.2.Geçimsizlikler-Enjeksiyonluk heparin çözeltisi.-Serum fizyolojik (% 0.9) kuru aktif maddeyi çözmek için, çözücü olarak kullanılmamalıdır; fakat etkin maddeyi enjeksiyonluk suda çözdükten sonraki seyreltmeler için kullanılabilir. 6.3.Raf ömrü48 ay6.3. Saklamaya yönelik özel tedbirler25 °C'nin altındaki oda sıcaklığında saklayınız.Ürün hazırlandıktan hemen sonra uygulanmalıdır (tedaviye 3 saat içinde başlanmalıdır). Garantili aseptik şartlarda hazırlanması halinde ürün, uygulamadan önce en çok 24 saat oda sıcaklığında saklanabilir. 6.5.Ambalajın niteliği ve içeriğiKauçuk kapaklı, 7,5 ml'lik renksiz cam flakon 10 flakonluk ambalajlarda sunulmaktadır.6.6.Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerÜrünün uygulanması ile ilgili daha detaylı bilgi için bölüm 4.2 Pozoloji ve uygulama şekli bölümüne bakınız.Parenteral olarak kullanıldığında, daha yüksek konsantrasyonun gerekebileceği i.m. enjeksiyon hariç ilaç, enjeksiyonluk su içerisinde 95 mg/ml'lik çözelti olarak kullanılmalıdır. Subkutan, intravenöz ve intramusküler uygulamalar için enjeksiyonluk çözelti tozunun hazırlanışı sırasıyla Tablo 1 ve Tablo 2'de verilmektedir. DESFERAL toz içeren flakon içerisine, yeteri miktarda enjeksiyonluk su enjekte edilir ve flakon iyice çalkalanır. Sadece berrak ve renksiz-çok hafif sarımsı çözeltiler kullanılabilir. 6.Tablo 1:_Subkutan ve intravenöz uygulamalar için hazırlanış
DESFERAL, STERİL ENJEKSİYONLUK SU İLE SEYRELTİLİR_boyutugereken steril sonrasında toplam başına son konsantrasyon enjeksiyonluk suilaç içeriği miktarı 500 mg2 mL500 mg/2.35 mL213 mg/mL95 mg/ml DESFERAL çözeltisi sulandırıldıktan sonra, rutin olarak kullanılan infüzyon çözeltileri (%0.9 NaCl, %5 glikoz, Ringer çözeltisi, Ringer-Laktat çözeltisi; Dianeal 137 %2.27 glikoz, Dianeal PD4 %2.27 glikoz ve CAPD/DPCA 2 %1.5 glikoz gibi periton diyalizi çözeltileri) ile daha fazla seyreltilebilir. DESFERAL infüzyon testinde ve kronik alüminyum birikiminin tedavisinde, 500 mg'lık flakondaki 5.3 ml DESFERAL çözeltisi (5 mg/kg), vücut ağırlığı 100 kg olan bir hasta için yeterli dozdur. Hastanın gerçek vücut ağırlığına göre uygun miktarda DESFERAL çözeltisi flakondan çekilir ve 150 ml % 0.9 NaCl çözeltisine (serum fizyolojik) eklenir. Çözünmüş DESFERAL diyaliz sıvısına da eklenerek CAPD veya CCPD uygulanan hastalara intraperitoneal uygulanabilir. Kronik demir birikiminin uzun süreli tedavisi için DESFERAL'in taşınabilir bir infüzyon pompası kullanılarak uygulanması aşağıda belirtilmiştir: 1.Bir enjektöre enjeksiyonluk su çekiniz. 2.DESFERAL flakonunun lastik tıpasını alkolle temizledikten sonra enjektör içeriğini flakon içerisine boşaltınız. 3.Tozun çözünmesi için flakonu iyice çalkalayınız. 4.Çözünmüş ilacı enjektöre çekiniz. 5.Bağlantı tüpünün bir ucunu enjektöre, öbür ucunu bir kelebek iğneye bağlayın ve tüpteki boşluğu, enjektördeki çözelti ile doldurunuz. 6.Enjektörü infüzyon pompasına yerleştiriniz. 7.İnfüzyonu vermek için kelebek iğneyi karın, kol, bacağın üst bölümü ya da uylukta deri altına yerleştiriniz. İğneyi deriye sokmadan önce derinin alkolle iyice temizlenmesi önemlidir. İğnenin ucunu, serbest elinizle oluşturduğunuz bir deri kıvrımının içine kanatlara kadar sıkıca yerleştirin. İğneyi salladığınız zaman, iğnenin ucu serbest bir şekilde hareket etmelidir. Eğer serbest hareket etmiyorsa, iğnenin ucu deriye çok yakın olabilir. Bu durumda başka bir yeri alkolle iyice temizledikten sonra deneyiniz. 8.İğneyi flasterle tespit ediniz. 9. Hastalar infüzyon pompasını genellikle bir kemere veya omuz askısına takılı durumda taşırlar. Hastaların çoğu gece boyunca uygulamayı yeğlemektedirler. 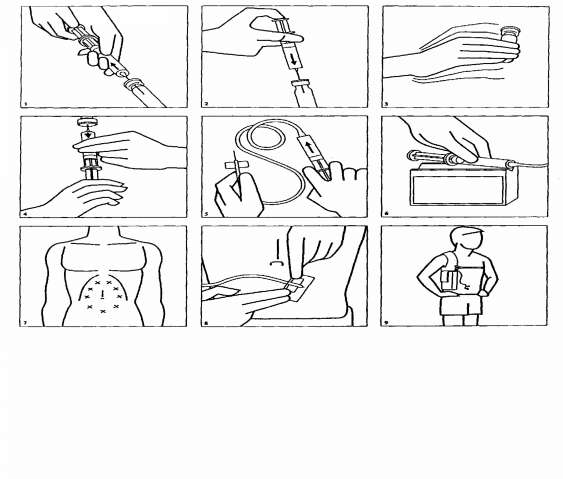 Kullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği"ne uygun olarak imha edilmelidir.
Kullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği"ne uygun olarak imha edilmelidir.7.RUHSAT SAHİBİNovartis Ürünleri 34912 Kurtköy-İstanbul8.RUHSAT NUMARASI85/739.İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 18.06.1984 Ruhsat yenileme tarihi : -10KÜB'ÜN YENİLENME TARİHİ16/16 |
İlaç BilgileriDesferal 0.5g FlakonEtken Maddesi: Desferoksamin metansülfonat Atc Kodu: V03AC01 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.