Spiriva Respimat 2.5 mcg/püskürtme inhalasyon çözeltisi Kısa Ürün BilgisiSolunum Sistemi » Solunum Sisteminde Tıkanma - Astım İlaçları » Diğer İnhalanlar (solukla içeri çekilen ilaçlar) » Antikolinerjik İlaçlar » Tiotropium Bromür KISA URUN BILGISI1. BEŞERI TIBBI URUNUN ADISPIRIVA RESPIMAT 2.5 mikrogram/püskürtme İnhalasyon Çözeltisi2. KALITATIF VE KANTİTATIF BILEŞIMEtkin madde:Her püskürtmede (puf), 2.5 mikrogram tiotropium'a eşdeğer, 3.124 mikrogram tiotropium bromür monohidrat (3 - Oksa - 9 - azoniatrisiklo [ 3.3.1.02,4 ] nonan, 7 - [(hidroksidi-2 -tienilasetil) oksi] -9,9 dimetil-, bromür, monohidrat, (1 a, 2 P, 4 P, 5 a, 7 P)-) salıverilmektedir. (INN ismi = tiotropium bromür).Yardımcı maddeler:Yardımcı maddeler arasında, doz başına 0.00221 mg benzalkonyum klorür içermektedir. İlgili uyarı için bölüm 4.4'e bakınız.Yardımcı maddelerin tam bir listesi için, bölüm 6.1'e bakınız. 3. FARMASÖTIK FORMİnhalasyon çözeltisi.4. KLİNIK ÖZELLIKLER4.1 Terapötik endikasyonlarTiotropium bromür, orta ve ağır KOAH (kronik obstrüktif akciğer hastalığı) olgularında düzenli kullanıldığında atak sıklığını azaltmakta, semptomları ve yaşam kalitesini düzeltebilmekte, ancak uzun dönemdeki FEVı düşüşünü değiştirmemektedir.4.2 Pozoloji ve uygulama şekliErişkinlerPozoloji:SPIRIVA RESPIMAT'ın önerilen dozu, günde bir kez 2 püskürtmenin (puf) inhale edilmesidir.Uygulama sıklığı ve süresi:İnhalasyon her gün, günün aynı saatinde, RESPIMAT inhalatörü kullanılarak yapılmalıdır.Uygulama şekli:Lütfen aşağıdaki talimatları okuyunuz ve dikkatle uygulayınız.
Spirivs'Respin«Ort(ün»imİKapak(A)'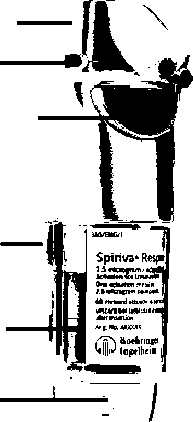
"Doz göstergesiiAğızlık (B)Hava deliği CC)Doz serbestleme düğmesi (D)P0 laıirlöP . Dlsctıtft#*®KSİm ^Kartuş CH)Güvenlik kilidi '■tjSaydamtabanDeliciiğneKartuşun yerleştirilmesi ve kullanıma hazırlamaİlk kullanımdan önce aşağıdaki 1'den 6'ya kadar olan basamakların uygulanması gerekir: Yeşil renkli kapak kapalı durumda iken, güvenlik kilidine (E) bastırınız ve saydam taban parçasını (G) çekerek çıkarınız. Güvenlikkilidi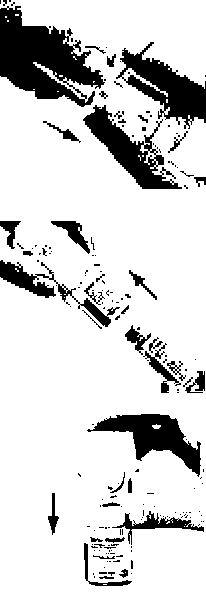 2a
2a2b 1 1.Kartuşu (H) kutusundan çıkarınız. Kartuşun darolan ucunu inhalatörün içine doğru itiniz ve bir klik sesi ile yerine oturmasını sağlayınız.2.Kartuşun tam olarak yerleştiğinden emin olmak için, sağlam bir yüzeyin üzerine koyarak hafifçe ve dikkatlibir şekilde bastırınız (2b).İnhalatöre yerleştirdikten sonra kartuşu yerinden çıkartmayınız. 3.Saydam taban parçasını yerine takınız (G).Saydam tabanı bir daha yerinden çıkarmayınız.  SPIRIVA RESPIMAT inhalatörün ilk kullanım için hazırlanması4.SPIRIVA RESPIMAT inhalatörü, yeşil kapak (A) kapalı halde iken, dik olarak tutunuz. Saydam taban parçasını (G) etiketin üzerindeki kırmızı ok işaretleri yönünde, bir klik sesi alıncaya kadar döndürünüz (yarım tur).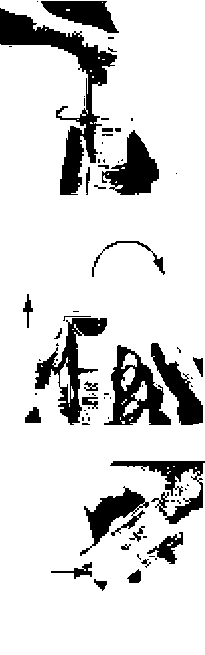 4
45 6 5.Yeşil kapağı (A), tamamen yana yatıncaya kadar açınız.6.SPIRIVA RESPIMAT inhalatörü yere doğru tutunuz.Doz serbestleme düğmesine (D) basınız. Yeşil kapağı (A) kapatınız. 4, 5 ve 6. basamakları küçük bir bulut görününceye kadar tekrarlayınız.Daha sonra 4, 5 ve 6. basamakları, inhalatörün kullanıma hazır olduğundan emin olmak amacıyla üç kez daha tekrarlayınız.SPIRIVA RESPIMAT inhalatör şimdi artık kullanımahazırdır.Bu işlemler, inhalatördeki kullanılabilir doz sayısını etkilemeyecektir. SPIRIVA RESPIMAT inhalatör, kullanım için hazırlandıktan sonra, 30 doz (60 püskürtme / puf) verebilecek durumdadır. I. Kazaen bir doz serbestlenmesini önlemek amacıyla yeşil kapak (A) kapalı durumda iken, SPIRIVA RESPIMAT inhalatörü dik olarak tutunuz. Saydam tabanı (G) etiketteki kırmızı ok işaretleri yönünde, bir klik sesi alıncaya kadar döndürünüz (yarım tur). 
SPIRIVA RESPIMAT inhalatörün kullanılması I  II. Yeşil kapağı (A), tamamen yana yatıncaya kadar açınız. Nefesinizi yavaşça ve tamamen dışarı veriniz. Daha sonra dudaklarınızı, hava deliklerini (C) kapatmayacak şekilde, ağızlığın ucu çevresinde sıkıca kapayınız. SPIRIVA II RESPIMAT inhalatörü boğazınızın arkasına doğru yönlendiriniz. Ağzınızdan yavaş ve derin bir nefes alırken, doz serbestleme düğmesine (D) basınız ve alabildiğiniz kadar, yavaş nefes almaya devam ediniz. Nefesinizi 10 saniye kadar veya sizi zorlamayacak bir süre tutunuz. III I. ve II. basamakları tekrarlayınız; böylelikle dozun tamamını almış olacaksınız.Bu inhalatörü sadece GÜNDE bIr KEZ kullanmanız gerekmektedir.SPIRIVA RESPIMAT inhalatörü tekrar kullanıncaya kadar yeşil kapağı kapalı durumda tutunuz.Eğer SPIRIVA RESPIMAT inhalatörünüz 7 günden uzun süredir kullanılmamış ise, yere doğru bir kez püskürtünüz. Eğer SPIRIVA RESPIMAT inhalatörünüz 21 günden uzun süredir kullanılmamış ise, 4'ten 6'ya kadar olan basamakları küçük bir bulut görününceye kadar tekrarlayınız. Daha sonra 4'ten 6'ya kadar olan basamakları üç kez daha tekrarlayınız.Yeni bir SPIRIVA RESPIMAT inhalatör ne zaman alınmalıSPIRIVA RESPIMAT inhalatör 30 doz (60 püskürtme) içermektedir. Doz göstergesi, yaklaşık olarak ne kadar ilacın kaldığını gösterir. İşaret oku ölçeğin kırmızı bölümüne girdiğinde, yaklaşık 7 günlük ilaç (14 püskürtme) kalmış demektir. Bu durumda yeni bir SPIRIVA RESPIMAT inhalatör reçetesi alma zamanınız gelmiştir. 
HE!^Inıjp» km■ Boş■■f'DoluJDoz göstergesi kırmızı ölçeğin sonuna ulaştığında (yani 30 dozun tamamı kullanıldığında), SPIRIVA RESPIMAT inhalatör boşalmıştır ve otomatik olarak kilitlenir. Bu durumda iken, taban parçası artık daha fazla döndürülemez.İçindeki ilacın tamamı kullanılmamış bile olsa, SPIRIVA RESPIMAT inhalatör ilk kez kullanıldıktan en geç üç ay sonra atılmalıdır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Böbrek yetmezliği olan hastalar, SPIRIVA RESPIMAT'ı önerilen dozlarda kullanabilirler. Ancak, esas olarak böbrekler yoluyla atılan bütün ilaçlarda olduğu gibi, orta ile şiddetli böbrek yetmezliği olan hastalarda SPIRIVA RESPIMAT kullanımı yakından izlenmelidir (Bkz. Özel kullanım uyarıları ve önlemleri ve Farmakokinetik özellikler bölümleri).Karaciğer yetmezliği:Karaciğer yetmezliği olan hastalar SPIRIVA RESPIMAT'ı önerilen dozlarda kullanabilirler.Pediyatrik popülasyon:Kronik obstrüktif akciğer hastalığı, normal olarak çocuklarda ortaya çıkmamaktadır. SPIRIVA'nın pediyatrik hastalardaki güvenlilik ve etkinliği belirlenmemiştir.Geriyatrik popülasyon:Yaşlı hastalar SpIRIVA RESPIMAT'ı önerilen dozlarda kullanabilirler.4.3 KontrendikasyonlarSPIRIVA RESPIMAT atropin veya türevlerine, örn. ipratropium ya da oksitropium, veya bu ilacın bileşenlerinden herhangi birisine karşı aşırı duyarlılık öyküsü olan hastalarda kontrendikedir (Bkz. Bölüm 2 ve Bölüm 6.1 Yardımcı maddeler).4.4 Özel kullanım uyarıları ve önlemleriSPIRIVA RESPIMAT günde bir kez kullanılan bir idame tedavisi bronkodilatörü olarak, akut bronkospazm episodlarının başlangıç tedavisinde, yani kurtarma tedavisi şeklinde kullanılmamalıdır.SPIRIVA RESPIMAT uygulamasından sonra ani aşırı duyarlılık reaksiyonları oluşabilir Diğer antikolinerjik ilaçlarla olduğu gibi, SPIRIVA RESPIMAT dar açılı glokom, prostat hiperplazisi ya da mesane boynu obstrüksiyonu bulunan hastalarda dikkatle kullanılmalıdır. İnhalasyon yoluyla alınan ilaçlar, inhalasyonun indüklediği bronkospazma neden olabilirler. SPIRIVA RESPIMAT kardiyak ritm bozuklukları olduğu bilinen hastalarda dikkatle kullanılmalıdır (bkz. 5.1). Esas olarak böbrekler yoluyla atılan bütün ilaçlarda olduğu gibi, orta ile şiddetli böbrek bozukluğu olan hastalarda (kreatinin klerensi <50 mL/dk) SPIRIVA RESPIMAT kullanımı yakından izlenmelidir. Hastalara, SPIRIVA RESPIMAT'ın doğru bir şekilde nasıl kullanılacağı öğretilmelidir. Çözeltinin ya da buğusunun göze kaçmaması için dikkatli olunmalıdır. Konjonktivada konjesyon ve korneada ödem sonucunda gelişen göz kızarmasıyla birlikte gözde ağrı veya rahatsızlık hissi, bulanık görme, haleler veya renkli görüntüler görme, akut dar açılı glokom belirtileri olabilir. Bu semptomlar herhangi bir kombinasyon şeklinde gelişirse, hemen bir uzman hekimin görüşü alınmalıdır. Miyotik göz damlalarının, etkili bir tedavi sağlamadıkları kabul edilmektedir. SPIRIVA RESPIMAT günde bir defadan daha sık kullanılmamalıdır. SPIRIVA kartuşları, yalnızca RESPIMAT inhalatörü ile kullanılmalıdır. SPIRIVA RESPIMAT yardımcı maddeler arasında, önerilen doz başına 0.00221 mg benzalkonyum klorür içermektedir. Benzalkonyum klorür göz ve deride irritasyona neden olabilir. Ayrıca solunum yoluyla doz başına 10 mg alındığında bronkospazma yol açabilir. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriDüzenli ilaç etkileşimi çalışmaları yürütülmemiş olmakla birlikte tiotropium bromür, KOAH tedavisinde yaygın olarak kullanılan diğer ilaçlar ile beraber, ilaç etkileşimine yönelik klinik bulgular görülmeksizin kullanılmıştır; sempatomimetik bronkodilatörler, metilksantinler, oral ve inhale steroidler, bu ilaçlar arasındadır.Tiotropium bromürün diğer antikolinerjik ilaçlar ile birlikte kronik olarak uygulanması henüz incelenmemiştir. Bu nedenle, diğer antikolinerjik ilaçların SPIRIVA RESPIMAT ile birlikte kronik olarak uygulanması önerilmemektedir. Özel popülasyonlara ilişkin ek bilgiler:Özel bir veri bulunmamaktadır.Pediyatrik popülasyon:Özel bir veri bulunmamaktadır.4.6 Gebelik ve laktasyonGenel tavsiye:Gebelik kategorisi C'dir.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon):Lütfen aşağıdaki bilgilere bakınız.Gebelik dönemi:Tiotropium bromür için, gebeliklerde maruz kalmaya ilişkin klinik veri bulunmamaktadır.Hayvanlar üzerinde yapılan çalışmalar, gebelik / embriyonal / fetal gelişim / doğum ya da doğum sonrası gelişim ile ilgili olarak doğrudan ya da dolaylı zararlı etkiler olduğunu göstermemektedir (bkz. kısım 5.3). Gebe kadınlara verilirken tedbirli olunmalıdır. Laktasyon dönemi:Bebeklerini emziren annelerde, tiotropium temasına yönelik klinik veri bulunmamaktadır. Laktasyondaki kemirgenlerde yapılan çalışmalarda, az miktarda tiotropiumun süte geçtiği belirlenmiştir.Bu nedenle SPIRIVA RESPIMAT emziren kadınlarda, beklenen yararları bebek üzerindeki herhangi bir olası riske karşı ağır basmadığı sürece kullanılmamalıdır. Üreme yeteneği/Fertilite:Tavşanlar ve sıçanlardaki üreme çalışmalarında gebelik,embriyo/fetal gelişim, doğum ve doğum sonrası gelişime yönelik zararlı etkiler, yalnızca anne için toksik olan doz düzeylerinde gösterilebilmiştir. 4.7 Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanma becerileri üzerindeki etkilerine yönelik bir çalışma yapılmamıştır. Baş dönmesi ve bulanık görme olaylarının ortaya çıkması, araç ve makine kullanma becerilerini etkileyebilir.4.8 istenmeyen etkilerListelenmiş olan istenmeyen etkilerin çoğu, SPIRIVA RESPIMAT'ın antikolinerjik özelliklerine bağlanabilir.Advers ilaç reaksiyonları, klinik araştırmalardan elde edilen veriler ve ilacın onay sonrası kullanımı süresince yapılan spontan bildirimlerden tanımlanmıştır. Klinik araştırma veritabanı, tedavi dönemi on iki hafta ile bir yıl arasında değişen 5 plasebo kontrollü klinik araştırmada yer alan ve 2.248 kişi yılı tiotropium temasını temsil eden 2.802 tiotropium hastasını içermektedir. MedDRA konvansiyonuna göre yaygınlık dereceleri şu şekildedir: Çok yaygın (>1/10); yaygın (>1/100 ilâ <1/10); yaygın olmayan (>1/1,000 ilâ <1/100); seyrek (>1/10,000 ilâ <1/1,000); çok seyrek (<1/10,000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Metabolizma ve beslenme hastalıklarıBilinmiyor: DehidratasyonSinir sistemi hastalıklarıYaygın olmayan: Baş dönmesi, baş ağrısıBilinmiyor: Uykusuzluk Göz hastalıklarıSeyrek: Glokom, göz içi basıncında artış, bulanık görmeKardiyak hastalıklarYaygın olmayan: Atriyal fibrilasyon, palpitasyonlar, supraventriküler taşikardi, taşikardiSolunum, göğüs bozuklukları ve mediyastinal hastalıklarYaygın olmayan: Öksürük, burun kanaması, farenjit, disfoniSeyrek: Bronkospazm, larenjit Bilinmiyor: Sinüzit Gastrointestinal hastalıklarYaygın: Ağız kuruluğu, genellikle hafifYaygın olmayan: Konstipasyon, orofarenjiyal kandidiyazis, disfaji Seyrek: Gastroözofajiyal reflü hastalığı, gingivit, glossit, stomatit Bilinmiyor: Paralitik ileus dahil intestinal obstrüksiyon, bulantı, diş çürümesi Deri ve derialtı dokusu hastalıkları, bağışıklık sistemi hastalıklarıYaygın olmayan: Kaşıntı, döküntüSeyrek: Anjiyonörotik ödem, ürtiker, deri infeksiyonu ve deri ülseri, deride kuruluk Bilinmiyor: Aşırı duyarlılık (ani reaksiyonlar dahil) Kas-iskelet bozuklukları, bağ dokusu ve kemik hastalıklarıBilinmiyor: Eklemlerde şişlikBöbrek ve idrar hastalıklarıYaygın olmayan: İdrar retansiyonu (genellikle predispozan faktörleri olan erkek hastalarda),idrar yapmada güçlük Seyrek: İdrar yolu enfeksiyonu 4.9 Doz aşımı ve tedavisiYüksek dozlarda SPIRIVA RESPIMAT antikolinerjik bulgu ve semptomlara yol açabilir.Sağlıklı gönüllülerde 14 gün süreyle 40 mikrograma kadar tiotropium inhalasyon çözeltisi uygulamasından sonra, 7. günden itibaren ortaya çıkan tükürük salgısında anlamlı azalma dışında, doza bağımlı bir sıklıkla görülen (günlük 10 - 40 mikrogram) ağız kuruluğu, boğazda kuruluk ve burun mukozasında kurumanın ötesinde, başka ilişkili bir advers olay gözlenmemiştir. Kronik obstrüktif akciğer hastalarına 4 ile 48 hafta boyunca, 10 mikrogramlık günlük tiotropium inhalasyon çözeltisi dozlarının uygulandığı uzun dönemli 6 çalışmada önemli istenmeyen etkiler görülmemiştir. Oral yoldan biyoyararlanımının düşük olması nedeniyle, kartuştaki tiotropium inhalasyon çözeltisinin kasıtsız olarak oral yoldan alınması sonucunda akut intoksikasyon pek olası değildir. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: AntikolinerjiklerATC kodu: R03B B04 Tiotropium bromür, klinik tıpta genellikle antikolinerjik olarak adlandırılan, uzun etkili spesifik bir antimuskarinik ajandır. Mı'den M5'e kadar olan muskarinik reseptör alt-tiplerine karşı benzer bir afinite gösterir. Hava yollarında, düz kasta bulunan M3 reseptörlerinin inhibisyonu gevşeme ile sonuçlanmaktadır. Antagonizmanın yarışmacı ve geri-dönüşümlü olduğu, insan ve hayvan kaynaklı reseptörlerde ve izole organ preparatlarında gösterilmiştir. Klinik öncesi in vitroin vivoin vitroçalışmalarda M2'ye karşı M3 için kinetik olarak kontrol edilen bir reseptör alt-tipi seçiciliğinin varlığını açığa çıkarmıştır. Yüksek düzeydeki potens ve reseptörden yavaş dissosiyasyonun klinikteki karşılığı, KOAH'lı kişilerdeki belirgin ve uzun etkili bronkodilatasyondur.Tiotropium inhalasyonunu izleyen bronkodilatasyon, esas olarak lokal (havayolları üzerinde) bir etki olup, sistemik bir etki değildir. Klinik Faz III programında 2901 KOAH hastası üzerinde yürütülen (1038'ine 5 mikrogram tiotropium dozu verildi) ikisi 1 yıl süreli, ikisi 12 hafta süreli ve ikisi dört hafta süreli randomize, çift-kör çalışma bulunmaktaydı. Bir yıllık program plasebo kontrollü iki araştırmadan oluşuyordu. On iki hafta süreli iki araştırma, hem aktif (ipratropium) hem de plasebo kontrollüydü. Altı çalışmanın hepsinde de akciğer fonksiyonu ölçümleri yer almaktaydı. Ek olarak, 1 yıl süreli iki çalışma, dispne, sağlıkla ilişkili yaşam kalitesi ve alevlenmeler üzerindeki etkilere yönelik, sağlık sonuçlanım ölçümlerini de içeriyordu. Sözü edilen bu çalışmalarda, günde bir kez uygulanan SPIRIVA RESPIMAT akciğer fonksiyonlarında (bir saniyelik zorlu ekspirasyon hacmi ve zorlu vital kapasite) ilk dozu izleyen 30 dakika içinde, plaseboya kıyasla belirgin iyileşmeye yol açtı. Akciğer fonksiyonlarındaki bu iyileşme, kararlı durum düzeylerinde, 24 saat süreyle kalıcı oldu. Farmakodinamik kararlı duruma bir hafta içerisinde ulaşıldı. SPIRIVA RESPIMAT sabah ve akşam pik ekspiratuar akım hızı (PEFR) düzeylerini, hastalarda yapılan günlük kayıtlarda ölçüldüğü şekliyle, anlamlı olarak iyileştirdi. SPIRIVA RESPIMAT uygulaması, kurtarıcı bronkodilatör kullanımında, plaseboya kıyasla azalma ile sonuçlandı. SPIRIVA RESPIMAT'ın bronkodilatör etkileri, 48 haftalık uygulama dönemi boyunca tolerans belirtisi bulunmaksızın kalıcı oldu. Şekil 1:Sırasıyla Gün 1 ve 337'de her zaman noktasında (çalışma ilacı uygulamasından önce ve sonra) ortalama FEV1 (litre) düzeyleri (bir yıl süreli, paralel gruplu iki araştırmanın bileşik verileri)*Araştırma 2!05.;254 v-'e ;2([)5.2i)5 - İncele;nıe günü 1■iş>PJPH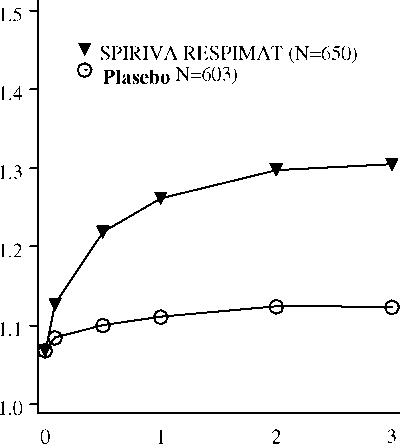
İlaç uyguli^masındiiiı sonrió ^^e(çen ziimiiıı (saat)Araştırma 205.254 ve 205.;255 - İnceleme günü 337>PJPH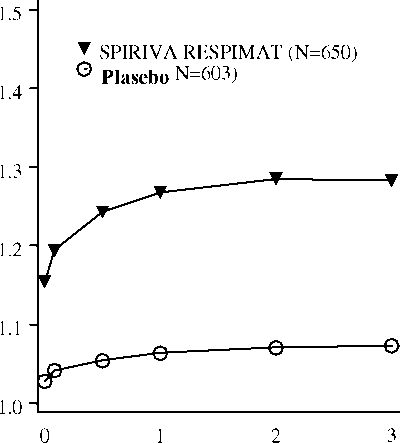
İlaç ^y^^ıılciıniisından sonrii ^^ei^en ^^annn (saat)*Ortalama değerler, merkez, sigara içme durumu ve başlangıç dönemi etkilerine göre uyarlanmıştır. SPIRIVA ve plasebo gruplarında sırasıyla, toplam 545 ve 434 hasta, 337. inceleme gününü tamamlamıştı. Kalan hastalara ilişkin veriler, ileri taşınan son ya da en az elverişli gözlem yöntemiyle girildi.Şekil 2:Sırasıyla Gün 1 ve 85'te her zaman noktasında (çalışma ilacı uygulamasından önce ve sonra) ortalama FEV1 (litre) düzeyleri (on iki hafta süreli, paralel gruplu iki araştırmanın bileşik verileri)*Araştırma 205.251 ve 205.252 - İnceleme; günü 85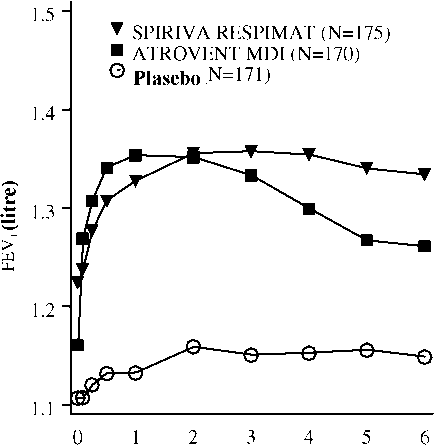
İlaç uygul^n:ıasııed^ sonma |i;e(ren zam^n (saat)Araştırma 205.251 -ve 205.İİ52 - İnceleme günü 1>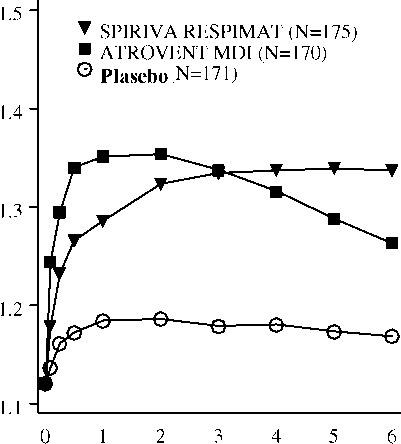
İlaç uygul^m^sınd^n sonr^ |i;eı;:en z:anı^n (saat)* Gün 85'te, SPIRIVA, Atrovent İnhalatörlü Aerosol (MDI) ve plasebo gruplarında sırasıyla, toplam 155, 142 ve 152 hasta 85. inceleme gününü tamamlamıştı. Kalan hastalara ilişkin veriler, ileri taşınan son ya da en az elverişli gözlem yöntemiyle girildi.Şekil 3:Gün 29'da her zaman noktasında (çalışma ilacı uygulamasından önce ve sonra) ortalama FEV1 (litre) düzeyleri (dört hafta süreli, çapraz geçişli iki araştırmanın [205.249 ve 205.250] bileşik verileri)*> m 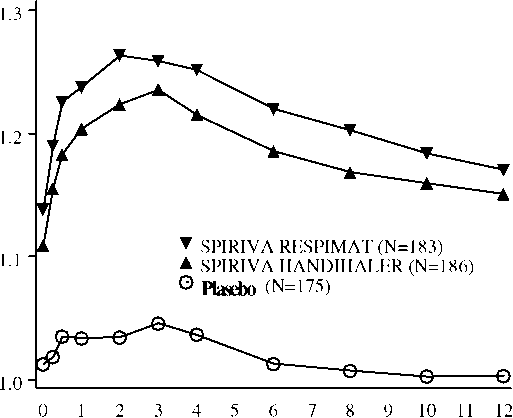
İlaç uy^lamasııedan sonra g^çı^n zanoan (saat)*Ortalama değerler, merkez, hasta (merkez içinde), dönem ve başlangıç dönemi etkilerine göre uyarlanmıştır. Çalışmayı daha önce sonlandıran hastalara ilişkin veriler, ileri taşınan son ya da en az elverişli gözlem yöntemiyle girildi. Araştırmaları tamamlayan hastalar üç tedavi ilacının tamamını almışlardı.Randomize, plasebo kontrollü, çapraz geçişli iki klinik araştırmanın bileşik analizinde, 4 haftalık bir tedavi döneminin arkasından, SPIRIVA RESPIMAT (5 mikrogram) ile alınan bronkodilatör yanıtın, SPIRIVA HandiHaler® (18 mikrogram) inhalasyon tozu ile alınandan sayısal olarak daha yüksek olduğu ortaya konuldu.Bir yıllık uzun süreli araştırmalarda, sağlığa ilişkin olarak aşağıdaki sonuçlar ortaya çıkarılmıştır: (a) SPIRIVA RESPIMAT dispneyi anlamlı derecede iyileştirdi (Transizyon Dispne İndeksi kullanılarak değerlendirildiği şekliyle). Bu iyileşme bütün tedavi dönemi süresince kalıcıydı. (b) Hastaların kendi Yaşam Kalite'leri üzerinde yaptıkları değerlendirmeler (St. George Respiratuar Anketi kullanılarak ölçüldüğü üzere), SPIRIVA RESPIMAT'ın, KOAH'ın psikososyal etkileri, KOAH'ın etkilediği aktiviteler ve KOAH semptomları nedeniyle oluşan sıkıntılar üzerinde pozitif etkileri olduğunu gösterdi. Bir yıl süreli iki çalışmanın sonunda ortalama toplam skorda plaseboya kıyasla SPIRIVA RESPIMAT ile görülen iyileşme istatistiksel olarak anlamlıydı ve bütün tedavi dönemi boyunca kalıcı oldu. (c) SPIRIVA RESPIMAT KOAH'taki alevlenmelerin sayısını anlamlı derecede azalttı ve ilk KOAH alevlenmesine kadar geçen süreyi geciktirdi. Bir yıl süreli, randomize, çift-kör, plasebo kontrollü bir klinik araştırmada, 1939 KOAH hastasına SPIRIVA RESPIMAT ve 1953 hastaya plasebo verildi. Araştırma sırasında hastaların, inhale antikolinerjikler dışında bütün respiratuar ilaçları (uzun etkili beta agonistler ve inhale kortikosteroidler) kullanmalarına izin verildi. SPIRIVA® RESPIMAT® tedavisi plaseboya kıyasla, KOAH alevlenmesi riskinde %31 azalma (%95 GA %23 ile %37; p <0.0001), KOAH alevlenmesi nedeniyle hospitalizasyon riskinde %27 azalma (%95 GA %10 ile %41; p = 0.003), %21 daha az KOAH alevlenmesi (%95 GA %13 ile %28; p <0.0001) ve %19 daha az KOAH alevlenmesi nedeniyle hospitalizasyon (%95 GA %7 ile %30; p = 0.004) ile sonuçlandı. SPIRIVA RESPIMAT ile yürütülen ve 6,096 hastayı kapsayan bir yıl süreli üç ve altı ay süreli bir plasebo kontrollü araştırmanın retrospektif toplu analizinde, SPIRIVA RESPIMAT ile tedavi edilen hastalarda, tüm nedenlere bağlı mortalitede plaseboya kıyasla (51; insidans oranı (IR) yüz hasta yılı başına 1.98), sayısal bir artış görülmüştür (68; IR 2.64); planlanan tedavi dönemi içinde görülen oluşum oranı (%95 güven aralığı) 1.33 (0.93, 1.92) olmuştur. Birlikte alınan respiratuar ilaçlar, başlangıç dönemindeki demografik faktörler ve kardiyak bozuklukları içeren, ancak bunlarla sınırlı olmayan alt-grup analizlerinde, mortalitedeki bu dengesizliğin, ritm bozuklukları olduğu bilinen hastalarda gözlendiği açığa çıkmıştır. Ancak bu analizler, retrospektif yaklaşım, çoklu karşılaştırmalar ve küçük rakamlar ile sonuçlanan alt-gruplar nedeniyle kısıtlanmaktadır. SPIRIVA HandiHaler ya da plasebo uygulanan 17,014 hastayı kapsayan, 4 haftadan uzun süreli çalışmaların bir toplu analizinde, tüm nedenlere bağlı mortalite için oluşum oranı (%95 GA), 0.85 (0.75 - 0.97) bulunmuştur. HandiHaler ve Respimat formülasyonları arasında tüm nedenlere bağlı mortalite riskinde ortaya çıkan belirgin farklılığın nedenleri belirsizdir, ihtiyatla yorumlanmalıdır ve klinik araştırmalara bağlı faktörleri ya da sonuçlanımlardaki değişkenliği yansıtabilir. 5.2 Farmakokinetik özellikler Genel özelliklerTiotropium bromür, kiralite göstermeyen bir kuaterner amonyum bileşiğidir ve suda kısmen çözünür. Tiotropium bromür, RESPIMAT inhalatörü ile uygulanan inhalasyon çözeltisi şeklinde bulunmaktadır. İnhale edilen dozun %40 civarı, hedef organ olan akciğerde, kalan miktar ise gastrointestinal kanalda tutulur. Aşağıda açıklanan farmakokinetik verilerin bazıları, tedavi için önerilenden daha yüksek dozlar ile elde edilmiştir.Emilim:Sağlıklı genç gönüllülerce çözeltinin inhalasyonundan sonra elde edilen üriner atılım verileri, inhale edilen dozun yaklaşık %33'ünün sistemik dolaşıma ulaştığını düşündürmektedir. Bileşiğin kimyasal yapısından (kuaterner amonyum bileşiği), tiotropium bromürün gastro-intestinal kanaldan iyi absorbe edilmemesi beklenir. Aynı nedenle besinlerin tiotropium absorpsiyonu üzerinde etkili olması beklenmemektedir. Oral tiotropium çözeltileri, %2-3 düzeyinde bir mutlak biyoyararlanıma sahiptirler. Maksimum plazma tiotropium bromür konsantrasyonları, inhalasyondan beş dakika sonra gözlenmiştir. Dağılım:İlaç plazma proteinlerine %72 oranında bağlanır ve 32 L/kg'lık bir dağılım hacmi gösterir. Kararlı durumda, kronik obstrüktif akciğer hastalarında RESPIMAT inhalatör ile uygulanan 5 mikrogramlık dozdan 10 dakika sonra ölçüldüğünde, tiotropium bromür doruk plazma düzeyleri 10.5-11.7 pikogram/mL idi ve çok-kompartmanlı bir model içinde, hızla azaldı. Kararlı durum çukur plazma konsantrasyonları 1.49-1.68 pikogram/mL idi. Akciğerdeki lokal konsantrasyonlar bilinmemektedir, ancak uygulama şekli, akciğerlerde önemli oranda daha yüksek konsantrasyonların varlığını düşündürmektedir. Sıçanlarda yapılan çalışmalarda, tiotropium bromürün kan beyin bariyerini önemli bir düzeyde geçmediği gösterilmiştir. Biyotransformasyon:Biyotransformasyona uğrama derecesi küçüktür. Bu durum, sağlıklı genç gönüllülerde bir doz intravenöz uygulamadan sonra %74 oranında değişmemiş maddenin idrarla atılmasıyla belirlenmiştir. Ester yapısındaki tiotropium bromür, enzimatik olmayan bir yol ile parçalanarak, bir alkol olan N-metilskopin ve ditiyenilglikolik aside parçalanır; bu maddelerin her ikisi de muskarinik reseptörlere bağlanmazlar. İnsan karaciğer mikrozomları ve insan hepatositleri ile yapılan in vitrodeneyler bir miktar ilacın (intravenöz uygulama sonrasında dozun %20'sinden azı), sitokrom P450'ye bağımlı oksidasyon ve daha sonrasında glutatyon konjügasyonu yoluyla, çeşitli Faz II metabolitlerine metabolize olduğunu düşündürmektedir. Bu enzimatik yol CYP450 2D6 (ve 3A4) inhibitörleri olan kinidin, ketokonazol ve gestoden ile inhibe edilebilir. Böylelikle CYP450 2D6 ve 3A4, dozun küçük bir bölümünün eliminasyonundan sorumlu metabolik yolda yer almaktadırlar. Tiotropium bromür, supra-terapötik konsantrasyonlarda bile, insan karaciğer mikrozomlarındaki sitokrom P450 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 ya da 3A'yı inhibe etmez.Eliminasyon:İnhalasyon sonrasında tiotropiumun terminal eliminasyon yarı-ömrü 5 ve 6 gün arasındadır. Sağlıklı genç gönüllülerde intravenöz uygulanan dozdan sonra total klerens 880 mL/dk, bireyler arası değişkenlik ise %22 oranındaydı. İntravenöz uygulanan tiotropium bromür, idrar yoluyla esas olarak değişmemiş halde atılır (%74). Çözeltinin inhalasyonundan sonra üriner ekskresyon dozun %20.1-29.4'üdür, geri kalanı barsaklarda esas olarak emilmemiş ilaç halinde bulunur ve feçes ile elimine edilir. Tiotropium bromürün renal klerensi, kreatinin klerensini geçer; bu durum idrara sekrete olduğunu işaret etmektedir. KOAH'lı kişiler tarafından, günde bir kez kronik inhalasyondan sonra, farmakokinetik kararlı duruma 7. günde ulaşılmış ve daha sonrasında herhangi bir birikim görülmemiştir. Doğrusallık/Doğrusal olmayan durum:Tiotropium bromür, intravenöz uygulama, kuru toz inhalasyonu ve çözelti inhalasyonu sonrasında terapötik aralıkta doğrusal farmakokinetik gösterir. Hastalardaki karakteristik özelliklerYaş:Pediyatrik popülasyon:SPIRIVA'nın pediyatrik hastalardaki güvenlilik ve etkinliğibelirlenmemiştir. Geriyatrik popülasyon:Esas olarak böbrekler yoluyla atılan bütün ilaçlardan beklendiği gibi, ileri yaş tiotropium bromürün renal klerensinde bir azalma ile ilişkili idi (58 yaşından küçük KOAH hastalarında 326 mL/dk'dan, 70 yaşından büyük KOAH hastalarında 163 mL/dk'ya); bu durum böbrek fonksiyonunun azalmasıyla açıklanabilir. İnhalasyonu izleyerek idrarda tiotropium bromür ekskresyonu %14'ten (sağlıklı genç gönüllüler), %7 civarına (KOAH'ı olan kişiler) azaldı; ancak KOAH'ı olan kişiler arasında plazma konsantrasyonları, kişiler-arası ve kişi-içi değişkenliğe göre karşılaştırıldığında, ilerleyen yaş ile birlikte anlamlı bir değişiklik göstermedi (kuru toz inhalasyonu sonrasında EAAo-4saat değerinde %43 artış).Böbrek yetmezliği:Esas olarak renal ekskresyon ile atılan bütün diğer ilaçlar ile ortaklaşa özellik olarak, böbrek bozukluğu, hem intravenöz infüzyon, hem de kuru toz inhalasyonlarından sonra plazma ilaç konsantrasyonlarında yükselme ve renal ilaç klerensinde azalma ile ilişkiliydi. Yaşlı hastalarda sıklıkla görülen hafif böbrek bozukluğu (CLcR 50-80 mL/dk), tiotropium bromür plazma konsantrasyonlarını hafifçe artırdı (intravenöz infüzyon sonrasında EAAo-4saat değerinde %39 artış). Orta ile şiddetli böbrek bozukluğu (CLCR <50 mL/dk) olan KOAH hastalarında intravenöz tiotropium bromür uygulaması, plazma konsantrasyonlarının iki katına çıkmasıyla sonuçlandı (EAA0-4saat değerinde %82 artış) ve bu durum kuru toz inhalasyonundan sonraki plazma konsantrasyonları ile doğrulandı. Karaciğer yetmezliği:Karaciğer yetersizliğinin tiotropium bromür farmakokinetiği üzerinde önemli bir etkisinin olması beklenmemektedir. Tiotropium bromür büyük çoğunlukla renal eliminasyon yoluyla (sağlıklı genç gönüllülerde %74) ve enzimatik olmayan basit ester parçalanmasıyla farmakolojik olarak inaktif ürünlere ayrılarak vücuttan temizlenmektedir. 5.3 Klinik öncesi güvenlilik verileriFareler, sıçanlar ve köpeklerdeki akut inhalasyon ve oral toksisite düşüktü; bu nedenle insanlarda akut ilaç dozaşımından dolayı toksik etkiler pek mümkün değildir. Tek doz güvenlilik farmakolojisi çalışmalarında, midriyazis, kalp hızında artış ve gastro-intestinal geçiş zamanında uzama dahil olmak üzere, bir antikolinerjik ilaçtan beklenen etkiler görülmüştür.Sıçanlar, fareler ve köpeklerdeki tekrarlı doz çalışmalarının yan etkileri, tiotropium bromürün midriyazis, kalp hızında artış, konstipasyon, kilo almada azalma, tükrük ve lakrimal bez sekresyonlarında azalma gibi antikolinerjik özelliklerine bağlıydı. Kaydedilen diğer önemli değişiklikler ise şunlardı; sıçanlarda rinit ve nazal kavite ile larinkste epitelyal değişiklikler ile kendisini gösteren, üst solunum yollarında hafif irritasyon; erkek sıçanların mesanelerinde proteinimsi birikmeler ve litiyazis ile birlikte prostatit; sıçanlarda akciğer ağırlığında artma ve köpeklerde kalp ağırlığında azalma. Tavşanlar ve sıçanlardaki üreme çalışmalarında gebelik, embriyo/fetal gelişim, doğum ve doğum sonrası gelişime yönelik zararlı etkiler, yalnızca anne için toksik olan doz düzeylerinde gösterilebildi. Bir in vivoin vitroin vitroin vivokoşullarda kromozomal harabiyete, ya da primer DNA hasarına neden olmadı.6. FARMASÖTIK ÖZELLIKLER6.1 Yardımcı maddelerin listesiBenzalkonyum klorür Disodyum edetat Saf supH ayarlaması için hidroklorik asit 6.2 GeçimsizliklerGeçerli değil.6.3 Raf ömrüSatışa sunulmak üzere ambalajlanmış SPIRIVA RESPIMAT'ın raf ömrü 36 aydır.6.4 Saklamaya yönelik özel tedbirler25o C'nin altında oda sıcaklığında saklanmalıdır. Dondurulmamalıdır.6.5 Ambalajın niteliği ve içeriğiAluminyum silindir içinde plastik kap; entegre kapatma halkası ve kurcalamaya karşı koruyucu mühür ile birlikte plastik kapak.Her SPIRIVA RESPIMAT inhalatörü 30 doz (60 püskürtme) içerir. Her püskürtmede 2.5 mikrogram tiotropium salıverilmektedir. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürün ya da atık materyaller Tıbbi Atıkların Kontrolü ve Ambalaj ve Ambalaj Atıklarının Kontrolü yönetmeliklerine uygun olarak imha edilmelidir.İnhalatörünüzün bakımıAğızlık parçası ve içinde bulunan metal bölümü, en az haftada bir kez, nemli bir bez veya ıslak kağıt mendil ile temizleyiniz. Ağızlık parçasında herhangi bir hafif renk değişimi, SPIRIVA RESPIMAT inhalatörün performansını etkilemez. Gerekli olduğunda, SPIRIVA RESPIMAT inhalatörün dış tarafını nemli bir bezle silebilirsiniz. 7. RUHSAT SAHİBİBoehringer Ingelheim İlaç Ticaret A.Ş.Eski Büyükdere Cad., USO Center No: 61, K: 13-14 34398 - Maslak, İSTANBUL Tel: (0 212) 329 1100 Faks: (0 212) 329 1101 8. RUHSAT NUMARASI128/089. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 15.06.2009 Ruhsat yenileme tarihi:10. KÜB'ÜN YENİLENME TARİHİMart 2010 |
İlaç BilgileriSpiriva Respimat 2.5 mcg/püskürtme inhalasyon çözeltisiEtken Maddesi: Tiotropium Bromur Monohidrat Atc Kodu: R03BB04 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.