Mabthera Roche 500 mg/50 ml i.v. infüzyon için konsantre solüsyon içeren flakon Kısa Ürün BilgisiAntineoplastik ve İmmünomodülatör Ajanlar » Antineoplastik İlaçlar (Kanser İlaçları) » Diğer Kanser İlaçları » Monoklonal Antikorlar » Rituksimab KISA ÜRÜN BİLGİSİ 1. BEŞERİ TIBBİ ÜRÜNÜN ADIMABTHERA 500 mg/50 mL i.v. infüzyon için konsantre solüsyon içeren flakon2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:Her bir flakon 50 mL'lik çözelti içinde 500 mg rituksimab içerir.Çözeltinin her mL'sinde 10 mg rituksimab bulunur. Rituksimab insan IgG1 sabit bölgeleri ve sırasıyla değişken mürin hafif zincir ve ağır zincir içeren bir glikozile immünoglobulin sunan, genetik mühendisliği ile üretilen kimerik fare/insan monoklonal antikorudur. Antikor, memelilerin (Çin hamster over hücresi) hücre süspansiyon kültüründe üretilir ve viral aktivasyon ve çıkarma prosedürlerini içerecek şekilde afinite kromotografisi ve iyon değiştirme ile saflaştırılır. Yardımcı maddeler: Sodyum sitrat dihidrat: 7.35 mg/mL Sodyum klorür : 9.0 mg/ mL Sodyum hidroksit : pH ayarı için y.m. Yardımcı maddeler için bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMİnfüzyon için konsantre solüsyon içeren flakon.Çözelti berrak, renksiz bir sıvıdır. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarHodgkin-dışı Lenfoma (NHL)MABTHERA'nın, - Nükseden veya kemorezistan CD20 pozitif foliküler lenfoma, difüz büyük B hücreli lenfoma, mantle hücreli lenfoma tanılı hastaların tedavisinde - Daha önce tedavi edilmemiş evre III-IV foliküler lenfomalı hastalarda kemoterapi ile kombinasyon halinde - İndüksiyon tedavisine yanıt veren foliküler lenfomalı hastalarda idame tedavisi olarak (en fazla 2 yıl süreyle ve en fazla 8 siklus olarak) - CD20 pozitif, difüz büyük B hücreli lenfomada CHOP kemoterapi şemasına ek olarak kullanımı endikedir. Kronik Lenfositik Lösemi (KLL)Birinci basamak:MABTHERA, tedavi endikasyonu olan, performans durumu iyi olan (ECOG 0-1), 17 p delesyonu bulunmayan KLL hastalarının birinci basamak tedavisinde fludarabin ve siklofosfamid ile kombine olarak kullanılır. Relaps/Refrakter (Nükseden/Dirençli):Relaps/refrakter, tedavi endikasyonu olan, daha önce fludarabin ve alkilleyici ajanlarla tedavi sonrası progresyon gelişmiş, 65 yaş ve altı, ECOG performans statüsü 0-1 olan, 17p delesyonu bulunmayan, kronik lenfositer lösemi hastalarında, fludarabin ve siklofosfamid ile kombine olarak 4 kür rituksimab kullanılması uygundur. İlk kürde 375 mg/m2, diğer kürlerde 500 mg/m2 kullanılabilir; 4 kür sonunda en az kısmi yanıt alınması halinde, 2 kür daha verilerek tedavi 6 küre tamamlanabilir. Romatoid Artrit (RA)MABTHERA metotreksat ile kombinasyon halinde aktif romatoid artriti bulunan ve bir veya daha fazla tümör nekrozis faktör (TNF) inhibitörü tedavilerine karşın hastalığı aktif kalan (DAS 28 skoru >5.1) veya hastalığı aktif olmasına karşın (DAS 28 skoru >5.1) TNF inhibitörü başlanması uygun olmayan/görülmeyen veya TNF inhibitörlerine karşı intoleransı olan hastalarda endikedir. MABTHERA, metotreksat ile kombinasyon halinde verildiğinde, röntgen ile ölçülen eklem hasarının ilerlemesini azaltmış, fiziksel fonksiyonları iyileştirmiş ve majör klinik yanıtın başlatılmasını sağlamıştır. 4.2 Pozoloji ve uygulama şekliPozoloji/ uygulama sıklığı ve süresi:Standart dozDüşük-evreli veya foliküler Hodgkin-dışı lenfoma:Her MABTHERA infüzyonundan önce, analjezik/antipiretik (örn. parasetamol) ve antihistaminik ilaçtan (örn. difenhidramin) oluşan bir premedikasyon her zaman yapılmalıdır. MABTHERA steroid içeren kemoterapiyle kombinasyon halinde verilmiyorsa, glukokortikoidlerle premedikasyon da ayrıca göz önünde bulundurulmalıdır. Başlangıç tedavisi:Erişkin hastalarda monoterapi olarak uygulanan MABTHERA için önerilen doz, 4 hafta süreyle haftada bir kere i.v. infüzyon yoluyla (bkz. İlk infüzyon ve izleyen infüzyonlar) verilen 375 mg/m2 vücut yüzey alanıdır. Herhangi bir kemoterapi ile kombinasyon halinde önerilen MABTHERA dozu, her siklüste 375 mg/m2 vücut yüzey alanı olacak şekilde toplam: - R-CVP ile birlikte 8 siklüs (21 gün/siklüs) - R-MCP ile birlikte 8 siklüs (28 gün/siklüs) - R-CHOP ile birlikte 8 siklüs (21 gün/siklüs); 4 siklüs sonunda tam remisyon elde edildiyse 6 siklüs kullanılır - R-CHVP-İnterferon ile 6 siklüs (21 gün/siklüs) Eğer uygulanabilirse, MABTHERA, kemoterapinin glukokortikoid bileşeninin i.v. yolla verilmesinden sonra her bir kemoterapi siklusunun ilk gününde uygulanmalıdır. Nüksten sonra tekrarlanan tedavi:Başlangıçta MABTHERA'ya yanıt veren hastalar dört hafta süreyle haftada bir kere i.v. infüzyon yoluyla uygulanan 375 mg/m2 vücut yüzey alanı dozunda MABTHERA ile yeniden tedavi edilmişlerdir (bkz. bölüm 5.1 Farmakodinamik özellikler; Tekrarlanan tedavi, haftada bir uygulama, toplam 4 doz). İdame tedavisi:İndüksiyon tedavisine yanıt vermiş olan hastalar, hastalık ilerleyene kadar ya da maksimum iki yıl süresince, üç ayda bir 375 mg/m2 vücut yüzey alanı dozunda verilen MABTHERA ile (en çok 8 siklus olarak) idame tedavisi görebilir. Difüz büyük B hücreli Hodgkin-dışı lenfoma:Her MABTHERA infüzyonundan önce, analjezik/antipiretik (örn. parasetamol) ve antihistaminik ilaçtan (örn. difenhidramin) oluşan bir premedikasyon her zaman yapılmalıdır. MABTHERA steroid içeren kemoterapiyle kombinasyon halinde verilmiyorsa, glukokortikoidlerle premedikasyon da ayrıca göz önünde bulundurulmalıdır. MABTHERA, CHOP (siklofosfamid, doksorubisin, prednizon ve vinkristin) kemoterapisi ile kombinasyon şeklinde kullanılmalıdır. Önerilen MABTHERA dozu, her kemoterapi siklusunun 1. gününde, 8 siklus için, CHOP rejiminin glukokortikoid bileşeni i.v. yoldan uygulandıktan sonra verilmek üzere, 375 mg/m vücut yüzey alanıdır. CHOP rejiminin öteki bileşenleri, MABTHERA uygulandıktan sonra verilmelidir (bkz. ilk infüzyon ve izleyen infüzyonlar). Kronik Lenfositik Lösemi (KLL):Her MABTHERA infüzyonundan önce, analjezik/antipiretik (örn. parasetamol) ve antihistaminik ilaçtan (örn. difenhidramin) oluşan bir premedikasyon her zaman yapılmalıdır. MABTHERA steroid içeren kemoterapiyle kombinasyon halinde verilmiyorsa, glukokortikoidlerle premedikasyon da ayrıca göz önünde bulundurulmalıdır. KLL hastaları için, tümör lizis sendromu (TLS) riskini azaltmak amacıyla tedavi başlangıcından 48 saat öncesinde yeterli hidrasyon ve ürikostatik uygulanmaya başlanması ile profilaksi önerilmektedir. Lenfosit sayıları >25 x109/L olan tüm KLL hastalarında akut infüzyon reaksiyonları ve/veya sitokin salıverilme sendromunun oranını ve ciddiyetini azaltmak amacıyla, MABTHERA infüzyonundan kısa bir süre önce 100 mg IV prednizon/prednizolon uygulanması önerilmektedir. Daha önce tedavi edilmemiş ve relaps/ refrakter hastalar için kemoterapiyle kombinasyon halinde önerilen MABTHERA dozu, toplam 6 kür olmak üzere, ilk tedavi kürünün 0. gününde uygulanan 375 mg/m vücut yüzey alanı ve sonrasındaki her kürün 1. gününde uygulanan 500 mg/m2 vücut yüzey alanıdır (bkz. bölüm 5.1 Farmakodinamik özellikler). Kemoterapi, MABTHERA infüzyonundan sonra verilmelidir. ilk infüzyonÖnerilen ilk infüzyon hızı 50 mg/saattir; sonra her 30 dakikada bir 50 mg/saatlik artışlarla hız maksimum 400 mg/saate çıkarılabilir. izleyen infüzyonlarSonraki MABTHERA infüzyonlarına 100 mg/saat hızıyla başlanabilir ve daha sonra her 30 dakikada bir 100 mg/saatlik artışlarla oran maksimum 400 mg/saate çıkarılabilir. Tedavi sırasında doz ayarlamalarıMABTHERA dozunda herhangi bir azaltım önerilmemektedir. MABTHERA, kemoterapi ile kombine halde uygulandığında, kemoterapötik ilaçlar için geçerli standart doz azaltımları yapılmalıdır. Romatoid artrit (RA)Her MABTHERA infüzyonundan önce, analjezik/antipiretik (örn. parasetamol) ve antihistaminik ilaçtan (örn. difenhidramin) oluşan bir premedikasyon her zaman yapılmalıdır.İnfüzyonla ilişkili reaksiyonların sıklığını ve ciddiyetini azaltmak için her MABTHERA infüzyonundan 30 dakika önce tamamlanacak şekilde 100 mg IV metilprednizolon uygulanmalıdır (bkz. bölüm 4.4 Özel kullanım uyarıları ve önlemleri). Bir MABTHERA kürü 2 adet 1000 mg'lık i.v. infüzyonu içermektedir. MABTHERA'nın bir kür için önerilen dozu ilk 1000 mg'lık i.v. infüzyondan iki hafta sonra ikinci bir 1000 mg'lık i.v. infüzyon şeklindedir. İlave kür ihtiyacı, önceki kürün ardından 24 hafta geçtikten sonra tedavi sonrası kalan hastalık aktivitesine veya hastalık aktivitesinin DAS28-ESR 2.6 üzerinde bir düzeye çıkmasına (remisyona kadar tedavi) dayanılarak yeniden değerlendirilmelidir (bkz. bölüm 5.1 Farmakodinamik özellikler). Hastalar 16 haftadan daha önce olmamak şartıyla ek (ilave) kür alabilir. Her kürün ilk infüzyonuÖnerilen ilk infüzyon hızı 50 mg/saattir; sonra her 30 dakikada bir 50 mg/saatlik artışlarla hız maksimum 400 mg/saate çıkarılabilir. Her kürün ikinci infüzyonuSonraki MABTHERA infüzyonlarına 100 mg/saat hızıyla başlanabilir ve daha sonra her 30 dakikada bir 100 mg/saatlik artışlarla oran maksimum 400 mg/saate çıkarılabilir. Uygulama şekli:MABTHERA sadece ona ayrılmış damar yoluyla, tek başına intravenöz infüzyonla, tüm resüsitasyon olanaklarının eksiksiz olarak hazır bulunduğu bir ortamda ve uzman bir hekimin yakın gözetimi altında uygulanmalıdır.Hazırlanmış infüzyon solüsyonlarını i.v. push veya bolus yoluyla uygulamayınız(bkz. bölüm 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler).Özel popülasyonlara ilişkin ek bilgiler:Böbrek/ Karaciğer yetmezliği:Böbrek/ karaciğer yetmezliği olan hastalarda özel bir kullanım söz konusu değildir.Pediyatrik popülasyon ve adolesanlar:MABTHERA'nın pediyatrik hastalar üzerinde güvenliliği ve etkinliği kanıtlanmamıştır.Geriyatrik popülasyon:Yaşlı hastalarda (> 65 yaş) herhangi bir doz ayarlaması gerekli değildir.4.3 KontrendikasyonlarMABTHERA'nın Hodgkin-dışı lenfoma ve kronik lenfositik lösemide kullanımda kontrendike olduğu durumlar: Etkin maddeye veya ürünün içindeki herhangi bir maddeye veya mürin proteinlerine aşırı duyarlılık olması durumunda Aktif, ciddi enfeksiyonlarda (bkz. bölüm 4.4 Özel kullanım uyarıları ve önlemleri) İmmün sistemi ciddi şekilde baskılanmış hastalarda MABTHERA'nın Romatoid artritte kullanımda kontrendike olduğu durumlar: Etkin maddeye veya ürünün içindeki herhangi bir maddeye veya mürin proteinlerine aşırı duyarlılık olması durumunda Aktif, ciddi enfeksiyonlarda (bkz. bölüm 4.4 Özel kullanım uyarıları ve önlemleri) İmmün sistemi ciddi şekilde baskılanmış hastalarda Ciddi kalp yetmezliğinde (New York Kalp Birliği Sınıf IV) veya ciddi, kontrol edilemeyen kalp hastalığında 4.4 Özel kullanım uyarıları ve önlemleriUYARI: ÖLÜMCÜL İNFÜZYON REAKSİYONLARI, TÜMÖR LİZİS SENDROMU (TLS), CİDDİ MUKOKÜTANÖZ REAKSİYONLAR VE PROGRESİF MULTİFOKAL LÖKOENSEFALOPATİ (PML)İnfüzyon ReaksiyonlarıMABTHERA infüzyonları ciddi, ölümcül olabilen infüzyon reaksiyonları ile sonuçlanabilir. MABTHERA infüzyonu sonrasındaki 24 saat içinde ölüm vakaları görülmüştür. Ölümcül infüzyon reaksiyonlarının yaklaşık % 80'i ilk infüzyonla ilişkili olarak görülmüştür. İnfüzyon sırasında hastaları dikkatlice gözlemleyiniz. Evre 3 veya 4 infüzyon reaksiyonları gelişirse MABTHERA infüzyonunu kesiniz ve tıbbi tedavi uygulayınız (bkz. bölüm 4.4 Özel kullanım uyarıları ve önlemleri, 4.8 İstenmeyen etkiler).Tümör Lizis Sendromu (TLS)Hodgkin dışı lenfoma (NHL) hastalarının MABTHERA tedavisi sonrasında, TLS sonucu, diyaliz gerektiren ve ölümle sonuçlanan akut renal yetmezlik görülebilir.Ciddi Mukokütanöz ReaksiyonlarMABTHERA kullanan hastalarda ölümcül olabilen, ciddi mukokütanöz reaksiyonlar meydana gelebilir (bkz. bölüm 4.4 Özel kullanım uyarıları ve önlemleri, 4.8 İstenmeyen etkiler).Progresif Multifokal Lökoensefalopati (PML)MABTHERA kullanan hastalarda PML ile sonuçlanan JC virüs aktivasyonu ve ölüm meydana gelebilir.Hodgkin-dışı lenfoma ve kronik lenfositik lösemi hastalarıİnfüzyonla ilgili reaksiyonlar:MABTHERA'nın, infüzyonla ilişkili reaksiyonları sitokinlerin ve/veya diğer kimyasal mediyatörlerin salıverilmesine bağlı olabilir. İnfüzyonla ilişkili şiddetli reaksiyonlar, aşırı duyarlılık reaksiyonlarından veya sitokin salınma sendromundan klinik olarak ayırt edilemeyebilir. Pazarlama sonrası kullanım sırasında ölümle sonuçlanan şiddetli infüzyonla ilişkili vakalar bildirilmiştir. Sıklıkla ilk MABTHERA infüzyonun başlamasından 30 dakika - 2 saat sonra ortaya çıkan şiddetli infüzyonla ilişkili reaksiyonlar, pulmoner olaylarhızlı tümör lizisitümör lizis sendromu (TLS)belirtileri de görülmüştür ( bkz. bölüm 4.8 İstenmeyen etkiler).İnfüzyon reaksiyonu semptomları, genellikle infüzyonun kesilmesiyle geriler. Difenhidramin ve asetaminofenle infüzyon ile ilgili semptomların tedavisi tavsiye edilir. Bronkodilatörler ya da i.v salin çözeltisi ile ilave tedavi endike olabilir. Çoğu vakada infüzyona, semptomlar tamamen ortadan kalktığında hızı %50 azaltılarak (örneğin, 100 mg/saatten 50 mg/saate) devam edilebilir. Hayatı tehdit etmeyen infüzyon ile ilgili reaksiyon görülen çoğu hasta, MABTHERA tedavisini tam olarak tamamlayabilmiştir. Belirti ve semptomların tamamen ortadan kalkmasından sonra yapılan tedaviler, seyrek olarak tekrarlayan ciddi infüzyon ile ilgili reaksiyonlarla sonuçlanmıştır. Anafilaktik ve diğer hipersensitivite reaksiyonları, hastalara proteinlerin intravenöz uygulamasını takiben rapor edilmiştir. MABTHERA'ya karşı hipersensitivite reaksiyonlarında derhal kullanım için epinefrin, antihistaminikler ve glukokortikoidler mevcut olmalıdır. KLL ve mantle hücreli lenfoma hastaları gibi, dolaşımda yüksek sayıda malign hücresi (>25 x 109/L) ya da yüksek tümör yükü olan hastalarda özellikle ciddi infüzyon ile ilgili reaksiyon görülme riski yüksek olabilir. Bu hastalar ancak aşırı dikkatle tedavi edilmelidir, ilk infüzyonun başından sonuna kadar çok yakından gözlemlenmelidir. Bu hastalarda, ilk kür sırasında ve lenfosit sayısının hala >25 x 109/L olduğu takip eden kürlerde ilk infüzyon hızının azaltılması veya iki güne bölünerek verilmesi göz önünde bulundurulmalıdır. Pulmoner vakalar:Pulmoner vakalar hipoksi, akciğer infiltrasyonu ve akut solunum yetmezliğini içermektedir. Bu vakaların bir kısmında öncesinde şiddetli bronkospazm ve dispne görülmüştür. Bazı vakalarda, zaman içinde semptomlar daha da ağırlaşırken diğerlerinde başlangıçta görülen iyileşme daha sonra yerini klinik kötüleşmeye bırakmıştır. Bu nedenle, pulmoner vakalar ve diğer şiddetli infüzyonla ilişkili semptomları bulunan hastalar, semptomları tamamen ortadan kalkana kadar yakından takip edilmelidir. Geçmişte pulmoner yetmezliği olan hastalar veya pulmoner tümör infiltrasyonu bulunan hastalar daha kötü sonuç verme riski altında olabilirler ve bu hastalar daha dikkatli tedavi edilmelidirler. Akut solunum yetmezliğine, akciğer grafisinde görülen pulmoner dokular arası infiltrasyon ya da ödem gibi olaylar eşlik edebilir. Sendrom, genellikle ilk infüzyonun başlatılmasından sonraki bir ya da iki saat içinde kendini gösterir. Ciddi pulmoner olaylar görülen hastalarda infüzyon derhal kesilmeli (bkz. bölüm 2.2 Pozoloji ve uygulama şekli) ve agresif semptomatik tedavi başlanmalıdır. Hızlı tümör lizisi:MABTHERA, benign ve malign CD20 pozitif hücrelerin hızlı lizisine aracılık etmektedir. Yüksek sayıda sirküle eden malign lenfosite sahip hastalarda ilk MABTHERA infüzyonundan 1 ila 2 saat sonra TLS ile ilişkili belirti ve semptomlar (örneğin hiperürisemi, hiperkalemi, hipokalsemi, hiperfosfatemi, akut böbrek yetmezliği, yüksek LDH) bildirilmiştir. Hızlı tümör lizisi geliştirme riski altındaki hastalarda TLS profilaksisi gündeme getirilmelidir (örneğin, yüksek tümör yükü ya da KLL ve Mantle hücreli lenfoma olan hastalar gibi dolaşımda yüksek sayıda malign hücresi olan (>25 x 109/L) hastalar). Bu hastalar yakından takip edilmeli ve uygun laboratuvar gözlemi uygulanmalıdır. Hızlı tümör lizisi ile tutarlı belirti ve semptom geliştiren hastalar için uygun tıbbi tedavi sağlanmalıdır. Tedavinin sağlanması, belirti ve semptomların tamamen ortadan kalkmasından sonra, sınırlı sayıdaki vakada profilaktik TLS tedavisi ile birlikte takip eden MABTHERA terapisi de uygulanır. Ciddi mukokütanöz reaksiyonlar:MABTHERA tedavisi sırasında ölümle sonuçlanabilen mukokutanöz reaksiyonlar bildirilmiştir. Bu vakalar paraneoplastik pemfigus, Stevens-Johnson sendromu, liken dermatiti, vezikülobüllöz dermatit ve toksik epidermal nekrolizi içermektedir. Bildirilen olaylarda reaksiyonun başlangıcı MABTHERA uygulamasının 1 ila 13 hafta sonrasında olmuştur. Şiddetli mukokutanöz reaksiyonlarla karşılaşılan hastalarda, tedaviye son verilmeli ve hastalar gecikmeden tıbbi kontrolden geçirilmelidir. Deri biyopsisi, değişik mukokutanöz reaksiyonları ayırt etmeyi ve uygun tedaviye ulaşmayı sağlar. MABTHERA'nın mukokutanöz reaksiyonları göstermiş hastalarda tekrar kullanımı ile ilgili güvenliği tespit edilmemiştir. Kardiyovasküler:MABTHERA infüzyonu sırasında hipotansiyon oluşabileceğinden MABTHERA infüzyonundan 12 saat öncesinden başlanarak ve infüzyon sırasında antihipertansif ilaç kullanılmamasına dikkat edilmelidir. MABTHERA ile tedavi edilen hastalarda, anjina pektoris veya atriyal flatter ve fibrilasyon gibi kardiyak aritmiler, kalp yetmezliği ve/veya miyokardiyal infarktüs meydana gelmiştir.Bu nedenle kardiyak hastalık hikayesi olan hastalar infüzyon sırasında ve sonrasında dikkatle izlenmelidir. Kan sayımının izlenmesi:Monoterapi şeklinde uygulanan MABTHERA miyelosupresif olmadığı halde, nötrofil sayısı <1.5 x 109/L ve/veya trombosit sayısı <75 x 109/L olan hastalar MABTHERA ile tedavi edilirken dikkatli olunmalıdır, çünkü bu tip hastalarla ilgili klinik deneyimler sınırlıdır. MABTHERA otolog kemik iliği transplantasyonu olanlarda ve miyelotoksisite indüklenmediği halde kemik iliği fonksiyonlarında azalma olan diğer risk gruplarında kullanılmıştır. MABTHERA monoterapisi sırasında düzenli olarak kan hücrelerinin sayımına (trombosit sayısı dahil) dikkat edilmelidir. MABTHERA, CHOP veya CVP kemoterapisi ile kombinasyon şeklinde verildiğinde, rutin tıbbi uygulamalar doğrultusunda tam kan sayımları yapılmalıdır. Enfeksiyonlar:MABTHERA tedavisi sırasında ölümcül, ciddi enfeksiyonlar meydana gelebilir (bkz. bölüm 4.8 İstenmeyen etkiler). MABTHERA tedavisi, aktif, ciddi enfeksiyonu (ör. tüberküloz, sepsis ve fırsatçı enfeksiyonlar, bkz. bölüm 4.3 Kontrendikasyonlar) bulunan hastalarda başlatılmamalıdır. Doktorlar, tekrarlayan veya kronik enfeksiyon öyküsü bulunan veya hastayı ciddi enfeksiyonlara eğilimli hale getirecek şekilde altta yatan koşullara sahip hastalarda kullanırken dikkatli olmalıdırlar (bkz. bölüm 4.8 İstenmeyen etkiler). Hepatit B Enfeksiyonları:Fulminan hepatit raporları da dahil olmak üzere, bazı vakalarda ölümcül olabilen hepatit B reaktivasyonu vakaları rapor edilmiştir. Bu vakaların büyük çoğunluğu, sitotoksik kemoterapiye maruz kalmıştır. Raporlarda hem temelde yatan hastalık durumu, hem de sitotoksik kemoterapi birbirine karıştırılmaktadır. Relaps/refrakter KLL hastalarında yapılan bir çalışmadan elde edilen kısıtlı verilere göre, MABTHERA tedavisi primer hepatit B enfeksiyonlarının sonucunu da kötüleştirebilmektedir. MABTHERA tedavisi başlatılmadan önce, yüksek risk taşıyan hastalarda hepatit B virüs (HBV) taraması göz önünde bulundurulmalıdır. Hepatit B taşıyıcısı olanlar ve geçmişinde hepatit B öyküsü bulunan hastalar, MABTHERA tedavisi sırasında ve tedaviden aylar sonrasına (yedi ay) kadar aktif HBV enfeksiyonunun klinik ve laboratuvar belirtilerine karşı, dikkatlice izlenmelidirler. MABTHERA'nın NHL'de kullanımı sırasında, progresif multifokal lökoensefalopati (PML) vakaları bildirilmiştir (bkz. bölüm 4.8 İstenmeyen etkiler). Hastaların büyük çoğunluğu MABTHERA'yı kemoterapi ile birlikte veya hematopoetik kök hücre transplantasyonunun bir parçası olarak almışlardır. NHL hastalarını tedavi eden doktorlar, nörolojik semptom bildiren hastaların ayırıcı tanısı sırasında PML'yi göz önünde bulundurmalı ve klinik gereklilik nedeniyle bir nörolog tarafından konsültasyon da dikkate alınmalıdır. PML (Progresif Multifokal Lökoensefalopati) riski nedeniyle tedaviye devam edecek hastalardan yılda bir Nöroloji konsültasyonu istenmesi gerekir. immünizasyon:MABTHERA tedavisini takiben canlı viral aşılarla yapılan immünizasyonun güvenliliği üzerinde çalışma yapılmamıştır ve canlı virüs aşılarıyla aşılama yapılması önerilmemektedir. MABTHERA ile tedavi edilen hastalar canlı olmayan aşılarla aşılanabilirler. Ancak canlı olmayan aşılarla yanıt oranları düşebilir. Randomize olmayan bir çalışmada MABTHERA monoterapisi alan relaps, düşük evreli NHL hastaları ile sağlıklı, tedavi görmemiş kontrol vakaları karşılaştırıldığında tetanoz hatırlatıcı antijenine (% 16'ya karşılık % 81) ve Keyhole Limpet Haemocyanin (KLH) neoantijenine (antikor titrelerinde >2 katı artışa göre değerlendirildiğinde % 4'e karşılık % 69) düşük oranda yanıt gerçekleşmiştir. Bir grup antijene karşı (Streptokokus pnömoni, influenza A, kabakulak, kızamıkçık, suçiçeği) ortalama tedavi öncesi antikor titreleri MABTHERA tedavisi sonrasında en az 6 ay süreyle korunmuştur. Gastrointestinal reaksiyonlar:Rituksimab kullanan lenfomalı hastalarda GİS obstrüksiyonu veya perforasyonu yönüyle dikkat edilmelidir. Romatoid artrit hastalarıMABTHERA'nın, romatoid artrit ve ANCA ilişki vaskülit dışında diğer otoimmün hastalıkların tedavisinde etkinliği ve güvenliliği araştırılmamıştır.infüzyonla ilgili reaksiyonlar (İİR):MABTHERA, sitokinlerin ve/veya diğer kimyasal mediyatörlerin salıverilmesine bağlı olabilen infüzyonla ilgili reaksiyonlarla ilişkilendirilmiştir. Her MABTHERA infüzyonundan önce, analjezik/antipiretik (örn. parasetamol) ve antihistaminik ilaçtan oluşan bir premedikasyon her zaman yapılmalıdır. Romatoid artrit hastaları için, her MABTHERA infüzyonundan önce, infüzyonla ilgili reaksiyonların sıklığını ve ciddiyetini azaltması için glukokortikoid ile premedikasyon uygulanmalıdır. (bkz. bölüm 4.2 Pozoloji ve uygulama şekli, bölüm 4.8 İstenmeyen etkiler). Klinik çalışmalarda romatoid artrit hastalarında bildirilen infüzyona bağlı olguların çoğu hafif ve orta ciddiyettedir. Pazarlama sonrası dönemde, ölümcül, ciddi infüzyonla ilgili reaksiyonlar bildirilmiştir (bkz bölüm 4.8 Pazarlama sonrası deneyim/ Romatoid artrit). Önceden kardiyak bozukluğu bulunan ve kardiyopulmoner advers olay yaşayan hastaların çok yakından izlenmesi gerekir. En yaygın semptomlar baş ağrısı, kaşıntı, boğazda tahriş, kızarıklık, döküntü, ürtiker, hipertansiyon ve pireksidir. Genel olarak, herhangi bir tedavi kürünün birinci infüzyonunun ardından herhangi bir infüzyon reaksiyonu yaşayan hastaların oranı, ikinci infüzyonun ardından görülene oranla daha yüksektir. Hastalar sonraki MABTHERA infüzyonlarını, başlangıçtaki infüzyona göre daha iyi tolere etmiştir. Hastaların %1'den azı ciddi İİR'ler yaşamıştır, bunların çoğu birinci kürün birinci infüzyonu sırasında bildirilmiştir. Bildirilen reaksiyonlar MABTHERA infüzyonunun hızının azaltılması (yavaşlatılması) ya da kesilmesine ve bir antipiretik, antihistaminik ve seyrek olarak oksijen, i.v. serum fizyolojik veya bronkodilatörün uygulanmasına ve gerektiğinde uygulanan glukokortikoide bağlı olarak genellikle geri dönüşümlüdür. Önceden kalp sorunları bulunan ve önceden kardiyopulmoner advers reaksiyon yaşamış olan hastalar dikkatlice izlenmelidir. İnfüzyonla ilgili reaksiyonun ciddiyetine göre ve gereken müdahaleye göre, MABTHERA kullanımı geçici veya kalıcı olarak bırakılmalıdır. Olguların çoğunda, semptomlar tamamen giderildiğinde, infüzyon hızı %50 oranında (örn. 100 mg/saat'ten 50 mg/saat hızına) azaltılarak infüzyona devam edilebilir. Hastalara intravenöz yolla protein verilmesinden sonra anafilaktik reaksiyonlar veya diğer aşırı duyarlılık reaksiyonları bildirilmiştir. MABTHERA uygulaması sırasındaki allerjik reaksiyon olgularında acil kullanım için, aşırı duyarlılık reaksiyonlarının tedavisine yönelik tedaviler (örn. epinefrin, antihistaminikler ve glukokortikoidler) kullanıma hazır bulundurulmalıdır. Romatoid artrit için üniversite ve eğitim-araştırma hastanesi immünoloji ve romatoloji kliniklerinde hastane koşullarında uygulanmalıdır. Kardiyovasküler:Ciddi veya orta şiddette kalp yetmezliği (NYHA class III) olan hastalarda MABTHERA kullanımıyla ilgili güvenlilik verisi bulunmamaktadır. MABTHERA ile tedavi edilen hastalarda, atriyal fibrilasyon ve flatter ile anjina pektoris gibi önceden mevcut olan iskemik kardiyak koşulların belirti verdiği gözlemlenmiştir. Bu sebeple, MABTHERA tedavisinden önce, bilinen bir kardiyak öyküsü olan ve önceden kardiyopulmoner advers reaksiyon yaşamış olan hastalarda, infüzyon reaksiyonlarından kaynaklanan kardiyovasküler komplikasyonların riski dikkate alınmalı ve hastalar uygulama sırasında dikkatle gözlenmelidir. MABTHERA infüzyonu sırasında hipotansiyon oluşabileceğinden, MABTHERA infüzyonu öncesindeki 12 saatlik süre boyunca herhangi bir antihipertansif ilacın alınmamış olmasına dikkat edilmelidir. Enfeksiyonlar:MABTHERA'nın etki mekanizmasına ve B hücrelerinin normal immün yanıtın sürdürülmesinde önemli bir rol oynamasına bağlı olarak, MABTHERA tedavisini takiben hastalarda enfeksiyon riskinin artabileceği söylenebilir. MABTHERA aktif enfeksiyonu olan hastalara veya şiddetli immün sistem bozukluğu olan (örn. CD4 veya CD8 düzeyleri çok düşük olan) hastalara uygulanmamalıdır. Tekrarlayan veya kronik enfeksiyon öyküsü olan ya da altta yatan sağlık sorunları nedeniyle daha sonra ciddi enfeksiyon eğilimleri olan hastalarda, MABTHERA uygulamalarında dikkatli olmalıdır (bkz. bölüm 4.8 İstenmeyen etkiler). MABTHERA tedavisini takiben enfeksiyon gelişen hastalar derhal değerlendirmeye alınarak uygun şekilde tedavi edilmelidir. MABTHERA tedavisi alan romatoid artrit hastalarında hepatit B reaktivasyon olguları bildirilmiştir. Progresif Multifokal Lökoensefalopati (PML):MABTHERA'nın romatoid artrit dahil otoimmün hastalıkların tedavisi için kullanımını takiben, ölümcül olabilen PML vakaları rapor edilmiştir. Raporlanan vakaların tamamı olmasa da çoğunda altta yatan hastalık, uzun süreli immünsüpresif tedavi veya kemoterapi dahil, PML için potansiyel risk faktörleri mevcuttur. MABTHERA ile tedavi edilmeyen ve otoimmün hastalığı bulunan hastalarda da PML rapor edilmiştir. Otoimmün hastalığı bulunan hastaları tedavi eden doktorlar, nörolojik semptomlar bildiren hastaların ayırıcı tanısında PML'yi göz önünde bulundurmalı ve klinik gereklilik nedeniyle, bir nörolog tarafından konsültasyon yapılması da dikkate alınmalıdır. İmmünizasyon:MABTHERA tedavisini takiben canlı viral aşılar ile immünizasyonun güvenliliği araştırılmamıştır. Bu sebeple, MABTHERA kullanırken veya periferik B hücresi azalmasında canlı viral aşılar ile aşılanma tavsiye edilmemektedir. MABTHERA ile tedavi edilen hastalar canlı olmayan aşılarla aşılanabilirler. Ancak canlı olmayan aşılara yanıt oranları düşebilir. Romatoid artrit hastaları için, doktorlar, MABTHERA tedavisi öncesinde hastanın aşılanma durumunu gözden geçirmeli ve güncel immünizasyon kılavuzlarını takip etmelidirler. Aşılama, ilk MABTHERA uygulamasından en az 4 hafta önce tamamlanmalıdır. Randomize bir çalışmada, MABTHERA ve metotreksat ile tedavi edilen RA hastaları ile yalnızca metotreksat alan hastalar MABTHERA kullanımından en az 6 ay sonra aşılandıklarında, tetanoz hatırlatıcı antijenine karşı karşılaştırılabilir yanıt oranına (% 39'a karşılık % 42), pnömokokkal polisakkarid aşısı (en az 2 pnömokokkal antikor serotipine karşı % 43'e karşılık % 82) ve KLH neoantijenine (% 47'ye karşılık % 93) karşı ise azalmış yanıt oranı göstermişlerdir. MABTHERA tedavisi alırken canlı olmayan aşı olunması gerekirse, bu işlemin, bir sonraki MABTHERA kürüne başlamadan en az 4 hafta önce bitirilmesi gerekmektedir. MABTHERA tekrar tedavisindeki bir yıldan uzun tecrübeye göre, s.pnömoni, influenza, kabakulak, kızamıkçık, suçiçeği ve tetanoz toksoidine karşı pozitif antikor titrelerine sahip hastaların oranı, başlangıç oranları ile genel olarak benzerdir. Metotreksat (MTX) naif Romatoid Artrit popülasyonu: Olumlu bir fayda-risk ilşkisi tespit edilemediğinden, MTX naif hastalarda MABTHERA tedavisi tavsiye edilmemektedir. MABTHERA, flakon başına yaklaşık 55 mg sodyum ihtiva eder. Sodyum miktarı 1 mmol'den (23 mg) fazladır. Bu durum, kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriŞu anda MABTHERA ile olası ilaç etkileşimleri konusunda sınırlı veri vardır.KLL hastalarında, MABTHERA ile kombine kullanımın fludarabin veya siklofosfamidin farmakokinetiği üzerine bir etkisinin olmadığı, bununla birlikte fludarabin veya siklofosfamidin de MABTHERA farmakokinetiği üzerine açıkça bir etkisinin olmadığı görülmüştür. Romatoid artrit hastalarında metotreksatla kombine kullanım MABTHERA'nın farmakokinetiği üzerinde etkili olmamıştır. İnsan anti-mürin antikoru (HAMA) veya insan anti-kimerik antikoru (HACA) titrelerine sahip hastalar tanı veya tedavi amacıyla başka monoklonal antikorlarla tedavi edildiklerinde alerjik reaksiyonlar veya aşırı duyarlılık reaksiyonları geliştirebilirler. Romatoid artrit klinik çalışma programında, 373 hasta bir sonraki tedavilerini diğer DMARD'lar ile almıştır. Bu hastaların 240'ı biyolojik DMARD kullanmıştır, Bu hastalarda MABTHERA tedavisi sırasında ciddi enfeksiyon oranı, (biyolojik DMARD almadan önce) 100 hasta yılı başına 6.1 iken, sonraki tedavi olarak biyolojik DMARD almış hastalarda 100 hasta yılı başına 4.9'dur. Özel popülasyonlara ilişkin ek bilgilerHiçbir etkileşim çalışması yapılmamıştır.Pediyatrik popülasyon:Güvenlilik ve etkinliğe ilişkin veri bulunmadığından kullanımı önerilmez.4.6 Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi: CÇocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (kontrasepsiyon)Rituksimab'ın gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir. İnsanlara yönelik potansiyel risk bilinmemektedir.Üreme çağındaki kadınlara MABTHERA tedavisi sırasında ve bu tedaviden 12 ay sonrasına kadar etkili doğum kontrol yöntemleri uygulanmalıdır. Gebelik dönemiIgG immünoglobulinlerinin plasenta engelini geçtiği bilinmektedir. Sinomolgüs maymunlarıyla yürütülen gelişimsel toksisite çalışmalarında intrauterin embriyotoksisiteye ilişkin bir kanıt bulunmamıştır. MABTHERA uygulanan yeni doğmuş memeli hayvanların yavrularında postnatal dönemde B hücre popülasyonu yıkımı olduğu kaydedilmiştir. Anne vasıtasıyla MABTHERA'ya maruz kalan insan yenidoğanındaki B hücre seviyeleri klinik çalışmalarla araştırılmamıştır.Gebe kadınlarda yapılmış çalışmalarda yeterli ve kontrollü veri elde edilememiştir, ancak gebelik süresince anneleri rituksimab'a maruz kalmış olan bazı yenidoğanlarda geçici B hücre deplesyonu ve lenfositopeni bildirilmiştir. Bu sebeplerle MABTHERA, potansiyel faydalar riskten fazla olmadığı sürece gebe kadınlarda uygulanmamalıdır. Laktasyon dönemiRituksimab'ın insan ya da hayvan sütü ile atıldığına ilişkin yetersiz/sınırlı bilgi mevcuttur. Ancak maternal IgG süte geçmektedir. Bu durumda MABTHERA emzirme döneminde kullanılmamalıdır.Üreme yeteneği/ FertiliteÜreme yeteneği üzerine etkisi hakkında bilgi mevcut değildir.4.7 Araç ve makine kullanımı üzerindeki etkilerMABTHERA'nın araç veya makine kullanma becerisine etkisini belirleyecek çalışmalar yapılmamıştır, ancak farmakolojik aktivite ve bugüne kadar bildirilen yan etkiler bu etkinin beklenmesi gerektiğini göstermez.4.8 İstenmeyen etkilerİstenmeyen etkiler aşağıdaki sıklık sınıflandırmasına göre sıralanmıştır.Çok yaygın (> 1/10); yaygın (> 1/100 ila <1/10); yaygın olmayan (> 1/1.000 ila <1/100); seyrek (> 1/10.000 ila <1/1.000); çok seyrek (< 1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Hemato-Onkoloji klinik çalışmalarıMABTHERA ile tek başına ya da kemoterapi ile kombinasyonda rapor edilen yan etkilerin görülme sıklığı, aşağıda özetlenmektedir ve klinik çalışmalardan gelen verilere dayanmaktadır. Bu yan etkiler, hem tek kollu çalışmalarda meydana gelmiştir hem de başlıca randomize klinik çalışmaların en az birinde kontrol koluna kıyasla en az %2'lik bir farkla ortaya çıkmıştır. Yan etkiler, başlıca klinik çalışmaların herhangi birinde görülen en yüksek insidans oranına göre aşağıda uygun kategoriye eklenmiştir. Her sıklığın gruplandırmasında yan etkiler, azalan ciddiyet sırasına göre listelenmektedir.MABTHERA monoterapisi/ idame tedavisi:Aşağıda verilen yan etkiler, Hodgkin-dışı lenfoma tedavisi ya da tekrar tedavisi için, tek ajan olarak haftalık MABTHERA ile tedavi edilen 356 düşük dereceli ya da foliküler lenfoma hastasının bulunduğu tek kollu çalışmalardan alınan verilere dayanmaktadır.(bkz. bölüm 5.1 Farmakodinamik özellikler). Aynı zamanda, CHOP ya da R-CHOP ile başlangıç indüksiyonuna yanıt veren sonrasında 2 yıla kadar idame tedavisi olarak MABTHERA alan foliküler lenfomalı 166 hastadan alınan verilere dayanan yan etkileri de içermektedir (bkz. bölüm 5.1 Farmakodinamik özellikler). Yan etkiler, monoterapi ile tedaviden sonra 12 aya kadar ve MABTHERA idame tedavisinden sonra 1 aya kadar rapor edilmiştir. Klinik çalışmalarda MABTHERA monoterapisi (n=356) veya MABTHERA idame tedavisi (n= 166) alan düşük evreli ya da foliküler lenfomalı hastalarda rapor edilen yan etkilerin özetiEnfeksiyonlar ve enfestasyonlarÇok yaygın : bakteriyel enfeksiyonlar, viral enfeksiyonlarYaygın : sepsis, +pnömoni, +febril enfeksiyon, +herpes zoster, +solunum sistemi enfeksiyonu, fungal enfeksiyonlar, etiyolojisi bilinmeyen enfeksiyonlar Kan ve lenfatik sistem hastalıklarınötropeni, lökopeni anemi, trombositopeni
Çok yaygın Yaygın Yaygın olmayan pıhtılaşma bozuklukları, geçici aplastik anemi, hemolitik anemi, lenfadenopati Bağışıklık sistemi hastalıklarıÇok yaygın : anjiyoödemYaygın : hipersensitivite Metabolizma ve beslenme hastalıklarıYaygın : hiperglisemi, kilo kaybı, periferal ödem, yüz ödemi, yüksek LDH,hipokalsemi Psikiyatrik bozukluklarYaygın olmayan : depresyon, sinirlilikSinir sistemi hastalıklarıYaygın : parestezi, hipoestezi, ajitasyon, uykusuzluk, vazodilatasyon,baş dönmesi, anksiyete Yaygın olmayan : tat alma duyusunda bozukluk Göz hastalıklarıYaygın : lakrimasyon bozukluğu, konjonktivitKulak ve iç kulak hastalıklarıYaygın : kulak çınlaması, kulak ağrısıKardiyak bozukluklarYaygın : +miyokardiyal enfarktüs, aritmi, +atrial fibrilasyon, taşikardi, +kardiyakbozukluk Yaygın olmayan : +sol ventrikül yetmezliği, +supraventriküler taşikardi, +ventriküler taşikardi, +anjina, +miyokardiyal iskemi, bradikardi Vasküler hastalıklarYaygın : hipertansiyon, ortostatik hipotansiyon, hipotansiyonSolunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın : bronkospazm, solunum hastalığı, göğüs ağrısı, nefes darlığı, öksürük,rinit Yaygın olmayan : astım, bronşiyolit obliterans, akciğer hastalığı, hipoksi Gastrointestinal hastalıklarÇok yaygın : bulantıYaygın : kusma, diyare, karın ağrısı, disfaji, stomatit, konstipasyon, dispepsisi anoreksi, boğaz irritasyonu Yaygın olmayan : karın genişlemesi Deri ve deri altı dokusu hastalıklarıÇok yaygın : kaşıntı, döküntüYaygın : ürtiker, +alopesi, terleme, gece terlemeleri Kas-iskelet, bağ dokusu ve kemik hastalıklarıYaygın : hipertoni, miyalji, artralji, sırt ağrısı, boyun ağrısı, ağrıGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarateş, titreme, asteni, baş ağrısı
Çok yaygın Yaygın Yaygın olmayan tümör ağrısı, kızarma, kırıklık, soğuk algınlığı sendromu infüzyon yeri ağrısı AraştırmalarÇok yaygın : azalmış IgG seviyeleriHer bir terim için görülme sıklığı, sadece ciddi (>3.derece Ulusal Kanser Enstitüsü (NCI) yaygın toksisite kriterleri) reaksiyonların dayandırıldığı ile işaretlenmiş terimler haricinde, her dereceden (orta şiddetten ciddiye kadar) reaksiyona dayandırılmıştır. Sadece her iki çalışmada da gözlenen en yüksek frekans rapor edilmektedir. NHL veKLL 'de MABTHERA ile kemoterapi kombinasyonuAşağıda listelenen yan etkiler, monoterapi/idame tedavisi ile ve/veya daha yüksek bir görülme sıklığı gruplandırmasında: R-CHOP ile tedavi edilen difüz büyük B hücreli lenfoma (DBBHL) olan 202 hasta ve sırasıyla, R-CHOP ya da R-CVP ile tedavi edilen foliküler lenfomalı 234 ve 162 hastadan ve fludarabin ve siklofosfamid ile kombinasyon halinde rituksimab ile tedavi edilen (R-FC) daha önce tedavi edilmemiş 397 KLL hastasından ve 274 relaps/refrakter KLL hastasından görülenlere ilaveten oluşan kontrollü klinik çalışmalardan rituksimab kolu verilerine dayanmaktadır (bkz. bölüm 3.1 Farmakodinamik özellikler). DBBHL'de R-CHOP (n=202), foliküler lenfomada R-CHOP (n=234), foliküler lenfomada R-CVP (n=162) ve daha önce tedavi edilmemiş (n=397) veya relaps/refrakter KLL'de R-FC (n= 274) alan hastalarda rapor edilen ciddi yan etkilerin özeti:Enfeksiyonlar ve enfestasyonlarÇok yaygın : bronşitYaygın : akut bronşit, sinüzit, hepatit B* Kan ve lenfatik sistem hastalıklarıÇok yaygın : febril nötropeni, trombositopeniYaygın : pansitopeni, granülositopeni Deri ve deri altı dokusu hastalıklarıÇok yaygın : alopesiYaygın : cilt bozukluğu Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın : yorgunluk, titreme*Reaktivasyon ve primer enfeksiyonları içerir; sıklık, relaps/refrakter KLL'deki R-FC rejimine dayanmaktadır. Görülme sıklığı, klinik çalışmalarda >3.derece NCI yaygın toksisite kriterleri olarak belirtilmiş olan sadece ciddi reaksiyonlara dayandırılmıştır. Yalnızca herhangi bir çalışmada gözlemlenen en yüksek sıklık raporlanır. Aşağıdaki terimler, yan etki olarak rapor edilmiştir, bununla birlikte, kontrol kollarına kıyasla MABTHERA kollarında benzer (gruplar arasında <%2'lik fark) ya da daha düşük oranda rapor edilmiştir: Hematotoksisite, nötropenik infeksiyon, üriner sistem infeksiyonu, septik şok, akciğer süperinfeksiyonu, implant infeksiyonu, stafilokokal septisemi, akciğer infeksiyonu, rinore, pulmoner ödem, kalp yetmezliği, algılama bozukluğu, venöz tromboz, mukozal inflamasyon, influenza benzeri hastalık, alt ekstremite ödemi, anormal ejeksiyon fraksiyonu, yüksek ateş, genel fiziksel sağlık bozukluğu, düşme, çoklu organ yetmezliği, derin ven trombozu, pozitif kan kültürü, yetersiz diabetes mellitus kontrolü. Diğer kemoterapilerle (örneğin, MCP, CHVP-IFN) kombinasyonda MABTHERA için güvenlilik profili, eşdeğer popülasyonlarda MABTHERA ve CVP, CHOP veya FC kombinasyonu için tanımlanan güvenlilik profiliyle karşılaştırılabilirdir. Seçilmiş, ciddi advers ilaç reaksiyonları üzerine daha fazla bilgiİnfüzyonla ilişkili reaksiyonlar:Klinik çalışmalarda hastaların %50'sinden fazlasında infüzyon ile ilgili bir reaksiyonu düşündüren belirtiler ve semptomlar bildirilmiş ve bunlar çoğunlukla ilk infüzyondan sonra ve genelde ilk bir iki saat içinde görülmüştür. Bu belirtiler çoğunlukla ateş, titreme ve kasılmadan oluşmaktadır. Diğer semptomlar ise kızarma, anjiyoödem, bronkospazm, kusma, bulantı, ürtiker/döküntü, yorgunluk, baş ağrısı, boğazda tahriş, rinit, kaşıntı, ağrı, taşikardi, hipertansiyon, hipotansiyon, dispne, dispepsi, asteni ve tümör lizis sendromuna ilişkin belirleyici özelliklerdir. Vakaların %12'sinde infüzyonla ilişkili şiddetli reaksiyonlar (bronkospazm, hipotansiyon gibi) meydana gelmiştir. Bazı vakalarda bildirilen diğer reaksiyonlar ise miyokard enfarktüsü, atriyal fibrilasyon, pulmoner ödem ve akut reversibl trombositopenidir. Anjina pektoris veya konjestif kalp yetmezliği veya şiddetli kardiyak olaylar (kalp yetmezliği, miyokard enfarktüsü, atriyal fibrilasyon) gibi önceden var olan kardiyak hastalıkların, pulmoner ödemin, çoklu organ yetmezliğinin ve solunum yetmezliğinin şiddetlenmesi çok az veya bilinmeyen bir sıklıkta bildirilmiştir. İnfüzyon ile ilgili semptomların insidansı, sonraki infüzyonlarla önemli ölçüde azalmış ve MABTHERA (içeren) tedavisinin sekizinci kürüyle %1'den daha aza inmiştir. Enfeksiyonlar ve enfestasyonlarMABTHERA hastaların %70 ila %80'inde B hücre sayısında düşmeye neden olmuş, ancak hastaların sadece küçük bir kısmında serum immünoglobülinlerinde azalma olmuştur.Randomize çalışmaların MABTHERA içeren kolunda Herpes zoster'in yanı sıra lokalize olmuş kandida enfeksiyonları daha yüksek bir insidansta bildirilmiştir. MABTHERA monoterapisi ile tedavi edilen hastaların %4'ünde şiddetli enfeksiyonlar raporlanmıştır. Gözlem grubu ile karşılaştırıldığında, MABTHERA ile 2 yıla kadarki idame tedavisi sırasında evre 3 veya 4 enfeksiyonlar dahil genel enfeksiyon sıklığı daha yüksektir. 2 yıllık tedavi periyodu boyunca rapor edilen enfeksiyonlar bakımından hiçbir kümülatif toksisite bulunmamaktadır. Ek olarak MABTHERA tedavisiyle bir kısmı ölümle sonuçlanan yeni, reaktive olan veya şiddetlenen diğer ciddi viral enfeksiyonlar rapor edilmiştir. Hastaların büyük çoğunluğu MABTHERA'yı kemoterapi ile birlikte veya hematopoetik kök hücre transplantasyonunun bir parçası olarak almışlardır. Bu çeşitli ciddi viral enfeksiyonlara herpes virüsleri nedeniyle oluşan enfeksiyonlar (sitomegalovirüs, Varisella zoster virüs ve Herpes simpleks virüs), JC virüs (Progresif multifokal lökoensefalopati (PML)) ve Hepatit C virüsü örnek verilebilir. Klinik çalışmalarda hastalık progresyonundan ve tekrar tedaviden sonra ölüme neden olabilen PML vakaları bildirilmiştir. Sitotoksik kemoterapi ile birlikte MABTHERA alan gönüllülerin çoğunda hepatit B reaktivasyonu vakaları bildirilmiştir. Nükseden/ dirençli KLL'li hastalarda, evre 3/4 hepatit B enfeksiyonu insidansı FC kolundaki %0 değerine karşı R-FC'de %2'dir. Önceden Kaposi sarkomu olan ve rituksimab kullanan hastalarda Kaposi sarkomu'nda ilerleme gözlenmiştir. Bu vakalar, onaylı olmayan endikasyonlara bağlı kullanım sonucu meydana gelmiştir ve hastaların da çoğu HIV pozitif hastalardır. Kan ve lenfatik sistem hastalıkları4 hafta boyunca MABTHERA monoterapisi verilerek yapılan klinik çalışmalarda, hastaların küçük bir kısmında hematolojik anormallikler meydana gelmiştir ve bunlar genelde hafif ve geri dönüşümlüdür. Hastaların %4.2'sinde ciddi nötropeni (evre 3/4), %1.1'inde anemi ve %1.7'sinde trombositopeni bildirilmiştir. MABTHERA ile yapılan 2 yıla kadarki idame tedavisi sırasında, gözlem ile karşılaştırıldığında daha yüksek bir insidansta lökopeni (%2'ye karşı %5, evre 3/4) ve nötropeni (%4'e karşı %10, evre 3/4) bildirilmiştir. Trombositopeni insidansı düşüktür (<1, evre 3/4) ve tedavi kolları arasında farklı değildir. MABTHERA'nın kemoterapi ile birlikte kullanıldığı çalışmalarda tek başına kemoterapi ile karşılaştırıldığında evre 3/4 lökopeni (%79 CHOP'a karşı %88 R-CHOP, %12 FC'ye karşı %23 R-FC), nötropeni (önceden tedavi edilmemiş KLL'de %14 CVP'ye karşı %24 R-CVP, %88 CHOP'a karşı %97 R-CHOP, %19 FC'ye karşı %30 R-FC) ve pansitopeni (önceden tedavi edilmemiş KLL'de %1 FC'ye karşı %3 R-FC) genelde daha yüksek sıklıklarda bildirilmiştir. Ancak MABTHERA ve kemoterapi ile tedavi edilen hastalarda daha yüksek insidansta görülen nötropeni, tek başına kemoterapi ile tedavi edilen hastalarla karşılaştırıldığında daha yüksek enfeksiyon ve enfestasyon insidansı ile ilişkili değildir ve MABTHERA artı kemoterapi grubunda nötropeni uzun sürmemiştir. Anemi insidansı için bildirilmiş herhangi bir farklılık yoktur. MABTHERA'nın son infüzyonundan sonra dört haftadan uzun süren bazı geç nötropeni vakaları bildirilmiştir. KLL birinci basamak çalışmasında, Binet C evresindeki hastalarda FC kolu ile karşılaştırıldığında (%71 FC'ye karşı %83 R-FC) R-FC kolunda daha fazla advers olay yaşanmıştır. Nükseden/refrakter KLL çalışmasında, FC grubundaki hastaların %9'una karşılık R-FC grubunda hastaların %11'inde evre 3/4 trombositopeni bildirilmiştir.Waldenström makroglobulinemi hastalarında MABTHERA ile yapılan çalışmalarda, tedavi başladıktan sonra serum IgM düzeylerinde hiperviskozite ve ilgili semptomlarla ilişkili olabilecek geçici artışlar gözlenmiştir. Bu geçici IgM artışları genellikle 4 ay içinde en azından başlangıç düzeyine dönmüştür. Kardiyovasküler reaksiyonlarMABTHERA monoterapisi ile yapılan klinik çalışmalar sırasında hastaların %18'inde en sık bildirilen kardiyovasküler reaksiyonlar hipotansiyon ve hipertansiyondur. İnfüzyon sırasında evre 3 veya 4 aritmi (ventriküler ve supraventriküler taşikardi dahil) ve anjina pektoris bildirilmiştir. İdame tedavisi sırasında, evre 3/4 kardiyak bozukluk insidansı MABTHERA ile tedavi edilen hastalar ve gözlem hastaları arasında karşılaştırılabilirdir. Gözlem grubunda görülen <%1 değer ile karşılaştırıldığında, MABTHERA ile tedavi edilen hastaların %3 'ünde ciddi advers olay (atriyal fibrilasyon, miyokard enfarktüsü, sol ventrikül yetersizliği, miyokardiyal iskemi dahil) olarak kardiyak olaylar bildirilmiştir. Kemoterapi ile birlikte MABTHERA'nın değerlendirildiği çalışmalarda evre 3 ve 4 kardiyak aritmi insidansı, çoğunlukla taşikardi ve atriyal ritim bozukluğu/fibrilasyon gibi supraventriküler aritmiler CHOP grubuna kıyasla (3 hasta, %1.5) R-CHOP grubunda daha yüksektir (14 hasta, %6.9). Bu aritmilerin tümü ya bir MABTHERA infüzyonu ile ilişkili olarak meydana gelmiş ya da ateş, enfeksiyon, akut miyokard enfarktüsü veya önceden var olan solunum ve kardiyovasküler hastalık gibi predispozan koşullarla bağlantılıdır. R-CHOP ve CHOP grubu arasında kalp yetmezliği, miyokardiyal hastalık ve koroner arter hastalığı belirtilerini kapsayan diğer evre 3 ve 4 kardiyak olayların insidansında hiçbir farklılık gözlenmemiştir. KLL'de, birinci basamak çalışma (%4 R-FC, %3 FC) ve nükseden/refrakter çalışmanın (%4 R-FC, %4 FC) her ikisinde de evre 3 veya 4 toplam kardiyak bozukluk insidansı çok düşüktür.Solunum, göğüs bozuklukları ve mediastinal hastalıklarBazıları ölümle sonuçlanabilen interstisyel akciğer hastalığı vakaları bildirilmiştir.Sinir sistemi hastalıklarıTedavi periyodu sırasında, R-CHOP ile tedavi edilen hepsi kardiyovasküler risk faktörlü dört hastada (%2) ilk tedavi kürü sırasında tromboembolik serebrovasküler olaylar görülmüştür. Diğer tromboembolik olayların insidansında tedavi grupları arasında hiçbir farklılık olmamıştır. Buna karşın CHOP grubunda üç hastanın (%1.5) hepsinde takip döneminde meydana gelen serebrovasküler olaylar olmuştur. KLL'de birinci basamak çalışma (%4 R-FC, %4 FC) ve nükseden/refrakter çalışmanın (%3 R-FC, %3 FC) her ikisinde de evre 3 veya 4 toplam sinir sistemi bozukluğu insidansı çok düşüktür.Posterior reversibl ensefalopati sendromu (PRES) / reversibl posterior lökoensefalopati sendromu (RPLS) bildirilmiştir. Belirti ve semptomlar; hipertansiyon ile ilişkili veya ilişkisiz görme bozukluğu, baş ağrısı, nöbet ve mental durumda değişikliği kapsamaktadır. PRES/RPLS tanısının beyin görüntülemesi ile doğrulanması gerekmektedir. Raporlanan vakalarda, hastanın altta yatan hastalığı, hipertansiyon, immünosüpresif tedavi ve/veya kemoterapi dahil PRES/RPLS için bilinen risk faktörleridir. Gastrointestinal hastalıklarHodkgin dışı lenfoma tedavisi için MABTHERA alan hastalarda bazı vakalarda ölüme neden olabilen gastrointestinal perforasyon gözlenmiştir. Bu vakaların çoğunda MABTHERA, kemoterapi ile beraber uygulanmıştır.IgG seviyeleriNükseden/refrakter foliküler lenfomada MABTHERA idame tedavisinin değerlendirildiği klinik bir çalışmada, medyan IgG seviyeleri hem gözlem grubunda hem de MABTHERA grubunda indüksiyon tedavisinden sonra normal değerin alt limitinin (LLN) (<7 g/L) altındadır. Gözlem grubunda IgG seviyeleri sonradan medyan LLN'nin üzerine kadar artmıştır ancak MABTHERA grubunda sabit kalmıştır. IgG seviyeleri LLN'nin altında olan hastaların oranı gözlem grubunda azalırken (2 yıl sonra %36), 2 yıllık tedavi periyodunun başından sonuna kadar MABTHERA grubunda yaklaşık %60 olmuştur.Özel popülasyonlara ilişkin ek bilgiler - MABTHERA monoterapisiGeriyatrik popülasyon (> 65 yaş):Tüm derecelerde AİR ve evre 3/4 AİR görülme insidansı, daha genç (< 65 yaş) hastalar ile karşılaştırıldığında yaşlı hastalarda benzer bulunmuştur.Geniş hacimli (bulky) hastalıkGeniş hacimli hastalığı olan kişilerde, evre 3/4 AİR görülme insidansı, geniş hacimli hastalığı olmayanlardan daha yüksektir (%15.4'e karşı %25.6). Herhangi bir derecede AİR görülme insidansı bu iki grupta benzerdir.Yeniden tedaviMABTHERA kürleri ile tekrarlanan tedavi sırasında AİR raporlanan hasta yüzdesi, ilk maruziyetten sonra AİR raporlanan hasta yüzdesi ile benzerdir (herhangi bir derecede AİR ve evre 3/4 AİR)MABTHERA kombinasyon tedavisiGeriyatrik popülasyon (> 65 yaş):
Evre 3/4 kan ve lenfatik advers olay görülme insidansı, önceden tedavi edilmemiş KLL'li veya nükseden/refrakter KLL'li genç hastalara (<65 yaş) kıyasla yaşlı hastalarda daha yüksektir. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sistem Organ Sınıfı |
Çok Yaygın |
Yaygın |
Yaygınolmayan |
Çok Seyrek |
Enfeksiyonlar ve enfestasyonlar |
Üst solunum yolu enfeksiyonu, idrar yolları enfeksiyonu |
Bronşit, sinüzit, gastroenterit, ayak mantarı |
|
PML, hepatit B reaktivasyonu |
Kan ve lenfsistemihastalıkları |
|
|
|
Serum hastalığı benzeri reaksiyon |
Bağışıklıksistemihastalıkları |
*İnfüzyonla ilişkili reaksiyonlar (hipertansiyon, bulantı, döküntü, pireksi, kaşıntı, ürtiker, boğazda tahriş, sıcak basması, hipotansiyon, rinit, katılık, taşikardi, yorgunluk, orofarengeal ağrı, periferik ödem, eritem) |
|
* İnfüzyonla ilişkili reaksiyonlar (genel ödem, bronkospazm , hırıltı, laringeal ödem, anjiyonörotik ödem, genel kaşıntı, anafilaksi, anafilaktoid reaksiyon) |
|
Genelbozukluklar ve uygulama yerine ilişkin hastalıklar | ||||
Metabolizma vebeslenmehastalıkları |
|
hiperkolesterole mi |
|
|
Sinir sistemi hastalıkları |
baş ağrısı |
parestezi, migren, baş dönmesi, siyatik |
|
|
Deri ve deri altı dokuhastalıkları |
|
alopesi |
|
|
Psikiyatrikhastalıklıkları |
|
depresyon, anksiyete |
|
|
GastrointestinalHastalıkları |
|
Dispepsi, diyare, gastro-özofajiyal |
|
|
Sistem Organ Sınıfı
Çok Yaygın
Çok Seyrek
Yaygın
Yaygın
olmayan
reflü, ağız ülserasyonu, üst
abdominal ağrı
artralji / kas iskelet
sisteminde ağrı, osteoartrit, bursit
sisteminde ağrı, osteoartrit, bursit
Kas-iskelet
bozuklukları
*İnfüzyon sırasında veya 24 saat içinde meydana gelen reaksiyonlar. Ayrıca aşağıdaki infüzyonla ilgili reaksiyonlara da bakınız. İnfüzyonla ilgili reaksiyonlar, aşırı duyarlılığın bir sonucu olarak veya etki mekanizması ile ilgili olarak meydana gelebilir.
Çoklu kürler
Çoklu tedavi kürlerinde, ilk uygulamayı takiben gözlenene benzer bir AİR profili görülmüştür. İlk MABTHERA maruziyetini takiben tüm AİR'ler için en yüksek oran ilk 6 ayda görülmüş ve daha sonra azalmıştır. Tümü en fazla tedavinin ilk 6 ayında görülmekle beraber, bu çoğunlukla infüzyonla ilişkili reaksiyonlar (en sık ilk tedavi kürü sırasında), RA şiddetlenmesi ve enfeksiyonlar için hesaplanmıştır.
İnfüzyonla ilişkili reaksiyonlar:
Klinik çalışmalarda MABTHERA'nın alımını takiben en sık bildirilen AİR'ler infüzyonla ilişkili reaksiyonlardır (IRR'ler) (Tablo 1'ye bakınız). MABTHERA ile tedavi edilen 3189 hasta arasından 1135'inde (%36) en az bir IRR görülmüş ve hastaların 733/3189'unda (%23) MABTHERA'ya ilk maruziyetin ilk infüzyonundan sonra bir IRR yaşanmıştır. IRR insidansı, sonraki tüm infüzyonlar için azalmıştır. Klinik çalışmalarda hastaların %1'inden azında (17/3189) bir ciddi IRR görülmüştür. Klinik çalışmalarda CTC Evre 4 IRR yaşanmamış veya IRR'ye bağlı ölüm gözlenmemiştir. CTC Evre 3 olayların oranı ve ilacın geri çekilmesine neden olan IRR'lerin oranı kür ile azalmış olup, 3. kürden itibaren seyrekleşmiştir. İntravenöz glukokortikoid ile uygulanan premedikasyon, IRR insidansını ve şiddetini anlamlı düzeyde azaltmıştır (bkz. bölüm 4.2 ve 4.4). Pazarlama sonrası ortamda, ölümcül sonuçlara neden olabilen infüzyonla ilişkili şiddetli reaksiyonlar bildirilmiştir.
Enfeksiyonlar ve enfestasyonlar:
Genel enfeksiyon oranı, MABTHERA ile tedavi edilen hastalarda 100 hasta yılında yaklaşık 94'tür. Enfeksiyonlar genelde hafif-orta şiddetlidir ve çoğunlukla üst solunum yolları enfeksiyonu ve idrar yolları enfeksiyonlarından oluşmaktadır. Ciddi veya IV antibiyotik uygulaması gerektiren enfeksiyonların insidansı, 100 hasta yılında yaklaşık 4'tür. Ciddi enfeksiyon oranı, MABTHERA'nın çoklu tedavi kürlerinden sonra herhangi bir önemli artış göstermemiştir. Klinik çalışmalar sırasında, kontrol kolları ile karşılaştırıldığında MABTHERA kollarında benzer insidansta alt solunum yolları enfeksiyonları (pnömoni dahil) bildirilmiştir.
Otoimmün hastalıkların tedavisi için MABTHERA kullanımını takiben ölümcül sonuçları olabilen progresif multifokal lökoensefalopati vakaları bildirilmiştir. Buna Romatoid Artrit ve Sistemik Lupus Eritematozus (SLE) ve Vaskülit dahil endikasyon dışı otoimmün hastalıklar dahildir. Sitotoksik kemoterapi ile beraber rituksimab alan Hodgkin dışı lenfoma hastalarında, hepatit B reaktivasyonu vakaları bildirilmiştir (bkz. Hodgkin dışı lenfoma). Ayrıca çok seyrek olarak MABTHERA alan RA hastalarında da hepatit B enfeksiyonu reaktivasyonu bildirilmiştir (bkz. Bölüm 4.4).
Kardiyovasküler:
Plasebo ile tedavi edilen hastalarda 100 hasta yılında 1.3 oranında görülme oranı ile karşılaştırıldığında, MABTHERA ile tedavi edilen hastalarda 100 hasta yılında 1.3 oranında ciddi kardiyak olaylar bildirilmiştir. Kardiyak olay (tümü veya ciddi olanlar) yaşayan hastaların oranı, çoklu tedavi kürleri boyunca artmamıştır.
4.9 Doz aşımı ve tedavisi
İnsanlarda yapılan klinik çalışmalarda aşırı dozla ilgili deneyim olmamıştır. Kontrollü klinik çalışmalarda 1000 mg'ın üzerindeki tek dozlar test edilmemiştir. Bugüne kadar test edilen en yüksek doz kronik lenfositik lösemi hastalarında 5 gramdır. İlave güvenlilik belirtileri tespit edilmemiştir. Doz aşımı durumu yaşayan hastalara acilen müdahale edilmeli veya infüzyon hızları azaltılmalı ve yakından takip edilmelidir. Kan hücre sayımının düzenli takibi gereken durumlar ve hastaların B hücrelerinin azalması nedeniyle artan enfeksiyon riskleri değerlendirilmelidir.5. FARMAKOLOJİK ÖZELLİKLER
5.1 Farmakodinamik özellikler
Farmakoterapötik grubu: Antineoplastik ATC kodu: L01X C02Etki mekanizması
Rituksimab spesifik olarak CD20 adlı transmembran antijenine bağlanan kimerik fare/insan monoklonal antikorudur. Bu antijen pre-B ve olgun B lenfositlerinde bulunur ancak hematopoetik kök hücrelerde, pro-B hücrelerde, normal plazma hücrelerinde veya diğer normal dokuda bulunmaz. Tüm B hücreli Hodgkin-dışı lenfomaların (NHL) >%95'inde bu antijene rastlanır. Antikora bağlandıktan sonra CD20 hücre içine alınmaz veya hücre membranından çevreye yayılmaz. CD20 plazmada serbest antijen olarak dolaşmaz ve dolayısıyla antikora bağlanmak için yarışmaz.Rituksimab B lenfositlerdeki CD20 antijenine bağlanır ve B hücresinin lizisine yol açan bağışıklık reaksiyonlarını başlatır. Hücre yıkımındaki olası mekanizmalar komplemana bağımlı sitotoksisite (CDC), antikora bağımlı hücresel sitotoksisite (ADCC) ve apopitozun indüklenmesidir. Son olarak,
in vitro
çalışmalar rituksimabın ilaca dirençli insan B lenfoma hücre serilerini bazı kemoterapötik ajanların sitotoksik etkilerine karşı duyarlılaştırdığını göstermiştir.Periferdeki B hücre sayısı ilk MABTHERA dozundan sonra normalin altına düşer. Hematolojik malignite tedavisi gören hastalarda B hücre lerinin normal düzeyine dönmesi tedavinin 6. ayı içinde başlar, bazı hastalarda daha uzun sürse bile, genellikle tedavi tamamlandıktan sonraki 9-12 ay içinde de normal düzeylere döner (bkz. bölüm 4.8
Hemato-Onkoloji klinik çalışmaları)
. Romatoid artrit hastalarında, periferdeki B hücre düzelme süreçleri değişkendir. Hastaların büyük çoğunluğu B hücresi tam replesyonu öncesinde ek tedavi alırlar.İnsan anti-fare antikoru (HAMA) açısından değerlendirilen 67 hastanın hiçbiri pozitif çıkmamıştır. İnsan anti-kimerik antikoru (HACA) açısından değerlendirilen 356 Hodgkin-dışı lenfoma hastasının %1.1'i (4 hasta) pozitif çıkmıştır.
Klinik etkinlik ve güvenlilik
Düşük evreli veya foliküler Hodgkin-dışı lenfomaMonoterapi
Başlangıç tedavisi, haftada bir uygulama, toplam 4 doz
Ana çalışmada, nüksetmiş veya kemorezistan düşük seviyeli ya da foliküler B hücreli NHL'ye sahip 166 hastaya haftada bir, toplam dört doz olarak i.v. infüzyon halinde 375 mg/m2 MABTHERA verilmiştir. ITT popülasyonunda genel yanıt oranı (GYO) %48 (GA%95 %41 - %56) olup tam yanıt (TY) oranı %6 ve kısmi yanıt (KY) oranı %42 olarak gerçekleşmiştir. Yanıt veren hastalarda hastalığın ilerlemesine kadar geçen medyan süre (TTP) 13 ay'dır.
Yapılan bir alt-grup analizinde GYO, IWF B, C ve D histolojik alt-tiplerinde IWF A alt-tipine kıyasla daha yüksek (%58'e karşılık %12), en büyük lezyonu <5 cm olan hastalarda, >7 cm olan hastalara kıyasla daha yüksek (%53'e karşılık %38) ve kemorezistan nüks grubu ile karşılaştırıldığında kemoduyarlı nüks hastalarında (yanıt süresi <3 ay olarak tanımlanır) daha yüksek (%22'ye karşılık %50) bulunmuştur. Önceden otolog kemik iliği transplantasyonu (OKİT) ile tedavi edilmiş hastalarda GYO %78 iken, OKİT tedavisi görmeyenlerde %43 olmuştur. Yaş, cinsiyet, lenfoma derecesi, başlangıçtaki tanı, geniş hacimli hastalık varlığı ya da yokluğu, normal ya da yüksek LDH düzeyleri veya ekstranodal hastalık varlığının MABTHERA 'ya karşı verilen yanıt üzerinde istatistik olarak anlamlılık (Fischer'in exact testi) taşıyan bir etkisi bulunmamaktadır.
Yanıt oranları ile kemik iliği tutulumu arasında istatistiksel olarak anlamlı bir bağıntı kaydedilmiştir. Kemik iliği tutulumu olan hastaların %40'ı yanıt verirken, kemik iliği tutulumu olmayan hastaların %59'u yanıt vermiştir (p=0.0186). Histolojik tip, başlangıçta bcl-2 pozitifliği, son kemoterapiye karşı direnç ve ağır hastalık faktörlerinin prognostik faktörler olarak tanımlandığı kademeli lojistik regresyon analizi bu bulguyu desteklememiştir.
Başlangıç tedavisi, haftada bir uygulama, toplam 8 doz
Çok merkezli, tek kollu bir çalışmada nüksetmiş veya kemorezistan, düşük dereceli veya foliküler B hücreli NHL'si olan 37 hastaya, toplam sekiz doz olacak şekilde, i.v. infüzyon yoluyla haftada bir kere 375 mg/m2 MABTHERA verilmiştir. GYO %57 (CI%95 %41-%73; TY %14, KY %43) ve medyan TTP 19.4 ay (aralık 5.3 ila 38.9 ay) bulunmuştur.
Başlangıç tedavisi, geniş hacimli hastalık, haftada bir uygulama, toplam 4 doz
Üç çalışmanın bir araya getirilmiş verilerinde, nüksetmiş veya kemorezistan, bulky hastalık (tek lezyon >10 cm çapında) özelliklerini taşıyan düşük dereceli veya foliküler B hücreli NHL'si olan 39 hastaya toplam dört doz, haftada bir kere 375 mg/m2 MABTHERA,
i.v. infüzyon yoluyla verilmiştir. GYO %36 (GA%95 %21-%51; TY %3, KY %33) ve yanıt veren hastalarda medyan TTP 9.6 ay olmuştur (aralık 4.5 ila 26.8 ay).
Çok merkezli, tek kollu bir çalışmada, önceki bir MABTHERA küründe objektif klinik yanıt alınan, nüksetmiş veya kemorezistan düşük evreli veya foliküler B hücreli NHL'si olan 58 hasta toplam dört doz, haftada bir kere, i.v. infüzyon yoluyla 375 mg/m2 MABTHERA ile yeniden tedavi edilmiştir. Hastaların üçü çalışmaya kaydolmadan önce iki seans MABTHERA tedavisi gördüğünden, bunlara çalışmada üçüncü bir seans uygulanmıştır. Çalışmada iki hasta, iki kez yeniden tedavi edilmiştir. Çalışmadaki 60 yeniden tedavi vakasında, yanıt veren hastalar için GYO %38 (GA%95 %26-%51; TY %10, KY %28) ve yanıt veren hastalarda projekte edilen ortalama TTP, 17.8 ay (aralık 5.4 ila 26.6 ay) olmuştur. Bu değerler, önceki MABTHERA küründe elde edilen sonuçlar (12.4 ay) ile olumlu yönde karşılaştırılabilir niteliktedir.
Kemoterapi ile kombinasyon halinde
Başlangıç tedavisi
Randomize, açık tasarımlı bir çalışmada, daha önce tedavi görmemiş foliküler lenfoması olan 322 hasta, 8 siklus, her 3 haftada bir CVP kemoterapisi (siklofosfamid 750 mg/m2, 1. gün maksimum 2 mg doza kadar, vinkristin 1.4 mg/m2 ve 1-5. gün arasında prednizolon 40 mg/m2/gün) ya da CVP ile kombinasyon halinde MABTHERA 375 mg/m2 (R-CVP) alacak şekilde randomize edilmiştir. MABTHERA her tedavi siklusunun ilk gününde uygulanmıştır. Toplam 321 hasta (162 R-CVP, 159 CVP) tedavi görmüş ve etkinlik bakımından analiz edilmiştir.
Hastaların medyan takip süresi 53 aydır. R-CVP, primer sonlanma noktası olan tedavi başarısızlığına kadar geçen süre açısından CVP'ye göre önemli bir üstünlük sağlamıştır (27 aya karşılık 6.6 ay, p <0.0001, log-sıra testi). Tümör cevabı bulunan hastaların oranı (tY, TYo, KY), R-CVP grubunda (%80.9) CVP grubundan (%57.2) önemli oranda daha yüksek olmuştur (p< 0.0001, Ki-Kare testi). R-CVP ile yapılan tedavi, hastalık ilerlemesi veya ölüme kadar geçen süreyi belirgin bir şekilde artırmıştır (33.6 ay ve14.7 ay) (p <0.0001, log-sıra testi). R-CVP grubunda medyan yanıt süresi 37.7 ayken, CVP grubunda bu süre 13.5 ay olarak bulunmuştur (p <0.0001, log-sıra testi). Genel sağkalım açısından tedavi grupları arasındaki farklılık güçlü bir klinik yarar göstermiştir (p=0.029, log-sıra testi): 53. aydaki sağkalım oranları R-CVP grubunda %80.9 iken, CVP
grubunda %71.1'dir.
CVP dışındaki kemoterapi rejimleriyle (CHOP, MCP, CHVP/İnterferon-a) yapılan diğer 3 çalışmadan elde edilen sonuçlar yanıt oranlarında ve zamana bağlı parametrelerde olduğu gibi genel sağkalımda da belirgin iyileşmeler göstermiştir. Bu dört çalışmadan elde edilen anahtar sonuçlar aşağıdaki tabloda özetlenmektedir.
Tablo 2. MABTHERA'nın foliküler lenfomada farklı kemoterapi rejimleriyle yararlarının değerlendirildiği dört faz III çalışmadan elde edilen sonuçların özetleri
Çalışma |
Tedavi,n |
Medyan takip süresi,a |
GYO,% |
TY,% |
Medyan TTF/PFS/ EFS ay |
OS oranları,% |
M39021 |
CVP, 159 |
53 |
57 |
10 |
Medyan TTP: 14.7 |
53 ay 71.1 |
|
R-CVP, 162 |
81 |
41 |
33.6 p<0.0001 |
80.9 p=0.029 | ||
GLSG'00 |
CHOP, 205 |
18 |
90 |
17 |
Medyan TTF: 2.6 yıl |
18 ay 90 |
|
R-CHOP, 223 |
96 |
20 |
Ulaşılamamıştır p <0.001 |
95 p = 0.016 | ||
OSHO-39 |
MCP, 96 R-MCP, 105 |
47 |
75 92 |
25 50 |
Medyan PFS: 28.8 Ulaşılamamıştır p <0.0001 |
48 ay 74 87 p = 0.0096 |
FL2000 |
CHVP-IFN, 183 R-CHVP-IFN, 175 |
42 |
85 94 |
49 76 |
Medyan EFS: 36 Ulaşılamamıştır p<0.0001 |
42 ay 84 91 p=0.029 |
TTP: Progresyona veya ölüme kadar geçen süre
PFS: Progresyonsuz sağkalım
TTF: Tedavinin başarısızlığına kadar geçen süre
OS oranları: Analiz zamanlarında genel sağkalım oranları
İdame tedavisi
Prospektif, açık etiketli, uluslararası, çok merkezli bir faz III çalışmada 465 relaps/refrakter foliküler NHL hastası, CHOP (siklofosfamid, doksorubisin, vinkristin, prednizolon; n=231) veya MABTHERA + CHOP (R-CHOP, n=234) ile yapılan indüksiyon tedavisine ilk basamakta randomize edilmiştir. İki tedavi grubu, başlangıç karakteristiklerine ve hastalık durumuna göre iyi dengelenmiştir. İndüksiyon tedavisinden sonra tam ya da kısmi remisyon sağlanan toplam 334 hasta, ikinci aşamada MABTHERA idame tedavisi (n=167) veya gözlem koluna (n=167) randomize edilmiştir. MABTHERA idame tedavisi, maksimum iki sene süresince ya da hastalık ilerleyene kadar, üç ayda bir 375 mg/m2 vücut yüzey alanı dozunda verilen tek MABTHERA uygulamasından ibarettir.Son etkinlik analizi, çalışmanın her iki bölümüne randomize edilen tüm hastaları içerir. İndüksiyon fazına randomize edilen hastaların 31 aylık medyan gözlem süresi sonunda, R-CHOP'ın, CHOP ile kıyaslandığında relaps/refrakter foliküler NHL hastalarının klinik sonuçlarını belirgin olarak iyileştirdiği görülmüştür (Bkz. Tablo 3).
TT
CHOP
R-CHOP
p değeri
Risk Azaltımı
Primer Etkinlik
GYO2)
TY2)
KY2)
Sekonder Etkinlik
OS (ortalama)PFS(ortalama)
yok
yok
yok
%32
%38
yok
yok
%32
%38
%74
%16
%58
NR
%16
%58
NR
19.4 ay
%87
%29
%58
NR
%29
%58
NR
33.2 ay
0.0003
0.0005
0.9449
0.0508
0.0001
0.0005
0.9449
0.0508
0.0001
17
2) Araştırmacı tarafından değerlendirilen son tümör yanıtı. Yanıt için yapılan primer istatistiksel test, tam yanıt, kısmi yanıt ve hiç yanıt olmaması durumlarını karşılaştıran bir eğilim testidir (p <0.0001)
Kısaltmalar: NR: ulaşılamamıştır; GYO: genel yanıt oranı; TY: tam yanıt; KY: kısmi yanıt; OS: genel sağkalım; PFS: progresyonsuz sağkalım
Çalışmanın idame fazına randomize edilen hastalar için medyan gözlem süresi, idame randomizasyonundan itibaren 28 aydır. MABTHERA ile idame tedavisi, sadece gözlem koluna kıyasla, primer sonlanma noktası olan PFS'de (idame randomizasyonundan nükse, hastalık ilerlemesine ya da ölüme kadar olan süre) klinik olarak anlamlı ve istatistiksel olarak belirgin düzelme ile sonuçlanmıştır (p<0.0001, log-sıra testi). Medyan PFS, MABTHERA idame kolunda 42.2 ayken gözlem kolunda 14.3 aydır. Cox regresyon analizi kullanıldığında, hastalık ilerlemesi ya da ölüm riski, MABTHERA idame tedavisi ile gözleme göre %61 oranında azalmıştır (GA%95; %45-%72). 12 ayda Kaplan-Meier yöntemiyle hesaplanan progresyonsuz oranlar, MABTHERA idame grubunda %78 iken gözlem grubunda %57'dir. Genel sağkalım analizi, MABTHERA idamesinin, gözleme göre belirgin fayda sağladığını kanıtlamıştır. MABTHERA idame tedavisi, ölüm riskini %56 azaltmıştır (GA%95; %22-%75).
Yeni lenfoma tedavisine kadar geçen medyan süre, MABTHERA idame tedavisinde gözleme oranla anlamlı ölçüde daha uzundur (38.8 ay'a karşı 20.1 ay, p<0.0001, log-sıra testi). Yeni bir tedaviye başlama riski %50 oranında azalmıştır (GA%95; %30-%64). İndüksiyon tedavisine en iyi yanıt olarak TY/TYo (onaylanmamış tam yanıt) sonucunu veren hastalarda MABTHERA idame tedavisi, medyan hastalıksız sağkalım (DFS) süresini gözlem grubuna kıyasla önemli ölçüde uzatmıştır (53.7 ve 16.5 ay, p=0.0003, log-sıra testi) (Tablo 4). Tam yanıt verenlerde nüksetme riski %67 oranında düşmüştür (GA%95; %39-%82).
2) Araştırmacı tarafından değerlendirilen son tümör yanıtı. Yanıt için yapılan primer istatistiksel test, tam yanıt, kısmi yanıt ve hiç yanıt olmaması durumlarını karşılaştıran bir eğilim testidir (p <0.0001)
Kısaltmalar: NR: ulaşılamamıştır; GYO: genel yanıt oranı; TY: tam yanıt; KY: kısmi yanıt; OS: genel sağkalım; PFS: progresyonsuz sağkalım
Çalışmanın idame fazına randomize edilen hastalar için medyan gözlem süresi, idame randomizasyonundan itibaren 28 aydır. MABTHERA ile idame tedavisi, sadece gözlem koluna kıyasla, primer sonlanma noktası olan PFS'de (idame randomizasyonundan nükse, hastalık ilerlemesine ya da ölüme kadar olan süre) klinik olarak anlamlı ve istatistiksel olarak belirgin düzelme ile sonuçlanmıştır (p<0.0001, log-sıra testi). Medyan PFS, MABTHERA idame kolunda 42.2 ayken gözlem kolunda 14.3 aydır. Cox regresyon analizi kullanıldığında, hastalık ilerlemesi ya da ölüm riski, MABTHERA idame tedavisi ile gözleme göre %61 oranında azalmıştır (GA%95; %45-%72). 12 ayda Kaplan-Meier yöntemiyle hesaplanan progresyonsuz oranlar, MABTHERA idame grubunda %78 iken gözlem grubunda %57'dir. Genel sağkalım analizi, MABTHERA idamesinin, gözleme göre belirgin fayda sağladığını kanıtlamıştır. MABTHERA idame tedavisi, ölüm riskini %56 azaltmıştır (GA%95; %22-%75).
Yeni lenfoma tedavisine kadar geçen medyan süre, MABTHERA idame tedavisinde gözleme oranla anlamlı ölçüde daha uzundur (38.8 ay'a karşı 20.1 ay, p<0.0001, log-sıra testi). Yeni bir tedaviye başlama riski %50 oranında azalmıştır (GA%95; %30-%64). İndüksiyon tedavisine en iyi yanıt olarak TY/TYo (onaylanmamış tam yanıt) sonucunu veren hastalarda MABTHERA idame tedavisi, medyan hastalıksız sağkalım (DFS) süresini gözlem grubuna kıyasla önemli ölçüde uzatmıştır (53.7 ve 16.5 ay, p=0.0003, log-sıra testi) (Tablo 4). Tam yanıt verenlerde nüksetme riski %67 oranında düşmüştür (GA%95; %39-%82).
Tahminler, risk oranlarına göre hesaplanmıştır
Etkinlik Parametresi |
Olaya Kadar Medyan Sürenin (ay) Kaplan-Meier Yöntemiyle Hesaplanması |
RiskAzaltımı | ||
|
|
Gözlem (n = 167) |
MABTHERA(n=167) |
Log-sıra p değeri |
|
|
Progresyonsuz sağkalım (PFS) |
14.3 |
42.2 |
<0.0001 |
%61 |
|
Genel sağkalım |
NR |
NR |
0.0039 |
%56 |
|
Yeni lenfoma tedavisine kadar geçen süre |
20.1 |
38.8 |
<0.0001 |
%50 |
|
Hastalıksız sağkalıma |
16.5 |
53.7 |
0.0003 |
%67 |
|
Alt Grup Analizi |
|
|
|
|
|
PFS CHOP R-CHOP TY KY |
11.6 22.1 14.3 14.3 |
37.5 51.9 52.8 37.8 |
<0.0001 0.0071 0.0008 <0.0001 |
%71 %46 %64 %54 |
|
TS CHOP R-CHOP |
NR NR |
NR NR |
0.0348 0.0482 |
%55 %56 |
MABTHERA idame tedavisinin faydası, indüksiyon rejimi (CHOP ya da R-CHOP) ya da indüksiyon tedavisine verilen yanıtların niteliğiyle (TY ya da KY) ilgili olmaksızın tüm alt gruplarda analiz edilmiştir (Tablo 4). MABTHERA idame tedavisi, CHOP indüksiyon tedavisine yanıt veren hastalarda (medyan PFS 37.5 aya karşılık 11.6 ay, p<0.0001) olduğu kadar R-CHOP indüksiyon tedavisine yanıt veren hastalarda da (medyan PFS 51.9 aya karşılık 22.1 ay, p=0.0071) medyan PFS'yi önemli ölçüde uzatmıştır. MABTHERA idame tedavisi ayrıca, çalışmanın indüksiyon fazında toplam sağkalım açısından CHOP'a yanıt veren hastalarda ve R-CHOP'a yanıt veren hastalarda klinik açıdan anlamlı fayda sağlamıştır.
MABTHERA idame tedavisi, bulky hastalığı olan hastalardan oluşan küçük bir alt grup haricinde test edilen cinsiyet (kadın ya da erkek), yaş (<60 ya da >60 yaş), evre (III, IV), WHO performans durumu (0 ya da >0), B semptomları (mevcut ya da değil), kemik iliği tutulumu (var ya da yok), IPI (0-2 ya da 3-5), FLIPI skoru (0-1 ya da 2 ya da 3-5), ekstra nodal bölgelerin sayısı (0-1 ya da >1), nodal bölgelerin sayısı (<5 ya da >5), önceki rejimlerin sayısı (1 ya da 2), ilk tedaviye verilen en iyi yanıt (TY/KY ya da NC/PD), hemoglobin (<12 g/dL ya da >12 g/dL), P2-mikroglobulin (<3 mg/L ya da >3 mg/L), LDH (artmış ya da artmamış) gibi alt grupların daimi faydasını sağlamıştır.
Randomize, açık tasarımlı bir çalışmada, difüz büyük B hücreli lenfoması olan önceden tedavi görmemiş, yaşları 60 ile 80 arası değişen 399 hastaya, sekiz siklus boyunca her üç haftada bir standart CHOP kemoterapisi (1. günde siklofosfamid 750 mg/m2, doksorubisin 50 mg/m , vinkristin 1.4 mg/m ile maksimum 2 mg'a kadar ve 1-5. günlerde prednizolon 40 mg/m2/gün) veya 375 mg/m2 MABTHERA + CHOP (R-CHOP) verilmiştir. MABTHERA tedavi siklusunun birinci gününde uygulanmıştır.
Nihai etkinlik analizi randomize edilen tüm hastaları (197 CHOP, 202 R-CHOP) kapsamıştır ve ortalama izleme süresi yaklaşık 31 aydır. İki tedavi grubu, başlangıç düzeyi özellikleri ve hastalık durumu bakımından iyi dengelenmiştir. Nihai analiz, R-CHOP tedavisinin olaysız geçen sağkalım süresini (primer etkinlik parametresi, buradaki olaylar ölüm, nüks veya lenfoma ilerlemesi ya da yeni bir anti-lenfoma tedavisinin tesis edilmesidir) önemli oranda uzattığını doğrulamıştır (p=0.0001). Medyan olaysız sağkalım süresine ilişkin Kaplan-Meier tahminlerine göre, CHOP kolundaki 13 ay ile, R-CHOP kolunda 35 ayın karşılaştırılması riskin %41 azaldığını göstermektedir. 24. ayda, genel sağkalıma ilişkin tahminler CHOP kolundaki %57.4'lük orana kıyasla R-CHOP kolunda %68.2 olarak bulunmuştur. Medyan 60 aylık izleme süresi ile gerçekleştirilen daha sonraki bir genel sağkalım süresi analizi, R-CHOP tedavisinin CHOP tedavisinden daha yararlı olduğunu doğrulamış (p=0.0071) ve riskin %32 azaldığını göstermiştir.
Tüm sekonder parametrelerin analizi (yanıt oranları, progresyonsuz sağkalım, hastalıksız sağkalım, yanıt süresi), CHOP ile karşılaştırıldığında R-CHOP tedavisinin etkisini doğrulamıştır. 8. siklusdan sonra tam yanıt oranı, R-CHOP grubunda %76.2 ve CHOP grubunda %62.4 bulunmuştur (p=0.0028). Hastalığın ilerleme riski %46 ve nüks riski %51 oranında azaltılmıştır.
Tüm hasta alt gruplarında (cinsiyet, yaş, yaşa göre ayarlanmış IPI, Ann Arbor evresi, ECOG, Beta 2 Mikroglobulin, LDH, Albümin, B-semptomları, geniş hacimli hastalık, ekstranodal hastalık, kemik iliği tutulumu), olaysız sağkalım ve genel sağkalıma ilişkin risk oranları (R-CHOP'ye karşılık CHOP) sırasıyla 0.83 ve 0.95'den daha az bulunmuştur. Yaşa göre ayarlanmış IPI'ye göre R-CHOP, hem yüksek hem de düşük risk taşıyan hastalarda, sonuçta ulaşılan iyileşme düzeyiyle ilişkili bulunmuştur.
Daha önce tedavi edilmemiş ve relaps/refrakter kronik lenfositik lösemi
Açık etiketli randomize iki çalışmada, daha önce tedavi görmemiş toplam 817 KLL hastası ve 552 relaps/refrakter KLL hastası, 6 kür için 4 haftada bir FC kemoterapi (fludarabin 25mg/m , siklofosfamid 250 mg/m , 1-3. günler) veya FC ile kombinasyon halinde MABTHERA (R-FC) alacak şekilde randomize edilmiştir. MABTHERA, ilk kür sırasında kemoterapiden bir gün önce 375 mg/m dozunda ve sonraki her tedavi kürünün 1. gününde 500 mg/ m2 dozunda uygulanmıştır. Etkililik için birinci basamak çalışmasında (Tablo 5) ve (Tablo 6) toplam 810 hasta (403 R-FC, 407 FC), relaps/refrakter çalışmada da (Tablo 7) 552 hasta (276 R-FC, 276 FC) analiz edilmiştir.
Birinci basamak çalışmasında, 20.7'lik medyan gözlem süresi sonunda, medyan progresyonsuz sağkalım (primer sonlanım noktası) R-FC grubunda 40 ay iken FC grubunda 32 aydır (p <0.0001, log-rank testi) (Tablo 8). Genel sağkalım analizi, R-FC kolu (p=0.0427, log-rank testi) lehine iyileşmiş bir sağkalım göstermiştir. Bu sonuçlar uzun süreli takip ile de konfirme edilmiştir; 48.1 aylık medyan gözlem süresi sonunda, medyan PFS R-FC grubunda 55 ay ve FC grubunda 33 aydır (p <0.0001, log-rank testi),
genel sağkalım analizi, yalnızca FC kemoterapisi kullanılan kola göre, R-FC kolu lehine belirgin bir fayda göstermeye devam etmiştir (p=0.0319, log-rank testi). PFS açısından fayda, başlangıçtaki hastalık riskine göre analiz edilen hasta alt gruplarının çoğunda tutarlı olarak gözlenmiştir (örneğin Binet A-C evreleri) ve uzun süreli takip ile konfirme edilmiştir (Tablo 6).
Tablo 5 Kronik lenfositik löseminin birinci basamak tedavisi - Tek başına
FC'ye kıyasla MABTHERA artı FC için etkinlik sonuçlarına genel
bakış (medyan gözlem süresi 20.7 ay) | ||||
Etkinlik Parametresi |
Olaya K Süre i( |
adar Geçen M çin Kaplan-M |
edyan[eier |
Risk oranı |
|
|
FC(n=407) |
c:(n=403) |
Log-sıra p değeri |
|
|
Progresyonsuz sağkalım (PFS) |
32.2 (32.8)*** |
39.8 (55.3)*** |
< 0.0001 (< 0 0001)*** |
0.56 (0.55)*** |
|
Genel Sağkalım |
NR (NR)*** |
NR (NR)*** |
0.0427 (0.0319)*** |
0.64 (0 73)*** |
|
Olaysız Sağkalım |
31.1 (31.3)*** |
39.8 (51.8)*** |
< 0.0001 (< |
0.55 (0.56)*** |
|
Cevap oranı (TY, nKY veya KY) TY oranları Cevap süresi (DoR) Hastalıksız sağkalım (DFS)** Yeni KLL tedavisine kadar geçen süre |
%72.7 %17.2 34.7 (36.2)*** NR (48.9)*** NR (47.2)*** |
%86.1 %36.0 40.2 (57.3)*** NR (60.3)*** NR (69.7)*** |
^ 0.0001 <0.0001 0.0040 (< 0.7^82 (0.0520)*** 0.0052 (< |
n.a. n.a. 0.61 (0.56)*** 0.93 (0.69)*** 0.65 (0.58)*** |
*: Yalnızca TY, nKY veya KY elde edilen hastalar için tedavi sonu yanıtı olarak geçerlidir;
**: Yalnızca TY elde edilen hastalar için tedavi sonu yanıtı olarak geçerlidir;
***: Parantez içindeki rakamlar 48.1 aylık medyan gözlem süresine tekabül eder (ITT popülasyonu: 409 FC, 408 R-FC)
Binet evresine gore (ITT) progresyonsuz sağkalım risk oranı-medyan gözlem süresi 20.7 ay
Progresyonsuz sağkalım (PFS) |
Hasta sayısı |
Risk oranı (%95 CI) |
Log-Rank p değeri | |
FC |
R-FC | |||
|
Binet Evre A |
22 |
18 |
0.13 (0.03; 0.61) |
0.0025 |
|
|
(22)* |
(18)* |
(0.39(0.15; 0.98))* |
(0.0370)* |
|
Binet Evre B |
257 |
259 |
0.45 (0.32; 0.63) |
<0.0001 |
|
|
(259)* |
(263)* |
(0.52 (0.41; 0.66))* |
(<0.0001)* |
|
Binet Evre C |
126 |
125 |
0.88 (0.58; 1.33) |
0.5341 |
|
|
()* |
()* |
())* |
()* |
Tablo 6
*Kalın parantez içindeki değerler 48.1 aylık medyan gözlem süresine karşılık gelir (ITTpopülasyonu: 409 FC, 408 R-FC)
Relaps/refrakter kronik lenfositik lösemi
Relaps/refrakter çalışmada, R-FC grubunda medyan progresyonsuz sağkalım (primer sonlanım noktası) 30.6 ay iken FC grubunda 20.6 aydır (p = 0.0002, log-rank testi). PFS açısından fayda, başlangıçtaki hastalık riskine göre analiz edilen hasta alt gruplarının çoğunda gözlenmiştir. R-FC kolunda FC koluna kıyasla, genel sağkalımda (OS) az fakat belirgin olmayan bir artış bildirilmiştir.Tablo 7 Relaps/refrakter kronik lenfositik löseminin tedavisi - Tek başına FC'ye kıyasla MABTHERA-FC için etkinlik sonuçlarına genel bakış (medyan gözlem süresi 25.3 ay)
Olaya Kadar Geçen Medyan Süre için Kaplan-Meier _Tahmini (Ay) ^_
Risk
Azaltımı
Etkinlik Parametresi
FC
(n=276)
R-FC
(n=276)
Log-sırap değeri
Progresyonsuz sağkalım (PFS)
%35
20.6
50.6
0.0002
Genel Sağkalım
%17
51.9
0.2874
ulaşılamadı
Olaysız Sağkalım
%36
19.3
28.7
0.0002
Yanıt oranı (TY, nKY veya KY)
%58.0
%13.0
27.6
42.2
34.2
%13.0
27.6
42.2
34.2
TY
oranları
Yanıt süresi*
Hastalıksız sağkalım (DFS)** Yeni KLL tedavisine kadar geçen süre
%69.9
0.0034
0.0007
0.0252
0.8842
0.0024
0.0007
0.0252
0.8842
0.0024
%24.3
39.6
39.6
ulaşılamadı
uygulanabilir
değil
uygulanabilir
değil
%31
-%6
%35
Yanıt oranı ve TY oranları Ki-kare Testi kullanılarak analiz edilmiştir
*: Yalnızca TY, nKY, KY elde edilen hastalar için geçerlidir **: Yalnızca TY elde edilen hastalar için geçerlidir
KLL hastalarının tedavisinde diğer kemoterapi rejimleriyle (CHOP, FCM, PC, PCM, bendamustin ve kladribin dahil) kombinasyon halinde MABTHERA kullanılan diğer destekleyici çalışmalardan elde edilen sonuçlara göre, yüksek genel yanıt oranları ile birlikte anlamlı PFS değerleri elde edilirken, tedavi ile ilişkili toksisitede anlamlı artış gözlenmemiştir.
Romatoid artrit
MABTHERA'nın romatoid artritin belirti ve semptomlarını gidermedeki etkinliği üç pivotal, faz III, randomize, plasebo-kontrollü, çift-kör, çok merkezli çalışma ile ortaya konmuştur. ACR (American College of Rheumatology) kriterlerine göre şiddetli aktif RA tanısı konmuş hastalar çalışmaya uygun kabul edilmiştir. MABTHERA, 15 gün arayla iki IV infüzyon olarak uygulanmıştır. Her kürden önce 100 mg metilprednizolon IV infüzyonu yapılmıştır. Tüm hastalar eşzamanlı oral metotreksat almıştır. Ayrıca, WA17042 çalışmasında, tüm hastalar 2-7. günlerde ve birinci infüzyonun ardından 8 ila 14. günlerde eşzamanlı oral glukokortikoid almıştır.Yeniden tedavi kriterleri çalışmalar arasında farklılık göstermiş ve iki yaklaşımdan biri kullanılmıştır; bunlar, hastaların DAS28 remisyonunda (yani DAS28-ESR >2.6) değillerse 6 ayda birden daha sık tedavi edilmedikleri Remisyona Kadar Tedavi ve hastalık aktivitesine ve/veya klinik semptomların geri dönmesine (şiş ve hassas eklem sayıları >8) dayalı ve 16 haftada birden daha sık tedavi edilmedikleri Gerektiğinde Tedavi (PRN Tedavi) stratejisidir.
WA17042 çalışması bir veya daha fazla TNF inhibitörü tedavisinde yetersiz yanıt alınan (TNF-IR) ya da bu tedavileri tolere edemeyen 517 hastanın dahil edildiği bir çalışmadır. Birincil sonlanım noktası, 24. haftada ACR20 düzeyinde cevap veren hasta oranıdır. Hastalar 15 gün ara ile 2x1000 mg MABTHERA veya plasebo almışlardır. Uzun vadeli sonlanım noktaları için hastalar, 56. haftadaki radyografik inceleme de dahil olmak üzere, 24. haftanın sonrasında da takip edilmişlerdir. Bu süre içinde çalışma protokolünün açık etiketli olması nedeniyle hastalar ilave MABTHERA kürleri alabiliyorlardı. Açık etiketli çalışmada hastalar Gerektiğinde Tedavi (PRN Tedavi) kriterine göre ilave kürler almışlardır.
WA17045 çalışması metotreksata yetersiz cevap veren (MTX-IR) ve daha önce biyolojik tedavi almamış 512 hastayı içermiştir. Birincil sonlanım noktası, 24. haftada ACR 20 cevabı elde edebilen hastaların oranı olarak belirlenmiştir. Hastalar plasebo veya 2 x 500 mg ya da 2 x 1000 mg MABTHERA infüzyonu almıştır. Hastalar 24. haftadan sonra uzun süreli son noktalar için takip edilmiş ve Remisyona Kadar Tedavi kriterlerine dayanarak ilave MABTHERA kürleri alabilmişlerdir. 48. haftada bir aktif doz karşılaştırması yapılmıştır
Hastalık Aktivitesi Bulguları
Bu çalışmalarda, MABTHERA (2 kere 1000 mg dozunda uygulanan), ACR (American College of Rheumatology) skorunda en az %20 iyileşme olan hasta oranını, sadece metotreksat alan hastalara oranla anlamlı derecede artırmıştır (Tablo 4). Tüm geliştirme çalışmalarında, tedavinin faydası, yaş, cinsiyet, vücut yüzey alanı, ırk ve önceki tedavi sayısı ya da hastalık statülerinden bağımsız olarak benzer bulunmuştur. Hastalıkla ilgili oto antikorlara (RF ve/veya anti CCP) seropozitif olan hastalar, çalışmalar arasında tek başına MTX'e kıyasla tutarlı biçimde yüksek etkililik sergilemiştir. Seropozitif hastalardaki etkililik, etkililiğin az olduğu seronegatif hastalarda gözlenenden yüksektir.
ACR yanıtının tüm bireysel komponentleri için (yumuşak ve ödem gelişimli eklem sayımları, hasta ve hekim global değerlendirmeleri, fonksiyonel özürlülük skorları (HAQ), ağrı değerlendirmesi ve CRP (mg/dL)) klinik ve istatistik olarak anlamlı gelişim kaydedilmiştir.
Tablo 8 ACR Yanıtlarının Çapraz Çalışma Karşılaştırmaları (Tüm Tedavi Popülasyonu - ITT)
|
|
Zaman |
ACRYanıtı |
Plasebo+ MTX |
Rituksimab+ MTX (2 x 1000 mg) |
|
WA17042 Çalışması (TNF-IR) |
24 Hafta |
ACR20 ACR50 ACR70 |
n= 201 36 (%18) 11 (%5) 3 (%1) |
n= 298 153 (%51)*** 80 (%27)*** 37 (%12)*** |
|
WA17045 Çalışması (MTX-IR) |
24 Hafta |
ACR20 ACR50 ACR70 |
n= 172 40 (%23) 16 (%9) 9 (%5) |
n= 170 86 (%51)*** 44 (%26)*** 17 (%10) |
Primer sonlanım noktasında plaseboya göre belirgin farklılık: *p <0.05, ** p<0.001, ***p değeri <0.0001
MABTHERA ile tedavi gören hastalardaki hastalık aktivite skoru (DAS28) sadece metotreksat ile tedavi gören hastalara oranla anlamlı düzeyde daha yüksek olmuştur. İyi ila orta düzey arasında değişen EULAR yanıtı (tedavi etkinliğinin gelişimsel + durumsal analiz skoru), sadece metotreksat ile tedavi gören hastalara oranla, anlamlı düzeyde daha fazla olarak MABTHERA ile tedavi gören hastalardan alınmıştır (Tablo 8).Tablo 9 DAS28-ESR ve EULAR Yanıtlarının Çapraz Çalışma Karşılaştırmaları (Tüm Tedavi Popülasyonu - ITT)
|
|
Plasebo+ MTX |
Rituksimab + MTX (2 X 1000 mg) |
WA17042 Çalışması (TNF-IR)24. haftada DAS28'de değişim |
|
|
|
n |
n=201 |
n=298 |
|
Ortalama değişim |
-0.4 |
-1 9*** |
|
EULAR yanıtı (24. hafta) |
|
|
|
n |
n=201 |
n=298 |
|
Orta düzeyde |
%20 |
%50*** |
|
İyi düzeyde |
%2 |
%15*** |
WA17045 Çalışması (MTX-IR)24. haftada DAS28'de değişim |
|
|
|
n |
n=171 |
n=168 |
|
Ortalama değişim |
-0.8 |
-1.7*** |
|
EULAR yanıtı (24. hafta) |
|
|
|
n |
n=172 |
n=170 |
|
Orta düzeyde |
%29 |
%51*** |
|
İyi düzeyde |
%5 |
%12*** |
Primer sonlanım noktasında plaseboya göre belirgin farklılık: *p <0.05, n p<0.001, mp değeri <0.0001Eklem Hasarının inhibisyonu
WA17042 ve WA17047 çalışmalarında, yapısal eklem hasarı radyografik olarak değerlendirilmiş ve modifiye Total Sharp Skorunda (TSS) ve bileşenleri olan erozyon skoru ve eklem aralığı daralma skorunda değişim olarak ifade edilmiştir.MABTHERA ile kombine halde metotreksat kullanan TNF-IR hastalarda yürütülen WA17042 çalışması, bu hastaların 56. haftada, yalnızca metotreksat kullanan gruba göre belirgin olarak daha az radyografik ilerleme kaydettiklerini göstermiştir. 56. haftanın sonrasında da MABTHERA alan hastalarda erozif ilerleme görülmeme durumu daha yüksek orandadır.
Daha önce MTX almamış hastalarda yürütülen WA17047 çalışması
(8 hafta ila dört yıl süre arasında erken romatoid artriti bulunan 755 hasta)
, birincil hedef olarak yapısal eklem hasarının önlenmesini değerlendirmiştir (bkz. 4.4 Özel kullanım uyarıları ve önlemleri). Hastalar, plasebo, 2 x 500 mg veya 2 x 1000 mg MABTHERA infüzyonu almışlardır. Hastalar, 24. haftadan itibaren Remisyona kadar Tedavi kriterine göre ilave MABTHERA kürleri (veya 104. haftaya kadar plasebo) alabilmişlerdir. Modifiye Total Sharp Skorundaki (TSS) değişim olarak belirlenen birincil sonlanım noktası, metotreksat ile kombinasyon halinde 2 x 1000 mg dozda MABTHERA tedavisinin, plasebo + MTX'e kıyasla, eklem hasarı progresyonu oranını 52 haftada anlamlı oranda düşürdüğünü göstermiştir (Tablo 9). PJD'deki düşüşün başlıca temeli Erozyon Skorunda değişimdeki anlamlı düşüştür.Progresif eklem hasarı oranının inhibisyonu uzun sürede gözlenmiştir. WA17042 çalışmasında 2. yıldaki radyografik analiz, tek başına MTX alanlara kıyasla, MABTHERA (2 x 1000mg) + MTX alan hastalarda eklem hasarında progresyonun anlamlı oranda düşük olduğunu ve ayrıca 2 yıllık dönemde hiç eklem hasarı progresyonu olmayan hasta sayısının anlamlı oranda daha yüksek olduğunu göstermiştir. PJD'deki düşüşün başlıca temeli Erozyon Skorunda değişimdeki anlamlı düşüştür.
Progresif eklem hasarının inhibisyonu uzun dönem olarak da gözlenmiştir. WA17042 çalışmasında 2. yıldaki radyografik analiz, tek başına MTX alanlara kıyasla, MABTHERA (2 x 1000mg) + MTX alan hastalarda eklem hasarında progresyonun anlamlı oranda düşük olduğunu ve ayrıca 2 yıllık dönemde hiç eklem hasarı progresyonu olmayan hasta sayısının anlamlı oranda daha yüksek olduğunu göstermiştir.
Tablo 10 WA17042 ve WA17047 çalışmalarında 1. yıldaki radyografik sonuçlar
(MITT Popülasyonu)
|
|
Plasebo+MTX |
RTX+MTX(2 x l000mg) |
WA17042 çalışması (TNF-IR) |
n=184 |
n=273 |
|
Başlangıca göre Ortalama Değişim: |
|
|
Modifiye Total Sharp Skoru |
2.30 |
1.01* |
Erozyon Skoru |
1.32 |
0.59* |
Eklem Aralığı Daralması Skoru |
0.98 |
0.41** |
|
Radyografik değişim olmayan hastaların oranı |
%46 |
%53BD |
|
Eroziv değişim olmayan hastaların oranı |
%52 |
%60 BD* |
WA17047 çalışması (MTX almamış) |
n=232 |
n=244 |
|
Başlangıca göre Ortalama Değişim: |
|
|
Modifiye Total Sharp Skoru |
1.079 |
0.359** |
Erozyon Skoru |
0.738 |
0.233*** |
Eklem Aralığı Daralması Skoru |
0.341 |
0.126 |
|
Radyografik değişim olmayan hastaların oranı |
%53 |
%64* |
|
Eroziv değişim olmayan hastaların oranı |
%55 |
%67* |
Radyografik sonuçlar WA17047 çalışmasında 52. Haftada ve WA17042 çalışmasında 56. Haftada değerlendirilmiştir. WA17042 çalışmasında başlangıçta plasebo + MTX'e randomize edilen 150 hasta, bir yıl dolduğunda en az bir kür RTX + MTX almıştır. * p <0.05. n p <0.001. m p <0.0001, BD: Belirgin değil (NS: Non Significant)
Yaşam Kalitesi Bulguları
MABTHERA ile tedavi gören hastalar, tüm hasta bildirim sonuçlarında (HAQ-DI; FACIT-Yorgunluk ve SF-36 formları) bir gelişim kaydetmişlerdir. Sadece metotreksat ile tedavi gören hastalara oranla, MABTHERA ile tedavi gören hastalarda fonksiyonelözürlülük indeksi (HAQ-DI) ve yorgunlukta (FACIT-Yorgunluk) anlamlı düzeyde azalmalar ve SF-36'nın hem fiziki hem mental sağlık alanlarında gelişim gözlenmiştir.
Tablo 11 HAQ-DI ve FACIT-Yorgunluk yanıtlarının çalışmalar arası karşılaştırması
|
|
Plasebo+MTX1 |
RTX+MTX1 (2 x 1000mg) |
WA17042 çalışması (TNF-IR) |
n=201 |
n=298 |
24. haftada HAQa |
-0.1 |
-0 4*** |
24. haftada HAQ MCID elde eden hastaların %'si |
%20 |
%51 |
24. haftada FACIT-Yorgunlukta ortalama değişim |
-0.5 |
-9 1*** |
WA17045 çalışması (MTX-IR) |
n=172a |
n=170P (168)b |
24. haftada HAQa |
-0.21 |
-0.42*** |
24. haftadaHAQMCID elde eden hastaların %'si |
%48 |
%58 |
24. haftada FACIT- Yorgunlukta b |
2.7 |
6.4*** |
a
Birincil sonlanım noktasında plaseboya göre anlamlı fark: * p <0.05, **p <0.001 ***p <0.0001
(Kategorik değişim için CMH testi, ortalama değişim için ANOVA, ayarlanmamış ortalama değişimler
gösterilmektedir).
Tablo 12 Kısa Form Sağlık Anketinin çalışmalar arası karşılaştırmaları (SF-36)
|
|
Plasebo+MTX |
RTX +MTX(2 x 1000mg) |
WA17042 çalışması (TNF-IR) |
n=197 |
n=294 |
|
Fiziksel sağlık |
|
|
24. haftada ortalama değişim |
0.9 |
5 8*** |
24. haftada MCID elde eden hastaların % 'si |
%13 |
%48*** |
|
Akıl sağlığı |
|
|
24. haftada ortalama değişim |
1.3 |
4 7** |
24. haftada MCID elde eden hastaların % 'si |
%20 |
%38** |
WA17045 çalışması (MTX-IR) |
n=147 |
n=155 |
|
Fiziksel sağlık |
|
|
24. haftada ortalama değişim |
2.7 |
5 9*** |
24. haftada MCID elde eden hastaların % 'si |
%31 |
%48 |
|
Akıl sağlığı |
|
|
24. haftada ortalama değişim |
2.1 |
4 4** |
24. haftada MCID elde eden hastaların % 'si |
%24 |
%35* |
MCID = akıl sağlığı skorunda >6.33 ve fiziksel sağlık skorunda >5.42'lik yükselmeyle açıklanan minimum klinik olarak anlamlı fark, değerlendirilebilir hasta sayısına dayanarak hastaların %'si (N)
Birincil sonlanım noktasında plaseboya göre anlamlı fark: * p <0.05, **p <0.001 ***p <0.0001 (kategorik değişim için CMH testi, ortalama değişim için ANOVA- ayarlanmamış ortalama değişimler gösterilmektedir)
Laboratuvar Değerlendirmeleri
Klinik çalışmalarda, test edilen romatoid artrit hastalarının yaklaşık %10'unda HACA (İnsan Anti-Kimerik Antikoru) pozitif bulunmuştur. HACA'nın görülmesi, bu hastaların büyük çoğunluğunda klinik kötüleşme ya da müteakip infüzyonlara karşı reaksiyon riski artışı ile ilişkilendirilmemiştir. HACA'nın varlığı, müteakip kürlerin ikinci infüzyonundan sonra infüzyon veya allerjik reaksiyonların kötüleşmesi ve ilave tedavi kürlerinin alımından sonra nadiren gözlenen B hücrelerinin sayısının azalmasının sağlanamaması durumu ile ilişkilendirilebilir.Romatoid faktör (RF) pozitif olan hastalarda, her üç çalışmadaki rituksimab tedavisini takiben RF konsantrasyonlarında aşağıdaki şekilde işaretli azalmalar gözlenmiştir (%45-64 aralığında, Şekil 1).
Şekil 1. Çalışma 1'de Toplam RF Konsantrasyonunun Zaman Göstergeli Yüzde Değişimi (Tedaviye Alınan Tüm Popülasyon-ITT; RF-Pozitif Hastalar)
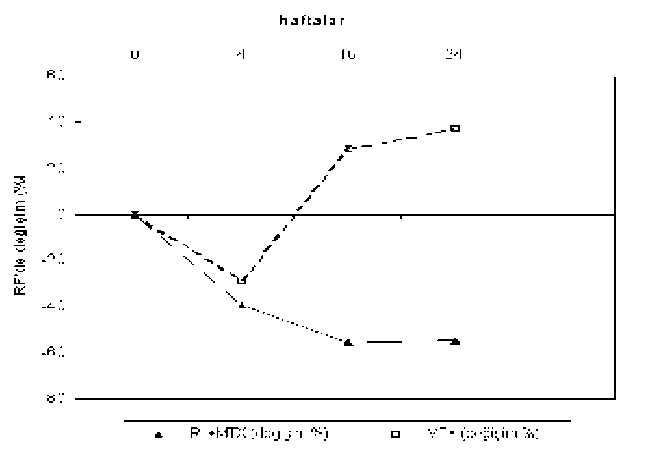 MABTHERA tedavisini takiben, tedavinin ilk dört haftasındaki lökosit sayımlarının normal sınırların altına geçici olarak düşmesi haricinde, toplam plazma immünoglobulin konsantrasyonları, toplam lenfosit sayımları ve lökositler genel olarak normal sınırlarda kalmıştır. Romatoid artrit hastalarında, IgG antijen spesifik kabakulak, rubella, varisella, tetanoz toksini, influenza ve streptococcus pneumococci antikor titrasyonları, MABTHERA'ya uygulamasını takip eden 24 hafta boyunca sabit kalmıştır.
MABTHERA tedavisini takiben, tedavinin ilk dört haftasındaki lökosit sayımlarının normal sınırların altına geçici olarak düşmesi haricinde, toplam plazma immünoglobulin konsantrasyonları, toplam lenfosit sayımları ve lökositler genel olarak normal sınırlarda kalmıştır. Romatoid artrit hastalarında, IgG antijen spesifik kabakulak, rubella, varisella, tetanoz toksini, influenza ve streptococcus pneumococci antikor titrasyonları, MABTHERA'ya uygulamasını takip eden 24 hafta boyunca sabit kalmıştır.Rituksimabın bir grup biyomarkör üzerindeki etkisi bir klinik çalışmaya dahil olan hastalarda değerlendirilmiştir. Bu alt çalışma, inflamasyon markörleri [İnterlökin 6, C Reaktif protein, Serum amiloid tip A protein, Protein S100 izotip A8 ve A9], otoantikor (RF ve anti-siklüs sitrülinat peptid immünoglobulin) üretimi ve kemik döngüsü [osteokalsin ve prokolajen 1 N terminal peptid (P1NP)] de aralarında olmak üzere, tek kür rituksimab tedavisinin biyokimyasal markör seviyeleri üzerindeki etkisini değerlendirmiştir. Metotreksat monoterapisi ile karşılaştırıldığında, rituksimab tedavisi hem monoterapide, hem de metotreksat veya siklofosfamid ile kombine edildiğinde inflamasyon markörlerini ilk 24 haftalık takip süresi boyunca anlamlı oranda azaltmıştır. Metotreksat monoterapisi ile karşılaştırıldığında, rituksimab gruplarında kemik döngüsü markörleri olan osteokalsin ve P1NP seviyeleri anlamlı düzeyde artmıştır.
Çoklu Kür Tedavileri İle Uzun Süreli Etkililik
Klinik çalışmalarda hastalar, Remisyona Kadar Tedavi veya Gerektiğinde Tedavi stratejisine göre yeniden tedavi edilmiştir. Tekrarlanan MABTHERA kürleri, tedavi stratejisinden bağımsız olarak, tedavi faydasını sürdürmüş veya artırmıştır (Remisyona Kadar Tedavi veya Gerektiğinde Tedavi) (Şekil 2). Bununla birlikte, zaman içinde ACRn, DAS28-ESR ve HAQ-DI skorlarıyla gösterildiği gibi, Remisyona Kadar Tedavi genellikle daha iyi cevaplar ve hastalık aktivitesinin daha sıkı kontrolünü sağlamıştır. Gerektiğinde Tedavi alan hastalar kürler arasında geri dönen hastalık semptomları da yaşamıştır, bu durum her kürden önce DAS28-ESR skorlarının tedavi öncesi düzeylere yakın olmasıyla kanıtlanmıştır (Tablo 9).Tablo 13 Hastalık Aktivitesi Parametreleri için Her Kür Öncesinde Başlangıç Değerleri
Popülasyon |
Parametre |
C1 |
C2 |
C3 |
C4 |
C5 |
RemisyonaKadarTedavi |
|
n=236 |
n=218 |
n=198 |
n=156 |
n=83 |
Ortalama BL DAS |
6.6 |
4.9 |
4.6 |
4.6 |
4.7 | |
Medyan BL ACRn |
- |
22.7 |
25.5 |
26.5 |
26.3 | |
Gerektiğindetedavi |
|
N=257 |
N=182 |
N=139 |
N=85 |
N=39 |
Ortalama BL DAS |
6.7 |
6.2 |
6.2 |
5.9 |
6.0 | |
Medyan BL ACRn |
- |
-5.3 |
-11.1 |
-10.9 |
-4.2 |
ACRn'de pozitif değişim: ilerleme BL= başlangıç (baseline)
Şekil 2
Tedavi Kriterine (MTX-IR Popülasyonu) Göre Zaman içindeki Ortalama ACRn Grafiği
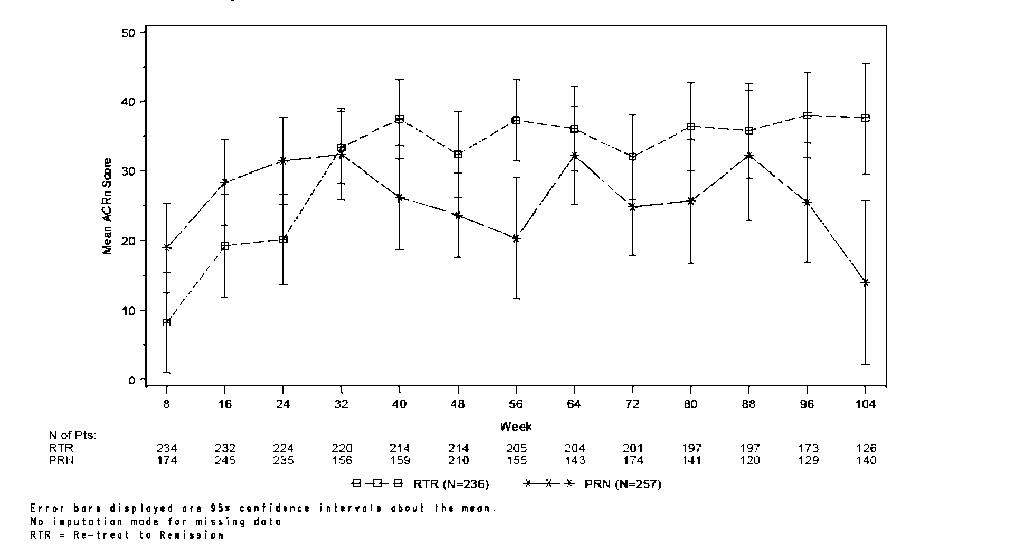
5.2 Farmakokinetik özellikler
Emilim
:Uygulama şekli nedeniyle veri yoktur.
Biyotransformasyon:
Uygulama şekli nedeniyle veri yoktur.
Dağılım ve Eliminasyon:
Hodgkin-dışı lenfoma
Tek bir ajan olarak ya da CHOP tedavisi ile kombinasyonda rituksimabın tek ya da çoklu infüzyonlarını alan 298 NHL hastasının farmakokinetik analizine dayanarak, muhtemelen B hücreleri ya da tümör yükünün katkıda bulunduğu spesifik olmayan klerensin (KL1), spesifik klerensin (KL2) tipik hasta grubu tahminleri ve santral dağılım hacmi (V1), sırasıyla 0.14 L/gün, 0.59 L/ gün ve 2.7 L'dir. Rituksimab'ın tahmin edilen medyan terminal eliminasyon yarı ömrü 22 gündür (aralık, 6.1 ila 52 gün). Rituksimabın, 4 haftalık dozlar halinde 375 mg/m2 i.v. infüzyon olarak verildiği 161 hastadan elde edilen verilerde KL2'sindeki değişkenliğin bir kısmına başlangıç CD19-pozitif hücre sayısı ve ölçülebilir tümör lezyonlarının boyutu katkıda bulunmuştur. Daha yüksek CD19-pozitif hücre sayısı ya da tümör lezyonları olan hastaların daha yüksek KL2'si olmuştur. Bununla birlikte, CD19-pozitif hücre sayısı ve tümör lezyonu boyutu için düzeltme yapıldıktan sonra, KL2 için bireyler arası değişkenliğin büyük kısmı aynen kalmıştır. V1, vücut yüzey alanı (BSA) ve CHOP tedavisi ile değişmiştir. Sırasıyla, BSA'daki aralık (1.53 ila 2.32 m2) ve eşzamanlı CHOP tedavisinin katkıda bulunduğu V1'deki (%27.1 ve %19.0) bu değişkenlik, göreceli olarak küçüktür.
Rituksimab'ın farmakokinetiği üzerine yaş, cinsiyet, ırk ve DSÖ performans statüsünün hiçbir etkisi olmamıştır. Bu analiz, test edilen eşdeğişken faktörlerin herhangi biriyle rituksimab'ın doz ayarlamasının, farmakokinetik değişkenlikte anlamlı bir azalmayla sonuçlanmasının beklenmediğini belirtmektedir.
375 mg/m 'lik dozdaki rituksimab, daha önce rituksimab almamış olan 203 NHL hastasına 4 doz için haftada bir i.v. infüzyon olarak uygulanmıştır. Dördüncü infüzyonu takiben ortalama Cmaks 486 mikrogram/mL'dir (aralık, 77.5 ila 996.6 mikrogram/mL). Rituksimab'ın tepe ve direkt serum seviyeleri, sirkülasyondaki CD19-pozitif B hücrelerinin sayısı ve hastalık yükü ölçümleri için bazal değerleri ile ters ilişkilidir. Medyan kararlı serum seviyeleri, yanıt vermeyenlere kıyasla yanıt verenler için daha yüksektir. Serum seviyeleri, alt tip A'lılara kıyaslandığında Uluslararası Çalışma Formülasyonu (IWF) alt tip B, C ve D'li hastalarda daha yüksektir. Rituksimab son tedavinin tamamlanmasından 3-6 ay sonra hastaların serumunda saptanabilecek düzeydedir.
375 mg/m2'lik bir dozda rituksimab, NHL'li 37 hastaya 8 doz için haftada bir i.v. infüzyon olarak uygulanmıştır. Ortalama Cmaks, başarılı her bir infüzyonla artmış ve ilk infüzyondan sonra 243 mikrogram/mL'ye (aralık, 16-582 mikrogram/mL) sekizinci infüzyondan sonra ise 550 mikrogram/mL'ye (aralık, 171-1177 mikrogram/mL) çıkmıştır..
6 kür CHOP kemoterapisi ile kombinasyonda, 375 mg/m2'lik 6 infüzyon olarak uygulandığında rituksimab'ın farmakokinetik profili, tek başına rituksimab ile gözlenenle benzerdir.
Kronik Lenfositik Lösemi
Rituksimab KLL hastalarında, fludarabin ve siklofosfamid ile kombinasyon halinde, IV infüzyon olarak ilk kürde 375 mg/m2, sonraki 5 kürün her birinde 500 mg/m2'ye artırılarak uygulanmıştır. Beşinci 500 mg/m2'lik infüzyondan sonra ortalama Cmaks (n=15), 408 mikrogram/mL'dir (97-764 mikrogram/mL aralığında)
Romatoid artrit
İki hafta aralıkla uygulanan iki 1000 mg intravenöz rituksimab infüzyonunu takiben, ortalama terminal yarılanma ömrü 20.8 gün (aralık 8.58 ila 35.9 gün), ortalama sistemik klerens 0.23 L/gün (aralık 0.091 ila 0.67 L/gün) ve ortalama kararlı durum dağılım hacmi
4.6 L (aralık 1.7 ila 7.51 L) olmuştur. Aynı verilerin popülasyon farmakokinetiği analizinde, sistemik klerens ve yarılanma ömrü, benzer ortalama değerler elde edilerek, sırasıyla 0.26 L/gün ve 20.4 gün bulunmuştur. Popülasyon farmakokinetiği analizi, vücut yüzey alanı ve cinsiyetin, farmakokinetik parametrelerdeki bireysel farklılıkları açıklayan en anlamlı kovaryantlar olduğunu ortaya koymuştur. Vücut yüzey alanı uyarlamasının sonucunda, tedaviye dahil olan kadınlara oranla, erkeklerde dağılım hacmi daha yüksek ve klerens daha hızlıdır. Cinsiyete bağlı farmakokinetik farklılıklar klinik olarak anlamlı bulunmamıştır ve doz ayarlamasına gerek görülmemiştir.
İki hafta aralıkla uygulanan 500 ve 1000 mg dozlarındaki iki intravenöz rituksimab infüzyonunu takiben, ortalama Cmaks değerleri sırasıyla 183 mcg/mL (aralık 81.8 ile 279 mcg/mL) ve 370 mcg/mL (aralık 212 ile 637 mcg/mL) ve ortalama yarılanma ömrü değerleri sırasıyla 17.9 gün (aralık 12.3 ile 31.3 gün) ve 19.7 gün (aralık 12.3 ile 34.6 gün) bulunmuştur. Çoklu tedavi kürü uygulanan hastalara ilişkin farmakokinetik veri bulunmamaktadır. Anti-TNF tedavisine yeterli yanıt vermeyen popülasyonundaki farmakokinetik parametreleri, aynı dozaj rejimini (2 hafta ara ile 2 x 1000 mg i.v.) takiben, 369 mg/mL ortalama maksimum serum konsantrasyonu ve 19.2 gün ortalama terminal yarılanma ömrü değerleri ile, benzer bulunmuştur.
Hastalardaki karakteristik özellikler
Böbrek veya karaciğer yetmezliği olan hastalara ait farmakokinetik veri bulunmamaktadır.5.3 Klinik öncesi güvenlilik verileri
Veri yoktur.6. FARMASÖTİK ÖZELLİKLERİ
6.1 Yardımcı maddelerin listesi
Sodyum sitrat dihidrat: 7.35 mg/mL Sodyum klorür : 9.0 mg/ mL
Sodyum hidroksit : pH ayarı için y.m.
Polisorbat 80
Hidroklorik asit (pH ayarlaması için)
Enjeksiyonluk su
6.2 Geçimsizlikler
MABTHERA ile polivinilklorür veya polietilen torbalar veya infüzyon seti arasında geçimsizlik gözlenmemiştir.6.3 Raf ömrü
30 ay.6.4 Saklamaya yönelik özel tedbirler
Flakonları 2°-8°C'de (buzdolabında) saklayınız. Flakonları direkt güneş ışığından korumak için ambalajında saklayınız.Seyreltilmiş ürünlerin saklaması için:
Mikrobiyolojik açıdan seyreltilmiş ürünlerin hemen kullanılması gerekir. Bu ürünler hemen kullanılmazsa, seyreltme işlemi kontrollü ve valide edilmiş aseptik koşullar altında gerçekleştirilmediği takdirde kullanım sırasındaki saklama süreleri ve kullanım öncesindeki koşullar kullanıcının sorumluluğundadır ve normal olarak 2°C-8°C'de 24 saati aşmamalıdır.
6.5 Ambalajın niteliği ve içeriği
50 mL'de 500 mg rituksimab (10 mg/mL) içeren, bütil kauçuk tıpalı Tip I cam flakon.1 flakon içeren ambalajlarda.
6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
MABTHERA infüzyonları, acil uygulama için tüm resüsitasyon olanaklarının bulunduğu merkezlerde ve deneyimli bir onkolog/hematoloğun gözetimi altında uygulanmalıdır.
Romatoid artrit için üniversite ve eğitim-araştırma hastanesi immünoloji ve romatoloji kliniklerinde hastane koşullarında uygulanmalıdır.MABTHERA berrak ve renksiz bir sıvı olup steril, koruyucu maddeler içermeyen, pirojen olmayan, tek dozluk flakonlarda bulunur. Gerekli miktarda MABTHERA'yı aseptik koşullarda çekiniz ve içinde steril, pirojen bulundurmayan, %0.9'luk sodyum klorürün veya %5'lik dekstrozun sudaki çözeltisinden bulunan bir infüzyon torbasında, hesaplanmış olan 1-4 mg/mL'lik rituksimab konsantrasyonuna ulaşıncaya dek seyreltiniz. Çözeltiyi karıştırmak için, torbayı köpük oluşumunu önleyecek şekilde nazikçe ters çeviriniz.
Parenteral ilaçlar uygulanmadan önce, partiküllü maddeler ve renk değişikliğine dikkat edilmelidir.
Seyreltilen ürün fiziksel ve kimyasal olarak 24 saat süresince 2°C-8°C'de ve sonra da 12 saat süresince oda sıcaklığında stabildir.
Farmasötik ürünlerin çevreye bırakılmasından kaçınılmalıdır. İlaçlar, atık suları ve evsel atık ile imha edilmemelidir. Varsa bulunduğunuz yerdeki donanımlı atık toplama sistemlerini kullanınız.
Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği'ne uygun olarak imha edilmelidir.
7. RUHSAT SAHİBİ
Roche Müstahzarları Sanayi Anonim ŞirketiEski Büyükdere Caddesi No: 13
Güney Plaza Maslak, İstanbul
Tel: (0 212) 366 90 00 Faks: (0 212) 285 22 00
8. RUHSAT NUMARASI
112/189. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ
İlk ruhsatlandırma tarihi: 3 Nisan 2002 Ruhsat yenileme tarihi: 17 Aralık 200910. KÜB'ÜN YENİLENME TARİHİ
İlaç Bilgileri
Mabthera Roche 500 mg/50 ml i.v. infüzyon için konsantre solüsyon içeren flakon
Etken Maddesi: Rituximab
Atc Kodu: L01XC02
Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.