Sinir Sistemi » Anestezik İlaçlar » Genel Anestezikler » Opioid Anestezik İlaçlar » Fentanil KISA URUN BILGISI
1. BEŞERI TIBBI ÜRÜNÜN ADI FENTANYL 0,05 MG/ML
2 ml Enjeksiyon için Solüsyon İçeren Ampul
2. KALITATIF VE KANTİTATIF BILEŞIM
Etkin madde: Her bir ml solüsyon, 78,5 mikrogram fentanil sitrat (50 mikrogram fentanile eşdeğer) içerir.
Yardımcı madde: Her bir ml solüsyon 9 mg sodyum klorür içerir.
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTIK FORM
İntravenöz enjeksiyon için solüsyon
İntravenöz kullanım için steril, koruyucu içermeyen, izotonik, şeffaf çözelti.
4. KLİNIK ÖZELLIKLER
4.1. Terapötik endikasyonlar
FENTANYL aşağıdaki durumlarda endikedir:
- Genel ya da bölgesel anestezide narkotik analjezik katkısı olarak,
- Anestezinin indüksiyonunda bir nöroleptik ile (droperidol gibi) birlikte anestezik premedikasyon olarak ve genel ya da bölgesel anestezinin idamesinde yardımcı olarak,
- Majör cerrahi operasyona girecek yüksek riskli hastalarda oksijen ile birlikte anestezik ajan olarak.
4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi
FENTANYL dozu yaşa, vücut ağırlığına, fiziksel duruma, altta yatan patolojik koşullara, diğer ilaçların kullanımına, cerrahinin tipine ve anesteziye göre bireyselleştirilmelidir
Yaşlı ve güçten düşmüş hastalarda başlangıç dozu azaltılmalıdır. Tamamlayıcı (ek) dozlar belirlenirken başlangıç dozunun etkisi göz önünde bulundurulmalıdır.
Bradikardi oluşmasını önlemek için, indüksiyondan hemen önce düşük doz bir intravenöz anti-kolinerjik uygulanması önerilir (Bulantı ve kusmayı önlemek amacıyla droperidol verilebilir).
Genel anestezide analjezik destek olarak kullanımıDüşük doz: 2 mikrogram/kg
Düşük dozlardaki FENTANYL daha çok, küçük ancak ağrılı cerrahi uygulamalarda yararlıdır.
Orta düzey doz: 2-20 mikrogram/kg
Cerrahi uygulama daha komplike olduğunda daha yüksek dozlar gerekebilir.
Etki süresi doza bağlıdır.
Yüksek doz: 20-50 mikrogram/kg
Daha uzun süren ve stres yanıtının hastanın iyi olma haline zarar verebileceği büyük cerrahi uygulamalarda nitröz oksit/oksijen ile birlikte 20-50 mikrogram/kg FENTANYL'in hafifletici etkisi olduğu gösterilmiştir. Cerrahi operasyon sırasında bu aralıktaki dozlar kullanıldığında, uzamış post-operatif solunum depresyonu olasılığı göz önüne alınarak post-operatif ventilasyon ve izleme şarttır.
Hastanın gereksinimleri ve operasyonun tamamlanması için gerektiği tahmin edilen süreye göre 25-250 mikrogram'lık (0.5-5 ml) ek dozlar uygulanabilir.
Anestezik ajan olarak kullanımı
Cerrahi strese yanıtın hafifletilmesi özellikle önemli olduğunda, oksijen ve kas gevşetici ile birlikte 50-100 mikrogram/kg'lık dozlar uygulanabilir. Bu teknik ek anestezik ajanlar kullanımına gerek kalmaksızın anestezi sağlar. Belirli olgularda bu anestezik etkinin sağlanması için 150 mikrogram/kg'a kadar dozlar gerekebilir. FENTANYL bu biçimde miyokardın aşırı oksijen gereksiniminden korunması gereken hastalardaki açık kalp cerrahisi ve belirli başka majör cerrahi prosedürlerde özellikle kullanılmıştır.
Uygulama şekli
İntravenöz enjeksiyon yolu ile uygulanır.
Özel popülasyonlara ilişkin ek bilgiler Böbrek/Karaciğer yetmezliği
Böbrek ve karaciğer fonksiyonlarında bozukluk olan hastalarda opioidler dikkatle titre edilmelidir.
Pediyatrik popülasyon
2-12 yaşlarındaki çocuklarda indüksiyon ve idame için 2-3 mikrogram/kg doz önerilir.
Geriyatrik popülasyon
Diğer opioidlerde olduğu gibi, yaşlı ya da düşkün kişilerde başlangıç dozu azaltılmalıdır.
4.3. Kontrendikasyonlar
- İlacın etkin maddesine ya da yardımcı maddelerden herhangi birine ya da başka morfinomimetiklere karşı aşırı duyarlılık.
- Solunum depresyonu
- Obstrüktif solunum yolu hastalığı
- Safra kanalında cerrahi müdahale sonrası hastalarda kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
FENTANYL, yalnızca hava yolunun kontrol edilebildiği bir ortamda ve hava yolunu kontrol edebilen bir personel tarafından uygulanmalıdır.
Tüm güçlü opiodlerde olduğu gibi:
Solunum depresyonu dozla ilişkilidir ve nalokson gibi spesifik bir narkotik antagonisti ile geri döndürülebilir, ancak solunum depresyonunun opioid etkisinden daha uzun sürebilmesi nedeniyle daha sonra naloksonun ek dozları gerekebilir. Derin analjeziye post-operatif periyotta da kalıcı olabilen ya da nüks edebilen belirgin solunum depresyonu eşlik edebilir. Bu nedenle hastalar gerektiği şekilde izlenmelidir. Resüsitasyon ekipmanı ve narkotik antagonistler hazır bulundurulmalıdır. Anestezi sırasında hiperventilasyon, hastanın CO'e yanıtını değiştirebilir, bu da post-operatif solunumu etkiler.
Torakal kasları da kapsayan kas rijiditesi ortaya çıkabilir ancak aşağıdaki önlemlerle bundan kaçınılabilir: yavaş intravenöz enjeksiyon (düşük dozlarda genellikle yeterlidir), benzodiazepinlerle premedikasyon ve kas gevşeticilerinin kullanımı.
Non-epileptik (miyo)klonik hareketler ortaya çıkabilir.
Yeterli miktarda antikolinerjik almayan hastalarda ya da FENTANYL, vagolitik olmayan kas gevşeticilerle kombine edildiğinde bradikardi ve muhtemelen kardiyak arrest ortaya çıkabilir. Bradikardi atropinle tedavi edilebilir.
FENTANYL, yüksek dozlarda veya infüzyon ile uygulandığında anestezi sonrası bakım/derlenme odasından çıkış yapılmadan önce yeterli spontan solunumun oluşturulmuş ve sürekliliğinin sağlanmış olduğundan emin olunması zorunludur.
Tekrarlanan FENTANYL kullanımları tolerans gelişimine ve bağımlılığa yol açabilir.
Opioidler özelikle hipovolemik hastalarda hipotansiyonu indükleyebilirler. Stabil arteryel basıncın korunması için uygun önlemlerin alınması gerekir.
İntraserebral uyuncu bozulmuş olan hastalarda hızlı bolus enjeksiyonlardan kaçınılmalıdır; böyle hastalarda ortalama arteryel basınçtaki geçici düşüşe, serebral perfüzyon basıncında kısa süreli bir azalma eşlik eder.
Kronik opioid terapisinde olan ya da opioid bağımlılık öyküsü bulunan hastalarda daha yüksek doz gerekebilir.
Yaşlı ya da düşkün hastalarda dozun azaltılması önerilir. Aşağıdaki koşulların herhangi biri geçerli olan hastalarda opioidler dikkatle titre edilmelidir: Kontrol edilemeyen hipotiroidizm; pulmoner hastalık; solunum rezervinin azalması; alkolizm veya yetersiz böbrek ya da karaciğer fonksiyonu. Bu tip hastalar için daha uzun süreli post-operatif izleme gereklidir.
FENTANYL bir nöroleptik (droperidol gibi) ile birlikte uygulandığında, hasta her bir ilacın özel niteliklerinden, özellikle de etki sürelerinin farklı olabileceğinden haberdar olmalıdır. Böyle bir kombinasyon kullanıldığında hipotansiyon görülme sıklığı daha yüksektir. Nöroleptikler ekstrapiramidal semptomları indükleyebilirler ancak bu durum anti-Parkinson ajanlarla kontrol altına alınabilir.
Diğer opioidlerde olduğu gibi antikolinerjik etkilerinden dolayı fentanil uygulanması safra kanalında basıncın artmasına yol açabilir ve izole vakalarda Oddi sfinkterinde spazmlar gözlenebilir.
Myastenia gravis hastalarında, fentanil sitrat infüzyonunun da dahil olduğu genel anestezi rejimlerinin uygulanması öncesinde veya sırasında belirli antikolinerjik ajanlar ve nöromüsküler bloke edici farmasötik ajanların kullanımı ile ilgili dikkatli değerlendirme yapılmalıdır.
Doğum sırasında fentanil uygulanması neonatal solunum depresyonuna neden olabilir.
Pediatrik Kullanımı:
Solunumu normal olan bir çocukta, analjezik (ağrı kesici) teknikler sadece anestezik tekniklerin bir parçası olarak kullanılmalı veya entübasyon gerektiren göğüs duvarı sertliğine (rijiditesi) neden olabilecek ya da hava girişi desteği gerektiren soluk durması durumunda yatıştırıcı/ağrı kesici tekniğin bir parçası olarak deneyimli personel tarafından verilmelidir.
FENTANYL her dozunda 23 mg'dan daha az sodyum içerdiğinden, sodyuma bağlı herhangi bir olumsuz etki beklenmez.
Diğer ilaçların FENTANYL üzerindeki etkisi:
Barbitüratlar, benzodiazepinler, nöroleptikler, halojenik gazlar ve diğer non-selektif santral sinir sistemi (SSS) depresanları (örn. alkol) narkotiklerin neden olduğu solunum depresyonunu güçlendirebilirler.
Hastalar böyle ilaçlar aldıklarında ihtiyaç duyulan FENTANYL dozu normalden az olacaktır.
FENTANYL klerensi yüksek olan bir ilaçtır. Çoğunlukla sitokrom (CYP3A4) tarafından büyük ölçüde ve hızlı biçimde metabolize edilir. Dört gün süreyle oral yolla verilen 200 mg/gün dozunda itrakonazolün (en güçlü CYP3A4 inhibitörlerinden biri) intravenöz FENTANYL farmakokinetiği üzerinde belirgin bir etkisi olmamıştır.
Oral ritonavir (güçlü bir CYP3A4 inhibitörü) intravenöz FENTANYL klerensini üçte iki oranında azaltmıştır; ancak tek doz intravenöz FENTANYL uygulamasının ardından elde edilen maksimum plazma konsantrasyonu etkilenmemiştir. FENTANYL tek doz olarak kullanıldığında, ritonavir gibi güçlü CYP3A4 inhibitörlerinin birlikte kullanımı özel hasta bakımı ve izlenmesini gerektirir.
Flukonazol veya vorikonazolün FENTANYL ile birlikte uygulanması, FENTANYL'e maruziyette artışla sonuçlanabilir.
Sürekli tedavide, uzun süreli ya da gecikmiş solunum depresyonuna neden olabilecek FENTANYL birikiminden kaçınmak üzere doz azaltımı gerekebilir.
Genellikle herhangi bir cerrahi ya da anestezik uygulamadan 2 hafta önce monoamin oksidaz (MAO) inhibitörlerinin bırakılması önerilir. Ancak bir kaç bildirimde, MAO inhibitörü kullanmakta olan hastalardaki cerrahi ya da anestezik prosedürlerde FENTANYL'in herhangi bir olaya neden olmadığı belirtilmiştir.
FENTANYL'in diğer ilaçlar üzerindeki etkisi:
FENTANYL uygulanmasını takiben uygulanacak diğer santral sinir sistemi depresanı ilaçların dozu azaltılmalıdır.
FENTANYL ile birlikte kullanıldığında etomidatın yarılanma ömründe bir değişiklik olmamasına rağmen, total plazma klerensi ve dağılım hacmi 2 ila 3 kat azalmaktadır. FENTANYL ile birlikte uygulanan intravenöz midazolamın terminal yarılanma ömrü uzamakta ve plazma klerensi azalmaktadır. Bu ilaçların FENTANYL ile birlikte kullanılmaları durumunda, dozlarının azaltılması gerekebilir.
Fentanilin vagolitik olmayan kas gevşeticilerle kombine kullanımında, bradikardi ve muhtemelen asistol meydana gelebilir.
Fentanilin droperidol ile eş zamanlı kullanımı daha yüksek hipotansiyon insidansına neden olabilir.
Simetidin ile ön tedavi veya simetidinin eş zamanlı uygulanması her iki ilacın tekrar eden dozları kullanıldığında plazma fentanil seviyelerini yükseltebilir.
Kendileri bradikardiye neden olabilen beta blokerler, süksametonyum, halotan, veküronyum gibi ilaçlarla ön tedavi veya bu ilaçların eş zamanlı kullanımları ile bradikardi şiddetlenebilir.
4.6. Gebelik ve Laktasyon:
Genel tavsiye
Gebelik Kategorisi: C - yüksek doz
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
FENTANYL' in gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. FENTANYL gebeliğin erken dönemlerinde plasentadan geçebilir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir(bkz. Bölüm 5.3).İnsanlara yönelik potansiyel risk bilinmemektedir. Bu nedenle FENTANYL kullanımı gereken dönemde, gerekiyorsa, uygun bir kontrasepsiyon yöntemi kullanarak gebelikten korunulmalıdır.
Gebelik dönemi
FENTANYL gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
FENTANYL'in plasentaya geçmesi ve fötal solunum merkezinin opiatlara özellikle duyarlı olması nedeniyle doğum sırasında (sezaryen de dahil olmak üzere) uygulama önerilmez (intramüsküler ya da intravenöz). Buna rağmen FENTANYL kullanılacaksa, her zaman çocuk için bir antidot bulundurulmalıdır.
Laktasyon dönemi
Fentanil anne sütüne geçmektedir. Bu nedenle ilacın uygulamasından sonraki 24 saat içinde emzirme önerilmemektedir. FENTANYL uygulamasını takiben emzirmenin risk/ fayda oranı dikkate alınmalıdır.
Üreme yeteneği/Fertilite
Dişi sıçanlarda yapılan bazı deneyler, fertilite azalmasını ve embriyo mortalitesini göstermiştir(Bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
Hastalar yalnızca, FENTANYL uygulamasının ardından yeterli zaman geçtiğinde araç ya da makine kullanmalıdır. Hastalar FENTANYL' in etkisi altındayken araç ve makine kullanmamaları ve dikkat gerektiren bir iş yapmamaları konusunda uyarılmalıdır.
4.8. istenmeyen etkilerKlinik Çalışma Verileri
IV FENTANYL' in güvenliliği ile ilgili veriler, IV FENTANYL'in anestezik bir ajan olarak kullanıldığı 20 klinik çalışmaya katılan 376 hastadan elde edilmiştir. Bu hastalar en az bir doz IV FENTANYL almışlar ve güvenlilik bilgisi sağlamışlardır. Bu çalışmalarda IV FENTANYL ile tedavi edilen hastaların %1 ya da daha fazlasında
görüldüğü araştırmacı tarafından bildirilen Advers İlaç Reaksiyonları (AİR) Tablo 1'de gösterilmektedir.
Tablo 1. FENTANYL IV ile Yürütülen 20 Klinik Çalışmaya Katılan, Hastalarda >% 1 Oranında Bildirilen FENTANYL IV ile Tedavi Edilen Advers _İlaç Reaksiyonları_
Sistem/Organ
FENTANYL IV (n=376)
%
Advers Reaksiyon
Sinir Sistemi Hastalıkları
Göz Hastalıkları
Kalp Hastalıkları
Damar Hastalıkları
Solunum Sistemi, Toraks ve Mediasten Hastalıkları
Mide-barsak Sistemi Hastalıkları
Deri ve Derialtı Dokunun Hastalıkları
Kas-iskelet ve Bağ Dokusu Hastalıkları
Hasarlanma, Zehirlenme ve İşleme Bağlı Komplikasyonlar
Bu 20 klinik çalışmada, FENTANYL IV ile tedavi edilen hastaların %1'inden azında görülen diğer AİR'leri Tablo 2'de gösterilmektedir.
Tablo 2. FENTANYL IV ile Yürütülen 20 Klinik Çalışmada Klinik FENTANYL IV ile Tedavi Edilen Hastaların %1' inden Azında Görülen Advers İlaç
_Reaksiyonları_Reaksiyonları_Reaksiyonları_
Sistem/Organ
Advers Reaksiyon_
Psikiyatrik Hastalıklar Öforik mizaç Sinir Sistemi Hastalıkları
Başağrısı
Damar Hastalıkları
Kan basıncında değişkenlikler Flebit
Solunum Sistemi, Toraks ve Mediasten Hastalıkları
Hıçkırık
Hiperventilasyon Genel Bozukluklar ve Uygulama Yeriyle İlgili Durumlar
Titreme
Hipotermi
Hasarlanma, Zehirlenme ve İşleme Bağlı Komplikasyonlar
Postoperatif ajitasyon
İşleme bağlı komplikasyon
Anestezide solunum yolu (airway) komplikasyonu
Pazarlama sonrası deneyim
FENTANYL IV ile pazarlama sonrası deneyim sırasında ilk defa bildirilen advers ilaç reaksiyonları aşağıda Tablo 3 ve 4'de verilmektedir. Her iki tabloda da sıklıklar şu tanımlamalarla verilmiştir: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1,000 ila <1/100); seyrek (>1/10,000 ila <1/1,000), çok seyrek (<1/10,000 - izole raporlar dahil).
Tablo 3'de Advers İlaç Reaksiyonları spontan bildirimlerdeki bildirilen sıklık tanımlamasına göre listelenmişken, Tablo 4'de aynı Advers İlaç Reaksiyonları eğer biliniyorsa klinik çalışmalarda veya epidemiyoloji çalışmalarında bildirilen sıklık tanımlamasına göre sunulmaktadır. Klinik çalışmalarda sıklığı geçerli bir şekilde belirlenememiş olan AİR'ları için sıklık tanımlaması olarak bilinmiyor kullanılmıştır.
Tablo 3: FENTANYL IV ile Pazarlama Sonrası Deneyimlerde Görülen Advers İlaç Reaksiyonları (Spontan Bildirimlerden Hesaplanan Sıklıklarına Göre)
İmmün Sistem Bozuklukları
Çok seyrekHipersensitivite (anafilaktik şok, anafilaktik reaksiyon ve ürtiker
gibi)
Sinir Sistemi Hastalıkları
Çok seyrekKonvülsiyon, Bilinç kaybı, Miyoklonus
Kalp Hastalıkları
Çok seyrekKardiyak arrest (aynı zamanda bkz. bölüm 4.4)
Solunum Sistemi, Toraks ve Mediasten Hastalıkları
Çok seyrekSolunum depresyonu (aynı zamanda bkz. bölüm 4.4)
Deri ve Derialtı Doku Hastalıkları
Çok seyrekKaşıntı
Tablo 4: FENTANYL IV ile Pazarlama Sonrası Deneyimlerde Görülen Advers İlaç Reaksiyonları (Klinik Çalışmalarda ya da Epidemiyolojik Çalışmalarda Hesaplanan Sıklıklarına Göre)
İmmün Sistem Bozuklukları
BilinmiyorHipersensitivite (anafilaktik şok, anafilaktik reaksiyon ve ürtiker
gibi)
Sinir Sistemi Hastalıkları
BilinmiyorKonvülsiyon, Bilinç kaybı, Miyoklonus
Kalp Hastalıkları
BilinmiyorKardiyak arrest (aynı zamanda bkz. bölüm 4.4)
Solunum Sistemi, Toraks ve Mediasten Hastalıkları
BilinmiyorRespiratuvar depresyon (aynı zamanda bkz. bölüm 4.4)
Deri ve Derialtı Doku Hastalıkları
BilinmiyorKaşıntı
Bir nöroleptik FENTANYL ile birlikte kullanıldığında aşağıdaki advers reaksiyonlar gözlenebilir: ürperme ve/veya titreme; huzursuzluk, post-operatif halüsinasyon epizodları ve ekstrapiramidal semptomlar(bkz. Bölüm 4.4).
4.9. Doz aşımı ve tedavisi
Belirti ve işaretler:
FENTANYL' in doz aşımı farmakolojik etkilerinin artması şeklinde ortaya çıkar. Bireysel hassasiyete bağlı olarak klinik tablo öncelikle solunum depresyonunun bradipneden apneye kadar değişen dereceleri ile tanımlanır.
Tedavi:
Hipoventilasyon ya da apne oluşması halinde oksijen uygulanmalı ve gereken biçimde solunuma yardımcı olunmalı ya da kontrol edilmelidir. Solunum depresyonunun kontrolünde nalokson gibi bir narkotik antagonistinin kullanımı endikedir. Bu daha acil karşı önlemlerin alınmasını gereksiz kılmaz. Solunum depresyonu antagonistin etkisinden daha uzun sürebilir; bu nedenle daha sonra antagonistin ilave dozları gerekebilir.
Solunum depresyonuna kas rijiditesi eşlik ediyorsa yardımlı ya da kontrollü solunumu kolaylaştırmak üzere bir intravenöz nöromusküler bloke edici ajan gerekebilir.
Hasta dikkatle gözlenmelidir; uygun vücut sıcaklığı ve yeterli sıvı alımı sağlanmalıdır. Hipotansiyon şiddetli ya da kalıcı ise hipovolemi olasılığı düşünülmelidir ve hipovolemi mevcutsa uygun parenteral sıvı uygulaması ile kontrol altına alınmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik Grup: Opioid Anestezikler ATC Kodu: N01AH02 Genel özellikler
FENTANYL ^-agonist farmakolojik etkileri olan sentetik bir opioidtir.
Fentanil güçlü bir narkotik analjeziktir. Fentanil, genel anesteziye ilave analjezik bir ajan olarak ya da tek başına bir anestezik ajan olarak kullanılabilir. Fentanil kardiyak stabiliteyi korur ve yüksek dozlarda strese bağlı hormonal değişimleri önler. 100 mikrogram (2.0 ml) düzeyinde bir dozun etkisi 10 mg morfinin analjezik etkisine denktir. Etkisi hızlı başlar. Bununla birlikte maksimum analjezik ve solunumu baskılayıcı etkisi bir kaç dakika içinde ortaya çıkmayabilir. Analjezik etkinin normal süresi 100 mikrogram'a kadar tek intravenöz dozdan sonra yaklaşık 30 dakikadır. Analjezinin derinliği dozla ilişkilidir ve cerrahi uygulamada ağrının düzeyine göre ayarlanabilir. Fentanilin güvenlilik sınırları geniştir. Sıçanlarda en düşük analjezi düzeyindeki LD50
Diğer narkotik analjeziklerde olduğu gibi fentanil de doz ve uygulama hızına bağlı olarak, kas rijiditesi, öfori, miyozis ve bradikardiye neden olabilir.
Köpeklerdekiin vivotestlerde olduğu gibi insanlardaki histamin deneyleri ve cilt-kabartı testi, fentanil ile klinik olarak anlamlı histamin serbestleşmesinin nadir olduğunu ortaya koymuştur.
Fentanilin tüm etkileri nalokson gibi spesifik bir narkotik antagonisti ile hızla ve tamamen geri döndürülebilir.
5.2. Farmakokinetik özellikler
Dağılım:
İntravenöz enjeksiyondan sonra fentanilin plazma konsantrasyonları hızla düşer, ardışık dağılım yarılanma ömürleri yaklaşık 1 dakika ve 18 dakikadır, terminal eliminasyon yarılanma ömrü ise 475 dakikadır. Fentanilin Vc
Biyotransformasyon:
Fentanil başlıca karaciğerde CYP3A4 enzimiyle hızla metabolize edilir. Başlıca metaboliti norfentanildir. Fentanilin klerensi 574 ml/dakikadır.
Eliminasyon:
Uygulanan dozun yaklaşık %75'i 24 saat içinde atılır ve yalnızca %10'u değişmemiş ilaç olarak idrarla atılmaktadır.
Hastalardaki karekteristik özellikler
Çocuklar:
Fentanilin yeni doğan bebeklerdeki plazma proteinlerine bağlanma oranı yaklaşık %62'dir ve erişkinlerdekinden düşüktür. Süt çocukları ve çocuklarda klerens ve dağılım hacmi daha yüksektir. Bu durum, FENTANYL için daha fazla doz gereksinimine neden olabilir.
Yanığı olan erişkin hastalar:
Fentanilin klerensinde olan %44'e varan bir artışla beraber daha geniş bir dağılım hacmi, ilacın plazma konsantrasyonlarında azalmayla sonuçlanır. Bu durum FENTANYL'in dozunun arttırılmasını gerektirebilir.
5.3. Klinik öncesi güvenlilik verileri
Diğer opioid analjeziklerle olduğu gibi,in vitrofentanil, memeli hücre kültürü deneyinde yalnızca sitotoksik konsantrasyonlarda ve metabolik aktivasyonla birlikte mutajenik etkiler göstermiştir.In vivokemirgen deneylerinde ve bakteriyel çalışmalarda FENTANYL mutajenite belirtisi göstermemiştir.
Fentanil, sıçanlarda gerçekleştirilen iki yıllık bir karsinojenite çalışmasında, erkeklerde maksimum tolere edilebilen dozlar olan günde 33 mikrogram/kg'a varan subkutan dozlarda, dişilerdeyse maksimum tolere edilebilen dozlar olan günlük 100 mikrogram /kg'a varan subkutan dozlarda tümör insidansında artışa neden olmamıştır. Dişi sıçanlarda yapılan bazı testler, fertilite azalması ve embriyo mortalitesi göstermiştir. Bu bulgular, maternal toksisite ile ilişkilidirler ve ilacın gelişmekte olan embriyo üzerine doğrudan etkisi ile ilişkili değildir. Teratojenik etkilere dair bulgu yoktur.
6. FARMASÖTİK ÖZELLİKLERİ
6.1 Yardımcı maddelerin listesi
Sodyum klorür Enjeksiy onluk su
6.2 Geçimsizlikler:
Diğer ürünlerle karıştırılıp kullanılmamalıdır.
FENTANYL, sodyum klorür ve glukoz intravenöz infüzyonlarıyla karıştırılabilir. Bu seyreltmeler plastik infüzyon setleriyle kullanıma uygundur ve 24 saat içinde kullanılmalıdır.
6.3. Raf ömrü: 36 ay.
6.4. Saklamaya yönelik özel tedbirler
15°C-30°C arasındaki oda sıcaklığında saklanmalıdır.
Işıktan korumak için ampuller orijinal dış kartonu içinde saklanmalıdır.
6.5. Ambalajın niteliği ve içeriği
2 ml x 5 adet ve 2 ml x 50 adet plastik muhafazalı, renksiz, kırma halkası olan, cam ampul.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller, yerel düzenlemelere uygun olarak atılmalıdır.
Uygulama şekli:
FENTANYL dozu yaşa, vücut ağırlığına, fiziksel duruma, altta yatan patolojik koşullara, diğer ilaçların kullanımına, cerrahinin tipine ve anesteziye göre bireyselleştirilmelidir
Yaşlı ve güçten düşmüş hastalarda başlangıç dozu azaltılmalıdır. Tamamlayıcı (ek) dozlar belirlenirken başlangıç dozunun etkisi göz önünde bulundurulmalıdır. Bradikardi oluşmasını önlemek için, indüksiyondan hemen önce düşük doz bir intravenöz anti-kolinerjik uygulanması önerilir (Bulantı ve kusmayı önlemek amacıyla droperidol verilebilir).
Kullanımda dikkat edilmesi gereken noktalar
1. Ampulü baş ve işaret parmakları arasında tutunuz, ampulün ucunu serbest bırakınız.
2. Diğer elle ampulün ucunu, işaret parmağı ampulün boynuna ve baş parmak renkli çizgilere paralel olarak renkli noktanın üzerine gelecek şekilde tutunuz.
3. Baş parmağı noktanın üzerinde tutarak ampulün
ucunu hızla kırınız, bu sırada ampulün gövdesi diğer elle sıkıca tutulmalıdır.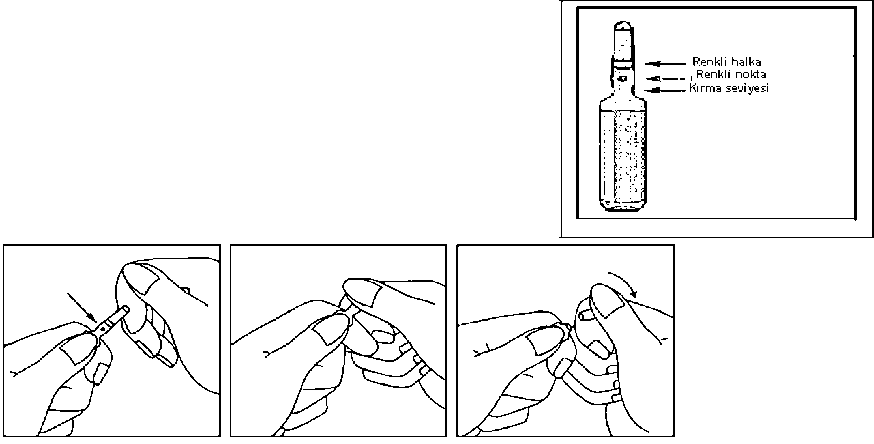
7. RUHSAT SAHİBİ
Johnson and Johnson Sıhhi Malzeme San. ve Tic. Ltd. Şti., Kavacık Mahallesi Ertürk Sokak Keçeli Plaza No:13 Kavacık, Beykoz-İstanbul Tel: 0 216 538 20 00 Faks: 0 216 538 23 69
8. RUHSAT NUMARASI
110/53
9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ
İlk ruhsatlandırma tarihi: 01.08.2001 Son yenileme tarihi: 12.11.2007
10. KÜB'ÜN YENİLENME TARİHİ
|
|
