Konakion MM 2 mg/0,2 ml pediatrik ampul Kısa Ürün BilgisiKan ve Kan Yapıcı Organlar » Kanama Durdurucu İlaçlar » K Vitamini ve Diğer Hemostatikler » K Vitamini » Vitamin k1 KISA URUNBILGISI1.BEŞERI TIBBI URUNUN ADIKONAKION MM 2 mg/0.2 mL pediatrik ampul2.KALITATIF VE KANTİTATIF BİLEŞİMEtkin madde:2 mg K1 vitamini (fitomenadion)Bir ampul 2 mg K1 vitamini ile hazırlanan, oral veya parenteral uygulama için 0.2 mL berrak mikst misel solüsyonu içerir. Yardımcı maddeler:Sodyum hidroksit: 0.92 mg (Sodyum: 2.64 mg/mL) Yardımcı maddeler için 6.1'e bakınız.3.FARMASÖTK FORMSteril ampul oral/i.m./i.v.Ampul çözeltisi berrak ila opak, açık sarı renktedir. Etkin madde, glikokolik asit ve lesitinden oluşan bir mikst misel taşıyıcı içinde çözünmüş olarak bulunmaktadır. 4.KLINIK ÖZELLIKLER4.1Terapötik endikasyonlarKONAKION MM, yenidoğanlarda ve bebeklerde K1 vitamini eksikliğinden kaynaklanan kanamaların profilaksi ve tedavisinde kullanılır.KONAKION MM, yenidoğanlarda ve bebeklerde kumarin tipi antikoagülan ilaçlara karşı antidot olarak kullanılabilir. Ergenlerde (adolesan) ve yetişkinlerde kumarin tipi antikoagülan ilaçlara karşı antidot olarak kullanım için KONAKION MM 10 mg/mL ampul ürün bilgilerine bakınız. 4.2Pozoloji ve uygulamaekli Pozoloji/ uygulama sıklıı ve süresi:Ki vitamini eksikliğinde^ kaynaklanan kanamaların p^ofilaksisi36 haftalık ve daha büyük, sağlıklı yenidoğanlar:Doğum sırasında ya da doğumdan hemen sonra intramüsküler enjeksiyonla uygulanan 1 mg, veya Doğum sırasında ya da doğumdan hemen sonra ağız yoluyla (oral) uygulanan 2 mg. Ağızdan verilen ilk dozu, 4 ila 7 gün sonra uygulanacak olan ikinci bir 2 mg doz takip eder. Doğum sırasında ağız yoluyla KONAKION MM alan emzirilen bebekler:Doğum sırasında ve doğumdan 4 ila 7 gün sonrasında verilen dozlara ilaveten, doğumdan 1 ay sonrasında bir 2 mg oral doz daha verilmelidir. Bebek mama ile beslenmeye başlanıncaya kadar, 2 ayda bir verilen ilave dozlara devam edilmesi tavsiye edilir. Fakat bu ilave dozlarla ilgili etkinlik ve güvenlilik verisi bulunmamaktadır.36 haftadan daha küçük ve 2.5 kg veya üstü ağırlıkta erken doğan ve zamanında doğan ancak risk taşıyan yenidoğanlar:Doğum sırasında veya doğumdan hemen sonra 1 mg IM veya IV uygulanır. İlave dozların miktarı ve sıklığı pıhtılaşma durumuna göre belirlenir. 36 haftadan daha küçük ve 2.5 kg'ın altında ağırlıkta erken doğan bebekler:Doğum sırasında veya doğumdan hemen sonra 0.4 mg/kg (0.04 mL/kg'a eşdeğer) IM veya IV olarak uygulanır. Dozlama için aşağıdaki tabloya bakınız. Bu parenteral doz aşılmamalıdır (bkz. bölüm 4.4). İlave dozların sıklığı pıhtılaşma durumuna göre belirlenir.DKKAT:Bebeğin ağırlığına göre doz hesabı yapılırken dikkatli olunmalıdır (10 katı hataları yaygındır).Ki vitamini eksikliinden kaynaklanan kanamaların önlenmesi için, erken doan bebeklerde doum sırasında doz bilgisi
Ki vitamini eksikliğinden kaynaklanan kanamaların erken ve/veya geç dönem tedavisiKlinik tablo ve pıhtılaşma durumuna göre, başlangıç olarak, 1 mg IV ve ilave dozlar uygulanır. KONAKION MM tedavisinin, kan nakli veya ciddi kan kaybını ve K1 vitaminine yanıt gecikmesini kompanse etmek için pıhtılaşmayı sağlayan faktörler gibi, daha hızlı, etkin bir tedavi seçeneği ile uygulanması gerekebilir. Kumarin tipi antikoagülan ilaçlar ile antidot tedavisiKONAKION MM için, bebeklerde ve çocuklarda, kumarin tipi antikoagülan ilaçlara karşı antidot olarak kullanmak üzere, spesifik bir doz önermek için doz ayarlama çalışması yapılmamıştır. Önerilen dozlar aşağıda detaylı olarak verilmiştir. Bu hastalarda KONAKION MM intravenöz enjeksiyon yoluyla verilmelidir. KONAKION MM ile tedavisi düşünülen bebek veya çocuğun, uygun bir şekilde muayene edilmesi ve tedavisi hakkında bir hematoloğa danışılması tavsiye edilmektedir. Ki vitamini uygulamasının, warfarin ile 2-3 haftalık antikoagülasyon tedavisi ile etkileşmesi sebebiyle, warfarin ile tedavi edilen hastalarda, terapötik girişim için hastanın neden warfarin kullandığı ve antikoagülan tedavinin devam edip etmeyeceği (mekanik kalp valfi bulunan veya tekrarlayan trombo-embolik komplikasyonlar gibi) dikkate alınmalıdır. Warfarin kullanmaya devam eden hastalarda, antikoagülasyonun tamamen geri dönüşümü için önerilen doz, IV enjeksiyonla uygulanan 30 mikrogram/kg'dır. KONAKION MM, 13 kg'ın üstündeki çocuklarda, yalnızca 30 mikrogram/kg'lık dozlarda uygulanabilir. Warfarin doz aşımının tamamen geri dönüşümüne ihtiyaç duyulan hastalar için önerilen Ki vitamini dozu, IV enjeksiyonla uygulanan 250-300 mikrogram/kg'dır. Ki vitamini tedavisi sırasında en erken 4 ila 6 saat sonra etki görülmeye başlanır. Bu yüzden, ciddi kanaması bulunan hastaların, koagülasyon faktör konsantreleri ile replasman tedavisi düşünülmelidir (bir hematolog ile konuşulmalıdır). KONAKION MM, 1.6 kg'ın üstündeki çocuklarda yalnızca, 250-300 mikrogram/kg'lık dozlarda uygulanabilir. Protrombin zamanı 2 ila 6 saat sonra ölçülmelidir ve eğer yanıt yetersizse, KONAKION MM uygulaması tekrarlanabilir. Bu hastalarda, K1 vitamini bağımlı pıhtılaşma faktörünün sık sık ölçülmesi gereklidir. Uygulamaekli:KONAKION MM, endikasyona bağlı olarak, intramüsküler veya intravenöz enjeksiyon veya ağızdan (oral) uygulanabilir.Parenteral uygulama: 0.04 mL (0.4 mg) ila 0.1 mL (1 mg)'lık enjeksiyonların uygulanması için, 0.01 mL'lik gradyenli 0.5 mL şırıngalar tavsiye edilmektedir (bkz. bölüm 6.6). Diğer parenteral ürünlerle seyreltilmesi veya karıştırılması gerektiğinden KONAKION MM'in i.v. infüzyon ile uygulanması tavsiye edilmemektedir. Ancak, gerekli doz %5 dekstroz veya %0.9 sodyum klorür içeren ve >0.7 mL/dakika hızla akan bir infüzyon setinin alt kısımlarına enjekte edilmek suretiyle uygulanabilir (bkz. Geçimsizlikler). Oral uygulama: Oral uygulama için ambalajın içinde oral şırıngalar mevcuttur. Ampul kırılarak açıldıktan sonra, şırınga üzerindeki işarete (0.2 mL= 2 mg K vitamini) gelinceye dek 0.2 mL çözelti oral şırıngaya çekilir. Ardından piston itilerek şırınganın içeriği bebeğin ağzına boşaltılır. Ambalaj içindeki şırınga ile uygulama -Ampulü kırdıktan sonra, şırınga ampul içine dik olarak yerleştirilir. -Şırıngaya ampul içindeki solüsyon işaretli kısma kadar (= 2 mg K1 vitamini) çekilir. -Şırınga direkt olarak yenidoğanın ağzından içeri uygulanır.  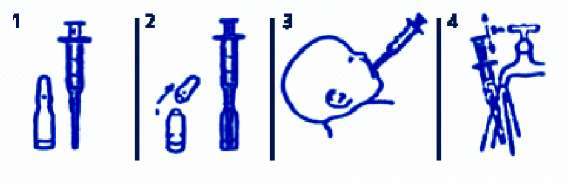 Oral uygulama şırıngasının olmadığı durumlarda:
Oral uygulama şırıngasının olmadığı durumlarda:-Gereken hacim, ampulden ucunda iğne bulunan bir şırınga ile çekilir. -İğnenin şırıngadan çıkartılmasından sonra, şırınga içeriği direkt olarak yenidoğanın ağzına uygulanır. Özel popülasyonlara ilikin ek bilgiler:Böbrek/Karacier yetmezlii:Özel bir kullanımı bulunmamaktadır.Pediyatrik popülasyon:Özel bir kullanımı bulunmamaktadır.Geriyatrik popülasyon:Yenidoğanlarda ve bebeklerde kullanılması nedeniyle geçerli değildir.4.3KontrendikasyonlarK1 vitamini veya ilacın içerdiği diğer yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olduğu bilinen hastalarda KONAKION MM kullanımı kontrendikedir.4.4Özel kullanım uyarıları ve önlemleriKullanım sırasında ampul içeriği berrak olmalıdır. Saklama koşuluna uyulmadığı taktirde, içerikte bulanıklaşma veya faz ayrışması meydana gelebilir. Böyle durumlarda ampul kullanılmamalıdır.2.5kg'dan az ağırlıktaki prematüre bebeklerde parenteral uygulama kernikterus (bilirubin ensefalopatisi) riskini artırabilir. Kolestatik hastalığı bulunan bebeklerde oral absorpsiyon yetmezliği görüldüğünden, KONAKION MM pediatrik, bu hastalara, intramüsküler veya intravenöz enjeksiyonla uygulanmalıdır. İntramüsküler enjeksiyonlar bu hastalarda anlamlı derecede kanamaya yol açtığından, KONAKION MM pediatrik, kumarin tipi antikoagülan ilaçlara karşı antidot olarak kullanıldığında intravenöz enjeksiyonla uygulanmalıdır. KONAKION MM, her dozunda 1 mmol (23 mg)'dan daha az sodyum ihtiva eder (1 mL'de 2.64 mg); yani esasında "sodyum içermez" kabul edilir. 4.5Dier tıbbi ürünlerle etkileimler ve dier etkileimekilleriK1 vitamini, kumarin tipi antikoagülanların etkisini antagonize eder. Bunun dışında anlamlı bir geçimsizlik bilgisi yoktur.Özel popülasyonlara ilikin ek bilgilerÖzel popülasyonlara ilişkin hiçbir etkileşim çalışması yürütülmemiştir.Pediyatrik popülasyon:Pediyatrik popülasyona ilişkin hiçbir etkileşim çalışması yürütülmemiştir.4.6Gebelik ve laktasyon Genel tavsiyeYenidoğanlarda ve bebeklerde kullanılması nedeniyle geçerli değildir.Çocuk dourma potansiyeli bulunan kadınlar/ Doum kontrolü (Kontrasepsiyon)Yenidoğanlarda ve bebeklerde kullanılması nedeniyle geçerli değildir.Gebelik dönemiYenidoğanlarda ve bebeklerde kullanılması nedeniyle geçerli değildir.Laktasyon dönemiYenidoğanlarda ve bebeklerde kullanılması nedeniyle geçerli değildir.Üreme yetenei/ FertiliteYenidoğanlarda ve bebeklerde kullanılması nedeniyle geçerli değildir.4.7Araç ve makine kullanımı üzerindeki etkilerYenidoğanlarda ve bebeklerde kullanılması nedeniyle geçerli değildir.4.8stenmeyen etkilerİstenmeyen etkiler, aşağıda tanımlanan sıklığa göre listelenmiştir:Çok yaygın (> 1/10); yaygın (> 1/100 ila < 1/10); yaygın olmayan (> 1/1,000 ila < 1/100); seyrek (> 1/10,000 ila < 1/1,000); çok seyrek (< 1/10,000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Baııklık sistemi hastalıklarıÇok seyrek: KONAKION MM'in parenteral uygulanması sonrasında anafilaktik reaksiyonlar görülebilir.Genel bozukluklar ve uygulama bölgesine ilikin hastalıklarSeyrek: Enflamasyon, atrofi ve nekrozu da içeren, ciddi olabilen enjeksiyon bölgesi reaksiyonları seyrek olarak meydana gelebilir. Enjeksiyon bölgesinde lokal iritasyon olabilir, ancak enjeksiyon hacmi küçük olduğu için pek beklenmez.4.9Doz aımı ve tedavisiK1 vitamini hipervitaminozuna bağlı, bilinen bir klinik sendrom bulunmamaktadır.KONAKION MM pediatrik'in yenidoğanlarda ve bebeklerde aşırı dozda kullanımı ile ilgili aşağıdaki advers olaylar bildirilmiştir: Sarılık, hiperbilirubinemi, yükselmiş GOT ve GGT, karın ağrısı, kabızlık, yumuşak dışkı, kırıklık, huzursuzluk ve ciltte döküntü. Bu olayların nedenleri belirlenememiştir. Advers olayların çoğunluğu ciddi olaylar olarak değerlendirilmemiştir ve tedavisiz çözümlenebilmiştir. Şüpheli doz aşımında tedavi, semptomları azaltmaya yönelik olmalıdır. 5.FARMAKOLOJIK ÖZELLIKLER5.1Farmakodinamik özelliklerFarmakoterapötik grubu: Antihemorajik. ATC kodu: B02BA01 Etki mekanizmasıKONAKION MM bir sentetik fitomenadion (K1 vitamini) preparatıdır. KONAKION MM pediatrik ampulün etkin maddesi olan K1 vitamini; vücutta protrombin, faktör VII, faktör IX ve faktör X, pıhtılaşma inhibitörleri olan protein C ve protein S yapımı için gereklidir. K1 vitamini plasentayı aşarak anneden bebeğe ulaşamaz ve anne sütüne de çok az miktarda geçebilir. K1 vitamini eksikliği, yenidoğanda kanamalı hastalık riskini artırır. K1 vitamini kullanılarak, yukarıda belirtilen pıhtılaşma faktörlerinin karaciğer tarafından sentezi uyarılır ve K1 vitamini eksikliğine bağlı anormal pıhtılaşma ve kanama tablolarının önüne geçilir. 5.2Farmakokinetik özellikler Genel özelliklerMikst misel solüsyonundaki K1 vitamini, lesitin ve safra asitlerinden oluşan fizyolojik kolloidal sistem aracılığıyla çözünür.Emilim:Oral uygulamayı takiben, K1 vitamini ince barsaklardan emilir. Bireyler arası değişkenlik göstermekle birlikte, oral uygulamadan sonra sistemik yararlanım %50'dir. Safra yokluğunda emilim sınırlıdır.Dağılım:K1 vitamini öncelikle karaciğerde birikir, %90'a ulaşan bölümü plazmada lipoproteinlere bağlanır ve vücutta yalnızca kısa süreler için depolanır.Biyotransformasyon:K1 vitamini, fitomenadion-2,3-epoksit gibi daha polar metabolitlere dönüşmektedir.Eliminasyon:K1 vitamininin plazma yarılanma ömrü yenidoğanlarda 72 saat, yetişkinlerde 1.5 - 3 saat kadardır. K1 vitamini, glukuronit ve sülfat bileşikleri şeklinde safra ve idrarla atılır.Doğrusallık/doğrusal olmayan durum:İntramüsküler uygulama sonrasında K1 vitamininin dolaşıma girmesinde gecikme görülür; yani IM uygulama yolu bir depo işlevi görür. Tek bir 1 mg IM dozla, 1 ay süresince, iki tane 2 mg doz ile (biri doğumdadiğeri bir hafta sonra verilmiş) karşılaştırılabilir Ki vitamini konsantrasyonları elde edilebilir. 5.3 Klinik öncesi güvenlilik verileriGeçerli değil.6. FARMASÖTK ÖZELLKLER6.1Yardımcı maddelerin listesiGlikokolik asit LesitinSodyum hidroksit Hidroklorik asit Enjeksiyonluk su. 6.2GeçimsizliklerSeyreltilmiş KONAKION MM çözeltisi ve bazı silikonize şırıngalar arasında geçimsizlikler gözlenmiştir, bu sebeple KONAKION MM enjeksiyondan önce seyreltilmemelidir.Çökme riski nedeniyle sodyum klorür içeren çözeltilerle seyreltmeyiniz (bkz. bölüm 4.2). 6.3Raf ömrü36 ay.6.4Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında saklayınız. Işıktan koruyunuz.Kullanım sırasında ampul içindeki çözelti berrak olmalıdır. Uygun olmayan saklama koşullarında çözelti bulanıklaşır ya da bir tabaka oluşur. Bu durumda ampul kullanılmamalıdır. 6.5Ambalajın nitelii ve içeriiKONAKION MM 2 mg/0.2 mL pediatrik ampul, 5 adet + oral uygulama için 5 adet şırınga6.6Beeri tıbbi üründen arta kalan maddelerin imhası ve dier özel önlemlerKONAKION MM'in uygulanması ile ilgili bilgiler için, bölüm 4.2, bölüm 4.4 ve bölüm 6.2'ye bakınız.Kullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği'ne" uygun olarak imha edilmelidir. 7.RUHSAT SAHBİRoche Müstahzarları Sanayi Anonim Şirketi, Eski Büyükdere Asfaltı No: 17/A 34398 Maslak, İstanbul Tel: (0 212) 366 90 00Faks: (0 212) 285 22 00 8.RUHSAT NUMARASI101/1009.LK RUHSAT TARH/RUHSAT YENLEME TARHİİlk ruhsat tarihi: 25.06.1997 Ruhsat yenileme tarihi: 06.10.2009 10.KÜB'ÜN YENLENME TARHİ |
İlaç BilgileriKonakion MM 2 mg/0,2 ml pediatrik ampulEtken Maddesi: K1 vitamini (fitomenadion) Atc Kodu: B02BA01 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.