Possia 90mg Film Kaplı Tablet Kısa Ürün BilgisiKan ve Kan Yapıcı Organlar » Antitrombotikler » Antitrombotik İlaçlar » Platelet Agregasyon İnhibitörleri » Tikagrelor KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADI POSSIA 90 mg film kaplı tablet 2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde : Tikagrelor.......................90 mg Yardımcı madde : Mannitol....................126 mg Yardımcı maddeler için, 6.1'e bakınız. 3. FARMASÖTİK FORM Film kaplı tablet Yuvarlak, bikonveks, sarı tabletler, bir yüzü 'T' üzerinde '90' ile işaretli, arka yüzü düzdür. 4. KLİNİK ÖZELLİKLER 4.1 Terapötik endikasyonlar Asetil salisilik asit (ASA) ile birlikte uygulanan POSSIA, tıbbi gözetimdeki hastalar ve perkütan koroner girişim (PCI) veya koroner arter bypass graftı (CABG) ile tedavi edilen hastalar da dahil olmak üzere, akut koroner sendromlu (stabil olmayan anjina, ST yükselmesiz miyokard enfarktüsü [NSTEMI] veya ST yükselmeli miyokard enfarktüsü [STEMI]) hastalarda trombotik olayların (kardiyovasküler ölüm, miyokard enfarktüsü ve inme) önlenmesinde endikedir. Daha fazla bilgi için bölüm 5.1'e bakınız. 4.2 Pozoloji ve uygulama şekli Pozoloji/ uygulama sıklığı ve süresi : POSSIA tedavisi, tek dozluk 180 mg yükleme dozu (iki tane 90 mg'lık tablet) ile başlatılır ve günde iki kez 90 mg ile devam edilir. POSSIA kullanan hastalar ayrıca, spesifik olarak kontrendike olmadıkça, günde bir doz ASA kullanmalıdır. ASA'nın başlangıç dozunu takiben POSSIA, ASA'nın 75-150 mg'lık idame dozu ile birlikte kullanılmalıdır (bakınız Bölüm 5.1). Tedavide kesintilerden kaçınılmalıdır. Bir doz POSSIA almayı unutan hastalar, planlanmış olan zamanda yalnızca bir adet 90 mg tablet (bir sonraki doz) almalıdır. Hastalarını klopidogrel tedavisinden POSSIA tedavisine geçirmek isteyen doktorlar, 90 mg'lık ilk POSSIA dozunu, klopidogrelin son dozundan 24 saat sonra uygulamalıdır (bakınız Bölüm 5.1). Klinik açıdan tedavinin kesilmesi gerekmediği sürece, en az 12 ay POSSIA ile tedavi önerilmektedir (bakınız Bölüm 5.1). Akut koroner sendromlu (ACS) hastalarda, POSSIA da dahil olmak üzere herhangi bir antitrombositik ile tedavinin erken kesilmesi, hastanın altta yatan hastalığından dolayı kardiyovasküler ölüm veya miyokard enfarktüsü risk artışı ile sonuçlanabilir (bakınız Bölüm 4.4). Uygulama şekli : Oral kullanım içindir. POSSIA gıdalarla birlikte veya ayrı alınabilir. Özel popülasyonlara ilişkin ek bilgiler : Böbrek yetmezliği Böbrek yetmezliği olan hastalarda doz ayarlamasına gerek yoktur (bakınız Bölüm 5.2). Diyaliz hastalarının tedavisi ile ilgili bilgi mevcut değildir. Karaciğer yetmezliği Hafif karaciğer yetmezliği olan hastalarda doz ayarlamasına gerek yoktur. Orta veya şiddetli karaciğer yetmezliği olan hastalarda POSSIA çalışılmamıştır (bakınız Bölüm 5.2). Pediyatrik popülasyon 18 yaşın altındaki çocuklarda POSSIA'nın etkililiği ve güvenliliği belirlenmemiştir. Geriyatrik popülasyon Yaşlılarda doz ayarlamasına gerek yoktur (bakınız Bölüm 5.2). 4.3 Kontrendikasyonlar Etkin madde veya diğer yardımcı maddelere aşırı duyarlılık Aktif patolojik kanama İntrakraniyal hemoraji öyküsü Orta veya şiddetli karaciğer yetmezliği 4.4 Özel kullanım uyarıları ve önlemleri Kanama riski : Diğer antitrombositik ilaçlarda olduğu gibi, bilinen artmış kanama riski olan hastalarda POSSIA kullanımı, trombotik olayların önlenmesi açısından faydasına karşı dengelenmelidir. Aşağıdaki durumlara dikkat edilmelidir : Kanama eğilimi olan hastalar (örn: yeni travma, yeni ameliyat, aktif veya yeni gastrointestinal kanama veya orta şiddette karaciğer yetmezliğinden dolayı). Aktif patolojik kanaması olan hastalarda ve intrakraniyal hemoraji öyküsü ve şiddetli karaciğer yetmezliği olanlarda POSSIA kullanımı kontrendikedir (bakınız Bölüm 4.3). Kanama riskini artıran ilaçlarla birlikte kullanan hastalar (örn: POSSIA dozlamasından sonra 24 saat içinde nonsteroidal antiinflamatuvar ilaçların (NSAİİ'ler), oral antikoagülanların ve/veya fibrinolitiklerin kullanılması) Trombosit transfüzyonlarının hemostatik faydası ile ilgili POSSIA ile bir veri mevcut değildir, dolaşımdaki POSSIA nakledilen trombositleri inhibe edebilir. POSSIA'nın desmopressin ile birlikte uygulanması, örnek kanama süresini azaltmadığından, desmopressinin klinik kanama olaylarının idaresine etkili olması beklenmez. Antifibrinolitik tedavi (aminokaproik asit veya traneksamik asit) ve/veya rekombinant faktör VIIa hemostazı artırabilir. Kanamanın sebebi tanımlanıp kontrol altına alındıktan sonra POSSIA tedavisi yeniden başlatılabilir. Cerrahi : Eğer hastanın ameliyat olması gerekiyorsa, POSSIA tedavisinin ne zaman kesilmesi gerektiğinin saptanması için doktorlar her hastanın klinik profilini ve devam eden antitrombositik tedavisinin fayda ve risklerini değerlendirmelidir. POSSIA'nın geri dönüşlü bağlanmasından dolayı, klopidogrel ile kıyaslandığında POSSIA ile trombosit agregasyonunun onarımı daha hızlı gerçekleşir. OFFSET çalışmasında, dozlamadan 72 saat sonra POSSIA için ortalama trombosit agregasyonu inhibisyonu (IPA), dozlamadan 120 saat sonra klopidogrel için ortalama IPA ile karşılaştırılabilir düzeydedir. Etkinin daha hızlı sona ermesi, kanama komplikasyonları riskinin azalmasının habercisi olabilir örn. Ameliyat veya travma nedeni ile antitrombositik tedavinin geçici sure ile kesilmesinin gerektiği durumlar (bakınız Bölüm 5.1). CABG geçiren PLATO hastalarında klopidogrel ile kıyaslandığında, POSSIA'nın daha yüksek majör kanama riski gösterdiği 1. gün dışında tüm günlerde POSSIA benzer oranda majör kanama gösterir (bakınız Bölüm 4.8). Eğer hasta elektif cerrahi müdahale geçirecekse ve antitrombositik etki istenmiyorsa, POSSIA ameliyattan 5 gün önce kesilmelidir. Orta şiddette karaciğer yetmezliği olan hastalar : Orta şiddette karaciğer yetmezliği olan hastalarda dikkatli olunması önerilmektedir; çünkü POSSIA bu hastalarda araştırılmamıştır. Şiddetli karaciğer yetmezliği olan hastalarda POSSIA kullanımı kontrendikedir (bakınız Bölüm 4.3). Bradikardik olaylar için risk altında olan hastalar : Eski bir klinik çalışmada genellikle asemptomatik ventriküler aralar gözlenmesinden dolayı, bradikardik olay riski artan hastalar (örn: hasta sinus sendromu, 2. veya 3. derece AV blok veya bradikardiye bağlı senkop gözlenen pacemaker olmayan hastalar) POSSIA'nın etkililiği ve güvenliliğinin değerlendirildiği ana çalışmadan hariç tutulmuştur. Bu sebeple, bu hastalardaki sınırlı klinik deneyimden dolayı, tedbirli olunmalıdır (bakınız Bölüm 5.1). Dispne : POSSIA ile tedavi edilen hastalarda gözlenen dispne genellikle hafif ila orta yoğunluktadır ve genellikle tedaviye ihtiyaç duymadan sorun ortadan kalkar (yaklaşık olarak %2.2). Eğer bir hastada POSSIA ile tedavi sırasında yeni, uzamış veya kötüleşen dispne gelişirse, tedavi gerektiren altta yatan hastalıklar gibi dispnenin diğer sebepleri kapsam dışında tutulmalıdır. Eğer dispne tolere edilmezse, POSSIA ile tedavi durdurulmalıdır (bakınız Bölüm 4.8). Diğer : POSSIA'nın güçlü CYP3A4 inhibitörleri (örn: ketakonazol, klaritromisin, nefazadon, ritonavir ve atanazavir) ile birlikte uygulanmasından kaçınılmalıdır, çünkü birlikte uygulama POSSIA'ya maruz kalmayı önemli ölçüde artırabilir (bakınız Bölüm 4.5). PLATO'da ASA'nın idame dozu ve klopidogrel ile karşılaştırıldığında tikagrelorun bağıl etkililiği arasında gözlenmiş olan bir ilişki temel alındığında, tikagrelor ve yüksek ASA idame dozunun (>300 mg) birlikte uygulanması önerilmez (bakınız Bölüm 5.1). İlacın kesilmesi : POSSIA tedavisinin kesilmesi gereken hastalar, kardiyak olaylar için yüksek risk grubundadır. Tedavinin zamansız kesilmesinden kaçınılmalıdır. Eğer POSSIA tedavisinin bir advers olaydan dolayı geçici olarak durdurulması gerekirse, faydaları advers olayların riskinden fazla olduğunda veya advers olay ortadan kalktığında en kısa zamanda tedavi yeniden başlatılmalıdır (bakınız Bölüm 4.2). POSSIA mannitol içerir, bu da hafif laksatif (müshil) etki oluşturabilir. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri Diğer tıbbi ürünlerin POSSIA üzerindeki etkisi CYP3A4 ile metabolize olan tıbbi ürünler : CYP3A4 Inhibitörleri : Güçlü CYP3A4 Inhibitorleri - ketokonazolün tikagrelor ile birlikte uygulanması tikagrelorun Cmax ve AUC'sini sırasıyla 2.4 kat ve 7.3 kat artırır. Aktif metabolitin Cmax ve AUC değerleri sırasıyla %89 ve %56 azalmıştır. Diğer güçlü CYP3A4 inhibitörlerinin (klaritromisin, nefazadon, ritonavir ve atanazavir) benzer etki göstermesi beklenir ve POSSIA ile aynı anda uygulanmamalıdır (bakınız Bölüm 4.4). Ortalama CYP3A4 Inhibitorleri - Diltiazemin tikagrelor ile birlikte uygulanması tikagrelorun Cmax değerini %69, AUC değerini %174 artırır ve aktif metabolit Cmax değerini %38 azaltır, AUC değişmemiştir. Tikagrelorun diltiazem plazma düzeyleri üzerinde etkisi yoktur. Diğer orta CYP3A4 inhibitörleri de (örn: amprenavir, aprepitant, eritromisin, flukonazol ve verapamil) POSSIA ile aynı anda uygulanabilir. CYP3A4 Indükleyicileri : Rifampisinin tikagrelor ile birlikte uygulanması, tikagrelor Cmax ve AUC değerlerini sırasıyla %73 ve %86 azaltır. Aktif metabolitin Cmax değeri değişmemiş ve AUC yaklaşık %46 azalmıştır. Diğer CYP3A4 indükleyicilerinin (örn: deksametazon, fenitoin, karbamazepin ve fenobarbital) POSSIA'ya maruziyeti azaltması beklenir ve POSSIA'nın etkisinde azalma ile sonuçlanabilir. Diğerleri : Klinik farmakoloji etkileşim çalışmaları, tikagrelorun heparin, enoksaparin ve aspirin ile birlikte uygulanmasının tikagrelor veya aktif metabolitinin plazma düzeyleri üzerinde etkisi olmadığını göstermiştir. Tikagrelor ve heparinin birlikte uygulanmasının heparin baz alındığında, aktive parsiyel tromboplastin zamanı (aPTT) ve aktive koagülasyon zamanı (ACT) analizleri üzerinde etkisi yoktur. Tikagrelor ve heparinin aynı anda uygulanmasının enoksaparin baz alındığında faktör Xa analizinde etkisi yoktur. POSSIA'nın diğer tıbbi ürünler üzerinde etkisi CYP3A4 ile metabolize olan tıbbi ürünler : Simvastatin - Tikagrelor ve simvastatinin birlikte uygulanması, simvastatin C maxmaxdeğerini %64, AUC değerini %52 artırır. 40 mg'dan fazla simvastatin alması gereken hastaların maruziyetinde değişiklik aralığı ve yoğunluğunun klinik öneminin değerlendirmesi verilmelidir. Simvastatinin tikagrelor plazma düzeyi üzerinde etkisi yoktur. POSSIA lovastatin üzerinde de benzer etki gösterebilir, fakat diğer statinler üzerinde klinik açıdan anlamlı bir etki göstermesi beklenmez. Atorvastatin - Atorvastatin ve tikagrelorun birlikte uygulanması, atorvastatin asit C maxmax'ta benzer artışlar gözlenmiştir. Bu artışların klinik açıdan önemli olmadığı değerlendirilmektedir.CYP2C9 ile metabolize olan tıbbi ürünler : Tikagrelorun tolbutamid ile birlikte uygulanması, her iki ilacın da plazma düzeylerinin değişmemesi ile sonuçlanır, bu da tikagrelorun CYP2C9 inhibitörü olmadığı ve varfarin ve tolbutamid gibi CYP2C9 bağımlı metabolize olan ilaçları değiştirmeyeceği izlenimini verir. Oral Kontraseptifler : Tikagrelorun levonorgestrel ve etinil estradiol ile birlikte uygulanması etinil estradiol maruziyetini yaklaşık %20 artırır; fakat levonorgestrelin farmakokinetiğini değiştirmez. Levonorgestrel ve etinil estradiol POSSIA ile birlikte uygulandığında oral kontraseptifin etkililiği üzerinde klinik olarak ilişkili bir etki beklenmez. Digoksin (PgP substratı) : Tikagrelor ile birlikte uygulama, digoksin C maxdeğerini %75, AUC değerini %28 artırır. Bu sebeple, digoksin gibi dar terapötik indeksli P-gp bağımlı ilaçlar POSSIA ile aynı anda verildiğinde uygun klinik ve/veya laboratuar takibinin yapılması önerilir.Diğer eşlik eden tedavi : Klinik çalışmalarda, birlikte uygulama koşulları için gerektiğinde POSSIA yaygın olarak asetil salisilik asit (ASA), heparin, düşük molekül ağırlıklı heparin, intravenöz GpIIb/IIIa inhibitörleri, proton pompası inhibitörleri, statinler, beta blokerler, anjiotensin dönüştürücü enzim inhibitörleri ve anjiotensin reseptör blokerleri ile birlikte uygulanır. Bu çalışmalar klinik açıdan önemli advers etkileşimlere dair herhangi bir kanıt ortaya koymamıştır. 4.6 Gebelik ve laktasyon Genel tavsiye Gebelik kategorisi :B Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) POSSIA için gebeliklerde maruz kalmaya ilişkin klinik veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik/embriyonal/fetal gelişim/doğum ya da doğum sonrası gelişim ile ilgili olarak doğrudan ya da dolaylı zararlı etkiler olduğunu göstermemektedir (bakınız Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Gebelik dönemi POSSIA'nın gebe kadınlarda kullanımına dair klinik bilgiler sınırlıdır. Gebe kadınlara verilirken tedbirli olunmalıdır. Hayvanlar üzerinde yapılan üreme çalışmaları her zaman insan cevabını öngöremediği için POSSIA sadece anneye sağlayacağı muhtemel yarar fetüsün maruz kalacağı potansiyel riski karşıladığında kullanılmalıdır. Laktasyon dönemi POSSIA'nın insan sütüne geçip geçmediği bilinmemektedir. Ratlarda yapılan çalışmalar, tikagrelor ve aktif metabolitinin süte geçtiğini göstermiştir. Emzirme sırasında POSSIA kullanımı önerilmemektedir. Üreme yeteneği/Fertilite Tikagrelorun dişi veya erkek fertilitesi üzerinde etkisi yoktur (bakınız Bölüm 5.3). 4.7 Araç ve makine kullanımı üzerindeki etkiler POSSIA'nın araç ve makine kullanma yetisi üzerindeki etkilerine ilişkin herhangi bir çalışma yapılmamıştır. POSSIA'nın araç ve makine kullanma yetisi üzerindeki etkisi zayıftır veya hiç yoktur. Akut Koroner Sendromların tedavisi sırasında, sersemlik ve konfüzyon bildirilmiştir. Bu sebeple, bu semptomların gözlendiği hastalar, araç ve makine kullanırken dikkatli olmalıdır. 4.8 İstenmeyen etkiler Güvenlilik profili özetiAkut koroner sendromlu (UA, NSTEMI ve STEMI) hastalarda POSSIA'nın güvenliliği tek büyük faz 3 çalışmasında (PLATO [PLATelet Inhibisyonu ve Hasta Sonuçları] çalışması) değerlendirilmiştir, bu çalışmada POSSIA ile tedavi edilen hastalar (180 mg POSSIA yükleme dozu ve günde iki kez 90 mg idame dozu) ve klopidogrel ile (300-600 mg yükleme dozunu takiben günde bir kez 75 mg idame dozu) tedavi edilen hastalar karşılaştırılmıştır, her iki grupta da ASA ve diğer standart tedavilerle kombine uygulanmıştır. POSSIA için ortalama tedavi süresi 277 gündür (6762 hasta 6 aydan uzun süre tedavi edilmiş, 3138 hasta 12 aydan uzun süre tedavi edilmiştir). Tikagrelor ile tedavi edilen hastalarda en sık rapor edilen advers reaksiyonlar dispne, başağrısı ve burun kanamasıdır ve bu olaylar klopidogrel tedavi grubundan daha yüksek oranlarda ortaya çıkmıştır. Advers reaksiyonların tablolanmış özetiAşağıdaki advers reaksiyonlar, POSSIA ile yapılan çalışmaları takiben tanımlanmıştır. Sıklıklar şu şekilde tanımlanır: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1,000 ila <1/100); seyrek (>1/10,000 ila <1/1,000), çok seyrek (<1/10,000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Metabolizma ve beslenme hastalıkları Çok yaygın: Hiperürisemia Psikiyatrik hastalıklar Yaygın olmayan: Konfüzyon Sinir sistemi hastalıkları Yaygın : Başağrısı, sersemlik Yaygın olmayan: İntrakraniyal hemorajib, parestezi Göz hastalıkları Yaygın olmayan: Göz hemorajisi (intraoküler, konjunktival, retinal) Kulak ve iç kulak hastalıkları Yaygın : Vertigo Seyrek: Kulak hemorajisi Solunum, toraks ve mediyastinal hastalıklar Çok yaygın: Dispnec Yaygın : Epistaksisd Yaygın olmayan: Hemoptizi Gastrointestinal hastalıklar Yaygın: Gastrointestinal hemorajid, abdominal ağrı, konstipasyon, diyare, dispepsi, bulantı, kusma Yaygın olmayan: Hematemez, gastrointestinal ülser hemorajisie, hemoroidal hemoraji, gastrit, oral hemoraji (dişeti kanaması dahil), retroperitoneal hemoraji Deri ve deri altı doku hastalıkları Yaygın: Deri altı veya deride kanamaf, morarmag, döküntü, kaşıntı Kas-iskelet bozukluklar, bağ doku ve kemik hastalıkları Seyrek: Hemartroz# Böbrek ve idrar hastalıkları Yaygın: İdrar yolunda kanamah Üreme sistemi ve meme hastalıkları Yaygın olmayan: Vajinal kanama (metroraji dahil) Araştırmalar Seyrek: Kan kreatinin düzeyinde artış Yaralanma ve zehirlenme ve prosedüre ait komplikasyonlar Yaygın: Prosedürel bölgede hemorajii Yaygın olmayan: Post-prosedürel hemoraji, hemoraji Seyrek: Yara hemorajisi, travmatik hemoraji Çoklu ilişkili advers reaksiyon terimi yukarıda birlikte gruplanmıştır ve aşağıda tanımlandığı şekilde tıbbi terimleri içermektedir: a Hiperürisemi, kanda ürik asit miktarının yükselmesi b Serebral hemoraji, intrakraniyal hemoraji, hemorajik inme c Dispne, efor dispnesi, dinlenme sırasında dispne, noktürnal dispne d Gastrointestinal hemoraji, rektal hemoraji, intestinal hemoraji, melena, gizli kan e Gastrointestinal ülser hemorajisi, gastrik ülser hemorajisi, duodenal ülser hemorajisi, peptik ülser hemorajisi f Subkütan hematom, deride hemoraji, subkütan hemoraji, peteşi g Kontüzyon, hematom, ekimoz, morarma eğiliminde artış, travmatik hematom h Hematüri, idrarda kan olması, idrar yolunda kanama i Damara giriş yerinde kanama, damara giriş yerinde hematom, enjeksiyon bölgesinde hemoraji, damara giriş yerinde hemoraji, kateter yerinde hemoraji # PLATO çalışmasının tikagrelor kolunda (n=9235) bildirilmiş hemartroz advers reaksiyonları bulunmamaktadır; sıklık nokta tahmin için %95 güven aralığının üst sınırı kullanılarak hesaplanmıştır (3/X'e dayalı olarak; burada X toplam örnek büyüklüğünü temsil etmektedir; örn., 9235). Bu değer 3/9235 olarak hesaplanmış olup 'seyrek' sıklık kategorisine karşılık gelmektedir. Seçilen advers reaksiyonların tanımıKanama :PLATO çalışmasında aşağıdaki kanama tanımları kullanılmıştır : 'Majör Ölümcül/Yaşamı Tehdit Edici':kanama dolayısıyla kardiyak tamponad veya hipovolemik şok veya şiddetli hipotansiyona yol açan ve presör veya cerrahi müdahale gerektiren ölümcül veya intrakraniyal veya intraperikardiyal kanama veya klinik açıdan belirgin veya anlaşılır kanama ile birlikte hemoglobinde 50 g/L veya daha fazla düşüş ya da kanama için 4 veya daha fazla ünite transfüzyon (tam kan veya PRBC) 'Majör Diğer':,belirgin engelleyici semptomlar (örn: kalıcı görüş kaybı ile intraoküler), veya klinik açıdan belirgin veya anlaşılır kanama ile birlikte hemoglobinde 30 ila 50 g/L düşüş ya da kanama için 2-3 ünite transfüzyon (tam kan veya PRBC) 'Minör':Kanamayı durdurmak veya müdahale için tıbbi girişim (örn, tampon için hastaneye başvurmayı gerektiren burun kanaması) Minimal kanamalar,tüm diğer kanamaları kapsar, bunlar toplanmış fakat hükmevarılmamıştır. PLATO'da raporlanan kanama olayları, diğer benzer çalışmalarla karşılaştırmayı kolaylaştırmak için aynı zamanda TIMI (Miyokard Enfarktüsünde Tromboliz) skalasında eşleştirilmiştir. TIMI Majör, hemoglobinde >5g/dl düşüş ile klinik anlamlı kanama veya intrakraniyal hemoraji olarak tanımlanır, TIMI Minör hemoglobinde 3 g/dl fakat <5 g/dL düşüş ile anlamlı kanama olarak tanımlanır. PLATO çalışmasındaki kanama olaylarının genel sonuçları Tablo 2'de mevcuttur.
Tablo 2 - Genel kanama olaylarının analizi
POSSIA (%) N=9235
Klopidogrel (%) N=9186 p-değeri
Primer Güvenlilik Dönüm Noktası Toplam Majör_
11.6
11.2
0.4336
Sekonder Dönüm Noktaları Ölümcül/yaşamı tehdit edici
5.8
5.8
0.6988
Kombine Toplam Majör + Minör kanama
16.1
14.6
0.0084 Non-CABG Majör
4.5
3.8
0.0264 Non-Prosedürel Majör
3.1
2.3
0.0058
Non-Prosedürel Majör + Minör
5.9
4.3
<0.0001
TIMI-tanımlı kanama kategorisi TIMI-tanımlı Majör
7.9
0.5669
7.7
TIMI-tanımlı Majör + Minör
11.4
10.9
0.3272
PLATO'da, POSSIA için ilk PLATO tanımlı Toplam Majör kanamaya kadar geçen süre, klopidogrelden belirgin derecede farklı değildir. Çalışmada POSSIA için 20 (%0.2), klopidogrel için 23 (%0.3) adet olmak üzere çok az sayıda ölümcül kanama olayı mevcuttur. Minör kanama dahil edildiğinde, kombine PLATO-tanımlı majör ve minör kanama olayları klopidogrele göre POSSIA'da belirgin derecede daha yüksektir. TIMI-tanımlı kanama olaylarının genel oranı POSSIA ve klopidogrel arasında belirgin derecede farklı değildir. CABG ile ilgili kanama:PLATO'da 1584 hasta (%12) koroner arter bypass graftı (CABG) operasyonu geçirmiştir. Majör Ölümcül/Yaşamı Tehdit-edici kanama her iki tedavi grubunda yaklaşık %42'dir. Prosedürden önceki son dozun zamanına bağlı Majör Ölümcül/Yaşamı Tehdit-edici CABG kanaması riski açısından tedavi grupları arasında bir fark yoktur. Ölümcül CABG kanaması yaygın olarak ortaya çıkmamaktadır, her iki tedavi grubunda 6 kişide gözlenmiştir (sırasıyla POSSIA ve klopidogrel alan CABG hastalarının %0.8 ve %0.7'sinde).CABG ile ilgili olmayan kanama:CABG kanaması analizden çıkarıldığında (bakınız Tablo 3), tüm kategoriler için absolü kanama oranları daha düşüktür. Gruplar CABG olmayan PLATO tanımlı Majör Ölümcül/Yaşamı tehdit edici kanama açısından farklı değildir, fakat PLATO tanımlı Toplam Majör, TIMI Majör ve TIMI Majör + Minör kanama POSSIA'da daha yaygındır.Tablo 3 - CABG ile ilgili olmayan PLATO-tanımlı Majör Kanama Olayları ve TIMI-tanımlı kanama olayları
POSSIA (%) N=9235
Klopidogrel (%) N=9186 p-değeri
PLATO-tanımlı kanama kategorisi Toplam Majör Kanama
4.5
3.8
0.0264
Majör Ölümcül/Yaşamı Tehdit edici
2.1
1.9
0.2516
TIMI-tanımlı kanama kategorisi TIMI-tanımlı Majör
2.8
2.2
0.0246
TIMI-tanımlı Majör + Minör
4.5
3.6
0.0093 Herhangi bir prosedürle ilgili olmayan kanama: Tablo 2'de gösterildiği gibi, PLATO tanımlı Majör ve Majör +Minör prosedürel olmayan kanama POSSIA ile daha sıktır. Prosedürel olmayan kanama sebebiyle tedavinin kesilmesi, klopidogrele göre (%1.2; p<0.001) POSSIA'da (%2.9) daha yaygındır. Majör+Minör kanama için klinik açıdan önemli lokasyonlar sıklık derecesine göre (POSSIA'ya karşı klopidogrel) : intrakraniyal (27'ye karşı 14 olay), perikardiyal (11'e karşı 11), retroperitoneal (3'e karşı 3), intraoküler (2'ye karşı 4) ve intraoküler (2'ye karşı 1) şeklindedir. Diğer yaygın lokasyonlar sıklık derecesine göre; gastrointestinal (170'e karşı 135 olay), burun kanaması (116'ya karşı 61), üriner (45'e karşı 37), subkutan/dermal /43'e karşı 38) ve hemoptisis (13'e karşı 7) şeklindedir. Ölümcül prosedürel olmayan kanama için klopidogrel ile karşılaştırıldığında, POSSIA ile fark yoktur. Majör Ölümcül/Yaşamı Tehdit edici gastrointestinal kanama POSSIA ve klopidogrel ile aynıdır, klopidogrel için sayısal olarak ölümcül olaylar (5) POSSIA'ya göre (0) daha fazladır. Sayısal olarak Majör Ölümcül/Yaşamı Tehdit Edici intrakraniyal prosedürel olmayan kanama olayları, klopidogrele göre (n=14 olay, %0.2) POSSIA ile (n=27 olay 26 hastada, %0.3) daha fazladır, bunlardan POSSIA ile kanama olaylarından 11'i, klopidogrel ile 1'i ölümcüldür. Yaş, cinsiyet, kilo, ırk, coğrafi bölge, tıbbi hikaye, eşlik eden koşullar ve eşlik eden tedavi gibi temel özellikler, POSSIA ile kanama riskinde herhangi bir artışın incelenmesi için değerlendirilmiştir. Kanamanın hiçbir alt grubu için özel risk grubu tanımlanmamıştır. Tedavi periyodu süresince, POSSIA grubunda advers etkiler sebebiyle tedavinin kesilmesi insidansı klopidogrele göre daha yüksektir (%7.4'e karşı %5.4). Dispne : Dispne, POSSIA ile tedavi sırasında gözlenir. Dispne advers olayları (dispne, dinlenme sırasında dispne, efor dispnesi, paroksimal nokturnal dispne ve nokturnal dispne), kombine edildiğinde, POSSIA alan hastaların %13.8'inde, PLATO çalışmasında klopidogrel alan hastaların %7.8'inde ortaya çıkmıştır. PLATO çalışmasında tikagrelor alan hastaların %2.2'sinde ve klopidogrel alan hastaların %0.6'sında araştırıcılar dispnenin tedaviyle nedensel olarak bağlantılı olduğunu düşünmüştür ve yalnızca birkaçı ciddi olarak değerlendirilmiştir (%0.14 tikagrelor; %0.02 klopidogrel) (bakınız Bölüm 4.4). Çalışmada altta yatan konjestif kalp yetmezliği (KKY), kronik obstruktif akciğer hastalığı (KOAH) veya astımı olan hastalar hariç tutulmamıştır. Dispne advers olaylarının çoğu hafif ya da orta şiddettedir. Dispne şiddetli advers olayları POSSIA alanların %0.7'sinde, klopidogrel alanların %0.4'ünde gözlenir. Dispne sebebiyle POSSIA alan hastalardan %0.9'u, klopidogrel alan hastalardan %0.1'i tedaviyi bırakmıştır. Dispne genellikle tedavinin ilk fazında ortaya çıkar. Dispne gözlenen POSSIA alan hastaların %87'sinde tek vaka deneyimlenmiştir. Tüm dispnelerin ortalama %30'u 7 gün içinde ortadan kalkmıştır. Genellikle yaşlı hastalarda ve temelde KKY, KOAH veya astım hastalığı olanlarda dispne görülme eğilimi ve sıklığı daha fazladır. PLATO çalışması verileri, POSSIA ile daha yüksek sıklıkta dispne gözlenmesinin yeni veya ağırlaşan kalp veya akciğer hastalığından kaynaklandığını ileri sürmemektedir (bakınız bölüm 4.4). Klinik programda pulmoner fonksiyon testine alınan hastalarda, pulmoner fonksiyon üzerinde POSSIA'nın advers etkisine dair bir belirti yoktur. Lab Anomalileri : PLATO'da, klopidogrel alan hastalar (%13) ile kıyaslandığında POSSIA alan hastalarda serum ürik asit konsantrasyonu normal üst limitin %22 üzerine yükselmiştir. Ortalama serum ürik asit konsantrasyonu klopidogrel alan hastalarla (%7) kıyaslandığında POSSIA ile yaklaşık %15 artmış ve tedavi kesildikten sonra düşmüştür. Klinik advers olayların sıklığı açısından bir fark yoktur. PLATO'da, klopidogrel alan hastalarla (%7) kıyaslandığında POSSIA alan hastaların %8'inde serum kreatinin konsantrasyonu %50'den fazla artmıştır. Artışlar tipik olarak devam eden tedavi ile gelişmez ve sıklıkla süren tedavide azalır. Tedavi artışlarının en büyük oldukları ile, tedavinin kesilmesinde geri dönüş belirtileri gözlenmiştir. PLATO'daki tedavi grupları ilgili ciddi advers olaylar açısından farklılık göstermemektedir. 4.9 Doz aşımı ve tedavisi Henüz POSSIA'nın etkilerini tersine çevirecek bilinen bir antidot yoktur, ve POSSIA'nın diyalizlenebilir olması beklenmemektedir (bakınız bölüm 4.4). Doz aşımı tedavisinde bölgesel standart tıbbi çalışma izlenmelidir. Aşırı POSSIA dozunda, kanama beklenen bir farmakolojik etkidir, eğer kanama gözlenirse uygun destekleyici tedbirler alınmalıdır. Tikagrelor 900 mg'a kadar olan tekli dozlarda iyi tolere edilir. GI toksisitenin, tekli yükselen doz çalışmasında doz sınırlayıcı olduğu belirlenmiştir. Doz aşımı ile ortaya çıkabilecek diğer klinik olarak anlamlı advers etkiler arasında dispne ve ventriküler duraklamalar mevcuttur. Doz aşımı durumunda bu potansiyel advers etkilere dikkat edilmeli ve EKG takibi düşünülmelidir. 5. FARMAKOLOJİK ÖZELLİKLER 5.1 Farmakodinamik özellikler Farmakoterapötik grup: Trombosit agregasyon inhibitörleri (Heparin hariç) ATC kodu: B01AC24 Etki mekanizması POSSIA, siklopentiltriazolopirimidinler (CPTP) kimyasal sınıfının üyesi, ADP-bağımlı trombosit aktivasyonu ve agregasyonu önleyebilen P2Y12ADP-reseptörü üzerinde etkili seçici ve tersinir olarak bağlanan adenozin difosfat (ADP) reseptör antagonisti tikagrelor içerir. Tikagrelor oral yoldan aktiftir ve geri dönüşlü olarak trombosit P2Y12ADP-reseptörü ile etkileşime girer. Tikagrelor ADP bağlayıcı bölgesi ile etkileşime girmez, fakat P2Y12 ADP-reseptörü ile etkileşimi sinyal transdüksiyonunu önler. ASA alan stabil koroner arter hastalığı olan hastalarda, tikagrelor için 0.5 saatte 180 mg yükleme dozundan sonra yaklaşık %41, dozdan 2-3 saat sonra %87.9 ila %89.6 maksimum IPA etkisi ile ortalama trombosit agregasyonu inhibisyonu (IPA) ile gösterildiği gibi tikagrelor hızlı farmakolojik etki başlangıcı göstermiştir. Dozdan 2 saat sonra hastaların %90'ında nihai kapsamlı IPA >%70'dir. Tikagrelorun yüksek IPA etkisi 2-8 saat arasında %87-%89'da devam etmiştir. Tikagrelor ve aktif metabolitinin konsantrasyonları, reseptör doygunluğu için istenen düzeyin altına düştüğünde, azalan plazma konsantrasyonları ile IPA dereceli olarak azalır. Tikagrelor geri dönüşlü bağlandığı için, trombosit fonksiyonunun geri eldesi trombositlerin rejenerasyonuna bağlı değildir. Son dozdan 4-72 saat sonra dengelemenin değişimi ile saptanmış olduğu gibi, klopidogrel ile kıyaslandığında tikagrelor IPA'nın dengelenmesi açısından daha hızlıdır (bakınız bölüm 4.4). Tikagrelorun son dozundan sonra ölçülen ortalama nihai kapsamlı IPA, klopidogrel ile kıyaslandığında tikagrelor için yaklaşık %20-30 daha yüksektir. Fakat, dozlamadan 24 saat sonra, tikagrelor ve klopidogrel arasında %IPA benzerdir ve 72. saatten 7. güne kadar klopidogrel ile kıyaslandığında tikagrelor için daha düşüktür. Son dozdan sonraki 72. saatte (3 gün) tikagrelor için ortalama %IPA, klopidogrel ile 5. günde karşılaştırılabilir ve 5. günde tikagrelor için %IPA, 7. günde klopidogrel ile benzer ve plasebodan istatistiksel belirgin farklı değildir. POSSIA ile indüklenen IPA, POSSIA'nın pik plazma konsantrasyonlarında daha düşük değişkenliğe sahiptir ve günde iki kez 90 mg doz ile gözlenen aktif metabolit klopidogrel ile karşılaştırılır. Önceden klopidogrele düşük IPA cevabı saptanan (cevap vermeyen) stabil koroner arter hastalığı olan hastalarda, birlikte ASA dozu verilen, klopidogrel ile kıyaslandığında POSSIA uygulandıktan sonra daha yüksek ortalama IPA cevabı ortaya çıkmıştır. Klopidogrele cevap vermeyen hastalarda, POSSIA'ya IPA cevabının daha yüksek ve daha uygun olduğu gözlenmiştir. POSSIA tedavisi klopidogrel ile kıyaslandığında tutarlı olarak daha yüksek IPA ile sonuçlanır ve bu durum hem cevap veren hem de cevap vermeyenler için dozlama sonrası açıkça ortadadır. Klopidogrelden tikagrelora aktarma, %26.4 absolü IPA artışı ile sonuçlanır ve tikagrelordan klopidogrele aktarma %24.5 absolü IPA azalması ile sonuçlanır. Hastalar antitrombositik etkide herhangi bir kesinti olmaksızın klopidogrelden tikagrelora geçebilir. POSSIA'nın etkililiği için klinik kanıtlar PLATO [PLATelet Inhibisyonu ve Hasta Sonuçları] çalışmasından, POSSIA ile klopidogrelin bir karşılaştırması, elde edilmiştir her iki tedavide de asetilsalisilik asit (ASA) ve diğer standart tedavi ile kombine olarak verilir. PLATO, Akut Koroner Sendromlu (stabil olmayan anjina, ST yükselmesiz miyokard enfarktüsü [NSTEMI] veya ST yükselmeli miyokard enfarktüsü [STEMI])hastalarda vasküler olayların önlenmesi için klopidogrel ile POSSIA'nın karşılaştırıldığı, 18 624 hasta ile yapılan randomize, çift körlü, paralel grup, faz III etkililik ve güvenlilik çalışmasıdır. Çalışma, göğüs ağrısı veya semptomların en güncel vakalarının başlangıcında 24 saat içinde bulunan hastaları ihtiva etmektedir. Hastalar klopidogrel (günde tek doz 75 mg, eğer önceden tiyenopiridin tedavisi verilmediyse 300 mg başlangıç yükleme dozu verilir, ilave 300 mg yükleme dozu verilmesi araştırmacının takdirine bırakılmıştır) veya 180 mg POSSIA yükleme dozu ve takiben günde iki kez 90 mg POSSIA idame dozu almak üzere randomize edilmiştir. Hastalar tıbbi olarak kontrol edilir, perkütanöz koroner girişim (PCI) veya koroner arter by pass graftı (CABG) ile müdahale edilir. Şekil 1'de bileşik etkililik sonlanım noktasında herhangi bir olayın tahmini ilk görülme riski gösterilmektedir. 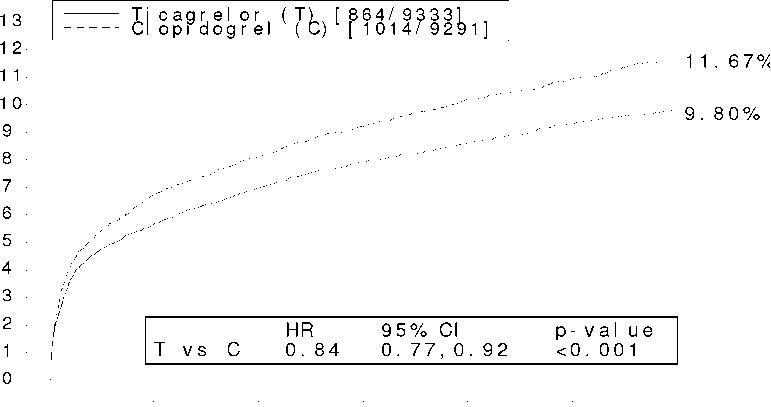
POSSIA, klopidogrel ile kıyaslandığında hem UA/STEMI hem de NSTEMI popülasyonunda primer bileşik sonlanım noktasının ortaya çıkmasını azaltır. Tablo 4 - PLATO'da sonuç olayları
nominal p-değeri 12 ay süresince bileşik etkililik sonlanım noktasının (kardiyovasküler ölüm (CV), miyokard enfarktüsü (MI), veya inme) trombotik olaylarının önlenmesinde POSSIA klopidogrele göre daha üstündür (RRR %16, ARR %1.9, NNT=54). Tedaviler arasındaki fark, inmelerde fark olmaksızın kardiyovasküler ölüm ve miyokard enfarktüsü ile çalışılmıştır. POSSIA, MI için %16 (ARR %1.1) belirgin risk azalması ve KV ölüm için %21(aRr %1.1) bağıl risk azalması göstermiştir. Klopidogrel yerine POSSIA ile tedavi edilen 91 hastada 1 KV ölüm önlenebilir. 12 aylık dönem boyunca sabit bir tedavi etkisi ile birlikte sonuç erken ortaya çıkmış (30. günde mutlak risk azalması [ARR] %0.6 ve Bağıl Risk Azalması [RRR] %12'dir) olup %16 RRR ile birlikte yıl başına %1.9'luk ARR'ye neden olmuştur. Bu durum en az 12 ay süresince AKS hastalarının POSSIA ile tedavi edilmesinin uygunluğunu gösterir (bakınız bölüm 4.2). Çoklu hasta gruplarında, yaş, cinsiyet, tıbbi geçmiş, eşlik eden tedavi ve final indeks olay teşhisi (STEMI, NSTEMI ve UA) gibi demografik özellikler ile klopidogrel yerine POSSIA tedavisinin etkililiği uygun. Zayıf belirgin bir tedavi etkileşimi bölgeler ile gözlenmiştir, dünyanın geri kalanında primer sonlanım noktası için POSSIA tedavisi risk oranı onaylanırken, çalışılan popülasyonun yaklaşık %10'unu temsil eden Kuzey Amerika'da klopidogrel risk oranı onaylanmaktadır (etkileşim p değeri =0.045). PLATO'da gözlenen bu belirgin tedavi-bölge etkileşimi makul bir şekilde en azından kısmen şansa bağlanabilir. İlave analizler, idame tedavisi sırasında klopidogrele göre POSSIA etkililiğinin ASA dozu ile bağlantılı olduğuna işaret etmektedir. Veriler, tikagrelorun ASA'nın düşük idame dozu (75150 mg) ile birlikte kullanıldığında klopidogrele göre daha yüksek bir etkililiğe sahip olduğunu göstermektedir. ASA'nın yüksek dozu (>300 mg) ile kullanılan tikagrelorun bağıl etkililiği klopidogrel karşısında daha az belirgindir. ASA'nın idame dozu ve klopidogrel ile karşılaştırıldığında tikagrelorun bağıl etkililiği arasında gözlenmiş olan bu ilişki baz alındığında, POSSIA'nın ASA'nın düşük idame dozu (75-150 mg) ile birlikte uygulanması önerilir (bakınız Bölüm 4.2 ve 4.4). POSSIA ile bağlantılı faydalar, heparin, düşük molekül ağırlıklı heparin (LMWH), intravenöz GpIIb/IIIa inhibitörler, lipid azaltıcı ilaçlar, beta blokörler, anjiotensin dönüştürücü enzim inhibitörleri, anjiyotensin II reseptör antagonisti ve proton pompası inhibitörleri de dahil olmak üzere diğer akut ve uzun süreli kardiyovasküler tedavilerin kullanımından bağımsızdır (bakınız bölüm 4.5) İnvazif tedavisi planlanan AKS hastalarında kardiyovasküler (KV) ölüm, miyokard enfarktüsü (MI) ve inme dönüm noktalarının bileşiminde POSSIA istatistiksel belirgin bağıl risk azalması göstermiştir (RRR %16, ARR %1.7, p=0.0025). Araştırmacı bir analizde, tıbbi yönetim planlanan ACS hastalarında POSSIA primer bileşik dönüm noktasının bağıl risk azalmasını gösterir (RRR %15, ARR %2.3, nominal p=0.0444). Çalışmanın primer dönüm noktası ile uyumlu olarak, bu iki gruptaki etki inmede bir etkisi olmaksızın KV ölüm ve MI ile sürer. Stent takılan hastalarda, klopidogrel ile kıyaslandığında tikagrelor ile tedavi edilen hastalarda daha az sayıda belli stent trombozu vardır (73'e karşı 107, RRR %32, ARR %0.6, nominal p=0.0123) Tüm nedenlere bağlı ölüm, MI ve inme bileşimi için klopidogrel ile kıyaslandığında POSSIA %16 istatistiksel belirgin RRR (ARR %2.1) göstermiştir. Final sekonder dönüm noktası ( tüm nedenlere bağlı ölüm) değerlendirilmiştir. Klopidogrel ile kıyaslandığında POSSIA tüm nedenlere bağlı ölüm için p=0.0003 nominal belirgin değerinde %1.4 ARR ile %22 RRR göstermiştir. PLATO genetik alt çalışması PLATO'da 10285 hastada CYP2C19 ve ABCB1 genotiplemesi, genotip gruplarının PLATO sonuçlarıyla ilişkilerini ortaya koymuştur. Klopidogrele göre tikagrelorun majör CV olaylarını azaltmadaki üstünlüğü, hastanın CYP2C19 ya da ABCB1 genotipinden anlamlı oranda etkilenmemiştir. Genel PLATO çalışmasına benzer şekilde, toplam PLATO Majör kanama da CYP2C19 ya da ABCB1 genotipinden bağımsız olarak tikagrelor ve klopidogrel arasında farklılık göstermemiştir. CABG dışı PLATO Majör kanama, bir ya da daha fazla CYP2C19 fonksiyon kaybı alleli olan hastalarda klopidogrel ile karşılaştırıldığında tikagrelor ile artış göstermiştir; fakat fonksiyon kaybı alleli olmayan hastalarda klopidogrele benzerdir. Holter alt çalışması : PLATO sırasında ventriküler aralar ve diğer aritmik olayların ortaya çıkmasını çalışmak için araştırmacılar, AKS'lerin akut fazında ve 1 ay sonra yaklaşık 2000 tanesinin kaydı olan 3000 hastalık bir alt grupta Holter izlemesi yapmıştır. Etkinin primer değişkeni >3 saniyelik ventriküler araların ortaya çıkmasıdır. Akut fazda klopidogrele (%3.5) göre POSSIA (%6.0) ile daha fazla hastada ventriküler ara vardır, 1 ay sonra bu oranlar sırasıyla %2.2 ve %1.6'dır. Klopidogrele göre POSSIA ile daha fazla hastada ventriküler ara vardır, fakat bu hasta grubunda bu dengesizlikle (pacemaker takılanlar dahil) ilgili advers klinik sonuçlar yoktur. Kombine etkililik ve güvenlilik bileşimi : Kombine etkililik ve güvenlilik bileşimi (KV ölüm, MI, inme veya PLATO tanımlı Toplam Majör Kanama) AKS olaylarından sonra 12 ay süresince klopidogrel ile karşılaştırıldığında tikagrelorun klinik faydalarını destekler (RRR %8, ARR %1.4, HR 0.92; p=0.0257). 5.2 Farmakokinetik özellikler Genel özellikler Emilim :Yaklaşık 1.5 saat ortalama tmax ile tikagrelorun absorpsiyonu hızlıdır. Tikagrelordan majör sirküle metabolit AR-C124910XX (aynı zamanda aktif) oluşumu, yaklaşık 2.5 saat ortalama tmax ile hızlıdır. Çalışılan doz aralığında (30-1260 mg) tikagrelor ve aktif metabolitinin Cmax ve AUC değerleri doza orantılı olarak artar. Tikagrelorun ortalama absolü biyoyararlanımının %36 (aralık %25.4 ila %64.0) olması tahmin edilmektedir. Yüksek yağlı beslenmenin tikagrelor Cmax değeri ve aktif metabolitin AUC değeri üzerinde etkisi yoktur, fakat tikagrelor AUC değerinde %21 artış ve aktif metabolit Cmax değerinde %22 azalma ile sonuçlanmıştır. Bu küçük değişikliklerin minimal klinik öneme sahip olduğu değerlendirilmektedir, bu sebeple tikagrelor yemeklerle birlikte veya ayrı alınabilir. Dağılım :Tikagrelorun kararlı hal dağılım hacmi 87.5 litredir. Tikagrelor ve aktif metaboliti insan plazma proteinine geniş ölçüde bağlanır (> %99). Biyotransformasyon :CYP3A, tikagrelorun metabolizmasından ve aktif metabolitin oluşumundan sorumlu majör enzimdir ve diğer CYP3A substratları ile etkileşimleri aktivasyondan inhibisyona kadar olan aralıktadır. Tikagrelor ve aktif metaboliti, P-glikoprotein zayıf inhibitörleridir. Tikagrelorun majör metaboliti, trombosit P2Y12 ADP-reseptörüne in vitrobağlanma ile değerlendirildiğinde aynı zamanda etkili olan AR-C124910XX'dir. Aktif metabolite sistemik maruziyet, tikagrelor için elde edilenin yaklaşık %30-40'dır.Eliminasyon:Tikagrelor eliminasyonunun primer yolu hepatik metabolizmadır. Radyoetiketlenmiş tikagrelor uygulandığında, radyoaktivitenin ortalama geri eldesi %84'tür (feçeste %57.8, idrarda %26.5). Tikagrelor ve aktif metabolitinin idrarda geri eldesi dozun %1'inden azdır. Aktif metabolit için primer eliminasyon yolu ağırlıklı olarak safra ile atılımdır. Ortalama t 1/2 tikagrelor için yaklaşık 6.9 saat (aralık 4.5-12.8 saat) ve aktif metabolit için 8.6 saattir. (aralık 6.5-12.8 saat) Doğrusallık/doğrusal olmayan durum :Tikagrelor doğrusal farmakokinetik gösterir ve tikagrelora maruziyet ve aktif metabolit (AR-C124910XX) yaklaşık dozla oranlıdır. Hastalardaki karakteristik özellikler Böbrek yetmezliği :Normal böbrek fonksiyonlu deneklerle kıyaslandığında şiddetli böbrek yetmezliği olan hastalarda tikagrelor ve aktif metabolitine maruziyet yaklaşık %20 daha düşüktür. Her iki grup arasında tikagrelorun IPA(trombosit aggregasyonu inhibisyonu) etkisi benzerdir, fakat şiddetli böbrek yetmezliği olan hastalarda bağımsız cevaplarda gözlenen değişkenlik daha yüksektir. Böbrek yetmezliği olan hastalarda doz ayarlamasına gerek yoktur. Diyaliz hastalarının tedavisine dair veri mevcut değildir (bakınız bölüm 4.2). Karaciğer yetmezliği :Eşlenmiş sağlıklı deneklerle karşılaştırıldığında hafif karaciğer yetmezliği olan hastalarda tikagrelor için C maksve EAA değerleri %12 ve %23 daha yüksektir, fakat tikagrelorun IPA etkisi iki grup arasında benzerdir. Hafif karaciğer yetmezliği olan hastalarda doz ayarlamasına gerek yoktur. Orta ila şiddetli karaciğer yetmezliği olan hastalarda tikagrelor çalışılmamıştır (bakınız bölüm 4.2).Geriyatrik popülasyon :Genç denekler ile kıyaslandığında yaşlılarda (> 65 yaş) tikagrelor (hem C maxmakshem de EAA için yaklaşık %50) yüksek maruziyet gözlenmiştir. Bu farklar klinik açıdan önemli olarak değerlendirilmemektedir (bakınız bölüm 4.2).Pediyatrik popülasyon :Tikagrelor Pediyatrik popülasyonda değerlendirilmemiştir (bakınız bölüm 4.2). Cinsiyet :Erkekler ile kıyaslandığında kadınlarda tikagrelor (sırasıyla C maksmaxve AUC için yaklaşık %50) yüksek maruziyet gözlenmiştir. Bu farklar klinik açıdan önemli olarak değerlendirilmemektedir.Irk :Beyaz ırktan hastalarla kıyaslandığında Asya kökenli hastalarda ortalama biyoyararlanım %39 daha yüksektir. Beyaz ırktan hastalarla kıyaslandığında POSSIA'nın biyoyararlanımı siyah ırktan hastalarda %18 daha düşüktür. Klinik farmakoloji çalışmalarında, beyaz ırkla kıyaslandığında Japon hastalarda POSSIA'ya maruziyet (Cmaks ve eAa) yaklaşık %40 (vücut ağırlığı için ayarladıktan sonra %20) daha yüksektir. 5.3 Klinik öncesi güvenlilik verileri Güvenlilik farmakolojisi, tek ve tekrarlanan doz toksisitesi ve genotoksik potansiyel klasik çalışmaları baz alındığında, tikagrelor ve majör metaboliti (AR-C124910XX) için klinik öncesi verileri insanlar için advers olaylar açısından kabul edilemez bir risk göstermemiştir. Klinik çalışmalarda gözlenmeyen fakat hayvan çalışmalarında klinik maruziyet düzeylerine benzer veya üzerinde maruziyet düzeylerinde görülen ve klinik kullanımla olası ilgili advers reaksiyonlar: gastrointestinal irritasyondur. 2 yıllık bir fare çalışmasında 250 mg/kg/güne kadar (insan terapötik dozunun 18 katından fazla) oral dozlarda bileşiğe bağlı tümörler gözlenmemiştir. 120 mg/kg/güne kadar (insan terapötik dozunun 15 katından fazla) oral dozlarda erkek sıçanlarda tümörlerde büyüme olmamıştır. Sadece yüksek doza maruz kalan (insan terapötik dozunun 25 katından fazla) dişi sıçanlarda uterus adenokarsinomları ve hepatoselüler adenomlar artı adenokarsinomlarda artış ve hipofiz adenomları ve memeli fibroadenomlarında azalma olmuştur. 60 mg/kg/gün (insan terapötik dozu ile >8 kat fark) dozda tümör insidansında artış gözlenmemiştir. Sadece sıçanlarda gözlenen uterus tümörlerinin, yüksek doz tikagrelor verilen sıçanlarda mevcut hormonal dengesizliğin non genotoksik endokrin etkisinin sonucu olabileceği bulunmuştur. Selim karaciğer tümörleri, tikagrelorun yüksek dozlarında karaciğere yerleşen metabolik yüklemenin karaciğer cevabına sekonder olarak değerlendirilmektedir. Tikagrelor in vitroin vivotestlerle bir aralıkta test edilmiş ve genotoksik olmadığı gösterilmiştir.Tikagrelorun 200 mg/kg/güne kadar (insan terapötik dozunun yaklaşık 20 katı) oral dozlarda dişi ratların fertilitesi üzerinde ve 180 mg/kg/güne kadar (insan terapötik dozunun 15.7 katı) dozlarda erkek sıçanların fertilitesi üzerinde herhangi bir etkisi bulunmamıştır. Tikagrelorun sıçanlarda 100 mg/kg/güne kadar (insan terapötik dozunun 5.1 katı) oral dozlarda ve tavşanlarda 4 mg/kg/güne kadar (insan terapötik dozuna eşit) dozlarda fetal gelişime etkisi yoktur. Tikagrelorun sıçanlarda 60mg/kg/güne kadar (insan terapötik dozunun 4.6 katı) dozlarda doğum ve doğum sonrası gelişime etkisi yoktur. 6. FARMASÖTİK ÖZELLİKLER 6.1 Yardımcı maddelerin listesi Mannitol Dibazik kalsiyum fosfat Magnezyum stearat Sodyum nişasta glikolat Hidroksipropil selüloz Talk Titanyum dioksit Demir oksit sarı Polietilen glikol 400 Hipromelloz 6.2 Geçimsizlikler Mevcut değildir. 6.3 Raf ömrü 24 ay 6.4 Saklamaya yönelik özel tedbirler 30oC'nin altında oda sıcaklığında saklayınız. 6.5 Ambalajın niteliği ve içeriği 56 (4x14 tablet) ve 168 (12x14 tablet) tabletlik kutularda takvimli blister ambalajlar. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler Kullanılmamış ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİ Zeneca İlaç Sanayi ve Tic. A.Ş. Büyükdere Cad. Yapı Kredi Plaza B Blok Kat:4 34330 Levent -İstanbul 8. RUHSAT NUMARASI 132/63 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ 30.12.2011 10. KÜB 'ün YENİLEME TARİHİ |
İlaç BilgileriPossia 90mg Film Kaplı TabletEtken Maddesi: Tikagrelor Atc Kodu: B01AC24 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.