Mivacron 10 enjektabl Kısa Ürün BilgisiKas İskelet Sistemi » Kas Gevşeticiler » Periferik Etkili Kas Gevşeticiler » Diğer Kuaterner Amonyumlar » Mivakuryum KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIMTVACRON 10 mg Enjektabl2. KALİTATİT VE KANTİTATİF BİLEŞİMEtkin madde:Her bir 5 mriik ampul;Mivakuryum 10 mg (10 mg Mivakuryuma eşdeğer mivakuryum kloriir) Yardımcı maddeler:Yardımcı maddeler için ö.l.'e bakımz.3. FARMASÖTİK FORMAmpul4. KLİNİK ÖZELLİKLER4.1.Terapötik endil^syonlarMİVACRON, genel anesteziye ek olarak iskelet kaslannı gevşetmek, trakeal entübasyonu sağlamak ve mekanik ventilasyonu kolaylaştırmak amacıyla uygulanır.
G 4.2. Pozoloji ve uygulama şekliTÜM NÖROMÜSKÜLER BLOKÖRLERDE OLDUĞU GİBİ, MİVACRON UYGULAMASI SIRASINDA BİREYSEL DOZ İHTİYACINI BELİRLEMEK İÇİN NÖROMÜSKÜLER FONKSİYONUN İZLENMESİ ÖNERİLİR.MİVACRON ile başlangıç sırasında anlamlı bir dörtlü uyarının sönmesi (train-of-four-fade) görülmez. Genellikle, 'adductor pollicis' kasının dörtlü uyan cevabı (traın-of-four-response) tamamen kalkmadan trakeanın entübasyonu mümkündür.Pozoloji/uygulama sıklığı ve süresi:Erişkinler;Enjeksiyon şeklinde:Narkotik anestezi uygulanan erişkinlerde ulnar sinir stimülasyonuna 'adductor pollİcis' tek seğirme cevabında %95 süpresyon (ED95) meydana getirecek ortalama doz 0.07mg/kg'dır (0.06-0.09mg/kg).Trakeal entübasyon için aşağıdaki dozlar önerilir: I. 0.2mg/kg'lık doz, 30 saniyede verildiğinde, 2.0-2.5 dakikada trakeal entübasyon için iyi veya mükemmel koşullan sağlar. II. 0.25mg/kg'lık doz, bölünmüş dozlar şeklinde verildiğinde (0.15rag/kg takiben 30 saniye sonra O.img/kg), ilk doz kısmının verilmesinin bitişini takiben 1.5-2.0 dakika içinde trakeal entübasyon için iyİ veya mükemmel koşulları sağlar. Sağlıklı yetişkinlerde önerilen bolus dozu 0.07-0.25mg/kg'dır. Nöromusküler blok süresi doza bağlıdır. 0.07, 0.15, 0.20 ve 0.25mg/kg'lık dozlar sırasıyla yaklaşık 13, 16, 20 ve 23 dakika süreyle, klinik olarak etkili blok sağlar. 0.15mg/kg'a kadar olan dozlar 5-15 saniyede verilebilir. Daha yüksek dozlar, kardiyovasküler etkilerin oluşma olasılığını en aza indirmek için 30 saniyenin üzerinde verilmelidir. Tam blok süresi MtVACRON'un idame dozlanyla uzatılabilir. Narkotik anestezi sırasında uygulanan O.img/kg'hk dozlarm her biri yaklaşık 15 dakikalık ilave klinik olarak etkili blok etkisi sağlar. Artarda uygulanan ek dozlar nöromusküler blok etkisinde birikmeye neden olmaz. Mivakuryumun nöromusküler blokör etkisi izofluran veya enfluran anestezisiyle kuvvetlendirilir. İzofluran veya enfluran ile kararh durum anestezisi sağlanmışsa önerilen MİVACRON başlangıç dozu %25 azaltılmalıdır. Halotan mivakuryumun etkisini sadece minimum ölçüde kuvvetlendirdiği için dozda herhangi bir azaltma gerekli olmayabilir. Spontan düzelme bir kez başlayınca yaklaşık 15 dakikada tamamlamr ve uygulanan doza bağlı değildir. Mivakuryumla oluşturulan nöromusküler blok, antikolinesteraz ajanlann standart dozlarıyla geriye çevrilebilir. Bununla beraber, mivakuryum sonrasmda düzelme hızlı olduğu ve geriye çevrilme (düzehne) süresini sadece 5-6 dakika kısalttığı için rutin olarak antikolinesteraz ilaçlar gerekli ohnayabilir. BU İLAÇ SADECE HASTANEDE VE DENETİM ALTINDA KULLAND.MALIDIR. infiizyon şeklinde:Çjgerektiği gösterilmiştir.MİVACRON infuzyonundan sonra spontan düzelme infüzyon süresine bağımh değildir ve tek doz uygulaması sonrasında bildirilen düzelme ile karşılaştınlabilir. MİVACRON'un sürekli İnfiizyonuna bağlı olarak taşiflaksi veya kümülatif nöromusküİer blok gelişimi görülmemektedir. Enjeksiyonluk MİVACRON (2mg/nü) infüzyon için seyreltihneden kullanılabilir. Enjeksiyonluk MİVACRON aşağıdaki infüzyon smlanyla geçimlidir: Sodyum Klorür İntravenöz İnfuzyon (%0.9 a/h) Glukoz İntravenöz İnfüzyon (%5 a/h) Sodyum Klorür (%0.18 a/h) ve Glukoz (%4 a/h) İntravenöz İnfuzyon Laktath Rİnger Solüsyonu, USP Yukandaki infüzyon solüsyonlarıyla l'e 3 oranıyla (Örn. 0.5mg/ml elde edilecek şekilde) seyredildiğinde MİVACRON enjeksiyonun SO^C'de en az 48 saat kimyasal ve fiziksel olarak stabil kaldığı gösterihniştir. Bununla beraber ürün hiçbir antimikrobiyal koruyucu madde içermediği içİn seyreltme hemen kullamm öncesinde yapıhnalı ve uygulamaya mümkün olduğu kadar erken başlanmalı ve artan solüsyon atılmalıdır. Uygulama şekli:MİVACRON İntravenöz enjeksiyon yoluyla uygulanır. Nöromusküİer bloğun idame ettirilmesi için sürekli MİVACRON infüzyonu uygulanabilir.MİVACRON kesinlikle intramusküler uygulanmamalıdır. özel popülasyonlara ilişkin ek bilgiler: Böbrek/Karaciğer yetmezliği: Son dönem hepatik yetersizlik görülen hastalarda 0.15mg/kg'Iık dozla meydana gelen klinik etkili blok süresi hepatik fonksiyonu normal olan hastalara nazaran yaklaşık 3 kez daha uzundur. Bu uzama bu hastalarda görülen azalmış plazma kolinesteraz aktivitesine bağlıdır. Bu nedenle doz hastaların bireysel klinik cevaplanna göre ayarlanmalıdır. Son dönem böbrek yetersizliği görülen hastalarda 0.15mg/kg'lık dozla meydana gelen klinik etkili blok süresi böbrek fonksiyonu normal olan hastalara nazaran yaklaşık 1.5 kez daha ımındur. Bu nedenle doz hastalann bireysel klinik cevaplarına göre ayarlanmalıdır. Pediatrik popülasyon: 7 ay-12 yaş arası çocuklarda doz:MİVACRON'un yetişkinlere nazaran 7 ay-12 yaş bebek ve çocuklarda ED95 değeri daha yüksek (yaklaşık O.img/kg), etkinin başlaması hızlı, klinik etkinlik olarak etki süresi daha kısa ve spontan düzelme daha hızlıdır. Önerilen bolus dozu 7 ay-12 yaş arası bebek ve çocuklarda 5-15 saniyede uygulanan 0.1-0.2 mg/kg'dır. Stabil narkotik ve halotan anestezisi altında uygulandığında 0.2 mg/kg ortalama 9 dakikalık klinik olarak etkin blok oluşturur. 7 ay - 12 yaş arası bebek ve çocuklarda trakeal entübasyon için 0.2 mg/kg'lık MİVACRON dozu önerilir. Bu dozun uygulanmasından 2 dakika sonra maksimum bloğa ulaşılır ve bu süre içinde entübasyon yapılması mümkün olabilir.Çocuklarda ve bebeklerde genellikle erişkinlerde olduğundan daha sık idame dozlan gereklidir. Mevcut veriler 0.1 mg/kg'lık idame dozlannın narkotik veya halotan anestezisi sırasında yaklaşık 6-9 dakikalık, klinik olarak etkili ek blok sağlayabileceğini göstermektedir. C - Spontan düzelme bİr kez başlayınca yaklaşık 10 dakikada tamamlamr. İnfüzyon şeklinde kullanım:Çocuklarda ve bebeklerde genellikle erişkinlerdekinden daha yüksek infüzyon hızları gerekir. Halotan anestezisi sırasında 7-23 aylık hastalarda %89-99 nöromusküler bloğun idame ettirilmesi için gereken infüzyon hızı ortalama 11 mİkrogram/kg/dakikadır (Yaklaşık 0.7 mg/kg/saat) [3-26 mikrogram/kg/dakika aralığında] (yaklaşık G.2-1.6 mg/kg/saat)]. 2-12 yaşındaki çocuklarda halotan veya narkotik anestezi altında eşdeğer ortalama infüzyon hızı 13-14 mikrogram/kg/dakikadır (yaklaşık 0.8 mg/kg/saat) [5-31 mikrogram/kg/dakika aralığında] (yaklaşık 0.3-1.9mg/kg/saat). MİVACRON'un nöromuslcüler blokör etkisi İnhalasyon ajanlarla kuvvetlendirilir. Yapılan bir çalışmada 2-12 yaş arasındaki çocuklarda sevofluran ile kullanıldığında infüzyon hızında %70'e kadar azaltılması gerektiği gösterilmiştir. 2-6 aylık bebeklerde dozaj:2-6 aylık bebeklerde MtVACRON ED95 değeri yetişkinlerdekine benzer (0.07 mg/kg), fakat etki başlaması daha hızlıdır ve klinik olarak etkili süre daha kısadır ve spontan düzelme daha hızlıdır.Önerilen bolus doz yayılunı 2-6 aylık bebek ve çocuklarda 5-15 saniyede uygulanan 0.1-0.15 mg/kg'dır. Stabil halotan anestezisi sırasında uygulandığmda 0.15mg/kg'hk doz ortalama 9 dakikalık klinik olarak etkili blok oluşturur. 2-6 aylık bebeklerde intratrakeal entübasyon için O.lSmg/kg'lık bir MtVACRON dozu önerilir. Bu dozun uygulanmasını takiben yaklaşık 1.4 dakikada maksimum bloğa ulaşılır ve bu süre için entübasyon mümkün olabilir. 2-6 aylık bebeklerde yetişkinlere nazaran daha sık idame dozlan gerekebilir. Mevcut veriler, halotan anestezisi sırasında 0.1 mg/kg'lık bir idame dozunun yaklaşık 7 dakikalık ilave klinik olarak etkili blok vereceğini göstermektedir. Spontan düzelme bir kez başlayınca, yaklaşık 10 dakikada tama mlanır.İnfüzyon şeklinde kullanım:2-6 aylık bebeklerde genellikle erişkinlerden daha yüksek infüzyon hızları gerekir. Halotan anestezisi sırasında %89-99 nöromusküler blok için gerekli ortalama infüzyon hızı 11 mikrogram /kg/dakikadır (yaklaşık olarak 0.7 mg/kg/saat (4-24 mikrogram /kg/dakika arahğında - yaklaşık 0.2-1,5mg/kg/saat).Yenidoğan ve 2 ayın altındaki bebeklerde doz:Yeterli klİnİk bilgi elde edilinceye kadar yenidoğan ve 2 ayın altındaki bebeklerde herhangi bir doz önerilmemektedir.Geriyatrik popfilasyon: MİVACRON'un tek bolus dozlan uygulanan yaşh hastalarda etkİ başlangıç süresi, etkinin devam süresi ve düzelme hızı genç hastalara nazaran %20-%30 daha uzayabilir. Yaşlı hastalara daha küçük veya daha seyrek uygulanan idame bolus dozlan gerekebilir. İnfüzyon şeklinde kullanım:Yaşlı hastalarda infüzyon hızımn azaltılması gerekebilir.Diğer: Kardiyovasküler hastalığı olanlar: Klinik balamdan önemli kardİyovasküler hastalığı olan hastalarda MİVACRON'un başlangıç dozu 60 saniye içinde uygulanmalıdır. Bu şekilde MİVACRON, kalp cerrahisi uygulanmakta olan hastalara minimal hemo dinamik etkiyle uygulanmaktadır. Plazma kolinesteraz aktivitesi azalmış hastalar: Mivakuryum, plazma kolinesterazı tarafindan metabolize edilir. Plazma kolinesteraz aktivitesi, plazma kolinesterazm genetik anormallikleri mevcudiyetinde (örn. atipik plazma kolinesteraz geni için heterozigot veya homozİgot hastalarda) ve çeşitli patolojik durumlarda (Bkz. Böbrek/Karaciğer yetmezliği) ve bazı ilaçlarla birlikte uygulanması (Bkz. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri) durumunda azalabilir. Plazma kolinesteraz aktivitesi azalmış hastalarda MİVACRON uygulamasım takiben nöromusküler blokta uzama göz önüne alınmalıdır. Plazma kolinesteraz aktivitesinde hafif azahnalara (Örn. normal aralığın alt limiinin%20'si içinde) bağlı olarak etki süresinde klinik önemi olan etkiler görülmez. Atipik plazma kolinesteraz geni için heterozigot hastalarda 0.15 mg/kg'hk MİVACRON'la sağlanan klinik bakımdan etkili blok süresi kontrol grubu hastalara göre yaklaşık 10 dakika daha uzundur.Obez hastalar: Obez hastalarda (boylanna göre ideal vücut ağırlıkları %30 veya daha fazla olanlar) MİVACRON başlangıç dozu için gerçek ağırlık değil ideal ağırlık esas alınmalıdır. 4.3. Kontrendikasyonlar MİVACRON, mivakuryuma veya yardımcı maddelerine aşın duyarlı olduğu bilinen hastalara uygulanmamahdır. MİVACRON, atipik plazma kolinesteraz geni için homozigot olduğu bilinen hastalarda kontrendikedir. MİVACRON gebe kadınlarda kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriBÜTÜN DİĞER NÖROMÜSKÜLER BLOKÖRLERİ GİBİ, MİVACRON DA DİĞER İSKELET KASLARI İLE BİRLİKTE SOLUNUM KASLARINDA DA FELÇ OLUŞTURUR, ANCAK ŞUUR ÜZERİNDE HERHANGİ BİR ETKİSİ YOKTUR. MİVACRON, SADECE UYGUN GENEL ANESTEZİ İLE BİRLİKTE, ENDOTRAKEAL ENTÜBASYON VE YAPAY SOLUNUM İÇİN UYGUN OLANAKLARIN MEVCUDİYETİNDE UYGULANMALIDIRMivakuryum uygulaması ardından aşağıdaki durum ya da patolojik olaylarda plazma kolİnesteraz aktivitesi azalmasma bağlı olarak uzamış ve yoğun nöromusküler blokaj ortaya çıkabilir: Gebelik ve puerperium gİbi fizyolojik değişiklikler (bkz. Gebelik ve Laktasyon), Genetik plazma kolİnesteraz anormallikleri (aşağıya ve Kontrendikasyonlara bakımz) Şiddetli yaygın tetanoz, tüberküloz ve diğer şiddetlİ/lcronik enfeksiyonlar Kronik yıkıcı hastalık, maligmte, kronik anemi ve malnütrİsyon. Miksödem ve kollajen hastalıklar. Dekompanze kalp hastalığı. Peptik Ülser. Yanıklar (aşağıya bakınız), Son e\Te karaciğer hastalığı (bkz. Pozolojİ ve Uygulama Şekli). Akut, kronik ya da son evre böbrek yetmezliği (bkz. Pozoloji ve Uygulama Şekli). İyatrojenik: plazma değişimi, plazmaferez, kardiyopulmoner bypass, eşzamanlı ilaç tedavisi (bkz. Etkileşimler) ardından. Atipik plazma kolİnesteraz geni için homozigot olan hastalar (2500 hastada 1 hasta) süksametonyum/süksinilkoline olduğu gibi mivakuryumun nöromusküler bloke edici etkisine de fazla duyarhdırlar. Böyle üç hastada 0.03 mg/kg'hk küçük bir MİVACRON dozu (genotipik bakımdan normal hastalarda yaklaşık EDI0-20) 26-128 dakikalık tam nöromusküler blok oluşturmuştur. Bu hastalarda bir kez spontan düzehne başladığında nöromusküler blok neostigminin konvansiyonel dozlanyla antagonize edilmiştir. Histamine duyarlılığı akla getiren bazı durumlarda (örn. astımlılar gibi) MİVACRON uygulanmasında dikkatli olunmalıdır. Bu gruptaki hastalarda MİVACRON kullamlırsa uygulama süresi 60 saniye olmalıdır. Diğer nöromusküler blokör ajanlara aşın duyarlılık gösteren hastalara MİVACRON uygularken nöromusküler blokör ajanlar arasında çapraz-duyarhhk bildirildiğinden dikkatli ohnalıdır. Hipovolemik hastalar gibi arteriyel kan basıncı düşmelerine fazla duyarlı hastalarda MİVACRON 60 saniyelik bir sürede uygulanmalıdır. Yetişkinlerde, MİVACRON >0.2 mg/kg (> 3xEDgs) dozlannda hızlı bolus enjeksiyon şeklinde verildiğinde histamin salıverilmesi olabilir. Ancak, 0.2mg/kg MİVACRON'un daha yavaş uygulanması ve 0.25 mg/kg MİVACRON dozunun bölünmüş dozlarda verilmesi (Bkz. Pozolojİ ve uygulama şekli) bu dozlardaki kardiyovasküler etkileri en aza indirir. Klinik çalışmalarda 0.2 mg/kg'lık hızlı bolus doz ile çocuklarda kardiyovasküler güvenilirliğin tehlikeye girdiği görülmemiştir. Önerilen dozlarda MİVACRON önemli vagal veya gangliyon bloke edici özellikler göstermez. Önerilen dozlarda MİVACRON'un kalp atış hızı üzerinde önemli hiçbir etkisi yoktur ve birçok anestezik ilaç veya ameliyat sırasında vagal stimülasyonla meydana gelen bradikardiye karşı etkili olmaz. ' Diğer non-depolarizan nöromusküler blokörlerle olduğu gibi miyastenia gravis hastalannda, diğer nöromusküler hastalıklan olan hastalarda ve kaşektik hastalarda mivakuryuma karşı duyarlıhğm artması beklenebilir. Ciddi asit-baz veya elektrolit anormallikleri, mivakuryuma duyarlıhğı artırabilir veya azaltabilir. MİVACRON solüsyonu asİdiktir (pH yaklaşık 4.5) ve yüksek alkali solüsyonlarla (Öm. barbiturat solüsyonları) aym enjektörde karıştırılmamalı veya aynı iğneden birlikte uygulanmamalıdır. Yaygın şekilde kullamlan bazı asidik perioperatif solüsyonlarla (Öm. fentanil, alfentanil, sufentanil, droperidol ve midazolam) geçimli olduğu gösterilmiştir. MİVACRON İçin kullamlan yerleşik İğne veya kanül diğer anestezik ajanlarm uygulanması için kullanılacaksa ve geçimlilikleri kamtlanmamışsa her ilacm serum fizyolojik ile tamamen yıkanması önerilir. Yanıklı hastalarda non-depolarizan nöromusküler blokörlere direnç gelişebilir ve nöromusküler blokör dozunun artmiması gerekebilir. Bununla beraber, bu hastalarda dozun azaltılmasım gerektiren plazma kolinesteraz aktivitesi azalması da olabilir. Bu nedenle, yanıklı hastalara 0.015-0.020mg/kg'lık bir MİVACRON test dozunun arkasından bir periferik sinir stimulanıyla bloğun izlenmesine göre ayarlanan uygun dozlama yapılır. MİVACRON, malign hipertermiye duyarlı insanlarda araştırılmamıştır. Nöromusküler bloğun geri dönmesi:Diğer nöromusküler blokör ajanlarda olduğu gibi geri döndürücü bir ajanm (neostigmin gibi) verilmesinden önce spontan düzelme belirtileri gözlenmelidir. Nöromusküler bloğun geri dönüşünü değerlendirmek için, öncesinde ve düzelmeyi takiben periferik sİnİr stimülasyonu kullamiması kuvvetle önerilmektedir.Yoğun bakım ünitesinde mekanik ventilasyon uygulanan hastalarda MİVACRON'un uzun süreli kullanımı üzerinde veri mevcut değildir. 4.5. Diğer tıbbi ürünler ile etkileşim ve diğer etkileşim şekilleriMivakuryum tarafından oluşturulan nöromusküler blok, enfluran, izofluran ve halotan gibi inhalasyon anestezikleriyle birlikte verildiğinde uzatılabilir. MİVACRON, süksametonyumla kolaylaştınlan trakeal entübasyon sonrasında emniyetli şekilde uygulanmıştır. MİVACRON uygulamasından önce süksametonyumdan spontan düzekne görüldüğü mutlaka gözlenmelidir. Bütün non-depolarizan nöromusküler blokörlerle olduğu gibi non-depolarizan nöromusküler bloğun şiddet ve/veya süresi aşağıdakilerle etkileşim nedeniyle artabilir ve infuzyon gereksinimleri azalabilir:Antibiyotikler:Aminoglikozidler, polimiksinler, spektinomisin,tetrasiklinler, linkomisİn ve klindamİsin ^ Anti-aritmik ilaçlar:Propranolol, kalsiyum kanal blokörleri, lidokain,prokainamid ve kinidin Diüretikler:Furosemid ve muhtemelen tiazidler, mannitol ve asetazolamid,magnezyum tuzlan, ketamin, lityum tuzlan Gangliyon hlokörü ilaçlar:Trimetafan, hekzametonyumPlazma kolinesteraz aktivitesini azaltabilen ilaçlar aym zamanda MİVACRON'un nöromusküler blokör aktivitesini de uzatabilir. Bu ilaçlar arasında antimitotik ilaçlar, monoamin oksidaz inhibitörleri, ekotiyopat iyodür, pankuronyum, organofosfatlar, antikolinesterazlar, bazı hormonlar, bambuterol bulunur. Nadiren bazı ilaçlar miyastenİa gravİsi şiddetlendirebilİr veya gizli miyastenia gravisi ortaya Çjçıkarabilir veya gerçekten bir miyastenik sendromu indükleyebilir; böyle bir gelişme sonrasmda MİVACRON'a karşı artmış duyarlılık görülebilir. Bu gibi ilaçlann arasında antibiyotikler, beta-blokörler (propranolol, oksprenolol), antiaritmik ilaçlar (prokainamid, kinidin), anti-romatizmal ilaçlar (klorokin, D-pensİllamin), trimetafan, klorpromazin, steroidler, fenitoin ve lityum bulunur. MİVACRON diğer non depolarizan nöromusküler blokörlerle kombinasyon halinde verildiğinde, nöromusküler blokaj etkisinde artma görülür. Bu artış, MİVACRON'un total dozundan beklenen etki gücünden daha fazladır. Değişik ilaç kombinasyonlannda bu sineıjik etki çeşitlilik gösterir.Süksametonyum klorür gibi depolarizan bir kas gevşeticinin birlikte uygulanması uzun ve antikolinesteraz ilaçlarla tersine çevrilmesi güç, kompleks bir bloğa neden olabileceği için non-depolarizan nöromusküler blokörlerin nöromusküler blok etkilerim uzatmak için bu gibi depolarizan kas gevşetici ilaçlar uygulanmamahdır. özel popttlasyonlara ilişkin ek bilgilerÖzel popülasyonlara ilişkin herhangi bir etkileşim çalışması yapılmamıştır.4.6. Gebelik ve laktasyon Genel tavsiyeGebelik Kategorisi: CÇocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Hayvanlar üzerinde yapılan çalışmalar, gebelik/ve-veya/ embriyonal/fetal gelişim/ve-veya /doğum /ve-veya doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. İnsanlara yönelik potansiyel risk bilinmemektedir.Ç) MIVACRON grldi olmadıkça gblik dönmindkullamlmamalıdır.Gebelik dönemiGebelik sırasında plazma kolin esteraz düzeyleri azalır. MtVACRON sezaryende nöromusküler blokajı sürdürmek için kullanılmıştır. Fakat plazma kolin esteraz düzeylerindeki azalma nedeniyle infuzyon hızmda doz ayarlaması gerekmiştir. Sezaryen sırasında önceden MgSÛ4 ile tedavi edilen hastalarda Mg'un potansiyalize edici etkisi nedeniyle infuzyon hızında daha da azaltma gerekebilir. MİVACRON gerekli olmadıkça gebelik döneminde kullanılmamalıdır. MİVACRON gebelikte anneye sağlaması beklenen potansiyel yararlan fetüs üzerinde olası risklerinden fazla ise kullanılabilir.Sezaryen sırasında MİVACRON kullanımıyla ilgili bir tecrübe yoktur. Laktasyon dönemiMivakuryumun anne sütüyle atılıp atılmadığı bilinmemektedir.Üreme yeteneği/FertiliteMİVACRON'nun üreme yeteneği ve fertilite üzerindeki etkisi bilinmemektedir.4.7. Araç ve makine kullanımı üzerindeki etkilerBildirilmemiştir.4.8. İstenmeyen etkilerİstenmeyen etkilerin sıklık gruplandırması şu şekildedir.Çok yaygm (> 1/10); yaygın (> 1/100 - <1/10); yaygın olmayan (> 1/1000 - <1/100); seyrek (> 1/10.000 - <1/1.000); Çok seyrek (<1/10.000); Bilinmiyor, (eldeki verilerden hareketle tahmin edilemiyor.) Kardiyak hastahklanYaygm olmayan: Geçici taşikardiVasküler hastalıklar*Çok yaygm: Deride kızanklık Yaygın olmayan: HipotansiyonSolunum, göğüs bozuklukları ve mediastinal hastalıklarıYaygm olmayan: BronkospazmBağışıklık sistemi hastalıklarıÇok seyrek: MİVACRON'u bir ya da daha fazla anestezik ajanla birlikte kullanan hastalarda çok nadir olarak ciddi anafilaksi veya anafilaktoid reaksiyonlar rapor edilmiştir.Deri ve deri altı doku hastalıklarıYaygm olmayan: Erit em, ürtikerMİVACRON uygulaması ile ilgili olarak, hafif geçici hipotansiyon, geçici taşikardi veya bronkospa2aii görüldüğü bildirilmiş ve bu durum histamin salınımıyla ilişkilendirilmiştir. Bu etkiler doza bağlıdır ve 0.2mg/kg veya daha yüksek başlangıç dozlarmın hızlı verilmesiyle daha sık görülür. Eğer MİVACRON 30-60 saniyede verilirse veya 30 saniyenin üzerinde bölünmüş dozlarda verilirse bu etkiler azalır. 4.9. Doz aşımı ve tedavisiUzun süreli kas paralizisi ve buna bağlı olarak görülen olaylar nöromusküler blokörler için temel doz aşımı bulgulandır. Bununla beraber, özellikle kan basmcmm düşmesi olmak üzere hemodinamik yan etkilerin riski de artabilir. Spontan solunum yeterli olana kadar hava yolımun açık tutulması ve pozitif beısınçlı ventilasyon uygulanması zorunludur. Bilinç yerinde olduğu için tam sedasyon gerekir. Düzelme, spontan düzelme bulgularımn görülmesi üzerine atropin veya glikopİrolat ile birlikte antikolinesteraz ilaçlarm uygulanmasıyla hızlandınlabilir. Hastanın pozisyonunun uygun şekilde ayarlanması ve sıvı uygulanması veya gereğine göre, vazopresör ilaçlann uygulanmasıyla kardiyovasküler destek sağlanabilir.5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup:Nöromuslcülr BlokörlrKas gevşeticiler, periferik etkili ajanlar ATC-kodu: M03AC10Mivakuryum, kısa etki süreli, geriye dönüş profili hızlı, seçiciliği yüksek, non-depolarizan nöromusküler blokördür. Mivakuryum üç stereoizomerin bir karışımıdır. Trans-trans ve cis-trans stereoizomerleri mivakuryum klorûrün % 92-96'sını oluşturur. Yapılan araştırmalarda bunlann nöromusküler blok oluşturma gücü birbirinden veya mivakuryum klorürünkinden öne mli ölçüde farklı bulunmamıştır. Çalışmalarda cis-cis izomerinin nöromusküler blok oluşturma gücünün, diğer iki stereoizomerin onda biri kadar olduğu hesaplanmıştır.5.2. Farmakokinetik özellikler Genel özelliklerEmilim: Mivakuryum intravenöz yoldan uygulamr. Etkisi yaklaşık 3-6 dk. başlar ve 15-30 dk. sürer.Dağılım:Esas olarak ekstraselüler sıvıya dağılır. Plazmada çok hızlı hidroliz olduğu için proteinlere baglatmıası araştınlamamıştır.Bivotransformasvon:Plazma kolinesterazıyla enzimatik hidroliz mivakuryumun inaktive edilmesi için primer mekanizmadır ve bir kuatemer alkol ve bir kuatemer monoester metabolit oluşur. Mivakuryumun nöromusküler blokör aktivitesinin sonlanması esas olarak insan plazmasında yüksek seviyelerde bulunan plazma psödokolinesteraz ile hidrolizine bağlıdır. Elimİnasvon:Mivakuryumun (öm. karaciğer esterazları ile hidroliz, safra içinde elimİnasyon ve böbrek yoluyla atılım gibi) çeşitli eliminasyon yollarının olduğu görülmektedir. 5.3. Klinik Öncesi güvenlilik verileriMutaienite:Mivakuryum kısa dönem mutajenite testlerinde değerlendirilmiştir. Ames Salmonella tayini, fare lenfoma tayini, insan lenfosit tayini ve in vitrosıçan kemik iliği sitogenetik tayininde mutajenik değildi.Karsinoienite:Mivakuryumun karsinojenik olup olmadığı hakkında herhangi bir veri bulunmamaktadır. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesipH ayan için yeterli miktarda hidroklorik asit çözeltisi, 5 mi'ye tamamlanacak miktarda enjeksiyonluk su.6.2. GeçimsizliklerMİVACRON asidiktir (yaklaşık pH 4.5) ve barbitüratlar gibi yüksek derecede alkalik olan çözeltiler ile karıştınimamalıdır.6.3. Raf ömrüO ''y6.4. Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında saklaymız. Işıktan koruyunuz. Dondurmayımz.6.5. Ambalajın niteliği ve içeriği5 mriİk Tip I ampul6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerTüm kullanılmayan ürün ve atık maddeler Tıbbi Atıklann Kontrolü Yönetmeliği veAmbalaj ve Ambalaj Atıklannın Kontrolü Yönetmeliği ne uygun olarak imha edilmelidir. Kullanıma hazırlama ve imha talimatlar:Hiçbir koruyucu madde içermediği için MİVACRON tam aseptik koşullarda kullanılmalı ve seyreltme hemen kullanım öncesinde yapılmalıdır. Açık ampullerde kalan kullamimamış solüsyon atılmalıdır. MİVACRON enjeksiyonun, asidik solüsyonlar şeklinde, yaygın şekilde kullamlan perİ-operatif ilaçlarla geçimli olduğu kanıtlanmıştır. Bu gibi ilaçlar MİVACRON için kullamlan yerleşik iğne veya kanülle uygulanacaksa ve geçimlilikleri kanıtlanmamışsa her ilacın serum fizyolojik ile tamamen yıkanması önerilir. Ampul açma talimatları:Ampuller OPC (Tek Kırma Noktası) açma sistemi ile donatılmışlardır ve aşağıdaki talimatlar doğrultusunda açılmalıdırlar; Ampul, Resim 1 'de gösterildiği gİbi alt kısmından tutulur
O Resim 2'de gösterildiği gibi diğer elinizin başparmağı ampuldeki renkli noktaya bastmiır. 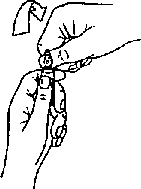 
7. RUHSAT SAHİBİGlaxoSmithKline İlaçlan San. ve Tic. A.Ş., Levent/İstanbul.Büyükdere cad. No. 173, 1.Levent Plaza, B Blok 34394 1 .Levent/İstanbul
O
Tel no Faks no
:212 ;212
339 44 00 339 45 00 8. RUHSAT NUMARASI103/929. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk Ruhsat Tarihi: 01.05.1998 Ruhsat Yenileme Tarihi: 16.09.200510. KÜB'ün YENİLEME TARİHİKÜB 02 28.12.201114/14 |
İlaç BilgileriMivacron 10 enjektablEtken Maddesi: Mivakuryum Atc Kodu: M03AC10 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.