Ozurdex 0.7mg İntravitreal İmplant Kısa Ürün BilgisiDuyu Organları » Göz ve Kulak İlaçları » Kortikosteroidler » Göz ve Kulak için Kortikosteroidler » Deksametazon KISA URUN BILGISI1. BEŞERİ TIBBİ ÜRÜNÜN ADI OZURDEX* 0.7 mg intravitreal implant2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde: Her bir implant, ii<i derecede PLGA'dan (50:50 PLGA esteri ve 50:50 PLGA asidi) oluşan 50:50 poli D,L-laktid-ko-glikolid polimer matriks içinde 0.7 mg deksametazon içerir. Yardımcı maddeler: Yardımcı maddelerin tüm listesi için 6.1'e bakınız. 3. FARMASÖTİK FORM İntravitreal implant Dışarıdan bakıldığında görünmeyen çubuk şeklinde bir implant içeren, tek kullanımlık enjeksiyon cihazı. İmplant yaklaşık 0.46 mm çapında ve 6 mm uzunluğundadır. İmplant görseli ve kesiti ile bilgilendirici şema aşağıda sunulmaktadır: APLİKATÖR İÇİN SEMADEX PS DDS Aplikatör  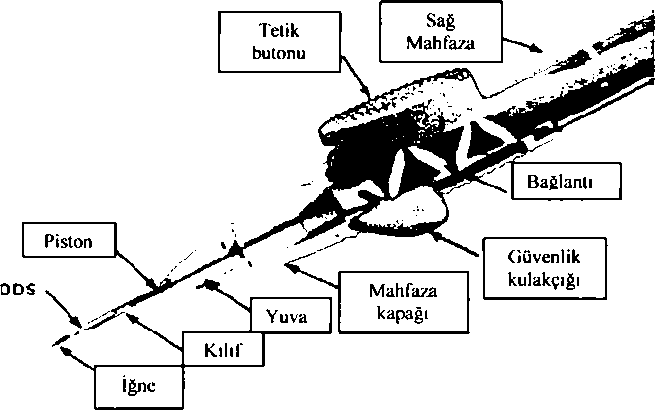
4. KLINIK ÖZELLIKLER4.1 Terapötik endikasyonlarOZURDEX®, Retina Ven Dalı Tıkanıklığı (RVPT [BRVO]) veya Santral Retinal Ven Tıkanıklığını (SRVT [CRVO]) takiben, maküler ödemi olan yetişkin hastaların tedavisinde endikedir.OZURDEX''^, gözün posteriyor segmentinde, kendisini non-infeksiyöz üveit şeklinde gösteren enflamasyonu olan yetişkin hastaların tedavisinde endikedir. 4.2 Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:OZURDEX®, intravitreal enjeksiyonlarda deneyimli bir göz hastalıkları uzmanı tarafından uygulanmalıdır.Tavsiye edilen doz, etkilenen göze intravitreal olarak uygulanan bir OZURDEX*^ implantıdır. Her iki göze eşzamanlı olarak uygulanması tavsiye edilmemektedir (Bkz. Bölüm 4.4). Hasta tedaviye yanıt verdikten daha sonra eğer görme keskinliğinde kayıp gelişirse ve doktorun düşüncesine göre önemli bir riske maruz kalmaksızın tekrar tedaviden yarar görebilecekse, tekrarlanan uygulamalar gündeme getirilebilir (Bkz. Bölüm 5.1). Görmede iyileşme sağlanan ve bu iyileşmenin devam ettiği hastalarda, tekrar tedavisi uygulanmamalıdır. OZURDEX® ile azaltılamayan bir görme bozukluğu olan hastalarda tekrar tedavisi uygulanmamalıdır. 6 aydan daha kısa aralıklarla doz tekrarlanması konusundaki bilgiler çok kısıtlıdır (Bkz. Bölüm 5.1). Posteriyor segment non-infeksiyöz üveitte tekrarlı uygulamalar ya da retinal ven dalı tıkanıklığında 2 implanttan fazla uygulama konusunda halen deneyim bulunmamaktadır. Infeksiyon ya da göz içi basıncında artış gelişmesi halinde erken tedaviye imkân sağlanabilmesi için, hastalar enjeksiyondan sonra izlenmelidir (Bkz. Bölüm 4.4). Uygulama şekli:Tek kullanımlık aplikatörlü intravitreal implant sadece intravitreal kullanım içindir.Her aplikatör yalnızca tek bir gözün tedavisi için kullanılabilir. İntravitreal enjeksiyon prosedürü kontrollü aseptik koşullar altında (steril eldiven, steril örtü ve steril göz kapağı spekulumu veya eşdeğerin kullanımı) yürütülmelidir. Enjeksiyondan önceki gün ve enjeksiyon gününde, hastaya geniş spektrumlu topikal antibiyotik verilmelidir. Yeterli bir lokal anestezi uygulanmalıdır. Aplikatörün içinde bulunduğu folyo torba kutudan çıkarılır ve hasarlı olup olmadığı incelenir (Bkz. Bölüm 6.6). Daha sonra, folyo torba steril bir ortamda açılır ve aplikatör yavaşça steril bir tepsiye yerleştirilir. Aplikatörün kapağı dikkatli bir şekilde çıkarılır. Aplikatör, folyo açıldıktan hemen sonra kullanılmalıdır. Aplikatör tek elde tutulur ve aplikatörün güvenlik kulakçığı düz bir şekilde çekilir. Kulakçık çekilirken kıvrılmamasına veya bükülmemesine özen gösterilmelidir. İğne, eğimli kısmı skleraya göre yukarıda kalacak şekilde skleraya yaklaşık 1 mm kadar sokulur ve silikon uç konjonktivanın karşısında kalana kadar vitröz boşluk içinde gözün ortasına doğru yeniden yönlendirilir. İşitilebilir bir klik sesi fark edilene kadar tetik butonuna yavaşça basılır. Aplikatör gözden çıkarılmadan önce, tetik butonuna tamamen basıldığından ve aplikatör yüzeyi ile aynı hizada olacak şekilde kilitlenmiş olduğundan emin olunmalıdır. İğne, vitreusa giriş için kullanılmış olan aynı doğrultudan çıkarılır. OZURDEX* enjekte edildikten hemen sonra, implantasyonun başarılı olduğunun doğrulanması amacıyla, enjeksiyonun yapıldığı kadranda indirekt oftalmoskop! yapılmalıdır. Olguların çok büyük bir bölümünde görselleme (vizualizasyon) mümkün olur. Implantın görülemediği durumlarda, steril bir pamuklu çubuk alınır ve enjeksiyon alanına hafifçe bastırılarak implantm görünmesi sağlanır. İntravitreal enjeksiyondan sonra, hastaların geniş spektrumlu bir antimikrobiyal ile tedavisine devam edilmelidir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:OZURDEX® böbrek yetmezliği olan hastalarda incelenmemiştir; ancak bu popülasyonda herhangi özel bir önlem gerekli değildir.Karaciğcr yetmezliği:OZURDEX*' karaciğer yetmezliği olan hastalarda incelenmemiştir; ancak bu popülasyonda herhangi özel bir önlem gerekli değildir.Pediyatrik mpülasyon: OZURDEX 'in pediyatrik popülasyonda, retinal ven dalı tıi<anıi<lığı (RVDT [BRVO]) veya santral retinal ven tıkanıklığını (SRVT [CRVO]) izleyerek gelişen maküler ödem ile ilişkili bir kullanımı bulunmamaktadır. OZURDEX®'in pediyatrik popülasyonda üveit üzerindeki etkinliği ve güveniiliği belirlenmemiştir. Herhangi bir veri bulunmamaktadır. Geriyatrik popülasyon: Yaşlı hastalarda (> 65 yaş) herhangi bir doz ayarlaması gerekmemektedir. 4.3 Kontrendikasyoniar OZURDEX® Etkin maddeye veya yardımcı maddelerden herhangi birine karşı aşırı hassasiyet Aktif epitelyal herpes simplex keratiti (dendritik keratit), çiçek (vaccinia), su çiçeği, mikobakteriyel enfeksiyonlar ve fungal hastalıklar dahil, çoğunlukla kornea ve konjonktivanın viral hastalıklarından oluşan aktif veya şüpheli oküler veya perioküler enfeksiyon İleri glokom (sadece ilaçla yeterince kontrol altına alınamayan vakalar) durumlarında kontrendikedir. 4.4 Özel kullanım uyarıları ve önlemleri TakipHerhangi bir intravitreal enjeksiyon, endoftalmit, intraoküler enflamasyon, artmış göz içi basıncı ve retina dekolmanı ile ilişkili olabilir. Her zaman için uygun aseptik enjeksiyon teknikleri uygulanmalıdır. İlave olarak, bir enfeksiyon veya göz içi basıncı artışı meydana gelirse erken tedaviye olanak sağlamak amacıyla hastalar enjeksiyondan sonra takip edilmelidir. Gözlem için enjeksiyondan hemen sonra optik sinir başı perfüzyonunun kontrolü, enjeksiyon sonrasındaki 30 dakika içinde tonometri ve enjeksiyonu takip eden ikinci ve yedinci günler arasında biyomikroskop incelemesi kullanılabilir. Hastalar, endoftalmit veya yukarıda sözü geçen herhangi bir olaya dair anlamlı herhangi bir semptom görülmesi durumunda, gecikmeden doktorlarına başvurmaları konusunda bilgilendirilmelidir (Bkz. Bölüm 4.8). Advers reaksiyonlarKortikosteriodlerin kullanımı posterior subkapsüler katarakt ve glokoma sebep olabilir ve sekonder oküler enfeksiyonlarla sonuçlanabilir. İlk enjeksiyondan sonra katarakt insidansı, posteriyor segmentte non-infeksiyöz üveiti olan hastalarda, RVDT/SRVT hastalarına kıyasla daha yüksek gibi görünmektedir. RVDT/SRVT klinik çalışmalarında katarakt, ikinci bir enjeksiyon uygulanan fakik lensli hastalarda daha sık bildirilmiştir (Bkz. Bölüm 4.8). İlk tedavi sırasında 368 hastadan yalnızca l'inde ve ikinci tedavi sırasında 302 hastadan 3'ünde katarakt cerrahisi gerekmişti. Non-infeksiyöz üveit tedavisi çalışmasında, 62 fakik lens hastasından İM tek enjeksiyondan sonra katarakt cerrahisi geçirmiştir. Posteriyor segmentte non-infeksiyöz üveiti olan hastalarda konjonktival hemoraji prevalansının, RVDT/SRVT hastalarına kıyasla daha yüksek olduğu görünmektedir. Bu durum, intravitreal enjeksiyon prosedürüne ya da topikal ve/veya sistemik kortikosteroidlerin veya non-steroid antienflamatuar ilaçların eşzamanlı kullanımına bağlı olabilir. Tablo kendiliğinden düzeldiği için tedavi gerekli değildir. Oküler steroid tedavisi ve intravitreal enjeksiyonlardan beklendiği gibi, göz içi basıncı (GİB) artabilir. Göz içi basıncında başlangıç dönemine kıyasla >10 mmHg'lık bir artış görülen hastaların büyük bir bölümünde, bu GİB artışı, enjeksiyondan yaklaşık 60 gün sonrasında ortaya çıkmıştır. Bu nedenle, başlangıç dönemindeki düzeyi ne olursa olsun, düzenli aralıklarla GİB kontrolü yapılmalı ve enjeksiyon sonrasında göz içi basıncındaki herhangi bir artış uygun bir şekilde tedavi edilmelidir. Retinal ven tıkanıklığından sonra maküler ödem gelişen, ya da posteriyor segmentte non-infeksiyöz üveiti olan 45 yaşından küçük hastalarda göz içi basıncında artış olasılığı daha yüksektir. Di5er uyarılar ve önlemlerKortikosteroidler oküler herpes simplex geçmişi olan hastalarda dikkatli kullanılmalıdır ve aktif oküler herpes simplex'te kullanılmamalıdır. OZURDEX*'in her iki göze eş zamanlı olarak uygulanmasının güvenliliği ve etkinliği üzerinde çalışılma yapılmamıştır. Bu nedenle her iki göze eşzamanlı olarak uygulanması önerilmemektedir. OZURDEX® afakik hastalarda incelenmemiştir. Bu nedenle, OZURDEX® böyle hastalarda dikkatle uygulanmalıdır. OZURDEX'^ retinal ven tıkanıklığına sekonder olarak maküler ödem gelişen ve anlamlı retinal iskemisi olan hastalarda incelenmemiştir. Bu nedenle, OZURDEX® kullanımı önerilmemektedir. OZURDEX''* uygulanan hastaların %1.7'sinde antikoagülan tedavi uygulanmıştır; bu hastalarda herhangi bir hemorajik advers olay bildiriminde bulunulmamıştır. Klinik araştırmaların herhangi bir evresinde, hastaların %40'tan fazlasında klopidogrel gibi antitrombositer ilaçlar kullanılmıştır. Antitrombositer tedavi alan klinik araştırma hastalarında hemorajik advers olaylar, OZURDEX*' enjeksiyonu yapılan hastalarda (%27), kontrol grubuna kıyasla (%20) daha yüksek oranda bildirilmiştir. En sık karşılaşılan hemorajik advers reaksiyon, konjonktival hemoraji olmuştur (%24). OZURDEX® antikoagülan ya da antitrombositer ilaç almakta olan hastalarda dikkatle kullanılmalıdır. 4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriHerhangi bir etkileşim çalışması gerçekleştirilmemiştir.Sistemik absorpsiyon minimaldir ve herhangi bir etkileşim beklenmemektedir. özel popülasyonlara ilişkin ek bilgiler:Bildirilmemiştir.Pediyatrik popülasyon:Bildirilmemiştir.Geriyatrik popülasyon:Bildirilmemiştir.4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: CÇocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Deksametazonun çocuk doğurma yaşındaki kadınlarda kullanımına ilişkin yeterli veri mevcut değildir.Çocuk doğurma yaşındaki kadınlar tedavi süresince etkili doğum kontrolü uygulamak zorundadır. Gebelik dönemiHayvan çalışmalarında topikal oftalmik uygulamadan sonra teratojenik etkiler gösterilmiştir (Bkz. Bölüm 5.3). Gebe kadınlarda intravitreal yoldan uygulanan deksametazon kullanımına ilişkin yeterli veri bulunmamaktadır. Gebelik sırasında glukokortikoidlerle uzun dönemli sistemik tedavi, yeni doğan bebekte intrauterin büyüme geriliği ve adrenal yetersizlik riskini artırmaktadır. Bu nedenle, lokal intraoküler tedaviden sonra sistemik deksametazon temasının çok düşük olması beklenmekle birlikte, potansiyel yararları fetus üzerindeki potansiyel riske üstün gelmediği sürece gebelik sırasında OZÜRDEX* kullanılması önerilmemektedir.Laktasyon dönemiDeksametazon süte geçmektedir. Uygulama yolu ve sonuçta oluşan sistemik düzeyler nedeniyle bebek üzerinde herhangi bir etki beklenmemektedir. Yine de, açık bir şekilde gerekli olmadığı sürece, emzirme sırasında OZURDEX® kullanımı önerilmemektedir.Üreme yeteneği/FertiliteDeksametazonun üreme yeteneği ve fertilite üzerindeki etkilerine dair yeterli veri mevcut değildir.4.7 Araç ve makine kullanımı üzerindeki etkilerİntravitreal OZURDEX® enjeksiyonu sonrasında hastalarda geçici görme azalması yaşanabilir (Bkz. Bölüm 4.8). Bu sorun geçene kadar araç veya makine kullanılmamalıdır.4.8 İstenmeyen etkilerAşağıda istenmeyen etkiler, her sıklık grubu içinde, azalan ciddiyet derecesine göre verilmektedir:Çok yaygın (> 1/10); yaygın (> 1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (> 1/10.000 ila <1/1.000); çok seyrek (< 1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). RVDT/SRVTa) OZURDEX®Mn santral ya da dal retinal ven tıkanıklığı sonrasında maküler ödem gelişen hastalardaki klinik güvenliliği. Faz III randomize, çift körlü, sham kontrollü iki çalışmada değerlendirilmiştir. Bu iki Faz III çalışmada, toplam 427 hasta OZURDEX® ve 426 hasta sham uygulanmak üzere randomize edilmiştir. OZURDEX*'e randomize edilerek tedavi edilen toplam 401 hasta (%94), başlangıç tedavisi dönemini tamamlamıştır (180 güne kadar). Hastaların toplam %47.3'ü en az bir advers reaksiyon geçirmiştir. OZURDEK® uygulanan hastalarda en sık bildirilen advers reaksiyonlar göz içi basmcmda artış (%24.0) ve konjonktival hemoraji (%14.7) olmuştur. RVDT hastalarmdaki advers reaksiyon profili, SRVT hastalarında gözlenen ile benzerdi; ancak SRVT hasta alt-grubundaki bütünsel advers reaksiyon insidansı daha yüksekti. b) OZURDEX® tedavisine bağlı olduğu düşünülen aşağıdaki advers reaksiyonlar, bu iki Faz ili çalışma sırasında bildirilmiştir: Sinir sistemi hastalıkları:Yaygın: Baş ağrısıGöz bozuklukları:Çok yaygın: Göz içi basıncı artışı, konjonktival hemoraji*Yaygın: Oküler hipertansiyon, vitreus dekolmanı, katarakt, subkapsüler katarakt, vitreus kanaması (hemoraji)*, görme bozukluğu, vitreusta opasite (vitreus boşlukta uçuşan siyah noktalar), göz ağrısı*, fotopsi*, konjonktival ödem*, ön kamarada hücre*, konjonktival hiperemi* Yaygın olmayan: Retina yırtılması*, ön kamarada tlare (hücre proteini)* *Deksametazon implantından ziyade intravitreal enjeksiyon prosedürü ile ilişkili olduğu düşünülen istenmeyen etkiler. c) OZURDEX* ile oluşan göz içi basınç (GİB) artışı 60 günde doruğa ulaşmış ve 180 günde başlangıç dönemindeki düzeylerine dönmüştür. GİB artışları ya tedavi gerektirmemiş ya da GİB düşürücü topikal ilaçların geçici sürelerle kullanılmasıyla tedavi edilmiştir. Başlangıç tedavisi dönemi sırasında OZURDEX® uygulanan hastaların %0.7'sinde (3/421) çalışma yapılan gözdeki GİB artışı için lazer ile ya da cerrahi girişimlere gerek duyulurken, sham uygulanan hastalarda bu oran %0.2 (1/423) olmuştur. İkinci bir OZURDEX® enjeksiyonu uygulandıktan sonra analiz edilen 341 hastanın advers reaksiyon profili, ilk enjeksiyondan sonrakine benzerdir. Toplam %54 hastada en az bir advers reaksiyon gelişmiştir. GİB artış insidansı (%24.9) ilk enjeksiyondan sonra gözlenene benzer niteliktedir ve aynı şekilde açık tasarımlı 180. günde başlangıç düzeylerine dönmüştür. Bir yıl sonraki bütünsel katarakt insidansı, ilk 6 aydakine kıyasla daha yüksekti. Üveita) OZURDEX®'in gözün posteriyor segmentinde, kendisini non-infeksiyöz üveit şeklinde gösteren enflamasyonu olan hastalardaki klinik güvenliliği, çok-merkezli, kör, randomize bir çalışmada değerlendirilmiştir. Toplam 77 hasta OZURDEX® ve 76 hasta sham uygulanmak üzere randomize edilmiştir. OZURDEX®'e randomize edilerek tedavi edilen toplam 73 hasta (%95) 26 haftalık çalışmayı tamamlamıştır. OZURDEX® uygulanan hastaların çalışma yapılan gözlerinde en sık bildirilen advers reaksiyonlar konjonktival hemoraji (%30.3), göz içi basıncında artış (%25.0) ve katarakt (%11.8) olmuştur. b) OZURDEX* tedavisine bağlı olduğu düşünülen aşağıdaki advers reaksiyonlar, Faz IH çalışma sırasında bildirilmiştir: Sinir sistemi hastalıkları:Yaygın: MigrenGöz bozuklukları:Çok yaygın: Göz içi basıncı artışı, katarakt, konjonktival hemoraji*Yaygın: Retina dekolmanı, miyodesopsi, vitreusta opasite, blefarit, sklerada hiperemi*, görme bozukluğu, gözde anormal duyular*, göz kapağında kaşıntı *Deksametazon implantmdan ziyade intravitreal enjeksiyon prosedürü ile ilişkili olduğu düşünülen istenmeyen etkiler. Pazarlama sonrası deneyimlerAşağıdaki advers reaksiyon. OZURDEX*' ile pazarlama sonrası dönemde belirlenmiştir: Göz hastalıkları: Endoftalmit (enjeksiyona bağlı) (Bkz. Bölüm 4.4) 4.9 Doz aşımı ve tedavisiEğer bir doz aşımı ortaya çıkarsa, göz içi basıncı doktorun gerekli gördüğü doğrultuda izlenmeli ve tedavi edilmelidir.5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Oftalmolojikler, antienflamatuar ajanlar ATC kodu: SOIBAOlEtki MekanizmasıGüçlü bir kortikosteroid olan deksametazonun. enflamatuar yanıttaki ödem, fibrin birikimi, kapiller sızıntı ve fagositik göçü inhibe ederek enflamasyonu baskıladığı gösterilmiştir. Vasküler Endotelyal Büyüme Faktörü (VEGF), makula ödeminde konsantrasyonu artan bir sitokindir. Bu sitokin. damar geçirgenliğinin güçlü bir uyaranıdır. Kortikosteroidlerin VEGF ekspresyonunu inhibe ettiği gösterilmiştir. İlave olarak, kortikosteroid 1er kistoid makula ödeminin mediatörü olarak tanımlanan bazı prostaglandinlerin serbest bırakılmasını önlemektedir. RVDT/SRVTOZURDEX'^'in güvenliliği, çok-merkezli, çift kör, randomize, sham kontrollü, aynı tasarıma sahip iki paralel çalışmada değerlendirilmiştir. Bu iki çalışma birlikte, deksametazon 350 ^g ya da 700 (ig implant veya sham implant ile tedavi edilmek üzere randomize edilen 1267 hastadan oluşmuştur (çalışma 206207-008 ve 206207-009). Toplam 427 hasta OZURDEX®, 414 deksametazon 350 jig ve 426 hasta sham uygulanmak üzere randomize edilmiştir. Toplu analiz sonuçları temelinde, OZURDEX® implant ile tedavide sham ile kıyaslandığında, istatistiksel olarak anlamlı ölçüde daha büyük bir yanıt insidansı görülmüştür (p <0.001). Yanıt, tek bir implantm enjeksiyonundan 90 gün sonra. En İyi Düzeltilmiş Görme Keskinliği (EİDGK/BCVA)'da başlangıç dönemine göre >15 harf düzelme sağlanan hastalar şeklinde tanımlanmıştı. Tek bir implant enjeksiyonundan sonra, EİDGK'de başlangıç dönemine göre >15 harf düzelme sağlama şeklindeki primer etkinlik ölçümüne ulaşılan hastaların oranı Tablo l'de gösterilmektedir. Tedavi etkisi, ilk gözlem zamanı olan 30. günde görülmüştür. Maksimum tedavi etkisi 60. günde gözlenmiş ve yanıt insidansları arasındaki farklılık, enjeksiyondan sonraki 90 güne kadar tüm zaman noktalarında, sham'a kıyasla OZURDEX® lehine istatistiksel olarak anlamlıdır. Gün 180'de sham'a kıyasla OZURDEX® ile tedavi edilen hastalarda EİDGK'nde başlangıç dönemine göre >15 harf düzelme elde edilen yanıt vericiler sayısal olarak daha büyük bir oranda olmayı sürdürmüşlerdir. Tablo 1. Çalışma Yapılan Gözde Başlangıç Dönemindeki En İyi Düzeltilmiş Görme Keskinliği'nden >15 Harf Düzelme Sağlanan Hastaların Oranı (Toplu Sonuçlar, ITT Popülasyonu)
Her iki Faz III çalışmada ve toplu analizde EİDGK kümülatif yanıt eğrilerinde >15 harf (3 sıra) düzelme OZURDEX* ile taklide kıyasla anlamlı derecede farklıydı (p<0.001); OZURDEX* tedavisindeki hastalarda EİDGK'da 3 sıra düzelme sağlanması sham tedavisindeki hastalardan daha erken dönemde gerçekleşti. Altı aylık değerlendirme dönemi boyunca OZURDEX* görme kaybının engellenmesinde sham'dan sayısal olarak üstündü. Bu durum, OZURDEX® grubunda görme kaybı >15 harf olan hasta oranının daha düşük olmasıyla gösterilmiştir. Her Faz III çalışmada ve toplu analizde, gün 90'da OZURDEX® ile (-207.9 mikron) taklide kıyasla (-95.0 mikron) ortalama retina kalınlığı düşüktü ve başlangıç dönemine göre ortalama azalma anlamlı olarak daha yüksekti (p <0.001, toplu veriler). Gün 90'da EİDGK ile değerlendirildiği şekilde tedavi etkisi, böylelikle bu anatomik bulguyla desteklenmiş oldu. Gün 180'de retina kalınlığında ortalama azalma (-119.3 mikron) taklide kıyasla anlamlı değildi. EİDGK skoru <84 ya da optik koherans tomografi (OCT)ile retina kalınlığı >250 mikron ve araştırmacının görüşüne göre tedavinin riske sokmayacağı hastalar açık tasarımlı bir uzatma çalışmasında OZURDEX® tedavisi almak için elverişliydi. Açık tasarımlı dönemde tedavi edilen hastaların %98'ine ilk tedaviden 5 ila 7 ay sonra bir OZURDEX® enjeksiyonu yapıldı. Başlangıç tedavisi için doruk yanıt açık tasarımlı çalışmada 60'ıncı günde görüldü. Ardışık iki OZURDEX® enjeksiyonu uygulanan hastalarda kümülatif yanıt oranlan açık tasarımlı çalışma dönemi boyunca, başlangıç fazında OZURDEX® enjeksiyonu uygulanmayan hastalara kıyasla daha yüksekti. Yanıt vericilerin oranı, ilk tedaviye kıyasla ikinci tedaviden sonra her zaman noktasında daha yüksekti. Bunun yanı sıra, tedavinin 6 ay süreyle ertelenmesi, ikinci bir OZURDEX®' yapılanlara kıyasla, yanıt verici oranlarının açık tasarımlı dönemde, tüm zaman noktalarında daha düşük olmasıyla sonuçlandı. ÜveitOZURDEX*'in klinik etkinliği, üveitli hastalarda gözün arka segmentindeki non-enfeksiyöz oküler enfeksiyonda tek bir çok-merkezli, kör, randomize çalışma ile değerlendirilmiştir. Toplam 229 hasta 350 ng ya da 700 ^g deksametazon implant ya da sham almak üzere randomize edildi. Bunların arasından toplam 77'si OZURDEX®, 76'sı 350 ng deksametazon ve 76'sı sham uygulanmak üzere randomize edildi. Hastaların toplam %95'i 26 haftalık çalışmayı tamamladı. Çalışılan gözde vitröz bulanıklık skoru 8'inci haftada (primer sonlanım noktası) O olan hastaların oranı OZURDEX® (%46.8) ile sham'a (%ll.8) kıyasla 4 kat daha yüksekti (p<001). İstatistiksel üstünlük Tablo 2'de gösterildiği gibi 26 hafta (p<O.OI4) süreyle devam etti. Kümülatif yanıt oranı eğrileri (bulanıklık skoru O'a kadar geçen süre) OZURDEX® grubunda sham grubuna kıyasla istatistiksel olarak anlamlı derecede farklıydı (p<O.OOI); deksametazon uygulanan hastalar daha erken yanıt verdi ve tedavi yanıtları daha yüksekti. Vitröz bulanıklıktaki azalmaya görme keskinliğinde düzelme eşlik etmekteydi. Çalışma yapılan gözde 8'inci haftada EİDGK'da başlangıç dönemine göre en az 15 harf düzelme sağlanan hastaların oranı taklide (%6.6) kıyasla OZURDEX® (%42.9) ile 6 kattan fazlaydı, p<O.OOI. İstatistiksel üstünlük, tablo 2'de gösterildiği gibi 3'üncü haftada elde edildi ve 26'ıncı haftanın sonuna kadar sürdürüldü (p<0.001). Başlangıç döneminden 8'inci haftaya kadar, kurtarma ilaçlarına gerek duyulan hastaların yüzdesi taklide (%22.4) kıyasla OZURDEX® (%7.8) ile yaklaşık 3 kat daha düşüktü, p=O.OI2. Tablo 2. Çalışma Yapılan Çözde, Vitröz Bulanıklık Skoru O Olan ve Başlangıç Dönemindeki En İyi Düzeltilmiş Görme Keskinliği'nden >15 Harf Düzelme Sağlanan Hastaların Oranı (ITT PopUlasyonu)
5.2 Farmakokinetik özelliklerGenel özelliklerEmilim:Plazma konsantrasyonları. 6 aylık iki etkinlik çalışmasında; 350 ng veya 700 ng deksametazon içeren intravitreal implant uygulamasından önce ve uygulamayı takip eden 7., 30., 60. ve 90'ıncı günlerde 21 hastalık alt gruplardan elde edilmiştir. 350 |ig doz grubu için plazma deksametazon konsantrasyonu değerlerinin %95'i ve 700 ^g doz grubu için %86'sı kantitatif limitin (0.05 ng/mL) altındadır. En yüksek plazma konsantrasyonu değeri, 0.094 ng/mL ile 700 ng grubundaki bir denekte gözlemlenmiştir. Plazma deksametazon konsantrasyonu, hastaların yaşı, vücut ağırlığı veya cinsiyeti ile ilgili bulunmamıştır. Darılım:OZURDEX®'in tek intravitreal enjeksiyonunu takiben maymunlarla yapılan 6 aylık bir çalışmada, deksametazon vitröz hümorCmax'ı enjeksiyon sonrası 42. günde 100 mg/mL ve 91. günde ise 5.57 ng/mL'dir. Enjeksiyon sonrası 6. ayda, deksametazon vitreusta tespit edilebilir durumdadır. Deksametazon konsantrasyonunun sıralaması retina >iris >siliyer cisim >vitröz humor >aköz humor >plazma şeklindedir. Bivotransformasvon:[I4C]-deksametazonun insan korneası, iris - siliyer cisim, koroid, retina, vitröz humor ve sklera dokuları ile 18 saat inkübasyonunu takiben, in vitro metabolizma çalışmasında, herhangi bir metabolit gözlemlenmemiştir. Bu, tavşan ve maymun oküler metabolizma çalışmalarından elde edilen sonuçlarla uyumludur. Eliminasvon:Deksametazon safra ve idrardan atılabilen yağda ve suda çözünebilir metabolitlere dönüşür. OZURDEX* matriksi, basit hidroliz vasıtasıyla yavaş bir şekilde laktik asit ve glikolik asite, daha sonra da karbondioksit ve suya parçalanmaktadır. Hastalardaki karakteristik özelliklerPlazma deksametazon konsantrasyonu, hastaların yaşı, vücut ağırlığı veya cinsiyeti ile ilgili bulunmamıştır.Yaşlı hastalarda (> 65 yaş) herhangi bir doz ayarlaması gerekmemektedir. OZURDEX^'in pediyatrik popülasyonda, retinal ven dalı tıkanıklığı (RVDT [BRVO]) veya santral retinal ven tıkanıklığını (SRVT [CRVO]) izleyerek gelişen maküler ödem ile ilişkili bir kullanımı bulunmamaktadır. OZURDEX'^'in pediyatrik popülasyonda üveit üzerindeki etkinliği ve güvenliliği belirlenmemiştir. Herhangi bir veri bulunmamaktadır. OZURDEX® böbrek yetmezliği olan hastalarda incelenmemiştir; ancak bu popülasyonda herhangi özel bir önlem gerekli değildir. OZURDEX® karaciğer yetmezliği olan hastalarda incelenmemiştir; ancak bu popülasyonda herhangi özel bir önlem gerekli değildir. 5.3 Klinik öncesi giivenlilik verileriKlinik dışı çalışmalardaki etkinliği sadece insanlarda maruz kalınan maksimum dozun yeteri kadar üzerindeki miktarlarda gözlemlenmiş olduğundan, bu sonuçlar klinik kullanım için çok düşük bir gösterge teşkil etmektedir.OZURDEX* için mutajenite, karsinojenite, üreme veya gelişim toksisitesi verileri mevcut değildir. Deksametazonun topikal oftalmik uygulamayı takiben farelerde ve tavşanlarda teratojenik olduğu gösterilmiştir. Implantm tavşanlarda gözün arka segmentine uygulanmasından sonra, sağlıklı/tedavi edilmemiş gözde kontralateral difüzyon yoluyla deksametazon maruziyeti gözlenmiştir. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiEster uçlu 50:50 poli D,L-laktid-ko-glikolid Asit uçlu 50:50 poli D,L-laktid-ko-glikolid6.2 GeçimsizliklerGeçerli değildir.6.3 Raf ömrü36 ay6.4 Saklamaya yönelik özel tedbirlerBu tıbbi ürün saklamaya yönelik herhangi bir özel tedbir gerektirmemektedir.25°C'nin altında oda sıcaklığında ve kum yerde saklayınız. 6.5 Ambalajın niteliği ve içeriği I ambalaj: Tek kullanımlık aplikatörün iğnesinde (paslanmaz çelik) bulunan ve 0.7 mg deksametazon içeren 1 adet uzatılmış salınım implante edilebilir çubuk şekilli steril implant. Aplikatör, iğne içinde bulunan bir pistondan oluşmaktadır. İmplant iğne ucuna bağlı olup, piston aplikatörün yan tarafında bulunan bir manivela ile kontrol edilmektedir. İğne bir başlıkla, manivela ise güvenlik bantı ile korunmaktadır. İmplantm bulunduğu aplikatör, desikatör içeren kapatılmış bir folyoda ambalajlanmıştır. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler OZURDEX® sadece bir seferlik kullanım içindir. Her aplikatör yalnızca tek bir gözün tedavisi için kullanılabilir. Folyo zarar görmüş ise kullanılmamalıdır. Aplikatör, folyo açıldıktan hemen sonra kullanılmalıdır. Kullanılmamış olan ürünler veya artık materyaller 'Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİ Allergan İlaçları Tic. A.Ş. Maslak Mah., Eski Büyükdere Cad. İz Plaza Giz. Kat: 12 Maslak-Sişli, 34398 İstanbul Tel: 0212 350 50 00 Faks: 0212 290 72 11 8. RUHSAT NUMARASI 132/75 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ İlk ruhsal tarihi: 21.02.2012 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ Ocak 2012 |
İlaç BilgileriOzurdex 0.7mg İntravitreal İmplantEtken Maddesi: Deksametazon Atc Kodu: S03BA01 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.