Tiobud 9/400mcg İnhalasyon İçin Toz İçeren Kapsül Kısa Ürün BilgisiSolunum Sistemi » Solunum Sisteminde Tıkanma - Astım İlaçları » Diğer İnhalanlar (solukla içeri çekilen ilaçlar) » Antikolinerjik İlaçlar » Tiotropium Bromür KISA URUN BILGISI1. BEŞERİ TIBBİ ÜRÜNÜN ADITİOBUD 9/400 mcg inhalasyon için toz içeren kapsül2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:Tiotropium bromür anhidrus* 10,9 mcgBudesonid 400 mcg *9 mcg Tiotropium'a eşdeğer Yardımcı madde(ler):Lai<toz 12,5891 mgYardımcı maddeler için, 6.1'e bakmız. 3. FARMASÖTİK FORMİnhalasyon İçin Toz İçeren KapsülFlesh opak, natural transparan renk kapsül içinde beyaz loz 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarAmfızem ve kronik bronşit de dahil reversibl kronik obstrüktif akciğer hastalığı (KOAH) olan hastalarda bronkokonstriksiyonun önlenmesi ve tedavisinde endikedir.4.2. Pozoloji ve uygulama şekli Pozoloji/ uygulama sıklığı ve süresi:Doktor tarafından başka bir şekilde kullanılması önerilmediği takdirde;Erişkinler için önerilen dozu, günde iki kez bir inhalasyon dozunun inhale edilmesidir. İnhalasyon her gün. günün aynı saatinde, inhalasyon cihazı kullanılarak yapılmalıdır. Hastanın cihazı doğru kullandığından emin olunmalıdır. Uygulama şekli:TİOBUD inhaler kapsül; ağız yoluyla inhalasyon şeklinde kullanılır.İnhalasyon cihazı yoluyla nefes alındığında ilaç akciğerlere ulaşır. Bu nedenle, cihazın ağız parçası aracılığıyla derin ve güçlü nefes alınması önemlidir. İnhalasyon cihazının kullanımı doktor veya eczacı tarafından hastaya gösterilmelidir. Kapsüllerin kesinlikle ağız içine ahnarak yutulmaması ve kesinlikle inhaler içine yerleştirildikten sonra soluk alma yoluyla kullanılması gerektiği konusunda hasta bilgilendirilmelidir. Jelatin kapsülün parçalanabileceği ve inhalasyondan sonra ağız veya boğaza küçük jelatin parçacıklarının ulaşabileceği hastaya anlatılmalıdır. Bu olasılık kapsülün birden fazla delinmemesi ile en aza indirilir. Kapsüller blister ambalajdan ancak kullanım öncesi çıkarılmalıdır. İnhalasyon cihazı kullanma talimatı için bakınız ekli talimat. Özel popülasyonlara ilişkin ek bilgiler:İnhalasyon yoluyla idame glukokortikosteroid kullanan hastalardaİnsanlarda yapılan klinik araştırmalar, aynı miktardaki kuru toz inhaleri ile uygulanan budesonid dozunun ölçülü doz inhalerden daha etkili olduğunu göstermiştir. Bu nedenle ölçülü doz inhaler tedavisi uygulanan hastalarda, kuru toz inhaleri ile budesonid tedavisine geçilirken, hastalar stabil ise dozun yarı yarıya azaltılması mümkündür. Bu durum, hastaların başka inhalasyon glukokortikosteroid tedavisinden kuru toz inhaleri ile budesonid tedavisine geçmeleri durumunda da, ilk önce transferden öncesinde aynı doz verilmesi lüzumlu ise de geçerlidir.Oral yoldan glukokortikosteroid kullanan hastalardaBudesonid, astım kontrolünde azalmaya yol açmaksızın ya da daha iyi bir kontrol sağlayarak, oral yoldan kullanılan glukokortikosteroid tedavisinin kesilmesini ya da dozunun büyük oranda azaltılmasını sağlayabilir.Başlangıçta budesonid hastanın alışkın olduğu oral glukokortikosteroid idame dozu ile birlikte aynı zamanda kullanılmalıdır. Bir hafta kadar sonra, oral doz yavaş yavaş düşürülebileceği en düşük doza indirilmelidir. Oral dozun yavaş bir oranda kesilmesi önerilir. Pek çok hastada oral glukokortikosteroidin yerini budesonidin tamamen alması mümkündür. Oral dozun kesilmesi sırasında idameye ya da akciğer fonksiyonlarında gelişmeye rağmen bazı hastalar sistemik kortikosteroid eksikliği semptomu yaşayabilirler örn. eklem ve/veya adale ağnları, halsizlik ve depresyon gibi. Böyle hastalara budesonid ile devam etmeleri öğütlenmeli, ancak adrenal yetersizliği oluşması bakımmdan dikkatle izlenmelidir. Adrenal yetersizlik oluşursa, sistemik kortikosteroid dozu geçici olarak yükseltilmeli ve oral dozun kesilmesi daha da yavaşlatılmalıdır. Stres ya da şiddetli astım nöbetinde, budesonide geçiş dönemindeki hastalara sistemik kortikosteroid tedavisi gerekebilmektedir. Böbrek yetmezliği:TİOBUD'un içeriğindeki tiotropium böbrek yetmezliği olan hastalarda önerilen dozlarda kullanılabilir. Bununla birlikte, esas olarak böbrekler yoluyla atılan bütün ilaçlarda olduğu gibi, orta ile şiddetli böbrek yetmezliği olan hastalarda (kreatinin klerensi <50 ml/dak) TİOBUD kullanımı yakından izlenmelidir. TİOBUD'un içeriğindeki budesonid için böbrek yetmezliği olan hastalarda özel bir doz önerisi bulunmamaktadır.Karaciğer yetmezliği:TİOBUD'un içeriğindeki tiotropium karaciğer yetmezliği olan hastalarda önerilen dozlarda kullanabilir.Karaciğer fonksiyonlarının azalması, kortikosteroidlerin atılımını etkileyebilir. Bununla birlikte intravenöz yoldan uygulanan budesonidin farmakokinetiği sirozlu hastalarda ve sağlıklı kişilerde benzerdir. Karaciğer fonksiyonlarının azaldığı durumlarda oral yoldan alınan budesonid farmakokinetiği değişir, sistemik yararlanımı artar. Ancak inhalasyon yoluyla kullanılan budesonidin sistemik yararlanımında sindirim sisteminden emilen budesoniden katkısı göreceli olarak az olduğundan bu durumun klinik açıdan önemi sınırlıdır. Pediyatrik popülasyon:Pediyatrik hastalarda tiotropiumum etkinliğine ve güvenilirliğine ilişkin deneyim bulunmamaktadır, bu nedenle 18 yaşın altındaki pediyatrik hastalarda TİOBUD kullanılmamalıdır.Geriyatrik popülasyon:Yaşlılar TİOBUD'u önerilen dozlarda kullanabilirler.4.3. KontrendikasyonlarTiotropiuma, atropin veya türevlerine, örn. ipratropium ya da oksitropiuma, budesonide, veya ürünün içindeki yardımcı madde laktoza karşı aşırı duyarlılığı olan hastalarda kontrendikedir.4.4. Özel kullanım uyanları ve önlemleriTiotropiumTİOBUD; KOAH akut ataklarında tek başına kullanılamaz. Kurtarıcı ilaç olarak kısa etkili beta 2 mimetik ilaçlar ile birlikte verilir. TİOBUD günde bir kez kullanılan bir idame tedavisi bronkodilatörü olarak, akut bronkospazm episodlarının başlangıç tedavisinde, yani kurtarma tedavisi şeklinde kullanılmamalıdır. TİOBUD uygulamasından sonra ani aşırı duyarlılık reaksiyonları oluşabilir. Diğer antikolinerjik ilaçlarla olduğu gibi, tiotropium dar açılı glokomu kötüleştirebileceği, prostat hiperplazisi ya da mesane boynu obstrüksiyonu bulunan hastalarda idrar güçlüğü oluşturabileceğinden bu hastalarda dikkatle kullanılmalıdır. İnhalasyon yoluyla alınan ilaçlar, inhalasyonun indüklediği bronkospazma neden olabilirler. Esas olarak böbrekler yoluyla atılan bütün ilaçlarda olduğu gibi, azalmış böbrek fonksiyonu plazma konsantrasyonlarını artırır, bu sebeple orta ile şiddetli böbrek yetmezliği olan hastalarda (kreatinin klerensi <50 ml/dk) sadece beklenen yarar potansiyel riskten büyük olduğunda kullanılmalıdır. Şiddetli böbrek yetmezliği olan hastalarda kullanımına ilişkin uzun süreli deneyim bulunmamaktadır. TİOBUD 9/400 mcg inhalasyon için toz içeren kapsülün hatasız bir şekilde nasıl kullanılacağı öğretilmelidir. Hastalara tozun göze kaçmaması için dikkatli olmaları öğütlenmelidir. Konjuktivada konjesyon veya korneada ödem sonucunda gelişen göz kızarmasıyla birlikte gözde ağrı veya rahatsızlık hissi, bulanık görme, haleler veya renkli görüntüler görme, akut dar açılı glokom belirtileri olabilir. Bu semptomların herhangi bir kombinasyonu görülürse, ilaç kesilmeli ve hemen bir uzman hekimin görüşleri alınmalıdır. Antikolinerjik tedavi ile gözlenen ağız kuruluğu uzun dönemde diş çürüklerine sebep olabilir. Budesonid Budesonid, kısa etkili bronkodilatörlerin gerektiği akut astım nöbetlerinde hızlı bir rahatlama sağlamak amacıyla kullanılmamalıdır. Kısa etkili bronkodilatör tedavisi etkisiz kalıyorsa, ya da normalden daha fazla inhalasyon gerekiyorsa, bir sağlık kurumuna başvurulmalıdır. Bu tür durumlarda, anti-inflamatuvar tedavinin arttıniması, örneğin inhalasyon yoluyla kullanılan budesonid dozunun yükseltilmesi ya da oral yoldan glukokortikosteroid kürüne başlanması gerekli olabilir. Budesonid KOAH'ta tek başma monoterapi olarak kullanılmamalıdır. KOAH alevlenmelerinde sorumlu hekim tarafından belirlenen ek tedavi uygulanmalıdır. Oral steroid tedavisinden inhalasyon yoluyla glukokortikosteroid tedavisine geçen hastalarda, önemli bir süre böbrek üstü bezi fonksiyonunun azalması riski olduğundan, özel bir dikkat gerekir. Yüksek dozda acil kortikosteroid tedavisi alan hastalar veya uzun süre en yüksek dozda inhale steroid tedavisi de benzer bir risk oluşturabilir. Bu hastalar ağır strese maruz kaldığında adrenal yetmezliğinin bulgu ve belirtileri ortaya çıkabilir. Stres veya cerrahi girişim durumlarında ek sistemik kortikosteroid takviyesi düşünülmelidir. Oral yoldan kullanılan glukokortikosteroid dozu azaltılırken, bazı hastalarda kas ve eklem ağrısı gibi spesifik olmayan rahatsızlık duyguları ortaya çıkabilir. Bu tür ender durumlarda, yorgunluk, başağrısı, bulantı ve kusma başlarsa genel bir glukokortikosteroid etkisi yetmezliğinden kuşkulanılmalıdır. Bu vakalarda bazen oral yoldan kullanılan glukokortikosteroid dozunun geçici olarak yükseltilmesi gerekli olabilir. Sistemik steroid tedavisinden inhalasyon tedavisine geçilmesi, bazen daha önceden sistemik ilaçlarla kontrol edilen rinit ve ekzema gibi alerjilerin açığa çıkmasına neden olabilir. Bu tür alerjiler, bir antihistaminik ve/veya topikal preparatlarla semptomatik olarak tedavi edilmelidir. Karaciğer fonksiyonlarının azalması, kortikosteroidlerin atılımmı etkileyebilir. Bununla birlikte, intravenöz yoldan uygulanan budesonidin farmakokinetiği sirozlu hastalarda ve sağlıklı kişilerde benzerdir. Karaciğer fonksiyonlarının azaldığı durumlarda oral yoldan alınan budesonidin farmakokinetiği değişir, sistemik yararlanımı artar. Ancak, inhalasyon yoluyla kullanılan TİOBUD'un sistemik yararlanımında sindirim sisteminden emilen budesonidin katkısı göreceli olarak az olduğundan, bu durumun klinik açıdan önemi sınırlıdır. İn vivo çalışmalarda ketokonazol ve itrakonazolün (CYP3A4 aktivitesinin karaciğer ve barsak mukozasındaki inhibitörleri, ayrıca bkz. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri) oral yolla verilmesi ile budesonidin sistemik maruziyetinde artış olabileceği gözlenmiştir. Bu durumun klinik olarak önemi kısa süreli (1-2 haftalık) tedavide sınırlıdır, ancak uzun süreli tedavide göz önüne alınmalıdır. Budesonidin insandaki uzun süreli lokal ve sistemik etkileri tam olarak bilinmemektedir. Doz. astım kontrolünün sağlandığı en düşük etkili idame dozunda tutulmalıdır. Hekimler, herhangi bir yoldan kortikosteroid tedavisi gören çocukların büyümesini yakından izlemeli ve kortikosteroid tedavisi ile astım kontrolünün yararlarını, büyümenin olası baskılanmasma karşı değerlendirmelidir. İnhaler steroidin kombine edildiği KOAH'lı ileri yaş hastalarda pnömoni riski artabilmektedir.Laktoz uyarısıTİOBUD yardımcı madde olarak laktoz içermektedir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriTiotropiumTiotropiumun antikolinerjik maddeler içeren diğer ilaçlar ile birlikte uygulanması henüz incelenmemiştir ve bu nedenle önerilmemektedir. Düzenli ilaç etkileşimi çalışmaları yürütülmemiş olmakla birlikte, tiotropium diğer ilaçlar ile birlikte, istenmeyen ilaç reaksiyonlan görülmeksizin kullanılmıştır. KOAH tedavisinde yaygın olarak kullanılan sempatomimetik bronkodilatörler, metilksantinler, oral ve inhale steroidler bu ilaçlar arasındadır. Budesonid Budesonidin. astım ve KOAH tedavisinde kullanılan hiçbir ilaçla etkileşimi gözlenmemiştir. Budesonidin metabolizması öncelikle, sitokrom p450 alt sınıfından, CYP3A4 tarafından gerçekleştirilmektedir. Bu enzimin inhibitörleri, örn. ketokonazol ve itrakonazol, budesonidin sistemik maruziyetini arttırabilir, bkz. 4.4 Özel kullanım uyarıları ve önlemleri. Önerilen dozlarda, simetidinin oral yoldan alınan budesonidin farmakokinetiği üzerindeki etkisi hafif, ancak klinik açıdan önemsizdir. Özel popülasyonlara ilişkin ek bilgiler Böbrek / Karaciğer yetmezliğiKaraciğer fonksiyonlarının azalması, kortikosteroidlerin atıhmmı etkileyebilir. Bununla birlikte intravenöz yoldan uygulanan budesonidin farmakokinetiği sirozlu hastalarda ve sağlıklı kişilerde benzerdir. Karaciğer fonksiyonlarının azaldığı durumlarda oral yoldan alınan budesonid farmakokinetiği değişir, sistemik yararlanımı artar. Ancak inhalasyon yoluyla kullanılan budesonidin sistemik yararlanımında sindirim sisteminden emilen budesonidin katkısı göreceli olarak az olduğundan bu durumun klinik açıdan önemi sınırlıdır.Pediyatrik popülasyonUzun dönem çalışmalar, inhale budesonid ile tedavi edilen çocukların adolesanların yetişkin dönemlerinde hedeflenen boy uzunluğuna eriştiklerini göstermektedir.Geriyatrik popülasyonHerhangi bir veri bulunmamaktadır.4.6. Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi C dir.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (kontrasepsiyon)Kapsamlı prospektif epidemiyolojik çalışmalar ve dünya çapındaki pazarlama sonrası deneyim, gebelik döneminde inhale budesonidin fetüs/yeni doğan sağlığı üzerinde bir advers etkisini işaret etmemektedir.TİOBUD'un gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Çocuk doğurma potansiyeli bulunan kadınların tedavi süresince etkin doğum kontrol (kontrasepsiyon) yöntemleri uygulaması önerilmektedir. Gebelik dönemiHayvanlar üzerinde yapılan araştırmalar tiotropiumun üreme toksisitesinin bulunduğunu göstermiştir, insanlara yönelik potansiyel risk bilinmemektedir.Diğer ilaçlarda olduğu gibi, budesonidin de gebelik döneminde kullanılması annedeki yararları ile fetus üzerindeki risklerin karşılaştırılmasını gerektirir. İnhale glukokortikosteroidler, benzer pulmoner cevaplara ulaşmak için gerekli oral glukokorikosteroidlere oranla daha düşük sistemik etkileri nedeniyle göz önüne alınmalıdır. TİOBUD gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Laktasyon dönemiTiotropiumun insan sütüyle atılıp atılmadığı bilinmemektedir. Hayvanlar üzerinde yapılan çalışmalar tiotropiumun sütle atıldığını göstermektedir. Budesonid anne sütüne geçer. Ancak budesonidin normal tedavi dozlarında emzirilen bebeğe etkisi olması beklenmez. Emzirmenin durdurulup durdurulmayacağına ya da TİOBUD tedavisinin durdurulup durdurulmayacağma/tedaviden kaçınılıp kaçınılmayacağına ilişkin karar verilirken, emzirmenin çocuk açısından faydası ve TİOBUD tedavisinin emziren anne açısından faydası dikkate alınmalıdır.Üreme yeteneği/FertiliteTİOBUD'un üreme yeteneği üzerindeki etkisine yönelik yeterli bilgi bulunmamaktadır. Tiotropium ile ilişkili üreme toksisitesi lokal veya sistemik maruziyet, terapötik maruziyetin 5 katından fazla olduğu zaman gözlenmiştir.4.7. Araç ve makine kullanımı üzerindeki etkilerTİOBUD'un araç ve makine kullanma yeteneği üzerindeki etkisine yönelik çalışma gerçekleştirilmemiştir. Meydana gelebilecek baş dönmesi, bulanık görme veya baş ağrısı araç ve makine kullanma yeteneğini etkileyebilir.4.8. İstenmeyen etkilerTiotropiumBelirtilen sıklık düzeyleri, advers ilaç reaksiyonlarının ham insidans oranlarıdır. Bu bilgiler, 26 plasebo kontrollü klinik araştırmalardan dört hafta ile dört yıl arasında değişen tedavi dönemlerinde tiotropium grubundan (9,149 hasta) toplanmış verilere dayanmaktadır. Yan etkilerin görülme sıklığı aşağıda belirtilmektedir: Çok yaygın (>1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (>1/1000 ila <1/100), seyrek (>1/10.000 ila <1/1000), çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Metabolizma ve beslenme hastalıklarıBilinmiyor*: DehidratasyonSinir sistemi hastalıklarıYaygın olmayan: Baş dönmesi, baş ağrısı, tat bozuklukları Seyrek: UykusuzlukGöz hastalıklarıYaygın olmayan: Bulanık görme Seyrek: Glokom, intraoküler basınç artışıKardiyak hastalıklarıYaygın olmayan: Atriyal fıbrilasyonSeyrek: Supraventriküler taşikardi, taşikardi, palpitasyonlar Solunum, göğüs bozuklukları ve mediastinal hastalıklarıYaygın olmayan: Faranjit. disfoni, öksürük Seyrek: Bronkospazm, epistaksis. larenjit, sinüzitGastrointestinal hastalıklarıYaygın: Ağız kuruluğuYaygın olmayan: Konstipasyon. stomatit. gastroözofageal reflü hastalığı, bulantı Seyrek: Paralitik ileusun da dahil olduğu intestinal tıkanıklık, jinjivit, dil iltihabı, orofaringeal kandidiyaz, dizfaji Bilinmiyor1: Diş çürükleri Deri ve deri altı doku hastalıklarıYaygın olmayan: RaşSeyrek: Ürtiker, kaşıntı, hipersensitivite (ani aşınlık reaksiyonlan dahil) Bilinmiyor*: Anjiyonörotik ödem, deri reaksiyonları, deri ülseri, derinin kuruması Kas-iskelet bozukluklar, bağ doku ve kemik hastalıklarıBilinmiyor*: Eklem şişliğiBöbrek ve idrar hastahklarıYaygın olmayan: İdrar yapmada güçlük ve idrar retansiyonu Seyrek: İdrar yolu enfeksiyonuKontrollü klinik çalışmalarda, hastaların yaklaşık %4'ünde gözlenen yaygın istenmeyen etkiler ağız kuruluğu gibi antikolinerjik istenmeyen etkilerdir. 26 klinik çalışmada gözlenen ağız kuruluğu tiotropium ile tedavi edilen 9,149 hastanın 18'inde (%0.2) tedaviye son vermeye yol açmıştır. Antikolinerjik etki ile ilişkili ciddi istenmeyen etkiler arasında glokom, konstipasyon, paralitik ileus dahil intestinal tıkanıklık ve de idrar retansiyonu yer alır. Yaş artışı ile birlikte antikolinerjik etkilerde de artış gözlenebilir. Budesonid Klinik deneyler, literatür kayıtları ve pazarlama sonrası deneyimlere göre aşağıdaki yan etkiler görülebilir: İstenmeyen etkiler aşağıdaki sınıflama kullanılarak sıklık gruplanna ayrılmıştır: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (< 1/10.000); bilinmiyor. Bağışıklık sistemi hastalıklarıSeyrek; Deri döküntüsü, kontakt dermatit, ürtiker, anjiyoödem, bronkospazm ve anaflaktik reaksiyon dahil ani ve geç aşırı duyarlılık reaksiyonları.Psikiyatrik hastalıklarıSeyrek: Sinirlilik, huzursuzluk, depresyon, davranış bozukluklarıDeri ve deri altı dokusu hastalıklarıSeyrek: Deride morarmaGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarıYaygın: Boğazda hafif bir iritasyon (solunum), orofarenkste Candida enfeksiyonu, ses boğuklaşması, öksürükİnhalasyon yoluyla kullanılan ilaçlar, etki mekanizması bilinmemekle birlikte, nadiren bronkospazma yol açabilir. İnhalasyon glukokortikosteroidleri ile, nadir olarak, bazı hastalarda, muhtemelen doza, tedavi süresine, birlikte kullanılan ya da daha önceden kullanılmış olan steroidlere kişisel duyarlılığa bağlı olarak adrenal hipofonksiyonu ve büyüme hızının azalması dahil, sistemik glukokortikosteroidlerin bulgu ve belirtileri ortaya çıkabilir. 4.9. Doz aşımı ve tedavisiTiotropiumYüksek dozlarda tiotropium bromür, antikolinerjik bulgu ve semptomlara yol açabilir. Ancak, sağlıklı gönüllülerde 340 mcg tiotropium bromür dozuna kadar inhale tek doz sonrasında sistemik antikolinerjik advers etkiler görülmemiştir. Sağlıklı gönüllülerde 170 mcg'a kadar tiotropium bromür ile yedi günlük doz uygulaması sonrasında ağız kuruluğu dışında advers etki görülmemiştir. KOAH'ı olan kişilerde dört hafta süreyle, günlük maksimum 43 mikrogram tiotropium bromür dozları ile uygulanan bir çoklu doz çalışmasında anlamlı istenmeyen etkiler gözlenmemiştir. Tiotropium bromürün oral yoldan alınması ile akut intoksikasyon pek olası değildir, çünkü oral yoldan biyoyararlanımı düşüktür. Budesonid Çok yüksek dozlarda olsa bile, budesonid akut doz aşımının klinik açıdan sorun oluşturması beklenmez. 5. FARMAKOLOJİK ÖZELLİKLER5.L Farmakodinamik özelliklerFarmakoterapötik grubu: Obstrüktif Solunum Yolu Hastalıklarında Kullanılan İlaçlar ATC kodu:Tiotropium için; ATC Kodu: R03BB04 Grup: Antikolinerjikler Budesonid için; ATC Kodu: R03BA02 Grup: Glukokortikosteroidler Tiotropium Tiotropium, klinik tıpta genellikle antikolinerjik olarak adlandırılan, uzun etkili spesifik bir antimuskarinik ajandır. Mı'den Ms'e kadar olan muskarinik reseptör alt-tiplerine karşı benzer bir afinite gösterir. Hava yollarında, düz kasta bulunan M3 reseptörlerinin inhibisyonu, gevşeme ile sonuçlanmaktadır. Bu antagonizma yarışmacı ve geri-dönüşümlüdür. Yapılan çalışmalarda, bronkoprotektif etkilerin doza bağımlı olduğu ve 24 saatten daha uzun sürdüğü görülmüştür. Etkisinin uzun süreli oluşu, muhtemel M3 reseptörlerinden son derece yavaş dissosiye olmasına bağlıdır; ipratropium ile gözlenenden anlamlı derecede daha uzun bir dissosiyasyon yarı-ömrüne sahiptir. N-kuvatemer bir antikolineıjik olarak tiotropium, inhalasyon yoluyla uygulandığında, bronko-selektiftir; sistemik antikolinerjik etkilere yol açmadan önce, kabul edilebilir bir terapötik aralık gösterir. M2 reseptörlerinden dissosiyasyonu. M3 reseptörleriyle olduğundan daha hızlıdır ve bu durum, M2'ye karşı M3 için bir alt-tip reseptör selektivitesine yol açar. Yüksek düzeydeki potens ve reseptörden yavaş dissosiyasyonun klinikteki karşılığı, KOAH'ı olan kişilerdeki belirgin ve uzun etkili bronkodilatasyondur. Tiotropium inhalasyonunu izleyen bronkodilatasyon. primer olarak bölgeye özgü (havayolları üzerinde) bir etki olup, sistemik bir etki değildir. Klinik geliştirme programında yürütülen uzun süreli, randomize, çift-kör çalışmalarda günde bir kez uygulanan tiotropium, akciğer fonksiyonlarında (bir saniyelik zorlu ekspirasyon hacmi, FEV] ve zorlu vital kapasite, FVC) ilk dozu izleyen 30 dakika içinde belirgin iyileşmeye yol açmış ve bu etki 24 saat süreyle kalıcı olmuştur. Bronkodilatasyon büyük çoğunlukla üçüncü gün görülmeye başlar ve farmakodinamik kararlı duruma bir hafta içerisinde ulaşılır. Tiotropium sabah ve akşam pik ekspiratuvar akım hızı (PEFR) düzeylerinde, anlamlı bir iyileşme sağlar. Tiotropium ile akciğer fonksiyonlarında görülen iyileşmeler, uzun dönemli çalışmalarda, hiçbir tolerans belirtisi bulunmaksızın kalıcı olmuştur. Tiotropium'un oluşturduğu bronkodilatasyon, 24 saatlik doz aralığı boyunca kalıcıdır ve sabah ya da akşamları uygulamasından bağımsızdır. Uzun dönemli (6 ay ve 1 yıl) araştırmalarda, sağlığa ilişkin olarak aşağıdaki sonuçlar ortaya çıkarılmıştır: Tiotropium, dispneyi anlamlı derece iyileştirir (Transizyon Dispne İndeksi kullanılarak değerlendirildiği şekliyle). Bu şekilde iyileşme tedavi dönemi süresince kalıcılık gösterir. Tiotropium plaseboya kıyasla, KOAH alevlenmeleri sayısını anlamlı derecede azaltır ve ilk alevlenmeye kadar geçen süreyi geciktirir. Tiotropium, sağlığa bağlı yaşam kalitesini, hastalığa özgü St.George Solunum Anketi ile gösterildiği üzere, anlamlı düzeyde iyileştirir. Bu iyileşme, bütün tedavi dönemi süresince kalıcıdır. Tiotropium, KOAH alevlenmelerine bağlı hospitalizasyonların sayısını anlamlı düzeyde azaltır ve ilk hospitalizasyona kadar geçen süreyi geciktirir. Budesonid Budesonid. güçlü lokal antienflamatuvar etkileri olan bir glukokortikosteroiddir. Topikal antienflamatuvar etki Glukokortikosteroidlerin astım ve KOAH tedavisindeki etki mekanizmaları tam olarak aydmlatılamamıştır. Enflamatuvar mediyatörlerin salgılanmasmm ve sitokinlerce yönlendirilen immün yanıtlann inhibisyonları gibi antienflamatuvar etkiler, muhtemelen önemlidir. Glukokortikosteroid reseptör afmitelerine göre, budesonidin entrensek etki gücü, prednizolondan yaklaşık 15 kat fazladır. Astımlı hastalarda inhalasyon ve oral yoldan kullanılan budesonidin karşılaştırıldığı bir klinik çalışmada, plaseboya göre inhalasyon yoluyla kullanılan budesonidin istatistiksel açıdan anlamlı bir şekilde etkili olduğu, oral yoldan kullanılan budesonid ve plasebo arasında ise anlamlı bir farkın olmadığı görülmüştür. Alışılmış dozlarda inhalasyon yoluyla kullanılan budesonidin etkisi, solunum yolları üzerindeki doğrudan etkisi ile açıklanabilir. Budesonid hayvanlar ve insanlar üzerinde yapılan provokasyon çalışmalarında, antianaflaktik ve antienflamatuvar etki göstermiş, hem erken hem de geç alerjik reaksiyonlarda bronşiyal obstrüksiyonu azaltmıştır. Astımın alevlenmesi Günde bir veya iki kez uygulanan inhale budesonidin hem çocuk hem de erişkinlerde astımın alevlenmesini etkili olarak önlediği gösterilmiştir. Egzersizle ortaya çıkan astım İnhalasyon yoluyla günde bir veya iki kez uygulanan budesonid tedavisi, egzersizle ortaya çıkan bronkokonstrüksiyonun önlenmesinde etkili olmuştur. Solunum yolu reaktivitesi Budesonidin aşırı duyarlılığı olan hastalarda hem direkt hem de indirekt provokasyonlarda solunum yolları reaktivitesini azalttığı gösterilmiştir. HPA eksen fonksiyonu Sağlıklı gönüllülerde kuru toz inhaleri aracılığıyla uygulanan budesonid plazma ve idrar kortizolü üzerinde doz ile orantılı bir etki göstermiştir. Kuru toz inhaleri yoluyla önerilen dozlarda kullanılan budesonid, ACTH testlerine göre, adrenal fonksiyonlarını 10 mg prednizolondan belirgin olarak daha az etkiler. Büyüme Uzun süreli çalışmalar, inhale budesonid ile tedavi edilen çocuk ve ergenlerde yetişkin hedef boyuna sonuçta ulaşıldığmı göstermiştir. Ancak büyümede başlangıçta küçük ancak çabuk geçen bir büyüme azalması (yaklaşık 1 cm) gözlenmiştir. Bu genellikle tedavinin ilk yılında ortaya çıkmaktadır. 5.2. Farmakokinetik özellikler Genel özelliklerEmilim:Tiotropium Tiotropium, kiralite göstermeyen bir kuvatemer amonyum bileşiğidir ve suda kısmen çözünür. Tiotropium, kuru toz inhalasyonu şeklinde uygulanır. İnhalasyon yolu ile uygulamada genel olarak, verilen dozun büyük çoğunluğu gastrointestinal kanalda, daha az bir kısmı ise, hedef organ olan akciğerde tutulur. Kuru toz inhalasyonundan sonra elde edilen %19.5 düzeyindeki mutlak biyoyararlanım değeri, akciğere ulaşan bölümün yüksek ölçüde biyoyararlanılabilir olduğunu düşündürmektedir. Bileşiğin kimyasal yapısından (kuvatemer amonyum bileşiği), tiotropiumun gastrointestinal kanaldan iyi absorbe edilmemesi beklenir. Oral tiotropium solüsyonları, %2-3 düzeyinde bir mutlak biyoyararlanıma sahiptirler. Maksimum plazma tiotropium konsantrasyonları, inhalasyondan beş dakika sonra gözlenir. Besinler tiotropiumun emilimini etkilememektedir. Budesonid Kuru toz inhaleri yoluyla uygulanan budesonid dozunun yaklaşık %25-30'u akciğerlere ulaşır, ki bu ölçülü doz inhalatörün yaklaşık iki katıdır. Oral yoldan tek doz halinde 800 mg budesonid inhale edildikten sonra en yüksek plazma konsantrasyonu yaklaşık 4 nmol/L'dir ve bu değere inhalasyondan yaklaşık 30 dakika sonra ulaşılır. Kuru toz inhaleri ile uygulanan budesonidin sistemik yararlanımı, ölçülü dozun %38M kadardır ve bunun 1/6'sı yutulan ilaçtan kaynaklanmaktadır. DaSılım:Tiotropium İlaç plazma proteinlerine %72 oranında bağlanır ve 32 L/kg'lık bir dağılım hacmi gösterir. Kararlı durumda, kronik obstrüktif akciğer hastalarında 18 mikrogram dozunda kuru toz inhalasyonundan 5 dakika sonra ölçülen tiotropium doruk plazma düzeyleri 17-19 pg/mL'dir ve çok kompartmanlı bir model içinde, hızla azalma gösterir. Kararlı durumda plazma konsantrasyonları, 3-4 pg/mL'dir. Akciğerdeki lokal konsantrasyonlar bilinmemektedir, ancak uygulama şekli, akciğerlerde önemli oranda daha yüksek konsantrasyonların varlığını düşündürmektedir. Çalışmalar, tiotropiumun kan beyin bariyerini herhangi önemli bir düzeyde geçmediğini göstermektedir. Budesonid Budesonidin dağılım hacmi yaklaşık 3 L/kg'dır. Plazma proteinlerine ortalama % 85-90 oranında bağlanır. B i yo transformasyon:Tiotropium Biyotransformasyona uğrama derecesi küçüktür. Tek doz intravenöz uygulamadan sonra, değişmemiş madde %74 oranında idrarla atılır. Ester yapısında olan tiotropium, enzimatik olmayan bir yol ile, bir alkol olan N-metilskopin ve ditiyenilglikolik aside parçalanır; bu maddelerin her ikisi de muskarinik reseptörlere bağlanmazlar. İntravenöz uygulama sonrasında dozun % 20'sinden azı, CYP450, 2D6 ve 3A4 tarafından, çeşitli Faz 11 metabolitlerine metabolize edilir. Karaciğer mikrozomlarmdaki in vitro çalışmalar enzimatik yolun CYP 2D6 (ve 3A4) inhibitörleri, kinidin, ketokonazol ve gestoden tarafından etkilenebileceğini ortaya koymaktadır. Böylelikle, CYP 2D6 ve 3A4 dozunun daha az bir kısmının eliminasyonundan sorumlu metabolik yolda yer almaktadır. Tiotropium bromür insan karaciğer mikrozomlarında terapötik konsantrasyonların üstünde bile CYP lAl, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 veya 3A'yı inhibe etmemektedir. Budesonid Budesonid, karaciğerden ilk geçiş sırasında yüksek oranda (~%90) metabolize edilerek glukokortikosteroid aktivitesi düşük metabolitlerine dönüşür. En önemli metabolitleri 6B-hidroksibudesonid ve 16a-hidroksiprednizolonun glukokortikosteroid aktivitesi, budesonidin aktivitesinin %1'inden azdır. Budesonid metabolizması temel olarak sitokrom p450'nin alt sınıfı olan CYP3A aracılığıyla olur. Eliminasvon:Tiotropium İnhalasyon sonrasında tiotropiumun terminal eliminasyon yarı-ömrü 5 ve 6 gün arasındadır. İntravenöz uygulanan tiotropium, idrar yoluyla esas olarak değişmemiş halde atılır (% 74). Kuru toz inhalasyonundan sonra üriner ekskresyon dozun % 14'üdür, geri kalanı büyük oranda barsaklarda emilmemiş ilaç halinde bulunur ve feçes ile elimine edilir. KOAH'lı kişiler tarafından, günde bir kez kronik inhalasyondan sonra, farmakokinetik kararlı duruma 2-3 hafta içerisinde ulaşılır ve daha sonrasında herhangi bir birikim görülmez. Budesonid Budesonidin metabolitleri, aynen ya da konjuge edilerek, temel olarak böbrekler aracılığıyla atılır. İdrarda değişime uğramamış halde budesonid bulunmaz. Budesonidin sistemik klerensi yüksektir (dakikada yaklaşık 1.2 L) ve intravenöz yoldan uygulandığında plazma yanlanma süresi ortalama 2-3 saattir. Do&rusallık/dogrusal olmayan durum:Tiotropium Tiotropium intravenöz ve kuru toz inhalasyonu olarak verildiğinde terapötik doz aralığında doğrusal farmakokinetik göstermektedir. Budesonid Klinik dozlarda budesonid kinetiği, doz ile orantısaldır. Hastalardaki karakteristik özelliklerTiotropiumGerivatrik hastalar:Başlıca renal yolla atılan tüm ilaçlarda beklenildiği gibi artan yaş, böbrek fonksiyonlarında azalma ile açıklanabilen, tiotropium bromür renal klerensinde (58 yaşından küçük KOAH'lı hastalarda 326 mL/dak, 70 yaşından büyük KOAHTı hastalarda 163 mL/dak) azalma ile ilişkili olmuştur. İnhalasyondan sonra idrarda tiotropium bromür atılımı %14 (genç sağlıklı gönüllü bireyler)-yaklaşık %7 (KOAH'lı hastalar) oranında azalmıştır. Bununla birlikte plazma konsantrasyonları bireylere ait ve bireyler arası değişkenlikle karşılaştırıldığında KOAH'lı hastalarda ilerleyen yaşla birlikte anlamlı oranda değişmemiştir (kuru toz inhalasyonundan sonra EAAo-4sa değerinde %43 oranında artış). Böbrek yetmezliği:Başlıca renal yoldan atılıma uğrayan diğer ilaçlarda olduğu gibi, böbrek yetmezliği hem intravenöz infüzyon hem de kuru toz inhalasyonundan sonra artan ilaç plazma konsantrasyonları ve azalan renal ilaç klerens ile ilişkili olmuştur. Yaşlı hastalarda sık karşılaşılan bir durum olan hafif şiddette böbrek yetmezliğinde (CL/cr 50-80 ml/dak) tiotropium bromür plazma konsantrasyonlarında hafif bir artış meydana gelmiştir (intravenöz infiizyon sonrasında EAAo-4sa'da %39 oranında artış). Orta-şiddetli böbrek yetmezliği durumunda (CL/cr <50 ml/dak), intravenöz tiotropium bromür uygulaması plazma konsantrasyonlarının iki katına çıkması ile sonuçlanmıştır (EAAo-4sa değerinde %82 oranında artış) (kuru toz inhalasyonundan sonra ki plazma konsantrasyonları ile doğrulanmıştır). Karaciğer yetmezliği:Karaciğer yetmezliğinin tiotropium bromür farmakokinetiği üzerinde klinik olarak anlamlı etkiye sahip olacağı beklenmemektedir. Tiotropium bromür başlıca renal eliminasyon yoluyla (genç sağlıklı gönüllülerde %74 oranında) ve basit enzimatik olmayan ester ayrışması ile farmakolojik olarak inaktif bileşenlerine parçalanmaktadır. Budesonid Veri mevcut değildir. 5.3. Klinik öncesi güvenlilik verileriTiotropiumGüvenlik farmakolojisi, tekrarlı doz toksisitesi ve üreme toksisitesi gibi klasik çalışmalarda gözlenen birçok etki tiotropium bromürün antikolineıjik etkileri ile açıklanabilir. Hayvanlarda tipik olarak azalmış besin tüketimi, kilo alımı engellenmesi, ağız kuruluğu, azalmış lakrimal ve salivasyon, göz bebeğinin anormal büyümesi, artmış kalp atış hızı gözlenmiştir. Tekrarlı doz toksisite çalışmalarından bildirilen diğer ilişkili advers etkiler: sıçanlarda ve farelerde rinit, nazal boşluğun ve larinksin epitel değişmeleri ile beliren solunum yolunun hafif şiddette tahriş olması ve sıçanlarda mesanede taş oluşumu ve proteinimsi birikintiler ile birlikte prostat. Hamilelik, embriyonel/fetusa ilişkin gelişim, doğum veya doğum sonrası gelişim ile ilgili zararlı etkiler sadece matemal olarak toksik doz seviyelerinde gösterilebilmiştir. Tiotropium bromür sıçanlarda ve tavşanlarda teratojenik bulunmamıştır. Solunumsal (tahriş), ürogenital (prostat) değişiklikler ve üreme toksisitesi lokal veya sistemik maruziyet, terapötik maruziyetin 5 katından fazla olduğu zaman gözlenmiştir. Genotoksisite ve karsinojenik potansiyel insanlar için özel bir tehlike ortaya çıkarmamıştır. Budesonid Akut, subakut ve kronik toksisite çalışmalarının sonuçları, vücut ağırlığındaki artışın azalması ve lenfoid dokular ile adrenal korteks atrofısi gibi budesonidin sistemik etkilerinin, diğer glukokortikosteroidlerin uygulanmasında gözlenenlerden daha hafif ya da benzer düzeyde olduğunu göstermektedir. Altı test sisteminde incelenen budesonid mutajenik ya da klastojenik etki göstermemiştir. Yapılan bir karsinojenik etki araştırmasında erkek sıçanlarda gözlenen beyin glioma insidans artışı, tekrarlanan çalışmada doğrulanamamıştır. Tekrarlanan bu çalışmada, glioma insidansı, aktif tedavi (budesonid, prednizolon, triamsinolon asetonid) gruplarında ve kontrol gruplarında aynı bulunmuştur. İlk karsinojenite çalışmasında erkek sıçanlarda gözlenen karaciğer değişiklikleri (primer hepatoselüler tümörler), yinelenen çalışmada da. budesonid yanında referans glukokortikosteroidlerin uygulandığı gruplarda da görülmüştür. Bu etkilerin bir reseptör etkisine bağlı olması ve bir sınıf etkisini göstermesi kuvvetle muhtemeldir. Mevcut klinik deneyimlere göre, budesonid ya da diğer glukokortikosteroidlerin insanlarda beyin gliomalarmı ya da primer hepatoselüler tümörleri uyardığına dair hiçbir işaret yoktur. 6. FARMASÖTİK ÖZELLİKLERİ6.1. Yardımcı maddelerin listesiLaktoz6.2. GeçimsizliklerBilinen geçimsizliği yoktur.6.3. Raf ömrü24 ay6.4. Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında ve kuru yerde saklayınız.6.5. Ambalajın niteliği ve içeriğiTİOBUD 9/400 mcg İnhalasyon için toz içeren 60 veya 120 kapsül, PVC/PVDC/Alü blister ambalajlarda inhalasyon cihazı ve kullanma talimatı ile birlikte karton kutuda piyasaya sunulmaktadır.6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller 'Tıbbi atıkların kontrolü yönetmeliği' ve 'Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikleri'ne uygun olarak imha edilmelidir.7. RUHSAT SAHİBİMentis İlaç San. Tic. Ltd. ŞtiFlorya Asfaltı Florya İş Merkezi B Blok No:88/6 Bakırköy/İSTANBUL Telefon: O 212 481 79 52 Faks: O 212 481 79 52 e-mail: [email protected] 8. RUHSAT NUMARASI (LARI)241/189. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi; 05.03.2012 Ruhsat yenileme tarihi:10. KÜB'ÜN YENİLENME TARİHİ k 1
k 1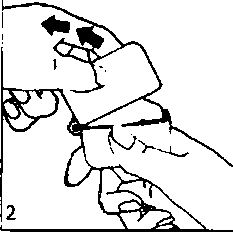  1., 2. ve 3. Toz başlığını yukarı doğru çekerek açınız. Daha sonra ağızlık parçasını açınız.
1., 2. ve 3. Toz başlığını yukarı doğru çekerek açınız. Daha sonra ağızlık parçasını açınız.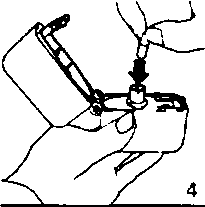 4. Blister ambalajından bir TİOBUD inhalasyon için toz içeren kapsülü çıkarınız (kullanımdan hemen önce çıkarınız) ve şekilde gösterildiği gibi merkezi hazneye yerleştiriniz. Kapsülün hazneye hangi yönde yerleştirildiği önemli değildir.
4. Blister ambalajından bir TİOBUD inhalasyon için toz içeren kapsülü çıkarınız (kullanımdan hemen önce çıkarınız) ve şekilde gösterildiği gibi merkezi hazneye yerleştiriniz. Kapsülün hazneye hangi yönde yerleştirildiği önemli değildir.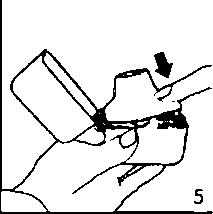 5. Ağızlık parçasını bir klik sesi duyuncaya değin
5. Ağızlık parçasını bir klik sesi duyuncaya değin sıkıcakapatınız. Toz başlığını açık bırakınız.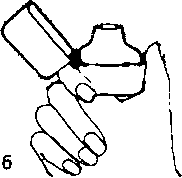 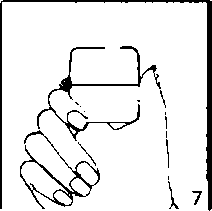 6. ve 7. İnhalasyon cihazını ağızlık parçası yukarıda olacak şekilde tutunuz ve kapağı bastırarak kapatınız.
6. ve 7. İnhalasyon cihazını ağızlık parçası yukarıda olacak şekilde tutunuz ve kapağı bastırarak kapatınız.Böylece kapsülde delikler açılacak ve nefes aldığınızda ilacın salıverilmesini sağlayacaktır.  8. Nefesinizi tam olarak veriniz.
8. Nefesinizi tam olarak veriniz.Önemli: Hiçbir zaman ağızlık parçasına doğru nefes vermeyiniz. 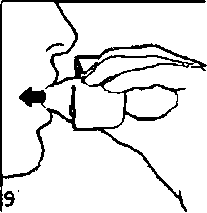 9. İnhalasyon cihazının ağzını açıp, cihazı ağzınıza kadar kaldırınız ve dudaklarınızı ağızlık parçasının çevresinde sıkıca kapayınız. Başınızı dik bir şekilde tutarak, yavaş ve derin bir nefes alınız; nefes alma hızınızı, kapsülün titreştiğini algılayacak şekilde ayarlayınız. Akciğerleriniz doluncaya kadar nefes alınız; nefesinizi sizi zorlamayacak bir süreyle tutunuz ve bu esnada inhalasyon cihazını ağzınızdan çıkarınız. Şimdi normal nefes alıp vermeye başlayabilirsiniz.
9. İnhalasyon cihazının ağzını açıp, cihazı ağzınıza kadar kaldırınız ve dudaklarınızı ağızlık parçasının çevresinde sıkıca kapayınız. Başınızı dik bir şekilde tutarak, yavaş ve derin bir nefes alınız; nefes alma hızınızı, kapsülün titreştiğini algılayacak şekilde ayarlayınız. Akciğerleriniz doluncaya kadar nefes alınız; nefesinizi sizi zorlamayacak bir süreyle tutunuz ve bu esnada inhalasyon cihazını ağzınızdan çıkarınız. Şimdi normal nefes alıp vermeye başlayabilirsiniz.Basamak 8 ve 9'u bir kez daha tekrarlayınız, bu kapsülün tamamen boşalmasını sağlayacaktır. 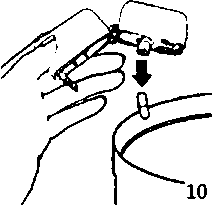 10. Ağızlık parçasını yeniden açınız. Cihazı çevirerek kullanılmış kapsülü çıkannız ve atınız. Sonrasında ağzınızı su ile çalkalayınız. Ağızlık parçasını ve toz başlığını kapatınız ve inhalasyon cihazınızı yerine kaldınnız.
10. Ağızlık parçasını yeniden açınız. Cihazı çevirerek kullanılmış kapsülü çıkannız ve atınız. Sonrasında ağzınızı su ile çalkalayınız. Ağızlık parçasını ve toz başlığını kapatınız ve inhalasyon cihazınızı yerine kaldınnız.İnhalasyon cihazının temizleme işlemi İnhalasyon cihazını ayda bir kez yıkayınız. Kapağı ve ağızlığı açınız. Cihazı sıcak su ile yıkayarak içerisindeki tozlardan armdınnız. Cihaz içerisindeki suyu boşaltarak kağıt bez üzerine kapak, ağızlık ve gövde kısımları açık kalacak şekilde kurumaya bırakınız. 24 saat kurumaya bırakılan cihaz kullanılmaya hazırdır. Eğer ihtiyaç varsa ağızlık kısmının dış yüzeyi ıslak olmayan nemli bir bezle silinebilir. 1 Tiotropium ile tedavi edilen 9,149 hastada tiotropium ile ilişkilendirilen olay yoktur ancak olaylar tiotropiuma bağlı advers ilaç reaksiyonlan olarak düşünülmektedir. |
İlaç BilgileriTiobud 9/400mcg İnhalasyon İçin Toz İçeren KapsülEtken Maddesi: Tiotropium Bromür Anhidrus, Budesonid Atc Kodu: R03BB04 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.