Duesonit 18/400 mcg İnhalasyon İçin Toz İçeren Kapsül Kısa Ürün BilgisiSolunum Sistemi » Solunum Sisteminde Tıkanma - Astım İlaçları » Diğer İnhalanlar (solukla içeri çekilen ilaçlar) » Antikolinerjik İlaçlar » Tiotropium Bromür KISA URUN BILGISI 1. BEŞERI TIBBI ÜRÜNÜN ADIDUESONİT 18/400 mcg inhalasyon için toz içeren kapsül2. KALITATIF VE KANTİTATIF BILEŞIM ETKIN MADDE:Tiotropium bromür anhidrus* 21,7 mcgSiklesonid 400 mcg *18 mcg tiotropium'a eşdeğer Yardımcı madde(ler):Laktoz 12, 5783 mgYardımcı maddeler için, 6.1'e bakınız. 3. FARMASÖTIK FORMİnhalasyon İçin Toz İçeren KapsülFlesh opak, natural transparan renk kapsül içerisinde beyaz toz. 4. KLİNIK ÖZELLIKLER4.1. Terapötik endikasyonlarAmfizem ve kronik bronşit de dahil reversibl kronik obstrüktif akciğer hastalığı (KOAH) olan hastalarda bronkokonstriksiyonun önlenmesi ve uzun süreli tedavisinde endikedir.4.2. Pozoloji ve uygulama şekli Pozoloji/ uygulama sıklığı ve süresi:Doktor tarafından başka bir şekilde kullanılması önerilmediği takdirde;Erişkinler için önerilen dozu, günde bir kez bir kapsül içeriğinin inhale edilmesidir. İnhalasyon her gün, günün aynı saatinde, inhalasyon cihazı kullanılarak yapılmalıdır. Hastanın cihazı doğru kullandığından emin olunmalıdır. Uygulama şekli:DUESONİT, ağız yoluyla inhalasyon şeklinde kullanılır.İnhalasyon cihazı yoluyla nefes alındığında ilaç akciğerlere ulaşır. Bu nedenle, cihazın ağız parçası aracılığıyla derin ve güçlü nefes alınması önemlidir. İnhalasyon cihazının kullanımı doktor veya eczacı tarafından hastaya gösterilmelidir. Kapsüllerin kesinlikle ağız içine alınarak yutulmaması ve kesinlikle inhaler içine yerleştirildikten sonra soluk alma yoluyla kullanılması gerektiği konusunda hasta bilgilendirilmelidir. Jelatin kapsülün parçalanabileceği ve inhalasyondan sonra ağız veya boğaza küçük jelatin parçacıklarının ulaşabileceği hastaya anlatılmalıdır. Bu olasılık kapsülün birden fazla delinmemesi ile en aza indirilir. Kapsüller blister ambalajdan ancak kullanım öncesi çıkarılmalıdır. İnhalasyon cihazı kullanma talimatı için bakınız ekli talimat. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:DUESONİT'in içeriğindeki tiotropium böbrek yetmezliği olan hastalarda önerilen dozlarda kullanılabilir. Bununla birlikte esas olarak böbrekler yoluyla atılan bütün ilaçlarda olduğu gibi, orta ile şiddetli böbrek yetmezliği olan hastalarda (kreatinin klerensi <50 ml/dak) DUESONİT kullanımı yakından izlenmelidir. DUESONİT'in içeriğindeki siklesonid için ağır böbrek yetmezliğinde ilaç dozuna ilişkin yeterli veri bulunmamaktadır.Karaciğer yetmezliği:DUESONİT'in içeriğindeki tiotropium karaciğer yetmezliği olan hastalarda önerilen dozlarda kullanılabilir. DUESONİT'in içeriğindeki siklesonid için karaciğer yetmezliği olan hastalarda doz ayarlaması gerekmez. Ancak, ağır karaciğer yetmezliğinde ilaç dozuna ilişkin yeterli veri bulunmamaktadır.Pediyatrik popülasyon:Pediyatrik hastalarda DUESONİT'in içeriğindeki tiotropiumun etkinliğine ve güvenilirliğine ilişkin deneyim bulunmadığından, 18 yaşın altındaki pediyatrik hastalarda kullanılmamalıdır.Geriyatrik popülasyon:DUESONİT geriyatrik popülasyonda önerilen dozda kullanılabilir.4.3. KontrendikasyonlarTiotropiuma, atropin veya türevlerine, örn. ipratropiuma ya da oksitropiuma, siklesonide ve/veya ürünün içindeki yardımcı madde laktoza karşı aşırı duyarlılığı olanlarda kullanılmamalıdır.Siklesonid içeren DUESONİT, aktif veya semptomsuz akciğer tüberkülozu olan ya da fungal, virütik veya bakteriyel enfeksiyonu bulunan hastalarda kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriTiotropiumDUESONİT; KOAH akut ataklarında tek başına kullanılamaz. Kurtarıcı ilaç olarak kısa etkili beta 2 mimetik ilaçlar ile birlikte verilir. DUESONİT günde bir kez kullanılan bir idame tedavisi bronkodilatörü olarak, akut bronkospazm episodlarının başlangıç tedavisinde, yani kurtarma tedavisi şeklinde kullanılmamalıdır. DUESONİT uygulamasından sonra ani aşırı duyarlılık reaksiyonları oluşabilir. Diğer antikolinerjik ilaçlarla olduğu gibi, tiotropium dar açılı glokomu kötüleştirebileceği, prostat hiperplazisi ya da mesane boynu obstrüksiyonu bulunan hastalarda idrar güçlüğü oluşturabileceğinden bu hastalarda dikkatle kullanılmalıdır. İnhalasyon yoluyla alınan ilaçlar, inhalasyonun indüklediği bronkospazma neden olabilirler. Esas olarak böbrekler yoluyla atılan bütün ilaçlarda olduğu gibi, azalmış böbrek fonksiyonu plazma konsantrasyonlarını artırır, bu sebeple orta ile şiddetli böbrek yetmezliği olan hastalarda (kreatinin klerensi <50 ml/dk) sadece beklenen yarar potansiyel riskten büyük olduğunda kullanılmalıdır. Şiddetli böbrek yetmezliği olan hastalarda kullanımına ilişkin uzun süreli deneyim bulunmamaktadır. DUESONİT 18/400 mcg inhalasyon için toz içeren kapsülün hatasız bir şekilde nasıl kullanılacağı öğretilmelidir. Hastalara tozun göze kaçmaması için dikkatli olmaları öğütlenmelidir. Konjuktivada konjesyon veya korneada ödem sonucunda gelişen göz kızarmasıyla birlikte gözde ağrı veya rahatsızlık hissi, bulanık görme, haleler veya renkli görüntüler görme, akut dar açılı glokom belirtileri olabilir. Bu semptomların herhangi bir kombinasyonu görülürse, ilaç kesilmeli ve hemen bir uzman hekimin görüşleri alınmalıdır. Antikolinerjik tedavi ile gözlenen ağız kuruluğu uzun dönemde diş çürüklerine sebep olabilir. DUESONİT 18/400 mikrogram inhalasyon için toz içeren kapsül günde bir defadan daha sık kullanılmamalıdır. Siklesonid Diğer tüm inhale kortikosteroidler gibi, siklesonid de, status astmatikus ve diğer yoğun bakım gerektiren acil durumların tedavisinde endike değildir. Diğer tüm inhale kortikosteroidler gibi, siklesonid de, inhale kısa etkili bir bronkodilatörün gerekli olduğu akut astım semptomlarının giderilmesi amacıyla kullanılamaz. Hastalara bu gibi acil durumlara uygun ilaçları hazır bulundurmaları gerektiği konusunda bilgi verilmelidir. İnhale kortikosteroidlerin özellikle yüksek dozda ve uzun süreli kullanımlarında sistemik etkileri ortaya çıkabilmektedir. Ancak, oral yoldan kullanılan kortikosteroidlere kıyasla bu gibi durumların meydana gelme ihtimali çok daha azdır. Olası sistemik etkilerin arasında böbrek üstü bezi salgısında azalma, çocuk ve genç ergenlerde büyüme geriliği, kemik mineral yoğunluğunda azalma, katarakt ve glokom gibi durumlar yer almaktadır. Bu yüzden inhale kortikosteroid dozunun astım kontrolünü sağlayabilen en düşük etkin dozuna ayarlanmış olması önem taşımaktadır. İnhale kortikosteroidlerle uzun süre tedavi olan çocukların ve ergenlik çağındaki hastaların boylarının düzenli olarak ölçülmesi önerilir. Eğer büyüme yavaşsa, inhale kortikosteroid dozunun astımı kontrol altına alabilecek etkili en düşük doza azaltılması amacıyla tedavi tekrar düzenlenmelidir. Herhangi bir girişim öncesinde bu hastaların böbrek üstü bezi yetersizliği açısından uzman gözetimine alınması gerekebilir. Böbrek üstü bezindeki bozulmanın kalıntıları olabileceği göz önüne alınarak tıbbi ya da cerrahi aciller veya stres oluşturan planlı girişimler söz konusu olduğunda bu hastalara uygun kortikosteroid tedavisine başlanmalıdır. Oral kortikosteroid kullanan hastalarda inhale siklesonid tedavisine geçilmesi hakkında: Oral steroid bağımlı hastaların siklesonid tedavisine geçilmesi ve bu hastaların daha sonraki tedavileri özel bakım gerektirir; çünkü uzun süren sistemik kortikosteroid kullanımı nedeniyle böbrek üstü bezi fonksiyonlarındaki bozukluğun iyileşmesi uzun zaman alabilir. Uzun süredir ya da yüksek dozda sistemik steroid kullanmış olan hastaların böbrek üstü bezi fonksiyonları baskılanmış olabilir. Bu hastaların böbrek üstü bezi fonksiyonları düzenli olarak kontrol edilerek, kullandıkları sistemik steroidin dozu dikkatle azaltılmalıdır. Sistemik steroidin kademeli bir şekilde bırakılması amacıyla mevcut doz her hafta 1 mg prednizolon veya diğer türevlerin buna eşdeğer olacak miktarı şeklinde hesaplanarak azaltma süreci başlatılır. Prednizolon idame dozunun günlük 10 mg'ı aştığı olgularda daha büyük dilimler halinde haftalık azalışlar da uygun olabilir. Bazı hastalar bu kademeli bırakma aşamalarında solunum fonksiyonları değişmediği ve hatta düzeldiği halde kendilerini bir şekilde kötü hissetmektedir. Bu gibi hastaları eğer böbrek üstü bezi yetmezliğine ait objektif bulguları yoksa, inhale siklesonid kullanmaya ve de sistemik steroid tedavisini bırakmaya azimle devam etmeleri konusunda cesaretlendirmek gerekir. Böbrek üstü fonksiyonları hâlâ düzelmemiş olan oral steroid tedaviden inhale siklesonid tedavisine geçilmiş hastaların stres dönemlerinde (örn. astım ataklarının sıklaşması, torakal enfeksiyonlar, araya giren ciddi hastalık, cerrahi girişim, travma, vb.) ilave sistemik steroid kullanmalarının gerekli olduğunu belgeleyen uyarı/bilgi kartlarını taşımaları gerekir. Sistemik steroid tedavisinin yerine inhale tedavinin başlatılması bazen alerjik rinit ya da egzama gibi evvelce sistemik ilaç ile kontrol edilmiş bulunan alerjileri açığa çıkarabilir. İnhale kortikosteroid uygulamasının hemen ardından artan hırıltılı solunum gibi paradoksal bronkospazm ve bronkospazmın diğer semptomları genellikle hızlı şifa sağlayan inhale kısa etkili bronkodilatör ile tedavi edilmelidir. Hasta muayene edilip değerlendirilmeli ve siklesonid tedavisi ancak beklenen faydanın olası riski aşması halinde sürdürülmelidir. Astım tablosunun ciddiyeti ile akut bronşiyal reaksiyonların sebep olduğu genel hassasiyet artışı arasındaki ilinti göz önünde bulundurulmalıdır (bkz. 4.8. İstenmeyen etkiler). Laktoz uyarısı DUESONİT yardımcı madde olarak laktoz içermektedir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriTiotropiumTiotropiumun antikolinerjik maddeler içeren diğer ilaçlar ile birlikte uygulanması henüz incelenmemiştir ve bu nedenle önerilmemektedir. Düzenli ilaç etkileşimi çalışmaları yürütülmemiş olmakla birlikte, tiotropium diğer ilaçlar ile birlikte, istenmeyen ilaç reaksiyonları görülmeksizin kullanılmıştır. KOAH tedavisinde yaygın olarak kullanılan sempatomimetik bronkodilatörler, metilksantinler, oral ve inhale steroidler bu ilaçlar arasındadır. Siklesonid CYP3A4, in vitroverilere göre, siklesonidin aktif metaboliti olan Ml'in insandaki metabolizmasından sorumlu en önemli enzimdir.Siklesonid ve aktif metaboliti olan Ml'in serum düzeyleri düşüktür. Ancak, CYP3A4 sisteminin güçlü inhibitörlerinin (örneğin itrakonazol, ritonavir ya da nelfinovir) eş zamanlı olarak kullanımı, siklesonid/Ml düzeylerinde artmaya neden olabilir. Klinik açıdan önemli olabilecek istenmeyen etki riski gözardı edilmemelidir. Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlara ilişkin herhangi bir etkileşim çalışması tespit edilmemiştir.Pediyatrik popülasyon:Pediyatrik popülasyona ilişkin herhangi bir etkileşim çalışması tespit edilmemiştir.4.6. Gebelik ve laktasyon Genel tavsiyeGebelik kategorisi C dir.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (kontrasepsiyon)Henüz gebe kadınlarda yapılmış yeterli ve iyi kontrol edilmiş çalışma mevcut değildir.Hayvan çalışmalarında glukokortikoidlerin malformasyonlara sebep olduğu gösterilmiştir (bkz. 5.3. Klinik öncesi güvenlilik verileri). Ancak, bu sonuçların insanlara önerilen dozlarda oluşabilmesi mümkün görünmemektedir. Çocuk doğurma potansiyeli bulunan kadınların tedavi süresince etkin doğum kontrol (kontrasepsiyon) yöntemleri uygulaması önerilmektedir. Gebelik dönemiHayvanlar üzerinde yapılan araştırmalar tiotropiumun üreme toksisitesinin bulunduğunu göstermiştir. İnsanlara yönelik potansiyel risk bilinmemektedir.Diğer glukokortikoidler gibi, siklesonid'i de gebelik sırasında ancak fetüs için olan potansiyel riskinin anneye sağladığı potansiyel fayda tarafından karşılanması durumunda kullanmak gerekir. Gebeliği sırasında kortikosteroid kullanmış olan annelerin bebekleri, hipoadrenalizm açısından dikkatle izlenmelidir. DUESONİT gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Laktasyon dönemiTiotropiumun ve siklesonidin insan sütüyle atılıp atılmadığı bilinmemektedir. Hayvanlar üzerinde yapılan çalışmalar tiotropiumun sütle atıldığını göstermektedir. Emzirmenin durdurulup durdurulmayacağına ya da DUESONİT tedavisinin durdurulup durdurulmayacağına/tedaviden kaçınılıp kaçınılmayacağına ilişkin karar verilirken, emzirmenin çocuk açısından faydası ve DUESONİT tedavisinin emziren anne açısından faydası dikkate alınmalıdır.Üreme yeteneği/FertiliteÜreme yeteneği üzerinde yeterli bilgi bulunmamaktadır.Tiotropium ile ilişkili üreme toksisitesi lokal veya sistemik maruziyet, terapötik maruziyetin 5 katından fazla olduğu zaman gözlenmiştir. 4.7. Araç ve makine kullanımı üzerindeki etkilerDUESONİT'in araç ve makine kullanma yeteneği üzerindeki etkisine yönelik çalışma gerçekleştirilmemiştir. Meydana gelebilecek baş dönmesi, bulanık görme veya baş ağrısı araç ve makine kullanma yeteneğini etkileyebilir.4.8. İstenmeyen etkilerTiotropiumBelirtilen sıklık düzeyleri, advers ilaç reaksiyonlarının ham insidans oranlarıdır. Bu bilgiler, 26 plasebo kontrollü klinik araştırmalardan dört hafta ile dört yıl arasında değişen tedavi dönemlerinde tiotropium grubundan (9,149 hasta) toplanmış verilere dayanmaktadır. Yan etkilerin görülme sıklığı aşağıda belirtilmektedir: Çok yaygın (>1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (>1/1000 ila <1/100), seyrek (>1/10.000 ila <1/1000), çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Metabolizma ve beslenme hastalıklarıBilinmiyor*: DehidratasyonSinir sistemi hastalıklarıYaygın olmayan: Baş dönmesi, baş ağrısı, tat bozuklukları Seyrek: UykusuzlukGöz hastalıklarıYaygın olmayan: Bulanık görme Seyrek: Glokom, intraoküler basınç artışıKardiyak hastalıklarıYaygın olmayan: Atriyal fibrilasyonSeyrek: Supraventriküler taşikardi, taşikardi, palpitasyonlar Solunum, göğüs bozuklukları ve mediastinal hastalıklarıYaygın olmayan: Faranjit, disfoni, öksürük Seyrek: Bronkospazm, epistaksis, larenjit, sinüzitGastrointestinal hastalıklarıYaygın:Ağız kuruluğuYaygın olmayan: Konstipasyon, stomatit, gastroözofageal reflü hastalığı, bulantı Seyrek: Paralitik ileusun da dahil olduğu intestinal tıkanıklık, jinjivit, dil iltihabı, orofaringeal kandidiyaz, dizfaji Bilinmiyor*: Diş çürükleri Deri ve deri altı doku hastalıklarıYaygın olmayan: RaşSeyrek: Ürtiker, kaşıntı, hipersensitivite (ani aşırılık reaksiyonları dahil) Bilinmiyor*: Anjiyonörotik ödem, deri reaksiyonları, deri ülseri, derinin kuruması Kas-iskelet bozukluklar, bağ doku ve kemik hastalıklarıBilinmiyor*: Eklem şişliğiBöbrek ve idrar hastalıklarıYaygın olmayan: İdrar yapmada güçlük ve idrar retansiyonu Seyrek: İdrar yolu enfeksiyonu*Tiotropium ile tedavi edilen 9,149 hastada tiotropium ile ilişkilendirilen olay yoktur ancak olaylar tiotropiuma bağlı advers ilaç reaksiyonları olarak düşünülmektedir. Kontrollü klinik çalışmalarda, hastaların yaklaşık %4'ünde gözlenen yaygın istenmeyen etkiler ağız kuruluğu gibi antikolinerjik istenmeyen etkilerdir. 26 klinik çalışmada gözlenen ağız kuruluğu tiotropium ile tedavi edilen 9,149 hastanın 18'inde (%0.2) tedaviye son vermeye yol açmıştır. Antikolinerjik etki ile ilişkili ciddi istenmeyen etkiler arasında glokom, konstipasyon, paralitik ileus dahil intestinal tıkanıklık ve de idrar retansiyonu yer alır. Yaş artışı ile birlikte antikolinerjik etkilerde de artış gözlenebilir. Siklesonid Siklesonidin ve siklesonid ile tedavi edilen hastalarda bildirilen reaksiyonları içeren istenmeyen etkilerin sıklığı aşağıda listelenmiştir. Siklesonid ile gözlemlenen etkiler genellikle doz veya konsantrasyona bağlıdır. İstenmeyen etkiler aşağıdaki kategorilere göre listelenmiştir: Çok yaygın (>1/10), yaygın (>1/100 ila <1/10), yaygın olmayan (>1/1000 ila <1/100), seyrek (>1/10.000 ila <1/1000), çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Enfeksiyonlar ve enfestasyonlarYaygın olmayan: Oral mantar enfeksiyonlarıBağışıklık sistemi hastalıklarıSinir sistemi hastalıklarıYaygın olmayan: Baş ağrısıKardiyak hastalıklarıSeyrek : PalpitasyonVasküler hastalıklarıSeyrek: HipertansiyonSolunum, göğüs bozuklukları ve mediastinal hastalıklarıYaygın olmayan: Paradoksikal bronkospazm, inhalasyon sonrası öksürük, disfoniGastrointestinal hastalıklarıYaygın olmayan: Bulantı, kusma, kötü tad Seyrek: Karın ağrısı, dispepsiDeri ve deri altı doku hastalıklarıYaygın olmayan: Egzema, döküntüGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın olmayan: Uygulama bölgesinde reaksiyon ve kurulukSıklığı bilinmeyen advers reaksiyonlar: İnhale kortikosteroidlere bağlı sistemik etkiler özellikle yüksek dozda ve uzun süreli kullanım söz konusu olduğunda oluşabilmektedir. Olası sistemik etkiler arasında Cushing sendromu, cushingoid özellikler, adrenal supresyon, çocuklar ve adölesanlarda büyümede gecikme, kemik mineral yoğunluğunda azalma, katarakt, glokom sayılabilir. 4.9. Doz aşımı ve tedavisiTiotropiumYüksek dozlarda tiotropium bromür, antikolinerjik bulgu ve semptomlara yol açabilir. Ancak, sağlıklı gönüllülerde 340 mcg tiotropium bromür dozuna kadar inhale tek doz sonrasında sistemik antikolinerjik advers etkiler görülmemiştir. Sağlıklı gönüllülerde 170 mcg'a kadar tiotropium bromür ile yedi günlük doz uygulaması sonrasında ağız kuruluğu dışında advers etki görülmemiştir. KOAH'ı olan kişilerde dört hafta süreyle, günlük maksimum 43 mikrogram tiotropium bromür dozları ile uygulanan bir çoklu doz çalışmasında anlamlı istenmeyen etkiler gözlenmemiştir. Tiotropium bromürün oral yoldan alınması ile akut intoksikasyon pek olası değildir, çünkü oral yoldan biyoyararlanımı düşüktür. Siklesonid Akut: Tek doz halinde 2880 mikrogram siklesonid inhale etmiş sağlıklı gönüllüler tarafından oldukça iyi tolere edilmiştir. İnhale siklesonid aşırı dozunu takiben oluşabilecek akut toksik etki potansiyeli düşüktür. Akut doz aşımı söz konusu olduğunda hastaya özgün bir tedavi uygulamak gerekli değildir. Kronik: Siklesonid'in 1280 mikrogram dozundaki uzun süreli kullanımında böbrek üstü bezinin baskılanması ile ilişkili klinik bulgulara rastlanmamıştır. Bununla birlikte, önerilen dozun aşıldığı uzun süreli kullanımlarda böbrek üstü bezinin bir miktar baskılanma ihtimali dışlanamaz. Bu durumda hastadaki böbrek üstü bezi rezervinin denetlenmesi gerekebilir. 5. FARMAKOLOJIK ÖZELLIKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grubu: Obstrüktif Solunum Yolu Hastalıklarında Kullanılan İlaçlar Tiotropium ATC Kodu:R03BB04 Grup: AntikolinerjiklerSiklesonid ATC Kodu:R03BA08 Grup: Glukokortikoidler Tiotropium Tiotropium, klinik tıpta genellikle antikolinerjik olarak adlandırılan, uzun etkili spesifik bir antimuskarinik ajandır. M1'den M5'e kadar olan muskarinik reseptör alt-tiplerine karşı benzer bir afinite gösterir. Hava yollarında, düz kasta bulunan M3 reseptörlerinin inhibisyonu, gevşeme ile sonuçlanmaktadır. Bu antagonizma yarışmacı ve geri-dönüşümlüdür. Yapılan çalışmalarda, bronkoprotektif etkilerin doza bağımlı olduğu ve 24 saatten daha uzun sürdüğü görülmüştür. Etkisinin uzun süreli oluşu, muhtemel M3 reseptörlerinden son derece yavaş dissosiye olmasına bağlıdır; ipratropium ile gözlenenden anlamlı derecede daha uzun bir dissosiyasyon yarı-ömrüne sahiptir. N-kuvaterner bir antikolinerjik olarak tiotropium, inhalasyon yoluyla uygulandığında, bronko-selektiftir; sistemik antikolinerjik etkilere yol açmadan önce, kabul edilebilir bir terapötik aralık gösterir. M2 reseptörlerinden dissosiyasyonu, M3 reseptörleriyle olduğundan daha hızlıdır ve bu durum, M2'ye karşı M3 için bir alt-tip reseptör selektivitesine yol açar. Yüksek düzeydeki potens ve reseptörden yavaş dissosiyasyonun klinikteki karşılığı, KOAH'ı olan kişilerdeki belirgin ve uzun etkili bronkodilatasyondur. Tiotropium inhalasyonunu izleyen bronkodilatasyon, primer olarak bölgeye özgü (havayolları üzerinde) bir etki olup, sistemik bir etki değildir. Klinik geliştirme programında yürütülen uzun süreli, randomize, çift-kör çalışmalarda günde bir kez uygulanan tiotropium, akciğer fonksiyonlarında (bir saniyelik zorlu ekspirasyon hacmi, FEV1 ve zorlu vital kapasite, FVC) ilk dozu izleyen 30 dakika içinde belirgin iyileşmeye yol açmış ve bu etki 24 saat süreyle kalıcı olmuştur. Bronkodilatasyon büyük çoğunlukla üçüncü gün görülmeye başlar ve farmakodinamik kararlı duruma bir hafta içerisinde ulaşılır. Tiotropium sabah ve akşam pik ekspiratuvar akım hızı (PEFR) düzeylerinde, anlamlı bir iyileşme sağlar. Tiotropium ile akciğer fonksiyonlarında görülen iyileşmeler, uzun dönemli çalışmalarda, hiçbir tolerans belirtisi bulunmaksızın kalıcı olmuştur. Tiotropium'un oluşturduğu bronkodilatasyon, 24 saatlik doz aralığı boyunca kalıcıdır ve sabah ya da akşamları uygulamasından bağımsızdır. Uzun dönemli (6 ay ve 1 yıl) araştırmalarda, sağlığa ilişkin olarak aşağıdaki sonuçlar ortaya çıkarılmıştır: Tiotropium, dispneyi anlamlı derece iyileştirir (Transizyon Dispne İndeksi kullanılarak değerlendirildiği şekliyle). Bu şekilde iyileşme tedavi dönemi süresince kalıcılık gösterir. Tiotropium plaseboya kıyasla, KOAH alevlenmeleri sayısını anlamlı derecede azaltır ve ilk alevlenmeye kadar geçen süreyi geciktirir. Tiotropium, sağlığa bağlı yaşam kalitesini, hastalığa özgü St.George Solunum Anketi ile gösterildiği üzere, anlamlı düzeyde iyileştirir. Bu iyileşme, bütün tedavi dönemi süresince kalıcıdır. Tiotropium, KOAH alevlenmelerine bağlı hospitalizasyonların sayısını anlamlı düzeyde azaltır ve ilk hospitalizasyona kadar geçen süreyi geciktirir. Siklesonid Siklesonid'in vücuttaki glukokortikoid reseptörlerine bağlanma afinitesi düşüktür. Ağızdan inhalasyon yoluyla uygulanan siklesonid akciğer dokusuna ulaştıktan sonra enzim aracılığı ile esas metaboliti olan C21-des-metilpropionil-siklesonid'e (M1) dönüşür. Siklesonid'in aktif metaboliti olan C21-des-metilpropionil-siklesonid güçlü lokal antienflamatuar etkinliğe sahiptir. Klinik etkinlik Yapılan klinik çalışmalarda siklesonid'in, yetişkinlerde 640 mikrogram dozlarda maksimal etkilerin gözlendiği aşırı duyarlı hastalardaki adenozin monofosfat ve metakoline bağlı hava yolu duyarlılığını azalttığı gösterilmiştir. Farklı bir çalışmada ise 7 gün süreyle siklesonid uygulanıp ardından inhale alerjen verilen grubun erken ve geç dönem hava yolu reaksiyonlarında anlamlı azalma sağlandığı saptanmıştır. İnhale siklesonid tedavisinin hastaların akciğer sekresyonlarındaki enflamatuar hücre (total eozinofil) ve enflamatuar mediatör artışını azalttığı da gösterilmiştir. 26 erişkin astımlı hastada yapılan kontrollü çalışmada 7 gün süreyle siklesonid tedavisinden sonraki plazma kortizol EAA (konsantrasyon-zaman eğrisi altındaki alan) değerlerinin 24 saatlik takipleri yapılmıştır. Plasebo ile kıyaslamalı olan bu çalışmada siklesonid'in 320, 640 ve 1280 mikrogram/gün gibi muhtelif dozları plazma kortizol düzeyinin 24 saatlik ortalamalarında istatistiksel açıdan anlamlı düşüşe sebep olmadığı gibi, doza bağımlı bir etki de gözlenmemiştir. 164 adet erişkin erkek ve kadın astımlı hastanın katıldığı bir klinik çalışmada siklesonid 12 hafta süreyle 320 ya da 640 mikrogram/gün dozunda uygulanmıştır. 12. haftanın sonunda hastalara 1 ya da 250 mikrogram kosintropin uygulanmış ve plasebo kullanan gruba kıyasla plazma kortizol düzeylerinde anlamlı değişiklik gözlenmemiştir. Erişkin, ergen ve çocuklarda, 12 hafta süren, çift kör ve plasebo kontrollü birçok çalışmada siklesonid ile tedavinin hastaların akciğer fonksiyonlarında sağladığı düzelme ölçülen FEV1 ve doruk ekspiryum akım hızı değerleri ile gösterilmiş olup astım semptomlarının kontrolündeki gelişmenin yanı sıra hastaların inhale beta-2 agonist ihtiyacında azalma sağlanmıştır. Daha önce günde 500-1000 mikrogram flutikazon propiyonat veya eşdeğeri verilen 680 şiddetli, 12 yaş ve üzeri astım hastası ile yapılan 12 haftalık bir çalışmada, 160 veya 640 mikrogram siklesonid tedavisi sırasında hastaların sırasıyla %87,3 ve %93,3'ünde alevlenme görülmemiştir. 12 haftalık çalışmanın sonuçları, ilk günden sonra, 160 mikrogram/gün ve 640 mikrogram/gün siklesonid doz uygulamaları arasında alevlenme açısından istatistiksel olarak belirgin bir fark göstermiştir: 160 mikrogram/gün verilen 339 hastanın 43'ünde (%12,7) ve 640 mikrogram/gün verilen 341 hastanın 23'ünde (%6,7) alevlenme görülmüştür (Risk oranı: 0,523; p:0,0134). Her iki doz, 12 hafta boyunca FEV1 değerleri ile karşılaştırılmıştır. 160 veya 640 mikrogram/gün siklesonid ile tedavi edilen hastaların sırasıyla %3,8 ve %5'inde tedaviye bağlı istenmeyen etki gözlenmiştir. Şiddetli astım hastalarında yapılan 160, 320 ve 640 mikrogram/gün dozlarının karşılaştırıldığı bir çalışma yoktur. 12 hafta süreyle yapılan bir pediyatrik çalışmada, 160 mikrogram siklesonid/gün uygulamasının, 80 mikrogram siklesonid/gün doz uygulamasına kıyasla anlamlı olarak daha az alevlenme görülmüştür. Büyüme üzerine etki, 12 hafta süreyle 5-9 yaş arası 609 çocuk üzerinde, plasebo kontrollü, çift kör, çok merkezli, randomize paralel gruplu bir çalışmayla araştırılmıştır. Çift kör tedavi sırasında gözlemlenen ortalama büyüme hızı, plasebo grubunda 5.76 cm/yaş, 40 mikrogram siklesonid grubunda 5.75 cm/yaş, 160 mikrogram siklesonid grubunda 5.60 cm/yaş oranındaydı. Büyüme hızı bakımından, günde 40 mikrogram siklesonid ve 160 mikrogram siklesonid plasebo grubuna kıyasla non-inferior değildir. Ayrıca, 292 hastada, HPA eksen fonksiyonuyla 24 saatlik idrarda serbest kortikozol ölçümlerinde, siklesonid ile plasebo arasında anlamlı fark gözlemlenmemiştir. 5.2. Farmakokinetik özellikler Genel özelliklerTiotropiumTiotropium, kiralite göstermeyen bir kuvaterner amonyum bileşiğidir ve suda kısmen çözünür. Tiotropium, kuru toz inhalasyonu şeklinde uygulanır. İnhalasyon yolu ile uygulamada genel olarak, verilen dozun büyük çoğunluğu gastrointestinal kanalda, daha az bir kısmı ise, hedef organ olan akciğerde tutulur. Siklesonid Farmakokinetik karakterizasyon çoğunlukla M1 üzerinden yapılmıştır. Emilim: Tiotropium Kuru toz inhalasyonundan sonra elde edilen %19.5 düzeyindeki mutlak biyoyararlanım değeri, akciğere ulaşan bölümün yüksek ölçüde biyoyararlanılabilir olduğunu düşündürmektedir. Bileşiğin kimyasal yapısından (kuvaterner amonyum bileşiği), tiotropiumun gastrointestinal kanaldan iyi absorbe edilmemesi beklenir. Oral tiotropium solüsyonları, %2-3 düzeyinde bir mutlak biyoyararlanıma sahiptirler. Maksimum plazma tiotropium konsantrasyonları, inhalasyondan beş dakika sonra gözlenir. Besinler tiotropiumun emilimini etkilememektedir. Siklesonid Radyoizotop ile işaretlenmiş siklesonid kullanarak yapılan oral ve intravenöz uygulamalarda oral emiliminin az olduğu (%24.5) gösterilmiştir. Siklesonid ve aktif metabolitinin oral biyoyararlanımları ihmal edilebilir düzeydedir (siklesonid <%0.5; metabolit <%1). y-sintigrafi yöntemi ile yapılan bir ölçüm ile sağlıklı gönüllülerin akciğer dokusundaki birikiminin, alınan dozun %52'si oranında olduğu gösterilmiştir. Siklesonid'in ölçülü doz inhalasyon uygulaması sonrasında aktif metabolitin sistemik biyoyararlanımı %50'nin üzerindedir. Aktif metabolitin oral biyoyararlanımının %1'in altında olması nedeniyle inhale edilen siklesonid'in ağızdan yutulan kısmının sistemik emilime herhangi bir katkısı yoktur. Dağılım:Tiotropium İlaç plazma proteinlerine %72 oranında bağlanır ve 32 L/kg'lık bir dağılım hacmi gösterir. Kararlı durumda, kronik obstrüktif akciğer hastalarında 18 mikrogram dozunda kuru toz inhalasyonundan 5 dakika sonra ölçülen tiotropium doruk plazma düzeyleri 17-19 pg/mL'dir ve çok kompartmanlı bir model içinde, hızla azalma gösterir. Kararlı durumda plazma konsantrasyonları, 3-4 pg/mL'dir. Akciğerdeki lokal konsantrasyonlar bilinmemektedir, ancak uygulama şekli, akciğerlerde önemli oranda daha yüksek konsantrasyonların varlığını düşündürmektedir. Çalışmalar, tiotropiumun kan beyin bariyerini herhangi önemli bir düzeyde geçmediğini göstermektedir. Siklesonid Sağlıklı gönüllülere intravenöz yoldan uygulanan siklesonid'in başlangıç dağılım aşamasının hızlı olduğu saptanmıştır; bu durum, ilacın yüksek lipofilik özelliğiyle de uyumludur. Dağılım hacminin ortalama değeri 2.9 L/kg'dır. Siklesonid'in total serum klerensi ilacın hepatik ekstraksiyonunun yüksek olduğuna işaret etmektedir (ortalama 2.0 L/sa/kg). Siklesonid ve aktif metaboliti neredeyse tamamen plazma proteinlerine bağlanmaktadır (%98-99). Biyotransformasyon:Tiotropium Biyotransformasyona uğrama derecesi küçüktür. Tek doz intravenöz uygulamadan sonra, değişmemiş madde %74 oranında idrarla atılır. Ester yapısında olan tiotropium, enzimatik olmayan bir yol ile, bir alkol olan N-metilskopin ve ditiyenilglikolik aside parçalanır; bu maddelerin her ikisi de muskarinik reseptörlere bağlanmazlar. İntravenöz uygulama sonrasında dozun % 20'sinden azı, CYP450, 2D6 ve 3A4 tarafından, çeşitli Faz II metabolitlerine metabolize edilir. Karaciğer mikrozomlarındaki in vitro çalışmalar enzimatik yolun CYP 2D6 (ve 3A4) inhibitörleri, kinidin, ketokonazol ve gestoden tarafından etkilenebileceğini ortaya koymaktadır. Böylelikle, CYP 2D6 ve 3A4 dozunun daha az bir kısmının eliminasyonundan sorumlu metabolik yolda yer almaktadır. Tiotropium bromür insan karaciğer mikrozomlarında terapötik konsantrasyonların üstünde bile CYP 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 veya 3A'yı inhibe etmemektedir. Siklesonid Siklesonid, akciğer dokusunda esteraz enzimleri aracılığıyla hidrolize edilerek biyolojik aktif metabolitine dönüştürülür. İnsan karaciğer mikrozomlarında uğradığı daha ileri metabolizma aşamaları enzimolojik olarak incelendiğinde, bu bileşiğin de daha sonra CYP3A4 tarafından katalizlenen inaktif hidroksillenmiş metabolitlere dönüştüğü saptanmıştır. Akciğerde ayrıca aktif metabolite ait reversibl lipofilik yağ asidi ester bileşiklerinin varlığı da saptanmıştır. Eliminasyon:Tiotropium İnhalasyon sonrasında tiotropiumun terminal eliminasyon yarı-ömrü 5 ve 6 gün arasındadır. İntravenöz uygulanan tiotropium, idrar yoluyla esas olarak değişmemiş halde atılır (% 74). Kuru toz inhalasyonundan sonra üriner ekskresyon dozun % 14'üdür, geri kalanı büyük oranda barsaklarda emilmemiş ilaç halinde bulunur ve feçes ile elimine edilir. KOAH'lı kişiler tarafından, günde bir kez kronik inhalasyondan sonra, farmakokinetik kararlı duruma 2-3 hafta içerisinde ulaşılır ve daha sonrasında herhangi bir birikim görülmez. Siklesonid Oral ve intravenöz uygulama sonrasında siklesonid'in vücuttan esasen dışkı ile (%67) atıldığı ve atılımdaki esas yolun safra sistemi olduğu gösterilmiştir. Doğrusallık/doğrusal olmayan durum:Tiotropium Tiotropium intravenöz ve kuru toz inhalasyonu olarak verildiğinde terapötik doz aralığında doğrusal farmakokinetik göstermektedir. Siklesonid Farmakokinetiği lineerdir. Önerilen tedavi dozlarında; sistemik maruziyeti dozla orantılı artış gösterir. Hastalardaki karakteristik özelliklerGeriyatrik hastalar:Tiotropium Başlıca renal yolla atılan tüm ilaçlarda beklenildiği gibi artan yaş, böbrek fonksiyonlarında azalma ile açıklanabilen, tiotropium bromür renal klerensinde (58 yaşından küçük KOAH'lı hastalarda 326 mL/dak, 70 yaşından büyük KOAH'lı hastalarda 163 mL/dak) azalma ile ilişkili olmuştur. İnhalasyondan sonra idrarda tiotropium bromür atılımı %14 (genç sağlıklı gönüllü bireyler)-yaklaşık %7 (KOAH'lı hastalar) oranında azalmıştır. Bununla birlikte plazma konsantrasyonları bireylere ait ve bireyler arası değişkenlikle karşılaştırıldığında KOAH'lı hastalarda ilerleyen yaşla birlikte anlamlı oranda değişmemiştir (kuru toz inhalasyonundan sonra EAA0-4sa değerinde %43 oranında artış). Siklesonid Geniş çaplı toplumsal çalışmalarda saptanan farmakokinetik özelliklerinden yola çıkılarak aktif metabolitin sistemik maruziyetinde yaş faktörünün etkisi bulunmadığı ortaya konmuştur. Böbrek yetmezliği:Tiotropium Başlıca renal yoldan atılıma uğrayan diğer ilaçlarda olduğu gibi, böbrek yetmezliği hem intravenöz infüzyon hem de kuru toz inhalasyonundan sonra artan ilaç plazma konsantrasyonları ve azalan renal ilaç klerens ile ilişkili olmuştur. Yaşlı hastalarda sık karşılaşılan bir durum olan hafif şiddette böbrek yetmezliğinde (CL/CR 50-80 ml/dak) tiotropium bromür plazma konsantrasyonlarında hafif bir artış meydana gelmiştir (intravenöz infüzyon sonrasında EAA0.4sa'da %39 oranında artış). Orta-şiddetli böbrek yetmezliği durumunda (CL/CR <50 ml/dak), intravenöz tiotropium bromür uygulaması plazma konsantrasyonlarının iki katına çıkması ile sonuçlanmıştır (EAA0-4sa değerinde %82 oranında artış) (kuru toz inhalasyonundan sonra ki plazma konsantrasyonları ile doğrulanmıştır). Siklesonid Aktif metabolitin böbrek yoluyla atılımı söz konusu olmadığından, böbrek yetmezlikli hastalar ile çalışma yapılmamıştır. Karaciğer yetmezliği:Tiotropium Karaciğer yetmezliğinin tiotropium bromür farmakokinetiği üzerinde klinik olarak anlamlı etkiye sahip olacağı beklenmemektedir. Tiotropium bromür başlıca renal eliminasyon yoluyla (genç sağlıklı gönüllülerde %74 oranında) ve basit enzimatik olmayan ester ayrışması ile farmakolojik olarak inaktif bileşenlerine parçalanmaktadır. Siklesonid Karaciğer fonksiyonundaki azalma kortikosteroidlerin vücuttan atılımını etkileyebilir. Sirotik hastaların da katılmış olduğu bir çalışmada aktif metabolitin sistemik maruziyetinde artış gözlenmiştir. Diğer:Astımlı hastalar: Siklesonid'in hafif-orta düzeyde astım hastalarındaki farmakokinetiği sağlıklı gönüllülerde saptanmış olan değerlerden farklı değildir. 5.3. Klinik öncesi güvenlilik verileriTiotropiumGüvenlik farmakolojisi, tekrarlı doz toksisitesi ve üreme toksisitesi gibi klasik çalışmalarda gözlenen birçok etki tiotropium bromürün antikolinerjik etkileri ile açıklanabilir. Hayvanlarda tipik olarak azalmış besin tüketimi, kilo alımı engellenmesi, ağız kuruluğu, azalmış lakrimal ve salivasyon, göz bebeğinin anormal büyümesi, artmış kalp atış hızı gözlenmiştir. Tekrarlı doz toksisite çalışmalarından bildirilen diğer ilişkili advers etkiler: sıçanlarda ve farelerde rinit, nazal boşluğun ve larinksin epitel değişmeleri ile beliren solunum yolunun hafif şiddette tahriş olması ve sıçanlarda mesanede taş oluşumu ve proteinimsi birikintiler ile birlikte prostat. Hamilelik, embriyonel/fetusa ilişkin gelişim, doğum veya doğum sonrası gelişim ile ilgili zararlı etkiler sadece maternal olarak toksik doz seviyelerinde gösterilebilmiştir. Tiotropium bromür sıçanlarda ve tavşanlarda teratojenik bulunmamıştır. Solunumsal (tahriş), ürogenital (prostat) değişiklikler ve üreme toksisitesi lokal veya sistemik maruziyet, terapötik maruziyetin 5 katından fazla olduğu zaman gözlenmiştir. Genotoksisite ve karsinojenik potansiyel insanlar için özel bir tehlike ortaya çıkarmamıştır. Siklesonid Güvenilirlik farmakolojisi, kronik toksisite, genotoksisite ile karsinojenik potansiyel gibi geleneksel çalışmalardan elde edilen preklinik veriler, siklesonid kullanımının insan için hiçbir özel tehlikesi olmadığını ortaya çıkartmıştır. Üreme toksisitesi için yapılan hayvan çalışmalarında glukokortikosteroidlerin yarık damak, iskelet malformasyonları gibi etkilerine rastlanmıştır. Ancak, bu sonuçların insanlara önerilen dozlarda oluşabilmesi mümkün görünmemektedir. Köpekler ile yapılan 12 ay süren iki çalışmada, en yüksek dozların yumurtalıklar üzerinde tedaviye bağlı etkiler (atropi) oluşturduğu gözlenmiştir. Bu etkiler, 160 mikrogramlık günlük dozun 5,27-8,34 katının sistemik maruziyeti sonucu meydana gelmiştir. Bu bulguların insanlar ile ilişkisi bilinmemektedir. Diğer glukokortikoid türevleri ile yapılan hayvan çalışmalarında gebelik sırasında ve farmakolojik dozlardaki kullanımlarında glukokortikoidlerin intrauterin büyüme geriliği, erişkinlikte karşılaşılan kalp-damar ve/veya metabolik hastalık ile glukokortikoid reseptör yoğunluğunda değişim, nörotransmiter üretimi ve davranış bozukluğu gibi riskleri artırabildiği gösterilmiştir. Bu verilerin insanlara inhalasyon yoluyla uygulanan siklesonid ile ilintisi hakkında bilgi mevcut değildir. 6. FARMASÖTİK ÖZELLİKLERİ6.1. Yardımcı maddelerin listesiLaktoz6.2. GeçimsizliklerBilinen geçimsizliği yoktur.6.3. Raf ömrü24 ay6.4. Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında ve kuru yerde saklayınız.6.5. Ambalajın niteliği ve içeriğiDUESONİT 18/400 mcg, inhalasyon için toz içeren 60 ve ya 120 kapsül PVC/PVDC/Alü blister ambalajlarda inhalasyon cihazı ve kullanma talimatı ile birlikte karton kutuda sunulmaktadır.6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller 'Tıbbi Atıkların Kontrolü Yönetmeliği' ve 'Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikleri'ne uygun olarak imha edilmelidir.7. RUHSAT SAHİBIMentis İlaç San. Tic. Ltd. Şti.Florya Asfaltı Florya İş Merkezi No:88 B Blok No:6 Bakırköy/İSTANBUL Tel: 0 212 481 79 52 Fax: 0 212 481 79 52 e-mail: [email protected]8. RUHSAT NUMARASI (LARI)241/979. İLK RUHSAT TARIHI/RUHSAT YENILEME TARIHIİlk ruhsat tarihi: 26.04.2012 Ruhsat yenileme tarihi:10. KÜB'ÜN YENİLENME TARIHI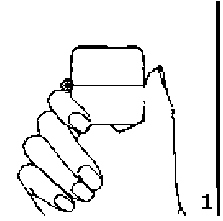 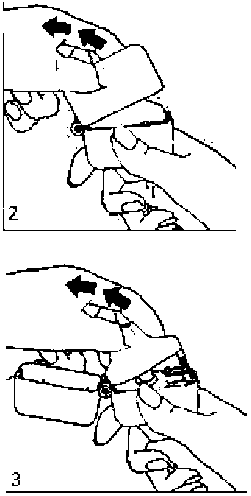 1., 2. ve 3. Toz başlığını yukarı doğru çekerek açınız. Daha sonra ağızlık parçasını açınız.
1., 2. ve 3. Toz başlığını yukarı doğru çekerek açınız. Daha sonra ağızlık parçasını açınız.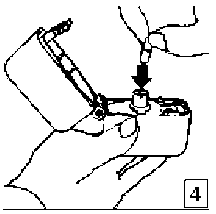 4. Blister ambalajından bir DUESONİT inhalasyon için toz içeren kapsülü çıkarınız (kullanımdan hemen önce çıkarınız) ve şekilde gösterildiği gibi merkezi hazneye yerleştiriniz. Kapsülün hazneye hangi yönde yerleştirildiği önemli değildir.
4. Blister ambalajından bir DUESONİT inhalasyon için toz içeren kapsülü çıkarınız (kullanımdan hemen önce çıkarınız) ve şekilde gösterildiği gibi merkezi hazneye yerleştiriniz. Kapsülün hazneye hangi yönde yerleştirildiği önemli değildir.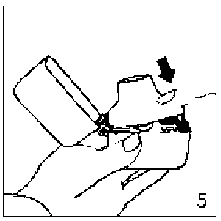 5. Ağızlık parçasını bir klik sesi duyuncaya değin
5. Ağızlık parçasını bir klik sesi duyuncaya değin sıkıcakapatınız. Toz başlığını açık bırakınız.  6. ve 7. İnhalasyon cihazını ağızlık parçası yukarıda olacak şekilde tutunuz ve kapağı bastırarak kapatınız.
6. ve 7. İnhalasyon cihazını ağızlık parçası yukarıda olacak şekilde tutunuz ve kapağı bastırarak kapatınız.Böylece kapsülde delikler açılacak ve nefes aldığınızda ilacın salıverilmesini sağlayacaktır.  8. Nefesinizi tam olarak veriniz.
8. Nefesinizi tam olarak veriniz.Önemli: Hiçbir zaman ağızlık parçasına doğru nefes vermeyiniz.  9. İnhalasyon cihazının ağzını açıp, cihazı ağzınıza kadar kaldırınız ve dudaklarınızı ağızlık parçasının çevresinde sıkıca kapayınız. Başınızı dik bir şekilde tutarak, yavaş ve derin bir nefes alınız; nefes alma hızınızı, kapsülün titreştiğini algılayacak şekilde ayarlayınız. Akciğerleriniz doluncaya kadar nefes alınız; nefesinizi sizi zorlamayacak bir süreyle tutunuz ve bu esnada inhalasyon cihazını ağzınızdan çıkarınız. Şimdi normal nefes alıp vermeye başlayabilirsiniz.
9. İnhalasyon cihazının ağzını açıp, cihazı ağzınıza kadar kaldırınız ve dudaklarınızı ağızlık parçasının çevresinde sıkıca kapayınız. Başınızı dik bir şekilde tutarak, yavaş ve derin bir nefes alınız; nefes alma hızınızı, kapsülün titreştiğini algılayacak şekilde ayarlayınız. Akciğerleriniz doluncaya kadar nefes alınız; nefesinizi sizi zorlamayacak bir süreyle tutunuz ve bu esnada inhalasyon cihazını ağzınızdan çıkarınız. Şimdi normal nefes alıp vermeye başlayabilirsiniz.Basamak 8 ve 9'u bir kez daha tekrarlayınız, bu kapsülün tamamen boşalmasını sağlayacaktır.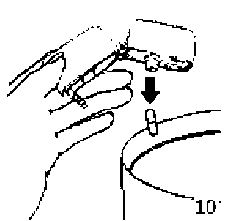 10. Ağızlık parçasını yeniden açınız. Cihazı çevirerek kullanılmış kapsülü çıkarınız ve atınız. Sonrasında ağzınızı su ile çalkalayınız. Ağızlık parçasını ve toz başlığını kapatınız ve inhalasyon cihazınızı yerine kaldırınız.
10. Ağızlık parçasını yeniden açınız. Cihazı çevirerek kullanılmış kapsülü çıkarınız ve atınız. Sonrasında ağzınızı su ile çalkalayınız. Ağızlık parçasını ve toz başlığını kapatınız ve inhalasyon cihazınızı yerine kaldırınız.İnhalasyon cihazının temizleme işlemiİnhalasyon cihazını ayda bir kez yıkayınız. Kapağı ve ağızlığı açınız. Cihazı sıcak su ile yıkayarak içerisindeki tozlardan arındırınız. Cihaz içerisindeki suyu boşaltarak kağıt bez üzerine kapak, ağızlık ve gövde kısımları açık kalacak şekilde kurumaya bırakınız. 24 saat kurumaya bırakılan cihaz kullanılmaya hazırdır. Eğer ihtiyaç varsa ağızlık kısmının dış yüzeyi ıslak olmayan nemli bir bezle silinebilir. |
İlaç BilgileriDuesonit 18/400 mcg İnhalasyon İçin Toz İçeren KapsülEtken Maddesi: Tiotropium bromür anhidrus, Siklesonid Atc Kodu: R03BB04 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.