Sonicad 200 mcg İnhalasyon İçin Toz İçeren Kapsül Kısa Ürün BilgisiSolunum Sistemi » Solunum Sisteminde Tıkanma - Astım İlaçları » Diğer İnhalanlar (solukla içeri çekilen ilaçlar) » Glükokortikoidler » Siklesonid KISA URUN BILGISI 1. BEŞERI TIBBI ÜRÜNÜN ADISONİCAD 200 mcg inhalasyon için toz içeren kapsül2. KALITATIF VE KANTİTATIF BILEŞIMEtkin madde:Siklesonid 200 mcgYardımcı madde(ler):Laktoz 12,8000 mgYardımcı maddeler için 6.1'e bakınız.3. FARMASÖTIK FORMİnhalasyon için toz içeren kapsülFlesh opak, natural transparan renk kapsül içinde beyaz toz4. KLİNIK ÖZELLIKLER4.1. Terapötik endikasyonlarAstımın tüm basamaklarında antienflamatuar, bronkodilatör, semptom kontrolü ve oral steroid ihtiyacını azaltmak amaçlı kullanılır.KOAH'ta tek başına kullanılması önerilmez.4.2. Pozoloji ve uygulama şekli Pozoloji:12 yaş ve üzeri yetişkinler:SONİCAD'in önerilen başlangıç dozu günde 1 kez uygulanan 200 mikrogramdır. Bununla birlikte astım belirtilerinin şiddetlendiği hastalarda SONİCAD dozunun arttırılması gerekebilir. Günde iki kez 400 mikrogram verilmek üzere, 800 mikrogram/gün'e kadar yükseltilebilir. Ancak yüksek dozların 3 aydan daha uzun süre kullanımını doğrulayan veri yoktur. Bazı hastalar için etkin idame dozu olarak günde 1 kez 100 mikrogram da tercih edilebilir.6 -11 yaş arası çocuklar:SONİCAD'in önerilen başlangıç dozu, astım şiddetine bağlı olarak günde 100-200 mikrogramdır. Astım kontrolünün sağlandığı en düşük doz ile idame edilmelidir. Tam doz kişisel yanıta göre belirlenmelidir.Uygulama sıklığı ve süresi:Günde bir kez sabah veya akşam kullanılır. Hastaların SONİCAD'i günün hangi saatinde (akşam ya da sabah) kullanacakları konusundaki son karar hekim tarafından belirlenmelidir. Hastalık semptomları SONİCAD ile tedaviye başlandıktan sonraki ilk 24 saat içinde düzelmeye başlar. Astım kontrol altına alındıktan sonra SONİCAD'in dozu hastanın bireysel durumuna göre şekillendirilir ve hastalığın iyi bir şekilde kontrol edilebileceği minimum idame dozu tercih edilir.Astım yakınmaları şiddetli olan hastalarda akut atak riski mevcut olup bu hastaların akciğer fonksiyon testleri de dahil olmak üzere muayenelerini düzenli şekilde sürdürmeleri gerekir. Astım semptomlarını gidermeye yönelik kısa etkili bronkodilatör kullanımının artışı hastalığın kontrolünde bozulma olduğuna işaret eder. Kısa etkili bronkodilatör kullanımının hastaya sağladığı rahatlama azalmış ise ya da eskisinden daha fazla sayıda inhalasyona ihtiyacı söz konusu olmaya başladıysa hekime başvurulması zorunludur.Bu durumda hastanın antiinflamatuar tedavinin artırılması yönündeki ihtiyacı göz önünde bulundurularak tekrar değerlendirilmesi gerekir (örn. SONİCAD dozunun artırılması ya da oral kortikosteroid tedavisine geçilmesi). Ciddi astım alevlenmeleri olağan şekilde tedavi edilmelidir.Uygulama şekli:SONİCAD inhaler kapsül; ağız yoluyla inhalasyon şeklinde kullanılır.İnhalasyon cihazı yoluyla nefes alındığında ilaç akciğerlere ulaşır. Bu nedenle, cihazın ağız parçası aracılığıyla derin ve güçlü nefes alınması önemlidir.İnhalasyon cihazının kullanımı doktor veya eczacı tarafından hastaya gösterilmelidir. Kapsüllerin kesinlikle ağız içine alınarak yutulmaması ve kesinlikle inhaler içine yerleştirildikten sonra soluk alma yoluyla kullanılması gerektiği konusunda hasta bilgilendirilmelidir.Jelatin kapsülün parçalanabileceği ve inhalasyondan sonra ağız veya boğaza küçük jelatin parçacıklarının ulaşabileceği hastaya anlatılmalıdır. Bu olasılık kapsülün birden fazla delinmemesi ile en aza indirilir.Kapsüller blister ambalajdan ancak kullanım öncesi çıkarılmalıdır.İnhalasyon cihazı kullanma talimatı için bakınız ekli talimat.Özel popülasyonlara ilişkin ek bilgiler: Böbrek/Karaciğer yetmezliği:Karaciğer yetmezliği olan hastalarda doz ayarlaması gerekmez. Ancak, ağır karaciğer yetmezliği ve böbrek yetmezliğinde ilaç dozuna ilişkin yeterli veri bulunmamaktadır.Pediyatrik popülasyon:SONİCAD'in 6 yaş altındaki çocukların tedavisinde kullanımına ilişkin veriler yeterli olmadığından bu yaş grubuna önerilmez.Geriyatrik popülasyon:Yaşlı hastalarda doz ayarlaması gerekmez.4.3. KontrendikasyonlarSONİCAD, siklesonid'e ve içeriğindeki bileşenlerden herhangi birine karşı aşırı duyarlılığı olduğu bilinen kişilerde kontrendikedir.Diğer tüm inhale kortikosteroidler gibi, SONİCAD de, aktif veya semptomsuz akciğer tüberkülozu olan ya da fungal, virütik veya bakteriyel enfeksiyonu bulunan hastalarda kontrendikedir.4.4. Özel kullanım uyarıları ve önlemleriLokal etkiler:Yapılan klinik çalışmalarda, inhale siklesonid ile tedavi edilen 3038 hastanın 32'sinde ağızda ve farinkste lokalizeCandida alhicansenfeksiyonu oluşumu gözlenmiştir. Bildirilen 32 olgudan 20'sinde hastalar, siklesonidin günlük 320 mcg'lik dozu ya da daha yüksek bir dozu ile tedavi edilmiştir (günlük 320 mcg ya da daha yüksek siklesonid dozuyla tedavi edilen hasta sayısı 1394).Gözlenen candida enfeksiyonlarının birçoğu hafif ve orta şiddetlidir. İnhale siklesonid tedavisi devam ederken enfeksiyon oluşumu gözlenirse, hastalara uygun lokal ya da sistemik tedavi (örn; oral antifungal ile tedavi) uygulanmalıdır, ancak bazen inhale siklesonid tedavisinin durdurulması gerekebilir. Hastalar siklesonid inhalasyonunun ardından ağızlarını durulamalıdırlar.Akut astım semptomları:SONİCAD bronkodilatör değildir ve bronkospazmda hızlı bir rahatlama sağlamada ya da astımın diğer akut semptomlarının iyileştirilmesinde endike değildir. Eğer inhale siklesonid tedavisi sırasında hastaların astım semptomları kendi normal bronkodilatör dozlarına yanıt vermezse, hastalar doktorlarıyla iletişime geçmeleri konusunda bilgilendirilmelidir. Bu gibi semptomlar meydana geldiği zaman, hastaların oral kortikosteroidler ile tedavi edilmesi gerekebilir.Astım kontrolünün izlenmesi:Şiddetli astımı olan hastaların akut atak riski vardır ve akciğer fonksiyon testlerini içeren astım kontrolleri düzenli olarak yapılmalıdır. Astım semptomlarının rahatlaması için kısa etkili bronkodilatörlerin kullanımının artışı, astım kontrolünün kötüleştiğine işaret etmektedir. Eğer hastalar kısa etkili rahatlatıcı bronkodilatörlerin sağladığı etkinin azaldığını hissediyor ya da her zaman kullandıklarından daha fazla inhalasyona gereksinim duyuyorlarsa tıbbi müdahaleye başvurulmalıdır. Bu durumda hastalar yeniden değerlendirilmeli ve antiinflamatuar tedavinin arttırılması (ya daha yüksek dozda inhale siklesonid kullanılması ya da oral kortikosteroid tedavisine başlanılması) düşünülmelidir. Şiddetli astım alevlenmeleri standart medikal uygulamaya göre tedavi edilmelidir.Endokrin ve metabolizma:Hipotiroidizm: Hipotiroidizmi olan hastalarda kortikosteroidlerin etkisinde artış gözlenir. Hematolojik durumlar:Eozinofilik durumlar: Nadir durumlarda inhale kortikosteroid tedavisi alan hastalar bazen Churg-Strauss sendromu (genellikle sistemik kortikosteroid tedavisiyle tedavi edilen bir durum) ile uyumlu klinik vaskülit bulgularıyla kendini gösteren sistemik eozinofili tablosuyla başvurabilirler. Bu olaylar her zaman olmamakla birlikte genellikle oral kortikosteroid tedavisinin azaltımı ve/veya durdurulması ve ardından inhale kortikosteroidlerin uygulanması ile ilişkilendirilmiştir ve bu klinik durumda, ciddi eozinofilik tabloya sahip olgular bildirilmiştir.Hekimler, hastalarındaki eozinofili, vaskülitik döküntü, kötüleşen akciğer semptomları, kardiyak komplikasyonlar ve/veya nöropatiye karşı dikkatli olmalıdır. Bu altta yatan olaylar ile siklesonid arasında nedensel bir ilişki kurulamamıştır.Hipoprotrombinemi: Hipoprotrombinemisi olan hastalarda, kortikosteroidler ile birlikte asetilsalisilik asit dikkatli bir şekilde kullanılmalıdır.Hepatik/Bliyer/Pankreatik durumlar:Siroz: Sirozu olan hastalarda kortikosteroidlerin etkisinde artış gözlenir.Bağışıklık sisteminin baskılanması:Bağışıklık sistemini baskılayan ilaçlar kullanan kişiler enfeksiyonlara, sağlıklı kişilerden daha duyarlıdırlar. Örneğin suçiçeği ve kızamık gibi enfeksiyonlar, kortikosteroid kullanan duyarlı çocuklar ya da erişkinlerde çok ciddi boyutlarda gözlenebilir, hatta ölümcül olabilir. Bu hastalıklara sahip olmayan ya da bağışıklığı çok iyi olmayan çocuklar ve erişkinler, maruziyetten kaçınmak için özellikle dikkat etmelidirler. Uygulanan kortikosteroid dozunun, yolunun ve süresinin yaygın enfeksiyon oluşma riskini nasıl etkilediği bilinmemektedir. Altta yatan hastalığın ve/veya önceki kortikosteroid tedavisinin riske katkısı bilinmemektedir. Eğer suçiçeği ile maruziyet meydana gelirse,Varicella zosterimmün globulini (VZIG) ile profilaksi endike olabilir. Eğer kızamık ile maruziyet meydana gelirse, intramusküler immünoglobulin (IG) ile profilaksi endike olabilir. Eğer hastada suçiçeği oluşumu gözlenirse, antiviral ajanlar ile tedavi göz önünde bulundurulabilir.Aktif veya semptomsuz akciğer tüberkülozu olan; fungal, bakteriyel, viral ya da parazitik enfeksiyonu bulunan; ya da okülerHerpes simplex'iolan hastalarda inhale kortikosteroidler dikkatli kullanılmalıdır.Kortikosteroidler, enfeksiyonların bazı belirtilerini maskeleyebilir ve hastalarda yeni enfeksiyonların oluşumu gözlenebilir. Kortikosteroid tedavisi sırasında lokalize enfeksiyonlara karşı azalmış direnç gözlenir. Bu durum, uygun tedavinin uygulanmasını ya da enfeksiyon eradike edilene kadar siklesonid uygulamasının durdurulmasını gerektirebilir.Sistemik kortikosteroid kullanan hastalarda inhale siklesonid tedavisine geçiş:Sistemik kortikosteroid kullanan hastalarda inhale siklesonid tedavisine geçilirken özel bir dikkat gerekir, çünkü sistemik kortikosteroidlerden daha az sistemik etkisi olan inhale kortikosteroidlerin kullanımına geçiş sırasında ve sonrasında, astımlı hastalarda adrenal yetersizliğe bağlı olarak ölümler meydana gelmiştir. Oral kortikosteroidler ile tedavi edilen hastalarda inhale siklesonid tedavisine geçilirken öncelikle inhale siklesonid tedavisi, devam etmekte olan steroid tedavisine eklenmeli ve sonrasında steroid tedavisi kademeli olarak sonlandırılmalıdır. Adrenokortikal supresyonu olan hastalar düzenli olarak izlenmeli ve oral steroid dikkatli bir şekilde azaltılmalıdır. Diğer inhale steroidlerden ya da oral steroidlerden inhale siklesonid tedavisine geçen bazı hastalarda, inhale siklesonid tedavisine geçilmesinin ardından uzun bir süre boyunca bozulmuş adrenal rezerv riski bulunur.Sistemik kortikosteroidlerin kullanımının bırakılmasının ardından hipotalamus-hipofiz-adrenal (HPA) fonksiyonun iyileşmesi için birkaç ay gereklidir. Daha önceden günlük 20 mg ya da daha fazla prednizon (ya da eşdeğeri) ile tedavi edilmiş olan hastalar, özellikle de sistemik kortikosteroidlerin alımı neredeyse tamamen durdurulduğunda, çok daha duyarlı olabilirler. Bu HPA baskılanma süreci sırasında hastalar travmaya, cerrahi bir işleme, enfeksiyona (özellikle gastroenterit) ya da şiddetli elektrolit kaybı ile ilişkili diğer durumlara maruz kaldıklarında, hastalarda adrenal yetersizliğin belirti ve semptomları gözlenebilir. İnhale siklesonid, bu episodlar sırasında astım semptomlarının kontrolünü sağlayabilmesine rağmen, önerilen dozlarda sistemik kortikosteroidlerin normal fizyolojik miktarlarından daha azını karşılar ve bu durumların tedavisi için gerekli olan mineralokortikoid aktiviteyi sağlamaz.Sistemik kortikosteroid kullanımı durdurulmuş olan hastalar, stres ya da şiddetli astım atağı sırasında, oral kortikosteroidleri (yüksek dozlarda) hemen yeniden almaya başlamaları ve daha detaylı bilgi almak için doktorları ile iletişime geçmeleri konusunda bilgilendirilmelidir. Bu hastalar, stres ya da şiddetli astım atakları sırasında ilave sistemik steroid kullanmalarının gerekli olduğunu belgeleyen uyarı/bilgi kartlarını taşımaları gerektiği konusunda bilgilendirilmelidir. Acil durumlarda adrenal yetmezlik riskini değerlendirmek için, sabah ve akşam kortizol seviyelerinin ölçülmesini içeren rutin adrenal kortikal fonksiyon testleri tüm hastalarda periyodik olarak yapılmalıdır. Eğer sabah kortizol seviyesi ortalama normal seviyeye ya da buna yakın bir seviyeye düşerse sadece ozaman normal olarak kabul edilebilir.Oral kortikosteroid kullanımına ihtiyaç duyan hastalar, inhale siklesonid tedavisine geçişin ardından sistemik kortikosteroid kullanımını yavaş yavaş bırakmalıdır. Prednizon dozunun azaltılması, inhale kortikosteroid kullanımı sırasında haftalık olarak, günlük prednizon dozu 2,5 mg azaltılarak yapılmalıdır. Oral kortikosteroidlerin bırakılması sırasında akciğer fonksiyonu (FEV1Hastaların sistemik steroid tedavisinden inhale siklesonid tedavisine geçişi, daha önceden sistemik steroid tedavisi ile baskılanan rinit, konjunktivit, egzema, artrit ve eozinofilik durumlar gibi alerjik durumları açığa çıkarabilir. Bu alerjik durumlar, anti-histaminikler ile ve/veya topikal steroidleri içeren topikal preparasyonlar ile semptomatik olarak tedavi edilmelidir.Oral steroidlerin bırakılması sırasında, hastalarda iyileşme olmasına ya da solunum fonksiyonunda iyileşme olmasına rağmen bazı hastalarda, sistemik aktif steroid kullanımının bırakılmasıyla gözlenen eklem ve/veya kas ağrısı, bitkinlik, depresyon gibi semptomlar gözlenebilir.Hiperkortisizm ve adrenal supresyon:İnhale siklesonid, HPA fonksiyonunu terapötik olarak benzer olan prednizonun oral dozundan daha az baskılayarak astım semptomlarını kontrol etmeye yardımcı olacaktır. Kortizol üretimi üzerindeki etkilerde bireysel olarak duyarlılık meydana geldiğinden dolayı, doktorlar inhale siklesonidi reçetelerken bu bilgiyi göz önünde bulundurmalıdırlar. Hastalar özellikle ameliyat sonrasında ya da yetersiz adrenal yanıta bağlı olan stres süreci sırasında izlenirken çok dikkatli olunmalıdır. Hiperkortisizm ve adrenal supresyon gibi sistemik kortikosteroidin olası etkileri, özelliklede inhale siklesonid uzun süre önerilen dozlardan daha yüksek dozlarda uygulandığı zaman, hastaların bir kısmında gözlenebilir. Eğer bu gibi etkiler meydana gelirse, inhale siklesonidin dozu, astım tedavisinde sistemik kortikosteroidlerin kabul edilen azaltım prosedürleri ile uyumlu olarak, yavaş yavaş azaltılmalıdır.Kemik mineral yoğunluğunun azalması:Kemik mineral yoğunluğundaki azalmalar, inhale kortikosteroidleri içeren ürünlerin uzun bir süre uygulanması ile gözlenmiştir. Uzun dönem sonuçları ile bağlantılı olarak, kemik mineral yoğunluğundaki küçük değişikliklerin klinik olarak önemi bilinmemektedir. Uzun süre hareketsiz kalma, ailede osteoporoz öyküsü varlığı ya da kemik kütlesini azaltabilen ilaçların (örn; antikonvülsanlar ve oral kortikosteroidler) kronik kullanımı gibi kemik mineral içeriğinin azaltılması için majör risk faktörlerine sahip olan hastalar izlenmelidir ve belirlenen standart tedavi ile tedavi edilmelidir.Büyüme üzerine etkiler:Oral olarak inhale edilen kortikosteroidler, pediyatrik hastalarda büyüme hızında azalmaya neden olabilir. İnhale siklesonid kullanan pediyatrik hastalardaki büyüme, düzenli olarak kontrol edilmelidir (örn; stadiometre ile). İnhale siklesonidi de içeren oral olarak inhale edilen kortikosteroidlerin sistemik etkilerini en aza indirmek için doz, her bir hasta için astımı kontrol altına alabilecek etkili en düşük doza azaltılmalıdır.Glokom ve katarakt:Glokom, intraoküler basınç artışı ve katarakt, inhale siklesonidi de içeren inhale kortikosteroidlerin uygulanmasının ardından bildirilmiştir. Bu nedenle, görmesinde değişiklikler olan ya da intraoküler basınç artışı, glokom ve/veya katarakt gibi öyküsü olan hastalar yakından takip edilmelidir.1 yıllık tedavi süresini içeren bir karşılaştırmalı kontrol çalışmasında, orta şiddetli persistan astımı olan 18 yaş ve üzerindeki (ortalama yaş 43,1) 743 hasta, günde 2 kez 320 mcg inhale siklesonid ile ve 742 hasta, hasta popülasyonu için uygun olan bir karşılaştırıcı inhale kortikosteroidin işaretli dozu ile tedavi edilmiştir. Hastalara başlangıçta, 4., 8. ve 12. ayda görüş keskinliğini, intraoküler basınç ölçümünü ve yarık lamba incelemesini içeren oftalmoloji incelemeleri yapılmıştır. Lens opasiteleri Lens Opasifikasyon Sistemi III kullanılarak derecelendirilmiştir. 52 haftanın ardından SINIF I etkiler (saptanan minimum değişiklikler), inhale siklesonid ile tedavi edilen hastaların %36,1'inde ve karşılaştırıcı inhale kortikosteroid ile tedavi edilen hastaların %38,4'ünde gözlenmiştir. Çok şiddetli SINIF III etkiler, inhale siklesonid ile tedavi edilen hastaların %8,1'inde ve karşılaştırıcı inhale kortikosteroid ile tedavi edilen hastaların %9,2'sinde gözlenmiştir. SINIF III etkilerin gözlendiği hastalarda posteriör subkapsüler opasitelerin insidansı, inhale siklesonid ile tedavi edilen hastalarda %0,9 ve karşılaştırıcı inhale kortikosteroid ile tedavi edilen hastalarda ise %0,5 olarak saptanmıştır.Bronkospazm:Diğer inhale astım tedavilerinde de olduğu gibi, dozun uygulanmasının ardından hırıltıda ani bir artış ile bronkospazm meydana gelebilir. İnhale siklesonidin uygulanmasının ardından bronkospazm meydana gelirse, hemen hızlı-etkili inhale bronkodilatör ile tedavi edilmelidir. İnhale siklesonid ile tedavi sonlandırılmalıdır ve alternatif bir tedaviye başlanmalıdır.Laktoz uyarısıSONİCAD yardımcı madde olarak laktoz içermektedir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriCYP3A4,in vitroverilere göre, siklesonidin aktif metaboliti olan Ml'in insandaki metabolizmasından sorumlu en önemli enzimdir.Siklesonid ve aktif metaboliti olan Ml'in serum düzeyleri düşüktür. Ancak, CYP3A4 sisteminin güçlü inhibitörlerinin (örneğin itrakonazol, ritonavir ya da nelfinovir) eş zamanlı olarak kullanımı, siklesonid/Ml düzeylerinde artmaya neden olabilir. Klinik açıdan önemli olabilecek istenmeyen etki riski (cushing sendromu) göz ardı edilemez.4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi C.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Henüz gebe kadınlarda yapılmış yeterli ve iyi kontrol edilmiş çalışma mevcut değildir.Hayvan çalışmalarında glukokortikoidlerin malformasyonlara sebep olduğu gösterilmiştir (bkz. 5.3. Klinik öncesi güvenlilik verileri). Ancak, bu sonuçların insanlara önerilen dozlarda oluşabilmesi mümkün görünmemektedir.Diğer glukokortikoidler gibi, siklesonid'i de gebelik sırasında ancak fetüs için olan potansiyel riskinin anneye sağladığı potansiyel fayda tarafından karşılanması durumunda kullanmak gerekir. Yeterli astım kontrolünü sağlayabilen en düşük etkin siklesonid dozu kullanılmalıdır. Gebeliği sırasında kortikosteroid kullanmış olan annelerin bebekleri, hipoadrenalizm açısından dikkatle izlenmelidir.Gebelik dönemiDiğer glukokortikoidler gibi, siklesonid'i de gebelik sırasında ancak fetüs için olan potansiyel riskinin anneye sağladığı potansiyel fayda tarafından karşılanması durumunda kullanmak gerekir. Yeterli astım kontrolünü sağlayabilen en düşük etkin siklesonid dozu kullanılmalıdır.Laktasyon dönemiİnhale siklesonid'in anne sütüne geçişi hakkında bilgi mevcut değildir. Bebeğini emziren annelere siklesonid tedavisine ancak anneye sağlayacağı faydanın bebeğe getireceği olası riski aşması durumunda başlanmalıdır.Üreme yeteneği/FertiliteYeterli klinik veri yoktur.4.7. Araç ve makine kullanımı üzerindeki etkilerSiklesonid inhalasyonunun araç ve makine kullanma yeteneği üzerinde etkisi yoktur ya da ihmal edilebilecek düzeydedir.4.8. İstenmeyen etkilerSistemik ve lokal kortikosteroid kullanımı aşağıdaki istenmeyen etkilere neden olabilir:Candida alhicansenfeksiyonu, Bağışıklık sisteminin baskılanması, Hiperkortisizm ve adrenal supresyon, Büyüme üzerine etkiler, Glokom ve katarakt.Klinik çalışma verileriAşağıda belirtilen güvenilirlik verileri, erişkinler, 12 yaş ve üzerindeki adölesanlar ile yapılan beş çift-kör, plasebo kontrollü klinik çalışmadan elde edilmiştir. Bu çalışmaların sonuçları, günde iki kez 80 mcg ve 640 mcg doz aralığındaki inhale siklesonid maruziyetinin etkilerini yansıtmaktadır. Günde bir kez doz uygulaması ile yapılan çalışmaların sonuçları, güvenilirlik verilerine dahil edilmemiştir çünkü günde bir kez doz uygulaması ile yapılan çalışmalardaki dozlar, günde iki kez uygulanan, önerilen en yüksek dozdan daha düşüktür. Beş çalışmanın tedavi süresi 12 ile 16 hafta arasında değişmektedir. Bu çalışmalardan bir tanesi 1 yıla kadar uzayan güvenilirlik periyodunu içermektedir. 12 - 16 haftalık tedavi çalışmalarında, yaşları 12 yaş ve üzerinde olan 720 hastaya (298 erkek, 422 kadın) inhale siklesonid uygulanmıştır. Uzun dönem güvenilirlik çalışmasında, 12 haftalık çalışmaların birinden bu çalışmaya katılan, şiddetli persistan astımı olan 197 hasta (82 erkek, 115 kadın), günde 2 kez 320 mcg inhale siklesonid ile 1 yıl boyunca tedavi edilmek üzere yeniden randomize edilmiştir. 4 - 11 yaş arasındaki pediyatrik hastaların güvenilirlik verileri, günde 1 kez doz uygulaması yapılan çalışmalardan elde edilmiştir. Bu çalışmaların ikisi 12 haftalık çift-kör tedavi periyodunun ardından 1 yıla kadar devam eden uzun dönem, açık etiketli güvenilirlik çalışması olarak ve bir çalışma da, bir yıl boyunca devam eden açık etiketli güvenilirlik çalışması olarak tasarlanmıştır.İlaç ile yapılmış klinik çalışmalarda gözlenen advers reaksiyon oranları, diğer ilaçlar ile yapılan çalışmalardaki oranlar ile doğrudan karşılaştırılamaz ve aynı zamanda pratikte gözlenen oranları yansıtmayabilir, çünkü klinik çalışmalar çok çeşitli şartlar altında yürütülmüştür.Erişkinler ve 12 yaş ve üzeri adölesanlar:Beş çalışmanın 4'ü, yaşları 12 yaş ve üzerinde, çeşitli şiddette astımı olan 624 hasta (359 kadın ve 265 erkek) ile gerçekleştirilmiştir. Bu hastalar 12 - 16 hafta boyunca, günde 2 kez 80 mcg, 160 mcg ya da 320 mcg inhale siklesonid ile tedavi edilmiştir. Bu çalışmalar, ya daha önceden kontrol tedavisi (ağırlıklı olarak inhale kortikosteroidler) ya da daha önce semptom giderici tedavi (sadece bronkodilatör tedavi) alan hastalar ile gerçekleştirilmiştir. Bu çalışmalarda ortalama yaş 39,1 yıldır ve hastaların büyük bir çoğunluğu (%79,0) beyaz ırktandır. Bu çalışmalarda inhale siklesonidin 80 mcg dozunu alan hastaların %52,3'ünde, 160 mcg dozunu alan hastaların %59,8'inde, 320 mcg dozunu alan hastaların %54,1'inde ve plasebo alan hastaların %58,0'inde en az 1 advers olay gözlenmiştir.12 hafta süren beşinci klinik çalışma, daha önceden oral kortikosteroidlere gereksinim duyan (günlük prednizon dozu yaklaşık olarak 12 mg/gün), >12 yaşındaki astım hastalarıyla gerçekleştirilmiştir. Bu çalışmada, günde 2 kez 320 mcg inhale siklesonid (n=47) ve günde 2 kez 640 mcg inhale siklesonid (n=49) alan hastalarda gözlenen advers olaylar ile plasebo alan hastalarda (n=45) gözlenen advers olayların sıklıkları karşılaştırılmıştır. İnhale siklesonid ile tedavi edilen hastalarda gözlenen, insidansı >%3 olan ve plasebo alan grup ile karşılaştırıldığında inhale siklesonid alan grupta daha sıklıkla gözlenen advers olaylar aşağıdaki gibidir: sinüzit, ses kısıklığı, oral kandidiyaz, influenza, pnömoni, nazofarenjit, artralji, sırt ağrısı, muskuloskeletal göğüs ağrısı, baş ağrısı, ürtiker, baş dönmesi, gastroenterit, yüz ödemi, yorgunluk ve konjunktivit.Aşağıda tanımlanan advers ilaç reaksiyon verileri (tedavi ile ilişkili olarak değerlendirilen advers reaksiyonlar) inhale siklesonid ile gerçekleştirilen klinik çalışmalardan elde edilmiştir (plasebo kontrollü, aktif kontrollü ve açık etiketli çalışmalar).Advers ilaç reaksiyonları aşağıda tanımlanan sıklığa göre listelenmiştir:Çok yaygın (>1/10); yaygın (>1/100 ila <1/10), yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).Enfeksiyonlar ve enfestasyonlarYaygın olmayan: Oral kandidiyaz, kandidiyaz, oral fungal enfeksiyon, farenjitSinir sistemi hastalıklarıYaygın olmayan: Baş ağrısı, disguzi, baş dönmesi Göz hastalıklarıYaygın olmayan: Subkapsüler kataraktKardiyak hastalıklarıYaygın olmayan: PalpitasyonlarSolunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın: Paradoksikal bronkospazm, disfoniYaygın olmayan: Faringolaringeal ağrı, boğaz irritasyonu, boğaz kuruluğu Gastrointestinal hastalıklarYaygın olmayan: Mide bulantısı, ağız kuruluğu, dispepsi,Deri ve deri altı doku hastalıklarıYaygın olmayan: RaşGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarYaygın olmayan: Çürük oluşumuAraştırmalarYaygın olmayan: ALT artışı, gamma-glutamil transferaz artışı, kilo artışıİnhale siklesonid ile tedavi edilen hastalarda (n=1850) gözlenen lokal orofaringeal advers reaksiyonların insidansı düşük ve plasebo ile tedavi edilen hastalarda (n=934) gözlenenler ile benzer bulunmuştur. Plasebo kontrollü çalışmalarda gözlenen lokal advers reaksiyonların sıklığı siklesonid için aşağıdaki gibidir:Advers ilaç reaksiyonları aşağıda tanımlanan sıklığa göre listelenmiştir:Çok yaygın (>1/10); yaygın (>1/100 ila <1/10), yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).Enfeksiyonlar ve enfestasyonlarYaygın olmayan: Oral kandidiyaz, oral fungal enfeksiyonSinir sistemi hastalıklarıYaygın olmayan: DisguziSolunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın olmayan: Disfoni (ses kısıklığı), boğaz kuruluğu, farenjit, boğaz irritasyonuGastrointestinal hastalıklarYaygın olmayan: Ağzı kuruluğu4 - 11 yaş arasındaki pediyatrik hastalar:İnhale siklesonidin 4 - 11 yaş arasındaki pediyatrik hastalar (n=3754) ile yapılan güvenilirlik çalışmasında hastalar günde bir kez 50 - 200 mcg dozlarında inhale siklesonid ile tedavi edilmiştir. Klinik çalışma süresi 2 hafta ile 1 yıl arasındadır. Erişkinler ve adolesanlarda gözlenenler ile benzer advers olaylar gözlenmiştir. Tedavi ile ilişkili advers olayların insidansı, erişkinler ve adolesanlarda gözlenen advers olayların sıklıkları ile benzer bulunmuştur. İlaç ile ilişkili en sık bildirilen advers olay baş ağrısı olmuştur (%0.5).4 yaşın altındaki pediyatrik hastalar:4 yaşın altındaki hastalar ile çalışma yapılmamıştır.Uzun dönemli klinik çalışmalardan elde edilen veriler:12 haftalık, plasebo kontrollü tedavi çalışmalarının birinden uzun dönemli bu çalışmaya katılan, >12 yaşındaki 197 hasta (82 erkek, 115 kadın), günde 2 kez 320 mcg inhale siklesonid ile 1 yıl boyunca tedavi edilmek üzere yeniden randomize edilmiştir. 1 yıllık çalışmada gözlenen güvenilirlik profili, 12 - 16 haftalık tedavi çalışmalarında gözlenen güvenilirlik profili ile benzer bulunmuştur. 4 - 11 yaş arasındaki pediyatrik hastaların uzun dönemli güvenilirlik verileri, 3 açık etiketli, 1 yıllık güvenilirlik çalışmalarından elde edilmiştir.Anormal hematoloji ve klinik biyokimya bulguları:Çalışmanın başlangıcında değerleri normal olan ve tedaviden sonra değerleri normal değerlerin altında ya da üzerinde olan hastaların sonuçları değerlendirildiğinde, hematoloji ve biyokimya değerleri açısından değişiklik gözlenmemiştir.Pazarlama sonrası deneyimler:Siklesonidin pazarlanmasının ardından spontan olarak bildirilen advers olaylar aşağıda verilmiştir. Bu advers olaylar spontan olarak bildirildiği için insidansları güvenilir bir şekilde tahmin edilemez. Siklesonidin pazarlanmasının ardından spontan olarak bildirilen aşağıdaki advers olayların siklesonid ile ilişkili olduğu kabul edilmiştir:Dudaklarda, dilde ve boğazda şişme ile anjiyoödem gibi ani ya da gecikmiş aşırı duyarlılık reaksiyonları ve aynı zamanda duyarlı hastalarda intraoküler basınçta artış seyrek olarak bildirilmiştir.Pazarlama sonrasında klinik çalışmalarda gözlenen advers reaksiyonlar:Devam eden klinik çalışmalarda egzema, inhalasyonun ardından öksürük, kötü tat ve kusma yaygın olmayan sıklıkta; hipertansiyon ve abdominal ağrı seyrek olarak bildirilmiştir.4.9. Doz aşımı ve tedavisiAkut: Tek doz halinde 3200 mikrogram siklesonid inhalasyonu sağlıklı gönüllüler tarafından oldukça iyi tolere edilmiştir.İnhale siklesonid aşırı dozunu takiben oluşabilecek akut toksik etki potansiyeli düşüktür. Akut doz aşımı söz konusu olduğunda hastaya özgün bir tedavi uygulamak gerekli değildir.Kronik: Siklesonid'in 1280 mikrogram dozundaki uzun süreli kullanımında böbrek üstü bezinin baskılanması ile ilişkili klinik bulgulara rastlanmamıştır. Bununla birlikte, önerilen dozun aşıldığı uzun süreli kullanımlarda böbrek üstü bezinin bir miktar baskılanma ihtimali dışlanamaz. Bu durumda hastadaki böbrek üstü bezi rezervinin denetlenmesi gerekebilir.5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grubu: Obstrüktif solunum yolu hastalıklarında kullanılan diğer ilaçlar(inhalerler)/GlukokortikoidlerATC kodu: R03BA08Siklesonid'in vücuttaki glukokortikoid reseptörlerine bağlanma afinitesi düşüktür. Ağızdan inhalasyon yoluyla uygulanan siklesonid akciğer dokusuna ulaştıktan sonra enzim aracılığı ile esas metaboliti olan C21-des-metilpropionil-siklesonid'e (M1) dönüşür. Siklesonid'in aktif metaboliti olan C21-des-metilpropionil-siklesonid güçlü lokal antiinflamatuar etkinliğe sahiptir.Klinik etkinlikYapılan klinik çalışmalarda siklesonid'in, yetişkinlerde 640 mikrogram dozlarda maksimal etkilerin gözlendiği aşırı duyarlı hastalardaki adenozin monofosfat ve metakoline bağlı hava yolu duyarlılığını azalttığı gösterilmiştir. Farklı bir çalışmada ise 7 gün süreyle siklesonid uygulanıp ardından inhale alerjen verilen grubun erken ve geç dönem hava yolu reaksiyonlarında anlamlı azalma sağlandığı saptanmıştır. İnhale siklesonid tedavisinin hastaların akciğer sekresyonlarındaki inflamatuar hücre (total eozinofil) ve inflamatuar mediatör artışını azalttığı da gösterilmiştir.26 erişkin astımlı hastada yapılan kontrollü çalışmada 7 gün süreyle siklesonid tedavisinden sonraki plazma kortizol EAA (konsantrasyon-zaman eğrisi altındaki alan) değerlerinin 24 saatlik takipleri yapılmıştır. Plasebo ile kıyaslamalı olan bu çalışmada siklesonid'in 320, 640 ve 1280 mikrogram/gün gibi muhtelif dozları plazma kortizol düzeyinin 24 saatlik ortalamalarında istatistiksel açıdan anlamlı düşüşe sebep olmadığı gibi, doza bağımlı bir etki de gözlenmemiştir.164 adet erişkin erkek ve kadın astımlı hastanın katıldığı bir klinik çalışmada siklesonid 12 hafta süreyle 320 ya da 640 mikrogram/gün dozunda uygulanmıştır. 12. haftanın sonunda hastalara 1 ya da 250 mikrogram kosintropin uygulanmış ve plasebo kullanan gruba kıyasla plazma kortizol düzeylerinde anlamlı değişiklik gözlenmemiştir.Erişkin, ergen ve çocuklarda, 12 hafta süren, çift kör ve plasebo kontrollü birçok çalışmada siklesonid ile tedavinin hastaların akciğer fonksiyonlarında sağladığı düzelme ölçülen FEV1 ve doruk ekspiryum akım hızı değerleri ile gösterilmiş olup astım semptomlarının kontrolündeki gelişmenin yanı sıra hastaların inhale beta-2 agonist ihtiyacında azalma sağlanmıştır.Daha önce günde 500-1000 mikrogram flutikazon propiyonat veya eşdeğeri verilen 680 şiddetli, 12 yaş ve üzeri astım hastası ile yapılan 12 haftalık bir çalışmada, 160 veya 640 mikrogram siklesonid tedavisi sırasında hastaların sırasıyla %87,3 ve %93,3'ünde alevlenme görülmemiştir. 12 haftalık çalışmanın sonuçları, ilk günden sonra, 160 mikrogram/gün ve 640 mikrogram/gün siklesonid doz uygulamaları arasında alevlenme açısından istatistiksel olarak belirgin bir fark göstermiştir: 160 mikrogram/gün verilen 339 hastanın 43'ünde (%12,7) ve 640 mikrogram/gün verilen 341 hastanın 23'ünde (%6,7) alevlenme görülmüştür (Risk oranı: 0,523; p:0,0134). Her iki doz, 12 hafta boyunca FEVdeğerleri ile karşılaştırılmıştır. 160 veya 640 mikrogram/gün siklesonid ile tedavi edilen hastaların sırasıyla %3,8 ve %5'inde tedaviye bağlı istenmeyen etki gözlenmiştir. Şiddetli astım hastalarında yapılan 160, 320 ve 640 mikrogram/gün dozlarının karşılaştırıldığı bir çalışma yoktur.12 hafta süreyle yapılan bir pediyatrik çalışmada, 160 mikrogram siklesonid/gün uygulamasının, 80 mikrogram siklesonid/gün doz uygulamasına kıyasla anlamlı olarak daha az alevlenme görülmüştür.Büyüme üzerine etki, 12 hafta süreyle 5-9 yaş arası 609 çocuk üzerinde, plasebo kontrollü, çift kör, çok merkezli, randomize paralel gruplu bir çalışmayla araştırılmıştır. Çift kör tedavi sırasında gözlemlenen ortalama büyüme hızı, plasebo grubunda 5.76 cm/yaş, 40 mikrogram siklesonid grubunda 5.75 cm/yaş, 160 mikrogram siklesonid grubunda 5.60 cm/yaş oranındaydı. Büyüme hızı bakımından, günde 40 mikrogram siklesonid ve 160 mikrogram siklesonid plasebo grubuna kıyasla non-inferior değildir. Ayrıca, 292 hastada, HPA eksen fonksiyonuyla 24 saatlik idrarda serbest kortikozol ölçümlerinde, siklesonid ile plasebo arasında anlamlı fark gözlemlenmemiştir.5.2. Farmakokinetik özellikler Genel özelliklerFarmakokinetik karakterizasyon çoğunlukla M1 üzerinden yapılmıştır.Emilim:Radyoizotop ile işaretlenmiş siklesonid kullanarak yapılan oral ve intravenöz uygulamalarda oral emiliminin az olduğu (%24.5) gösterilmiştir. Siklesonid ve aktif metabolitinin sistemik biyoyararlanımları ihmal edilebilir düzeydedir (siklesonid <%0.5; metabolit <%1). y-sintigrafi yöntemi ile yapılan bir ölçüm ile sağlıklı gönüllülerin akciğer dokusundaki birikiminin, alınan dozun %52'si oranında olduğu gösterilmiştir. Siklesonid'in ölçülü doz inhalasyon uygulaması sonrasında aktif metabolitin sistemik biyoyararlanımı %50'nin üzerindedir. Aktif metabolitin oral biyoyararlanımının %1'in altında olması nedeniyle inhale edilen siklesonid'in ağızdan yutulan kısmının sistemik emilime herhangi bir katkısı yoktur.Dağılım:Sağlıklı gönüllülere intravenöz yoldan uygulanan siklesonid'in başlangıç dağılım aşamasının hızlı olduğu saptanmıştır; bu durum, ilacın yüksek lipofilik özelliğiyle de uyumludur. Dağılım hacminin ortalama değeri 2.9 L/kg'dır. Siklesonid'in total serum klerensi ilacın hepatik ekstraksiyonunun yüksek olduğuna işaret etmektedir (ortalama 2.0 L/sa/kg). Siklesonid ve aktif metaboliti neredeyse tamamen plazma proteinlerine bağlanmaktadır (%98-99).Biyotransformasyon:Siklesonid, akciğer dokusunda esteraz enzimleri aracılığıyla hidrolize edilerek biyolojik aktif metabolitine dönüştürülür. İnsan karaciğer mikrozomlarında uğradığı daha ileri metabolizma aşamaları enzimolojik olarak incelendiğinde, bu bileşiğin de daha sonra CYP3A4 tarafından katalizlenen inaktif hidroksillenmiş metabolitlere dönüştüğü saptanmıştır. Akciğerde ayrıca aktif metabolite ait reversibl lipofilik yağ asidi ester bileşiklerinin varlığı da saptanmıştır.Eliminasyon:Oral ve intravenöz uygulama sonrasında siklesonid'in vücuttan esasen dışkı ile (%67) atıldığı ve atılımdaki esas yolun safra sistemi olduğu gösterilmiştir.Doğrusallık/Doğrusal olmayan durum:Farmakokinetiği lineerdir. Önerilen tedavi dozlarında; sistemik maruziyeti dozla orantılı artış gösterir.Hastalardaki karakteristik özelliklerBöbrek yetmezliği:Aktif metabolitin böbrek yoluyla atılımı söz konusu olmadığından, böbrek yetmezlikli hastalar ile çalışma yapılmamıştır.Karaciğer yetmezliği:Karaciğer fonksiyonundaki azalma kortikosteroidlerin vücuttan atılımını etkileyebilir. Sirotik hastaların da katılmış olduğu bir çalışmada aktif metabolitin sistemik maruziyetinde artış gözlenmiştir.Geriyatrik popülasyon:Geniş çaplı toplumsal çalışmalarda saptanan farmakokinetik özelliklerinden yola çıkılarak aktif metabolitin sistemik maruziyetinde yaş faktörünün etkisi bulunmadığı ortaya konmuştur.Diğer:Astımlı hastalar:Siklesonid'in hafif-orta düzeyde astım hastalarındaki farmakokinetiği sağlıklı gönüllülerde saptanmış olan değerlerden farklı değildir.5.3. Klinik öncesi güvenlilik verileriGüvenilirlik farmakolojisi, kronik toksisite, genotoksisite ile karsinojenik potansiyel gibi geleneksel çalışmalardan elde edilen preklinik veriler, siklesonid kullanımının insan için hiçbir özel tehlikesi olmadığını ortaya çıkartmıştır.Üreme toksisitesi için yapılan hayvan çalışmalarında glukokortikosteroidlerin yarık damak, iskelet malformasyonları gibi etkilerine rastlanmıştır. Bu verilerin insanlara inhalasyon yoluyla uygulanan siklesonid ile ilintisi hakkında bilgi mevcut değildir.Köpekler ile yapılan 12 ay süren iki çalışmada, en yüksek dozların yumurtalıklar üzerinde tedaviye bağlı etkiler (atropi) oluşturduğu gözlenmiştir. Bu etkiler, 160 mikrogramlık günlük dozun 5,27-8,34 katının sistemik maruziyeti sonucu meydana gelmiştir. Bu bulguların insanlar ile ilişkisi bilinmemektedir.Diğer glukokortikoid türevleri ile yapılan hayvan çalışmalarında gebelik sırasında ve farmakolojik dozlardaki kullanımlarında glukokortikoidlerin intrauterin büyüme geriliği, erişkinlikte karşılaşılan kalp-damar ve/veya metabolik hastalık ile glukokortikoid reseptör yoğunluğunda değişim, nörotransmiter üretimi ve davranış bozukluğu gibi riskleri artırabildiği gösterilmiştir.6. FARMASÖTIK ÖZELLIKLER6.1. Yardımcı maddelerin listesiLaktoz6.2. GeçimsizliklerBilinen geçimsizliği yoktur.6.3. Raf ömrü24 ay6.4. Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında ve kuru yerde saklayınız.6.5. Ambalajın niteliği ve içeriğiSONİCAD 200 mcg inhalasyon için toz içeren 60 veya 120 kapsül, PVC/PVDC/Alü blister ambalajlarda inhalasyon cihazı ve kullanma talimatı ile birlikte karton kutuda sunulmaktadır.6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikleri'ne uygun olarak imha edilmelidir.7. RUHSAT SAHİBİ İnventim İlaç San. Tic. Ltd. Şti.General Ali Rıza Gürcan Cad.Merter İş Merkezi Bağımsız Bölüm No:8Güngören/İSTANBULTelefon: 0 212 481 76 41Faks: 0 212 481 76 41e-mail: [email protected]8. RUHSAT NUMARASI (LARI)243/419. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 29.06.2012 Ruhsat yenileme tarihi:10. KÜB'ÜN YENİLENME TARİHİ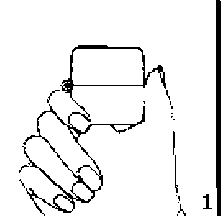 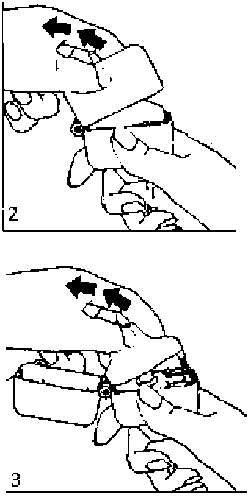
1., 2. ve 3. Toz başlığını yukarı doğru çekerek açınız. Daha sonra ağızlık parçasını açınız.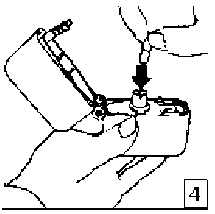
4. Blister ambalajından bir SONİCAD inhalasyon için toz içeren kapsülü çıkarınız (kullanımdan hemen önce çıkarınız) ve şekilde gösterildiği gibi merkezi hazneye yerleştiriniz. Kapsülün hazneye hangi yönde yerleştirildiği önemli değildir.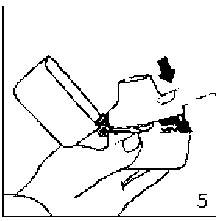
5. Ağızlık parçasını bir klik sesi duyuncaya değin sıkıca kapatınız. Toz başlığını açık bırakınız.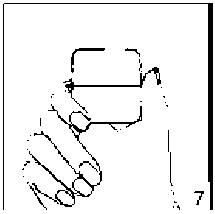 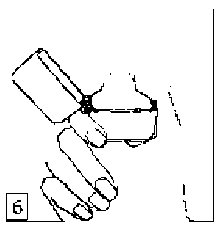
6. ve 7. İnhalasyon cihazını ağızlık parçası yukarıda olacak şekilde tutunuz ve kapağı bastırarak kapatınız.Böylece kapsülde delikler açılacak ve nefes aldığınızda ilacın salıverilmesini sağlayacaktır.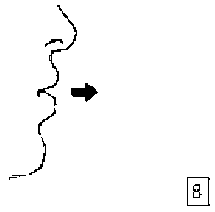
8. Nefesinizi tam olarak veriniz.Önemli: Hiçbir zaman ağızlık parçasına doğru nefes vermeyiniz.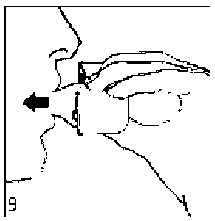
9. İnhalasyon cihazının ağzını açıp, cihazı ağzınıza kadar kaldırınız ve dudaklarınızı ağızlık parçasının çevresinde sıkıca kapayınız. Başınızı dik bir şekilde tutarak, yavaş ve derin bir nefes alınız; nefes alma hızınızı, kapsülün titreştiğini algılayacak şekilde ayarlayınız. Akciğerleriniz doluncaya kadar nefes alınız; nefesinizi sizi zorlamayacak bir süreyle tutunuz ve bu esnada inhalasyon cihazını ağzınızdan çıkarınız. Şimdi normal nefes alıp vermeye başlayabilirsiniz.Basamak 8 ve 9'u bir kez daha tekrarlayınız, bu kapsülün tamamen boşalmasını sağlayacaktır.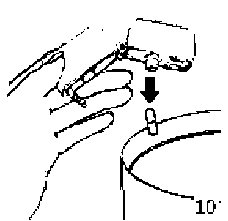
10. Ağızlık parçasını yeniden açınız. Cihazı çevirerek kullanılmış kapsülü çıkarınız ve atınız. Sonrasında ağzınızı su ile çalkalayınız. Ağızlık parçasını ve toz başlığını kapatınız ve inhalasyon cihazınızı yerine kaldırınız.İnhalasyon cihazının temizleme işlemiİnhalasyon cihazını ayda bir kez yıkayınız. Kapağı ve ağızlığı açınız. Cihazı sıcak su ile yıkayarak içerisindeki tozlardan arındırınız. Cihaz içerisindeki suyu boşaltarak kağıt bez üzerine kapak, ağızlık ve gövde kısımları açık kalacak şekilde kurumaya bırakınız. 24 saat kurumaya bırakılan cihaz kullanılmaya hazırdır. Eğer ihtiyaç varsa ağızlık kısmının dış yüzeyi ıslak olmayan nemli bir bezle silinebilir. |
İlaç BilgileriSonicad 200 mcg İnhalasyon İçin Toz İçeren KapsülEtken Maddesi: Siklesonid Atc Kodu: R03BA08 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.