Salofalk 1g Rektal Köpük Kısa Ürün BilgisiSindirim Sistemi ve Metabolizma » İshal İlaçları, Barsak Antienflamatuar ve Antienfektifleri » Barsak Antienflamatuarları » Aminosalisilik Asit ve Benzerleri » Mesalazin KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADISALOFALK® 1 g rektal köpük2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:Her bir tüp, birim dozunda etkin madde olarak 1.0 g mesalazin içerir.Yardımcı madde(ler):Sodyımı metabisülfıt (E 223) 0.05 g A Setostearil alkol 0.0091 gPropilen glikol 3.4364 g Disodyum edetat 0.0136 g Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMRektal köpükSALOFALK®, grimsi beyaz veya kırmızımsı eflatun renkli kremsi dolgun köpük. 4. KLİNİK ÖZELLİKLER4.1. TerapStik endikasyonlar^ Sigmoid kolon ve rektumun hafif ülseratif kolit ataklarının tedavisinde endikedir.4.2. Pozoioji ve uygulama şekli Pozolojiy uygulama sıklığı ve süresi:Yetişkinler ve 12 yaş üzerindeki ergenler:Günde bir kez yatmadan önce iki uygulama yapılır. Hasta bu köpük miktanm tutmada zorluk çekiyorsa, köpük ikiye bölünerek uygunalabilir; biri akşamın ilk saatlerinde ve diğeri gece yatmadan önce veya sabah erken saatlerde (ilk tek dozun boşaltılmasından sonra) uygulanabilir. En iyi sonuç, SALOFALK®'ın uygulama öncesinde bağırsakların boşaltılmasıyla elde edilmiştir. Genellikle hafif ülseratif kolitin akut ataklan 4-6 hafta içinde yatışır. İdame tedaviye, ürünün diğer formu olan oral mesalazinile devam edilmesi önerilir.Uygulama şekli:SALOFALK® mutlaka oda sıcaklığında (20 - 25°C) kullanılmalıdır (aynca bkz. bölüm 6.4).
Aplikatörü spreyin başına takınız. Sprey kutuyu içeriğinin kanşması için yaklaşık 20 saniye çalkalayınız. 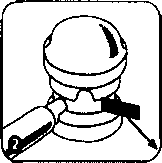 İlk kullanımda pompa altındaki güvenlik kilidini (plastik parça) çıkanmz.
İlk kullanımda pompa altındaki güvenlik kilidini (plastik parça) çıkanmz.Pompa başlığının işaretle gösterilen bölümünü sprey ucu ile aynı hizaya gelene kadar çeviriniz. Sprey kutusu şu anda kullanıma hazırdır.  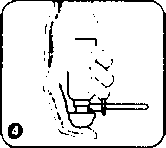 İşaret parmağınızı pompa kapağının üstüne koyunuz ve spreyi baş aşağı gelecek biçimde çeviriniz. Spreyin gerektiği şekilde çalışması için işaret parmağınız pompa başlığı ile birlikte aşağıyı göstermelidir. Aplikatörü mümkün olduğunca rektum içine yerleştiriniz. Rahat bir uygulama için bir ayağmız yerdeyken diğerini bir sandalyeye veya tabureye koyunuz. Bir kez pompaya basımz ve yavaşçaserbest bırakınız. İkinci uygulama için pompaya tekrar basınız ve yavaşça serbest bırakınız. Halen bir miktar köpük gelmeye devam ettiğinden, aplikatörü uygulama yaptıktan 10-15 saniye sonra çıkarımz, aksi takdirde köpük aplikatörden dışarı akar.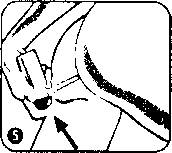 Uygulama sonrası aplikatör atılır ve plastik torba içinde olmak kaydıyla evsel atık olarak imha edilir. Diğer bir uygulama için yeni aplikatör kullanılır. Özel popülasyonlara ilişkin ek bilgiler Böbrek/ Karaciğer yetmezliği: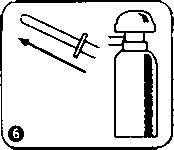 Karaciğer fonksiyon bozukluğu olan hastalarda dikkatli kullanılmalıdır. Böbrek fonksiyonları bozuk olan hastalarda kullanılması önerilmez. Tedavi sırasında böbrek fonksiyonlan tozulursa, mesalazinin yol açtığı renal toksisite düşünülmelidir. Şiddetli böbrek ve karaciğer yetmezliği olan hastalarda kontrendikedir. Pediyatrik popülasyon:SALOFALK®'ın 12 yaşın altındaki çocuklarda etki yaptığına dair sınırlı sayıda dokümantasyon ve çok az deneyim bulunduğundan bu yaş grubunda kullanılmamalıdır.Geriyatrik popülasyon:Geriyatrik popülasyon için pozoloji bilinmemektedir,4.3. KontrendikasyonlarSALOFALK®,- Daha önceden salisilik asit ve türevlerine ya da diğer bileşenlerine karşı duyarlılığı olanlarda, - Şiddetli karaciğer veya böbrek fonksiyonu bozukluklannda, - Daha önceden var olan gastrik veya duodenal ülserde, - Hemorajik diyatezi olanlarda kontrendikedir. 4.4. Özel kullanım uyanları ve önlemleriTedaviye başlamadan önce ve tedavi sırasında hekimin isteğine göre kan testleri (diferansiyel kan sayımı; ALT veya AST gibİ karaciğer fonksiyon testleri ve serum kreatinİn) ve idrar muayenesi (test çubuklan/dip çubuklan) yapılmalıdır. Kontroller tedaviye başlandıktan 14 gün sonra yapılmalı ve 4 haftalık aralarla 2-3 kez tekrarlanmalıdır.Bulgular normal ise, kontroller 3 aylık aralarla yapılabilir. Eğer ilave belirtiler gelişirse, kontrol muayeneleri hemen yapılmalıdır. Sülfasalazin içeren ilaçlarla yan etki görülme öyküsü olan hastalarda, SALOFALK® tedavisine yalnızca dikkatli bir hekim muayenesi ile başlanmalıdır. Kramplar, akut kann ağnsı, ateş, şiddetli baş ağnsı ve deride döküntü gibi akut reaksiyonlar görüldüğünde tedavi hemen kesilmelidir, SALOFALK®, her tüpteki birim dozunda 0.05 g sodyum metabisülfit içerir. Özellikle astun olmak üzere akciğer rahatsızlığı olan hastalar için seyrek olarak şiddetli aşın duyarlılık reaksiyonlan ve bronşların daralmasına (bronkospazm) neden olabilir. Bu nedenle, hastalar SALOFALK® ile tedavi sırasında çok dikkatli bir şekilde izlenmelidir. Ayrıca izole vakalarda SALOFALK® içeriğindeki sülfıt, astımlı olmayan hastalar için solunum problemleri şeklinde kendini gösterebilen aşın duyarlılık reaksiyonlarına neden olabilir. SALOFALK® her tüpteki birim dozunda 0.0091 g setostearil alkol içerir. Bu nedenle, lokal deri reaksiyonlarına (örneğin, kontak dermatite) sebebiyet verebilir. SALOFALK®, her tüpteki birim dozunda 3.4364 g propilen glikol içerir. Bu sebeple, laktoz asidoz, hiperozmolalite, hemoliz, SSS depresyonuna ve ciltte irritasyona (hafıf-orta derecede) neden olabilir. SALOFALK®, her tüpteki birim dozunda toplam 13.8 rag (0.6 mmol) sodyum içerir. Bu miktar eşik değerin (1 mmol^ 23 mg sodyum) altında olduğundan hiçbir olumsuz etki beklenmez. Günlük tedavi dozlarında alınmak kaydıyla güvenlidir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriKarşılıklı etkileşime ilişkin Özel araştırmalar yapılmamıştır.SALOFALK® aşağıdaki ilaçlarla birlikte kullamiması halinde karşılıklı etkileşimler ortaya çıkarabilir. Bu olası etkileşimlerin çoğu teorik nedenlere dayanır: - Kumarin tipi antikoagülanlar; Antikoagülan etkinin artma olasılığı vardır (gastrointestinal kanama riskini artırır) - Glukokortikoidler: İstenmeyen gastrik yan etkilerin artma olasılığı vardır. - Sülfonilüre: Kan şekerini düşürücü etkinin artma olasılığı vardır. - Metotreksat: Metotreksatın toksisite potansiyelinin artma olasılığı vardır. - Probenesid/sülfinpirazon: Ürikozürik etkinin azalma olasılığı vardır. - Spironolaktan/furosemid: Diüretik etkinin azalma olasılığı vardır. - Rifampisİn: Tüberkülostatik etkinin azalma olasılığı vardır. Azatiyoprin ya da 6-merkaptopürin ile tedavi görmekte olan hastalarda mesalazinin bu ilaçlann miyelosupresif etkilerini artırabileceği düşünülmelidir. Özel popülasyonlara ilişkin ek bilgilerPediyatrik popülasyon:SALOFALK®'m 12 yaşın altındaki çocuklarda etki yaptığına dair sınırlı sayıda dokümantasyon ve çok az deneyim bulunduğundan bu yaş grubunda kullanılmamalıdır.4.6. Gebelik ve İaktasyon Genel tavsiyeGebelik kategorisi B'dir.Çocuk doğurma potansiyeli bulunan kadınlar/ Doğum kontrolü (Kontrasepsiyon)SALOFALK*'m çocuk doğunna potansiyeli bulunan kadınlara herhangi bir etkisi veya doğum kontrolü (kontrasepsiyon) için kullanılan ilaçlarla herhangi bir etkileşimi bildirilmemiştir.Gebelik dönemiSmırlı sayıda gebelikte maruz kalma olgularına ilişkin veriler, SALOFALK®'m gebelik üzerinde ya da fetüsün/yeni doğan çocuğun sağlığı üzerinde advers etkileri olduğunu göstermemektedir. Bugüne kadar herhangi önemli bir epidemiyolojik veri elde edilmemiştir.Oral yol ile alınan mesalazinde, hayvanlar üzerinde yapılan çalışmaleır, gebelik/embriyonal/fetal gelişim/doğum ya da doğum sonrası gelişim ile ilgili olarak doğrudan ya da dolaylı zararlı etkiler olduğunu göstermemektedir (bkz. Bölüm 5.3). Gebe kadınlara verilirken tedbirli olunmalıdır. İzole tek bir vakada gebelik sırasmda yüksek mesalazin dozunun uzun süreli uygulanması neticesinde (2-4 g/gün, oral) yeni doğan bebekte böbrek yetmezliği bildirilmiştir. SALOFALK®, gebelik sırasında ancak beklenen faydanın potansiyel riskten fazla olması halinde uygulanmalıdır. Laktasyon donemiMesalazinin insan ya da hayvan sütü ile atılmasına ilişkin sınırlı bilgi mevcuttur. Memedeki çocuk açısından bir risk olduğu göz ardı edilemez. Emzirmenin durdurulup durdurulmayacağma ya da SALOFALK® tedavisinin durdurulup durdurulmayacağına/ tedaviden kaçınılıp kaçınılmayacağına ilişkin karar verilirken, emzirmenin çocuk açısından faydası ve SALOFALK® tedavisinin emziren anne açısından faydası dikkate alınmalıdır.N-asetil-mesalazin (N-Ac-5-ASA) ve az miktarda mesalazin anne sütüne geçmektedir. Diyare gibi aşın duyarlılık reaksiyonları emzirilen bebeklerde göz ardı edilemez. SALOFALK® tedavisi bu nedenle emziren annelerde önerilmez. Tedavi gerekli İse, emzirmeye son verilmelidir. Üreme yeteneği/FertiliteRektal yol ile alınan mesalazin için hayvanlarda üreme toksisitesi ile İlgili çalışmalar yapılmamıştır, insanlarda üreme yeteneği/fertilite üzerine etkisi bilinmemektedir.4.7. Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanma yeteneği üzerinde hiçbir etki görülmemiştir.4.8. İstenmeyen etkilerAşağıdaki sıklık verilerine göre yan etkiler değerlendirilmiştir:Çok yaygın: (> 1/10) Yaygın: {> 1/100-<1/10) Yaygın olmayan: (> 1/1000 - 1/100) Seyrek: (> 1/10,000- 1/1000) Çok seyrek: ( <1/10,000) (istisnai raporlar dahildir) Kan ve lenf sistemi hastalıklarıÇok seyrek: Bozulan kan sayımı (aplastik anemi, agranülositoz, pansitopeni, nötropeni, lökopeni, trombositopeni)Bağışıklık sistemi hastalıklarıÇok seyrek; Aleıjik egzantem, ilaç ateşi, bronkospazm, perikardit, miyokardit, akut pankreatit, alerjik alveolit, lupus eritomatozus sendromu, pankolit.Sinir sistemi hastalıklarıSeyrek: Baş ağrısı, sersemlik Çok seyrek: Periferal nöropatiGastrointestinal hastalıklarSeyrek: Karın agnsı, diyare, gaz, bulantı ve kusmaHepato-biUer hastalıklarıÇok seyrek: ICaraciğer fonksiyon testlerinde değişiklikler (transaminazlarda ve kolestaz parametrelerinde artış), hepatit, kolestatik hepatitDeri ve deri altı doku hastalıktanÇok seyrek: Alopesi (saç dökülmesi)Kas-iskelet bozukluklar, bağ doku ve kemik hastalıklanÇok seyrek: Miyalji, artraljiBöbrek ve idrar hastahklarıÇok seyrek: Akut ve kronik intersitisyel nefrit ve böbrek yetmezliğini içeren böbrek fonksiyon bozukluklanGenel bozukluklar ve uygulama bölgesine ilişkin hastalıktanYaygın: Kann şişkinliğiYaygın olmayan: Anal rahatsızlık, uygulama bölgesi iritasyonu, rektal tenezm Çok seyrek: Oligospermi (geri dönüşümlü) 4.9. Doz aşımı ve tedavisiBugüne dek bildirilen bir aşın doz olgusu bulunmamaktadır. Bilinen özgün bir antidotu yoktur. Eğer gerekliyse, aşın doz olgularında elektrolitlerin infüzyonu (zorlu diürez) düşünülmelidir.5. FARMAKOLOJİK ÖZELLİKLER5.L Farmakodinamik özelliklerFarmakoterapötik grup: İntestinal Anti-inflamatuvar Ajanı ATC kodu: A07 EC 02Anti-inflamatuvar etki mekanizması bilinmemektedir. İn vitro çalışmaların sonuçlan lipoksijenaz inhibisyonunun etkili olabileceğini göstermektedir. Bağırsak mukozasındaki prostaglandin içeriği üzerine etkisi de gösterilmiştir. Mesalazin (5-Aminosalisilik asit/5-ASA) reaktif oksijen bileşenlerin radikal tutucusu olarak da etki göstermektedir. Mesalazin, bağırsakta lokal olarak etkilidir ve kalın barsağm luminal bölümünün mukoza ve submokozasmda etki gösterir. Mesalazinin, inflamasyon bölgesinde bulunması önemlidir. Bu nedenle mesalazinin sistemik biyoyararlanım/plazma konsantrasyonlan, terapötik etkinlik ile değil güvenlilik ile ilişkili bir faktördür. 5.2. Farmakokinetik özelliklerEmilim:Mesalazin emilimi en yüksek oranda bağırsağın proksimal bölgelerinde, en düşük oranda da bağırsağın distal bölgelerinde gerçekleşir. Mesalazinin emilimi hızlıdır. Mesalazin ve mesalazinin metaboliti N-Ac-5-ASA'nm pik plazma konsantrasyonlanna yaklaşık 4 saat sonra ulaşılır. Bununla birlikte, köpüğün 2 g mesalazin dozunun plazma konsantrasyonlan ile mesalazinin 250 mg oral dozu karşılaştınldığında, yaklaşık 0.4 [ig/ml'de maksimum konsantrasyonlanna ulaşılır. Pre-sistemik metabolizma hızlıdır ve aynca N-Ac-5-ASA mesalazin gibi maksimum plazma konsantrasyonuna yaklaşık 4 saat sonra ulaşır, fakat plazma konsantrasyonlan 2 p.g/ml ile yaklaşık 4-5 kat daha fazladır. DaSılım:Farmakosintigrafık/farmakokinetik kombine çalışması, SALOFALK.® dağılımmm homojen, hızlı ve yaklaşık 1 saat içinde tamamlandığını göstermiştir. Dağılım, inflamasyonun yayılımına bağlı olarak bağırsak bölgesi rektum, sigmoid kolon ve kolonun sol tarafına ulaşır. Bivotransformasvon:Mesalazin presistemik olarak bağırsak mukozasında ve karaciğerde farmakolojik açıdan inaktif metaboliti olan N-asetil-5-amİnosalisilİk asite (N-Ac-5-ASA) dönüşür. Asetilasyon, hastanın asetilatör fenotipİnden bağımsız olarak gerçekleşmektedir. Bazı asetilasyon İşlemi kalın bağırsak bakterileri tarafından oluşmaktadır. Mesalazin ve N-asetil-5-amİnosalİsilik asidin proteine bağlanma oranlan sırasıyla % 43 ve % 78'dir. Eliminasvon:Mesalazin ve metaboliti olan N-Ac-5-ASA feçes (asıl kısmı) ile birlikte renal (miktarı uygulama şekline, farmasötik foraıuna ve mesalazinin salınma yoluna bağlı olarak %20 - % 50 arasında değişir) ve biliyer (küçük bir kısmı) yollanyla atılmaktadır. Renal atılım temelde N-Ac-5-ASA şeklinde gerçekleşir. Ağız yoluyla toplam uygulanan mesalazin dozunun yaklaşık % l'i temelde N-Ac-5-ASA şeklinde anne sütüne geçer. 5.3. Klinik öncesi gûvenlilik verileriKöpekler üzerinde, iyi rektal tolerans gösteren, lokal tolerans çalışması dışında SALOFALK® ile preklinik çalışmalar yapılmamıştır.Preklinik veriler gûvenlilik farmakolojisi, genotoksisite, karsinojenite (sıçanlarda) ya da üreme toksisite ile ilgili olarak özel bir zarar ortaya çıkarmamıştır. Yüksek doz oral mesalazin ile yapılan tekrarlayan doz çalışmalannda, böbrek toksisitesi (renal papiler nekroz ve proksimal kıvnmiı tüplerde ya da tüm nefronda epitelyal hasar) görülmüştür. Bu bulgunun klinik önemi bilinmemektedir. 6. FARMASÖTİK ÖZELLİKLERİ6.1. Yardımcı maddelerin listesiSodyum metabisülfıt (E 223)Setostearil alkol Polisorbat 60 Disodyum edetat Propilen glikol Propan n-bütan izobütan Azot gazı (2.5 barlık) 6.2. GeçimsizliklerGeçerli değil.6.3. Raf fimrü36 ay6.4. Saklamaya yönelik özel tedbirler25C'nin altında oda sıcaklığında saklayınız ve ışıktan koruyunuz.6.5. Ambalajın niteliği ve içeriğiPoliamid-imid veya epoksid-fenolik reçineden yapılmış uygun bir iç yüzey örtücüsü ile poHester veya poliasetal valf gövdesi, ölçme başlığı ve koruyucudan oluşan 5 ml'lik bir ölçme valfı bulunan ve LDPE koruyucu traya yerleştirilmiş 14 adet beyaz PVC aplikatör ile perçinlenmiş alüminyum tüp.PVC aplikatör, beyaz yumuşak parafın (BP) ve sıvı parafinden (Ph. Eur. 7:3) oluşan bir merhem ile kaplanmıştır 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller 'Tıbbi atıklarm kontrolü yönetmeliği' ve 'Ambalaj ve Ambalaj Atıklannm Kontrolü yönetmelikleri'ne uygun olarak imha edilmelidir.7. RUHSAT SAHİBİAli Raif ilaç San. A.Ş.Eski Büyükdere Caddesi Dilaver Sokak No:4 34418 Oto Sanayi - 4. Levent/İSTANBUL 8. RUHSAT NUMARASI(LARI)122/409. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 24.05.2007 Ruhsat yenileme tarihi:10. KÜB'ÜN YENİLENME TARİHİ14.06.2012 |
İlaç BilgileriSalofalk 1g Rektal KöpükEtken Maddesi: Mesalazin Atc Kodu: A07EC02 Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.