Staloral 300 spesifik immunoterapi için dilaltı alerjen ekstre solüsyon Kısa Ürün BilgisiÇeşitli İlaçlar » Allerjenler » Allerjenler » Alerjen Ekstratları KISA URUNBILGİSİ1.TIBBI URUNUNADISTALORAL 300 spesifik immünoterapi için dilaltı alerjen ekstre solüsyonu.2.KALITATIF VE KANTİTATIFBİLEŞİMIEtkin madde:Bir flakon aşağıdaki solüsyonlardan birinden 10 ml içerir: 10 veya 300 IR/ml (standardize edilmiş ekstraktlar) bir alerjen ekstresi veya birçok alerjen ekstrelerinin karışımı. İçinde bulunan bir veya daha fazla ürün ekteki listede verilmiştir. Medikal ürünün potensi IR olarak ifade edilir. *IR (Reaktivite indeksi): Araştırılan alerjene duyarlı 30 deneğe Stallerpoint® kullanılarak prick testi yapıldığında, 7 mm çapında (geometrik ortalama) kabarcık oluşuyorsa alerjen ekstresinin 100 IR/mL titre olduğu kabul edilir. Bu deneklerde deri hassasiyeti, %9 kodein fosfat veya 10 mg/mL histamin dihidroklorür ile bir prick testine pozitif cevap alınarak gösterilir.Aktif madde mannitollü liyofilize alerjen ekstresi veya gliserinlenmiş mannitollü allerjen ekstre solüsyonuna tekabül eder. Yardımcı maddeler:Her 10 mL flakon Sodyum klorür 590 mg Gliserol 580 mg Mannitol 200 ±2 mg Yardımcı maddeler için bkz. 6.1.3.FARMASÖTIK FORMSTALORAL 300 spesifik immünoterapi için dilaltı alerjen ekstre solüsyonu, her biri 10 ml içeren 12 ml'lik Tip I cam flakon içinde kauçuk tapa, renkleri farklı plastik kapak ile birlikte alüminyum "tear-off^' kapak ile ambalajlanır. Uygulama için dozaj pompası bulunur.Mavi kapsül : 10 IR/ml Mor kapsül: 300 IR/ml
POLENLEROtlar
IR/ml olarak ekstreler
Alerjen karışımlarıAğaçlarIR/ml olarak ekstreler *3 ot: - Dactylis glomerata L.-Lolium perenne L.-Phleum pratense L.*5 ot: -Dactylis glomerata L.-Anthoxanthum odoratum L.-Lolium perenne L.-Poa pratensis L.-Phleum pratense L.*12 ot: -Agrostis capillaris L.-Arrhenantherum elatius (L.) P. Beauv. Ex Jet C. Pres l.-Avena fatua L.-Bromus inermi Leyss.-Cynodon dactylon (L.)pers.-Dactylis glomerata L.-Festuca pratensis Hudson-Anthoxanthum odoratum L.-Holcus lanatus L.-Lolium perenne L.-Poa pratensis L.-Phleum pratense L._* Betulaceae: -Alnus glutinosa (L.) Gaertn.-Betula pendula Roth-Carpinus betulus L.-Corylus avellana L.*4 hububat: -Avena sativa L.-Tricicum aestivum L.-Zea mays L.-Hordeum vulgare L.*5 ot/4hububat*5 ot/çavdar4.KLINIK ÖZELLIKLER4.1. Terapötik endikasyonlarGell ve Coombs sınıflamasına göre Tip I alerjilerde, özellikle mevsimsel ya da bütün yıl devam eden rinit, konjunktivit, rinokonjunktivit ve astımla ortaya çıkan alerjilerde.Etiyolojik faktörler açıkça belirlendiğinde, spesifik immünoterapinin (SIT) amacı hassaslaşan organın alerjenle temasında meydana gelebilecek klinik neticeleri önlemektir. 4.2. Dozaj ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:SIT endike olduğunda kullanılmalıdır. Erken başlandığında çok daha fazla etkili olur. Bundan dolayı çocuklarda tedavi 5 yaşında başlayabilir. Çocuklarda veya gençlerde ilk endikasyonu doğrulayıcı semptomlar görüldüğünde tedaviye derhal başlanabilir.Pozoloji Staloral sadece dilaltı uygulama içindir. Staloral enjekte edilmemelidir. Alerjen immünoterapisi 5 yaşın altındaki çocuklara önerilmez. Yaş ile dozaj değişmez, fakat her bireyin göstereceği tepkiye göre düzenleme yapılır. Mevsimsel alerjiler için, tedaviye polen mevsiminden 2-3 ay önce başlanması ve mevsimin sonuna kadar devam edilmesi önerilir. Bütün yıl devam eden alerjiler için tedavinin tüm yıl boyunca sürdürülmesi önerilir. Tedavi 2 kısımdan oluşur: -Artan dozlarda başlangıç tedavisi -Değişmeyen dozlarda idame tedavisi. Başlangıç tedavisi: doz artımı Doz uygulaması günlük olarak artan dozlarda en yüksek katlanılabilir doza ulaşıncaya kadar (idame dozu) devam edilir. Genellikle başlangıç tedavisi 11-13 gün sürer. STALORAL 300 pompa sistemi kullanılarak yapılan tedavi planının örnekleri aşağıdadır:
İdame tedavisi: sabit doz Başlangıç tedavisi tamamlandığında idame dozu uygulanır. Önerilen pozoloji 300 IR/ml konsantrasyon kullanılarak günde en az 4 doz veya haftada üç kez 8 dozdur. Not: Önerilen bu tedavi şeması sadece örnek olarak verilmiştir ve hastanın durumuna ve muhtemel reaksiyonlara göre değiştirilebilir. STALORAL ile yapılan klinik çalışmalar günlük 300 IR dozun iyi tolere olduğunu göstermiştir. Tedavi süresi Genellikle, spesifik immünoterapi (SIT) 3-5 yıl devam etmelidir. 1 yıllık tedaviden sonra (bütün yıl devam eden alerji) veya ilk polen mevsiminden sonra (mevsimsel alerji), semptomlarda önemli bir iyileşme görülmezse tedavi tekrarlanmalıdır. Tedavinin geçici olarak kesilmesi Tedavinin 1 haftadan daha kısa süre kesilmesi durumunda tedaviye en son doz ile devam edilmesi önerilir. Tedavinin 1 haftadan daha uzun süre kesilmesi durumunda, mevcut flakon kullanılarak tekrar doz artışı ile başlanır ve maksimum katlanılabilir doza ulaşana kadar devam edilir. Uygulama şekli:Tedavinin gün içinde ağızdan, yiyecek ve içecek olmaksızın alınması önerilir.Ekstre dozu, dilaltına direkt olarak yerleştirilmiş pompa sıkılarak uygulanır ve yutmadan önce dilaltında iki dakika tutulur. Genç çocuklar için yetişkinlerin yardımı gerekir. Tedaviye başlamadan önce aşağıdakileri kontrol edin: -Son kullanım tarihi, -Kullanılan flakonun reçete edilen ile aynı olduğundan (kompozisyon, hasta ismi, konsantrasyon, plan) emin olunmalıdır. Şişeler emniyet ve bütünlük açısından hava geçirmeyecek şekilde plastik ve alüminyum kapsül ile kapatılmıştır. İlk kullanımda aşağıda belirtilen sıra takip edilir: 1.Kapağın plastik renkli kısmını çıkartın. 2.Metal ucu çekerek alüminyum kapağı çıkarın. 3.Gri renkli tapayı çıkarın. 4.Plastik koruyucusundan pompayı çıkarın. Şişeyi düz bir zemin üzerine koyarak bir elinizle sıkıca tutun, diğer elinizle pompayı sıkıca yerleştirin. 5.Turuncu renkli emniyet halkasını çıkartın. 6.Önce pompaya birbiri ardına basın. 5 basmadan sonra pompa tam doz taşımaya hazırdır. 7.Pompanın ucunu ağza ve dilin altına yerleştirin. Güçlü ve kontrollü şekilde basarak tavsiye edilen dozu sağlayın. Doktor tarafından tavsiye edilen doz kadar kullanın. Ürünü dilaltında 2 dakika tutun. 8.Apareyin ağız kısmını temizleyin ve emniyet halkasını takın. Daha sonraki kullanımlarda emniyet halkasını çıkardıktan sonra 7 ve 8.inci basamakları tekrar edin. 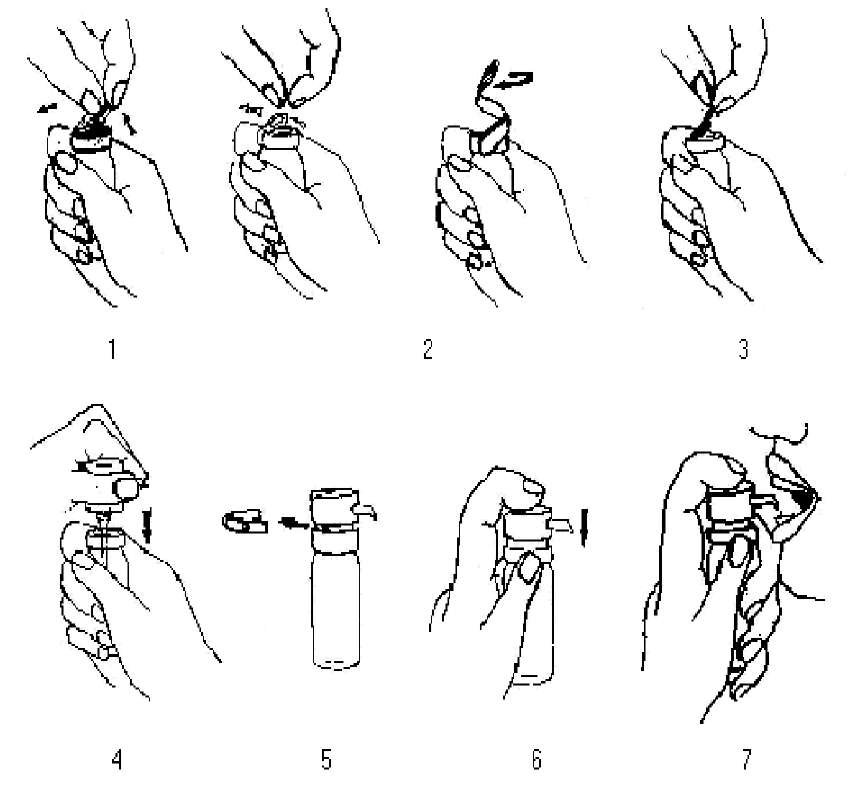
Özel popülasyonlara ilişkin ek bilgiler: Böbrek yetmezliği/karaciğer yetmezliği:Bu hasta grubu hakkında spesifik bilgi bulunmamaktadır.Pediyatrik popülasyon:Erken başlandığında çok daha fazla etkili olur. Bundan dolayı çocuklarda tedavi 5 yaşında başlayabilir. Çocuklarda veya gençlerde ilk endikasyonu doğrulayıcı semptomlar görüldüğünde tedaviye derhal başlanabilir.Geriyatrik popülasyon:45 yaş üzerindeki hastalarda STALORAL 300 ile yapılan immünoterapi hakkındaki klinik deneyimler yeterli değildir.4.3. Kontrendikasyonlar-Yardımcı maddelerden herhangi birine karşı aşırı duyarlılık (6.1. yardımcı maddelerin listesine bakınız),-Otoimmün hastalıklar, immün kompleks hastalıklar veya immün yetmezlik hastalıkları, -Habis hastalıklar, -Kontrol edilemeyen ciddi astımı olan hastalar (FEV1 < beklenen değerin %70'i) -Süregelen beta-bloker tedavisi (topikal oftalmik ürünler dahil), -Oral enflamasyonlar (oral liken planus, oral ülserasyon veya oral mikozis, gibi) 4.4.Özel kullanım uyarıları ve önlemleriSpesifik immünoterapi (SIT) uygulanacak hastaların semptomları kontrol altına alınmalıdır, gerekirse uygun bir tedavi yapılmalıdır. Tedavinin başlangıcında alerjik hastalığın önemli klinik semptomları varsa tedavi ertelenmelidir.Alerjen nedenli semptomların varlığı durumunda, kortikoidler, H1- antihistaminler ve beta-2-agonistler gibi ilaçların kullanılması gerekebilir. Tedavi uygulandıktan sonra, avuç içinde ve ayak tabanında aşırı kaşıntı, ürtiker, ağızda ödem, yutarken veya soluma sırasında zorluğa neden olan boğazda ödem veya seste değişiklik gibi semptomların görülmesi durumunda, hemen doktora haber verilmeli ve tedavi kesilmelidir. Ciddi alerjik reaksiyonlar oluşması durumunda epinefrin ile tedavi edilebilir. Trisiklik antidepresanlar ve monoamin oksidaz inhibitörleri (MAOI) kullananlarda epinefrin etkileri ölümcül sonuçlar doğurabilecek kadar büyüyebilir; spesifik immünoterapiye başlamadan önce bunun göz önünde bulundurulması gerekir. Mikozis, aft, mukoza lezyonları, diş kayıpları veya diş çekimi de dahil olmak üzere oral cerrahi durumlarında STALORAL 300 tedavisi tam iyileşme olana kadar durdurulmalıdır. (en az 7 gün). STALORAL 300 tedavisi ile eş zamanlı aşılamalara ilişkin klinik deneyimler yoktur. Hastanın tıbbi açıdan genel durumunun değerlendirilmesinden sonra STALORAL 300 tedavisini kesmeden aşılama yapılabilir. Hasta başka hastalığı varsa veya alerjik hastalığının kötüleşmesi durumunda doktorunu bilgilendirmelidir. Bu ilacın her flakonunda (10 mL çözeltide) 590 mg sodyum klorür vardır. Bu durum, düşük sodyum diyetinde olan hastalar için, özellikle çocuklar için göz önünde bulundurulmalıdır. İçeriğinde bulunan mannitolün hafif derecede laksatif etkisi olabilir. İçeriğinde bulunan gliserol baş ağrısı, mide bulantısı ve ishale sebebiyet verebilir. 4.5.Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriİlaçlarla etkileşimi bildirilmemiştir.STALORAL 300 ile yapılan klinik çalışmalarda herhangi bir etkileşim bildirilmemiştir. 4.6.Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: BÇocuk doğurma potansiyeli bulunan kadınlar/ Doğum kontrolü (Kontrasepsiyon)STALORAL300 için, gebeliklerde maruz kalmaya ilişkin klinik veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik / embriyonal / fetal gelişim / doğum ya da doğum sonrası gelişim ile ilgili olarak doğrudan ya da dolaylı zararlı etkiler olduğunu göstermemektedir. Gebe kadınlara verilirken tedbirli olunmalıdır.Gebelik dönemiGebelik sırasında immünoterapiye başlanması önerilmemektedir. Eğer tedavi sırasında hamilelik başlarsa tedavi sıkı tıbbi takiple sürdürülebilir.Laktasyon dönemiLaktasyon sırasında STALORAL 300 kullanımı üzerine herhangi bir klinik veri bulunmamaktadır. Anne sütü ile beslenen bebekler üzerinde herhangi bir etki oluşması beklenmemektedir. Bebek emzirilmesi sırasında immünoterapiye başlanılması önerilmemektedir. Bununla birlikte, eğer hasta doğum sırasında bu tedaviyi alıyorsa, sıkı tıbbi gözetim altında bu emzirmeye devam edebilir.Üreme yeteneği/ fertiliteÜreme yeteneği/fertilite üzerine etkileri bilinmemektedir.4.7.Araç ve makine kullanma yeteneği üzerindeki etkilerSTALORAL'ın araç ve makine kullanma yeteneği üzerine bilinen bir etkisi yoktur.4.8.istenmeyen etkilerTedavi sırasında alerjenlere maruz kalan hastalarda enjeksiyondan hemen sonra veya daha sonradan ortaya çıkan reaksiyonlar görülebilir.Bazı hastalarda verilen dozun toleransı, hastanın durumuna ve ortama göre zaman içinde değişebilir. Önceden anti-alerjik maddelerle (örneğin antihistaminler) tedavi, advers etkilerin sıklığını ve ciddiyetini azaltabilir. Advers reaksiyon görüldüğünde tedavi planı yeniden değerlendirilmelidir. Yanetkiler MedDRA kurallarına göre sistem organ sınıfı ve görülme sıklığı açısından sınıflandırılır. Çok yaygın (>1/10); Yaygın (>1/100 - <1/10); Yaygın olmayan (>1/1000 - <1/100); Seyrek (>1/10,000 - <1/1000); Çok seyrek (<1/10,000), Bilinmemektedir (eldeki verilerle ölçülememektedir) Kan ve lenf sistemi hastalıklarSeyrek: Lenf bezleri hastalığıBağışıklık sistemi hastalıklarıSeyrek: Serum hastalığıBilinmemektedir: Anjiyoödem, anaflaktik şok Sinir sistemi hastalıklarıSeyrek: Baş ağrısı.Göz hastalıklarıYaygın olmayan: KonjunktivitSolunum, göğüs bozuklukları ve mediastinal hastalıklarıYaygın olmayan: Rinit, astım Bilinmemektedir: Boğazda ödem.Gastrointestinal hastalıklarYaygın: Oral kaşıntı, ağız ödemi, dil ödemi, ağız ve boğaz rahatsızlığı, tükrük bezlerinde rahatsızlık, mide bulantısı, karın ağrısı, kusma, ishal. Bilinmemektedir: Ağız ve boğazda şişme.Deri ve deri altı doku hastalıklarıSeyrek: Egzama Bilinmemektedir: Ürtiker.Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıSeyrek: Artralji, miyaljiGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarSeyrek: Asteni, pireksi.Hasta STALORAL 300 alırken herhangi bir istenmeyen etki gördüğünde doktoruna haber vermelidir. 4.9.Doz aşımıÖnerilen günlük dozdan daha yüksek dozun kullanımı sonucunda, advers reaksiyon oluşma riski ve ciddiyeti artabilir.5. FARMAKOLOJİK ÖZELLİKLERİ5.1.Farmakodinamik özelliklerFarmakoterapötik grup: Alerjen ekstreleri ATC kodu: V01 AAAlerjen immünoretapi tedavisi (AIT) sırasında uygulanan alerjenlerin etki mekanizması tam olarak bilinmemektedir. Alerjen ile immünoterapi tedavisinin, T-lenfosit cevaplarında değişimlere neden olduğu, daha sonra alerjen-spesifik IgG4, ve/veya IgGI ve bazen IgA değerlerinde yükselmelere ve spesifik IgE değerinde düşüşe neden olduğu gösterilmiştir. İkinci ve olası daha sonraki immünolojik cevap, alerjen spesifik T hücrelerinde değişiklik ile birlikte immün sapmalardır. 5.2.Farmakokinetik özelliklerSTALORAL içindeki alerjenlerin büyük çoğunluğu protein ve glikoproteinlerin karışımıdır. Ekstrelerin yapısı nedeniyle, dil altına uygulandıktan sonra bozulmamış alerjenlerin kan biyoyararlanımı beklenmez. Bu sebeple, farmakokinetik profili ve metabolizmasını değerlendirmek için hayvanlarda veya insanlarda herhangi bir farmakokinetik çalışması yapılmamıştır.5.3. Klinik öncesi güvenlilik verileriGenotoksisite, tekrarlanan doz toksisitesi, embriyofetal gelişim veya juvenil toksisite çalışmalar, dil altı immünoterapi için solüsyonların içinde bulunan birçok alerjen ekstreleri ile yapılmış ve insanlara özel herhangi bir tehlike göstermemiştir.6. FARMASÖTiK ÖZELLİKLERİ6.1.Yardımcı maddelerin listesi-Sodyum klorür-Mannitol -Gliserol -Saflaştırılmış su 6.2.GeçimsizliklerGeçerli değil.6.3.Raf ömrüBitmiş ürünün raf ömrü: 36 ay6.4.Saklamaya yönelik özel tedbirlerSTALORAL 300 spesifik immünoterapi için dilaltı alerjen ekstre solüsyonu + 2 ve + 80C arasında (buzdolabında) saklanmalıdır.Yerleri değiştiğinde, flakonların dikey konumda olması sağlanmalıdır. Pompası takılmış şişeler nakliye sırasında ambalajına emniyet halkaları yerleşmiş olarak konmalıdır. Pompası takılı şişeler kargo ile taşınmaz. 6.5.Ambalajın niteliği ve içeriğiSTALORAL 300 spesifik immünoterapi için dilaltı alerjen ekstre solüsyonu, her biri 10 mL içeren 12 mL'lik Tip I amber cam flakon içinde, kauçuk tapa, renkleri farklı plastik kapak ile birlikte alüminyum "tear-off^' kapak ile ambalajlanır. Uygulama için dozaj pompası bulunur.Mavi kapsül : 10 IR/ml Mor kapsül: 300 IR/ml 6.6.Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği"ne uygun olarak imha edilmelidir.7.RUHSAT SAHİBISay İlaç San. ve Tic. Ltd. Şti Bağdat Caddesi Göker Apt. 314/2 Caddebostan -İstanbul Tel: 0216 3561740 Fax: 0216. 3856368 e-mail:[email protected]8.RUHSATNUMARASI9.iLKRUHSAT TARIHI/RUHSAT YENİLEME TARIHIİlk ruhsat tarihi: Ruhsat yenileme tarihi:10.KUB'UN REVIZYON TARIHI11/07/2012 |
İlaç BilgileriStaloral 300 spesifik immunoterapi için dilaltı alerjen ekstre solüsyonEtken Maddesi: Alerjen ekstresi Atc Kodu: V01AA Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.