Salmecap 50 mcg İnhalasyon İçin Toz İçeren Kapsül Kısa Ürün BilgisiSolunum Sistemi » Solunum Sisteminde Tıkanma - Astım İlaçları » Adrenerjikler (İnhalan) » Selektif Beta 2 Adrenoreseptör Agonistleri » Salmeterol KISA URUN BILGISI1. BEŞERI TIBBI URUNUN ADISALMECAP 50 mcg inhalasyon için toz içeren kapsül2. KALITATIF VE KANTİTATIF BILEŞIM ETKIN MADDE:Salmeterol ksinafoat* 72,50 mcg*50 mcg Salmeterol'e eşdeğer.Yardımcı maddeler:Laktoz 12,9275 mgYardımcı maddeler için 6.1'e bakınız.3. FARMASÖTIK FORMİnhalasyon için toz içeren kapsülKapak şeffaf, Gövde; natural transparan kapsül içinde beyaz toz4. KLINIK ÖZELLIKLER4.1 Terapötik endikasyonlar SALMECAP, astım semptomlarının düzeltilmesi ve kontrol altına alınması amacıyla bir inhale kortikosteroid ile birlikte kullanılır. Astım hastalığının basamaklı tedavisinde 3. basamaktan itibaren (inhaler steroidlerle kontrol altına alınamayan astımlı hastalarda) kullanılır. Orta ve ağır KOAH olgularında uzun etkili Pagonistler, hem semptomları kontrol altına almada hem de yaşam kalitesini düzeltmede ve alevlenme sıklığını azaltmada etkilidir.SALMECAP, aynı dozda devam edilmesi gereken inhale veya oral kortikosteroidlerin yerine kullanım için değildir. Bu nedenle SALMECAP tedavisine başlanacağı zaman kortikosteroid tedavisi azaltılmamalı veya durdurulmamalıdır.4.2 Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:SALMECAP, sadece oral inhalasyon yoluyla kullanım içindir.SALMECAP, düzenli bir şekilde kullanılmalıdır. Tedaviden sağlanacak yarar ilacın birkaç doz alınmasından sonra belirgin olacaktır.Astım gibi reversibl solunum yolu obstrüksiyonuYetişkinler (yaşlılar dahil) ve 12 yaş ve üzeri adolesanlar:
Başlangıç dozu günde iki kez bir inhalasyondur.Çocuklar ve adolesanlar:Çocuklarda ve adolesanlarda endike değildir.Uygulama şekli:SALMECAP inhaler kapsül; ağız yoluyla inhalasyon şeklinde kullanılır.İnhalasyon cihazı yoluyla nefes alındığında ilaç akciğerlere ulaşır. Bu nedenle, cihazın ağız parçası aracılığıyla derin ve güçlü nefes alınması önemlidir.İnhalasyon cihazının kullanımı doktor veya eczacı tarafından hastaya gösterilmelidir.Kapsüllerin kesinlikle ağız içine alınarak yutulmaması ve kesinlikle inhaler içine yerleştirildikten sonra soluk alma yoluyla kullanılması gerektiği konusunda hasta bilgilendirilmelidir.Jelatin kapsülün parçalanabileceği ve inhalasyondan sonra ağız veya boğaza küçük jelatin parçacıklarının ulaşabileceği hastaya anlatılmalıdır. Bu olasılık kapsülün birden fazla delinmemesi ile en aza indirilir.Kapsüller blister ambalajdan ancak kullanım öncesi çıkarılmalıdır.İnhalasyon cihazı kullanma talimatı için bakınız ekli talimat.Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Böbrek yetmezliği olan hastalarda doz ayarlaması gerekli değildir.Karaciğer yetmezliği:Karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli değildir.Pediyatrik popülasyon:4 yaşından küçük çocuklarda SALMECAP kullanımı ile ilgili klinik veriler yetersiz olduğundan 4 yaşın altındaki çocuklarda kullanımı önerilmemektedir. 4 yaş ve üzeri çocuklarda kullanım için Pozoloji/uygulama sıklığı ve süresi alt başlığına bakınız.Geriyatrik popülasyon:Geriyatrik popülasyonda doz ayarlaması gerekli değildir.4.3 KontrendikasyonlarSalmeterol ksinafoat ve/veya ürünün içindeki yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olan hastalarda kullanılmamalıdır.4.4 Özel kullanım uyarıları ve önlemleriUzun etkili beta agonist preparatlarına bağlı olarak nadiren, ciddi ve bazen ölümcül olabilen astım ile ilgili solunum problemleri meydana gelebilir.SALMECAP, astım hastalığının başlangıç tedavisi için önerilmez.Uzun etkili beta agonistler astım semptom kontrolünü sağlayan en kısa süre boyunca kullanılmalı ve astım kontrolüne ulaşıldığında eğer mümkünse kullanımları durdurulmalıdır. Sonrasında hastaların kontrol edici bir tedaviyle idamesi sağlanmalıdır.İnhale kortikosteroide ek olarak uzun etkili beta agonist kullanan pediatrik ve adölesan hastalarda, her iki ilaca uyumu garanti altına almak için, hem inhale kortikosteroid hem de uzun etkili beta agonist içeren bir kombinasyon preparatı kullanılması önerilir.Hastalar alevlenme dönemlerinde ise ya da önemli ölçüde veya akut olarak kötüye giden astım şikayetleri varsa, uzun etkili beta agonistlerle tedaviye başlanmamalıdır.Astım kontrolünün ani ve ilerleyen şekilde kötüleşmesi hayatı tehdit eden bir durumdur ve kortikosteroid tedavisinin başlatılması veya kortikosteroid dozunun artırılması düşünülmelidir. Bu durumda, günlük pik akışının izlenmesi tavsiye edilir. İdame astım tedavisi için salmeterol inhale veya oral kortikosteroidlerle birlikte verilmelidir.İnhale kortikosteroidler ile yeterli astım semptom kontrolünün sağlanamadığı durumlarda SALMECAP ek tedavi olarak başlatılsa da, hastalar şiddetli astım alevlenmesinin olduğu veya astımın anlamlı oranda kötüleştiği veya akut olarak kötüye gittiği durumlarda SALMECAP ile tedaviye başlatılmamalıdır.SALMECAP ile tedavi sırasında astımla ilişkili ciddi advers olaylar veya alevlenmeler meydana gelebilir. Tedaviye başladıktan sonra astım semptomlarının yeterli kontrolünün sağlanamadığı veya kötüleştiği durumlarda hastalar tedaviye devam etmeleri fakat tıbbi yardım almaları konusunda uyarılmalıdır.SALMECAP, inhale veya oral kortikosteroidlerin yerine kullanılamaz. Hastalar SALMECAP ile tedaviye başladıktan sonra, kendilerini iyi hissetseler bile doktora danışmadan steroid tedavisini kesmemeleri veya steroid dozunu azaltmamaları konusunda uyarılmalıdır.SALMECAP kısa etkili bronkodilatörlerin gerekli olduğu akut astmatik semptomları gidermek için kullanılmamalıdır. Hastalara bu gibi durumlarda kurtarıcı tedavi olarak kullanacakları ilaçları hazır bulundurmaları tavsiye edilmelidir.Uzun etkili bronkodilatörler idame astım tedavisinde tek başına veya asıl tedavi olarak kullanılmamalıdır. Semptomların rahatlatılması için bronkodilatörlerin, özellikle kısa etkili inhale beta2Astım semptomları kontrol altına alındığında salmeterol dozunun kademeli olarak azaltılması düşünülmelidir. Tedavi kademeli olarak azaltıldığında hastaların düzenli olarak incelenmesi önemlidir. Etkili en düşük salmeterol dozu kullanılmalıdır.Salmeterol, tirotoksikozlu hastalarda dikkatli kullanılmalıdır.Salmeterol kullanımı ile nadiren kan glukoz seviyelerinde artış bildirilmiştir. Bu nedenle diabetes mellitus öyküsü olan hastalara SALMECAP reçete edilirken bu husus göz önünde bulundurulmalıdır.Tüm sempatomimetik ilaçlarla, özellikle terapötik dozlardan daha yüksek dozlarda uygulandıklarında, bazen sistolik kan basıncında ve kalp hızında artış gibi kardiyovasküler etkiler görülebilir. Bu nedenle SALMECAP, önceden kardiyovasküler hastalığı olanlarda dikkatli kullanılmalıdır.Beta- agonist tedavisi potansiyel olarak ciddi hipokalemi ile sonuçlanabilir. Akut şiddetli astımda, bu etki hipoksi ile veya eş zamanlı ksantin türevleri, steroid ve diüretik kullanımı ile artabileceğinden dikkatli olunmalıdır. Serum potasyum seviyeleri bu gibi durumlarda monitörize edilmelidir.Büyük ölçekli bir klinik çalışmadan (Salmeterol Çok Merkezli Astım Araştırma Çalışması -SMART) elde edilen veriler Afro-Amerikalı hastalarda, plaseboya kıyasla salmeterol kullanımı sırasında solunum ile ilişkili ciddi olay veya ölüm riskinin daha yüksek olduğunu ileri sürmüştür. Bu artışın farmakogenetiğe veya diğer faktörlere bağlı olup olmadığı bilinmemektedir. Siyah Afrikalı veya Afro- Karayip soyundan gelen hastalar astım semptomlarının yeterli kontrolünün sağlanamadığı veya kötüleştiği durumlarda tedaviye devam etmeleri fakat tıbbi yardım istemeleri konusunda uyarılmalıdır.Sistemik ketokonazol ile eş zamanlı kullanım salmeterole sistemik maruziyeti anlamlı oranda arttırmıştır. Bu durum sistemik etkilerin insidansında artışa neden olabilir (örneğin QTc aralığında uzama ve çarpıntı). Bu nedenle, salmeterol tedavisinin hastaya sağlayacağı yararlar potansiyel olarak artan sistemik yan etki riskinden fazla değilse ketokonazol ve diğer güçlü CYP3A4 inhibitörleri ile birlikte kullanımından kaçınılmalıdır.Laktoz uyarısıSALMECAP laktoz içermektedir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glukoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriBeta-adrenerjik blokörler salmeterolün etkisini zayıflatabilir veya antagonize edebilir. Hem selektif hem de selektif olmayan beta-blokörlerinin kullanımını zorunlu kılacak bir neden yoksa kullanımlarından kaçınılmalıdır.Beta2Güçlü CYP3A4 inhibitörleri7 gün süresince 15 sağlıklı gönüllüde günde bir kez oral olarak uygulanan 400 mg ketokonazolle günde iki kez inhale edilen 50 mcg salmeterolün eş zamanlı kullanımı plazma salmeterol maruziyetinde anlamlı bir artışla sonuçlanmıştır (CmaOrta düzeyde CYP3A4 inhibitörleri6 gün süreyle 15 sağlıklı gönüllü bireye eş zamanlı günde üç kez oral olarak uygulanan 500 mg eritromisin ve günde iki kez inhale edilen 50 mcg salmeterol, salmeterol maruziyetinde az fakat istatistiksel olarak anlamlı olmayan artışla sonuçlanmıştır (C'ta 1.4 kat, EAA'da 1.2 kat). Eritromisin ile eş zamanlı kullanım herhangi bir ciddi advers etki ile ilişkili bulunmamıştır.Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlara ilişkin herhangi bir etkileşim çalışması yapılmamıştır.Pediyatrik popülasyon:Pediyatrik popülasyona ilişkin herhangi bir etkileşim çalışması yapılmamıştır.4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi C.Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınların tedavi süresince etkin doğum kontrol (kontrasepsiyon) yöntemleri uygulaması önerilmektedir.Gebelik dönemiHayvanlar üzerinde yapılan çalışmalar, gebelik ve/veya embriyonal/fetal gelişim ve/veya doğum ve/veya doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. İnsanlara yönelik potansiyel risk bilinmemektedir.Hayvan çalışmalarında, betaagonistlerin fetüs üzerindeki tipik olan bazı etkileri, terapötik dozlardan önemli ölçüde yüksek dozlara maruz bırakılan hayvanlarda görülmüştür.SALMECAP gerekli olmadıkça gebelik döneminde kullanılmamalıdır.Hastaya yönelik potansiyel yarar, fetüse yönelik potansiyel riskten fazla olmadıkça, gebe kadınlarda SALMECAP kullanılmamalıdır.Laktasyon dönemiSalmeterol'ün insan sütüyle atılıp atılmadığı bilinmemektedir Hayvanlar üzerinde yapılan çalışmalar, Salmeterol'ün sütle atıldığını göstermektedir. Emzirmenin durdurulupdurdurulmayacağına ya da SALMECAP tedavisinin durdurulup durdurulmayacağına/tedaviden kaçınılıp kaçınılmayacağına ilişkin karar verilirken, emzirmenin çocuk açısından faydası ve SALMECAP tedavisinin emziren anne açısından faydası dikkate alınmalıdır.Üreme yeteneği/FertiliteSALMECAP'ın üreme yeteneği/fertilite üzerindeki etkileri ile ilgili veri mevcut değildir.4.7 Araç ve makine kullanımı üzerindeki etkilerSALMECAP'ın araç ve makine kullanma yeteneği üzerindeki etkisi bildirilmemiştir.4.8 İstenmeyen etkilerYan etkilerin görülme sıklığı aşağıda belirtilmektedir:Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1000 ila <1/100); seyrek (>1/10.000 ila <1/1000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).Aşağıda verilen istenmeyen etki sıklıklarının günde iki kez 50 mcg standart dozda gözlendiği tahmin edilmektedir. Günde iki kez 100 mcg'den daha yüksek dozlardaki sıklıklar da göz önünde bulundurulmalıdır.Bağışıklık sistemi hastalıklarıAşağıda verilen belirtilerle birlikte aşırı duyarlılık reaksiyonları:Yaygın olmayan: Döküntü (kaşıntı ve kızarıklık)Çok seyrek: Bronkospazm ve anafilaktik şok, ödem ve anjiyoödemi içeren anafilaktik reaksiyonlarMetabolizma ve beslenme hastalıklarıSeyrek: Hipokalemi Çok seyrek: Hiperglisemi Psikiyatrik hastalıklarıYaygın olmayan: Sinirlilik Seyrek: İnsomniaSinir sistemi hastalıklarıYaygın: Baş ağrısı, titreme Seyrek: Baş dönmesiKardiyak hastalıklarıYaygın: Çarpıntı Yaygın olmayan: TaşikardiÇok seyrek: Kardiyak aritmiler (atriyal fibrilasyon, supraventriküler taşikardi ve ekstrasistoller) Solunum, göğüs bozuklukları ve mediastinal hastalıkları Çok seyrek: Orofaringeal iritasyon, paradoksikal bronkospazm Gastrointestinal hastalıklarıÇok seyrek: Mide bulantısıKas-iskelet bozukluklar, bağ doku ve kemik hastalıklarıYaygın: Kas krampları Çok seyrek: ArtraljiGenel bozukluklar ve uygulama bölgesine ilişkin hastalıklarıÇok seyrek: Spesifik olmayan göğüs ağrısıDiğer inhalasyon tedavilerinde olduğu gibi doz uygulamasından sonra hırıltıda ani bir artış ve pik ekspiratuvar akış hızında ani bir düşüş ile birlikte paradoksikal bronkospazm meydana gelebilir. Bu, hızlı etkili inhale bronkodilatöre bir yanıttır. Böyle bir durumda SALMECAP ile tedavi hemen sonlandırılmalı, hasta değerlendirilmeli ve gerekli ise alternatif bir prezentasyon veya tedavi başlatılmalıdır.Beta-agonist tedavisinin farmakolojik yan etkileri olarak titreme, kişiye özgü çarpıntılar ve baş ağrısı bildirilmiştir; fakat bu etkiler geçici olma ve düzenli tedavi ile azalma eğilimindedir. Titreme ve çarpıntı günde iki kez 50 mcg'den daha yüksek dozlar uygulandığında daha sık meydana gelebilir.4.9 Doz aşımı ve tedavisiSalmeterolün aşırı dozu ile beklenen belirtiler ve bulgular baş dönmesi, tremor, sistolik kan basıncında artışlar, baş ağrısı ve taşikardidir. Hipokalemi de meydana gelebilir. Serum potasyum seviyelerinin izlenmesi gereklidir. Potasyum replasman tedavisi göz önünde bulundurulmalıdır. Salmeterolün aşırı dozu için tercih edilen antidot kardiyoselektif beta-bloke edici ajandır. Kardiyoselektif beta-bloke edici ajanlar bronkospazm geçmişi olan hastalarda son derece dikkatli kullanılmalıdır.5. FARMAKOLOJIK ÖZELLIKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grubu: Selektif beta-adrenoseptör agonistleri ATC kodu: R03AC12Salmeterol, reseptörün dış bölgesine bağlanan bir uzun yan zinciri olan, selektif uzun etkili (genellikle 12 saat) bir beta-agonistlerin önerilen dozlarına göre, en az 12 saat süren, daha uzun süreli bronkodilatasyon sağlar.İn vitrotestler salmeterolün, insan akciğerlerinde histamin, lökotrienler ve prostaglandin Dgibi mast hücresi mediyatörlerinin salımının güçlü ve uzun süreli bir inhibitörü olduğunu göstermiştir. İnsanda salmeterol inhale edilen alerjenlere karşı erken ve geç faz yanıtlarını inhibe eder; geç faz yanıtı önleyici etkisi tek bir dozu takiben 30 saat boyunca, bronkodilatör etki artık belirgin olmadığında bile devam eder. Tek bir salmeterol dozu bronşiyal aşırı duyarlılığı azaltır. Bu özellikler salmeterolün ilave olarak non-bronkodilatör aktivitesi olduğunu göstermektedir ancak bu etkinin klinik açıdan anlamı tam olarak açıklığa kavuşmamıştır. Bu mekanizma kortikosteroidlerin anti-enflamatuvar etki mekanizmasından farklıdır. SALMECAP reçetelendiği zaman mevcut kortikosteroid tedavisi durdurulmamalı veya azaltılmamalıdır.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hasta grubu |
Primer sonlanım noktası vakalarının sayısı/hasta sayısı |
Rölatif risk (%95 güven aralığı) | |
Salmeterol |
Plasebo | ||
Tüm hastalar |
50/13.176 |
36/13.179 |
1.40 (0.91, 2.14) |
İnhale steroid kullanan hastalar |
23/6.127 |
19/6.138 |
1.21 (0.66, 2.23) |
İnhale steroid kullanmayan hastalar |
27/7.049 |
17/7.041 |
1.60 (0.87, 2.93) |
Afro-Amerikanhastalar |
20/2.366 |
5/2.319 |
4.10 (1.54, 10.90) |
(Koyu karakterle yazılan yerlerde risk istatistiksel olarak %95 seviyesindedir).
Başlangıçta inhale steroid kullanımı ile SMART çalışmasından elde edilen anahtar bulgular: ikincil sonlanım noktaları
|
|
İkincil sonlanım noktası vakalarının sayısı/hasta sayısı |
Rölatif risk (%95 güven aralığı) | |
Salmeterol |
Plasebo | ||
Solunum ilişkili ölüm | |||
İnhale steroid kullanan hastalar |
10/6127 |
5/6138 |
2.01 (0.69, 5.86) |
İnhale steroid kullanmayan hastalar |
14/7049 |
6/7041 |
2.28 (0.88, 5.94) |
Kombine astım ilişkili ölüm veya hayat tehdit ec |
ici deneyim | ||
İnhale steroid kullanan hastalar |
16/6127 |
13/6138 |
1.24 (0.60, 2.58) |
İnhale steroid kullanmayan hastalar |
21/7049 |
9/7041 |
2.39 (1.10, 5.22) |
Astım ilişkili ölüm | |||
İnhale steroid kullanan hastalar |
4/6127 |
3/6138 |
1.35 (0.30, 6.04) |
İnhale steroid kullanmayan hastalar |
9/7049 |
0/7041 |
* |
(*=plasebo grubunda |
herhangi bir vakanın olmamasından dolayı hesaplanamamıştır. Koyu | ||
karakterle yazılan yerlerde risk istatistiksel olarak %95 seviyesindedir. Yukarıdaki tablodaki ikincil sonlanım noktaları tüm popülasyonda istatistiksel anlamlılığa ulaşmıştır). Kombine tüm nedenlere bağlı ölümler veya hayat tehdit edici deneyim, tüm nedenlere bağlı ölümler veya tüm nedenlere bağlı hastaneye kaldırılmaya ait ikincil sonlanım noktaları, tüm popülasyonda istatistiksel anlamlılığa ulaşmamıştır
KOAH klinik çalışmaları
TORCH çalışması (TOwards a Revolution in COPD Health; KOAH'ta devrime doğru):
TORCH, KOAH hastalarında, günde 2 kez 50/500 mikrogram salmeterol/flutikazon, günde 2 kez
50 mikrogram salmeterol, günde 2 kez 500 mikrogram FP (flutikazon propiyonat) veya plasebo ile yapılan tedavinin tüm nedenlere bağlı ölümler üzerindeki etkisini değerlendirmek için yapılan 3 yıllık bir çalışmadır. Başlangıç (bronkodilatörden önce) FEV1'i beklenen normal değerin % 60'ından az olan orta-şiddetli ve şiddetli KOAH hastaları çift-kör tedavi almak üzere randomize edilmiştir. Çalışma boyunca, diğer inhale kortikosteroidler, uzun etkili bronkodilatörler ve uzun süre sistemik kortikosteroidler dışında, her zamanki KOAH tedavilerini almalarına izin verilmiştir. Üç yıllık sağkalım durumu, çalışmadan çıkıp çıkmadıklarına bakılmaksızın hastaların tümü için tespit edilmiştir. Başlıca sonlanma noktası, plaseboya kıyasla salmeterol/flutikazon için 3 yılda tüm nedenlere bağlı ölümlerin azaltılması olmuştur.
|
|
PlaseboN=1524 |
Salmeterol 50 N=1521 |
FP 500 N=1534 |
Salmeterol/flutikazon 50/500 N=1533 |
3 yılda tüm nedenlere |
bağlı ölüm | |||
Ölüm sayısı (%) |
231 (%15.2) |
205 (%13.5) |
246 (%16.0) |
193 (%12.6) |
Plaseboya karşı risk oranı (GA) p değeri |
Geçerli değil |
0.879 (0.73, 1.06) 0.180 |
1.060 (0.89, 1.27) 0.525 |
0.825 (0.68, 1.00) 0.0521 |
Risk oranı,komponentlerinekarşısalmeterol/flutikazon 50/500 (GA) p değeri |
Geçerli değil |
0.932 (0.77, 1.13) 0.481 |
0.774 (0.64, 0.93) 0.007 |
Geçerli değil |
1
Salmeterol/flutikazon ile tedavi edilen hastalarda plasebo ile karşılaştırıldığında 3 yıl sonunda iyileşmiş sağ kalıma doğru bir eğilim olmakla birlikte istatistiksel olarak anlamlı p<0.05 değerine ulaşılamamıştır. Üç yıl içinde KOAH'a bağlı nedenlerden dolayı ölen hastaların yüzdesi plasebo için % 6.0, salmeterol için % 6.1, flutikazon için % 6.9 ve salmeterol/flutikazon için % 4.7'dir.
Salmeterol, flutikazon veya plasebo ile karşılaştırıldığında salmeterol/flutikazon kombinasyonu ile yılda ortalama orta-şiddetli alevlenme sayısı anlamlı ölçüde azalmıştır (Plasebodaki 1.13, flutikazon grubundaki 0.93, salmeterol grubunda 0.97 oranı ile karşılaştırıldığında salmeterol/flutikazon grubundaki ortalama oran 0.85 olmuştur). Plaseboya kıyasla salmeterol/flutikazon, orta şiddetli ve şiddetli alevlenmeleri % 25 (% 95 GA: % 19 ve % 31 arasında; p <0.001) oranında azaltmıştır. Salmeterol/flutikazon alevlenme oranını, salmeterol ile karşılaştırıldığında % 12 (% 95 GA: % 5 ve % 19 arasında; p = 0.002), FP ile karşılaştırıldığında da % 9 (% 95 GA: % 1 ve % 16 arasında; p = 0.024) oranında azaltmıştır. Plaseboya kıyasla salmeterol ve FP alevlenme oranını anlamlı derecede sırasıyla % 15 (% 95 GA: % 7 ve % 22 arasında; p <0.001) ve % 18 (% 95 GA: % 11 ve % 24 arasında; p <0.001) oranında azaltmıştır.
St George Solunum Anketi (SGSA) ile ölçülen Sağlıkla İlişkili Yaşam Kalitesi, plaseboya kıyasla tüm aktif tedavi yöntemleri ile düzelmiştir. Üç yıl boyunca salmeterol/flutikazon ile sağlanan ortalama düzelme plaseboya kıyasla - 3.1 birim (% 95 GA: - 4.1 ve - 2.1 arasında; p <0.001), salmeterole kıyasla - 2.2 birim (p <0.001) ve FP'ye kıyasla - 1.2 birimdir (p = 0.017). A 4 birimindeki düşüşün klinik olarak ilişkili olduğu düşünülmektedir.
Advers olay olarak bildirilen pnömoninin 3 yıllık tahmini olasılığı plasebo için % 12.3, salmeterol için % 13.3, FP için % 18.3 ve salmeterol/flutikazon için % 19.6'dır (salmeterol/flutikazon kombinasyonunun plaseboya karşı risk oranı: 1.64, % 95 GA: 1.33 ve 2.01 arasında, p <0.001). Pnömoni ile ilişkili ölümlerde artış olmamıştır; tedavi sırasında birincil olarak pnömoniye bağlı oldukları düşünülen ölümler plasebo için 7, salmeterol için 9, FP için 13 ve salmeterol/flutikazon kombinasyonu için 8 olarak tespit edilmiştir. Kemik kırılma olasılığında anlamlı farklılık yoktur (plasebo % 5.1, salmeterol % 5.1, FP % 5.4 ve salmeterol/flutikazon kombinasyonu %6.3; plaseboya karşı salmeterol/flutikazon kombinasyonu için risk oranı: 1.22, % 95 GA: 0.87 ve 1.72 arasında, p = 0.248).
5.2 Farmakokinetik özellikler Genel özellikler
Emilim:
Salmeterol akciğerlerde lokal olarak etki eder, bu nedenle plazma seviyeleri terapötik etkinin belirleyicisi değildir. Terapötik dozlarda inhalasyondan sonra çok düşük plazma konsantrasyonları gösterdiği için (yaklaşık 200 pg/ml veya daha az) plazmadaki ilaç miktarının tayini teknik olarak zor olduğundan salmeterolün farmakokinetiği ile ilgili sadece sınırlı veriler bulunmaktadır. Salmeterol ksinafoatın düzenli kullanımını takiben, hidroksinaftoik asit sistemik dolaşımda tayin edilebilir ve kararlı durum konsantrasyonları yaklaşık 100 ng/ml'ye ulaşır. Bu konsantrasyonlar, toksisite çalışmalarında gözlenen kararlı durum konsantrasyonlarından 1000 kez daha düşüktür. Havayolu tıkanıklığı olan hastalarda uzun süreli düzenli kullanımında (12 aydan fazla) herhangi bir zararlı etki görülmemiştir.
Dağılım:
Salmeterolün plazma proteinlerine bağlanma oranı %96'dır.
Biyotransformasyon:
İn vitrobir çalışma salmeterolün sitokrom P450 3A4 (CYP3A4) tarafından büyük oranda a-hidroksisalmeterole (alifatik oksidasyon) metabolize edildiğini göstermiştir.
Eliminasyon:
Eliminasyon yarılanma ömrü 5.5 saattir. Salmeterolün %60 dışkı ile %25 idrar ile itrah edilir.Doğrusallık/doğrusal olmayan durum:
Veri mevcut değildir.
5.3 Klinik öncesi güvenlilik verileri
Hayvanlarla gerçekleştirilen üreme çalışmaları, beta-agonistlerin çok yüksek dozlarda fetüs üzerinde bazı etkileri olduğunu göstermiştir.
İn vitroveyain vivoortamda ya prokaryotik ya da ökaryotik hücre kullanılarak gerçekleştirilen bir dizi çalışmada salmeterol ksinofoat verilen sıçanda genetik toksisiteye neden olmamıştır. Salmeterol ksinofoat ile gerçekleştirilen uzun süreli çalışmalar sıçanların mezoovaryumunda ve farelerin uterusunda sınıf ilişkili iyi huylu düz kas tümörlerini indüklemiştir. Bilimsel literatürler ve farmakolojik çalışmalar bu etkilerin türe özgü olduğuna ve klinik kullanımla ilişkili olmadığına ilişkin kanıtlar sunmaktadır.
6. FARMASÖTIK ÖZELLIKLER
6.1 Yardımcı maddelerin listesi
Laktoz
6.2 Geçimsizlikler
Geçerli değildir.
6.3 Raf ömrü
24 ay
6.4 Saklamaya yönelik özel tedbirler
25°C'nin altındaki oda sıcaklığında ve kuru yerde saklayınız.
6.5 Ambalajın niteliği ve içeriği
SALMECAP 50 mcg, inhalasyon için toz içeren 60 veya 120 kapsül, PVC/PVDC/Alü blister ambalajlarda inhalasyon cihazı ve kullanma talimatı ile birlikte karton kutuda sunulmaktadır.
6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller 'Tıbbi Atıkların Kontrolü Yönetmeliği' ve 'Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikleri'ne uygun olarak imha edilmelidir.
7. RUHSAT SAHİBI
Mentis İlaç San Tic. Ltd. Şti.
Florya Asfaltı Florya İş Merkezi No:88 B Blok No:6 Bakırköy/İSTANBUL Tel No: 0 212 481 79 52 Faks No: 0 212 481 79 52 e-mail: [email protected]
8. RUHSAT NUMARASI (LARI)
243/70
9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİ
İlk ruhsat tarihi: 12.07.2012 Ruhsat yenileme tarihi:
10. KÜB'ÜN YENİLENME TARİHİ
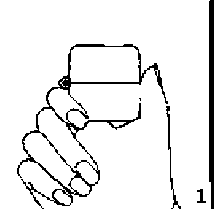
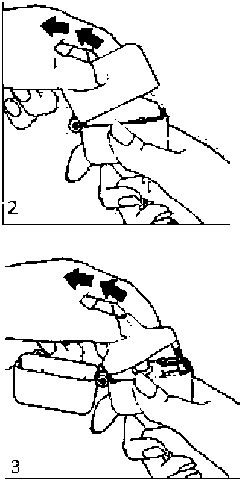
1., 2. ve 3. toz başlığını yukarı doğru çekerek açınız. Daha sonra ağızlık parçasını açınız.
4. Blister ambalajından bir SALMECAP inhalasyon için toz içeren kapsülü çıkarınız (kullanımdan hemen önce çıkarınız) ve şekilde gösterildiği gibi merkezi hazneye yerleştiriniz. Kapsülün hazneye hangi yönde yerleştirildiği önemli değildir.
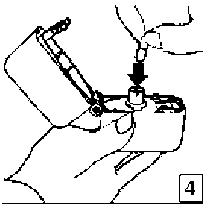
5. Ağızlık parçasını bir klik sesi duyuncaya değin sıkıca kapatınız. Toz başlığını açık bırakınız.
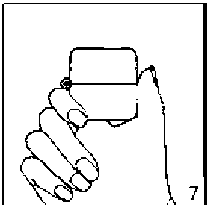
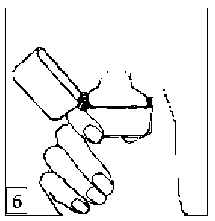
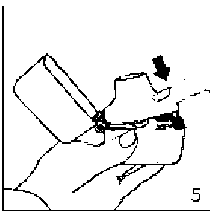
6. ve 7. İnhalasyon cihazını ağızlık parçası yukarıda olacak şekilde tutunuz ve kapağı bastırarak kapatınız.
Böylece kapsülde delikler açılacak ve nefes aldığınızda ilacın salıverilmesini sağlayacaktır.
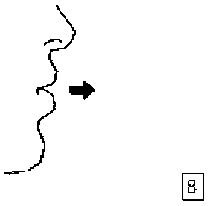
8. Nefesinizi tam olarak veriniz.
Önemli: Hiçbir zaman ağızlık parçasına doğru nefes vermeyiniz.
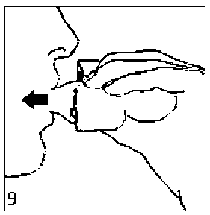
9. İnhalasyon cihazının ağzını açıp, cihazı ağzınıza kadar kaldırınız ve dudaklarınızı ağızlık parçasının çevresinde sıkıca kapayınız. Başınızı dik bir şekilde tutarak, yavaş ve derin bir nefes alınız; nefes alma hızınızı, kapsülün titreştiğini algılayacak şekilde ayarlayınız. Akciğerleriniz doluncaya kadar nefes alınız; nefesinizi sizi zorlamayacak bir süreyle tutunuz ve bu esnada inhalasyon cihazını ağzınızdan çıkarınız. Şimdi normal nefes alıp vermeye başlayabilirsiniz. Basamak 8 ve 9'u bir kez daha tekrarlayınız, bu kapsülün tamamen boşalmasını sağlayacaktır.
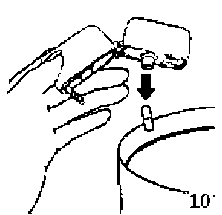
10. Ağızlık parçasını yeniden açınız. Cihazı çevirerek kullanılmış kapsülü çıkarınız ve atınız. Ağızlık parçasını ve toz başlığını kapatınız ve inhalasyon cihazınızı yerine kaldırınız.
inhalasyon cihazının temizleme işlemi
İnhalasyon cihazını ayda bir kez yıkayınız. Kapağı ve ağızlığı açınız. Cihazı sıcak su ile yıkayarak içerisindeki tozlardan arındırınız. Cihaz içerisindeki suyu boşaltarak kağıt bez üzerine kapak, ağızlık ve gövde kısımları açık kalacak şekilde kurumaya bırakınız. 24 saat kurumaya bırakılan cihaz kullanılmaya hazırdır. Eğer ihtiyaç varsa ağızlık kısmının dış yüzeyi ıslak olmayan nemli bir bezle silinebilir.

İlaç Bilgileri
Salmecap 50 mcg İnhalasyon İçin Toz İçeren Kapsül
Etken Maddesi: Salmeterol ksinafoat
Atc Kodu: R03AC12
Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.