Gaudit 6 Mg/6 Ml İ.v. İnfüzyon İçin Konsantre Çözelti İçeren Flakon Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIGAUDİT 6 mg/6 mL i.v. infüzyon için konsantre çözelti içeren flakon 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Bir flakon, 6 mL infüzyon için konsantre çözelti içinde, 6 mg ibandronik aside eşdeğer miktarda 6.75 mg ibandronik asit, monosodyum tuzu, monohidrat içerir. Yardımcı maddeler:Sodyum klorür: 52.65 mg Sodyum asetat trihidrat: 8.334 mg Yardımcı maddeler için, 6.1'e bakınız. 3. FARMASÖTİK FORMİnfüzyon için konsantre çözelti içeren flakon. Gözle görülebilir yabancı madde içermeyen, renksiz berrak çözelti. 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlar- GAUDİT kemik metastazlı meme kanseri hastalarındaki iskelet ile ilgili olayların (radyoterapive cerrahiyi gerektiren komplikasyonlar ve patolojik fraktür) önlenmesinde, - Metastazlı veya metastazlı olmayan tümör kaynaklı hiperkalsemi tedavisinde endikedir. 4.2 Pozoloji ve uygulama şekliGAUDİT tedavisi sadece kanser tedavisinde deneyimli doktorlar tarafından başlatılmalıdır. Pozoloji/ Uygulama sıklığı ve süresi:Kemik Metastazlı Meme Kanseri Hastalarındaki İskelet ile İlgili Olayların Önlenmesi Kemik metastazlı meme kanseri hastalarındaki iskelet ile ilgili olayların önlenmesi için tavsiye edilen doz, her 3-4 haftada bir verilen 6 mg intravenöz infüzyondur. Doz en az 15 dakikadainfüze edilmelidir. İnfüzyon için flakon içeriği, izotonik sodyum klorür solüsyonuna veya%5'lik dekstroz solüsyonuna eklenmelidir. Daha kısa infüzyon zamanı (örn. 15 dak) yalnızca normal böbrek fonksiyonu veya hafif böbrek yetmezliği olan hastalar için kullanılmalıdır. Kreatin klerensi 50 mL/dak'nın altında olan hastalar için kısa infüzyon zamanını tanımlayacak hiçbir veri bulunmamaktadır. Hekimler, dozlama hakkında tavsiye ve hasta gruplarındakullanım için Böbrek Yetmezliği Olan Hastalar bölümüne bakmalıdır. Tümöre bağlı olarak gelişen hiperkalsemi tedavisi GAUDİT ile tedaviye başlamadan önce, hasta %0.9 sodyum klorürle yeterli rehidrate edilmelidir. Tümörün tipi ile birlikte, hiperkalseminin şiddeti de dikkate alınmalıdır. Genelolarak, osteolitik kemik metastazı olan hastalar, hümoral tipte hiperkalsemisi olan hastalara 1göre daha düşük dozlara gereksinim duymaktadırlar. Şiddetli hiperkalsemisi (albümine göre düzeltilmiş serum kalsiyumu* > 3 mmol/L veya > 12 mg/dL) olan çoğu hastada 4 mg'lık tekdoz yeterlidir. Orta derecede hiperkalsemisi olan hastalarda (albümine göre düzeltilmiş serumkalsiyumu < 3 mmol/L veya < 12 mg/dL) 2 mg etkili bir dozdur. Klinik çalışmalarda kullanılanen yüksek doz 6 mg olmuştur ancak bu doz etkinlik açısından ek bir fayda getirmez. * Albümine göre düzeltilmiş serum kalsiyumu konsantrasyonları aşağıdaki gibi hesaplanmaktadır: Albümine göre düzeltilmiş = serum kalsiyumu (mmol/L) -[0.02 x albümin (g/L)]+ 0.8 serum kalsiyumu (mmol/L) veyaAlbümine göre düzeltilmiş = serum kalsiyumu (mg/dL) + 0.8 x [4-albümin (g/dL)] serum kalsiyumu (mmol/dL) Albümine göre düzeltilmiş serum kalsiyumunu mmol/L'yi mg/dL'ye çevirmek için 4 ile çarpınız. Çoğu vakada yüksek serum kalsiyum düzeyi normal sınırlara 7 günde indirilebilir. Nükse kadar geçen medyan süre (albümine göre düzeltilmiş serum kalsiyum düzeyinin 3 mmol/L'ninüzerine yeniden çıkması) 2 mg ve 4 mg dozlarda 18-19 gündür. Nükse kadar geçen medyansüre 6 mg'lık dozda 26 gündür. Sınırlı sayıda hasta (n=50) hiperkalsemi için ikinci bir infüzyon almıştır. Tekrarlayan hiperkalsemi durumunda veya yeterli etkinlik sağlanamadığında, tedavinin tekrarıdüşünülmelidir. Uygulama şekli:İskelet ile ilgili olayların önlenmesinde: Flakonların içeriği 100 ml izotonik sodyum klorür solüsyonuna veya 100 ml %5'lik dekstroz solüsyonuna ilave edilir ve en az 15 dakikada infüzeedilir. Tümor kaynaklı hiperkalsemi tedavisinde: GAUDİT, intravenöz infüzyon yoluyla uygulanmalıdır. Bu amaçla, flakonların içeriği 500 mL izotonik sodyum klorür solüsyonuna (veya 500 mL %5'lik dekstroz solüsyonu) eklenmeli ve 2 saatten uzun süre infüze edilmelidir. Hazırlanan solüsyonun dikkatsizce arter-içi uygulaması tavsiye edilmediği gibi, paravenöz uygulama da doku hasarına neden olabilir, GAUDİT'in intravenöz olarak uygulandığındanemin olmaya özen gösterilmelidir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/karaciğer yetmezliği:Hafif derecede böbrek yetmezliği (KI KRKRKR<30 mL/dak)aşağıdaki dozlama önerilerine uyulması gerekir (bkz. bölüm 5) 1
Kreatinin klerensi < 50 mL/dak olan kanser hastalarında 15 dakikalık infüzyon zamanı araştırılmamıştır. Karaciğer yetmezliği olan hastalarda doz ayarlamasının gerekli olmadığı beklenmektedir (bkz. bölüm 5.2). Pediyatrik popülasyon:Güvenlilik ve etkililik üzerine yeterli veri bulunmadığından, GAUDİT 18 yaşın altındaki hastalar için tavsiye edilmemektedir. Geriyatik popülasyon:Doz ayarlaması gerekli değildir. 4.3 KontrendikasyonlarGAUDİT hipokalsemide kontrendikedir (bkz. bölüm 4.4) GAUDİT ibandronik aside veya ilacın içerdiği diğer maddelerden herhangi birine aşırı duyarlılığı olduğu bilinen hastalarda kontrendikedir. Diğer bisfosfonatlara duyarlılığı olduğu bilinen hastalarda önlem alınmalıdır. GAUDİT çocuklarda kullanılmamalıdır. 4.4 Özel kullanım uyarıları ve önlemleriKlinik deneyim yokluğu nedeniyle GAUDİT çocuklarda kullanılmamalıdır. Meme kanserine bağlı kemik metastazı olan hastalarda yapılan randomize plasebo kontrollü klinik çalışmalar, uzun süreli GAUDİT tedavisi ile böbrek fonksiyonlarında herhangi birbozulma belirtisi göstermemiştir. Bununla birlikte, her bir hastanın klinik değerlendirmesinebağlı olarak, GAUDİT ile tedavi edilen hastalarda böbrek fonksiyonu, serum kalsiyum, fosfatve magnezyum seviyelerinin izlenmesi tavsiye edilir. Klinik veri bulunmadığından, ağır karaciğer yetmezliği olan hastalar için doz önerisi yapılamamaktadır. Kalp yetmezliği riski bulunan hastalarda aşırı hidratasyondan kaçınılmalıdır. Bifosfonat ile tedavi edilen hastalarda atipik bölgelerde (subtrokanterik ve femur şaft) kırıklar görülebilir. Bu kırıklar genellikle travma olmaksızın ya da minimal travma ile gelişmektedir.Bifosfonat kullanan ve uyluk ya da kasık ağrısı ile başvuran hastalar atipik kırık şüphesi iledeğerlendirilmelidir. Bu hastalarda bireysel risk/yarar analizine göre bifosfonat tedavisininkesilmesi gündeme gelebilir. 2 Metastatik kemik hastalığı için GAUDİT tedavisine başlanmadan önce, hipokalsemi ve diğer kemik ve mineral metabolizması bozuklukları etkin şekilde tedavi edilmelidir. Tüm hastalariçin, yeterli miktarda kalsiyum ve D vitamini alımı önemlidir. Günlük alımın yetersiz olduğudurumlarda, hastalar kalsiyum ve D vitamini desteği almalıdırlar. Hipokalsemi gelişebilir vehastanın serum kalsiyum düzeyleri buna göre ayarlanmalıdır. Primer olarak intravenöz uygulanan bisfosfonatlar dahil çeşitli tedavi rejimleri gören kanserli hastalarda, genellikle diş çekimi ve/veya lokal infeksiyonla (osteomiyelit dahil) ilişkili çeneosteonekrozu vakaları bildirilmiştir. Bu hastaların büyük çoğunluğu aynı zamanda kemoterapive kortikosteroidler de almıştır. Çene osteonekrozu, ayrıca oral bisfosfonatlarla tedavi edilenosteoporoz hastalarında da rapor edilmiştir. Beraberinde gelen risk faktörleri (örn. kanser, kemoterapi, radyoterapi, kortikosteroidler, zayıf oral hijyen) bulunan hastalarda, bisfosfonatlarla tedavi öncesinde uygun koruyucu diş hekimliğiile dental bir kontrol düşünülmelidir. Bu hastalar tedavi süresince, invaziv dental prosedürlerden eğer mümkünse kaçınmalıdır. Bisfosfonat tedavisi sırasında çene osteonekrozu gelişen hastalarda, dental ameliyat durumukötüleştirebilir. Dental prosedürlere ihtiyaç duyan hastalar için bisfosfonat tedavisininkesilmesinin çene osteonekrozu riskini azalttığına dair veri bulunmamaktadır. Tedaviyi yapanhekimin klinik kararı, tek tek yarar/risk değerlendirmesine dayanarak her hastanın tedavisineyol göstermelidir. Bu tıbbi ürün her mL'sinde 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani esasında sodyum içermez. İntravenöz ibandronik asit ile tedavi edilen hastalarda, ölümcül olabilen vakaları da içeren anafilaktik reaksiyon/şok vakaları rapor edilmiştir. GAUDİT intravenöz olarak uygulanacağı zaman uygun tıbbi destek ve gözlem koşullarının hazır bulundurulması gerekmektedir. Eğer anafilaktik veya diğer şiddetli hipersensitivitereaksiyonları meydana gelirse, infüzyon hemen kesilmeli ve uygun tedavi başlatılmalıdır. 4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriGAUDİT kalsiyum içeren solüsyonlarla karıştırılmamalıdır. Dispozisyonla ilişkili klinik olarak anlamlı bir ilaç etkileşimi bulunmamaktadır. İbandronik asit sadece renal sekresyon ile elimine edilir ve biyotransformasyona uğramaz. Sekresyonyollarının, diğer etkin maddelerin atılımında rol alan, bilinen asidik veya bazik transportsistemlerini içermediği gözlenir. Ayrıca, ibandronik asit major insan hepatik P450izoenzimlerini inhibe etmez ve sıçanlarda hepatik sitokrom P450 sistemlerini uyarmaz.Terapötik konsantrasyonlarda plazma proteinlerine bağlanma oranı yaklaşık %87'dir, bunedenle ibandronik asidin diğer etkin maddelerin yerini alma olasılığı düşüktür. Her iki ilaç da serum kalsiyum seviyelerini uzun süreli olarak düşürdüğünden, bisfosfonatlar aminoglikozidlerle birlikte uygulandığında önlem alınması tavsiye edilir. Olası simultane hipomagnezemi varlığına karşı ayrıca dikkatli olunmalıdır. 3 Klinik çalışmalarda GAUDİT, genel olarak kullanılan antikanser ilaçları, diüretikler, antibiyotikler ve analjezik ilaçlar ile birlikte klinik bir etkileşim meydana gelmedenuygulanmıştır. Etkileşim çalışmaları yalnızca yetişkinlerde yapılmıştır. Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlara ilişkin hiçbir etkileşim çalışması yürütülmemi ştir. Pediyatrik popülasyon:Pediyatrik popülasyona ilişkin hiçbir etkileşim çalışması yürütülmemi ştir. 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlarda ve doğum kontrolü (kontrasepsiyon) uygulayanlarda ilacın kullanımı yönünden bir öneri bulunmamaktadır. Gebelik dönemiİbandronik asidin gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Fareler üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. bölüm 5.3).İnsanlara yönelik potansiyel risk bilinmemektedir. GAUDİT gebelik döneminde kullanılmamalıdır. Laktasyon dönemiİbandronik asidin anne sütüne geçip geçmediği bilinmemektedir. Emziren sıçanlarda gerçekleştirilen çalışmalar, intravenöz uygulama sonrasında sütte düşük miktarlarda ibandronikasit varlığını göstermiştir. GAUDİT emziren annelerde kullanılmamalıdır. Üreme yeteneği/ FertiliteKlinik dışı çalışmalarda, GAUDİT verildiğinde, üreme performansı ve doğurganlık değerlendirme parametreleri etkilenmiştir (bkz. bölüm 5.3). 4.7 Araç ve makine kullanımı üzerindeki etkilerGAUDİT'ın araç ve makine kullanımı üzerine etkisi ile ilgili yapılmış herhangi bir çalışma bulunmamaktadır. 4.8 İstenmeyen etkilerGüvenlilik profilinin özetiİbandronatın güvenlilik profili, önerilen dozda ibandronatın intravenöz uygulaması için onaylanmış endikasyonlarda yapılan kontrollü klinik çalışmalardan ve pazarlama sonrasıdeneyimlerden elde edilmiştir. Tümör kaynaklı hiperkalsemi tedavisi çok yaygın olarak vücut sıcaklığında artış ile ilişkilendirilmiştir. Yaygın olmayan vakalarda serum kalsiyum seviyesi normal seviyenin 5altında gözlenmiştir. Çoğu vakada özel bir tedaviye gerek kalmadan birkaç saat veya gün sonra belirtiler kaybolmuştur. Meme kanseri ve kemik metastazları olan hastalarda iskelet olaylarının önlenmesinde, tedavi çok yaygın olarak asteniyi takip eden vücut sıcaklığında artış ve baş ağrısı ileilişkilendirilmiştir. Advers olayların tablo şeklinde listesiTablo 1, pivotal faz III çalışmaları (Tümör kaynaklı hiperkalsemi tedavisinde: 311 hastaya ibandronat 2 mg veya 4 mg uygulanmıştır; kemik metastazlı meme kanseri hastalarında iskeletile ilişkili olaylarının önlenmesi: 152 hastaya 6 mg ibandronat uygulanmıştır) ve pazarlamasonrası deneyimlerde oluşan advers reaksiyonları listelemektedir. Tablo 1 İbandronatın İntravenöz Uygulaması İçin Bildirilen Advers İlaç ReaksiyonlarıAdvers reaksiyonlar MedDRA sistem organ sınıfına ve sıklığa göre listelenmektedir. Aşağıdaki sıklık kategorileri kullanılmıştır: çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan(>1/1000 ila <1/100); seyrek (>1/10.000 ila <1/1000); çok seyrek (<1/10.000), bilinmiyor (eldekiverilerden hareketle tahmin edilemiyor). Her sıklık grubunda advers reaksiyonlar azalan şiddete göresunulmaktadır.
7Belli advers reaksiyonların tanımıHipokalsemiBöbreklerden kalsiyum atılımındaki azalmaya, serum fosfat düzeylerinde terapötik tedbirler gerektirmeyen bir azalma eşlik edebilir. Serum kalsiyum düzeyi hipokalemik değerlereazalabilir. Grip benzeri hastalıkAteş, titreme, kemik ve / veya kas ağrısı benzeri ağrıdan oluşan grip benzeri sendrom görülmüştür. Çoğu durumda özel bir tedavi gerektirmez ve semptomlar birkaç saat / birkaç günsonra kendiliğinden iyileşir. Çene osteonekrozuBisfosfonatlarla tedavi edilen hastalarda çene osteonekrozu vakaları rapor edilmiştir. Bu vakalar çoğunlukla kanser hastalarında görülmekle birlikte, bazıları da postmenopozalosteoporoz hastalarında görülmüştür. Çene osteonekrozu genellikle diş çekimi ve/veya lokalinfeksiyonla (osteomiyelit dahil) ilişkilidir. Kanser teşhisi, kemoterapi, radyoterapi,kortikosteroidler ve zayıf oral hijyen de bilinen risk faktörleridir (bkz. bölüm 4.4). Oküler inflamasyonİbandronik asit kullanımıyla üveit, episklerit ve sklerit gibi göz inflamasyonu olayları bildirilmiştir. Bazı vakalarda bu olaylar ibandronik asit sonlandırılana kadar ortadankalkmamıştır. Anafilaktik reaksiyon/şokİntravenöz ibandronik asit ile tedavi uygulanan hastalarda ölümcül olaylar dahil anafilaktik reaksiyon/şok vakaları bildirilmiştir. Astım alevlenmesini içeren alerjik reaksiyonlar rapor edilmiştir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr[email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99).4.9 Doz aşımı ve tedavisiGAUDİT ile hiçbir doz aşımı vakası bildirilmemiştir. Bugüne kadar ibandronat ile akut zehirlenme vakaları bildirilmemiştir. Böbrekler ve karaciğer yüksek dozla yapılan preklinik çalışmalarda toksisite için hedef organlar olduğundan, böbrekve karaciğer fonksiyonları takip edilmelidir. 8Klinik açıdan ilişkili hipokalsemi, intravenöz kalsiyum glukonat uygulamasıyla iyileştirilmelidir. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grubu: Bisfosfonatlar ATC kodu: M05BA06 İbandronik asidin farmakodinamik etkisi, kemik rezorpsiyonunun inhibisyonudur. Deneysel in-vivo çalışmalarda ibandronik asit, gonadal fonksiyonun durması, retinoidler ve tümor ya da tümör kaynaklı ürünlerin sebep olduğu deneysel uyarımlı kemik hasarını engellemiştir. Genç(hızlı büyüyen) sıçanlarda da endojen kemik rezorpsiyonu inhibe edilmiştir, bu da tedaviedilmeyen hayvanlara kıyasla artan normal kemik kütlesiyle sonuçlanmıştır. Hayvan modelleri, ibandronik asidin osteoklastik etkinliğin son derecede güçlü bir inhibitörü olduğunu doğrulamaktadır. Gelişmekte olan sıçanlarda, tümörle ilgili osteoliz tedavisiningerektirdiği dozun 500 katı olan dozlarda bile mineralizasyon bozulmamıştır. Metastatik kemik hastalığının hayvan modellerinde ibandronik asit, yeni kemik metastazlarının gelişmesini önlemenin yanı sıra, insan meme kanseri hücreleri tarafından başlatılan henüzoluşmuş metastazların progresyonunu da baskılamıştır. Direkt anti tümör etki in vitro olarak veimmün sistemi baskılanmış sıçanlarda da gösterilmiştir. İntraossöz Walker tümör modelinde,ibandronik asit ile trabeküler bütünlüğün ve kortikal kemiğin dramatik rezorpsiyonu tamameninhibe edilmektedir. İbandronik asit ayrıca subkutan modelde, hiperkalsüriyi inhibe etmiştir. Bu etkiler direkt olarak osteoklast sayısındaki değişiklikler ve üriner kemik rezorpsiyonu belirteçleri ile korelasyonhalindedir. MCF-7 fare modelinde osteosklerotik metastazların azalması ile de gösterildiği gibi,tüm modellerde tedavi ne kadar erken başlatılırsa tüm faydalı etkiler o kadar belirginolmaktadır. Anti metastatik özellikler, kemik matriksinden salınan osteoklast kaynaklı tümörbüyüme faktörlerinin azalması ile açıklanabilir. Yapılan in vitro çalışmalarda kemikparçalarının ibandronik asit ile ön tedavisinin, tümör hücrelerinin bağlanması ve yayılmasıkadar invazyonlarını da inhibe ettiği görülmüştür. Tedavi edilmemiş kemik parçalarına tümörhücreleri ile birlikte eklendiğinde ibandronik asit, taksoidler gibi sitotoksik ajanlarla birlikteilave etkinlik göstermiştir. Metastatik kemik hastalığı olan hastalarla yapılan çalışmalar, kemik rezorpsiyonu markerleri ile kendini gösteren kemik osteolizi üzerine doza bağlı bir inhibitör etkinin ve iskeletkomplikasyonları üzerinde de doza bağlı bir etkinin olduğunu göstermektedir. Tümör kaynaklı hiperkalsemisi bulunan hastalarla yapılan çalışmalar, ibandronik asidin tümör kaynaklı osteoliz ve özellikle tümör kaynaklı hiperkalsemi üzerine olan inhibitör etkisinin,serum kalsiyumundaki düşüşve üriner kalsiyum atılımı ile karakterize olduğunugöstermektedir. Etki Mekanizmasıİbandronik asit, kemik dokusu üzerinde etkili olan ve spesifik olarak osteoklast etkinliğini inhibe eden, bisfosfonatların azot içeren grubuna ait olan çok güçlü bir bisfosfonattır. 9Osteoklastların toplanmasını etkilemez. İbandronik asidin kemik dokusu üzerindeki seçici etkisi, bu bileşiğin kemiğin mineral matriksini temsil eden hidroksiapatit için olan yüksekafinitesine dayanmaktadır. İbandronik asit kemik oluşumu üzerinde doğrudan bir etkisi olmaksızın kemik rezorpsiyonunu azaltır. Malign hastalığa bağlı olarak gerçekleşen kemik rezorpsiyonu, uygun kemik oluşumu ile dengelenemeyen aşırı kemik rezorpsiyonu ile karakterizedir. İbandronik asit osteoklastaktivitesini selektif olarak inhibe ederek kemik rezorpsiyonunu azaltır ve böylece malignhastalığa bağlı olarak görülen iskelet komplikasyonlarını azaltır. Klinik/ Etkinlik çalışmalarıKemik metastazlı meme kanseri hastalarındaki iskelet ile ilgili olayların önlenmesinde yapılan klinik çalışmalar Meme kanseri olan hastalardaki metastatik kemik hastalığının GAUDİT ile tedavisi 96 haftalık randomize plasebo kontrollü faz III çalışma ile değerlendirilmiştir. Meme kanserli ve radyolojik olarak kanıtlanmış kemik metastazı olan kadın hastalar, plasebo (158 hasta) veya 6 mg i.v. GAUDİT (154 hasta) alacak şekilde randomize edilmişlerdir. Çalışmanın birincil sonlanım noktası, periyodik iskelet ile ilişkili olay oranıdır (SMPR) ve bu da, çalışmanın alt kollarından olan aşağıdaki iskelet ile ilgili olayları (SRE) içeren bir bileşiksonlanım noktasıdır; -Kemiğe radyoterapi -Kırıkların tedavisi için kemik ameliyatı -Vertebral kırıklar -Vertebral olmayan kırıklar SMPR analizleri zamana bağlı olup 12 haftalık tek bir periyot içinde oluşan bir veya daha fazla olayın potansiyel olarak birbiriyle ilgili olabileceği düşüncesinden kaynaklanmaktadır. Bunedenle verilen herhangi bir 12 haftalık periyot içinde gerçekleşen birden fazla sayıdaki olaylar,tek bir olay olarak hesaplanmıştır. Bu çalışmadan elde edilen veriler 6 mg GAUDİT i.v.' nin plaseboya oranla zamana bağlı iskelet hasarlanma oranı (SMPR) ile ölçülen iskeletle ilgili olayların (SRE) azalmasında önemli biravantaj sağladığını göstermiştir (p= 0.004). Ayrıca iskeletle ilgili olay sayısı da GAUDİT ileanlamlı bir düşüşe neden olmuştur ve plaseboya oranla iskelet ilgili olay riskinde %40 azalmameydana gelmiştir (ilgili risk 0.6, p= 0.003). Etkinlik sonuçları Tablo-2'de özetlenmiştir.
İkincil sonlanım noktaları, kemik ağrısı ölçümü, yaşam kalitesi ve idrardaki kemik rezorpsiyonu belirteçlerinin ölçülmesini içermektedir. Plasebo ile karşılaştırıldığında, 6 mg i.v. GAUDİT uygulamasının kemik ağrılarında istatistiksel olarak belirgin bir iyileşme sağladığı gösterilmiştir. Tüm çalışma boyunca ağrı altsınırın altına düşmüştür ve bu düşüşe analjezik ihtiyacında anlamlı bir azalma eşlik etmiştir.Plasebo ile karşılaştırıldığında, GAUDİT ile tedavi edilen hastalarda yaşam kalitesindekikötüleşme de belirgin olarak azalmıştır. Bu ikincil etkinlik sonlanım noktalarının sonuçlarıTablo-3'de özetlenmiştir. Tablo 3 İkincil etkinlik sonuçları (metastatik kemik hastalığı olan meme kanserli hastalar)
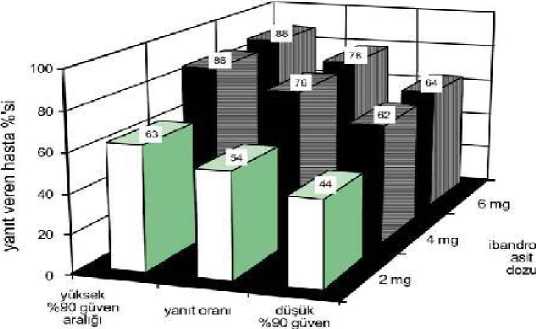
Plasebo ile karşılaştırıldığında, GAUDİT ile tedavi edilen hastalarda, kemik rezorbsiyonunun üriner işaretlerinde (piridinolin ve deoksipiridinolin), istatistiksel olarak anlamlı olacak şekilde,belirgin bir azalma söz konusudur. Metastatik meme kanserli 130 hastanın katıldığı bir çalışmada, 1 saat veya 15 dakika infüze edilen GAUDİT'in güvenliliği karşılaştırılmıştır. Renal fonksiyon göstergelerinde herhangi birdeğişiklik gözlenmemiştir. 15 dakikalık infüzyon sonrası ibandronik asidin genel advers olayprofili, uzun süreli infüzyon zamanlarında bilinen güvenlilik profili ile tutarlıdır ve 15 dakikalıkinfüzyon zamanının kullanımı ile ilgili herhangi bir yeni güvenlilik konusu tespit edilmemiştir. Kreatinin klerensi 50 mL/dak'nın altında olan kanser hastalarında, 15 dakikalık infüzyon zamanı araştırılmamıştır. Tümöre bağlı oluşan hiperkalsemi tedavisinde yapılan klinik çalışmalar Malign hiperkalsemide tümöre bağlı oluşan hiperkalsemi hastalarında yapılan klinik çalışmalarda, tümöre bağlı oluşan osteoliz ve spesifik olarak tümöre bağlı oluşanhiperkalsemiye karşı ibandronik asidin inhibitör etkisinin, serum kalsiyumunda ve ürinerkalsiyum atılımında düşüşle karakterize olduğu görülmüştür. Tedavi için önerilen doz aralığında, yeterli rehidratasyon sonrası, albumine göre düzeltilmiş serum kalsiyum alt sınırı > 3 mmol/L olan hastalarda yapılan çalışmalarda gözlenen güvenaralıkları ile birlikte yanıt oranları aşağıda açıklanmıştır: 11
Bu hastalar ve dozlarla, normokalsemiye ulaşmak için gereken medyan süre 4-7 gündür. Nükse kadar geçen ortalama süre (albumine göre düzeltilmiş serum kalsiyumunun tekrar 3mmol/L'nin üstüne çıkması) ise 18-26 gündür. 5.2 Farmakokinetik özelliklerGenel özelliklerİki saat boyunca süren 2, 4 ve 6 mg ibandronik asit infüzyonu sonrasında farmakokinetik özellikler dozla orantılı olmuştur. Emilim:İntravenöz infüzyon ile uygulandığı için geçerli değildir. Dağılım:İlk sistemik maruziyet sonrası, ibandronik asit hızla kemiğe bağlanır veya idrarla atılır. İnsanlarda görülen terminal dağılım hacmi en az 90 L'dir ve kemiğe ulaşan dozun, dolaşımdakidozun %40-50'si olduğu tahmin edilmektedir. İnsan plazmasındaki proteinlere bağlanma oranıterapötik konsantrasyonlarda yaklaşık %87'dir ve bu nedenle yer değiştirmeye bağlı olarakortaya çıkan ilaç-ilaç etkileşim potansiyeli düşüktür. Biyotransformasyon:İbandronik asidin hayvanlarda veya insanlarda metabolize olduğuna dair bir kanıt bulunmamaktadır. Eliminasyon:İbandronik asidin sistemik dolaşımdaki kısmı dolaşımdan kemik dokusuna absorbe edilerek dolaşımdan uzaklaştırılır (%40-50). Geri kalan kısmı değişmemiş olarak böbrek yoluyla atılır.İbandronik asidin absorbe edilmeyen kısmı feçes ile değişmemiş olarak atılır. Gözlenen yarı ömür aralığı geniştir ve doz ile kişinin duyarlılığına bağlıdır; ancak görünen terminal yarı ömür genellikle 10-60 saat aralığındadır. Bununla birlikte, başlangıçtaki plazmaseviyeleri hızla düşerek, intravenöz veya oral uygulamadan sonra sırasıyla 3 ila 8 saat içindedoruk değerlerin %10'una ulaşır. Metastatik kemik hastalığı olan hastalara, 48 hafta boyunca,4 haftada bir ibandronik asit intravenöz infüzyon uygulandığında, sistemik akümülasyongözlenmemiştir. 12İbandronik asidin total klerensi düşüktür ve ortalama değerleri 84-160 mL/dak aralığındadır. Renal klerens (postmenopozal sağlıklı kadınlarda yaklaşık 60 mL/dak), total klerensin %50-60'ı kadardır ve kreatinin klerensi ile ilişkilidir. Görünen total ve renal klerens arasındakifarkın, kemik tarafından alınan miktarı yansıttığı düşünülmektedir. Doğrusallık/doğrusal olmayan durum:100 mg'lık oral doz ve 6 mg'lık intravenöz doza kadar, ibandronik asidin plazma konsantrasyonları doza bağlı olarak artar. Hastalardaki karakteristik özelliklerCinsiyet:İbandronik asidin erkekler ve kadınlardaki biyoyararlanımı ve farmakokinetiği benzerdir. Irk:Asyalılar ve beyaz ırk arasında ibandronik asidin dağılımında klinik olarak ilişkili interetnik farklılıklarla ilgili bir kanıta rastlanmamıştır. Afrika kökenli hastalarla ilgili çok az verimevcuttur. Böbrek yetmezliği olan hastalar:Farklı derecelerde böbrek yetmezliği olan hastalarda, ibandronik asit maruziyeti kreatinin klerensi (KlKR) ile ilişkilidir. Ciddi böbrek yetmezliği olan (ortalama tahmini KI KRKRKRKRKRKRKR<30 mL/dak)dozda ayarlama yapılması önerilir (bkz. bölüm 4.2).Standart 4 saatlik bir hemodiyaliz prosedüründe ibandronatın yaklaşık %37'si vücuttan temizlenmiştir. Karaciğer yetmezliği olan hastalar:Karaciğer yetmezliği olan hastalarda, ibandronik asidin farmakokinetiğine dair veri bulunmamaktadır. İbandronik asit metabolize olmadığı, fakat renal atılım ve kemiğe alım yoluile temizlendiği için, karaciğerin ibandronik asidin klerensinde belirgin bir rolübulunmamaktadır. Bu nedenle, karaciğer yetmezliği olan hastalarda doz ayarlaması gereklideğildir. Terapötik konsantrasyonlarda ibandronik asidin proteine bağlanma oranı yaklaşık %87'dir, bu sebeple şiddetli karaciğer hastalığında gözlenen hipoproteineminin, serbest plazmakonsantrasyonlarında klinik olarak anlamlı artışlara yol açması mümkün değildir. 13Geriyatrik popülasyon:Çok değişkenli bir analizde yaşın, çalışılan farmakokinetik parametrelerin herhangi birinin bağımsız bir faktörü olduğu bulunmamıştır. Renal fonksiyon yaşla birlikte zayıfladığındandikkate alınması gereken tek faktör budur. Pediyatrik popülasyon:18 yaşından küçük hastalarda, GAUDİT'ın kullanımına ilişkin veri bulunmamaktadır. 5.3 Klinik öncesi güvenlilik verileriKlinik dışı çalışmalarda klinik kullanımla düşük bağlantı olasılığını işaret eder şekilde, hayvanlardaki toksik etki maksimum insan maruziyetinin aşıldığı dozlarda görülmüştür. Diğerbisfosfonatlarla olduğu gibi, sistemik toksisitenin ilk hedef organı böbrek olarak tespitedilmiştir. Karsinojenite Karsinojenik potansiyele dair hiçbir belirti görülmemiştir. Mutajenite Genotoksisite testleri sonucunda ibandronik asidin genotoksik potansiyeli olduğuna dair kanıt bulunamamıştır. Üreme toksisitesi Fertilite çalışmalarında, 1.2 mg/kg/gün i.v. ibandronik asit dişi sıçanlarda üreme yeteneğini bozacak etkiler göstermiş, 1.0-16.0 mg/kg/gün oral dozlarda ve 1.2 mg/kg/gün i.v. dozlarda daimplantasyon bölgelerinin sayısında düşüşe neden olmuştur. Teratojenite Oral veya intravenöz olarak tedavi edilen sıçan ve tavşanlarda ibandronik asit için direkt fetal toksisite veya teratojenik etki gözlenmemiştir. Diğer İbandronik asidin, üreme toksisitesi çalışmalarında sıçanlarda görülen yan etkileri, bisfosfonatlar sınıfında beklenen yan etkilerdir. Bunlar F1 yeni doğan sıçanlarda, implantasyonbölgelerinin sayısında düşüş, normal doğum güçlüğü (distosi), viseral varyasyonlarda artış(renal pelvis üreter sendromu) ve diş anormalliklerini içermektedir. 6. FARMASÖTİK ÖZELLİKLERİ6.1 Yardımcı maddelerin listesiSodyum klorür Glasiyal Asetik asit (%100) Sodyum asetat trihidrat Enjeksiyonluk su 6.2 GeçimsizliklerPotansiyel geçimsizlikleri önlemek için, GAUDİT infüzyon konsantresi yanlızca izotonik sodyum klorür solüsyonu veya %5'lik dekstroz solüsyonu ile seyreltilmelidir. GAUDİTkalsiyum içeren solüsyonlarla karıştırılmamalıdır. 146.3 Raf ömrü24 ay. Seyreltildikten sonra: Ürünü içeren infüzyon solüsyonu 24 saat süresince kimyasal ve fiziksel olarak stabildir (25°C'nin altındaki oda sıcaklığında saklayınız). Mikrobiyolojik açıdan, intravenöz infüzyon solüsyon anında kullanılmalıdır. Hemen kullanılamadığı durumlarda, kullanımdan önceki saklama koşulu ve zamanı, kullanan kişininsorumluluğundadır. Seyreltme kontrollü ve valide edilmiş aseptik şartlarda gerçekleşmediğisürece, kullanıma kadar geçen süre 2-8°C'de 24 saatin üzerinde olmamalıdır. 6.4 Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında saklayınız. Kullanıma hazır hale getirilen ürünün saklama koşulu için 6.3'e bakınız. 6.5 Ambalajın niteliğve içeriğiGAUDİT 6 mg/6 mL i.v. infüzyon için konsantre çözelti içeren flakon, Tip I cam flakon, 1 adet. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerGAUDİT sadece tek kullanım içindir. Yalnızca partikülsüz, berrak çözeltiler kullanılmalıdır. GAUDİT'in intravenöz kullanma talimatlarına sıkı bir şekilde uyulmalıdır. Kullanılmayan çözelti atılmalıdır. Farmasötik ürünlerin çevreye bırakılmasından kaçınılmalıdır. İlaçlar, atık suları ve evsel atık ile imha edilmemelidir. Varsa bulunduğunuz yerdeki donanımlı atık toplama sistemlerinikullanınız. Kullanılmamış olan ürünler ya da atık materyaller 'Tıbbi ürünlerin kontrolü yönetmeliği' ve 'Ambalaj Atıklarının Kontrolü yönetmelikleri'ne uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİPolpharma Sağlık Ürünleri San. ve Tic. A.Ş. Dikilitaş Mah. Prof. Dr. Bülent Tarcan Cad. No: 5 Pak İş Mrk. K:8 Beşiktaş/Gayrettepe/İstanbul 8. RUHSAT NUMARASI2016/585 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 05.08.2016 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ151
|
İlaç BilgileriGaudit 6 Mg/6 Ml İ.v. İnfüzyon İçin Konsantre Çözelti İçeren FlakonEtken Maddesi: İbandronat Sodyum Monohidrat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.