Biosfar 100/6 Mcg Aerosol İnhalasyon Çözeltisi Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1- BEŞERİ TIBBİ ÜRÜNÜN ADIBİOSFAR® 100/6 mcg aerosol inhalasyon çözeltisi 2- KALİTATİF VE KANTİTATİF BİLEŞİMEtkin maddeler:Her bir ölçülü doz; Beklometazon dipropiyonat (BDP).............................100 mcg (84,6 mcg aktarılan doz) Formoterol fumarat dihidrat.....................................6 mcg (5,0 mcg aktarılan doz) içerir. Yardımcı madde:Susuz etanol......................................................6.960 mg Yardımcı maddeler için 6.1'e bakınız. 3- FARMASÖTİK FORMHFA Modulite® Teknolojili Aerosol İnhalasyon Çözeltisi'dir. Çözelti renksiz veya hafif sarımsı görünümlüdür. 4- KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarUzun etkili beta-2-agonisti+inhale kortikosteroid kombinasyonları ile tedavilerde olduğu üzere BİOSFAR, astım semptomlarının düzeltilmesi ve kontrol altına alınması amacıyla astımhastalığının basamaklı tedavisinde 3. basamaktan itibaren ve orta- ağır şiddetli KOAH'ınsemptomlarının ve atak sıklığının azaltılmasında endikedir. 4.2 Pozoloji ve uygulama şekliPozoloji:BİOSFAR inhalasyon yoluyla kullanım içindir. BİOSFAR astımın başlangıç tedavisi yönetimine yönelik değildir. BİOSFAR'ın içerdiği bileşenlerin dozları farklı olduğu için ilaç, hastalığın şiddetine göre ayarlanmalıdır. Buyalnızca fiks doz kombinasyon ilaçları ile tedaviye başlandığı zaman değil aynı zamanda, dozayarlamasının yapıldığı durumda da dikkate alınmalıdır. Eğer bir hastada kombinasyoninhalerde mevcut olan kombinasyon dozlarından daha farklı bir doz kombinasyonu gerekirse,farklı inhalerlerdeki uygun beta 2-agonist ve/veya kortikosteroid dozları reçete edilmelidir.BİOSFAR içerisindeki beklometazon dipropiyonat ekstra ince partikül boyutu dağılımı ile tanımlanmaktadır ve bu ekstra ince partikül boyutu dağılımına sahip olmayan beklometazondipropiyonata göre daha güçlü etki göstermektedir (BİOSFAR içerisindeki 100 mikrogramekstra ince beklometzon dipropiyonat, 250 mikrogram ekstra ince olmayan beklometazondipropiyonata eşdeğerdir). Bu nedenle, BİOSFAR için günlük uygulanan beklometazondipropiyonat miktarı, ekstra ince olmayan beklometazon dipropiyonatın günlük toplammiktarından düşük olmalıdır. Sayfa 1/16 Uygulama sıklığı ve süresi:Astım tedavisinde BİOSFAR; 18 yaştan itibaren yetişkinler ve yaşlılarda; 1) Astım belirtilerini düzeltmek ve kontrol altına almak amacı ile olağan doz uygulaması; Astım semptomlarının şiddetine göre olağan doz günde iki kez bir puftur. Maksimum günlük doz 4 puftur. 2) Astım belirtilerinin aniden kötüleşmesinde rahatlatıcı amaçla ve astım kontrolünü amaçlayan düzenli tedavide; Astım belirtileriniz kötüleşirse 1 puf soluyunuz ve birkaç dakika bekleyiniz. Eğer kendinizi iyi hissetmezseniz 1 puf daha soluyunuz. Rahatlatıcı amaçla günde 6 puftan fazla dozsolumayınız. Astımınızın kontrol altında bulunmasını sağlayan olağan BİOSFAR dozunuzu doktorunuz reçetelediği şekilde düzenli olarak kullanınız. Astım belirtilerinizin kontrolü için daha fazla BİOSFAR dozuna ihtiyaç duyuyorsanız doktorunuzla konuşunuz, bu durumda tedavinizin değiştirilmesi gerekebilir. İnhaler tedavilerde oluşabilen paradoksal bronkospazm'a karşı kısa etkili rahatlatıcı nızı daima yanınızda bulundurunuz. KOAH (Kronik Obstrüktif Akciğer Hastalığı) tedavisinde BİOSFAR; 18 yaştan itibaren yetişkin ve yaşlılarda BİOSFAR, günde iki kez 2'şer puf, toplam 4 puf uygulanır. BİOSFAR'ın maksimum günlük dozu 8 puftur. Uygulama şekli:İlacın uygun kullanılması için, hastaya zaman zaman bir doktor veya başka sağlık personeli tarafından inhalerin nasıl kullanılacağı gösterilmelidir. İnhaler ilk kez kullanılacağı zaman ve 14 günden daha fazla bir süre kullanılmadığında hatasız işlev için havaya bir kez sıkım yapılmalıdır. İnhalasyon esnasında hasta mümkün iseoturmalı ya da ayakta dik durmalıdır. Dozajın uygun bir şekilde devam etmesi için hastalar düzenli olarak bir doktor tarafından değerlendirilmeli ve sadece tıbbi öneriye göre değiştirilmelidir. Tedavi dozu, semptomlarınetkili biçimde kontrol altına alındığı en düşük doza düşürülmelidir. Semptomlar en düşükdozla kontrol altına alındığında bir sonraki adım, tek başına inhale edilen kortikosteroidintestini içermelidir. Hastalara asemptomatik olduklarında dahi BİOSFAR'ı hergün almalarıkonusunda bilgi verilmelidir. Sayfa 2/16 Özel popülasyonlara ilişkin ek bilgiler:Böbrek/ Karaciğer yetmezliği:BİOSFAR kullanımına ilişkin veri bulunmamaktadır. (bakınız bölüm 5.2). Pediyatrik popülasyon:BİOSFAR'ın güvenliliği ve etkinliği 18 yaşın altındaki çocuklar ve adolesanlar için henüz kanıtlanmamıştır. 12 ve 17 yaş arasındaki adolesanlar için sınırlı veri mevcuttur. Bu nedenle,12 yaşın altındaki çocuklar ve 12 ve 17 yaş arasındaki adolesanlarda kullanımı daha fazla verisağlanana kadar önerilmemektedir. Geriyatrik popülasyon:Yaşlılarda doz ayarlanması gerekli değildir. 4.3 KontrendikasyonlarBeklometazon dipropiyonat, formoterol fumarat dihidrat ve/veya ürün içeriğindeki herhangi maddelerden birine karşı bilinen aşırı duyarlılık halinde BİOSFAR kontrendikedir. 4.4 Özel kullanım uyarıları ve önlemleriBİOSFAR üçüncü derece atriyoventriküler bloğu ve taşikardilerde (hızlanmış ve/veya düzensiz kalp atımı), idiyopatik subvalvüler aort stenozu, hipertrofik obstrüktifkardiyomiyopati, ağır kalp hastalığı, özellikle miyokard infarktüsü, koroner kalp hastalığı,konjestif kalp yetmezliği, tıkayıcı damar hastalıkları, özellikle arteriyoskleroz, arteriyelhipertansiyon ve anevrizmayı içeren kardiyak aritmilerde, hipertiroidizm, özellikletirotoksikoz, hastalarında dikkatle kullanılmalıdır. Bilinen veya şüpheli konjenital veya ilacabağlıQTc aralığı (QTc > 0.44 saniye) uzamış hastaların tedavisi esnasında dikkatli olunmalıdır. BİOSFAR taşikardik aritmisi bulunan hastalarda (hızlanmış ve/veya düzensiz kalp atımı) yalnızca özel önlemler alınarak (örn. hasta monitorizasyonu) kullanılabilir.Formoterol'ün kendisi de QTc aralığını uzatabilir. BİOSFAR tirotoksikoz, feokromositoma ve tedavi edilmemiş hipokalemi hastalarında dikkatle kullanılmalıdır. Beta 2-agonist tedavisi potansiyel olarak ciddi hipokalemiye neden olabilir. Bu etki hipoksiyi potansiyalize edebileceği için şiddetli astım tedavisinde özel dikkat gösterilmesi ve eş zamanlıtedavi önerilmektedir (bakınız bölüm 4.5). Bu gibi durumlarda serum potasyum düzeylerininmonitorize edilmesi önerilmektedir. Rahatlatıcı bronkodilatörlerin kullanabildiği kararsızastımda da özel dikkat gerekmektedir.Yüksek dozda formoterol inhalasyonu kan şekeri düzeyinde artışa neden olabilir. Bu nedenle diyabetiklerde bu parametre yakından izlenmelidir. Halojenli anestezikler ile anestezi planlandığında, kardiyak aritmi riski nedeniyle anestezi başlamadan en az 12 saat öncesinde BİOSFAR kullanılmadığından emin olmak gereklidir. Kortikosteroid içeren tüm inhale ilaçlar gibi BİOSFAR'da aktif veya latent pulmoner tüberkülozu olan ve solunum yollarında fungal ve viral enfeksiyonları olan hastalarda dikkatliolarak uygulanmalıdır. BİOSFAR'ın ani olarak kesilmemesi önerilmektedir. Sayfa 3/16 Hasta tedaviyi etkisiz buluyorsa tıbbi olarak dikkat gösterilmelidir. Kısa etkili rahatlatıcı etkili bronkodilatörlerin kullanımındaki artış, hastalığın kötüleştiğini gösterir ve astım tedavisininyeniden değerlendirilmesini gerektirir. Astım kontrolündeki ani ve artan seyirdeki kötüleşmepotansiyel olarak yaşamı tehdit edicidir ve tedavi modifikasyonu için hasta acil tıbbideğerlendirmeden geçmelidir. Oral ya da inhale kortikosteroid tedavisine ihtiyacın artmasıdurumunda dikkat gösterilmelidir veya enfeksiyon şüphesi var ise antibiyotik tedavisibaşlanmalıdır. Alevlenme durumunda veya belirgin şekilde kötüleşmiş akut astım atakları var olan hastalarda BİOSFAR ile tedaviye başlanmamalıdır. Eğer astım semptomları düzelmez veya BİOSFAR ile tedaviye başladıktan sonra kötüleşir ise hastalar tedavilerine devam etmeliancak tıbbi yardım almaları konusunda uyarılmalıdır. Diğer inhalasyon tedavilerinde olduğu gibi doz uygulaması sonrasında hışıltıda hemen bir artış ile paradoksal bronkospazm oluşabilir. Bu durumda BİOSFAR kullanımı derhalkesilmelidir, hasta tekrar değerlendirilmeli ve gerekli ise alternatif tedavi uygulanmalıdır. Akut astım ataklarının tedavisi için hastaların BİOSFAR'ı ve/veya hızlı etkili bronkodilatörlerini sürekli yanlarında bulundurmaları önerilir. Asemptomatik durumlarda da reçete edildiği üzere hastanın BİOSFAR'ı düzenli olarak her gün alması önerilir. BİOSFAR'ın rahatlatıcı inhalasyonu, kötüleşen astım semptomlarındakullanım içindir. Ayrı bir hızlı etkili bronkodilatör kullanım gerekliliği her zaman göz önündebulundurulmalıdır. Astım semptomları bir kez kontrol altına alındıktan sonra BİOSFAR dozunun zamanla azaltılması göz önünde bulundurulmalıdır. Tedavide hastaların düzenli kontrolü önemlidir.Kontrol altına alınan astımda BİOSFAR'ın minimum etkili dozu kullanılmalıdır (bakınızbölüm 4.2). İnhale kortikosteroidler, özellikle uzun süreli ve yüksek dozlarda reçete edildiklerinde sistemik etkiler oluşturabilirler. Bu etkilerin görülme olasılığı oral kortikosteroidlere nazaraninhale kortikosteroidler ile çok daha düşüktür. Olası sistemik etkiler şunlardır: Cushingsendromu, adrenal baskılanma, kemik mineral yoğunluğunda azalma, çocuk ve ergenlerdebüyüme geriliği, katarakt ve glokom ve daha seyrek olarak fizikomotor hiperaktivitesi, uykubozukluğu, anksiyete, depresyon veya saldırganlık (özellikle çocuklarda) da içeren çeşitlipsikolojik ve davranışsal etkiler. Bu nedenle, tedavi altındaki hastanın düzenli olarakkontrolü ve inhale kortikosteroid dozunun, astımın etkin olarak kontrolünün sağlandığıen düşük doza düşürülmesi önemlidir.İnhale kortikosteroidler ile yüksek dozlarda uzun süreli tedavi, adrenal baskılanma ve akut adrenal krize neden olabilir. Önerilenden yüksek doz beklometazon dipropiyonat inhale eden18 yaşından küçük çocuklar risk altında olabilirler. Akut adrenal krizi tetikleyebilecekpotansiyel durumlar travma, ameliyat, ciddi enfeksiyon ve dozun hızla azaltılmasıdır. Oluşansemptomlar çok belirgin olmamakla beraber iştahsızlık, karın ağrısı, kilo kaybı, yorgunluk,baş ağrısı, bulantı, kusma, hipotansiyon, bilinç düzeyinde azalma, hipoglisemi ve/veyakonvülsiyonları içerebilir. Stres ve elektif cerrahi sırasında ilave sistemik kortikosteroidverilmesi düşünülmelidir. Sayfa 4/16 Özellikle daha önceki sistemik steroid tedavisi nedeni ile adrenal fonksiyonun bozulmuş olduğudüşünülüyorsa, bu grup hastalar BİOSFAR tedavisine geçirilirken dikkatli olunmalıdır. Oral kortikosteroidlerden inhale steroidlere geçen hastalar oldukça uzun bir zaman adrenal rezerv eksikliği riski altında kalırlar. Geçmişte, yüksek doz acil kortikosteroid tedavisi gerekliolmuş hastalar da risk altında olabilirler. Bu bozukluk olasılığı strese neden olabilecek acil veelektif durumlarda daima akılda bulundurulmalıdır ve uygun kortikosteroid tedavisiuygulanmalıdır. Adrenal bozukluğunun derecesi elektif işlemlerden önce uzman tavsiyesinigerektirebilir. Uzun etkili beta agonist preparatlarına bağlı olarak nadiren, ciddi ve bazen ölümcül olabilen astım ile ilişkili solunum problemleri meydana gelebilir. BİOSFAR az miktarda susuz etanol içerir (her doz başına 6,96 mg); ve uygulanan dozlarda hastalar için risk oluşturmaz. Orofarengeal kandida enfeksiyonu riskini en aza indirmek için reçete edilen dozu kullandıktan sonra hastaların ağızlarını su ile çalkalamaları önerilmelidir. KOAH hastalarında pnömoniKortikosteroid içeren inhale ilaçları alan KOAH hastalarında, hastaneye yatış gerektiren pnömoni dahil pnömoni insidansında artış gözlemlenmiştir. Artan steroid dozu ile pnömoniriskinde artış kanıtları bulunmaktadır, ancak bu durum çalışmaların tamamında kesin olarakgösterilmemiştir. Kortikosteroid içeren inhale ilaçlarının pnömoni riskinin büyüklüğü konusunda sınıf içi farklılık için kesin klinik kanıt bulunmamaktadır. Hekimler, KOAH hastalarında olası pnömoni gelişimine karşı, enfeksiyonların klinik özellikleri ile KOAH semptomlarının alevlenme durumunun karışması ihtimali dolayısıyladikkatli olmalıdır. KOAH hastalarındaki pnömoni risk faktörleri arasında; sigara içimi, ileri yaş, düşük vücut kitle indeksi ve şiddetli KOAH bulunmaktadır. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriFarmakokinetik etkileşimlerBeklometazon dipropiyonat (BDP), sitokrom P-450 enzimleri ile karşılaşmadan esteraz enzimleri yoluyla hızla metabolize olur. Farmakodinamik etkileşimlerAstımlı hastalarda beta-bloker (göz damlaları da dahil) tedavisinden kaçınılmalıdır. Beta-blokerler zorunlu nedenler ile uygulanacak olursa, formoterolün etkisi azalır ya da ortadan kalkar. Diğer yandan beta-adrenerjik ilaçların eş zamanlı kullanımının olası ilave etkileriolabilir, bu nedenle formoterol ile eş zamanlı olarak teofilin ya da diğer beta-adrenerjikilaçların reçetelenmesi dikkat gerektirir. Sayfa 5/16 Kinidin, disopramid, prokainamid, fenotiyazinler, antihistaminikler, mono amino oksidaz inhibitörleri ve trisiklik antidepresanlar QTc-aralığını uzatarak ventriküler aritmi riskiniartırabilirler. Ayrıca, L-Dopa, L-tiroksin, oksitosin ve alkol, beta 2sempatomimetiklere karşı kardiyak tolerans azalabilir.Furazolidon ve prokarbazin gibi benzer özellikler gösteren mono amino oksidaz inhibitörleri ile eş zamanlı tedavi hipertansif reaksiyonları başlatabilir. Halojenli hidrokarbonlar ile eş zamanlı anestezi alan hastalarda aritmi riski artabilir. Ksantin türevleri, steroidler veya diüretikler ile eş zamanlı tedavi beta 2agonistlerinin olası hipokalemik etkilerini güçlendirebilir (bakınız bölüm 4.4). Dijital glikozidleri ile tedavi edilenhastalarda hipokalemi, aritmiye gidişi kolaylaştırabilir.Disülfiram veya metronidazol kullanan duyarlı hastalarda içeriğindeki düşük düzeydeki alkol etkileşime neden olabilir. Özel popülasyonlara ilişkin ek bilgiler: Böbrek/Karaciğer yetmezliği halinde BİOSFAR kullanımına ilişkin veri bulunmamaktadır.Pediyatrik popülasyon:18 yaşın altındaki astım ve KOAH hastalarında BİOSFAR ile yapılmış etkileşim çalışması bulunmamaktadır. 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon):BİOSFAR'ın çocuk doğurma potansiyeli olan kadınlarda ve doğum kontrolünde kullanımına ilişkin yeterli veri bulunmamaktadır. Gebelik dönemiBİOSFAR'ın gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermektedir (bakınız bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Kortikosteroidlerin gebe hayvanlara yüksek dozda uygulanmasının yarık damak ve rahim içi büyüme geriliği gibi fetal gelişme anomalilerine neden olduğu bilinmektedir. Beta-2-sempatomimetik ajanların tokolitik etkileri de doğumu etkileyebilir. Gebe kadınlarda BİOSFAR kullanımına ilişkin yeterli klinik veri mevcut değildir. Beklometazon dipropiyonat ve formoterol kombinasyonunun kullanıldığı hayvan çalışmalarıyüksek sistemik maruziyet sonrasında üreme üzerine toksisite bulunduğuna dair kanıtlargöstermiştir (bakınız. bölüm 5.3). Beta 2-sempatomimetik ajanların tokolitik etkisinden dolayıdoğumun yaklaşmasında gerekli önlemler alınmalıdır. Başka bir yerleşik alternatif (dahagüvenli) tedavi bulunmadıkça formoterol gebelik süresince ve özellikle gebeliğin sonlarındaya da doğum esnasında kullanılmamalıdır. BİOSFAR gebelik sırasında ancak beklenenyararlar potansiyel risklerden fazla olduğunda kullanılmalıdır.Sayfa 6/16 Laktasyon dönemiİnsanlarda laktasyon döneminde BİOSFAR kullanımına ilişkin yeterli klinik veri mevcut değildir. Hayvan deneylerinde veri elde edilememiş olmasına karşın, beklometazondipropiyonatın anne sütüne geçtiği varsayılabilir. Ancak, doğrudan inhalasyon için kullanılandozlarda anne sütünde anlamlı düzeylere ulaşılması çok olası değildir. Formoterol'ün annesütüne geçip geçmediğinin bilinmemesine karşın, hayvanların sütünde saptanmıştır. Bunedenle, emziren kadınlarda BİOSFAR yalnızca anne için beklenen yarar, çocuk için sözkonusu olası riskten daha fazla ise uygulanmalıdır. Üreme yeteneği / FertiliteSıçanlardaki üreme çalışmaları (0.2, 2.0 ve 20 mg/kg/gün) ile doza bağımlı etkiler gözlemlenmiştir. Erkek doğurganlığında hiç etki görülmezken dişi hayvanlarda fetal gelişmeüzerine advers etkilerin görülmediği seviye (NOAEL) 2 mg/kg/gündür. Daha yüksek dozlarda(20 mg/kg/gün), BİOSFAR doğumda güçlüğe neden olmuş ve maternal (implantasyonoranında azalma, plasenta ağırlığında azalma) ve fetal toksisite (kemikleşme bozuklukları,kiloda azalma) bulgularına neden olmuştur. 4.7 Araç ve makine kullanımı üzerindeki etkilerBİOSFAR'ın araç ve makine kullanma yeteneği üzerinde etkisi yoktur. 4.8 İstenmeyen etkilerBİOSFAR, beklometazon dipropiyonat ve formoterol fumarat dihidrat içerdiği için, her bir bileşik ile ilişkili türden ve şiddette advers reaksiyonların olması beklenir. Her iki bileşiğinbirlikte uygulanmasını takiben ek advers etki artışı gözlemlenmemiştir Sabit kombinasyon(BİOSFAR) olarak uygulanan beklometazon dipropiyonat ve formoterol fumarat ile ilişkiliistenmeyen etkiler aşağıda verilmiştir ve sistematik olarak organ sınıfına göre ve sıklığa göregösterilmiştir. Klinik çalışmalardan elde edilen istenmeyen etki görülme oranları şu şekilde tanımlanmıştır: Çok yaygın (>1/10); yaygın (>1/100 ve <1/10); yaygın olmayan (>1/1,000 ila <1/100); seyrek(>1/10,000 ila <1/1,000); çok seyrek (<1/10,000); bilinmiyor (mevcut verilerden tahminedilemiyor). Plasebo insidansları dikkate alınmamıştır. Enfeksiyonlar ve enfestasyonlarYaygın : Farenjit Yaygın olmayan : Grip, oral mantar enfeksiyonu, farengeal ve özofagal kandidiaz, vajinal kandidiaz, gastroenterit, sinüzit, rinit Kan ve lenf sistemi hastalıklarıYaygın olmayan :Granülositopeni Çok seyrek :Trombositopeni Bağışıklık sistemi hastalıklarıYaygın olmayan :Alerjik dermatit Çok seyrek : Eritem, dudaklar, yüz, göz ve farenks ödemini içeren hipersensitivite reaksiyonları Endokrin bozukluklarÇok seyrek :Adrenal baskılanma Sayfa 7/16 Metabolizma ve beslenme hastalıklarıYaygın olmayan : Hipokalemi, hiperglisemi Psikiyatrik hastalıklarYaygın olmayan : Yerinde duramama Bilinmiyor :Psikomotor hiperaktivite, uyku bozuklukları, anksiyete, depresyon, saldırganlık, davranış değişiklikleri (genellikle çocuklarda) Sinir sistemi hastalıklarıYaygın : Baş ağrısı Yaygın olmayan : Tremor, baş dönmesi Göz hastalıklarıÇok seyrek : Glokom, katarakt Kulak ve iç kulak hastalıklarıYaygın olmayan : Otosalpenjit Kardiyak hastalıklar
: Çarpıntılar; EKG'de QTc aralığı uzaması; EKG değişiklikleri, taşikardi, taşiaritmi
: Ventriküler ekstrasistoller, anjina pektoris : Atriyal fibrilasyon Yaygın olmayan Seyrek Çok seyrek Vasküler hastalıklarYaygın olmayan : Hiperemi; sıcak basması Solunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın : Disfoni Yaygın olmayan : Öksürük, prodüktif öksürük, boğazda tahriş, astım krizi Seyrek :Paradoksal bronkospazm Çok seyrek : Dispne, astımın şiddetlenmesi Gastrointestinal hastalıklarıYaygın olmayan : İshal, ağız kuruluğu, dispepsi, disfaji, dudaklarda yanma hissi, bulantı,tat alma bozukluğu Deri ve deri altı doku hastalıklarıYaygın olmayan : Kaşıntı, döküntü, hiperhidrozis Seyrek :Ürtiker, anjiyoödem Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıYaygın olmayan :Kas krampı, miyalji Çok seyrek : Çocuk ve adolesanlarda büyüme geriliği Böbrek ve idrar yolu hastalıklarıSeyrek :Nefrit Sayfa 8/16 Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Çok seyrek
: Periferik ödem AraştırmalarYaygın olmayan
Seyrek Çok seyrek
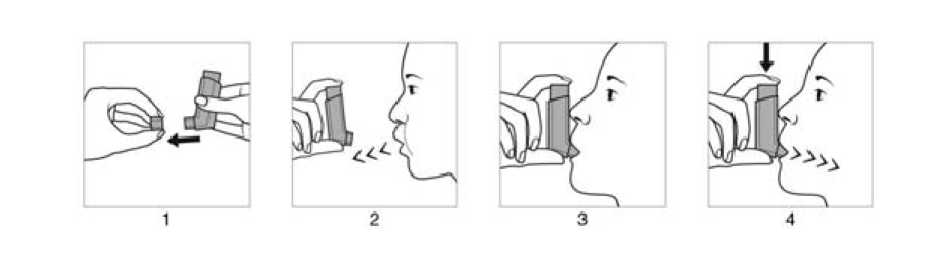
: C-reaktif proteinde artış, trombosit sayısında artma, serbest yağ asidinde artma, kan insülininde artış, kan keton cisimlerinde artış: Kan basıncında artma, kan basıncında azalma: Kemik yoğunluğunda azalma Diğer inhalasyon tedavilerinde de görüldüğü gibi paradoksal bronkospazm oluşabilir. Formoterol ile tipik olarak ilişkili gözlemlenen advers olaylar şunlardır: hipokalemi, başağrısı, tremor, çarpıntılar, öksürük, kas krampları ve QTc aralığı uzaması. Beklometazon ile tipik olarak ilişkili gözlemlenen advers olaylar şunlardır: oral mantar enfeksiyonları, oral kandidiaz, disfoni, boğazda tahriş. İnhale kortikosteroidlerin (örn., beklometazon dipropiyonat) sistemik etkileri özellikle uzun süreli olarak yüksek dozda uygulandığında ortaya çıkabilir. Bu etkiler şunlardır: adrenalbaskılanma, kemik mineral yoğunluğunda azalma, çocuklarda ve ergenlerde büyüme geriliği,glokom ve katarakt (bakınız bölüm 4.4) Aşırı duyarlılık reaksiyonları arasında döküntü, ürtiker şeklinde kaşıntı, eritem, göz, yüz, dudaklarda ve boğazda ödem vardır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği halinde BİOSFAR kullanımına ilişkin veri bulunmamaktadır. Pediyatrik popülasyon:18 yaş altındaki astım ve KOAH hastalarında BİOSFAR kullanılmamalıdır. Advers etki tablosu:Enfeksiyonlar ve infestasyonlarYaygın: Pnömoni (KOAH'lı hastalarda) Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr;4.9 Doz aşımı ve tedavisiPeş peşe 12 kümülatif uygulamaya kadar inhale BİOSFAR dozları (toplam 1200 mikrogram beklometazon dipropiyonat ve 72 mikrogram formoterol) astımlı hastalarda incelenmiştir.Kümülatif tedavi, vital bulgularda anormal bir etki göstermemiştir ve ciddi veya şiddetliadvers olaylar da gözlemlenmemiştir Aşırı formoterol dozları beta-2-adrenerjik agonistler için tipik olan etkilere yol açabilir: bulantı, kusma, baş ağrısı, tremor, uyku hali, çarpıntılar, taşikardi, ventrikül aritmileri, QTcaralığının uzaması, metabolik asidoz, hipokalemi, hiperglisemi. Sayfa 9/16 Formoterol ile doz aşımı durumunda, destekleyici ve semptomatik tedavi endikedir. Ciddi vakalar hastaneye yatırılmalıdır. Kardiyoselektif beta-adrenerjik blokörlerin kullanılmasıdüşünülebilir ancak çok dikkatli olarak uygulanmalıdır, çünkü beta-adrenerjik blokörkullanımı bronkospazma yol açabilir. Hastanın serum potasyumu izlenmelidir. Önerilenden fazla akut beklometazon dipropiyonat dozları inhalasyonu, adrenal fonksiyonun geçici olarak baskılanmasına neden olabilir. Bu acil önlem gerektirmez, çünkü, plazmakortizol ölçümleri ile doğrulandığı üzere, baskılanma birkaç gün içinde ortadan kalkar. Buhastalarda tedavi, astımı kontrol etmeye yetecek dozlarda sürdürülmelidir. Kronik alımlı fazla beklometazon dipropiyonat dozları inhalasyonu: Bölüm 4.4: adrenal baskılanma riskine bakınız. Adrenal rezervinin monitorizasyonu gerekli olabilir. 5- FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup :Obstrüktif solunum yolu hastalıklarında kullanılan ilaçlar Kortikosteroidler ya da diğer ilaçlarla kombine adrenerjikler - antikolinerjikler hariçATC Kodu :Etki mekanizması ve farmakodinamik etkiler:BİOSFAR beklometazon dipropiyonat ve formoterol içermektedir; bunların farklı etki mekanizmaları vardır ve astım alevlenmelerini azaltmak bakımından sinerjistik etkigösterirler. Bu iki maddenin etki mekanizması aşağıda incelenmiştir. Beklometazon dipropiyonat İnhalasyon yolu ile önerilen dozlarda verilen beklometazon dipropiyonatın akciğerlerde glukortikoidlere bağlı antiinflamatuvar etkisi vardır ve bu etki astım belirtileri vealevlenmelerinde azalma sağlamakla birlikte sistemik uygulanan kortikosteroidlere nazarandaha az advers etkiye neden olur. Formoterol Formoterol selektif bir beta 2-adrenerjik agonisttir ve reversibl solunum yolu obstrüksiyonu olan hastalarda bronş düz kaslarının gevşemesini sağlar. Bronş genişletici etkisi hızla,inhalasyondan 1-3 dakika sonra etkisini gösterir ve tek bir dozun etki süresi 12 saattir.BİOSFAR'ın idame tedavide klinik etkinliği Yetişkinlerde yapılan klinik çalışmalarda beklometazon dipropiyonata, formoterol eklenmesi astım belirtilerini ve akciğer fonksiyonunu iyileştirmiş ve alevlenmeleri azaltmıştır. BİOSFAR'ın akciğer fonksiyonu üzerindeki etkilerinin incelendiği 24 haftalık bir çalışmada, BİOSFAR en az birbirinden ayrı olarak verilen beklometazon dipropiyonat ve formoterol ileeşdeğer etki göstermiş ve tedavi etkinliği tek başına beklometazon dipropiyonat'tan dahafazla olmuştur. BİOSFAR'ın idame ve rahatlatıcı tedavide klinik etkinliği 1701 astım hastasının dahil edildiği 48 haftalık paralel grup çalışmasında; astımı kontrol altında olmayan orta veya ağır astımlı yetişkin hastalarda BİOSFAR'ın idame dozu (günde ikikez bir inhalasyon) ve rahatlatıcı (günde toplam 8 pufa kadar) tedavi olarak uygulaması,idame uygulaması (günde iki kez bir inhalasyon) artı ihtiyaç duyulduğunda salbutamol Sayfa 10/16 kullanımı ile karşılaştırılmışım Sonuçlar şunu göstermektedir; idame ve rahatlatıcı tedavi olarak uygulanan BİOSFAR, idame artı ihtiyaç duyulduğunda salbutamol kullanan grubagöre (ITT ve PP popülasyonlarını her ikisi için p<0.001) ilk ciddi alevlenme süresini belirginşekilde uzatmıştır. İdame ve rahatlatıcı tedavi grubunda ciddi astım alevlenmelerinin oranı,salbutamol grubuna kıyasla (hasta/yıl başına) belirgin şekilde azalmıştır (sırasıyla 0,1476 ve0,2239 istatistiksel olarak belirgin düşüş: p<0.001). BİOSFAR'ın idame ve rahatlatıcı tedavigrubundaki hastalar astım kontrolünde klinik olarak anlamlı başarı kaydetmişlerdir.Rahatlatıcı tedavinin ortalama inhalasyon sayısı ve rahatlatıcı tedavi uygulanan hasta sayısıher iki grupta da benzer şekilde azalmıştır. Not: ciddi alevlenmeler, hastaneye yatış ile sonuçlanan astımda kötüleşme veya acil tedavi veya sistemik steroid ihtiyacında 3 günden fazla artış olarak tanımlanmıştır. Diğer bir klinik çalışmada, astımlı hastalarda metakolin ile bronkokonstriksiyon geliştirilmiş ve BİOSFAR'nun tek doz ile (100/6 mcg) bronkodilatasyon sağlanması, salbutamol 200 mcgile karşılaştırılmıştır. BİOSFAR tek doz ile, salbutamol ile benzer şekilde hızlıbronkodilatasyon ve dispne de hızlı iyileşme sağlamıştır. 5.2 Farmakokinetik özelliklerGenel özelliklerSabit kombinasyon ilacı BİOSFAR'ın sistemik etkileri, içeriğindeki aktif maddeler olan beklometazon dipropiyonat (BDP) ve formoterol'ün sistemik etkileri ile klinik çalışmadakarşılaştırılmıştır. Beklometazon dipropiyonat için, ana aktif metabolit olan beklometazon- 17- monopropiyonat (B-17-MP) AUC'si ve maksimum plazma konsantrasyonu sabit kombinasyon uygulandıktansonra daha düşük olmuştur, fakat emilim hızı tek başına uygulanan beklometazon'a göre dahahızlıdır. Formoterol için maksimum plazma konsantrasyonu sabit veya serbest kombinasyon uygulamalarından sonra benzer bulunmuştur ve BİOSFAR ile sistemik etki, serbestkombinasyona göre biraz daha yüksek bulunmuştur. Beklometazon dipropiyonat ve formoterol arasında farmakokinetik veya farmakodinamik etkileşim gözlemlenmemiştir. Sağlıklı gönüllülerde yapılan bir çalışmada, Aerochamber Plus aktüatör kullanımı standart aktüatöre kıyasla, beklometazon dipropiyonatın aktif metaboliti olan 17- monopropiyonat veformoterol fumarat için akciğer erişimini sırasıyla % 41 ve % 45 artırmıştır. Formoterol fumarat için toplam sistemik etki değişmezken, beklometazon-17-monopropiyonat için %10 düşüş göstermiş ve değişmemiş beklometazon dipropiyonat için artmıştır. Beklometazon dipropiyonat Glukokortikoid reseptörlerine bağlanma afinitesi zayıf bir ön ilaç olan beklometazon dipropiyonat, esteraz enzimleriyle aktif metabolit olan beklometazon-17-monopropiyonatahidrolize olur. Beklometazon-17-monopropiyonat, ön ilaç olan beklometazon dipropiyonatagöre daha güçlü bir topikal anti-inflamatuvar etkinliğe sahiptir. Sayfa 11/16 Emilimİnhale edilen beklometazon dipropiyonat akciğerlerden hızla emilir; emilimden önce beklometazon dipropiyonat büyük oranda aktif metaboliti B-17-MP'ye dönüşür. B-17 MP'ninsistemik biyoyararlılığı akciğer (%36) ve yutulan dozun gastrointestinal emilimi ile ortayaçıkar. Yutulan beklometazon dipropiyonat'ın biyoyararlılığı ihmal edilebilir düzeydedir,ancak, sistemik dolaşım öncesinde B-17-MP'ye dönüşüm emilimin %41'inin B-17-MP olarakgerçekleşmesini sağlar. Yutulan dozun artışı ile birlikte sistemik etkide yaklaşık olarak lineerbir artış vardır. İnhalasyon sonrasındaki mutlak biyoyararlılık değişmemiş beklometazondipropiyonat ve B-17-MP için sırası ile nominal dozun %2 ve %62'si kadar olmuştur. Dağılımİntravenöz dozdan sonra, beklometazon dipropiyonat ve B-17-MP dağılımı yüksek plazma klerensi ile karakterizedir (sırasıyla 150 ve 120 L/saat) ve sabit durumda beklometazondipropiyonat için dağılım hacmi az (20L) B-17-MP için doku dağılımı daha fazladır (424L).Plazma proteinine bağlanma orta derecede yüksektir. BiyotransformasyonBeklometazon dipropiyonat sistemik dolaşımda çoğu dokuda bulunan esteraz enzimleri aracılığı ile metabolize olur ve sistemik dolaşımdan çok hızlı temizlenir. Metabolizmanın anaürünü aktif metabolittir (B-17-MP). Beklometazon-21-monopropiyonat (B-21-MP) vebeklometazon (BOH) gibi minör metabolitler de oluşur fakat bunlar sistemik maruziyete çokaz katkıda bulunur. EliminasyonBeklometazon dipropiyonatın başlıca atılım şekli polar metabolitler şeklinde feçesle atılımdır. Beklometazon dipropiyonat ve metabolitlerinin idrarla atılımı önemsiz miktardadır.Beklometazon dipropiyonat ve beklometazon-17-monopropiyonat için terminal eliminasyonyarılanma ömrü sırasıyla 0,5 ve 2,7 saattir. Hastalardaki karakteristik özelliklerRenal veya hepatik bozukluğu olan hastalarda beklometazon dipropiyonatın farmakokinetikleri çalışılmamıştır; ancak beklometazon dipropiyonat bağırsak sıvısında, serum, akciğerler ve karaciğerde bulunan esteraz enzimleri ile çok hızlı metabolize olarak,daha polar ürünler olan B-21-MP, B-17-MP ve BOH haline dönüştüğü için karaciğeryetersizliğinin Beklometazon dipropiyonat farmakokinetik ve güvenlik profilini değiştirmesibeklenmemektedir. Beklometazon dipropiyonat veya metabolitlerine idrarda rastlanmadığı için, böbrek yetersizliği olan hastalarda sistemik maruziyette artış gözlemlenmemiştir. Formoterol Emilimİnhalasyondan sonra formoterol hem akciğerden hem de gastrointestinal yoldan emilmektedir. Ölçülü doz inhalatör (MDI) ile oral uygulamadan sonra yutulan inhale dozun fraksiyonu % 60ile % 90 arasında bulunabilir.Yutulan dozun en az % 65'lik bir kısmı gastrointestinal sistemdeemilir. Değişmemiş ilaç zirve plazma konsantrasyonuna oral uygulamadan 0.5 saat-1 saatsonra ulaşır. Sayfa 12/16 DağılımFormoterol'ün plazma proteinlerine bağlanma oranı %61-64'tür ve %34'ü albümine bağlanır. Terapötik dozlarda ulaşılan konsantrasyon aralığında bağlanmada doygunluk gerçekleşmez.Oral uygulamadan sonra saptanan eliminasyon yarılanma ömrü 2-3 saattir. Formoterolemilimi 12-97 mikrogram inhale formoterol fumarat aralığı boyunca lineerdir. BiyotransformasyonFormoterol yaygın biçimde metabolize olur ve öne çıkan metabolik yol fenolik hidroksil grubundaki doğrudan konjugasyondur. Glukoronik asit konjugatı inaktiftir. İkinci majör yolfenolik 2'-hidroksil grubunda demetilasyon ve bunu izleyen konjugasyondur. Sitokrom P-450izoenzimleri CYP2D6, CYP2C19, CYP2C9, formoterol demetilasyonuna katılırlar.Karaciğer, primer metabolizma bölgesi olarak görülmektedir. Formoterol terapötik geçerlikonsantrasyonlarda CYP-450 enzimlerini inhibe etmez. EliminasyonFormoterolün idrardan kümülatif atılımı bir KTI (kuru toz inhaler)'den tek inhalasyon sonrasında 12-96 pg doz aralığında lineer artış göstermiştir. Sırası ile ortalama, %8 ve %25oranındaki doz değişmeden ve total formoterol olarak atılmıştır. 12 sağlıklı olguda tek bir 120 pg doz inhalasyonunu takiben ölçülen plazma konsantrasyonlarına dayanılarak, ortalama terminal eliminasyon yarılanma ömrünün 10 saatolduğu belirlenmiştir. (R,R) ve (S,S) enantiomerleri idrarda atılan değişmemiş ilacın sırasıylayaklaşık %40 ve %60'ını temsil etmektedir. İki enantiomerin oranı araştırılan doz aralığındasabit kalmıştır ve yinelenen dozlardan sonra bir enantiomerin diğerine nispetle daha fazlabiriktiğine ilişkin kanıt bulunamamıştır. Oral uygulamadan sonra (40-80 pg) dozun %6-%10'a varan oranı sağlıklı olgularda idrarda değişmemiş ilaç olarak bulunmuştur ve %8'e varan oranı ise glukuronid olarak bulunmuştur.Oral formoterol dozunun toplam %67'si idrarla (başlıca metabolitleri şeklinde) ve kalanıfeçesle atılır. Formoterolün renal klirensi 150 ml/dakika'dir. Hastalardaki karakteristik özelliklerKaraciğer/böbrek yetersizliği: Formoterolün farmakokinetiği karaciğer ve böbrek yetersizliği olan hastalarda araştırılmamıştır.Irk, cinsiyet:5.3 Klinik öncesi güvenlilik verileriKombinasyon halinde veya tek başına verilen beklometazon dipropiyonat (BDP) ve formoterol ile yapılan hayvan deneylerinde gözlenen toksisite, abartılmış farmakolojikaktivite ile ilişkili etkilerdir. Bu etkiler başlıca köpeklerde beklometazon dipropiyonat'ınbağışıklığı baskılayıcı etkileri ve formoterol'ün bilinen kardiyovasküler etkileri ile ilişkilidir.Kombinasyonun uygulanmasından sonra toksisitede artış veya beklenmedik bulgulargözlemlenmemiştir Karsinojenite: Önerilen kombinasyonla karsinojenisite çalışmaları gerçekleştirilmemiştir. Bununla birlikte, ayrı ayrı bileşenler için bildirilen hayvanlardan elde edilen veriler, insanlarda herhangi birpotansiyel karsinojenisite riskini akla getirmemektedir. Sayfa 13/16 Mutajenite: Beklometazon dipropiyonat/formoterol kombinasyonuyla gerçekleştirilen genotoksisite çalışmaları mutajenik bir potansiyele işaret etmemektedir. Üreme üzerine toksisitesi: Sıçanlarda yapılan üreme çalışmaları doza bağlı etkileri göstermiştir. Kombinasyon, dişilerde azalmış doğurganlık ve embriyofetal toksisite ile ilişkilendirilmiştir. Gebe hayvanlara göreyüksek kortikosteroid dozlarının, damak yarığı ve rahim içi büyüme geriliği dahil fetalgelişimanomaliliklerine nedenolduğubilinmektedir ve beklometazon dipropiyonat/formoterol kombinasyonuyla görülen etkiler muhtemelen beklometazon dipropiyonattan ötürüdür. Bu etkiler yalnızca, aktif metabolit olan beklometazon-17-monopropiyonata yüksek sistemik maruz kalımla fark edilmiştir (hastalarda beklenen plazmadüzeylerinin 200 katından daha fazla). Ayrıca, hayvanlarda yapılan çalışmalarda, beta2-sempatomimetiklerin bilinen tokolitik etkilerine dayandırılabilen bir etki olan gebelik vedoğum süresinin uzaması görülmüştür. Bu etkiler, BİOSFAR ile tedavi edilen hastalardamaternal plazma formoterol düzeyleri beklenen düzeylerin altında olduğunda kaydedilmiştir. CFC içermeyen itici gaz HFA-134a ile ilişkili klinik öncesi konvansiyonel güvenlilik farmakolojisi, tekrar doz toksisitesi, genotoksisite, karsinojenik potansiyel ve üremetoksisitesi çalışmalarında insanlar için herhangi bir özel risk ortaya çıkmamıştır. 6.FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiNorfluran (kloroflorokarbon CFC içermeyen bir itici gaz olan HFA-134a ) Susuz etanol Hidroklorik asit 6.2 GeçimsizliklerBilinen bir geçimsizliği yoktur. 6.3 Raf ömrü20 ay 6.4 Saklamaya yönelik özel tedbirlerEczane ve Depolar için Talimatlar2-8 °C'de buzdolabında saklanmalıdır (en fazla 15 ay). Hastalar için Talimatlar25°C'nin altındaki oda sıcaklığında saklanmalıdır (en fazla 5 ay). 6.5 Ambalajın niteliği ve içeriğiHFA Modulite® teknolojisi ile üretilen aerosol inhalasyon solüsyonu içeren, ölçülü valf, aktüatör ve koruyucu kapağı olan basınçlı aluminyum kap. Her bir BİOSFAR kabı 120 dozluk uygulama sağlar. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller, Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği ne uygun olarak imha edilmelidir. Sayfa 14/16 Kullanım talimatları 4.2.Pozoloji ve uygulama şekli bölümünde detaylı olarak açıklanmıştır. Uyarı: Kap yüksek basınç altında sıvı ihtiva eder. Kabı 50° C üzerinde sıcaklıklara maruz bırakmayınız, delmeyiniz ve açmaya çalışmayınız. BİOSFAR uygulaması esnasında aşağıdaki talimatlara uyulmalıdır: İnhalernizi ilk kez kullanacaksanız veya 14 gün veya daha uzun süre kullanmadıysanız, inhalerin düzgün bir biçimde çalıştığından emin olmak için bir puf aerosolü havaya sıkınız.Mümkün olduğu ölçüde, ilacı inhale ederken (solurken) ayakta durunuz veya sırtınız dikpozisyonda oturunuz. 1. Koruyucu kapağı ağızlıktan çıkarınız. 2. Ağzınızdan mümkün olduğunca yavaş ve derin nefes veriniz. 3. Vücut duruşunuz nasıl olursa olsun, tüpü alt kısmı yukarı bakacak biçimde dikey halde tutunuz ve ağızlığı dişlerinizin arasına koyunuz ve dudaklarınızı sıkıcakapatınız. 4. Ağzınızdan yavaş ve derin nefes alırken ve aynı anda bir puf aerosol boşaltmak için inhalerin üst kısmına basınız. 5. Nefesinizi mümkün olduğunca ve çaba harcamadan tutunuz ve nihayet inhaleriağzınızdan çıkarıp burnunuzdan nefes veriniz. 6. Kullandıktan sonra, koruyucu kapağı kapatınız. Bir puf aerosol daha gerekiyorsa, inhaleri yarım dakika kadar dikey halde tutunuz ve sonra 2 - 5 arasındaki işlemleri tekrarlayınız.
Eğer elleriniz güçsüz ise, inhaleri her iki elle tutmak daha kolay olabilir; bu durumda inhalerin üst kısmını her iki işaret parmağıyla tutunuz ve alt kısmını da her ikibaşparmağınızla tutunuz. Ağızda ve boğazda mantar enfeksiyonu riskini azaltmak için, her puf sonrasında ağzınızı su ile çalkalayınız. Sayfa 15/16 Bu Kullanma Talimatında belirtilen doz BİOSFAR'ın standart bir inhaler kullanılarak inhale edilmesi (solunması) ile ilgilidir. BİOSFAR'ın farklı bir hazne (spacer) ile kullanımıkonusunda yeterli veri yoktur. Eğer farklı bir hazne (spacer) ile kullanılacaksa, dozunayarlanması gerekebilir. T emizlikAğızlığın dışını kuru bir bezle düzenli olarak (haftada bir) siliniz. Ağızlığı temizlemek için su veya başka bir sıvı kullanmayınız. 7. RUHSAT SAHİBİPromedica İlaç Tic. Ltd. Şti. Büyükdere Cad. No: 122 Özsezen İş Merkezi C Blok Kat:3 Esentepe-Şişli 34394, İstanbulTel: 0212 370 9100Fax: 0212 370 9127 8. RUHSAT NUMARASI130/44 9. İLK RUHSAT TARİHİ/ RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 31.12.2010 Ruhsat yenileme tarihi: İO.KÜB'ÜN YENİLENME TARİHİSayfa 16/16 |
İlaç BilgileriBiosfar 100/6 Mcg Aerosol İnhalasyon ÇözeltisiEtken Maddesi: Beklometazon Dipropiyonat, Formoterol Fumarat Dihidrat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.