Nimbex 10mg/5ml Enjektabl Ampul Kısa Ürün BilgisiKas İskelet Sistemi » Kas Gevşeticiler » Periferik Etkili Kas Gevşeticiler » Diğer Kuaterner Amonyumlar » Sisatrakuryum KISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADINİMBEX 10 mg /5 mİ enjektabl ampul2. KALİTATİF VE KANTİTATİF BİLEŞİM Etkin madde:Bir 5 mriik ampulde;10 mg sisatrakuryuma eşdeğer sisatrakuryum besilat (2mg/ml) Yardımcı maddeler:Yardımcı maddeler için 6.1,'e bakınız.3. FARMASÖTİK FORMAmpulSteril solüsyon, pH=3.3-3.8 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasy onlarNİMBEX, intravenöz olarak uygulanan orta etki süreli, non-depolarizan nöromüsküler blokördür. NİMBEX'in cerrahi, diğer uygulamalar sırasında ve yoğun bakımda kullanımı endikedir. NİMBEX'in kardiyak cerrahiyi de içine alan cerrahi girişimlerde kullanımı endikedir. Genel anesteziye ek olarak veya yoğun bakım ünitelerinde sedasyon için, iskelet kaslarını gevşetmek ve trakeal entübasyonu ve mekanik ventilasyonu kolaylaştırmakta kullanılır. NİMBEX antimikrobiyal koruyucu taşımaz ve tek bir hasta kullanımı içindir.4.2. Pozoloji ve uygulama şekli Pozoloji/uygulama sıklığı ve süresi:İntravenöz bolus enjektabl şeklinde kullanımıErişkinler;Trakeal entübasyon; NİMBEX'in erişkinler için önerilen entübasyon dozu 5-10 saniyede hızlı olarak 0.15 mg/kg'dır. Bu doz, enjeksiyonu takiben 120 saniye içinde trakeal entübasyon için iyi veya mükemmel koşullar oluşturur. Yüksek dozlar nöromüsküler blokun oluşma süresini kısaltır. Aşağıdaki tablo NİMBEX'in sağlıklı erişkinlere opioid veya propofol anestezisi sırasında 0.1-0.4 mg/kg dozlarında uygulandığında ortalama farmakodinamik verilerini Özetlemektedir.
Enfluran veya izofluran anestezisi, NİMBEX'in başlangıç dozunun klinik etki süresini %15 kadar uzatabilir. İdame;Nöromüsküler blok, NİMBEX'in idame dozları ile uzatılabilir. 0.03mg/kg'lık doz opioid veya propofol anestezisi sırasında yaklaşık olarak 20 dakika ilave klinik olarak etkili nöromüsküler blok sağlar. Birbirini takip eden idame dozlar etkide ilerleyici bir uzama ile sonuçlanmaz.Kendiliğinden düzelme;Bir kez nöromüsküler bloktan kendiliğinden geriye dönme (düzelme-recovery) başlamışsa, düzelme hızı uygulanmış olan NİMBEX dozundan bağımsızdır. Opioid veya propofol anestezisi sırasında %25'ten %75'e ve %5'ten %95'e medyan düzelme süreleri sırasıyla yaklaşık olarak 13 dakika ve 30 dakikadır.Etkinin geriye döndürülmesi;NİMBEX uygulamasını takiben oluşan nöromüsküler blok antikolinesteraz ilaçların standart dozlarıyla geriye döndürülür. Etkiyi tersine çeviren ilaç uygulamasını takiben (ör. %13 Tl düzelmesi) %25'ten %75'e ve %25'ten tam klinik düzelme (T4:T1> 0.7) için geçen ortalama süre sırasıyla yaklaşık olarak 2 dakika ve 5 dakikadır.İntravenöz infüzyon şeklinde kullanımı:Erişkinler ve 2-12 yaş arası çocuklar; Nöromüsküler blokun devamlı olması NİMBEX'in infiizyon olarak uygulanması ile elde edilebilir. Erken spontan düzelme belirtisinden sonra %89-99 Tl süpresyonunu yeniden sağlamak için başlangıç infuzyon hızı 3 mikrogram/kg/dak. (0.18 mg/kg/saat) olarak önerilir. Nöromüsküler bloğun stabilizasyonu için geçen başlangıç periyodundan sonra 1-2 mikrogram/kg/dak.'İlk (0.06-0.12 mg/kg/sa) hız bu gruptaki birçok hastada idame blok için yeterlidir. Isofluran veya enfluran anestezisi sırasında NİMBEX uygulandığında infuzyon hızının %40 kadar azaltılması gerekli olabilir. İnfuzyon hızı; infiizyon solüsyonundaki sisatrakuryum konsantrasyonuna, istenilen nöromüsküler bloğun derecesine ve hastanın kilosuna bağlıdır. Aşağıdaki tablo dilüe edilmemiş NİMBEX'in dağılımını göstermektedir. NİMBEX 2mg/mrnin infuzyon dağılım hızı Doz (mikrogram/kg/dak) 1.0 1.5 2.0 3.0
İnfuzyon hızı
Hastanın ağırlığı (kg)
m
20 70 100 NİMBEX'in devamlı infüzyonu nöromüsküler blok etkisinin giderek artması veya azalması ile bağlantılı değildir. NİMBEX'in İnfuzyon olarak uygulanmasının durdurulmasını takiben nöromüsküler bloktan spontan düzelme hızı, tek bolus uygulamasını takiben meydana gelen hızla karşılaştırılabilir düzeydedir. 2 yaş altındaki çocuklar spesifik olarak çalışılmamakla birlikte bolus dozun farmakodinamik verilerine göre NİMBEX infuzyon hızlan da benzer olabilir. ^ Uygulama şekli:NİMBEX i.v. enjeksiyon yoluyla uygulanır.Dilüe edilmiş NİMBEX, 0.1 ila 2.0mg/ml konsantrasyonları arasında, aşağıdaki infiizyon sıvılarında, polivinil klorür (PVC) veya polipropilen kaplar içinde, 5° C ve 25 C'de en az 12 saat fiziksel ve kimyasal olarak stabil kalır. Sodyum klorür (%0.9 a/h) i.v. infuzyon Glukoz (%5 a/h) i.v. infiizyon Sodyum klorür (%0.18 a/h) ve Glukoz (%4 a/h) i.v. infiizyon Sodyum klorür (%0.45 a/h) ve Glukoz (%2.5 a/h) i.v. infuzyon Ancak, NİMBEX hiçbir antimikrobiyal koruyucu içermediğinden dilüsyon kullanmadan hemen önce yapılmalı, mümkün olduğu kadar çabuk, hemen uygulama başlatılmalı ve artan solüsyon atılmalıdır. NİMBEX Laktatlı Ringer enjeksiyonu ile seyre İtildiğinde kimyasal olarak stabil değildir. NİMBEX, Y-bölgesi enjeksiyon yerinden uygulanmakta olan intravenöz infuzyon içine verilmesine benzer şekilde kanştınidığmda, aşağıdaki ameliyat sırasmda kullanılan ilaçlarla geçimli olduğu görülmüştür: alfentanil hidroklorür, droperidol, fentanil sitrat, midazolam hidroklorür ve sufentanil sitrat. NİMBEX'in uygulandığı iğne ya da kanülden uygulanacak olan diğer ilaçların sodyum klorür %0.9'luk intavenöz infuzyon gibi uygun bir intravenöz sıvı içinde, yeterli hacimde uygulanması önerilir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Böbrek yetmezliği olan hastalarda herhangi bir doz değişikliği gerekmemektedir. Bu grup hastalarda NİMBEX normal böbrek fonksiyonu olan hastalarda gözlenene benzer farmakodinamik profil gösterir, fakat etkinin başlangıcı biraz daha yavaş olabilir.Karaciğer yetmezliği:İleri derecede karaciğer hastalığı olan hastalarda herhangi bir doz değişikliği gerekmemektedir. Bu grup hastalarda NİMBEX normal hepatik fonksiyonu olan hastalarda gözlenene benzer farmakodinamik profil gösterir, fakat etkinin başlangıcı biraz daha hızlı olabilir.Pediyatrik popülasyon:İntravenöz bolus enjekiabi şeklinde kullanımı1 ay-12 yaş arası çocuklar;Trakeai eniübasyon;Erişkinlerde olduğu gibi NİMBEX önerilen başlangıç entübasyon dozu 5-10 saniyede hızlı şekilde 0.15 mg/kg'dır. Bu doz NİMBEX'i takiben 120 saniyede trakeal entübasyon için iyi ve mükemmel koşullan oluşturur. Bu doz için farmakodinamik veriler aşağıdaki tabloda gösterilmiştir. Eğer kısa klinik süre istenirse, 0.1 mg/kg'lık dozun 120-150 saniyede benzer entübasyon koşullan sağladığını farmakodinamik veriler göstermektedir. 1 ay- 12 yaş arasındaki pediyatrik hastalarda NİMBEX, benzer anestezik koşullarda, erişkinde gözlenenden daha kısa klinik etki süresi ve daha hızlı spontan düzelme profiline sahiptir. Farmakodinamik profilde 1 ay-11 ay ile 1 yaş-12 yaş arasındaki yaşlarda aşağıdaki tabloda özetlenmiş olan çok küçük değişiklikler gözlenmiştir.1 ay -11 ay arasındaki çocuk hastalar;
Başlangıç NİMBEX dozu (mg/kg) Uygulanan anestetik %90 supresyon oluşturma süresi (dak.) Maksimum supresyon oluşturma süresi (dak.) %25 spontan Tl düzelme süresi (dak.)
0.08
Halotan
1.7
31
2.5
Opioid
28
1.7
2.8
0.1
0.15
Halotan
2.3
43
3.0
Opioid
2.6
3.6
0.15
38 Halotanm, NİMBEX'in klinik etki süresini %20'e kadar uzatabileceği beklenebilir. Çocuklarda izofluran ve enfluran anestezisi sırasında NİMBEX kullanımı ile ilgili geçerli bir bilgi bulunmamakla birlikte bu ajanlann NİMBEX'in klinik etki süresini %20'e kadar arttırması beklenebilir. idame;Kendiliğinden düzelme;Bir kez nöromüsküler bloktan geri dönme (düzelme) başlamışsa, düzelme hızı uygulanmış olan NİMBEX dozundan bağımsızdır.Opioid anestezisi sırasında %25'ten %75'e ve %5'ten %95'e düzelme medyan süresi sırasıyla yaklaşık olarak 11 dak. ve 28 dakikadır. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Hasta ağırlığı |
Doz (mikrogram/kg/dak) 1.0 1.5 2.0 3.0 |
İnfuzyon hızı | |||
|
70 |
0.8 |
1.7 |
1.2 |
2.4 |
ml/saat |
|
100 |
1.2 1 |
2.5 |
1.8 |
3.6 |
ml/saat |
Hipotermik kalp cerrahisi uygulanan hastalar:
Cerrahi uygulanan hipotermi oluşturulmuş (25''C-28°C) hastalara NİMBEX uygulamasını içeren çalışmalar bulunmamaktadır. Diğer nöromüsküler blokör ilaçlarda olduğu gibi bu koşullar altında yeterli cerrahi rölaksasyonu idame ettirmek için gerekli olan infiizyon hızının anlamlı derecede azaltılması beklenir.4.3. Kontrendikasyonlar
NİMBEX, sisatrakuryum, atrakuryum veya benzensüİfonik aside aşırı duyarhlığı olduğu bilinen hastalarda kontrendikedir.4.4. Özel kullanım uyarılan ve önlemleri
Sisatrakuryum diğer iskelet kaslarım olduğu gibi solunum kaslarım da felce uğratır, fakat bilinç veya ağrı eşiği üzerine bilinen bİr etkisi yoktur. NİMBEX sadece deneyimli anestezist tarafından veya gözetiminde veya nöromüsküler blokör ilaçların kullanımını ve etkilerini bilen diğer klinisyenler tarafından uygulanmalıdır. Trakeal entübasyon için uygun koşullar ve pulmoner ventilasyonun ve yeterli arteryel oksijenasyonun idamesi sağlanmalıdır. NİMBEX, nöromüsküler blokör ilaçlar arasında çapraz reaksiyon rapor edildiğinden diğer nöromüsküler blokör ilaçlara aleijik aşırı duyarlılık gösteren kişilere uygulandığında dikkat gösterilmelidir. Sisatrakuryumun önemli bir vagolitik veya gangliyon bloke edici özellikleri yoktur. Bu nedenle, NİMBEX'in kalp atım hızı üzerine klinik olarak anlamlı etkisi yoktur ve birçok anestetik ilaç veya ameliyat sırasında vagal stimülasyon ile oluşan bradikardi üzerine etkisi yoktur. Myastenia gravisi ve nöromüsküler hastalıkların diğer formlarını taşıyan hastalar non-depolarizan blokör ilaçlara büyük oranda artmış bir duyarlılık gösterirler. Bu hastalara 0.02 mg/kg'ı geçmeyen başlangıç dozunda NİMBEX önerilir. Ciddi asid-baz ve/veya serum elektrolit anormallikleri hastanın nöromüsküler blokör ilaçlara karşı duyarlılığını arttırabilirveya azaltabilir. NİMBEX malign hipertermi hikayesi olan hastalarda denenmemiştir. Sisatrakuryum yanıkları olan hastalarda denenmemiştir, fakat diğer non-depolarizan nöromüsküler blokör ilaçlarla olduğu gibi, eğer NİMBEX bu hastalara uygulanacaksa doz gereksinmelerinin artmış ve etki süresinin kısalmış olabileceği dikkate alınmalıdır. NİMBEX bir hipotoniktir ve kan transfüzyonun infüzyon yolu içinde verilmelidir.
Yoğun hakim hastalarında kullanımı:
Laboratuvar hayvanlanna yüksek dozda uygulandığında sisatrakuryum ve atrakuryumun bir metaboliti olan laudanosin geçici hipotansiyon ve bazı türlerde serebral eksitatör etkilerle ilişkili bulunmuştur. Sisatrakuryumun azalan infüzyon oranı ile tutarlı olarak plazma laudanosin konsantrasyonları, atrakuryum infuzyonunu takip eden konsantrasyonun yaklaşık üçte biri kadardır. Atrakuryum ve diğer ajanları alan yoğun Hll bakım hastalannda nadiren nöbetler bildirilmiştir. Bu hastalarda genellikle bir veya daha fazla nöbete yol açabilecek tibbi koşullar mevcuttur (Kranyal travma, hipoksik ensefalopati, serebral ödem, viral ensefalopati, üremi gibi). Laudanosin ile ilişkili bir neden tesbit edilememiştir.4.5. Diğer tıbbi ürünler ile etkileşim ve diğer etkileşim şekilleri
Aşağıdakiler de dahil olmak üzere birçok ilacın non-depolarizan nöromüsküler blokör ilaçların şiddet ve/veya etki süresini etkilediği gösterilmiştir.Artırıcı etkiler
Anestetikler:
Enfluran, isofluran, desfIurane, sevofluran ve halotan gibi uçucu ilaçlar ve ketamin; diğer non-depolarizan nöromüsküler blokör ilaçlar.Diğer ilaçlar:
Aminoglikozidler, polimiksinler, spektinomisin, tetrasiklinler, linkomisin ve klindamisin dahil antibiyotikler, propranolol, kalsiyum kanal blokörleri, lignokain, prokainamid ve kinidin dahil anti-aritmik ilaçlar, fıırosemid ve olasılıkla tiyazid, mannitol ve asetazolamid dahil diüretikler, magnezyum tuzlan, lityum tuzları, trimetafan, hekzametonyum gibi gangliyon blokör ilaçlar.Azaltıcı etkiler
Önceden fenitoin veya karbamazepinin kronik uygulaması; önceden süksametonyum uygulamasının NİMBEX bolus dozunu takiben nöromüsküler bloğun süresine veya infüzyon hızı gereksinimleri üzerine etkisi yoktur. Non-depolarizan nöromüsküler blokör ilaçların etkilerini uzatmak için süksametonyum uygulaması antikolinesterazlar ile geri dönmeyi
zorlaştıran uzamış ve kompleks bir blok ile sonuçlanabilir. Nadiren, belli ilaçlar latent myastenia gravisi şiddetlendirebilir veya ortaya çıkarabilir veya gerçekten myastenik sendrom oluşumuna yol açabilir. Non-depolarizan nöromüsküler blokör ilaçlara aşın duyarlılıkta artış meydana gelebilir. Bu gibi ilaçlara çeşitli antibiyotikler, beta-blokörler (propranolol, oksprenolol), anti-aritmik ilaçlar (prokainamid, kinidin), anti-romatizmal ilaçlar (klorokin. D-penisilamin), trimetafan, klorpromazin, steroidler, fenitoin ve lityum dahildir.
Eşzamanlı kullanılan bazı ilaçlar (örn, furosemid, fenitoin, teofılin, karbamazepin) nöromüsküler blokajı antagonize edebilir.
Özel popülasyonlara ilişkin ek bilgiler
Veri bulunmamaktadır.Pediyatrik popUlasyon;
Veri bulunmamaktadır.4.6. Gebelik ve laktasyon Genel tavsiye
Gebelik Kategorisi; CÇocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Hayvanlar üzerinde yapılan çalışmalar, gebelik/ve-veya/ embriyonal/fetal gelişim/ve-veya /doğum /ve-veya doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir. İnsanlara yönelik potansiyel risk bilinmemektedir.Gebelik dönemi
NİMBEX gebelikte ancak anneye sağlaması beklenen yararları fetüse olan herhangi bir potansiyel riskinden fazla ise kullanılmalıdır. Gerekli olmadıkça gebelik döneminde kullanılmamalıdır.Laktasyon dönemi
Sisatrakuryum veya metabolitlerinin anne sütüne geçip geçmediği bilinmemektedir.Üreme yeteneği/FertiUte
NİMBEX'in üreme yeteneği ve fertilite üzerindeki etkisi bilinmemektedir.4.7. Araç ve makine kullanımı üzerindeki etkiler
Bu önlem NİMBEX kullanımı ile ilgili değildir. Fakat gene! anesteziyi takiben görev performansı ile ilgili her zamanki önlemler göz önünde tutulmalıdır.4.8. İstenmeyen etkiler
Klinik geliştirme programı süresince NİMBEX'e atfedilebilen herhangi bir yan etki oluşmamıştır.Rapor edilen istenmeyen etkiler aşağıdaki sıklık derecesine göre listelenmiştir:
Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Vasküler hastalıklar
Yaygm: Hipotansiyon Yaygın olmayan; Ciltte kızarmaKardiyak hastalıklar
Yaygm: BradikardiSolunum, göğüs bozuklukları ve mediastinal hastalıklar
Yaygın olmayan: BronkospazmÇok seyrek: Ani hmltı, göğüs ağrısı veya göğüs sıkışması
Deri ve deri altı doku hastalıkları
Yaygın olmayan; Kızarıklık, döküntüÇok seyrek: Yumrulu döküntü veya vücudun herhangi bir yerinde kurdeşen
Ka$-iske)et bozukluklar, bağ doku ve kemik hastalıkları
Çok seyrek: Kas güçsüzlüğü ve/veya miyopati. Yoğun bakım ünitelerindeki ağır hastalarda kas gevşeticilerinin uzun süre kullanımı sonrası miyopati ve/veya kas zayıflığına ait bazı raporlar bildirilmiştir. Çoğu hasta birlikte kortikosteroid kullanmaktaydı. Bu olaylar NİMBEX ile birlikte, seyrek olarak rapor edilmektedirler ve nedensel bir ilişki gösterilememiştir.Bağışıklık sistemi hastalıkları
Çok seyrek: Anafılaksi. NİMBEX ile birlikte, bir ya da daha fazla anestezik ilaç verilen hastalarda çok ciddi anaflaktik reaksiyonlar bildirilmiştir.4.9. Doz aşımı ve tedavisi
NİMBEX aşırı dozajına bağlı olduğu beklenilen başlıca belirtiler uzayan kas paralizisi ve bunun sonuçlarıdır. Tedavi; yeterli spontan respirasyon geri dönene kadar pulmoner ventilasyon ve arteryel oksijenasyonun idamesi esastır. NİMBEX bilinci etkilemediğinden tam sedasyon gerekli olabilir. Spontan düzelme belirtisi bir kez başlamışsa antikolinesteraz ilaç uygulaması düzelmeyi hızlandırabilir.5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Non-depolarizan nöromüsküler blokör ATC-kodu: M03AC11Sisatrakuryum, motor sinir dallarının kas içinde sonlanan uç kısmındaki kolinerjik reseptörlere bağlanarak asetilkolinin etkisini antagonize eder ve sonuç olarak nöromüsküler iletiyi kompetitif olarak bloke eder. Bu etki neostıgmin veya edrofonyum gibi antikolinesteraz ilaçlarla tersine çevrilir. Sisatrakuryum İçin ED95 (ulnar sinirin stimülasyonu ile adductor pollicis kasının seğirme cevabında %95 depresyon oluşturmak için gerekli olan doz) opioid anestezisi (tiyopenton/fentanil/midazolam) sırasmda 0.05mg/kg vücut ağırlığı olduğu tahmin edilmektedir. Sisatrakuryumun halotan anestezisi sırasında çocuklardaki ED95 değeri 0.04 mg/kg'dır.
5.2. Farmakokinetik özellikler Genel özellikler
Sisatrakuryumun kompartımanh olmayan farmakokinetiği çalışılan doz aralığında doza bağımlı değildir (0.1-0.2mg/kg, öm. 2 ila 4 x ED95). Popülasyon farmakokinetik modelleri bu bulguları 0.4 mg/kg'a (8xED9s) kadar doğrular. Sağlıklı erişkin ameliyat hastalarına 0.1 ve 0.2 mg/kg dozlarında NİMBEX uygulanmasından sonra farmakokinetik parametreler aşağıdaki tabloda özetlenmiştir.|
PARAMETRE |
ORTALAMA DEĞERLERİN YAYILIMI |
|
Klerens Kararlı durumda dağılım hacmi Eliminasyon yarılanma ömrü |
4.7 - 5.7 ml/dak/kg 121 - 161ml/kg 22 - 29 dak |
Emilim
: Veri yoktur.Dağılım:
Veri yoktur.Bivotransformasvon:
Sisatrakuryum, vucutta laudanozin ve monokuatemer akrilat metaboliti oluşturmak üzere fizyolojik pH ve sıcaklıkta Hofrnann eliminasyonu ile parçalamr. Monokuatemer akrilat spesifik olmayan plazma esterazları ile monokatemer alkol metabolitini oluşturacak şekilde hidrolize uğrar. Sisatrakuryumun eliminasyonu organ bağımsız olmakla beraber, karaciğer ve böbrekler metabolitlerinin klerensi için temel yoldur. Bu metabolitler nöromüsküler blokör etki taşımazlar.
Eliminasvon:
Veri yoktur.Hastalardaki karekteristik özellikler
Yaslı hastalarda farmakokinetik:
Sisatrakuryumun yaşlı ve genç erişkin hastalarda farmakokinetiginde klinik olarak önemli bir fark yoktur.
Böbrek vetmezliği olan hastalarda farmakokinetik:
Sisatrakuryumun böbrek yetmezliği olan hastalar ile sağlıklı erişkin hastalar arasında farmakokinetiginde klinik olarak önemli bir fark yoktur.
Hepatik yetmezliği olan hastalarda farmakokinetik:
Sisatrakuryumun karaciğer yetmezliği olan hastalar ile sağlıklı erişkin hastalar arasmda farmakokinetiginde klinik olarak önemli fark yoktur.
İnfuzvon sırasında farmakokinetik
:İnfuzyonundan sonra sisatrakuryumun farmakokinetiği ile tek bolus enjeksiyondan sonraki farmakokinetiği aynıdır.
Yoğun bakım ünitelerindeki hastalarda farmakokinetik:
Sisatrakuryumun farmakokinetiği yoğun bakım ünitelerinde uzun süreli infuzyon alan hastalardaki farmakokinetiği ile infiizyon veya tek bolus enjeksiyon alan, sağlıklı ameliyat hastalarındaki farmakokinetiği ile benzerdir. Sisatrakuryumun ortalama klerensi 7.5 ml/kg/dak ve yarı ömür eliminasyonu 27 dak'dır. Yoğun bakım hastalarında NİMBEX infuzyonu sonrası geri dönüş profili infüzyonun süresi ile bağımsızdır. Normal hepatik ve/veya renal fonksiyonlu hastalarla karşılaştırılınca metabolitlerin konsantrasyonu yoğun ^ bakım hastalarında daha yüksektir.
5.3. Klinik öncesi güvenlilik verileri
Subakut toksisite çalışmalarında köpek ve maymunlara tekrarlayan doz 3 haftalık uygulama özel bir toksisite göstermemiştir.Sisatrakurium in vitro mikrobiyal mutajenite testinde 5000 mikrogram/tabla konsantrasyonunda mutajenik bulunmamıştır. Sıçanlarda yürütülen bir in vivo Sitogenetik çalışmada 4 mg/kg doz düzeyine dek anlamlı kromozomal anormallik gözlenmemiştir. Sisatrakurium in vitro fare lenfoma hücresi mutajenite tayininde 40 mikrogram/ml ve üzerindeki konsatrasyonlarda mutajenik bulunmuştur. Seyrek ve/veya kısa süreli kullamlan bir ilaç için tek bir mutajenik yanıtın klinik önemi şüphelidir.
^ Karsinojenite çalışması yürütülmemiştir.
Fertilite çalışması yürütülmemiştir. Sıçanlarda yürütülen üreme çalışmaları fötal gelişim üzerinde advers etki göstermemiştir.
Tavşanlarda yürütülen intraarteriyal çalışmada Nimbex enjeksiyonu iyİ tolere edilmiş ve ilaç ile ilişkili değişiklik görülmemiştir.
6. FARMASÖTİK ÖZELLİKLER
6.L Yardımcı maddelerin listesi
pH ayarı için benzen sülfonik asit çözeltisi Enjeksiyonluk su6.2. Geçimsizlikler
NİMBEX, Laktath Ringer enjeksiyonu ile seyreltildiğinde kimyasal olarak stabil değildir. NİMBEX sadece asidik solüsyonlarla stabil olduğu için aynı şırıngada alkali solüsyonlarla (örn.: sodyum tiyopenton) kanştırılmamalı veya aynı iğneden alkali solüsyonu takiben uygulanmamalıdır. NİMBEX, ketorolak, trometamol ve propofol enjektabl emülsiyon ile geçimli değildir. İntravenöz olarak uygulanan diğer ilaçlarda olduğu gibi, enjeksiyon bölgesi olarak küçük bir ven seçildiği zaman NİMBEX uygulamasını takiben damar, uygun bir i.v. sıvısı ile (öm.: sodyum klorür i.v. infuzyon (%0.9 a/h) ile) ven yıkanmalıdır.İzleme:
Diğer nöromüsküler blokör ilaçlarla olduğu gibi NİMBEX uygulaması sırasında bireysel doz ihtiyacını belirlemek için nöromüsküler fonksiyonun izlenmesi önerilir.6.3. Raf ömrü
24 ay6.4. Saklamaya yönelik özel tedbirler
2°C ve 8°C arasında saklayınız. Işıktan koruyunuz. Dondurmayınız. NtMBEX antimikrobiyal koruyucu içermez, bu nedenle dilüsyon işlemi kullanılmadan hemen önce yapılmalıdır ve seyreltmeyi takiben mümkün olduğu kadar çabuk, hemen uygulanmalıdır. İnfüzyon sıvısı ile seyrehilmiş solüsyon veya kullanılmış açık ampul atılmalıdır.6.5. Ambalajın niteliği ve içeriği
5 mİ, 5 ampul (2mg/ml), karton kutuda6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Tüm kullamimayan ürün ve atık maddeler Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği ne uygun olarak imha edilmelidir.Ampul açma talimatları:
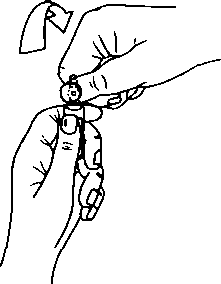
Ampuller OPC (Tek Kırma Noktası) açma sistemi ile donatılmışlardır ve aşağıdaki talimatlar doğrultusunda açılmalıdırlar:
Ampulü, resim 1 'de gösterildiği gibi alt kısmından tutunuz
Resim 2'de gösterildiği gibi diğer elinizin başparmağını ampuldeki renkli noktaya bastınnız
Şekil 2
Şekil

7. RUHSAT SAHİBİ
GlaxoSmithK]ine İlaçları San. ve Tic. A.Ş., Levent/İstanbul,
Büyükdere cad. No. 173, 1.Levent Plaza, B Blok 34394 1 Levent/istanbul
0 212 339 44 00 0 212 339 45 00
Tel no: Faks no:
8. RUHSAT NUMARASI
104/979. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ
İlk Ruhsat Tarihi: 23.11.1998 Ruhsat Yenileme Tarihi:10. KÜB*ün YENİLEME TARİHİ
İlaç Bilgileri
Nimbex 10mg/5ml Enjektabl Ampul
Etken Maddesi: Sisatrakuryum besilat
Atc Kodu: M03AC11
Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.