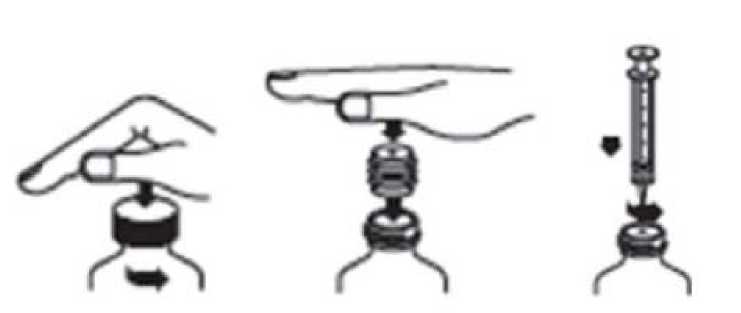
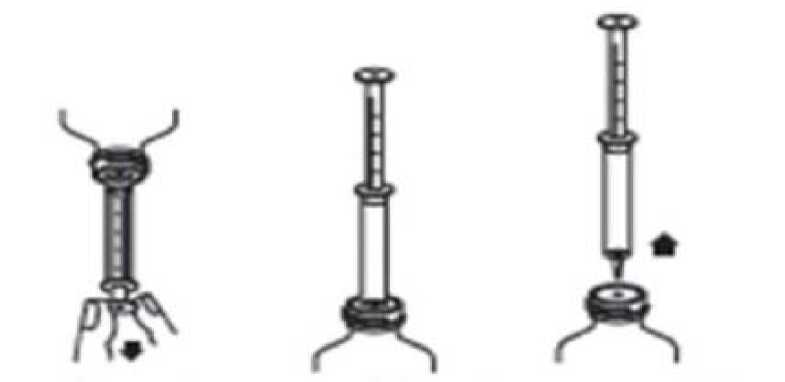
Regapen 20 Mg/ml Oral Çözelti Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIREGAPEN 20 mg/ml oral çözelti 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Pregabalin....................20 mg Yardımcı maddeler:Metil parahidroksibenzoat (E218)..................1,3 mg Propil parahidroksibenzoat (E216)...............0,16 mg Yardımcı maddeler için 6.1 'e bakınız. 3. FARMASÖTİK FORMOral kullanım için çözelti Berrak, renksiz, çilek aromalı çözelti 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarNöropatik ağrıREGAPEN periferik nöropatik ağrıda endikedir. EpilepsiREGAPEN sekonder jeneralize konvülsiyonların eşlik ettiği ya da etmediği parsiyel konvülsiyonlu yetişkin hastalarda ek tedavi olarak endikedir. Yaygın anksiyete bozukluğuREGAPEN yaygın anksiyete bozukluğunda endikedir. FibromiyaljiREGAPEN fibromiyalji tedavisinde endikedir. 4.2. Pozoloji ve uygulama şekliPozolojiGünlük doz aralığı 150-600 mg (7.5 ml - 30 ml) aç ya da tok karnına alınabilir Uygulama sıklığı ve süresi:Nöropatik ağrıREGAPEN tedavisinin önerilen başlangıç dozu, aç ya da tok karnına günde iki kez 75 mg olmak üzere 150 mg/gün'dür (7.5 ml/gün). Her bir hastanın yanıtına ve tolere edilebilirliğine göre doz, 3 ile 7 günlük bir aralıktan sonra günde iki kez 150 mg'a (300 mg/gün=15 ml/gün) ve gerekirse, ek bir haftadan sonra günde ikikez 300 mg'lık (600 mg/gün=30 ml/gün) maksimum doza çıkartılabilir. 1EpilepsiREGAPEN tedavisinin önerilen başlangıç dozu, aç ya da tok karnına günde iki kez 75 mg'dır (150 mg/gün=7.5 ml/gün). Her bir hastanın yanıtına ve tolere edilebilirliğine göre doz, 1haftadan sonra günde iki kez 150 mg'a (300 mg/gün=15 ml/gün) ve gerekirse, ek bir haftadansonra günde iki kez 300 mg'lık (600 mg/gün=30 ml/gün) maksimum doza çıkartılabilir. Yaygın anksiyete bozukluğuDoz aralığı ikiye bölünmüş dozlar halinde, günlük 150 - 600 mg'dır (7.5 ml/gün ile 30 ml/gün arası). Tedaviye devam edilmesinin gerekliliği düzenli olarak tekrar değerlendirilmelidir. REGAPEN tedavisi günlük 150 mg (7.5 ml/gün) dozunda başlatılabilir. Hastaların tedaviye bireysel yanıtına ve tolere edebilirliklerine göre 1 hafta sonra doz günlük 300 mg'a (15 ml/gün)çıkartılabilir. Bu haftayı takip eden, ilave 1 hafta sonrasında günlük doz 450 mg'a (22.5 ml/gün)artırılabilir ve ek 1 haftadan sonra 600 mg'lık (30 ml/gün) maksimum günlük doza ulaşılabilir. FibromiyaljiDoz aralığı ikiye bölünmüş dozlar halinde günlük 300- 450 mg'dır (15 ml/gün ile 22.5 ml/gün). Başlangıç dozu günde iki kez 75 mg'dır (150 mg/gün=7.5 ml/gün). Etkinlik ve tolerabiliteyegöre 1 hafta içinde doz günde iki kez 150 mg'a (300 mg/gün=15 ml/gün) çıkartılabilir. 300mg'lık günlük dozdan yeterli fayda sağlayamayan hastalar dozu, günde iki kez 225 mg (450mg/gün=22.5 ml/gün) şeklinde arttırabilir. Uygulama şekli:Ağızdan alınır. REGAPEN yemeklerle birlikte veya aç karnına alınabilir. REGAPEN, oral enjektör ve basmalı şişe adaptörü (BŞA) ile birlikte sunulmaktadır. Kullanma talimatları için bölüm 6.6'ya bakınız. Pregabalin tedavisine son verilmesi: Nöropatik ağrı, epilepsi, yaygın anksiyete bozukluğu veya fibromiyalji için uygulanan pregabalin tedavisinin sona erdirilmesi gerekirse, en az bir haftaya yayılarak, kademeli şekildesonlandırılması tavsiye edilir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Pregabalin sistemik dolaşımdan başlıca renal yolla değişmemiş ilaç şeklinde atılır. Pregabalin klerensi kreatinin klerensi ile doğru orantılı olduğundan (bkz. 5.2 Farmakokinetik özellikleri),renal fonksiyonları yetersiz hastalarda doz , Tablo 1 'de gösterildiği şekilde, aşağıdaki formülkullanılarak kreatinin klerensine (CLcr) göre bireyselleştirilmelidir (bkz. Bölüm 5.2Farmakokinetik özellikler, Hastalardaki karakteristik özellikler, Böbrek yetmezliği) . 1.23 [140-yaş (yıl)] x ağırlık (kg) CLcr(ml/dak) = - (x 0.85 kadın hastalar) serum kreatinin (pmol/L) Pregabalin hemodiyaliz yoluyla etkin şekilde plazmadan uzaklaştırılır (4 saat içinde ilacın %50'si). Hemodiyaliz gören hastalarda, pregabalinin günlük dozu renal fonksiyonlara göreayarlanmalıdır. Günlük doza ek olarak, her bir 4 saatlik hemodiyaliz tedavisinin hemensonrasında ek bir doz verilmelidir (bkz. Tablo 1). 2
TID = Günde üç doz BID = Günde iki dozQD = Günde tek doz * Toplam günlük doz (mg /gün) mg/doz sağlayacak şekilde doz rejimiyle belirtildiği gibi bölünmelidir Karacier yetmezlii:Karaciğer yetmezliği olan hastalarda herhangi bir doz ayarlamasına gerek yoktur (bkz. Bölüm 5.2 Farmakokinetik özellikler, Hastalardaki karakteristik özellikler, Karaciğer yetmezliği). Pediyatrik popülasyon:Pregabalinin 12 yaş altı pediyatrik hastalarda ve adolesanlarda (12-17 yaş arası) güvenlilik ve etkililiği belirlenmemiştir. Mevcut verilere Bölüm 4.8, 5.1, ve 5.2'de yer verilmiştir ancakpozoloji tavsiyesinde bulunmak mümkün değildir. Geriyatrik popülasyon (>65ya):Böbrek fonksiyonları normal olan yaşlı hastalarda herhangi bir doz ayarlamasına gerek yoktur (Bkz. Tablo 1). Böbrek fonksiyonları azalan yaşlı hastalarda pregabalinin dozunun azaltılmasıgerekebilir (bkz. Bölüm 5.2 Farmakokinetik özellikler, Hastalardaki karakteristik özellikler,Geriyatrik popülasyon). 34.3.KontrendikasyonlarEtkin maddeye veya içeriğindeki herhangi bir maddeye karşı aşırı duyarlılığı olan hastalarda kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriAntiepileptik ilaçlarla tedavi edilen hastalarda intihar düşüncesi ve davranışı bildirilmiştir. Bu nedenle hastalar intihar düşüncesi ve davranışı açısından yakından izlenmelidir. İntihardüşüncesi ve davranışı ortaya çıktığında, hasta ve hasta yakınının tıbbi destek almasıönerilmektedir. Klinik deneyimlere bağlı olarak, pregabalin tedavisi nedeniyle kilo artışı görülen diyabet hastalarında, hipoglisemik ilaçların dozu tekrar gözden geçirilmelidir. Pazarlama sonrasında anjiyoödemi de içeren aşırı duyarlılık reaksiyonları bildirilmiştir. Yüzde, ağız içinde veya üst solunum yolunda şişme gibi anjiyoödem belirtileri ortaya çıkarsapregabalin derhal kesilmelidir. Pregabalin tedavisi, somnolans (uyku hali) ve baş dönmesine neden olabileceğinden, yaşlı hastalarda kaza sonucu yaralanmaların (düşme) oranını artırabilir. Pazarlama sonrasıraporlarda bilinç kaybı, konfüzyon ve zihinsel bozukluk bildirilmiştir. Dolayısıyla hastalar,ilacın tüm potansiyel etkileri konusunda yeterli deneyime sahip oluncaya kadar dikkatliolmaları konusunda uyarılmalıdır. Kontrollü klinik çalışmalarda, pregabalin ile tedavi gören hastalarda plasebo ile tedavi gören hastalara kıyasla bulanık görme daha yüksek oranda bildirilmiştir. Ancak tedaviye devamedilmesi ile bu yan etki hastaların büyük bir kısmında ortadan kalkmıştır. Oftalmolojik testlerindeğerlendirildiği kontrollü klinik çalışmalarda, görüş keskinliğinde azalma ve görme alanındadeğişiklikler, pregabalin tedavi grubunda plasebo grubuna göre daha sık bildirilmiştir. Plasebotedavi grubunda ise, fundoskopik değişiklikler daha fazla bildirilmiştir. Pazarlama sonrası deneyimde, pregabalin ile tedavi gören hastalarda geçici olarak görme kaybı, görmede bulanıklık ve görme netliğinde başka değişiklikler bildirilmiştir. Pregabalininkesilmesi ile bu semptomlar iyileşebilir veya sona erebilir. Antiepileptik ilaç tedavisine pregabalin eklenmesi ile nöbet kontrolü sağlandıktan sonra, pregabalin ile monoterapiye geçilirken eş zamanlı kullanılan antiepileptiklerin çekilmesineilişkin yeterli bilgi bulunmamaktadır. Pregabalinle kısa veya uzun dönem tedavinin kesilmesinden sonra, bazı hastalarda çekilme semptomları görülmüştür. Aşağıdaki olaylar bildirilmiştir: Uykusuzluk, baş ağrısı, bulantı,ishal, grip benzeri semptomlar, anksiyete, sinirlilik, depresyon, ağrı, hiperhidroz, baş dönmesive anlamlı fiziksel bağımlılık. Tedaviye başlarken hasta bunlar hakkında bilgilendirilmelidir. Pregabalin tedavisi süresince veya tedavinin kesilmesinden kısa bir süre sonra, status epileptikus ve grand mal nöbetleri de dahil olmak üzere, konvülsiyonlar meydana gelebilir.Uzun süreli pregabalin tedavisinin sonlandınlması ile ilgili olarak veriler, çekilmesemptromlarının sıklığı ve şiddetinin pregabalin dozuyla ilişkili olabileceğini gösermektedir. 4Tüm antiepileptik ilaçlarda olduğu gibi, pregabalin de yavaş yavaş, en hızlı bir hafta içinde kesilmelidir. Pregabalin tedavisine son verilmesinin, böbrek yetmezliğinin geri dönüşümüne etkileri ile ilgili bir çalışma yapılmamış olmakla birlikte, tedaviye son verilmesini veya dozun azaltılmasınıtakiben böbrek fonksiyonunda iyileşme bildirilmiştir. Sebep-sonuç ilişkisi belirlenmemiş olsa da, pazarlama sonrası raporlarda pregabalin alan bazı hastalarda konjestif kalp yetmezliğinin geliştiği rapor edilmiştir. Bu etkilere nöropatik ağrılarakarşı pregabalin kullanan yaşlı hastalarda daha sık rastlanmaktadır. Klinik olarak anlamlı birkalp veya periferik vasküler hastalığı olmayan hastalarla yapılmış kısa süreli klinikçalışmalarda, hipertansiyon veya konjestif kalp yetmezliği gibi kardiyovaskülerkomplikasyonlar ve periferik ödemle belirgin bir ilişki gösterilmemiştir. Şiddetli konjestif kalpyetmezliği olan hastalarda sınırlı veri olduğu için, bu hastalarda pregabalin dikkatlekullanılmalıdır (Bkz. Bölüm 4.8 İstenmeyen Etkiler). Pregabalinin kesilmesi ile semptomlariyileşebilir. Spinal kord hasarına bağlı santral nöropatik ağrı tedavisinde, özellikle somnolans olmak üzere merkezi sinir sisteminde görülen advers reaksiyonların görülme sıklığı artmıştır. Bu artıştedavide birlikte kullanılan diğer ilaçların (anti-spastik ajanlar gibi) ilave etkisi ile oluşabilir.Spinal kord hasarına bağlı santral nöropatik ağrı tedavisinde pregabalin reçetelendirilirken budurum göz önüne alınmalıdır. Pazarlama sonrası deneyimlerde, pregabalinin opioid analjezikler gibi konstipasyon yapma potansiyelleri olan ilaçlar ile birlikte kullanımı sonucunda alt gastrointestinal kanalfonksiyonlarında azalma (intestinal tıkanma, paralitik ileus, konstipasyon gibi) bildirilmiştir.Pregabalin ve opioidler birlikte kullanılacak ise, konstipasyonu önleyici tedbirler alınmasıdüşünülmelidir (özellikle kadın hastalarda ve yaşlı hastalarda). İlaç suistimali, kötüye kullanım ve bağımlılık bildirilmiştir. Daha önce ilaç kötüye kullanım hikayesi olan hastalar pregabalinin suistimali, kötüye kullanımı ya da bağımlılık belirtilerinekarşı gözlenmelidir. Çoğunlukla ensefalopatiye zemin hazırlayan koşullar altındaki hastalarda, ensefalopati raporları bildirilmiştir. REGAPEN oral çözelti, alerjik reaksiyonlara (muhtemelen gecikmiş) ve olağanüstü olan bronkospazma sebebiyet verebilen metil parahidroksitbenzoat ve propil parahidroksibenzoatiçerir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriPregabalin çoğunlukla idrarla değişmeden atıldığı, önemsiz derecede metabolize olduğu (dozun <% 2'si metabolit şeklinde idrarla atılır), in vitroolarak ilaç metabolizmasını inhibeetmediği ve plazma proteinlerine bağlanmadığı için farmakokinetik etkileşim yaratma veyafarmakokinetik etkileşime uğrama olasılığı düşüktür. Buna göre, in vivo çalışmalardapregabalin ile fenitoin, karbamazepin, valproik asit, lamotrijin, gabapentin, lorazepam,oksikodon veya etanol arasında klinik açıdan önemli bir farmakokinetik etkileşimgözlenmemiştir. Buna ek olarak, popülasyon farmakokinetik analizi oral antidiyabetikler,5diüretikler, insülin, fenobarbital, tiagabin ve topiramat gibi sık kullanılan anti-epileptik ilaçların pregabalin klerensi üzerinde klinik olarak anlamlı bir etkisi olmadığını göstermiştir. Pregabalinin noretisteron ve/veya etinil östradiol içeren oral kontraseptifler ile birlikte alınması her iki ilacın da kararlı durum farmakokinetiğini etkilemez. Pregabalin etanol ve lorazepamın etkilerini güçlendirebilir. Kontrollü klinik çalışmalarda, pregabalinin oksikodon, lorazepam veya etanolle birlikte kullanılan çoklu oral dozları solunumüzerinde klinik açıdan önemli etkilere yol açmamıştır. Pazarlama sonrası edinilendeneyimlerde, pregabalin ve diğer merkezi sinir sistemini baskılayan ilaçlan alan hastalardasolunum yetmezliği ve koma rapor edilmiştir. Pregabalin, kognitif ve gros motorfonksiyonlarda oksikodonun yol açtığı bozukluğa katkı sağlar gibi görünmektedir. Özel popülasyonlara ilişkin ek bilgiler:Pediyatrik popülasyon:Etkileşim çalışmaları sadece yetişkinlerde gerçekleştirilmiştir. Geriyatrik popülasyon:Yaşlı gönüllülerde spesifik bir farmakodinamik etkileşim çalışması yürütülmemiştir. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik Kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Bu konuda yeterli bilgi bulunmamaktadır. Çocuk doğurma potansiyeli bulunan kadınlar REGAPEN tedavisi almakta iken uygun bir doğum kontrol yöntemi (kontrasepsiyon) kullanmakonusunda hekimine danışmalıdır. Gebelik dönemiHayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. Bölüm 5.3 Klinik öncesi güvenlilik verileri). İnsanlara yönelik potansiyel risk bilinmemektedir.Pregabalinin gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Anneye sağlayacağı yarar fetüse gelebilecek risk potansiyelinden fazla olmadıkça, gebelik sırasında pregabalin kullanılmamalıdır. Laktasyon dönemiPregabalin insanlarda anne sütüne geçmektedir (bkz. Bölüm 5.2). Pregabalinin yeni doğanlar /infantlar üzerine etkisi bilinmemektedir. Emzirmeye mi yoksa tedaviye mi son verileceğikararı, emzirmenin bebek için faydası ile tedavinin emziren kadın için yararı arasındadeğerlendirme yapılarak verilmelidir. Üreme yeteneği/ FertilitePregabalinin kadın fertilitesi üzerine etkisi ile ilgili klinik veri bulunmamaktadır. Pregabalinin sperm hareketliliği üzerine etkisini değerlendirmek için yürütülen bir klinik çalışmada, sağlıklıerkek deneklere 600 mg/gün dozunda pregabalin verilmiştir. 3 aylık tedavi sonrası spermhareketliliği üzerinde bir etkisi olmamıştır. 6Dişi sıçanlarda yürütülen fertilite çalışmasında üreme üzerine advers etkiler gözlenmiştir. Erkek sıçanlardaki fertilite çalışmalarında üreme ve gelişme üzerine advers etkilergözlenmiştir. Bu bulgulardaki klinik ilişki bilinmemektedir (bkz. Bölüm 5.3). 4.7. Araç ve makine kullanımı üzerindeki etkilerPregabalin baş dönmesi ve uyku haline neden olabilir. Bu nedenle, ilacın bu gibi aktiviteleri etkileyip etkilemediği bilinene kadar, hastalara araba kullanmaları, karmaşık makineleriçalıştırmaları veya tehlike potansiyeli barındıran başka aktivitelerde bulunmaları tavsiyeedilmez. 4.8. İstenmeyen etkilerPregabalin klinik programına, plasebo kontrollü çift kör çalışmalardaki 5600'den fazla hasta dahil olmak üzere toplam 8900'den fazla hasta katılmıştır. En yaygın şekilde bildirilen adversreaksiyonlar baş dönmesi ve uyku halidir. Advers etkiler genelde hafif ve orta şiddettedir.Bütün kontrollü çalışmalarda, advers etkiler yüzünden çalışmadan ayrılma oranı pregabalinalan hastalarda %%5'tir. Pregabalin tedavigruplarında çalışmadan ayrılmaya neden olan en yaygın advers reaksiyonlar baş dönmesi veuyku halidir. Fibromiyalji hastaları ile yürütülen klinik çalışmalarda pregabalin tedavigrubunda yan etkilere bağlı tedaviyi bırakma en sık baş dönmesi (% 6) ve uyku hali (% 3)nedeniyle olmuştur. Bu hasta grubunda, tedaviyi bırakmaya sebep olan diğer yan etkilerarasında ise yorgunluk, baş ağrısı, denge bozukluğu ve kilo artışı pregabalin tedavi grubundaplaseboya göre daha sık görülmüştür.Klinik çalışmaların toplu analizinde tedavi ile ilişkili olan istenmeyen etkiler aşağıdaki kategorilere göre listelenmiştir: çok yaygın >1/10; yaygın > 1/100 ile <1/10; yaygın olmayan>1/1.000 ile <1/100; seyrek >1/10.000 ile <1/1.000; çok seyrek <1/10.000; bilinmiyor: eldekiverilerden hareketle tahmin edilemiyor. Listede yer alan advers etkiler altta yatan bir hastalıktan veya birlikte kullanılan ilaçlardan da kaynaklanıyor olabilir. Spinal kord hasarına bağlı santral nöropatik ağrı tedavisinde, özellikle somnolans olmak üzere merkezi sinir sisteminde görülen advers reaksiyonların görülme sıklığı artmıştır. Pazarlama sonrası deneyimlerde bildirilen advers reaksiyonlar italik olarak gösterilmiştir. Enfeksiyonlar ve enfestasyonlarYaygın: Nazofarenjit Kan ve lenf sistemi bozukluklarıYaygın olmayan: Nötropeni Bağışıklık sistemi bozukluklarıYaygın olmayan: Aşırı duyarlılıkAnjiyoödem, alerjik reaksiyon7Metabolizma ve beslenme bozukluklarıYaygın: İştah artışı Yaygın olmayan: Anoreksi, hipoglisemi Psikiyatrik bozukluklarYaygın: Öfori hali, konfüzyon, irritabilite, dezoryantasyon, insomnia, libidoda azalma, anksiyete* Yaygın olmayan: Halüsinasyon, panik atak, huzursuzluk, ajitasyon, depresyon, depresif duygu durumu yükselmiş duygu durumu, agresyon,duygu durum dalgalanmaları, depersonalizasyon,kelime bulmada zorluk, anormal rüyalar, libidoda artış, anorgazm, apati,Seyrek: Disinhibisyon Sinir sistemi bozukluklarıÇok yaygın: Baş dönmesi, uyku hali, baş ağrısı Yaygın: Ataksi, koordinasyon bozukluğu, denge bozukluğu, amnezi, dikkat bozukluğu, hafıza bozukluğu, tremor, dizartri, parestezi, sedasyon, letarji, hipoestezi Yaygın olmayan: Senkop sersemlik/uyuşukluk, miyoklonus, bilinç kaybı,zihinsel bozukluk,malaz (halsizlik, kırıklık)Seyrek: Konvülsiyon,Göz bozukluklarıYaygın: Bulanık görme, diplopi Yaygın olmayan: Periferal görme kaybı, görme bozuklukları, görme alanında bozukluklar, göz kuruluğu, gözlerde şişme, görsel keskinlikte azalma, gözlerde ağrı, astenopi, fotopsi,gözyaşında artma, gözlerde iritasyon Seyrek: Görme kaybıkeratitKulak ve iç kulak bozukluklarıYaygın: Vertigo Yaygın olmayan: Hiperakuzi Kardiyak bozukluklarYaygın olmayan: Birinci derece AV blok, taşikardi, sinüs bradikardisi, konjestif kalp yetmezliğiQTuzaması,Vasküler bozukluklarYaygın olmayan: Hipotansiyon, hipertansiyon, yüz kızarması, sıcak basması, periferal soğukluk 8Solunum, göğüs bozuklukları ve mediastinal bozukluklarYaygın: Göğüste ağrı*, sinüzit*, faringolaringeal ağrı*Yaygın olmayan: Dispne, epistaksis, öksürük, nazal konjesyon, rinit, horlama, burunda kuruluk Seyrek: Pulmoner ödem,Gastrointestinal bozukluklarYaygın: Kusma, bulantı,diyare,dilde şişmeDeri ve deri altı doku bozukluklarıYaygın olmayan: Terleme, papüler döküntü, ürtiker, kaşıntıStevens-Johnson sendromuKas-iskelet, bağ doku ve kemik bozukluklarıYaygın: Kas krampları, artralji, sırt ağrısı, kol veya bacaklarda ağrı, servikal spazm, kas spazmı* Yaygın olmayan: Kas seğirmesi, eklemlerde şişme, miyalji, kas sertliği, boyunda ağrı Seyrek: Rabdomiyoliz Böbrek ve idrar yolu bozukluklarıYaygın olmayan: Dizüri, üriner inkontinans Seyrek: Oligüri, böbrek yetmezliği, üriner retansiyonÜreme sistemi ve meme bozukluklarıYaygın: Erektil disfonksiyonYaygın olmayan: Cinsel disfonksiyon, ejakülasyonda gecikme, dismenore, göğüs ağrısı Seyrek: Amenore, memede akıntı, meme büyümesi, jinekomastiGenel ve uygulama bölgesine ilişkin bozukluklarYaygın: Periferik ödem, ödem, yürüyüşte anormallik, sarhoşluk hissi, anormallik hissi, yorgunluk, düşme, sıvı retansiyonu*Yaygın olmayan: Yaygın ödem, göğüste sıkışma, yüz ödemi,AraştırmalarYaygın: Kilo artışı Yaygın olmayan: Kan kreatinin fosfokinazda yükselme, alanin aminotransferazda yükselme, aspartat aminotransferazda yükselme, trombosit sayısında azalma, kan glukozunda yükselme,kan kreatininde artma, kan potasyumunda düşme, kilo kaybı Seyrek: Lökosit sayısında azalma 9*Bu yan etkiler fibromiyalji hastaları ile yürütülen kontrollü klinik çalışmalarda bildirilmiştir. Kısa ve uzun süreli pregabalin tedavisi sonrası, ilacın kesilmesinin ardından bazı hastalarda kesilme semptomları görülmüştür. Bu semptomlar; insomnia, baş ağrısı, bulantı, anksiyete,diyare, grip sendromu, konvülsiyon, sinirlilik, depresyon, ağrı, hiperhidroz, sersemliktir, başdönmesi ve anlamlı fiziksel bağımlılıktır. Hastalar tedaviye başlamadan bu durum konusundabilgilendirilmelidir. Pregabalinin uzun süreli kullanımındaki veriler, kesilme semptomlarının sıklığının ve şiddetinin kullanım dozuna bağlı olabileceğini göstermektedir. Pediyatrik popülasyon: Pregabalinin, 2 pediyatrik çalışmada (farmakokinetik ve tolerabilite çalışması n=65; 1 yıllık devam eden açık etiketli güvenlilik çalışması n=54) gözlenen güvenlilik profili, yetişkinçalışmalarında gözlenen profil ile benzerdir (bkz. Bölüm 4.2, 5.1 ve 5.2). Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi'ne (TÜFAM) bildirmeleri gerekmektedir (www.titck.gov.tr;[email protected]. Doz aımı ve tedavisiPazarlama sonrası edinilen deneyimde, pregabalinin aşırı dozda alındığında gözlenen en yaygın advers etkiler olarak somnolans, konfüzyon durumu, ajitasyon ve huzursuzluk bildirilmiştir.Nadir olarak koma vakaları bildirilmiştir. Pregabalin doz aşımının tedavisinde genel destekleyici önlemler alınmalı, gerekirse hemodiyalize de başvurulmalıdır (bkz. Bölüm 4.2 Pozoloji ve Uygulama şekli, Tablo 1). 5. FARMAKOLOJK ÖZELLKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Antiepileptikler ATCkodu: N03AX16 Etkin madde pregabalin, bir gama-aminobütirik asit (GABA) analoğudur ((S)-3-(aminometil)-5 -metileksanoik asit). Etki mekanizması:Pregabalin santral sinir sistemindeki voltaja duyarlı kalsiyum kanallarının yardımcı alt ünitesine (012-Ö proteini) bağlanır. Elde edilen kanıtlar, hayvan modellerinde analjezik ve antikonvülzan aktivite için pregabalinin 012-Ö bölgesine bağlanması gerektiğini göstermektedir. Buna ek olarak, pregabalin glutamat, 10noradrenalin ve P maddesi dahil olmak üzere çok sayıda nörotransmiterin salıverilmesini de azaltmaktadır. Bu etkilerin pregabalinin klinik farmakolojisi açısından önemi bilinmemektedir.Pregabalin reseptör bölgelerine afinite göstermez veya konvülsiyon ya da ağrı tedavisindekullanılan birçok yaygın ilacın etkisine bağlı yanıtlarda değişikliğe yol açmaz. PregabalinGABAa veya GABAb reseptörleriyle etkileşime girmez; direk olarak GABAa , GABAb veyabenzodiazepin reseptörlerine bağlanmaz, metabolik şekilde GABA'ya veya bir GABAagonistine dönüştürülmez; GABA geri alınımı veya yıkımının inhibitörü değildir. Bununlabirlikte, uzun süreli pregabalin uygulaması GABA taşıyıcı proteinin yoğunluğunu vefonksiyonel GABA transport hızını artırır. Pregabalin, hiperaljezi ve allodini de dahil olmak üzere nöropatik ve cerrahi sonrası ağrı bulunan hayvan modellerinde ağrıyla ilgili davranışları önler. Pregabalin aynı zamanda fareler ve sıçanlarda maksimum elektroşok tonik ekstensör nöbetleri, pentilentetrazol kaynaklı eşik klonik nöbetler, hipokampal doğum yapmış sıçanlardakidavranışsal ve elektrografik nöbetler ve DBA/2 odyojen farelerdeki tonik ve klonik nöbetler dedahil olmak üzere hayvan nöbet modellerinde de etkilidir. Pregabalin Strazburg Sıçanlarındagenetik absans nöbetlerindeki spontan absans nöbetlerinin meydana gelme sıklığını azaltmaz. Klinik DeneyimNöropatik ağrıEtkinlik, diyabetik nöropati, postherpetik nevralji ve omurilik yaralanmaları çalışmalarında gösterilmiştir. Etkinlik nöropatik ağrının diğer modellerinde çalışılmamıştır. Pregabalin, 10 kontrollü klinik araştırmada; 13 haftaya kadar günde iki kez (BID) ve 8 haftaya kadar günde üç kez (TID) dozunda çalışılmıştır. BID ve TID doz rejimlerinin tümü, güvenlilikve etkinlik profilleri açısından benzer bulunmuştur. Hem santral hem de periferik nöropatik ağrı için 12 haftaya kadar yürütülen klinik çalışmaların 1.haftasında ağrıda azalma görülmüş ve bu düzelme tedavi süresince devam etmiştir. Periferik nöropatik ağrı için yürütülen kontrollü klinik çalışmalarda pregabalin ile tedavi edilen hastaların %%%50'lik biriyileşme göstermiştir. Somnolans gözlenmeyen pregabalin kullanan hastalarda ilgili iyileşme% 33, plasebo kullananlarda ise %18 bulunmuştur. Somnolans gözlenen hastalarda yanıt oranıpregabalin için % 48 plasebo için % 16 olmuştur.Santral nöropatik ağrı için yürütülen kontrollü klinik çalışmalarda pregabalin kullanan hastaların % 22'si ve plasebo kullananların % 7'si ağrı skorlarında % 50'lik bir iyileşmegöstermiştir. EpilepsiPregabalinin ek tedavi olarak etkinliği, günde iki veya üç kez uygulanan 1052 hastanın yer aldığı üç adet 12 haftalık, randomize, çift kör, plasebo kontrollü, çok merkezli çalışmadaaraştırılmıştır. Hastalarda sekonder jeneralizasyonu olan veya olmayan refrakter parsiyelnöbetler var olup, başlangıç seviyesindeki ortalama nöbet oranları 28 gün başına 21-22,başlangıçtaki medyan nöbet oranları ise 28 gün başına 10-12 nöbettir. 11Pregabalinin epilepsideki etkinliği, plaseboya oranla nöbetteki azalmaya dayanan bütün çalışmalarda gösterilmiştir. Yanıt verenlerin oranı, tedavi sırasında parsiyel nöbet sıklıklarındabaşlangıca göre >% 50Tik bir azalma meydana gelen hastaların oranı olarak tanımlanmıştır.Yanıt verenlerin oranı, günde 150 mg'da % 14 - 31, günde 300 mg'da %40, günde 600 mg'da %43 - 51 iken bu oran plasebo için % 6 - 14 olup, doz yanıtına işaret etmektedir. Pregabalin, 3 kontrollü klinik araştırmada, 12 haftaya kadar günde iki kez veya günde üç kez dozunda çalışılmıştır. BID ve TID doz rejimlerinin tümü, güvenlilik ve etkinlik profilleriaçısından benzer bulunmuştur. 1. haftada nöbet sıklığında anlamlı bir azalma gözlenmiştir. Genel olarak, 12 haftalık tedavi döneminde nöbet sıklığında anlamlı bir azalma meydana gelmiştir. Pediyatrik popülasyon: Pregabalinin epilepside 12 yaş altındaki pediyatrik hastalarda ve adölesanlarda ekleme tedavi olarak kullanılmasına ilişkin etkililik ve güvenliliği belirlenmemiştir. 3 aylıktan 16 yaşınakadar olan hastaların katıldığı (n=65) farmakokinetik ve tolerabilite çalışmasında gözlenenadvers reaksiyonlar, yetişkinlerinki ile benzer olmuştur. 3 aylık- 16 yaş aralığındaki 54pediyatrik epilepsi hastasının katıldığı bir yıllık açık etiketli güvenlilik çalışmasının sonucunda,advers olaylardan pireksi ve üst solunum yolları enfeksiyonları pediyatrik hastalarda yetişkinhastalara göre daha sık gözlenmiştir (bkz. Bölüm 4.2, 4.8 ve 5.2). Yaygın anksiyete bozukluğuPregabalin 4 - 6 hafta süreli 6 kontrollü araştırmada, 8 hafta süreli yaşlılarda yürütülen bir çalışmada ve 6 ay süreli bir çift-kör, uzun dönemde relaps önleme araştırmasında çalışılmıştır. Yaygın anksiyete bozukluğu semptomlarında 1 hafta içinde düzelme olduğu Hamilton Anksiyete Değerlendirme Skalasında (HAM-A) gözlenmiştir. 4-8 hafta süren kontrollü klinik araştırmalarda, pregabalin ile tedavi edilen hastaların %52'si ve plasebo alan hastaların %38'i başlangıçtan çalışma sonuna kadar HAM-A toplam puanında enaz %50 iyileşme kaydetmiştir. Kontrollü klinik çalışmalarda pregabalin ile tedavi gören hastalarda plasebo ile tedavi görenlere göre daha yüksek oranda bulanık görme bildirilmiş olup, vakaların çoğunluğunda devam edendozlarda son bulmuştur. Kontrollü klinik çalışmalarda 3600'ü aşkın hastada oftalmolojik testler (görsel keskinlik, formal görme alanı testi ve dilate funduskobik incelemeyi içerecek şekilde) değerlendirilmiştir.Pregabalin ile tedavi gören hastaların %6.5'i ve plasebo ile tedavi gören hastaların %4.8'indegörsel keskinlik azalmıştır. Pregabalin ile tedavi gören hastaların %12.4'ünde ve plasebo iletedavi gören hastaların %11.7'sinde görme alanı değişiklikleri belirlenmiştir. Pregabalin iletedavi gören hastaların %1.7'sinde ve plasebo ile tedavi gören hastaların %2.1'indefunduskobik değişiklikler gözlenmiştir. FibromiyaljiPregabalinin etkinliği 14 hafta süren çift-kör, plasebo kontrollü, çok merkezli bir çalışmada ve 6 ay süren randomize geri çekilme çalışmasında gösterilmiştir. 1214 haftalık çalışmada pregabalinin günlük 300 mg, 450 mg ve 600 mg dozları plasebo ile karşılaştırmıştır. 11 puanlı ağrı değerlendirme sistemine göre 4 puan ve üzerinde ve 100 mmağrı görsel analog skalasına (VAS) göre 40 mm ve daha üzerinde olan hastalar çalışmaya dahiledilmiştir. Çalışmada ortalama başlangıç ağrı skoru 6,7 'dir. Pregabalin grubuna randomizeedilen hastaların %64'ü çalışmayı tamamlamıştır. 450 mg/gün dozuna göre 600 mg/gün dozuile ağrı skorlarında daha fazla etki gözlenmemiş, bunun yanısıra doza bağlı advers etkilerbildirilmiştir. Hastaların bir kısmında 1. haftadan itibaren başlayan ağrıda azalma çalışmaboyunca devam etmiştir.Tedavide herhangi bir iyileşme gösteren hasta oranı; plasebo grubunda % 47,6 iken, pregabalin 300 mg/gün grubunda % 68,1, pregabalin 450 mg/gün grubunda % 77,8 ve pregabalin 600mg/gün grubunda % 66,1 'dir. 2. çalışma olan randomize geri çekilme çalışmasında hastalar 6 hafta boyunca toplamgünlükdoz 300 mg, 450 mg veya 600 mg olacak şekilde açık etiketli doz optimizasyon fazında titreedildiler. VAS skalasında ağrıda en az %50 azalma ve hastanın kendi değerlendirmesinde "çokiyi" veya "iyi" düzelme olduğunu bildirenler tedaviye yanıt verenler olarak tanımlandı.Tedaviye yanıt verenler çift kör tedavi fazına alınarak; ya açık etiketli dönemde ulaşılan dozladevam edecek şekilde ya da plasebo alacak şekilde randomize edilerek 6 ay boyunca takipedildiler. Açık etiketli dönemin başlangıcına göre çift kör fazın 2 ardışık ziyaretinde VASskorunda % 30'dan daha az bir azalma veya alternatif bir tedavi gerektirecek şekildefibromiyalji semptomlarında kötüleşme şeklinde tanımlanan terapötik cevap kaybına kadarolan süre ölçülerek etkinlik değerlendirildi. 6 haftalık açık etiketli faz sırasında hastaların %54'ü etkili ve tolere edilebilen bir doza titre edilebildiler. Randomize tedavi fazına girenhastalardan 26 haftalık tedaviyi tamamlayanların oranı pregabalin grubunda %38 iken plasebogrubunda %19 olmuştur. 5.2. Farmakokinetik özelliklerGenel özelliklerPregabalinin kararlı durum farmakokinetiği sağlıklı gönüllülerde, antiepileptik ilaç alan epilepsi hastalarında ve kronik ağrısı olan hastalarda benzerdir. Emilim: Pregabalin aç olarak uygulandığı zaman süratle emilip, hem tek hem de çoklu doz uygulama sonrasında doruk plazma konsantrasyonlarına 1 saat içinde ulaşılır. Pregabalinin oralbiyoyararlanımı > % 90 olup dozdan bağımsızdır. Tekrarlanan uygulama sonrasında, kararlıduruma 24 ile 48 saat içinde ulaşılır. Pregabalinin emilim hızı gıdalarla birlikte alındığındadüşer ve C maks 'ta yaklaşık % 25-30 bir azalmaya, T maks 'ta ise yaklaşık 2.5 saatlik birgecikmeye yol açar. Yine de pregabalinin gıdalarla birlikte alınmasının emilen pregabalinmiktarı üzerinde klinik açıdan önemli bir etkisi bulunmamaktadır. Dağılım: Preklinik çalışmalarda, pregabalinin fareler, sıçanlar ve maymunlarda kan beyin bariyerini geçtiği gösterilmiştir. Pregabalinin sıçanlarda plasentayı geçtiği ve laktasyon dönemindekisıçanların sütünde var olduğu gösterilmiştir. İnsanlarda, pregabalinin oral uygulamasonrasındaki görünen dağılım hacmi yaklaşık 0.56 L/kg'dır. Pregabalin plazma proteinlerinebağlanmaz. 13Biyotransformasyon: Pregabalin insanlarda göz ardı edilebilir bir metabolizmaya uğrar. Radyoaktif işaretli pregabalin dozu sonrasında, idrardaki radyoaktivitenin yaklaşık %98'i değişmemişpregabalindir. Pregabalinin idrarda bulunan ana metaboliti olan N-metillenmiş türevi, dozun%0.9'unu oluşturur. Preklinik çalışmalarda, pregabalin (S-enantiomer) rasemizasyon ileR-enantiomere dönüşmemiştir. Eliminasyon: Pregabalin sistemik dolaşımdan esas olarak renal eliminasyon yoluyla değişmemiş ilaç şeklinde atılır. Pregabalinin ortalama eliminasyon yarı ömrü 6.3 saattir. Pregabalinin plazmaklerensi ve renal klerensi kreatinin klerensi ile doğru orantılıdır (bkz. Bölüm 5.2Farmakokinetik özellikler, Hastalardaki karakteristik özellikler, Böbrek yetmezliği). Böbrekfonksiyonlarında azalma olan veya hemodiyaliz gören hastalarda doz ayarlaması gereklidir(bkz. Bölüm 4.2 Pozoloji ve Uygulama şekli, Tablo l) Doğrusallık / Doğrusal Olmayan Durum: Pregabalinin farmakokinetiği, tavsiye edilen günlük doz aralığında doğrusaldır. Pregabalinin gönüllüler arasındaki farmakokinetik değişkenliği düşüktür (<20%). Çoklu dozfarmakokinetiği tek doz verilerinden tahmin edilebilir. Dolayısıyla, pregabalinin plazmakonsantrasyonlannın rutin kontrolüne gerek yoktur. Hastalardaki karakteristik özelliklerCinsiyet: Klinik çalışmalar, cinsiyetin pregabalinin plazma konsantrasyonları üzerinde klinik açıdan önemli bir etkisinin bulunmadığını göstermektedir. Böbrek yetmezliği: Pregabalinin klerensi kreatinin klerensiyle doğru orantılıdır. Buna ek olarak, pregabalin plazmadan hemodiyalizle etkin şekilde uzaklaştırılmaktadır (4 saatlik hemodiyaliz sonrasındaplazma pregabalin konsantrasyonları yaklaşık olarak %50 düşmüştür). Böbrek ana atılım yoluolduğu için, böbrek yetmezliği olan hastalarda dozun azaltılması ve hemodiyalizin ardındandoz ilavesi gereklidir (bkz. Bölüm 4.2 Pozoloji ve Uygulama şekli, Tablo 1). Karaciğer yetmezliği: Karaciğer yetmezliği olan hastalarda spesifik farmakokinetik çalışmalar yürütülmemiştir. Pregabalin önemli oranda metabolize edilmediği ve idrarla çoğunlukla değişmemiş ilaçşeklinde atıldığı için karaciğer fonksiyon bozukluğunun pregabalin plazma konsantrasyonlarınıönemli derecede değiştirmesi beklenmemektedir. Pediyatrik popülasyon: Pediyatrik popülasyondaki (yaş grupları: 1 ila 23 aylık, 2 ila 6 yaş, 7 ila 11 yaş ve 12 ila 16 yaş) epilepsi hastalarında pregabalinin farmakokinetiği, farmakokinetik ve tolerabilite çalışmasındadeğerlendirilmiştir. Açlık durumunda pregabalinin oral alımını takiben plazma pik konsantrasyonuna ulaşma zamanı pediyatrik hastalarda genellikle tüm yaş gruplarınınki ile benzer olmuştur ve 0.5 saat ila2 saat arasındadır. Pregabalinin C maks ve eğri altı alan (EAA) parametreleri her yaş grubunda artan doz ile doğrusal olarak artmıştır. 30 kg'ın altındaki pediyatrik hastalarda pregabalinin EAA'sı, artmış 14vücut ağırlığı klerensi bu hastalar için %43'e ayarlandığından, > 30 kg olan hastalara göre %30 daha düşük olmuştur. Pregabalinin terminal yarılanma ömrü 6 yaşına kadar olan çocuklarda ortalama 3 ila 4 saat arasında , 7 ve daha büyük yaş grubundaki hastalarda ise 4 ila 6 saat arasında olmuştur. Popülasyon farmakokinetiği analizleri; kreatinin klerensi ile pregabalinin oral klerensinin belirgin şekilde eş değişken olduğunu, vücut ağırlığı ile de pregabalinin görünür oral dağılımhacmininin belirgin şekilde eş değişken olduğunu göstermiştir ve bu ilişkiler pediyatrik veyetişkin hastalar için benzer olmuştur. Pregabalinin farmakokinetiği 3 aydan küçük hastalar için çalışılmamıştır (bkz. Bölüm 4.2, 4.8 ve 5.1) Geriyatrik popülasyon: Pregabalin klerensi yaş ilerledikçe azalma eğilimi gösterir. Pregabalinin oral klerensindeki azalma, yaş ilerlemesine bağlı olarak kreatinin klerensinde meydana gelen değişikliklerletutarlılık göstermektedir. Yaşa bağlı olarak renal fonksiyonları azalan hastalarda pregabalindozunun azaltılması gerekebilir (bkz. bölüm 4.2 Pozoloji ve Uygulama Şekli Tablo 1). Emziren anneler: Pregabalinin farmakokinetiği, en az 12 haftalık doğum sonrası dönemindeki 10 emziren annede, her 12 saatte bir 150 mg pregabalin (300 mg günlük doz) verilerek değerlendirilmiştir.Emzirmenin, pregabalinin farmakokinetiği üzerine çok az etkisi olmuş ya da hiç etkisiolmamıştır. Pregabalin maternal plazmada ortalama kararlı durum konsantrasyonları yaklaşık% 76 olan hastalarda anne sütüne geçmektedir. 300 mg/gün veya maksimum doz olan 600mg/gün dozlarında pregabalin kullanan hastaların anne sütünden (ortalama süt tüketiminin 150ml/kg/gün olduğu varsayılmıştır), infant dozun sırasıyla 0.31 veya 0.62 mg/kg/gün olmasıbeklenmektedir. Bu tahmini dozlar, mg/kg bazında toplam günlük maternal dozunun yaklaşık% 7'sidir. 5.3. Klinik öncesi güvenlilik verileriHayvanlardaki konvansiyonel güvenlilik farmakoloji çalışmalarında, pregabalin klinik olarak ilgili dozlarda iyi tolere edilmiştir. Sıçanlarda ve maymunlarda tekrarlanan doz toksisiteçalışmalarında hipoaktivite, hiperaktivite ve ataksi de dahil olmak üzere MSS etkilerigörülmüştür. İnsanlara önerilen maksimum klinik doz uygulamasının >5 katı doza, yaşlı albinosıçanların uzun dönem maruziyeti sonrasında, retinal atrofi insidansında artış genel olarakgözlenmiştir. Teratojenite: Pregabalin fareler, sıçanlar veya tavşanlarda teratojen değildir. Sıçanlarda ve tavşanlarda fetal toksisite yalnızca insan maruziyetinin üzerindeki dozlarda ortaya çıkmıştır. Prenatal/postnataltoksisite çalışmalarında, pregabalin tavsiye edilen maksimum insan maruziyet seviyesinin >2katı maruz kalma seviyelerinde sıçanlarda yavru gelişim toksisitesine yol açmıştır. Fertilite: Erkek ve dişi sıçanlarda fertilite üzerine advers etki yalnızca terapötik maruziyeti aşan maruziyet ile gözlenmiştir. Erkek üreme organlarında ve sperm parametreleri üzerine adversetkiler geri dönüşlüdür ve yalnızca terapötik maruziyeti aşan yeterli maruziyet sonrası oluşmuş 15veya sıçanda erkek üreme organının spontan dejenaretif gelişimleri ile ilişkilendirilmiştir. Bu nedenle etkinin çok az olduğu ya da hiç olmadığı düşünülmüştür. Mutajenite: Pregabalin bir dizi in vitro ve in vivo testlerin sonuçlarına göre genotoksik değildir. Karsinogenez: Pregabalin ile fareler ve sıçanlar üzerinde iki yıllık karsinogenez çalışmaları yürütülmüştür. Önerilen maksimum klinik doz olan 600 mg/gün'deki ortalama insan dozu maruziyetinin 24katında sıçanlarda tümör gözlenmemiştir. Farelerde, ortalama insan dozu uygulaması benzerimaruziyetlerde tümör insidansında artış gözlenmemiştir, ancak artan maruziyettehemanjiosarkom insidansında artış gözlenmiştir. Farelerde pregabalin ile ilgili genotoksikolmayan tümör oluşma mekanizması trombosit değişiklikleri ve endotel hücreproliferasyonunu içermektedir. Kısa dönem ve sınırlı sayıda uzun dönem klinik verilerdoğrultusunda bu trombosit değişiklikleri sıçanlarda veya insanlarda bulunmamıştır. İnsanlarlailgili bir risk olduğu izlenimini oluşturacak bir kanıt bulunmamaktadır. Genç sıçanlarda görülen toksisite tipleri kalitatif olarak yetişkin sıçanlarda görülenlerden farklı olmamıştır. Ancak genç sıçanlar daha hassastır. Terapötik dozlarda MSS klinik belirtilerihiperaktivite ve bruksizm ve büyümede bazı değişiklikler (kilo almanın geçici olarakbaskılanması) bulunmaktadır. Çiftleşme dönemlerine olan etkisi insan terapötik dozuygulamasının 5 katında incelenmiştir. Genç sıçanlar üzerinde maruziyetten 1-2 hafta sonrainsan terapötik dozlarının >2 katında (akustik irkilme yanıtı) veya >5 katında (öğrenme/hafıza)nörodavranışsal/kognitif etkileri izlenmiştir. Genç sıçanlarda, insan terapötik dozlarının >2katında maruziyetten 1-2 hafta sonra gözlenen azalmış akustik irkilme yanıtı, maruziyetten 9hafta sonra artık gözlenmemiştir. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiMetil parahidroksibenzoat (E218) Sodyum fosfat monobazik anhidrat Sodyum fosfat dibazik anhidratPropil parahidroksibenzoat (E216) Çilek aroması SukralozSaf su 6.2. GeçimsizliklerMevcut değildir. 6.3. Raf ömrü24 ay Şişe açıldıktan sonra 25°C'nin altındaki oda sıcaklığında 45 gün saklanabilir. 6.4. Saklamaya yönelik özel tedbirlerOda sıcaklığında 25°C'nin altında oda sıcaklığında, ambalajında saklanmalıdır. 166.5. Ambalajın niteliği ve içeriğiBir karton kutu içerisinde 473 ml oral çözelti içeren bastır çevir kilitli kapağı olan beyaz yüksek yoğunluklu polietilen (HDPE) şişe. Kutu aynı zamanda oral enjektör ve bir Basmalı ŞişeAdaptörü (BŞA) içermektedir. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği"ne uygun olarak imha edilmelidir. Uygulama Yöntemi 1. Şişe açılır ve ilk kullanımda Basmalı Şişe Adaptörü (BŞA) takılır (Şekil 1 ve 2). 2. Enjektör BŞA'ya yerleştirilir ve gerekli hacim ters çevrilmiş şişeden çekilir (Şekil 3 ve 4). 3. Doldurulan enjektör, dik konumdaki şişeden çıkartılır (Şekil 5 ve 6). 4. Enjektör içeriği ağız içerisine boşaltılır (Şekil 7). Gerekli doza ulaşmak için adım 2-4 gerektiği şekilde tekrarlanır (Tablo 1). 5. Enjektör durulanır ve şişenin kapağı değiştirilir (BŞA yerinde kalır) (Şekil 8 ve 9).
17
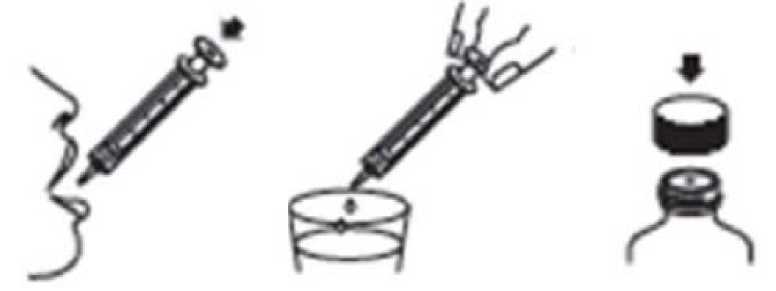 Şekil 7Şekil 8Şekil 9
187. RUHSAT SAHİBİİlko İlaç San. ve Tic. A.Ş. Veysel Karani Mah. Çolakoğlu Sok. No:10 34885 Sancaktepe /İstanbulTel: 0216 564 80 00Faks: 0216 564 80 99 8. RUHSAT NUMARASI2017/561 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 03.08.2017 Ruhsat yenileme tarihi: - 10. KUB'UN YENİLENME TARİHİ19 |
İlaç BilgileriRegapen 20 Mg/ml Oral ÇözeltiEtken Maddesi: Pregabalin Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.