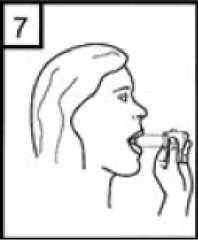
Pefsal 50 Mcg/500 Mcg İnhaler Kapsül Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIPEFSAL 50 mcg / 500 mcg inhaler kapsül 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Salmeterol ksinafoat 72,60 mikrogram Flutikazon propiyonat 500 mikrogram * 50 mikrogram salmeterole eşdeğer Yardımcı maddeler:Laktoz monohidrat (sığır kaynaklı) 19,83 miligram 3. FARMASÖTİK FORMİnhalasyon İçin Toz İçeren Kapsül Beyaz veya beyazımsı toz içeren kırmızı-kahverengimsi opak kapak ve şeffaf gövdeli sert jelatin kapsüller 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarAstım semptomlarının düzeltilmesi ve kontrol altına alınması amacıyla kullanılır. Astım hastalığının basamaklı tedavisinde 3. basamaktan itibaren verilir. Orta ve ağır KOAHolgularında semptomları ve atak sıklığını azaltır. 4.2 Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:PEFSAL sadece inhalasyon yolu ile uygulanır. Hastalar, belirtileri olmasa dahi optimum fayda için PEFSAL'i düzenli olarak kullanmaları gerektiği konusunda uyarılmalıdır. Hastaların düzenli olarak doktor kontrolünde bulundurularak aldıkları PEFSAL dozunun optimum düzeyde kalması sağlanmalı ve sadece doktor önerisi ile değiştirilmelidir. AstımDoz, belirtileri etkili olarak kontrol eden en düşük doza ayarlanmalıdır. Günde 2 kez uygulanan PEFSAL ile belirtilerin kontrolü sağlandığında, etkili en düşük doz açısından,günde 1 kez uygulanan PEFSAL de değerlendirmeye dahil edilebilir. Hastalara hastalıklarının şiddetine göre uygun flutikazon propiyonat dozu içeren PEFSAL verilmelidir. Eğer hasta yalnız inhale kortikosteroid tedavisi ile yeterli derecede kontrol edilemiyorsa tedavinin terapötik olarak eşdeğer kortikosteroid dozunda PEFSAL ile değiştirilmesi astımkontrolünde düzelme sağlayabilir. Astımı yalnız inhale kortikosteroid tedavisi ile yeterliderecede kontrol edilebilen hastalarda tedavinin PEFSAL ile değiştirilmesi astım kontrolünüsürdürürken kortikosteroid dozunun azaltılmasını sağlayabilir. Daha ayrıntılı bilgi için lütfenFarmakodinamik özellikler bölümüne bakınız. Tavsiye Edilen Dozlar:12 yaş ve üzeri ergenlerde:Günde 2 kez 1 inhalasyon (50 mikrogram salmeterol ve 100 mikrogram flutikazon propiyonat) veya günde 2 kez 1 inhalasyon (50 mikrogram salmeterol ve 250 mikrogram flutikazon propiyonat) veya günde 2 kez 1 inhalasyon (50 mikrogram salmeterol ve 500 mikrogram flutikazon propiyonat). 18 yaş ve üzeri yetişkinler:Yetişkinlerde 14 güne kadar tüm PEFSAL dozlarının iki katına çıkarılması ile düzenli olarak günde iki kez alınan doz karşılaştırılabilir güvenlilik ve tolerabilitededir ve bu durum astımtedavi rehberlerinde gösterildiği gibi hastalar ilave kısa süreli inhale kortikosteroid tedavisineihtiyaç duyduklarında (14 güne kadar) göz önünde bulundurulabilir. Kronik Obstrüktif Akciğer Hastalığı (KOAH)Yetişkin hastalar için tavsiye edilen doz günde 2 kez 1 inhalasyon 50/250 mikrogram - 50/500 mikrogram salmeterol/flutikazon propiyonattır. Günde iki kez alınan 50/500 mikrogramlık 2 / 27 maksimum PEFSAL dozunun tüm nedenlere bağlı ölümleri azalttığı gösterilmiştir ( bkz.Uygulama şekli:PEFSAL sadece inhalasyon yoluyla kullanılır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Doz modifikasyonu gerekli değildir. Pediatrik popülasyon:4 - 12 yaş arası çocuklarda PEFSAL 100 mikrogram kullanılır. 4 yaşından küçük çocuklarda PEFSAL kullanımı ile ilgili bilgi yoktur. Geriyatrik popülasyon:Doz modifikasyonu gerekli değildir. 4.3 KontrendikasyonlarPEFSAL, bileşenlerinden herhangi birine karşı aşırı duyarlılığı olan hastalarda kontrendikedir (bkz. 6.1 Yardımcı Maddeler Listesi). 4.4 Özel kullanım uyarıları ve önlemleriAstım tedavisinde normalde kademeli bir program izlemelidir ve hastanın yanıtı klinik olarak ve akciğer fonksiyon testleriyle izlenmelidir. PEFSAL hafif astım tedavisi için önerilmez. PEFSAL hızlı ve kısa etkili bir bronkodilatörün (örneğin salbutamol) kullanımını gerektiren akut belirtileri rahatlatmak için değildir. Hastalara rahatlamak için kullanmaları gerekenilaçları her zaman yanlarında bulundurmaları tavsiye edilmelidir. Belirtileri gidermek için kısa etkili bronkodilatör kullanımının artması astım kontrolünün kötüleştiğini gösterir ve bu durumda olan hastalar bir hekim tarafından tekrar muayeneedilmelidir. 3 / 27 Uzun etkili beta agonistler astım semptom kontrolünü sağlayan en kısa süre boyunca kullanılmalı ve astım kontrolüne ulaşıldığında eğer mümkünse kullanımları durdurulmalıdır.Sonrasında hastaların kontrol edici bir tedaviyle idamesi sağlanmalıdır. Astım kontrolünün ani ve ilerleyen şekilde kötüleşmesi hayatı tehdit eden bir durumdur ve hastanın bir hekim tarafından tekrar muayene edilmesi gereklidir. Kortikosteroid dozununartırılması düşünülmelidir. PEFSAL'in mevcut dozunun astımı yeterli derecede kontroledemediği durumda hasta hekim tarafından tekrar muayene edilmelidir. Hastalar alevlenme dönemlerinde ise ya da önemli ölçüde veya akut olarak kötüye giden astım şikayetleri varsa, uzun etkili beta agonistlerle tedaviye başlanmamalıdır. Astımlı ya da KOAH'lı hastalarda alevlenme bir enfeksiyon ile ilişkili ise ilave kortikosteroid tedavisi ve antibiyotik uygulanması düşünülmelidir. Astımlı hastalarda alevlenme riski nedeniyle PEFSAL tedavisi ani olarak kesilmemelidir, tedavi dozu hekim gözetiminde kademeli olarak azaltılmalıdır. KOAH'lı hastalarda tedavininkesilmesine semptomatik dekompanzasyon eşlik edebilir ve tedavinin kesilmesi bir hekimgözetiminde yapılmalıdır. KOAH'da yüksek doz kullanımının avantaj sağladığına ilişkin klinik kanıtlar yetersizdir.PEFSAL alan KOAH'lı hastalarla yapılan çalışmalarda (örn. TORCH) pnömoni bildirimlerinde artış olmuştur (bkz.4.8 İstenmeyen Etkiler). Alevlenme ve pnömoninin kliniközellikleri sıklıkla birbirleriyle örtüştüğünden, hekimler KOAH'lı hastalarda pnömonigelişmesi olasılığına karşı dikkatli olmalıdır.Kortikosteroid içeren tüm inhale ilaçlarla olduğu gibi, aktif veya sessiz akciğer tüberkülozu, fungal, viral ve diğer mikroorganizmalara bağlı havayolu enfeksiyonu olan hastalardaPEFSAL dikkatli kullanılmalıdır. PEFSAL tirotoksikozlu hastalarda dikkatli kullanılmalıdır. 4 / 27 Tüm sempatomimetik ilaçlarla, özellikle terapötik dozlardan daha yüksek dozlarda uygulandıklarında, bazen sistolik kan basıncında ve kalp hızında artış gibi kardiyovasküleretkiler görülebilir. Bu nedenle PEFSAL önceden kardiyovasküler hastalığı olanlarda dikkatlikullanılmalıdır. PEFSAL nadiren supraventriküler taşikardi, ekstrasistoller ve atriyal fibrilasyon gibi kalp aritmilerine ve yüksek terapötik dozlarda serum potasyumunda hafif geçici bir azalmayaneden olabilir. PEFSAL ağır kardiyovasküler bozukluklar veya kalp ritmi anormallikleri olanhastalarda ve şeker hastalığı, tirotoksikoz, düzelmemiş hipokalemi veya düşük serumpotasyum düzeylerine yatkın hastalarda dikkatli kullanılmalıdır. Tüm sempatomimetik ilaçlarla terapötik dozdan daha yüksek dozlarda uygulandıklarında serum potasyum düzeylerinde geçici bir azalma meydana gelebilir. Bu nedenle, düşük serumpotasyum düzeylerine eğilimi olan hastalarda PEFSAL dikkatli kullanılmalıdır. Herhangi bir inhale kortikosteroid özellikle yüksek dozlarda, uzun süre kullanıldığında sistemik etkiler oluşabilir. Oral kortikosteroid uygulamasına göre bu etkilerin oluşma olasılığıçok daha azdır ( bkz.4.9 Doz Aşımı). Olası sistemik etkiler; Cushing sendromu, Cushingbenzeri belirtiler, adrenal supresyon, çocukların ve adolesanların büyümesinde gecikme,kemik mineral dansitesinde azalma, katarakt ve glokomu içerir. Bu nedenle, astımı olanlardainhale kortikosteroid dozunun, etkili kontrolü sağlayan en düşük doza ayarlanması önemlidir.İnhale kortikosteroidler ile uzun süreli yüksek dozda tedavi adrenal supresyona ve akut adrenal krize neden olabilir. Flutikazon propionatın 500 ile 1000 mikrogram arası dozlarındaçok nadir olarak adrenal supresyon ve akut adrenal kriz vakaları görülmüştür. Travma,ameliyat, enfeksiyon veya dozajdaki herhangi hızlı bir azalma potansiyel olarak akut adrenalkrizi tetikleyebilir. Mevcut semptomlar tipik olarak belirsizdir ve iştahsızlık, karın ağrısı, kilokaybı, yorgunluk, baş ağrısı, bulantı, kusma, hipotansiyon, azalmış bilinç seviyesi,hipoglisemi ve kasılma nöbetlerini içerebilir. Stres yaratması muhtemel acil ve elektif durumlarda adrenal yanıt bozukluğu olasılığı daima akılda tutulmalıdır ve uygun kortikosteroid tedavisi düşünülmelidir (bkz. 4.9 Doz Aşımı). 5 / 27 Uzun süre inhale kortikosteroid tedavisi alan çocukların boyunun düzenli olarak izlenmesi tavsiye edilmektedir. Bazı bireyler inhale kortikosteroidlere çoğu hastada olduğundan daha fazla duyarlılık gösterebilir. Yetersiz adrenal cevap olasılığından dolayı, oral steroid tedavisinden inhale flutikazon propiyonat tedavisine geçirilen hastalar yakından izleyerek tedavi edilmeli ve adrenalfonksiyon düzenli olarak izlenmelidir. Sistemik kortikosteroidlerin kesilmesinden sonrahipotalamik pituiter adrenal aks (HPA) fonksiyonlarının düzelmesi için birkaç ay geçmesigerekmektedir. Stres ve şiddetli astım ataklarında sistemik steroid tedavisi kesilmiş olanhastalar tekrar oral kortikosteroid tedavisine başlamaları ve acil olarak hekimlerinebaşvurmaları hususunda bilgilendirilmelidir. İnhale flutikazon propiyonat tedavisinegeçildiğinde, sistemik steroid dozu yavaş yavaş azaltılmalı ve hastalar stres zamanlarında veşiddetli astım ataklarında ilave tedavi için gereklilik olabileceğini gösteren steroid uyarıkartları taşımaları hususunda teşvik edilmelidir. İnhale flutikazon propiyonat tedavisine başlandığında, sistemik steroid dozu kademeli olarak azaltılmalı ve hastalar stres zamanlarında ek tedavinin gerekli olabileceğini gösteren steroiduyarı kartı taşımaları konusunda teşvik edilmelidir. Nadiren kan glukoz düzeylerinde artış rapor edilmiştir (bkz.4.8 İstenmeyen Etkiler) ve diabetes mellitus öyküsü olan hastalara reçete edilirken bu husus göz önündebulundurulmalıdır.Uzun etkili beta agonist preparatlarına bağlı olarak nadiren, ciddi ve bazen ölümcül olabilen astım ile ilgili solunum problemleri meydana gelebilir. Diğer inhalasyon tedavilerinde olduğu gibi, uygulamadan sonra nefes darlığı ve hırıltılı solunumun aniden artmasıyla paradoksik bronkospazm ortaya çıkabilir. Paradoksikbronkospazm derhal hızla etki eden bir bronkodilatörle tedavi edilmelidir. PEFSAL derhalkesilmeli, hasta değerlendirmeli ve gerektiğinde alternatif bir tedavi başlatılmalıdır. 6 / 27 ABD'de yapılan SMART adlı büyük çaplı bir çalışmada standart tedaviye eklenen salmeterol (salmeterol-flutikazon propiyonatın bir bileşeni) veya plasebo karşılaştırılmış ve elde edilenverilere göre salmeterol uygulanan hastalarda astıma bağlı ölümlerde anlamlı bir artışgörülmüştür. Bu çalışmada elde edilen veriler Afro-Amerikalı hastaların, salmeterol kullanımısırasında plaseboya kıyasla solunum ile ilgili ciddi olay veya ölüm riskine daha fazla maruzkalabileceğini düşündürmektedir. Bu artışın farmakogenetiğe veya diğer faktörlere bağlı olupolmadığı bilinmemektedir. SMART çalışması, inhalasyon yoluyla eşzamanlı kortikosteroidkullanımının astıma bağlı ölüm riskini artırıp artırmadığının belirlenmesi amacıylatasarlanmamıştır. (Bkz 5.1 Farmakodinamik Özellikler) İnhale kortikosteroide ek olarak uzun etkili beta adrenerjik agonist kullanan pediatrik ve adölesan hastalarda, her iki ilaca uyumu garanti altında almak için, hem inhale kortikosteroidhem de uzun etkili beta agonist içeren bir kombinasyon preparatı kullanılması önerilir. P2 agonist tedavisinin tremor, çarpıntı ve baş ağrısı gibi geçici ve düzenli tedavi ile azalan farmakolojik yan etkileri bildirilmiştir. PEFSAL' in her bir dozu 19,83 miligrama kadar sığır kaynaklı laktoz içerir. Bu miktar, laktoz intoleransı olan kişilerde normalde bir probleme neden olmamaktadır. 4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriKullanımı zorunlu olmadıkça, selektif veya selektif olmayan beta-blokerlerin kullanılmasından kaçınılmalıdır. Diğer beta adrenerjik içeren ilaçların eşzamanlı kullanımı potansiyel aditif etkiye neden olabilir. Beta adrenerjik blokerler salmeterolün etkilerini zayıflatabilir veya antagonize edebilirler. Kullanımları için zorlayıcı nedenler olmadıkça seçici olmayan ve seçici P blokerlerinkullanımlarından kaçınılmalıdır. p2 agonist tedaviden dolayı ciddi derecede hipokalemi ortayaçıkabilir. Akut şiddetli astım tedavisinde ksantin türevleri, steroidler ve diüretiklerin eşzamanlı kullanımı etkiyi arttırma potansiyeli olduğundan, özellikle dikkat edilmelidir. B adrenerjik içeren ilaçlar ile birlikte kullanımı etkiyi potansiyel olarak arttırır. 7 / 27 Flutikazon propiyonatNormal şartlar altında, inhalasyon yolu ile uygulanmasından sonra, belirgin ilk geçiş metabolizması ve karaciğer ve bağırsakta sitokrom P450 3A4'ün aracılık ettiği yükseksistemik klerens sonucu, flutikazon propiyonatın plazma konsantrasyonları düşük düzeydekalır. Bu nedenle, flutikazon propiyonatın aracılık ettiği klinik olarak anlamlı ilaç etkileşimiolasılığı azdır. Sağlıklı gönüllüler üzerinde yapılan bir ilaç etkileşim çalışması, günde 2 kez 100 mg dozlarda uygulanan ritonavirin (oldukça güçlü sitokrom P450 3A4 inhibitörü), flutikazon propiyonatınplazma konsantrasyonlarını büyük oranda artırabildiğini ve serum kortizolkonsantrasyonlarında anlamlı azalmaya yol açtığını göstermiştir. Pazarlama sonrası kullanımsırasında intranazal veya inhale flutikazon propiyonat ve ritonavir alan hastalarda Cushingsendromu ve adrenal supresyon dahil sistemik kortikosteroid etkiler ile sonuçlanan klinikolarak anlamlı ilaç etkileşimleri bildirilmiştir. Bu nedenle, hastaya olan potansiyel yararısistemik kortikosteroid yan etkileri riskinden fazla olmadıkça, ritonavir ve flutikazonpropiyonatın birlikte kullanımından kaçınılmalıdır. Çalışmalar, diğer sitokrom P450 3A4 inhibitörlerinin, serum kortizol konsantrasyonlarında önemli bir düşüş olmadan flutikazon propiyonata sistemik maruziyette ihmal edilebilir(eritromisin) ve küçük (ketokonazol) artışlara neden olduklarını göstermiştir. Bununla birlikte,flutikazon propiyonata sistemik olarak maruz kalma potansiyeli artacağından, güçlü P4503A4 inhibitörleri (örneğin ketokonazol) ile birlikte kullanıldığında dikkatli olunmalıdır. SalmeterolBir ilaç etkileşim çalışmasında eşzamanlı sistemik ketokonazol kullanımının plazma salmeterol maruziyetini anlamlı derecede artırdığı gözlenmiştir (Cmaks 1.4 kat ve EAA 15 kat),bu durum EKG'de QTc aralığında uzamaya neden olabilir (Bkz 5.2 FarmakokinetikÖzellikler). Güçlü CYP3A4 inhibitörleri (örn, ketokonazol) ile salmeterol birlikteuygulandığında dikkatli olunmalıdır. Ketokonazol ile eşzamanlı kullanımından, tedavinin yararları salmeterolün artan sistemik yan etkiler riskinden daha yüksek olmadığı sürece kaçınılmalıdır. Diğer potent CYP3A4inhibitörleri ile benzer bir etkileşim riskinin olması muhtemeldir (örn, itrakonazol,telitromisin, ritonavir). 8 / 27 Eritromisin (günde üç defa 500 mg oral yoldan ) ve salmeterolün (günde iki kez 50 mikrogram inhalasyon ) 15 sağlıklı bireyde 6 gün boyunca birlikte kullanılması sonucu,salmeterol etkisinde anlamlı olmayan küçük bir artış gözlemlenmiştir(1.4 kat Cmax ve 1.2 katAUC). Eritromisin ile birlikte kullanımında ciddi herhangi bir yan etki beklenmez. 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)PEFSAL'in doğum kontrol yöntemleri üzerine etkisi olup olmadığına dair herhangi bir bilgi bulunmamaktadır. Gebelik dönemiGebelikte kullanım ile ilgili yeterli veri mevcut değildir. Hamile kadınlar hakkındaki veriler (300-1000 arası gebelik verileri) salmeterol ve flutikazon propiyonatın herhangi birmalformatif veya fetonatal / neonatal toksisitesinin olmadığını göstermektedir. Hayvanlarüzerinde yapılan çalışmalarda p2 adrenoreceptor agonistleri ve glukokortikoidlerin üremetoksisitesine neden olduğu gözlemlenmiştir (bkz. kısım 5.3). İnsanlara yönelik potansiyel riskbilinmemektedir. Tek ilaç veya kombinasyon halindeki ilaçlarla hayvanlar üzerinde yapılan üreme toksisite çalışmaları, güçlü bir beta 2 adrenoreseptör agonistinin ve glukokortikosteroidin aşırı sistemikmaruziyet seviyelerinde beklenen fötal etkilerini açığa çıkarmıştır. İlaç kullanımı ancak anneye sağlaması beklenen yararı fetusa olan olası bir riskten fazla ise düşünülmelidir. Bu sınıftaki ilaçlarla ilgili geniş klinik deneyim, etkilerinin terapötik dozlarla ilişkili olduğuna dair bir kanıt ortaya koymamıştır. Ne salmeterol ksinafoatın ne de flutikazon propiyonatıngenetik toksisite potansiyeline sahip olduğu gösterilmiştir. Gerekli olmadıkça gebelikdöneminde kullanılmamalıdır. 9 / 27 Laktasyon dönemiSalmeterol ksinafoat ve flutikazon propiyonatın gebelik ve emzirme döneminde kullanımı ile ilgili deneyimler yetersizdir. Emzirme döneminde tercihen kullanılmamalıdır. Sıçanlar üzerinde yapılan çalışmalar, salmeterol, flutikazon propiyonat ve metabolitlerinin, laktasyon döneminde süte geçtiğini göstermiştir. Terapötik dozlarda inhale edilen salmeterolve flutikazon propiyonatın plazma düzeyleri çok düşüktür ve buna bağlı olarak annesütündeki konsantrasyonların düşük olması muhtemeldir. Emziren hayvanlar üzerinde yapılançalışmalarda, sütte ölçülen düşük ilaç konsantrasyonlarıyla bu desteklenmiştir. Üreme yeteneği/Fertiliteİnsanlara yönelik veri yoktur. Hayvan üzerinde yapılan çalışmalar salmeterol veya flutikazon propiyonatın fertilite üzerine hiçbir etkisinin olmadığını göstermiştir. 4.7 Araç ve makine kullanımı üzerindeki etkilerPEFSAL'in araç ve makine kullanımı üzerinde herhangi bir etkisi yoktur. 4.8 İstenmeyen etkilerPEFSAL, salmeterol ve flutikazon propiyonat içerdiğinden her iki bileşenle de ilişkili olan tipte ve şiddette advers reaksiyonlar görülebilir. Bu iki bileşiğin birlikte verilmesiyle ilaveadvers etki bildirilmemiştir. Diğer inhalasyon tedavilerinde olduğu gibi, ilaç alındıktan sonra hırıltılı solunumda ani artış ile paradoksal bronkospazm oluşabilir. Bu durum hızlı ve kısa etkili inhale bronkodilatör ilehemen tedavi edilmelidir. Salmeterol/flutikazon propiyonat cihaz kullanımı hemen kesilmeli,hasta kontrol edilmeli ve gerekirse alternatif tedavi uygulanmalıdır. Salmeterol/flutikazon propiyonat ile ilgili advers olaylar aşağıda verilmiştir: Sıklık sınıflandırması, çok yaygın (>1/10), yaygın (>1/100 ve <1/10), yaygın olmayan (>1/1000 ve <1/100), seyrek (>1/10.000 ve <1/1000) ve 10 / 27 izole raporlar dahil çok seyrek (<1/10000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor) şeklinde tanımlanmıştır. Çok yaygın ve yaygın olaylar genellikle klinik çalışma verilerinden belirlenmiştir. Seyrek ve çok seyrek olaylar genellikle spontan verilere dayanmaktadır. Enfeksiyonlar ve enfestasyonlarYaygın: Ağız ve boğazda kandidiyazis, pnömoni, bronşit Seyrek: Özofageal kandidiyasis Bağışıklık sistemi hastalıklarıYaygın olmayan: Kütanöz aşırı duyarlılık reaksiyonları, anjiyoödem (temelde yüzde ve orofarinkste ödem)Seyrek: Solunum semptomları (dispne ve/veya bronkospazm), anafilaktik şok dahil, anafilaktik reaksiyonlar Endokrin hastalıklarıSeyrek: Cushing sendromu, Cushingoid özellikleri, adrenal süpresyon, çocuklar ve adolesanlarda büyüme geriliği, kemik mineral yoğunluğunda azalma. Göz hastalıklarıSeyrek: Katarakt, glokom. Metabolizma ve beslenme hastalıklarıYaygın: Hipokalemi Yaygın olmayan: Hiperglisemi Psikiyatrik hastalıklarYaygın olmayan: Anksiyete, uyku bozuklukları ve hiperaktivite ve iritabilite (temelde çocuklarda) dahil davranış değişiklikleri.Bilinmiyor: Depresyon, agresyon (çoğunlukla çocuklarda) Sinir sistemi hastalıklarıÇok yaygın: Baş ağrısı 11 / 27 Yaygın olmayan: Tremor Kardiyak hastalıklarYaygın olmayan: Palpitasyonlar, taşikardi, atrial fibrilasyon, angına pektoris Seyrek: Kardiyak aritmiler (supraventriküler taşikardi ve ekstrasistoller dahil) Solunum, göğüs bozuklukları ve mediastinal hastalıklarıÇok yaygın: Nazofarenjit Yaygın: Boğaz irritasyonu, ses kısıklığı/disfoni, sinüzit, pnömoni (KOAH'lı hastalarda) Seyrek: Paradoksik bronkospazm Deri ve deri altı doku hastalıklarıYaygın: Kontüzyonlar Kas-iskelet bozuklukları, bağdoku ve kemik hastalıklarıYaygın: Kas krampları, travmatik kırıklar, artralji, miyalji Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonların raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; eposta:[email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99) 4.9 Doz aşımı ve tedavisiSemptomlar ve bulgularSalmeterolSalmeterolün aşırı dozu ile beklenen belirtiler ve bulgular baş dönmesi, tremor, sistolik kan basıncında artışlar, taşikardi ve baş ağrısıdır. Hipokalemi de meydana gelebilir. Serumpotasyum seviyelerinin izlenmesi gereklidir. Potasyum replasmanı göz önündebulundurulmalıdır. 12 / 27 Flutikazon propiyonatAkut:Flutikazon propiyonatın tavsiye edilen dozlarının üzerindeki dozlarda akut inhalasyonu adrenal fonksiyonların geçici süpresyonuna neden olabilir. Bu durum acil önlem alınmasınıgerektirmez; bu hastalarda flutikazon propiyonat tedavisi astımı kontrol edecek düzeydesürdürülmelidir, adrenal fonksiyonların birkaç gün içinde eski haline döndüğü plazmakortizolü ölçülerek saptanabilir.Kronik:Önerilenin üzerindeki dozların alınmasına uzun süre devam edilirse bir miktar adrenal süpresyon oluşabilir. Adrenal rezervin izlenmesi gerekebilir. Flutikazon propiyonataşırı doz vakalarında tedaviye semptom kontrolünü sağlayan uygun dozlarda devam edilebilir.TedaviSalmeterolSalmeterolün aşırı dozu için tercih edilen antidot kardiyoselektif P-bloke edici ajandır. Kardiyoselektif P-bloke edici ajanlar bronkospazm geçmişi olan hastalarda son derece dikkatlikullanılmalıdır. Flutikazon propiyonatÖnerilenden fazla doz alan hastalar yakından kontrol edilmeli ve doz kademeli olarak azaltılmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerATC Kodu: R03A K06 Farmakoterapötik grubu: Kortikosteroidler ve diğer ilaçlar ile kombine adrenerjikler (antikolinerjik kombinasyonları hariç) Etki mekanizmasıPEFSAL farklı etki mekanizmalarına sahip salmeterol ve flutikazon propiyonat içerir. Salmeterol belirtilere karşı korurken, flutikazon propiyonat akciğer fonksiyonlarını düzeltir vealevlenmeleri önler. PEFSAL eşzamanlı olarak beta-agonist ve inhale kortikosteroid tedavisiuygulanan hastalar için daha uygun bir rejim sunabilir. Her iki ilacın da etki mekanizmalarıaşağıda verilmiştir: 13 / 27 SalmeterolSalmeterol, reseptörün dış bölgesine bağlanan bir uzun yan zinciri olan, selektif uzun etkili (12 saat) bir p2 -adrenoseptör agonistidir. Salmeterolün bu farmakolojik özellikleri histaminin neden olduğu bronkokonstriksiyonu daha etkili bir şekilde önler ve kısa etkili konvansiyonel p2 -agonistlerin önerilen dozlarına göre enaz 12 saat süren, daha uzun süreli bronkodilatasyon sağlar. İn vitrotestler salmeterolün, insan akciğerlerinde histamin, lökotrienler ve prostaglandin D2 gibi mast hücresi mediatörlerinin salıverilmesininin güçlü ve uzun süreli bir inhibitörüolduğunu göstermiştir.İnsanda salmeterol inhale edilen alerjenlere karşı erken ve geç faz yanıtlarını inhibe eder; geç faz yanıtı önleyici etkisi tek bir dozu takiben 30 saat boyunca, bronkodilatör etki sonaerdiğinde bile devam eder. Tek bir salmeterol dozu bronşiyal aşırı cevaplılığı azaltır. Buözellikler salmeterolün ilave olarak non-bronkodilatör aktivitesi olduğunu göstermektedirancak bu etkinin klinik açıdan anlamı tam olarak açıklığa kavuşmamıştır. Bu mekanizmakortikosteroidlerin anti-enflamatuvar etki mekanizmasından farklıdır. Flutikazon propiyonatFlutikazon propiyonat, tavsiye edilen dozlarda inhalasyon yoluyla verildiğinde akciğerlerde güçlü bir antienflamatuvar etki gösteren ve sistemik olarak verilen kortikosteroidlerlegözlenen yan tesirler olmadan astımın belirtilerini ve alevlenmelerini azaltan birglukokortikoidtir. İnhale flutikazon propiyonat ile kronik tedavi boyunca, günlük adrenokortikal hormon salıverilmesi, çocuklar ve yetişkinlerde tavsiye edilen en yüksek dozlarda bile genelliklenormal sınırlar içinde kalmıştır. Diğer inhale steroidlerden inhale flutikazon propiyonatageçildikten sonra, günlük adrenokortikal hormonların salıverilmesi geçmişte ve halen aralıklıoral steroid kullanımına rağmen tedricen düzelir, böylece inhale flutikazon propiyonat ilenormal adrenal fonksiyon değerlerine dönüldüğü gösterilmiş olur. Adrenal rezerv de kroniktedavi sırasında, stimülasyon testinde normal bir artışla ölçüldüğü üzere normal kalır. Bununlabirlikte önceki tedaviden kalan herhangi bir rezidüel adrenal bozukluğun önemli bir süredevam edebileceği göz önünde bulundurulmalıdır (bkz. 4.4 Özel kullanım uyarıları veönlemleri).14 / 27 5.2 Farmakokinetik özelliklerHayvanlarda veya insanlarda inhalasyon yoluyla birlikte uygulanan salmeterol ve flutikazon propiyonatın birbirlerinin farmakokinetiğini etkilediğine dair herhangi bir bulgu yoktur. Bu nedenle farmakokinetik açıdan her iki bileşen ayrı ayrı düşünülebilir. 15 sağlıklı denekte yapılan plasebo kontrollü, çapraz geçişli bir çalışmada 7 gün süreylebirlikte salmeterol (inhalasyon yoluyla günde iki kez 50 mikrogram) ve bir CYP3A4inhibitörü olan ketokonazol (oral yolla günde bir kez 400 mg) uygulanması plazma salmeterolmaruziyetinde anlamlı bir artışa neden olmuştur (Cmaks 1.4 kat ve EAA 15 kat). Tekrarlıdozlama ile salmeterol birikiminde bir artış bulunmamaktadır. Üç denekte QTc uzaması veyasinüs taşikardisinin eşlik ettiği palpitasyon nedeniyle, birlikte salmeterol ve ketokonazoluygulaması kesilmiştir. Kalan 12 denekte birlikte salmeterol ve ketokonazol uygulanması kalphızında, kan potasyumunda veya QTc aralığında klinik açıdan anlamlı bir etki yaratmamıştır.(bkz. 4.4 Özel kullanım uyarıları ve önlemleri ve 4.5 Diğer tıbbi ürünlerle etkileşimler vediğer etkileşim şekilleri) Emilim:Salmeterol Salmeterol akciğerlerde lokal olarak etki eder, bu nedenle plazma seviyeleri terapötik etkinin belirleyicisi değildir. Terapötik dozlarda inhalasyondan sonra çok düşük plazmakonsantrasyonları gösterdiği için (yaklaşık 200 pikogram /ml veya daha az) plazmadaki ilaçmiktarının tayini teknik olarak zor olduğundan salmeterolün farmakokinetiği ile ilgili sadecesınırlı veriler bulunmaktadır. Salmeterol ksinafoatın düzenli kullanımını takiben,hidroksinaftoik asit sistemik dolaşımda tayin edilebilir ve kararlı durum konsantrasyonlarıyaklaşık 100 ng/ml'ye ulaşır. Bu konsantrasyonlar, toksisite çalışmalarında gözlenen kararlıdurum konsantrasyonlarından 1000 kez daha düşüktür. Havayolu tıkanıklığı olan hastalardauzun süreli düzenli kullanımında (12 aydan fazla) herhangi bir zararlı etki görülmemiştir. Flutikazon propiyonat Her bir inhaler cihazı için flutikazon propiyonatın mutlak biyoyararlanımı inhalasyon veya intravenöz farmakokinetik verilerin çalışma içerisinde ve çalışmalar arasında karşılaştırılmasıile hesaplanmıştır. Sağlıklı erişkin deneklerde mutlak biyoyararlanımın, kullanılan inhalasyoncihazına göre %%11 arasında değişkenlik gösterdiği (flutikazon propiyonat15 / 27 Accuhaler/Diskus (%7.8), flutikazon propiyonat Diskhaler (%9.0), flutikazon propiyonat Evohaler (%10.9), salmeterol-flutikazon propiyonat Evohaler (%5.3) ve salmeterol-flutikazonpropiyonat Accuhaler/Diskus (%5.5)) belirlenmiştir. Bronşiyal astım ya da KOAHhastalarında flutikazon propiyonata sistemik maruziyetin daha az derecede olduğugörülmüştür. Sistemik absorpsiyon başlıca akciğerlerden gerçekleşir ve başlangıçta hızlı olupdaha sonra yavaşlamaktadır. Kalan inhale doz yutulabilir, fakat yutulan kısım sudaki düşükçözünürlüğü ve %1'den daha az oral biyoyararlanımla sonuçlanan presistemikeliminasyonundan dolayı sistemik maruziyete çok az katkıda bulunmaktadır. İnhale dozunartırılmasıyla sistemik maruziyette doğrusal artış olur.Dağılım:Salmeterol Salmeterolün plazma proteinlerine bağlanma oranı % 96'dır. Flutikazon propiyonat Flutikazon propiyonatın plazma proteinlerine bağlanma oranı % 91'dir Kararlı durumdaki dağılım hacmi geniştir (yaklaşık 300 L). Biyotransformasyon:Salmeterol İn vitrobir çalışma salmeterolün sitokrom P450 3A4 (CYP3A4) tarafından büyük oranda a-hidroksisalmeterole (alifatik oksidasyon) metabolize edildiğini göstermiştir.Flutikazon propiyonat Flutikazon propiyonat başlıca sitokrom P450 enzimi CYP3A4 tarafından inaktif karboksilik asite metabolize edilerek sistemik dolaşımdan çok hızlı temizlenir. CYP3A4 inhibitörleriolarak bilinen ajanlar ile birlikte kullanıldığında flutikazon propiyonata sistemik maruziyetpotansiyel olarak artacağından dikkatli olunmalıdır. Eliminasyon:Salmeterol Eliminasyon yarılanma ömrü 5.5 saattir. Salmeterolün % 60'ı dışkı ile % 25'i idrar ile itrah edilir. 16 / 27 Flutikazon propiyonat Flutikazon propiyonatın dispozisyonu, yüksek plazma klierensi (1150 L/dak) ve yaklaşık 8 saat olan terminal yarılanma ömrü ile karakterizedir. Flutikazon propiyonatın renal klerensiihmal edilebilir düzeydedir (< %%Hastalardaki karakteristik özelliklerBöbrek/Karaciğer yetmezliği:Veri bulunmamaktadır. Değişik yaş grupları:Popülasyon farmakokinetiği analizi, astım hastalarıyla ilgili veriler kullanılarak yapılmış (flutikazon propiyonat (FP) için 9 ve salmeterol için 5 klinik çalışma) ve aşağıdakilerigöstermiştir: - Tek başına verilen FP (100 mikrogram) ile karşılaştırıldığında, Salmeterol/Flutikazon(50/100 mikrogram) verildikten sonra ergenlerde ve yetişkinlerde (oran 1.52 [% 90 GA 1.08,2.13]) ve çocuklarda (oran 1.20 [% 90 GA 1.06, 1.37]) daha yüksek FP maruziyetigörülmüştür. - Ergenlere ve yetişkinlere (oran 1.63 [%90 GA 1.35, 1.96]) kıyasla Salmeterol/Flutikazon(50/100 mikrogram) alan çocuklarda daha yüksek FP maruziyeti gözlenmiştir. - Bu bulguların klinik anlamı bilinmemektedir, ancak, hem ergenlerde ve yetişkinlerde hemde çocuklarda, Salmeterol/Flutikazon' u (50/100 mikrogram) ve FP'ı (100 mikrogram)karşılaştıran 12 hafta kadar süren klinik çalışmalarda hipotalamus- hipofizadrenal ekseniüzerindeki etkileri arasında farklılık gözlenmemiştir. 50/500 mikrogramlık daha yüksek Salmeterol/Flutikazon dozu alındığında, tek başına uygulanan eşdeğerde FP dozu karşılaştırıldığında FP maruziyeti benzer bulunmuştur. - Ergenler ve yetişkinlere kıyasla Salmeterol/Flutikazon (50/100 mikrogram) alan çocuklardadaha yüksek salmeterol maruziyeti gözlenmiştir (oran 1.23 [% 90 GA 1.10, 1.38]). 17 / 27 - Bu bulguların klinik anlamı bilinmemektedir, ancak, 12 hafta kadar süren çalışmalarda yetişkinler, ergenler ve çocuklar arasında kardiyovasküler etkilerinde veya tremorbildirimlerinde farklılık gözlenmemiştir. Klinik Çalışmalar:Salmeterol ile yapılan klinik çalışmalar:Astım:Salmeterol Çok Merkezli Astım Araştırma Çalışması (The Salmeterol Multi-center Asthma Research Trial) (SMART), standart tedaviye eklenen salmeterol veya plasebonungüvenliliğinin karşılaştırıldığı, ABD'de yapılan büyük çaplı bir çalışmadır. Primer sonlanmanoktasında (solunum ile ilişkili ölüm ve solunum ile ilişkili yaşamı tehdit eden olaylarınkombine sayısı) Afro-Amerikalı hastalar dışında anlamlı farklar mevcut değildir. Bu çalışmasalmeterol uygulanan hastalarda astıma bağlı ölüm vakalarında anlamlı bir artış göstermiştir(28 haftalık sürede plasebo grubundaki 13,179 hastada 3 ölüm vakasına karşı salmeterolgrubundaki 13,176 hastada 13 ölüm vakası). Bu çalışma inhalasyon yoluyla eşzamanlıkortikosteroid kullanımının etkisinin değerlendirilmesi için tasarlanmamıştır. Bununla birlikte post-hocanalizler başlangıçta inhalasyon yoluyla alınan steroidleri kullanan hastalar içinastıma bağlı ölüm açısından tedavi grupları arasında anlamlı bir fark göstermemiştir (plasebogrubunda 3/6138'e karşı salmeterol grubunda 4/6127). İnhalasyon yoluyla steroidkullanılmayan gruplardaki astıma bağlı ölüm vakalarının sayısı salmeterol grubunda 9/7049olurken plasebo grubunda 0/7041 idi. Ayrıca, Salmeterol-FP kolunda 8,030 ve flutikazonpropiyonat kolunda 7,925 hastayı içeren 42 klinik çalışmanın bir meta analizi, ciddi solunumile ilişkili olaylar veya astıma bağlı olarak hastaneye yatma açısından salmeterol-FP ileflutikazon propiyonat arasında istatistiksel bir fark göstermemiştir.Salmeterol/Flutikazon İnhalasyon İçin Toz ile yapılan klinik çalışmalar:Astım:3416 astım hastasının katıldığı 12 aylık geniş bir çalışmada (Optimal Astım Kontrolünün Sağlanması - Gaining Optimal Asthma controL, GOAL), önceden belirlenmiş astım kontroldüzeylerine ulaşmada Salmeterol/Flutikazon 100 mikrogram İnhalasyon İçin Toz' un etkililikve güvenliliği tek başına verilen inhale kortikosteroid ile karşılaştırılmıştır. Tedavi dozu ##'Tam kontrol' sağlanıncaya veya çalışma ilacının en yüksek dozuna ulaşıncaya kadar her 12haftada bir artırılmıştır. Kontrolün, tedavinin son 8 haftasının en az 7'sinde devam etmesigerekli tutulmuştur. 18 / 27 Bu çalışmada aşağıdaki sonuçlar elde edilmiştir: Sadece inhale kortikosteroid ile tedavi edilen hastaların %59'u #'iyi kontrol' düzeyineulaşırken Salmeterol/Flutikazon İnhalasyon İçin Toz kullanan hastalarda bu oran % 71olmuştur. Sadece inhale kortikosteroid ile tedavi edilen hastaların % 28'i ##tam kontrol' düzeyineulaşırken Salmeterol/Flutikazon İnhalasyon İçin Toz kullanan hastalarda bu oran % 41olmuştur. Bu etkiler tek başına inhale kortikosteroide kıyasla, Salmeterol/Flutikazon İnhalasyon İçin Toz ile daha erken ve daha düşük inhale kortikosteroid dozunda görülmüştür. GOAL çalışmasında aynı zamanda aşağıdaki sonuçlara ulaşılmıştır: Sadece inhale kortikosteroid tedavisi ile karşılaştırıldığında Salmeterol/Flutikazonİnhalasyon İçin Toz ile alevlenme oranı % 29 daha düşüktür. Astım kontrolünde 'İyi kontrol' ve 'Tam kontrol' durumuna ulaşma Yaşam Kalitesi'niartırmıştır. Salmeterol/Flutikazon İnhalasyon İçin Toz ile tedaviden sonra hastaların % 61'iyaşam kalitelerinin 'minimal düzeyde bozulduğunu' veya 'hiç bozulmadığını' bildirmişlerdir.Başlangıçta % 8 olan bu etki astıma özgü yaşam kalitesi anketi ile ölçülmüştür. #İyi kontrol edilen astım: seyrek belirtiler veya seyrek olarak kısa etkili beta agonist kullanımı veya akciğer fonksiyonu beklenenin % 80'inden az olması artı gece uyanma yok, alevlenmeyok ve tedavide değişiklik gerektiren bir yan etki yok. ##Tam kontrol edilen astım: belirti yok, kısa etkili beta-agonist kullanımı yok, akciğer fonksiyonu beklenenin %80'ine eşit veya büyük, gece uyanma yok, alevlenme yok, tedavidedeğişiklik gerektiren bir yan etki yok. Başka iki çalışmada tek başına inhale kortikosteroid kullanımıyla karşılaştırıldığında Salmeterol/Flutikazon İnhalasyon İçin Toz ile akciğer fonksiyonunda düzelme ve belirtileringörülmediği günlerin yüzdesinde artma, kurtarıcı ilaç kullanımında azalma ve % 60 dahadüşük inhale kortikosteroid dozu kullanma şeklinde iyileşme görülürken bronşiyal biyopsi vebronkoalveolar lavaj ile ölçülen altta yatan havayolu enflamasyonunun kontrolü de devamlılıkgöstermiştir. İlave çalışmalar, Salmeterol/Flutikazon İnhalasyon İçin Toz' un tek tek bileşenleri ve plasebo ile karşılaştırıldığında Salmeterol/Flutikazon İnhalasyon İçin Toz' un anlamlı derecede astım 19 / 27 belirtilerini ve akciğer fonksiyonlarını iyileştirdiğini ve kurtarıcı ilaç kullanımım azalttığını göstermiştir. GOAL çalışmasının sonuçları bu sonlanma noktalarında Salmeterol/Flutikazonİnhalasyon İçin Toz ile görülen iyileşmenin en az 12 ay devam ettiğini göstermiştir. KOAH:Kısa etkili p2-agonistlerine %10 reversibilite kısıtlaması olmayan semptomatik KOAH hastaları: Altı ay boyunca yürütülen plasebo kontrollü klinik çalışmalar, 50/250 mikrogram ve 50/500 mikrogram'lık Salmeterol/Flutikazon İnhalasyon İçin Toz' un düzenli kullanımının akciğerfonksiyonunu hızlı ve anlamlı derecede düzelttiğini, nefes darlığını ve rahatlatıcı ilaçkullanımını anlamlı derecede azalttığını göstermiştir. Aynı zamanda hastaların sağlıkdurumunda da anlamlı derecede düzelme olmuştur. Kısa etkili p2-agonistlerine %10' dan daha az reversibilite gösteren semptomatik KOAH hastaları: 6 ve 12 ay boyunca yürütülen plasebo kontrollü klinik çalışmalar, 50/500 mikrogram Salmeterol/Flutikazon İnhalasyon İçin Toz' un düzenli kullanımının akciğer fonksiyonunuhızlı ve anlamlı derecede düzelttiğini, nefes darlığını ve rahatlatıcı ilaç kullanımını anlamlıderecede azalttığını göstermiştir. 12 aylık periyod boyunca KOAH alevlenme riski ve ilaveoral kortikosteroid ihtiyacı anlamlı derecede azalmıştır. Aynı zamanda hastaların sağlıkdurumunda da anlamlı derecede düzelme olmuştur. Salmeterol/Flutikazon İnhalasyon İçin Toz 50/500 mikrogram hem tedavi sırasında sigara içen, hem de sigarayı bırakmış hastalarda akciğer fonksiyonunu ve sağlık durumunudüzeltmede ve KOAH alevlenme riskini azaltmada etkili bulunmuştur. TORCH çalışması (TOwards a Revolution in COPD Health; KOAH'ta devrime doğru):TORCH, KOAH hastalarında, günde 2 kez 50/500 mikrogram Salmeterol/Flutikazonİnhalasyon İçin Toz, günde 2 kez 50 mikrogram salmeterol, günde 2 kez 500 mikrogram FP(flutikazon propiyonat) veya plasebo ile yapılan tedavinin tüm nedenlere bağlı ölümlerüzerindeki etkisini değerlendirmek için yapılan 3 yıllık bir çalışmadır. Başlangıç(bronkodilatörden önce) FEVı'i beklenen normal değerin % 60'ından az olan orta şiddetli veşiddetli KOAH hastaları çift-kör tedavi almak üzere randomize edilmiştir. Çalışma boyunca,diğer inhale kortikosteroidler, uzun etkili bronkodilatörler ve uzun süre sistemik20 / 27 kortikosteroidler dışında, her zamanki KOAH tedavilerini almalarına izin verilmiştir. Üç yıllık hayatta kalma durumu, çalışmadan çıkıp çıkmadıklarına bakılmaksızın hastaların tümüiçin tespit edilmiştir. Başlıca sonlanma noktası, plaseboya kıyasla Salmeterol/Flutikazonİnhalasyon İçin Toz için 3 yılda tüm nedenlere bağlı ölümlerin azaltılmasıdır (Tablo 1).
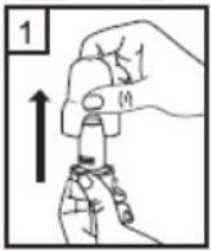
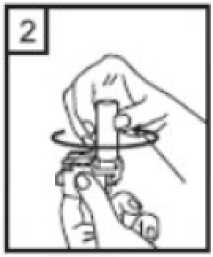
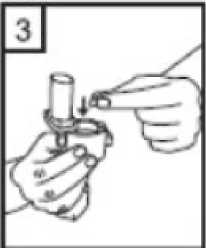
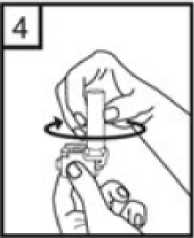
1. birincil etkinlik karşılaştırılması üzerinde yapılmış 2 ara analizin sigara içme durumu açısından gruplandırılmış bir log-rank analizi için ayarlanmış anlamlı-olmayan P değeri, Salmeterol/Flutikazon, plaseboya kıyasla 3 yıl içinde herhangi bir zamanda ölüm riskini %17,5oranında azaltmıştır. Plaseboya kıyasla, üç yıllık süre içinde herhangi bir zamandaherhangi bir nedenden dolayı şekillenen ölümlerde, salmeterol ile % 12 azalma ve FP ile % 6artış olmuştur. (Tablo 1)21 / 27 Cox'un Orantısal Risk modelinin kullanıldığı destekleyici bir analiz, plaseboya kıyasla 3 yıl içinde herhangi bir zamanda ölüm riskinde %19 azalma gösteren Salmeterol/Flutikazonİnhalasyon İçin Toz için 0,811'lik bir risk oranı olduğunu göstermiştir. Model önemlifaktörler (sigara içme durumu, yaş, cinsiyet, bölge, başlangıç FEV1 ve Vücut Kitle İndeksi)için ayarlanmıştır. Tedavi etkilerinin bu faktörlere göre değiştiğine dair kanıt yoktur. (Tablo1)Üç yıl içinde KOAH'a bağlı nedenlerden dolayı ölen hastaların yüzdesi plasebo için % 6,0, salmeterol için % 6,1, FP için % 6,9 ve Salmeterol/Flutikazon İnhalasyon İçin Toz için %4,7'dir. (Tablo 1) Plaseboya kıyasla Salmeterol/Flutikazon İnhalasyon İçin Toz, orta şiddetli ve şiddetli alevlenmeleri % 25 oranında azaltmıştır. Salmeterol/Flutikazon İnhalasyon İçin Tozalevlenme oranını, salmeterol ile karşılaştırıldığında % 12, FP ile karşılaştırıldığında da % 9oranında azaltmıştır. Plaseboya kıyasla salmeterol ve FP alevlenme oranını anlamlı derecedesırasıyla % 15 ve % 18 oranında azaltmıştır. St George Solunum Anketi (SGSA) ile ölçülen Sağlıkla İlişkili Yaşam Kalitesi, plaseboya kıyasla tüm aktif tedavi yöntemleri ile düzelmiştir. Üç yıl boyunca Salmeterol/Flutikazonİnhalasyon İçin Toz ile sağlanan ortalama düzelme plaseboya kıyasla - 3,1 birim, salmeterolekıyasla - 2,2 birim ve FP'ye kıyasla - 1,2 birimdir. Üç yıllık tedavi süresi boyunca, FEV1 değerleri Salmeterol/Flutikazon İnhalasyon İçin Toz ile tedavi edilenlerde plasebo ile tedavi edilenlerden daha yüksektir. FEV1'i düzeltmedeSalmeterol/Flutikazon İnhalasyon İçin Toz salmeterolden veya FP'den daha etkilidir. Advers olay olarak bildirilen pnömoninin 3 yıllık tahmini olasılığı plasebo için % 12,3, salmeterol için % 13,3, FP için % 18,3 ve Salmeterol/Flutikazon İnhalasyon İçin Toz için %19,6'dır Salmeterol/Flutikazon İnhalasyon İçin Toz'un plaseboya karşı risk oranı: 1,64'tür.Pnömoni ile ilişkili ölümlerde artış olmamıştır; tedavi sırasında birincil olarak pnömoniyebağlı oldukları düşünülen ölümler plasebo için 7, salmeterol için 9, FP için 13 veSalmeterol/Flutikazon İnhalasyon İçin Toz için 8 olarak tespit edilmiştir. Kemik kırılmaolasılığında anlamlı farklılık yoktur. Göz bozuklukları, kemik bozuklukları ve hipotalamus-hipofiz-adrenal eksen bozuklukları ile ilgili advers olayların insidansı düşüktür ve tedaviler 22 / 27 arasında farklılık gözlenmemiştir. Salmeterol alan tedavi gruplarında kardiyak advers olaylarında artış olduğuna dair kanıt yoktur. 5.3 Klinik öncesi güvenlilik verileriSalmeterol ksinafoat ve flutikazon propiyonat hayvanlar üzerinde yapılan toksisite testlerinde oldukça kapsamlı bir şekilde değerlendirilmiştir. Belirgin toksisite sadece insan kullanımı içintavsiye edilen dozlar aşıldığında oluşmuştur ve bunlar güçlü p2-adrenoreseptör agonistlerin veglukortikosteroidlerin kullanılmasıyla beklenen etkilerle uyumludur. Uzun süreli çalışmalarda salmeterol ksinafoat sıçan mezovaryumunun ve fare uterusunun düz kaslarında benign tümörlerin oluşmasına yol açmıştır. Kemirgenler farmakolojik olarak indüklenen bu tümörlerin oluşumuna duyarlıdır. Salmeterolün insanlarda onkojenik yönden anlamlı bir risk oluşturduğu düşünülmemektedir. Salmeterol ve flutikazon propiyonatın yüksek dozlarda birlikte uygulanması, bazı kardiyovasküler etkileşimlere yol açmıştır. Sıçanlarda görülen hafif derecede atriyalmiyokardit ve fokal koroner arterit, normal dozların verilmesiyle düzelen geçici etkilerdir.Köpeklerde, salmeterolün tek başına verilmesi ile karşılaştırılığında, birlikte yapılanuygulamaların ardından kalp atım hızındaki artışlar daha fazladır. Hayvanlarda, birlikte yapılan uygulamalar, ilaç sınıfları ile ilişkili diğer toksisitelerde bir değişikliğe neden olmamıştır. Hayvanlar üzerinde yapılan üreme çalışmalarında, glukokortikosteroidlerin malformasyonlara (yarık damak, iskelet malformasyonları) neden olduğu görülmüştür. Bu sonuçlar insanlaraönerilen dozlar için uygulanabilir değildir. Salmeterol ile yapılan hayvan çalışmalarında,sadece yüksek doz uygulandığında embriyofetal toksisite görülmüştür. Birlikte uygulamanındevamında, sıçanlarda bilinen glukokortikoid kaynaklı anormalliklerle ilişkili dozlarda,umbilikal arter geçişinin artan insidansı ve oksipital kemiğin tamamlanmamış ossifikasyonugörülmüştür. 23 / 27 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiLaktoz monohidrat (Sığır kaynaklı) 6.2 GeçimsizliklerGeçerli değildir. 6.3 Raf ömrü24 ay. 6.4 Saklamaya yönelik özel tedbirler25°C' nin altındaki oda sıcaklığında saklanmalıdır. Kuru bir yerde saklanmalıdır. Çocukların göremeyeceği, erişemeyeceği yerlerde ve ambalajında saklayınız. 6.5 Ambalajın niteliği ve içeriğiPefsal 50 mcg/ 500 mcg İnhaler Kapsül, 60 kapsül Alu/OPA-Alu-PVC blister içinde ve inhalasyon cihazı içeren karton kutularda satılmaktadır. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerTüm kullanılmayan ürün ve atık maddeler Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği ne uygun olarak imha edilmelidir.PEFSAL akciğerlere inhale edilen bir toz salıvermektedir. İnhalasyon cihazının kullanımı doktor ve eczacı tarafından hastaya gösterilmelidir. Kapsüllerin kesinlikle ağız içine alınarak yutulmaması ve kesinlikle inhaler içineyerleştirildikten sonra soluk alma yolu ile kullanılması gerektiği konusunda hastabilgilendirilmelidir. Jelatin kapsülün parçalanabileceği ve inhalasyondan sonra ağız ve boğazaküçük jelatin parçacıklarının ulaşabileceği hastaya anlatılmalıdır. Bu olasılık kapsülün birdenfazla delinmemesi ile en aza indirilir. İnhaler cihazı, koruma kapağı çıkarılarak açılır ve kullanıma hazırlanır. Ağızlık ağıza yerleştirilir ve dudaklar etrafını saracak şekilde kapatılır. Bundan sonra doz inhale edilebilirve koruma kapağı tekrar kapatılabilir. 24 / 27 İnhaler cihazının kullanım talimatları1- İnhaler cihazının kapağını çekerek çıkarın. 2- Bir elinizle İnhaler cihazının alt kısmını tutarak diğer elinizle ağızlık kısmını ok yönünde çevirerek açın. 3- Bir kapsülü İnhaler cihazının içindeki boşluğa yerleştirin. Kapsülü ambalajındankullanmadan hemen önce çıkartın. 4- Ağızlık kısmını çevirerek kapatın. 25 / 27 5- İnhaler cihazını dik tutun, kenardaki düğmelere sadece bir kez tam olarak basın ve bırakın.Kapsül her iki ucundan delinecektir. Nefes almanız sırasında küçük jelatin kapsül parçaları ağzınıza gelebilir. Jelatin parçaları zararsızdır ve yutulduktan sonra sindirileceklerdir. Küçük jelatin parçalarının oluşma riskikapsülün blister ambalajından çıkarılır çıkarılmaz hemen kullanılması ve düğmelere sadecebir kez basılması ile azalır.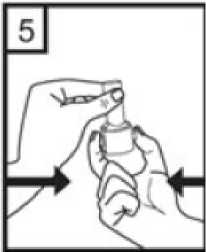
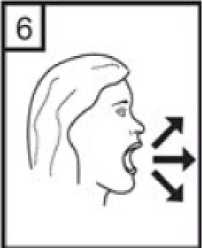
6- Nefesinizi kuvvetlice dışarı verin. 7- Ağız parçasını ağzınıza yerleştirin ve başınızı hafifçe arkaya doğru eğin. Ağızlık etrafındadudaklarınızı sıkıca kapatın ve olabildiğince hızlı ve derin bir nefes alın. 8- İnhaler cihazını ağzınızdan çıkarın ve rahatsız olmadan olabildiğince uzun süre nefesinizitutun. Sonra normal şekilde soluk alıp verin. İnhaler cihazını tekrar açın ve kapsül içerisinde 26 / 27 toz kalıp kalmadığına bakın. Kapsül içerisinde toz kalmış ise 6,7 ve 8 numaralı basamakları tekrar edin. 9- Sonrasında, ağzınızı su ile çalkalayınız ve tükürünüz. 10- Kullanımdan sonra, boş kapsülü atın ve ağızlık kısmını kapatın. UNUTMAYINIZ!İnhaler cihazınızı kuru tutunuz. Kullanılmadığı zaman kapalı tutunuz. İnhaler cihazın içine asla nefes vermeyiniz. Hareket kolunu sadece ilacı almaya hazır olduğunuzda itiniz. Söylenen dozdan daha fazla almayınız. 7. RUHSAT SAHİBİWorld Medicine İlaç San. ve Tic. A.Ş. Bağcılar / İstanbul Tel: +90 212 474 70 50Faks: +90 212 474 09 01 8. RUHSAT NUMARASI2017/741 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 29.09.2017 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ27 / 27 |
İlaç BilgileriPefsal 50 Mcg/500 Mcg İnhaler KapsülEtken Maddesi: Salmeterol Ksinafoat, Flutikazon Propiyonat Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.