Menopur 75 İu İm ve Sc Enjeksiyon İçin Toz İçeren Flakon Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIMENOPUR 75 IU IM ve SC enjeksiyon için toz içeren flakon Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Her bir toz flakonu, 75 IU folikül stimülan hormon (FSH) ve 75 IU luteinizan hormon (LH) aktivitesine sahip, ileri derecede saflaştırılmış menotropin (insan menopozalgonadotropini, HMG) içerir.MENOPUR içinde post-menopozal kadın idrarında doğal olarak bulunan bir hormon olan insan koryonik gonadotropini (hCG) mevcuttur ve LH (luteinizan hormon) aktivitesine katkıdabulunur. Yardımcı maddeler:Sodyum klorür 9.0 mg Sodyum hidroksit pH ayarı için yeterli miktar Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMEnjeksiyonluk çözelti için toz ve çözücü Tozun görünüşü: Beyaz ile beyazımsı liyofilize kek Çözücünün görünüşü: Berrak renksiz çözelti 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarMENOPUR aşağıdaki klinik durumlarda, infertilite tedavisinde endikedir: Kadınlarda Klomifen sitrat tedavisine yanıtsız olan kadınlarda polikistik over hastalığı (PCOS) dahil, anovülasyon, Yardımla üreme teknikleri (ART), örn. in vitro fertilizasyon/embriyo transferi (IVF), gametintra-fallopian transfer (GIFT) ve intrasitoplazmik sperm enjeksiyonu (ICSI) için çok sayıdafolikül büyümesini uyarma amaçlı kontrollü ovaryan hiperstimülasyonu, Hipogonadotropik hipogonadizmi olan kadınlarda folikül gelişiminin stimülasyonu Erkeklerde Hipogonadotropik hipogonadizmi olan erkeklerde yetersiz spermatojenez.
1/14
22 .4.2 Pozoloji ve uygulama şekliMENOPUR tedavisi, fertilite sorunlarmın tedavisinde deneyimli bir hekimin gözetiminde başlatılmalıdır. Pozoloji/uygulama sıklığı ve süresi:Aşağıda açıklanan doz uygulama rejimleri, S.C. ve I.M. uygulamalarda farklılık göstermez. Overlerin eksojen gonadotropinlere verdikleri yanıtta büyük ölçüde bireyler arası değişiklik söz konusudur. Bu durumda standart bir doz uygulama şeması oluşturmak olanaksızdır. Dozaj bunedenle, overlerin verdiği yanıt temelinde bireysel olarak uyarlanmalıdır. MENOPUR tek başınaya da bir gonadotropin serbestleyici hormon (GnRH) agonisti veya antagonisti ile birlikteverilebilir. Dozaj ve tedavi süresine yönelik tavsiyeler, uygulanan gerçek tedavi protokolünebağlı olarak değişebilir. Anovülasyonlu kadınlar (PCOS dahil) MENOPUR tedavisinin amacı tek bir Graaf (olgunlaşmış folikül) folikülünün gelişmesini ve insan koryonik gonadotropini (hCG) uygulamasından sonra oositin serbestleşmesini sağlamaktır. MENOPUR tedavisi menstrüel siklusun ilk 7 günü içinde başlatılmalıdır. Başlangıçta önerilen MENOPUR dozu günlük 75 - 150 IU'dur ve bu doza en az 7 gün süreyle devam edilmelidir.Bundan sonraki dozlar, klinik izleme sonuçlarına bağlı olarak (sadece over ultrasonu ya dabirlikte östradiol düzeyleri ölçümü), alınan bireysel hasta yanıtı doğrultusunda uyarlanmalıdır.Doz uyarlamaları her 7 günde birden daha sık yapılmamalıdır. Önerilen doz artışı, her defasında37,5 IU'dur ve 75 IU'yu aşmamalıdır. Maksimum günlük doz 225 IU'dan daha yüksekolmamalıdır. Eğer hasta 4 haftalık tedaviyle yeterli yanıt vermede başarısız olmuşsa, o siklustanvazgeçilmelidir ve hastada, vazgeçilen siklusta olduğundan daha yüksek bir başlangıç dozuylayeni bir tedaviye başlanmalıdır. Optimal bir yanıt alındığında, son MENOPUR enjeksiyonundan 1 gün sonra bir kez 5,000 IU ile 10,000 IU hCG verilmelidir. Hastaya hCG enjeksiyon günü ve ertesi gün koitusa girmesiönerilir. Buna alternatif olarak, intrauterin inseminasyon (IUI) uygulanabilir. Eğer MENOPURile aşırı bir yanıt alınmış ise tedavi sonlandırılmalı, hCG enjeksiyonu yapılmamalı (bkz. Bölüm4.4) ve hasta bir sonraki menstrüasyon kanaması başlayana kadar kontrasepsiyon yöntemiuygulamalı veya koitustan uzak durmalıdır. Yardımla üreme teknikleri (ART) için çok sayıda folikül büyümesini uyarma amaçlı kontrollü ovaryan hiperstimülasyonu olan kadınlar GnRH agonistiyle downregülasyon uygulanan protokolde, MENOPUR tedavisi, agonist tedavisi başladıktan yaklaşık 2 hafta sonra başlatılmalıdır. GnRH antagonistiyle downregülasyonuygulanan protokolde, MENOPUR tedavisi, menstrüel siklusun 2 ya da 3. günü başlatılmalıdır.Tavsiye edilen MENOPUR başlangıç dozu, tedavinin en az ilk beş günü için, günde 150 - 225IU'dur. Bundan sonraki dozlar, klinik izleme sonuçlarına bağlı olarak (sadece over ultrasonu yada birlikte östradiol düzeyleri ölçümü), alınan bireysel hasta yanıtı doğrultusunda uyarlanmalı vedoz artışları, uyarlama başına 150 IU'dan daha yüksek olmamalıdır. Günlük verilen maksimumdoz günde 450 IU'yu aşmamalıdır ve pek çok vakada 20 günü aşan dozaj tavsiyeedilmemektedir.
2/14
22 .01.2018Yeterli sayıda folikül uygun büyüklüklere ulaştığında, oosit toplama hazırlığı amacıyla son foliküler olgunlaşmayı indüklemek için, en fazla 10,000 IU olmak üzere tek bir hCG enjeksiyonuyapılmalıdır. Hastalar hCG uygulamasından sonra en az 2 hafta yakından izlenmelidir. EğerMENOPUR ile aşırı bir yanıt alınmış ise tedavi sonlandırılmalı, hCG enjeksiyonu yapılmamalı(bkz. Bölüm 4.4) ve hasta bir sonraki menstrüasyon kanaması başlayana kadar bariyerkontrasepsiyon yöntemi uygulamalı veya koitustan uzak durmalıdır. Erkekler Başlangıçta, haftada 3 kez 1000 - 3000 IU HCG uygulanır. Normal testesteron serum düzeyleri sağlandığında, bir kaç ay, ek olarak, haftada üç kez HMG (75 - 150 FSH + 75 - 150 IU LH) I.M.olarak uygulanır. Uygulama şekli:MENOPUR, kutusunda sunulan çözücü ile sulandırılarak hazırlandıktan sonra subkütan (S.C.) ya da intramusküler (I.M.) yoldan enjekte edilerek uygulanır. Toz kullanımdan hemen öncesulandırılmalıdır. Büyük hacimlerde enjeksiyondan kaçınmak amacıyla, sunulan 1 ml'lik çözücüile 3 flakona kadar toz sulandırılarak hazırlanabilir. Çalkalamadan kaçınılmalıdır. Çözelti partikül içeriyorsa ya da berrak değilse kullanılmamalıdır. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:MENOPUR'un farmakokinetiği, renal ve hepatik yetmezliği olan hastalarda incelenmemiştir.Pediatrik popülasyon:Çocuklarda kullanımı önerilmemektedir. MENOPUR'un çocuklarla ilgili kullanımı yoktur.Geriyatrik popülasyon:4.3 KontrendikasyonlarMENOPUR aşağıdaki durumlarda kadınlarda kontrendikedir: - Hipofiz bezi ya da hipotalamus tümörleri - Over, uterus ya da meme karsinomu - Gebelik ve laktasyon - Etiyolojisi bilinmeyen jinekolojik kanama - Etkin maddeye veya bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine aşırıduyarlılık - Over kistleri ya da polikistik over hastalığı dışında bir nedenden dolayı büyümüş overler Aşağıdaki durumlarda tedavi sonucunun olumlu olması beklenmemektedir ve bu nedenle MENOPUR uygulanmamalıdır: - Primer over yetmezliği - Cinsel organlarda gebelik ile bağdaşmayan malformasyonlar - Uterusta gebelik ile bağdaşmayan fibroid tümör
3/14
22 .01.2018MENOPUR aşağıdaki durumlardaki erkeklerde kontrendikedir: - Hipofiz bezi ya da hipotalamus tümörleri - Testisde tümörler - Prostat karsinomu - Etkin maddeye veya formülasyonda kullanılan herhangi bir bileşene karşı aşırı duyarlılık 4.4 Özel kullanım uyarıları ve önlemleriMENOPUR, hafiften şiddetliye kadar yan etkilere yol açabilen güçlü bir gonadotropik maddedir ve yalnızca infertilite sorunları ve bunların tedavilerini oldukça iyi bilen hekimler tarafındankullanılmalıdır. Gonadotropin tedavisi, doktorların ve yardımcı sağlık personelinin belirli bir zaman ayırmalarını, ve over yanıtının tek başına ultrason ya da tercihen ultrason ve serum östradiol düzeyleri ölçümükombinasyonuyla düzenli bir şekilde izlenmesini gerektirir. Menotropin uygulamasına alınanyanıtta önemli ölçüde hastalar arası değişiklik söz konusudur ve bazı hastalarda istenilen yanıtalınamaz. Tedavinin amacına yönelik, etkili olan en düşük doz kullanılmalıdır. İlk MENOPUR enjeksiyonu, doğrudan tıbbi denetim altında uygulanmalıdır. Tedaviye başlamadan önce, çiftin infertilite sorunu gereğince değerlendirilmeli ve gebelik için varsayılabilecek kontrendikasyonlar incelenmelidir. Özellikle de, hastalar hipotiroidizm,adrenokortikal yetmezlik, hiperprolaktinemi ve hipofizer ya da hipotalamik tümörler yönüyledeğerlendirilmeli ve gerekli spesifik tedavi uygulanmalıdır. Gerek anovulatuar infertilite tedavisi, gerekse ART prosedürleri kapsamında foliküler büyümenin uyarılması işlemi uygulanan hastalarda, overlerde büyüme ya da hiperstimülasyongelişebilir. Tavsiye edilen MENOPUR dozajı ve uygulama rejimine sadık kalınması ve tedavininözenli bir şekilde izlenmesi, bu türlü olayların insidansını en aza indirecektir. Folikül büyümesive olgunlaşması indekslerinin derhal yorumlanabilmesi, ilgili testlerin yorumlanmasındadeneyimli bir doktor gerektirir. Ovaryan hiperstimülasyon sendromu (OHSS) OHSS komplike olmayan over büyümesinden ayrı, farklı bir tıbbi olaydır. OHSS kendisini artan şiddet derecelerinde gösterebilen bir sendromdur. Belirgin over büyümesi, yüksek serum sekssteroidleri ve vasküler permeabilite artışından oluşur. Permeabilite artışı, periton, plevra ve enderolarak perikard boşluklarında sıvı birikimiyle sonuçlanabilir. Şiddetli OHSS olgularında şu semptomlar gözlenebilir; abdominal ağrı, abdominal distansiyon, overlerde ileri derecede büyüme, kilo alma, dispne, oligüri ve bulantı, kusma, diyare gibigastrointestinal semptomlar. Klinik değerlendirmede hipovolemi, hemokonsantrasyon, elektrolitdengesizlikleri, asit, hemoperiton, plevral efüzyon, hidrotoraks, akut pulmoner distres vetromboembolik olaylar açığa çıkabilir. Gonadotropin tedavisine karşı alınan aşırı over yanıtı, ovülasyonu tetiklemek üzere hCG uygulanmadığı sürece, ender olarak OHSS'ye yol açar. Bu nedenle ovaryan hiperstimülasyonudurumunda, hCG uygulamasını durdurmak ve hastaya en az 4 gün süreyle koitustan kaçınmasınıya da bariyer yöntemlerini kullanmasını tavsiye etmek akılcı bir yaklaşım olacaktır. OHSS hızla
4/14
22 .01.2018ilerleyebilir (24 saat ile birkaç gün içerisinde) ve ciddi bir tıbbi olay haline gelebilir, bu nedenle hastalar hCG uygulamasından sonra en az iki hafta süreyle izlenmelidir. Tavsiye edilen MENOPUR dozajına, uygulama rejimine bağlı kalınması ve tedavinin özenle izlenmesi, ovaryan hiperstimülasyonu ve çoğul gebelik insidanslarını en aza indirecektir (bkz.Bölüm 4.2 ve 4.8). ART'de ovülasyondan önce bütün foliküllerin aspire edilmesi,hiperstimülasyon oluşumunu azaltabilir. Gebelik gelişmesi durumunda OHSS daha şiddetli olabilir ve daha uzun sürebilir. OHSS en büyük sıklıkla hormon tedavisi bittikten sonra ortaya çıkar ve en yüksek şiddetine tedaviyiizleyen yedi ile on gün civarında ulaşır. OHSS sıklıkla, menstrüasyonun başlamasıyla spontanolarak geriler. Şiddetli OHSS ortaya çıkarsa, eğer halen devam ediyorsa gonadotropin tedavisi durdurulmalı ve hasta hospitalize edilerek spesifik OHSS tedavisi başlatılmalıdır. Bu sendrom polikistik over hastalarında daha yüksek bir insidansta ortaya çıkmaktadır. Çoğul gebelik Çoğul gebelik, özellikle de yüksek sayılarda olanları, yüksek bir maternal ve perinatal risk taşır. Gonadotropinlerle ovülasyon indüksiyonu yapılan kadınlarda çoğul gebelik insidansı, doğal konsepsiyona kıyasla yüksektir. Çoğul konsepsiyonların büyük bir kısmı ikizdir. Çoğul gebelikriskini en aza indirmek için, over yanıtının dikkatle izlenmesi önerilmektedir. ART prosedürlerinin uygulandığı kadınlarda çoğul gebelik riski esas olarak, yerleştirilen embriyo sayısına, bunların kalitesine ve hastanın yaşına bağlıdır. Hastalara tedaviye başlamadan önce çoğul doğum riski potansiyeli anlatılmalıdır. Gebelik kaybı Erken dönemde düşük ya da abortus sonucunda gebelik kaybı insidansı, normal popülasyona göre, ART prosedürleri için folikül büyümesi stimüle edilen hastalarda daha yüksektir. Dış gebelik Öyküsünde tübal hastalığı olan kadınlar, gebelik spontan konsepsiyon yoluyla ya da fertilite tedavisiyle elde edilmiş olsun, ektopik gebelik riski taşırlar. IVF'ten sonra dış gebelikprevalansının %2 ile %5 olduğu bildirilirken, genel popülasyonda %1 ile %1.5 olduğubildirilmektedir. Üreme sistemi neoplazmaları İnfertilite tedavisi için çok ilaçlı rejimlerin uygulandığı kadınlarda, overler ya da üreme sisteminin başka organlarında hem benign hem de malign neoplaziler bildirilmiştir. İnfertilkadınlarda gonadotropin tedavisinin, bu tümörlere yönelik bazal riski artırıp artırmadığı henüzbelirlenmemiştir.
5/14
22 .01.2018Konjenital malformasyonlar ART'den sonra konjenital malformasyonların prevalansı, spontan konsepsiyonlardan sonra olandan biraz daha yüksek olabilir. Bunun parental özelliklerdeki farklılıklara (örn. anne yaşı,sperm özellikleri) ve çoğul gebeliklere bağlı olduğu düşünülmektedir. Tromboembolik olaylar Kişisel ya da aile öyküsü, şiddetli obezite (vücut kütle indeksi >30 kg/m2) veya trombofili gibi tromboembolik olaylara yönelik genel kabul gören risk faktörlerine sahip kadınlarda,gonadotropin tedavisi sırasında ya da tedaviden sonra venöz veya arteriyel tromboembolik olayriski artabilir. Bu gibi kadınlarda, gonadotropin uygulamasının yararları, risklerine karşıdeğerlendirilmelidir. Ancak bizzat gebeliğin de, tromboembolik olay riskini artırdığıunutulmamalıdır. Erkeklerde tedavi Yüksek FSH düzeyleriprimertestiküler yetersizliğingöstergesidir. Bu hastalar MENOGON/hCG tedavisine karşı yanıt vermezler. Tedavi başladıktan sonraki değerlendirmede 4 - 6 ay sperm analizi önerilmektedir. Bu tıbbi ürün her dozunda 1 mmol (23 mg)'dan daha az sodyum ihtiva eder; yani aslında sodyum içermez. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriMENOPUR ile insanlarda etkileşim çalışmaları yürütülmemiştir. Kontrollü klinik deneyim bulunmamakla birlikte, eş-zamanlı MENOPUR ve klomifen sitrat uygulamasının foliküler yanıtı kuvvetlendirebileceğibeklenmektedir.Hipofizin duyarsızlaştırılması işleminde GnRH agonisti kullanılırken, yeterli foliküler yanıtın sağlanabilmesi için daha yüksek dozlarda MENOPUR gerekli olabilir. Özel popülasyonlara ilişkin ek bilgiler:Pediyatrik popülasyon:4.6 Gebelik ve laktasyonGenel tavsiye:Gebelik kategorisi: X. Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon)Geçerli değildir. Gebelik dönemiGebe kadınlarda MENOPUR kullanımı kontrendikedir (bkz. Bölüm 4.3). Gebe kadınlarda menotropin kullanımına ilişkin sınırlı veri mevcuttur. Gebelik süresince MENOPUR'un etkilerinin değerlendirilmesi için hayvanlar üzerinde çalışmalar gerçekleştirilmemiştir (bkz. Bölüm 5.3).
6/14
22 .Laktasyon dönemiLaktasyondaki kadınlarda MENOPUR kullanımı kontrendikedir (bkz. Bölüm 4.3). Üreme yeteneği / FertiliteMENOPUR infertilite tedavisinde endikedir (bkz. Bölüm 4.1). 4.7 Araç ve makine kullanımı üzerindeki etkilerAraç ve makine kullanma becerileri üzerindeki etkileri konusunda herhangi bir çalışma yürütülmemiştir. Ancak MENOPUR'un hastanın araç ve makine kullanma becerilerinietkilemesi pek olası değildir. 4.8 İstenmeyen etkilerKlinik araştırmalarda MENOPUR tedavisi sırasında en sık bildirilen advers ilaç reaksiyonları Ovaryan hiperstimülasyon sendromu (OHSS), baş ağrısı, abdominal ağrı, abdominal şişkinlik veenjeksiyon bölgesinde ağrıdır. Bu advers ilaç reaksiyonlarının hiçbiri %5'den fazla raporedilmemiştir. Aşağıdaki tabloda, klinik araştırmalarda MENOPUR ile tedavi edilen kadınlardaki başlıca advers ilaç reaksiyonları sistem organ sınıfları ve sıklıklarına göre verilmektedir. Pazarlama sonrasıfaaliyetlerde görülen advers reaksiyonlar bilinmiyor başlığı ile verilmektedir. İstenmeyen etkiler aşağıdaki sınıflama kullanılarak sıklık gruplarına ayrılmıştır: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000); bilinmiyor (eldeki verilerden hareketle tahminedilemiyor). Bağışıklık sistemi hastalıklarıBilinmiyor: Aşırı duyarlılık reaksiyonlarıc Sinir sistemi hastalıklarıYaygın: Başağrısı Yaygın olmayan: Baş dönmesi Göz hastalıklarıBilinmiyor: Görsel bozukluklara Vasküler hastalıklarYaygın olmayan: Sıcak basması Bilinmiyor: Tromboembolisme Gastrointestinal hastalıklarYaygın: Abdominal ağrı, abdominal şişkinlik, bulantı Yaygın olmayan: Abdominal rahatsızlık, diyare, kusma Deri ve deri altı doku hastalıklarıSeyrek: Akne, döküntü Bilimiyor: Prurit, ürtiker
7/14
22 .Kas-iskelet bozuklukları, bağ doku ve kemik hastalıklarıBilinmiyor: Kas-iskelet ağrısıd Üreme sistemi ve meme hastalıklarıYaygın: OHSSe, pelvik ağrıf Yaygın olmayan: Over kisti, meme şikayetlerig Bilinmiyor: Over torsiyonue Genel hastalıklar ve uygulama bölgesine ilişkin hastalıklarYaygın: Enjeksiyon bölgesi reaksiyonlarıb, Yaygın olmayan: Bitkinlik Bilinmiyor: Preksi, malez Araştırmalar:Bilinmiyor: Kilo artışı a Pazarlama sonrasında görsel bozukluklar olarak; amoroz, diplopi, midriyazis, skotom, fotopsi, vitröz floter, görme bulanıklığı ve görme bozukluklarının geçici olarak bireysel vakaları raporedilmiştir. f Pelvik ağrı; ovaryan ve adneksiyal ağrıyı içerir. g Meme şikayetleri; meme ağrısı, meme hassasiyeti, meme rahatsızlığı, meme ucu ağrısı ve memelerde şişliği içerir. Erkekler Gonodotropin tedavisi ile bağlantılı olarak, jinekomasti, akne ve kilo alımı rapor edilmiştir. İlave olarak, erkeklerde uygulama bölgesi reaksiyonları ve aşırı duyarlılık beklenmektedir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta:[email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9 Doz aşımı ve tedavisiDoz aşımının etkileri bilinmemektedir; ancak ovaryan hiperstimülasyon sendromunun gelişmesi beklenebilir.
8/14
22 .5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Gonadotropinler ATC kodu: G03G A02 MENOPUR menopoz sonrası kadınların idrarından elde edilmektedir. Menopoz sonrası idrarda doğal olarak bulunan bir hormon olan İnsan Koryonik Gonadotropini (hCG), MENOPURiçeriğinde yer alır ve luteinizan hormon (LH) aktivitesine katkıda bulunur. Kadınlar Hem FSH hem de LH aktivitesi taşıyan menotropin, primer over yetmezliği olmayan kadınlarda yumurtalıkta foliküler büyüme ve gelişmeyi ve aynı zamanda gonadal steroid üretimini indükler.FSH folikülogenezin erken dönemlerinde folikül seçimi ve büyümesinin primeryönlendiricisidir; LH ise overlerdeki steroidogenez için önem taşır ve uygun yeterlilikte bir pre-ovulatuar folikül gelişmesine öncülük eden fizyolojik olaylarda rol alır. Ortamda hiç LHbulunmaz iken, foliküler büyüme FSH ile stimüle edilebilir, ancak sonuçta ortaya çıkanfoliküller anormal gelişim gösterir. Bu foliküllerin östradiol düzeyleri düşüktür ve normal birovulatuar uyarıya yanıt olarak luteinize olma yetisine sahip değildirler. LH aktivitesinin steroidogenezin güçlendirilmesindeki etkilerine paralel olarak, MENOPUR tedavisiyle elde edilen östradiol düzeyleri, down-regüle IVF/ICSI sikluslarında, rekombinantFSH preparatları ile görülenden daha yüksektir. Hastanın verdiği yanıt östradiol düzeyleritemelinde izlenirken, bu nokta gözönünde tutulmalıdır. Anovulatuar hastalarda düşük-dozluovulasyon indüksiyon protokolleri kullanıldığında, östradiol düzeylerinde farklılık bulunmaz. Erkekler Testislerde FSH, olgunlaşmamış Sertoli hücresinden olgunlaşmış Sertoli hücresine dönüşümü indükler. Sperm kanallarının olgunlaşmasında ve spermatozoonsun gelişmesinde etkilidir.Bununla beraber, testislerde, yüksek konsantrasyonda androjenlerin bulunması gereklidir veHCG kullanılarak uygulanan bir ön tedavi ile elde edilebilir. 5.2 Farmakokinetik özelliklerGenel özelliklerMENOPUR içinde bulunan FSH'nın farmakokinetik profili belgelendirilmiştir. Emilim:Down-regüle sağlıklı kadın gönüllülerde 7 gün süreyle tekrarlı 150 IU MENOPUR uygulamasından sonra, maksimum plazma FSH konsantrasyonları Cmax (başlangıç döneminegöre düzeltilmiş) (ortalama ± SS), S.C. ve I.M. enjeksiyon için sırasıyla 8.9 ± 3.5 IU/litre ve 8.5± 3.2 IU/litre idi. Maksimum FSH konsantrasyonlarına (Tmax ), her iki uygulama yolunda da, 7saat içinde ulaşılmıştır. Dağılım:Veri yoktur.
9/14
22 .01.2018Biyotransformasyon:Veri yoktur.Eliminasyon:Tekrarlı uygulamadan sonra, FSH, S.C. ve I.M. enjeksiyondan sonra sırasıyla 30 ± 11 saat ve 27 ± 9 saat'lik yarılanma ömrü (T1/2) (ortalama ± SS) ile elimine edilmiştir. MENOPUR esas olarak böbrekler yoluyla atılmaktadır. Doğrusallık / Doğrusal olmayan durum:MENOPUR doz uygulamasından sonra bireysel LH konsantrasyonu-zaman eğrisinde LH konsantrasyonu artış göstermekle birlikte, mevcut veriler bir farmakokinetik analizdekullanılamayacak ölçüde azdır. Hastalardaki karakteristik özelliklerBöbrek/Karaciğer yetmezliği:MENOPUR'un farmakokinetiği, renal ve hepatik yetmezliği olan hastalarda incelenmemiştir. 5.3 Klinik öncesi güvenlilik verileriKapsamlı klinik deneyimlerden bilinmediği gibi, klinik dışı veriler insanlara yönelik özel bir tehlike ortaya koymamaktadır. Gebelik ya da postpartum süresince endike olmayan MENOPUR'un etkilerinin değerlendirilmesi için üreme toksisitesi çalışmaları yürütülmemi ştir. MENOPUR doğal hormanlardan oluştuğundan genotoksik olması beklenmemektedir. Endikasyon kısa dönem tedaviyi gerektirdiği için karsinojenisite çalışmaları yürütülmemiştir. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiToz: Laktoz monohidrat (sığır sütü kaynaklı) Polisorbat 20 Sodyum hidroksitHidroklorik asit Çözücü: Sodyum klorür Seyreltik hidroklorik asit %10 Enjeksiyonluk su 6.2 GeçimsizliklerMENOPUR, Ferring'in ürofollitropin (FSH) içeren ürünü dışında ilaçlarla beraber aynı enjeksiyonda uygulanmamalıdır. Çalışmalar Ferring'in ürofollitropin içeren ürünü veMENOPUR'un birlikte uygulanmasının beklenen biyolojik etkinliği önemli ölçüdedeğiştirmediğini göstermiştir.
10/14
22 .6.3 Raf ömrü24 ay.Sulandırılarak hazırlandıktan hemen sonra kullanılmalıdır. 6.4 Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında ışıktan korunarak ve orijinal ambalajında saklanmalıdır. Dondurulmamalıdır. 6.5 Ambalajın niteliği ve içeriğiToz: Kapak ile kapatılmış kauçuk tıpalı 2 ml'lik renksiz Tip I cam flakon. Çözücü: 1 ml'lik renksiz Tip I cam ampul. MENOPUR, 5 toz flakonu ve 5 çözücü ampul içeren ambalajlar halinde piyasaya sunulmaktadır. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanım için hazırlama MENOPUR yalnızca ambalaj içinde bulunan çözücü ile sulandırılarak hazırlanmalıdır. Sulandırma iğnesi enjektöre takılır. Çözücü ampul içeriğinin tamamı çekilir ve toz içeren flakona aktarılır. Toz hızla çözünerek berrak bir çözelti oluşturmalıdır. Eğer olmazsa, berrak halegelinceye kadar, flakon hafif hareketlerle döndürülür. Çalkalamadan kaçınılmalıdır. Eğer gerekiyorsa, reçete edilen doza ulaşıncaya kadar, çözelti enjektöre tekrar çekilerek bir sonraki toz flakonuna enjekte edilir. Bir çözücü ampul ile 3 flakona kadar toz çözündürülebilir. Reçete edilen doza ulaşıldığında, flakondaki çözelti enjektöre çekilir, enjektör iğnesi değiştirilerek hipodermik (subkütan) iğne takılır ve derhal uygulanır. Sulandırılarak hazırlanmış çözelti, eğer partikül içeriyorsa ya da berrak değilse enjekte edilmemelidir. Herhangi bir kullanılmamış ürün veya atık materyal lokal gerekliliklere uygun olarak imha edilmelidir. Özel bir gereklilik yoktur. Kullanılmamış olan ürün ya da atık materyaller, Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. KULLANIM TALİMATLARIEğer gittiğiniz klinikte MENOPUR enjeksiyonlarını kendinizin yapması öngörüldüyse, klinikte verilen talimatları eksiksiz yerine getirmeniz gereklidir.İlk MENOPUR enjeksiyonu bir doktorun gözetimi altında yapılmalıdır.
11/14
22 .01.2018MENOPUR'un sulandırılarak hazırlanması: MENOPUR flakon içinde toz formunda bulunmaktadır ve enjeksiyon öncesinde sulandırılması gerekir. MENOPUR'u sulandırmak için kullanacağınız çözücü sıvı, tozun yanında verilmiştir.MENOPUR mutlaka kullanımdan hemen önce sulandırılmalıdır. Bunun için şu adımlarıizleyiniz: Uzun ve kalın iğneyi (hazırlama / sulandırma iğnesi), enjektöre sıkıca takınız. 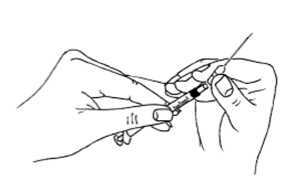 Çözücü sıvı içeren ampulü, nokta işareti size doğru iken kırınız. İğneyi çözücü sıvı ampulün içine batırınız. Ampuldeki sıvının tamamını enjektöre çekiniz. 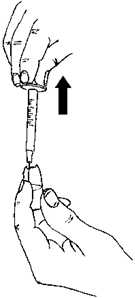 İğneyi, tozun bulunduğu flakonun kauçuk tepesinden batırınız ve sıvının tamamını yavaşça enjekte ediniz. Kabarcık oluşumunu önlemek için iğne ucu flakonun yan yüzeyine doğrututulmalıdır. Toz hızla çözünmeli (2 dakika içinde) ve berrak bir çözelti oluşmalıdır. Normalde bir kaçdamla çözücü eklendiğinde gerçekleşir. 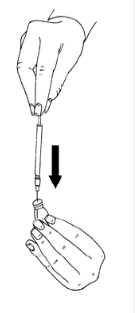
12/14
22.01.2018Tozun çözünmesine yardımcı olmak için, flakonu hafif hareketlerle döndürünüz. Çalkalamayınız, çünkü hava kabarcıklarının oluşmasına yol açar.Çözelti berrak değilse ya da içinde parçacık şeklinde maddeler varsa kullanılmamalıdır.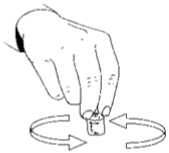 Çözeltiyi enjektöre geri çekiniz. 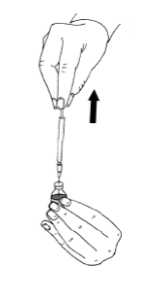 Eğer size her enjeksiyon için birden fazla MENOPUR flakonu reçete edilmişse, enjektördeki çözeltiyi (ilk MENOPUR flakonundaki çözelti), yukarıda anlatıldığı şekilde ikinci birMENOPUR toz flakonu içine enjekte ediniz. Büyük hacimlerde enjeksiyondan kaçınmakamacıyla, bu işlemi 3 flakona kadar tekrarlayabilirsiniz. Ancak doktorunuzun talimatlarınauymalısınız. Eğer size MENOPUR ile aynı zamanda Ferring'in ürofollitropin içeren ürünü reçete edildiyse, MENOPUR'u sulandırarak ve reçete edilen dozda MENOPUR'u sulandırılmış Ferring'inürofollitropin çözeltisine enjekte ederek, bu iki ilacı karıştırabilirsiniz. Karıştırdığınız çözeltiyienjektöre çekiniz: herbirini ayrı ayrı enjekte etmek yerine bir arada enjekte edebilirsiniz. MENOPUR'un enjekte edilmesi: Size reçete edilmiş olan dozu enjektöre çektikten sonra, enjektörün iğnesini değiştirerek, kısave ince bir iğneyi (enjeksiyon iğnesi) takınız. Enjektörü iğne üstte olacak şekilde tutunuz ve parmağınızla hafif fiskelerle vurunuz; böyleceolabilecek hava kabarcıkları üstte birikecektir. Enjektörün pistonunu, ilk sıvı damlası dışarıçıkana kadar dikkatle itiniz.
13/14
22 .01.2018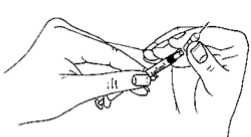 Doktor ya da hemşireniz enjeksiyonu nereden yapacağınızı size söyleyecektir (uyluğun öntarafı, karın bölgesi vb.). Enjeksiyon yapacağınız bölgeyi alkollü pamukla dezenfekte ediniz. Enjeksiyonu uygulamak için deriyi parmaklarınız arasında sıkıştırarak bir kıvrım oluşturunuzve iğneyi 90 derece açıyla (dik olarak) yumuşak, tek bir hareketle batırınız. Pistonu iterekçözeltiyi enjekte ediniz. Daha sonra iğneyi çekiniz. 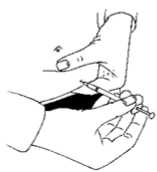 İğneyi çıkardıktan sonra, olası bir kanamayı engellemek için iğne yerine bastırınız. Enjeksiyon bölgesine hafifçe masaj yapılması, çözeltinin derinin altında yayılmasınayardımcı olacaktır. Kullandığınız enjeksiyon malzemelerini, olağan evsel atıkların arasına koymayınız; bunların uygun bir şekilde atılması gereklidir. 7. RUHSAT SAHİBİFerring İlaç San.ve Tic. Ltd. Şti. Büyükdere Cad. Nurol Plaza No: 255 Kat 13 Maslak 34398 Sarıyer, İstanbul Tel: (0212) 335 62 00 Faks: (0212) 285 42 74e-posta: [email protected] 8. RUHSAT NUMARASI120/63 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 27.07.2006 Ruhsat yenileme tarihi: 13.02.2014 10. KÜB'ÜN YENİLENME TARİHİ
14/14
22 .01.2018 |
İlaç BilgileriMenopur 75 İu İm ve Sc Enjeksiyon İçin Toz İçeren FlakonEtken Maddesi: Menotropin Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.