Physioneal 40 %1.36 Glukozlu Periton Diyaliz Çözeltisi Kısa Ürün BilgisiKISA URUN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIPHYSIONEAL 40 % 1,36 Periton Diyaliz Çözeltisi Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin maddeler:Karışım öncesi 1000 ml elektrolit çözeltisi (Küçük bölme "A"Glukoz monohidrat (37,5 g Glukoza eşdeğer) 41,25 g Kalsiyum klorür dihidrat 0,507 g Magnezyum klorür heksahidrat 0,140 g Karışım öncesi 1000 ml tampon çözelti (Büyük bölme "B")Karışım sonrası:Glukoz monohidrat (13,6 g Glukoza eşdeğer) 15 g Sodyum klorür 5,38 g Kalsiyum klorür dihidrat 0,184 g Magnezyum klorür heksahidrat 0,051 g Karışım sonrası oluşan 1 litre çözelti 362,5 ml çözelti A ve 637,5 ml çözelti B içerir. Karışım sonrası oluşan çözeltinin bileşimi
Glukoz (C6H12O6) Sodyum (Na+)
Kalsiyum (Ca++) Magnezyum (Mg++)Klorür (Cl-)Bikarbonat (HCO3-)Laktat (C3H5O3-) : 75,5 mmol/litre : 132 mmol/litre (132 mEq/litre): 1,25 mmol/litre (2,5 mEq/litre): 0,25 mmol/litre (0,5 mEq/litre): 95 mmol/litre (95 mEq/litre) : 25 mmol/litre (25 mEq/litre) : 15 mmol/litre (15 mEq/litre) Preparatın ticari adındaki "40", çözeltinin tamponlama kapasitesini ifade eder (15 mmol/litre laktat + 25 mmol/litre bikarbonat = 40 mmol/litre). Yardımcı maddeler:Yardımcı maddeler için bölüm 6.1'e bakınız. 1 3. FARMASÖTİK FORMPeriton diyalizi çözeltisi Steril, berrak, renksiz çözeltiKarışım sonrası çözeltinin pH'sı 7,4'dür.Ozmolarite: 344 mOsmol/litre 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarPHYSIONEAL 40 periton diyalizinin gerekli olduğu şu durumlarda endikedir: - Akut ve kronik böbrek yetmezliği - Ciddi sıvı tutulumu - Elektrolit bozuklukları - İlaç ve diğer toksik madde zehirlenmelerinde, daha etkili alternatif bir tedavibulunamadığı durumlar Bikarbonat / laktat içeren PHYSIONEAL 40 periton diyalizi çözeltilerinin pH'ları fizyolojiktir. Bu nedenle özellikle tampon madde olarak yalnızca laktat içeren çözeltilerletedavi gören hastalarda peritonun diyaliz sıvısıyla doldurulması sırasında görülen ağrı verahatsızlık hissi oluşan hastalarda endikedir. 4.2 Pozoloji ve uygulama şekliPozolojiuygulama sıklığı ve süresi:Tedavi şekli, sıklığı, kullanılacak çözeltinin hacmi, karın boşluğunda kalacağı süre ve toplam diyaliz süresi hastanın doktoru tarafından kararlaştırılır. Şiddetli dehidratasyon, hipovolemi tehlikesiyle karşılaşmamak ve protein kaybını olabildiğince azaltmak amacıyla, her bir değişim işleminde kullanılacak diyaliz sıvısının,hastadan alınması gereken sıvıyı çekebilecek en düşük ozmolariteye sahip olmasına dikkatedilmelidir. Erişkinler: Sürekli Ayaktan Periton Diyalizi (SAPD) tedavisindeki erişkin hastalar tipik olarak günde (24 saatte) 4 değiştirme işlemi gerçekleştirir. Aletli Periton Diyalizi (APD) tedavisindeki hastalar tipik olarak gece boyunca 4 -5 değiştirme işlemigerçekleştirir; bu hastalar gündüz ise2'ye kadar değiştirmeişlemi gerçekleştirmektedir. Dolum hacmi vücut boyutuna göre değişmekle birlikte genellikle 2,0 - 2,5 litredir. Yaşlılar: Erişkinlerdeki gibidir. Pediyatrik hastalar: PHYSIONEAL 40'ın pediyatrik hastalarda güvenlilik ve etkililiğigösterilmemiştir. Bu nedenle pediyatrik popülasyonda kullanılacaksa olası yarar veriskleri değerlendirilmelidir. 2 yaşından büyük pediyatrik hastalar için her bir siklus için tolere edilebilecek 800 -1400 ml/m , maksimum 2000 ml miktarına kadar önerilir. 2 yaşından küçükçocuklarda 200 ile 1000 ml/m2 dolum hacmi önerilmektedir. Uygulama şekli:Tıbbi ürünü almadan ve uygulamadan önce alınması gereken önlemler-PHYSIONEAL 40, yalnızca periton içine uygulama içindir; intravenöz yoldankullanılmaz.- Periton diyalizi çözeltileri, hasta konforunun arttırılması amacıyla 37 °C sıcaklığa kadarısıtılabilir. Ancak bu amaçla yalnızca kuru ısı (örn., ısıtıcı pedler, ısıtma cihazları)kullanılmalıdır. Hastada hasar ve rahatsızlığa yol açabileceğinden kaynar su içinde ya damikrodalga fırında ısıtılmamalıdır. - Tüm periton diyalizi süreci boyunca aseptik teknik kullanılmalıdır. - Çözeltinin renginde değişiklik varsa, bulanıksa, partikül içeriyorsa, torbada sızıntı varsaya da torbayı kapatmak için kullanılan parçalar yerinde değilse uygulanmamalıdır. - Drene edilen sıvı olası bir peritoniti gösterebilecek fibrin ya da bulanıklık olup olmadığıaçısından kontrol edilmelidir. - Tek kullanımlıktır. - Dış ambalajı açtıktan sonra, iki çözeltiyi karıştırmak için iki bölme arasındaki kapsülühemen kırınız. Üst bölmedeki çözeltinin tamamının alt bölmeye geçmesini bekleyiniz. Altbölmedeki çözeltiyi her iki elinizle sıkıştırarak hafifçe karışmasını sağlayınız. Çözeltikarışım sonrası 24 saat içerisinde intraperitoneal olarak infüze edilmelidir. - Tıbbi ürünün kullanımıyla ilgili talimatlar için bkz. Bölüm 6.6. Özel popülasyonlara ilişkin ek bilgiler:Böbrek /Karaciğer yetmezliği:Ürün böbrek yetmezliğinin tedavisinde kullanılır. Karaciğer fonksiyon bozukluğu olan hastalarda doz ayarlaması gerekmez. Pediyatrik popülasyon:PHYSIONEAL 40 kullanılarak gerçekleştirilen klinik çalışmalarda pediyatrik hastalar değerlendirilmemiştir. Bu nedenle pediyatrik popülasyonda kullanılacaksa olası yarar veriskleri değerlendirilmelidir. Pediyatrik popülasyonda kullanılacaksa, dolum hacimleri vücut boyutuna göre her bir hasta için bireysel olarak belirlenmelidir (genellikle her bir siklus için 800-1400 ml/m2 [35-45ml/kg]). Geriyatrik popülasyon:Yaşlılarda erişkinlerdeki gibi kullanılır. 4.3 KontrendikasyonlarEtkin maddelere ya da Bölüm 6.1'de listelenen yardımcı maddelere karşı hipersensitivite. PHYSIONEAL 40 aşağıdaki hastalarda kullanılmamalıdır:- Periton diyalizi tedavisinin etkinliğini engelleyen veya enfeksiyon riskini arttırandüzeltilemeyecek mekanik bozukluklar. - Periton membranının işlev kaybı ya da işlevini bozan ileri yapışıklıklar. - Laktik asidoz 3 4.4 Özel kullanım uyarıları ve önlemleri Kullanıma dikkat etmesi gereken hastalar Aşağıda belirtilen durumların varlığında periton diyalizi dikkatle uygulanmalıdır: 1) Uygulanan karın cerrahisi sırasında periton membranı ve diyaframın bütünlüğününbozulması, konjenital anomaliler, iyileşme gerçekleşene kadar karın bölgesine olantravmalar, batın tümörleri, karın duvarı enfeksiyonları, herni, fekal fistül, kolostomi yada ileostomi, sık tekrarlayan divertikülit atakları, enflamatuvar ya da iskemik bağırsakhastalığı, büyük polikistik böbrekler ya da karın duvarı, yüzeyi ya da boşluğununbütünlüğünü bozan durumlar. 2) Son zamanlarda uygulanmış aortik greft replasmanı ya da şiddetli solunum hastalığıgibi diğer durumlar. Enkapsülan peritoneal skleroz (EPS) Enkapsülan peritoneal skleroz (EPS) periton diyalizi tedavisinin bilinen nadir görülenkomplikasyonlarından biridir. Periton diyalizi tedavisinin kapsamında aralarındaPHYSIONEAL 40'ın da bulunduğu periton diyalizi çözeltileri kullanan hastalardaEPS görülebildiği rapor edilmiştir. Peritonit Periton diyalizi tedavisi sırasında peritonit gelişirse, mümkün olan her durumdakullanılacak antibiyotiklerin seçim ve dozajı izole edilen organizmaların tanıma veduyarlılık çalışmalarının sonuçlarına göre düzenlenmelidir. Peritonite yol açanorganizmaların belirlenmesinden önce geniş spektrumlu antibiyotiklerin kullanımıgerekli olabilir. Hipersensitivite Hidrolize edilmiş mısır nişastasından türetilen glikoz içeren çözeltiler mısır veya mısırürünlerine karşı bilinen bir alerjisi olan hastalarda dikkatli bir şekilde kullanılmalıdır.Mısır nişastası alerjisine bağlı anafilaktik/anafilaktoid reaksiyonlar gibi aşırı duyarlılıkreaksiyonları meydana gelebilir. Aşırı duyarlılık reaksiyon gelişimi gösteren herhangibir belirti veya semptom şüphesi mevcutsa, acilen infüzyonu durdurun ve peritonboşluğundaki çözeltiyi boşaltın. Klinik olarak belirtilen şekilde, uygun terapötikönlemler kullanılmalıdır. Laktat düzeyleri yükselmiş hastalarda kullanım Laktat düzeylerinin yükselmiş olduğu hastalarda, laktat içeren periton diyaliziçözeltilerinin kullanımında dikkat gerekir. Laktat temelli periton diyalizi çözeltileri iletedaviye başlamadan önce ve tedavi sırasında laktik asidoz riskini arttırdığı bilinendurumların [örn. ciddi düşük tansiyon, sepsis, akut böbrek yetmezliği, doğuştanmetabolik hastalıklar, metformin ve nükleosit/nükleotid revers transkriptazinhibitörleri (NRTI) gibi ilaçlarla tedavi] bulunduğu hastaların laktik asidoz oluşumuaçısından takibi gerekir. Genel izlem Reçetelenecek çözeltinin bireysel olarak belirlenmesinde, hastanın diğer mevcuthastalıkları için aldığı tedavilerin diyaliz tedavisiyle etkileşimi dikkate alınmalıdır.Kardiyak glikozit kullanan hastaların plazma potasyum düzeyleri dikkatle takipedilmelidir. 3 Konjestif kalp yetmezliği, hipovolemi ve şok gibi ciddi sonuçlara da neden olabilecekaşırı hidrasyon ya da sıvı kaybından kaçınmak için, hastanın sıvı-elektrolit dengesi vevücut ağırlığındaki değişimler izlenerek kayıt altında tutulmalıdır. Periton diyalizi sırasında protein, amino asit, suda çözünen vitamin ve diğer ilaçlarınkaybı oluşabilir ve bunların replasmanı gerekebilir. Serum elektrolit konsantrasyonları (özellikle bikarbonat, potasyum, magnezyum,kalsiyum ve fosfat), kan biyokimyası (paratiroid hormon ve lipid parametreleri dâhil)ve hematolojik parametreler düzenli olarak takip edilmelidir. Sekonder hiperparatiroidizm Sekonder hiperparatiroidi olan hastalarda, hiperparatiroidizmi kötüleştirebileceği için, PHYSIONEAL 40 gibi 1,25 mmol/L düzeyinde kalsiyum içeren diyaliz çözeltilerininkullanımının olası yarar ve riskleri dikkatle değerlendirilmelidir. Metabolik alkaloz Plazma bikarbonat düzeyleri 30 mmol/L üzerinde olan hastalarda, bu ürünleuygulanacak tedavinin yararları ile olası metabolik alkaloz riski karşılaştırılmalıdır. Gereğinden fazla infüzyon PHYSIONEAL 40 çözeltilerin periton boşluğuna gereğinden fazla infüzyonu karındagerginlik, ağrı ve/veya nefes darlığına neden olabilir. Fazla infüzyonun tedavisi için peritoneal boşluktan aşırı uygulanmış çözelti dreneedilmelidir. Yüksek glukoz konsantrasyonlarının kullanımı Periton diyalizi tedavisi sırasında yüksek konsantrasyonda dekstroz (glukoz) içeren PHYSIONEAL 40 çözeltilerinin aşırı kullanımı hastalarda fazla sıvı çekilmesiylesonuçlanabilir (Bkz. bölüm 4.9). Potasyum ilavesi Hiperkalemi riski nedeniyle PHYSIONEAL 40 çözeltilerine potasyum eklenmemiştir.o Serum potasyum düzeylerinin normal ya da düşük olduğu (hipokalemi) durumlarda, ağır bir hipokalemi gelişmesini önlemek amacıyla, çözeltiye potasyum klorür eklemek (4 mEq/L'ye kadar) gerekebilir; bu ekleme ancak serumve toplam vücut potasyum düzeyleri dikkatli bir şekilde değerlendirildikten sonrave yalnızca doktor tarafından önerildiğinde yapılmalıdır. Diyabetli hastalarda kullanım Diyabetli hastalarda, kan glukoz düzeyleri izlenerek insülin ya da hiperglisemi içinuygulanan diğer ilaçların dozajı duruma göre ayarlanmalıdır. Bu tıbbi ürün her 1000 ml'sinde 13,6 g glukoz içerir. Diyabet hastalarında göz önündebulundurulmalıdır. Sodyum Bu tıbbi ürün her 1000 ml'sinde 132 mmol sodyum ihtiva eder. Bu durum, kontrollüsodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır. 5 Uygun olmayan uygulama Art arda değişim veya doldurma işlemindeki düzensizlik, peritoneal boşluk içine havanın infüzyonuna sebep olabilir bu da karın ağrısına ve/veya peritonite nedenolmaktadır. Karışmamış çözeltinin infüzyonu durumunda hasta derhal çözeltiyi boşaltmalı ve yeni karıştırılmış bir torba kullanmalıdır. Pediyatrik popülasyon Pediyatrik hastalarda etkililik ve güvenliliği gösterilmemiştir. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriEtkileşim çalışmaları yapılmamıştır. Diyaliz sırasında, diyaliz edilebilir ilaçların kan konsantrasyonlarının düşebileceği gözönünde bulundurulmalıdır. Bu ilaçların kaybedilen miktarını telafi edebilecekönlemler alınmalıdır. Kardiyak glikozit kullanan hastaların plazma potasyum düzeyleri dijitalentoksikasyonu riski nedeniyle dikkatle takip edilmelidir. Tedaviye potasyumeklenmesi gerekebilir. Özel popülasyonlara ilişkin ek bilgilerHiçbir etkileşim çalışması yapılmamıştır. Pediyatrik popülasyonHiçbir etkileşim çalışması yapılmamıştır. 4.6 Gebelik ve laktasyonGenel tavsiye:Gebelik Kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar / doğum kontrolü (kontrasepsiyon)PHYSIONEAL 40'ın çocuk doğurma potansiyeli bulunan kadınlarda kullanımı ve doğum kontrolü üzerindeki etkilerine ilişkin veri yoktur. Doğum kontrol yöntemi kullanmayan çocukdoğurma potansiyeli bulunan kadınlarda PHYSIONEAL 40 kullanımı önerilmez. Gebelik dönemiPHYSIONEAL 40'ın gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. İnsanlara yönelik potansiyel risk bilinmemektedir.Hamilelik sırasında kadınlarda PHYSIONEAL 40 kullanımı önerilmez. Laktasyon dönemiPHYSIONEAL 40 metabolitlerinin anne sütüyle atılıp atılmadığı bilinmemektedir. Yeni doğanlara/bebeklere yönelik risk göz ardı edilemez. Emzirmenin çocuk açısından faydası ve tedavinin kadın açısından faydası göz önünde bulundurularak, emzirmeyi bırakma veya PHYSIONEAL 40 tedavisini bırakma/ara vermekararı verilmelidir. 6 Üreme yeteneği / FertiliteFertilite ile ilgili herhangi bir klinik veri mevcut değildir. 4.7 Araç ve makine kullanımı üzerindeki etkilerPeriton diyalizi tedavisi gören son dönem böbrek yetmezlikli-(SDBY) hastalarda, araç ve makine kullanımım etkileyebilecek istenmeyen etkiler görülebilir. 4.8 İstenmeyen etkilerKlinik çalışmalarda ve pazarlama sonrası deneyim sırasında (hastaların %1 ya da daha fazlasında) bildirilen advers etkiler aşağıda sıralanmıştır. Kontrollü klinik çalışmalarda PHYSIONEAL 40'a bağlı olarak bildirilen en yaygın advers etki hastaların yaklaşık %10 kadarında görülen alkalozdur. Bu vakaların çoğunda tanı serumbikarbonat düzeylerinin ölçümüyle konulmuş ve genellikle klinik semptom görülmemiştir. Görülen advers ilaç reaksiyonlarının sıklık sınıflandırması şu şekildedir: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila<1/1.000), çok seyrek, izole raporlar dâhil (<1/10.000); bilinmiyor (eldeki verilerdenhareketle tahmin edilemiyor). Kan ve lenf sistemi hastalıklarıBilinmiyor: Eozinofili. Metabolizma ve beslenme hastalıklarıYaygın: Alkaloz, hipokalemi, sıvı retansiyonu,hiperkalsemi. Yaygın olmayan: Hipervolemi, anoreksi, dehidratasyon,hiperglisemi, laktik asidoz. Psikiyatrik hastalıklarYaygın olmayan:İnsomnia.Sinir sistemi hastalıklarıYaygın olmayan: Baş dönmesi/sersemlik hali, baş ağrısı. Vasküler hastalıklarYaygın: Hipertansiyon. Yaygın olmayan: Hipotansiyon. Solunum, göğüs bozuklukları ve mediastinal hastalıklarYaygın olmayan: Dispne, öksürük Gastrointestinal hastalıklarYaygın: Peritonit. Yaygın olmayan: Peritoneal membran yetmezliği, karın ağrısı, dispepsi, flatulans, bulantı. Bilinmiyor: Enkapsülan periton sklerozu, peritoneal sıvıda bulanıklık Deri ve deri altı doku hastalıklarıBilinmiyor: Anjiyoödem, döküntü, Stevens-Johnson sendromu Kas-iskelet bozuklukları, bağ dokusu ve kemik hastalıklarıBilinmiyor: Kas-iskelet ağrısı. 7 Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın:
Yaygın olmayan: Bilinmiyor: AraştırmalarYaygın:Ödem, asteni. Titreme, yüzde ödem, herni, halsizlik, susama. Ateş. Kilo artışı. Yaygın olmayan: PCO2 düzeylerinde yükselme Periton diyalizi sırasında görülen diğer prosedürel istenmeyen reaksiyonlar: bakteriyel peritonit, kateter çıkış yeri enfeksiyonu, kateterle ilişkili komplikasyonlar. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e-posta: [email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99) 4.9 Doz aşımı ve tedavisiDoz aşımının muhtemel sonuçları arasında hipervolemi, hipovolemi, elektrolit bozuklukları ve hiperglisemi (diyabetik hastalarda) yer alır (Bkz. Bölüm 4.4). Doz aşımının tedavisi: Hipervolemi durumu hipertonik periton diyalizi çözeltilerinin kullanımı ve sıvı kısıtlaması ile tedavi edilir. Hipovolemi durumunda dehidratasyonun derecesine göre oral veya intravenöz yoldan sıvı replasmanı uygulanır. Elektrolit dengesindeki bozulmalar, azalan ya da artan elektrolit kan testleriyle belirlendikten sonra spesifik olarak bozukluğa yönelik olarak düzeltilmelidir. En olası bozukluk olanhipokalemi durumu potasyumun oral olarak uygulanımıyla ya da diyaliz çözeltisine hekimönerisiyle potasyum klorür eklenmesiyle tedavi edilir. Hiperglisemi durumu (diyabetli hastalarda), tedaviyi yürüten hekim tarafından insülin dozunun ayarlanmasını gerektirir. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik Grubu:ATC kodu:B05DBEtki mekanizmasıPeriton diyalizi, böbrek yetmezliği olan hastalarda azot metabolizması sonucu oluşarak normalde böbrekler yoluyla atılan toksik maddelerin vücuttan uzaklaştırılmasını sağlayan ve 8 bozulmuş olan asit-baz dengesi yanında sıvı ve elektrolit dengesizliklerinin düzeltilmesine de yardımcı olan bir yöntemdir. Bu işlem periton diyalizi sıvısının, aseptik olarak periton boşluğuna yerleştirilen özel bir kateter aracılığıyla karın boşluğuna verilmesiyle gerçekleşir. Farmakodinamik etkiler Çözeltideki glukoz, çözeltinin plazmaya göre hiperozmolar olmasını sağlar ve böylece ozmotik bir fark yaratarak, kronik böbrek yetmezlikli hastalarda görülen aşırı hidrasyondurumunu düzeltmek için gerekli olan plazmadan, diyaliz çözeltisine doğru sıvıçekilmesi-işlemini kolaylaştırır. Maddelerin diyaliz sıvısı ile hastanın peritonundaki kapilerdamarlar arasındaki transferi, osmoz ve difüzyon prensibine bağlı olarak periton membranıboyunca gerçekleşir. Bekleme süresinden sonra, çözelti toksik maddeler açısından doygunduruma gelir ve değiştirilmesi gerekir. Diyaliz sıvısının elektrolit yoğunlukları, bikarbonat ön-maddesi olarak eklenmiş laktat hariç, plazmanın elektrolit konsantrasyonunu normalleştirmekamacıyla formüle edilmiştir. Kanda yüksek konsantrasyonda bulunan azotlu atık maddeler,periton membranından diyaliz sıvısına doğru geçerler. Klinik etkililik ve güvenlilik Klinik çalışmaların yapıldığı hastaların %30'dan fazlası 65 yaş üzerindedir. Bu yaş grubundaki hastalardan elde edilen bilgiler, diğer yaş grubundaki hastalara göre herhangi birfarklılık göstermemektedir. İn vitroex vivoçalışmalar, standart laktat tamponlu çözeltilere göre PHYSIONEAL 40'ın biyolojik olarak daha fazla uyumlu olduğunu göstermektedir. Ayrıca, karın ağrısı olanhastalarda yapılan sınırlı sayıdaki klinik çalışmadan elde edilen sonuçlar, hastalarınsemptomatik yarar sağladığını göstermektedir. Bununla birlikte, bugüne kadar klinikkomplikasyonların tümüyle azaldığı ya da bu çözeltilerin düzenli kullanıldığında uzun sürelianlamlı yararı görüldüğüne ilişkin bilgi mevcut değildir.5.2 Farmakokinetik özelliklerİntraperitoneal olarak uygulanan glukoz, elektrolitler ve su kana emilir ve klasik yollarla metabolize edilir. Glukoz (1g glukoz = 4 kcal veya 17 kj) CO2 ve H2O'ya metabolize olur. Emilim:Çözeltinin bileşimine, hiperozmolar yapmak amacıyla katılan glukoz, vücutta doğal olarak bulunan bir maddedir. Periton diyalizi uygulaması sırasında glukoz periton membranından absorbe olabilir. Dağılım:Absorbe olanglukoz,normalbeslenmedetüketilenkarbonhidratların yadayağın metabolizasyonuyla vücutta oluşan glukozla aynı şekilde dağılıma uğrar. Biyotransformasyon:Absorbe olanglukoz,normalbeslenmedetüketilenkarbonhidratların yadayağın metabolizasyonuyla vücutta oluşan glukozla aynı şekilde biyotransformasyona uğrar. Glukoz, karbondioksit ve suya metabolize olur. Bu sırada 1 gram glukoz, 4 kcal'lik kalori sağlar. Eliminasyon:Böbrek yetmezliği durumunda böbreklerin eliminasyon yeteneği kaybolduğundan, vücutta biyotransformasyona uğramış glukoz periton diyalizi ile uzaklaştırılır. 9 Benzer şekilde çözelti içindeki sodyum klorür, sodyum laktat, kalsiyum klorür dihidrat ve magnezyum klorürü oluşturan sodyum, klorür, laktat, kalsiyum ve magnezyum iyonları davücutta doğal olarak bulunan maddelerdir. Bu iyonlar da periton membranındanemildiklerinde, vücutta bulunan iyonların normal farmakokinetiğine benzer birfarmakokinetik sergilerler. 5.3 Klinik öncesi güvenlilik verileriPHYSIONEAL 40 ile klinik dışı çalışmalar yapılmamıştır. 6. FARMASÖTİK ÖZELLİKLERİ6.1 Yardımcı maddelerin listesiEnjeksiyonluk suKarbondioksit (pH ayarı için)6.2 GeçimsizliklerBu ilaç bölüm 6.6'da bahsedilenler dışındaki ilaçlarla karıştırılmamalıdır. 6.3 Raf ömrü24 ay. Karışım sonrası raf ömrü: Dış ambalajı açılmış ve iki bölümü karıştırılmış çözelti 24 saat içerisinde kullanılmalıdır. 6.4 Saklamaya yönelik özel tedbirler25°C altındaki oda sıcaklığında saklayınız. Rekonstitüsyondan sonra 24 saat içinde kullanılmalıdır. Berrak olmayan ve ambalajı bozulmuş çözeltileri kullanmayınız. Eğer çökelti içerirse enjeksiyonu kullanmayınız. Orijinal ambalajında saklanmalıdır. 6.5 Ambalajın niteliği ve içeriğiPHYSIONEAL 40 çözeltisi, hava geçirmez veya sızdırmaz bir biçimde tıbbi kullanıma uygun plastikleştirilmiş PVC'den üretilmiş iki bölmeli torba içerisine yerleştirilir. Üst bölmede ilaç karışımını elektrolitli glukoz çözeltisine vermek için enjeksiyon girişi bulunmaktadır. Alt bölmede diyaliz işlemlerine imkan tanıyan uygun bir uygulama setibağlantısı için bir çıkış bulunmaktadır. Torba, termik füzyon ile elde edilen ve çok tabakalı kopolimerden yapılan transparan bir dış ambalaj içerisine konulur. Bölmeler arasındaki kapsül kırılarak karıştırıldığında 2 değişik hacimde çözelti elde edilir: 2000 ml (725 ml A çözeltisi ve 1275 ml B çözeltisi) ve 2500 ml (906 ml A çözeltisi ve 1594ml B çözeltisi). Tekli torbalar Aletli Periton Diyalizinde (APD) kullanım için geliştirilmiş iki bölmeli bir torba şeklinde sunulmaktadır (küçük bölme A ve büyük bölme B, bkz bölüm 2). Çiftlitorbalar Sürekli Ayaktan Periton Diyalizinde (SAPD) kullanım için geliştirilmiş iki bölmeli veentegre bir ayırma sistemi olan bir torbaya ek olarak boş bir drenaj torbasından oluşan şekildesunulmaktadır (küçük bölme A ve büyük bölme B, bkz bölüm 2). 10 Ticari sunum şekilleri: - 2 ve 2,5 litrelik tekli torbalarda - 2 ve 2,5 litrelik çiftli torbalarda mini kapak içeren ve mini kapak içermeyen - 1,5 litrelik çiftli torbada mini kapak içeren 6.6 Tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerUygulamayla ilgili ayrıntılar için bölüm 4.2'ye bakınız. - Torba değişim prosedürleri hastalara evde kullanmadan önce özel merkezlerde verileneğitimlerle ayrıntılı olarak anlatılmaktadır. - Dış ambalajı açtıktan sonra, iki çözeltiyi karıştırmak için iki bölme arasındaki kapsülühemen kırınız. Üst bölmedeki çözeltinin tamamının alt bölmeye geçmesini bekleyiniz. Altbölmedeki çözeltiyi her iki elinizle sıkıştırarak hafifçe karışmasını sağlayınız. Çözeltikarışım sonrası 24 saat içerisinde intraperitoneal olarak infüze edilmelidir. Bölüm 4.2'yebakınız. - Torbaya insülin (Actrapid 10 IU/L, 20 IU/L ve 40 IU/L) uygulandığında, insülinin25°C'da kullanım sırasında 6 saat süreyle kimyasal ve fiziksel olarak stabilitesinikoruduğu gösterilmiştir. - Aminoglikozidler kimyasal uyuşmazlık nedeniyle penisilinler ile aynı torbadakarıştırılmamalıdır. - İlaç eklenecekse, iki bölme arasındaki kapsül kırılmadan önce torbanın küçükbölmesindeki ilaç ekleme girişinden eklenmelidir. Ek ilaç kullanıldığı durumlardageçimsizlik olup olmadığı kontrol edilmeli, çözeltinin pH'sı ve içerdiği tuzlar dikkatealınmalıdır. Herhangi bir ilaç eklendikten sonra çözelti hemen kullanılmalıdır. - Kullanımdan sonra artan çözelti Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj veAmbalaj Atıklarının Kontrolü Yönetmeliğinene uygun olarak imha edilmelidir. - Hasarlı olması durumunda torba atılmalıdır. - Çözelti bakteriyel endotoksin içermez. MiniCap (Povidon İyotlu):TanımBu cihaz periton diyalizi tedavisinde kullanılan plastik bir ayırma kapağıdır ve Baxter transfer setinin dişi Lüer bağlantısını kontaminasyondan korumak üzere povidon-iyot içerir. Kontrendikasyonlarİyoda karşı bilinen alerjik reaksiyon öyküsü varsa bu ürünü kullanmayınız. Daha fazla bilgi için doktorunuza başvurunuz. UyarılarAseptik teknik kullanınız. Sıvı yolunun herhangi bir kısmında kontaminasyon olması peritonit ile sonuçlanabilir.Ambalaj açılmışsa veya hasar görmüşse veya ambalajın dış kısmı lekelenmişse kullanmayınız. Sünger kuru ise, yoksa ya da kapaktan dışarı çıkmışsa kullanmayınız (Bkz.Şekil 1). Süngere dokunulmuşsa atınız. Oda sıcaklığında saklayınız. Aşırı ısıdan koruyunuz. 11 Bu ürün tek kullanımlıktır. Tek kullanımlık bir ürünün yeniden kullanılması veya yeniden işlemden geçirilmesi, kontaminasyona ve ürünün işlevinin veya yapısal bütünlüğünün zarargörmesine neden olabilir. Çocukların göremeyeceği, erişemeyeceği yerlerde ve ambalajında saklayınız. Kazara yutulması halinde, derhal doktorunuza danışınız. Peritoneal diyalizat dolum hacmi düşük olan hastalarda, özellikle bebek ve çocuklarda, tiroid fonksiyonunun izlenmesi tavsiye edilmektedir. İyot maruziyetini minimuma indirmek için,klinik olarak mümkün olduğunda, bir sonraki dolum döngüsünü başlatmadan önce peritonboşluğundaki sıvıyı drenaj torbasına boşaltınız. Diğer üreticilerden temin edilebilen pek çok diyaliz ürünü, Baxter Healthcare Corporation ekipmanı veya tek kullanımlık ürünleriyle birlikte kullanılmaktadır. Bu ürünlerdekideğişkenlik, toleranslar, mekanik kuvvet veya zaman zaman yapılabilecek değişikliklerBaxter'ın kontrolü dışındadır. Bundan dolayı Baxter, başka üreticilerin diyaliz ürünlerinin,kendi ürünleri ile kullanıldığında sorunla karşılaşılmayacağını garanti edemez. Kullanım TalimatıDikkat: Aseptik teknik kullanınız.1. Doktorunuz tarafından verilen talimatlara uyunuz. Bir yüz maskesi takınız. Ellerinizidezenfektan özelliği olan sabun ile yıkayıp tamamen kurutunuz. Ellerinize antiseptikuygulayınız. 2. MiniCapMiniCap'i tamamen açığa çıkaracak şekilde açınız.3. MiniCap'i ambalajından alınız.4. Transfer setin uç kısmını aşağıya doğru pozisyonda tutunuz. MiniCapMiniCap'i çok sıkmayınız.5. Değişim sırasında, MiniCap'i saat yönünün tersine çevirerek transfer setibağlantısından çıkarınız.6. Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğinene uygun olarak imhaedilmelidir. 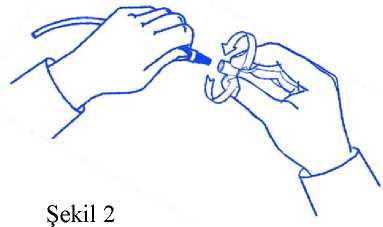
12  Baxter, MiniCap ve Physioneal, Baxter International Inc.'nin ticari markalarıdır.7. RUHSAT SAHİBİAdı: Baxter Turkey Renal Hizmetler A.Ş.AdresiTelFaksÜretim yeri: Baxter Healthcare S.A.Moneen Road, Castlebar, Country Mayo - İrlanda 8. RUHSAT NUMARASI2016/73 9. İLK RUHSAT TARİHİ / RUHSAT YENİLEME TARİHİİlk ruhsatlandırma tarihi: 01.02.2016 Son ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ13
|
İlaç BilgileriPhysioneal 40 %1.36 Glukozlu Periton Diyaliz ÇözeltisiEtken Maddesi: Glukoz Monohidrat, Kalsiyum Klorür Dihidrat, Magnezyum Klorür Heksahidrat, Sodyum Klorür, Sodyum Bikarbonat, Sodyum (s)-laktat Kullanma talimatı ve kısa ürün bilgileri |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.