Gynelle 2 Mg/0,035 Mg Kaplı Tablet Kısa Ürün BilgisiKISA URUN BİLGİSİ¡ Bu ilaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonları TÜFAM'abildirmeleri beklenmektedir. Bakınız Bölüm 4.8. Şüpheli advers reaksiyonların raporlanması. 1. BEŞERİ TIBBİ URUNUN ADIGYNELLE 2 mg/0,035 mg Kaplı Tablet 2. KALITATIF VE KANTITATIF BILEŞIMEtkin madde:
2 mg 0,035 mg 29,115 mg 19,637 mg Siproteron asetat Etinil estradiol Yardımcı maddeler:Laktoz monohidrat (inek sütü kaynaklı) Sukroz Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORM4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlar Doğurganlık çağındaki kadınlarda androjen duyarlılığına bağlı orta dereceli ila şiddetliakne (sebore ile birlikte veya tek başına) ve/veya hirsutizm tedavisi. Akne tedavisinde yalnızca topikal veya sistemik antibiyotik tedavisinin başarısız olduğudurumlarda. Hormonal kontraseptif gibi etki gösterdiğinden, diğer hormonal kontraseptiflerle birliktekullanılmamalıdır (Bkz. Bölüm 4.3). 4.2. Pozoloji ve uygulama şekliPozoloji / uygulama sıklığı ve süresi:GYNELLE ovülasyonu inhibe eder ve böylece gebeliği önler. GYNELLE kullanan hastalarda ek bir hormonal kontraseptif, hasta aşırı doz hormona maruz kalacağından ve aşırı doz alımıetkili kontrasepsiyon için gerekli olmadığından kullanılmamalıdır. Kullanım süresiSemptomların hafiflemesine kadar geçen süre en az üç aydır. Tedaviyi sürdürme ihtiyacı, tedavi eden hekim tarafından düzenli olarak değerlendirilmelidir. Uygulama şekli:Oral kullanım İlk tedavi kürü: Menstrual siklusun ilk gününde başlanmak üzere 21 gün boyunca, her gün 1 kaplı tablet (menstrüasyonun ilk günü 1. gün olarak sayılır) alınır. 1/18 Sonraki kürler: Sonraki her küre, ilk tedavi kürü olan 21 günlük uygulamayı takiben, kaplı tablet kullanılmadan geçen 7 günün ardından başlanır. GYNELLE'in kontraseptif olarak kullanıldığı durumlarda, yukarıdaki koşullara kesin olarak uyulmalıdır. Kaplı tablet alınmayan dönemde beklenen çekilme kanaması görülmezse,sonraki pakete geçilmeden önce gebelik olasılığı ortadan kaldırılmalıdır. Kontraseptif etkinlik için, oral yolla kullanılan bir kontraseptiften GYNELLE'e geçiş durumunda aşağıdaki talimatlara uyulmalıdır: 21 günlük kombine oral kontraseptiflerden (KOK) geçiş: İlk GYNELLE önceki oral kontraseptif kürünün bitimini takiben, ilk gün hemen alınmalıdır. Ek kontraseptif önlemlergerekli değildir. GYNELLE'in ilk paketi kullanılırken kanama meydana gelmeyecektir. İlkpaketin bitiminden sonra kanama başlayacaktır. 28 günlük KOK'lardan geçiş: GYNELLE, günlük hap paketindeki son aktif hap alımını takip eden gün alınmalıdır. Ek kontraseptif önlemler gerekli değildir. Yalnızca progesteron içeren haplardan geçiş: İlk GYNELLE kaplı tablet, o gün progesteron içeren hap alınmış bile olsa, kanamanın başladığı ilk gün alınmalıdır. Ek kontraseptifönlemler gerekli değildir. Kalan progesteron içeren haplar atılmalıdır. Doğum veya düşük sonrası kullanım: Hamilelik sonrasında hasta tamamen yürüyebilir durumdaysa ve doğumsal bir komplikasyonu yoksa GYNELLE kullanımına, doğumdan 21gün sonra başlanılabilir. İlacın alındığı ilk 7 gün, ek kontraseptif önlemler alınmalıdır. Doğumsonrası ilk ovulasyon, ilk kanamadan önce gerçekleşebileceği için, doğum ve ilk tedavi kürüarasındaki dönemde başka bir kontrasepsiyon yöntem kullanılmalıdır. GYNELLE laktasyonsüresince kontrendikedir. İlk trimester düşüğünden sonra GYNELLE'e hemen başlanılabilir.Bunun anlamı ilk kaplı tabletin alınmasıyla birlikte doğum kontrolü başlamış olacağıdır. Budurumda ek bir kontraseptif önlem gerekli değildir. Doğumu veya ikinci trimester düşüğünütakiben 21-28. günlerde başlanması önerilir. Daha sonra başlandığı takdirde kaplı tabletalımının ilk 7 günü ek bir bariyer yöntemi kullanılmalıdır. Eğer o zamana kadar ilişkigerçekleştiyse, GYNELLE kullanımına başlamadan önce gebelik ekarte edilmeli veya ilkmenstrüel kanama beklenmelidir. İlave kontrasepsiyonun gerekli olduğu özel durumlar: uygulama: Kaplı tablet alımı unutulduğunda, alımı geciken kaplı tablet hemen alınmalıdır. Kaplı tablet, gerçek 12 saatlik süre içerisinde alınabilirse, kaplı tabletinkontraseptif koruyucu özelliği değişmez. Ancak daha uzun süreli gecikmelerde, ekkontrasepsiyon gerekir. Bu durumda yalnızca en yakın zamanlı gecikmiş kaplı tablet alınmalı,daha önce unutulan kaplı tablet/kaplı tabletler atlanmalı ve 7 gün boyunca kaplı tablet alımınadevam ederken, ek olarak hormonal olmayan kontrasepsiyon metodu (ritim veya sıcaklıkmetodu dışındaki) uygulanmalıdır. Ek olarak, paket içerisindeki son 7 günlük kaplıtablet/kaplı tabletlerin alımı unutulursa, sonraki pakete geçmeden önceki ara verilmemelidir.Bu durumda çekilme kanamasının yeni paket bitene kadar olması beklenmez. Kaplı tabletlerinalındığı günlerde bazı ara kanamalar oluşabilir fakat bu klinik olarak önemli değildir.Hastada, ikinci paket bitimini takiben, kaplı tablet kullanılmayan ara dönemde beklenençekilme kanaması gerçekleşmezse, sonraki pakete geçilmeden önce, gebelik olasılığı ortadankaldırılmalıdır. 2/17Gastrointestinal bozukluk: Kusma ve diyare hali oral kontraseptiflerin tam emilimini engelleyerek etkilerini azaltabilir. Böyle bir durumda mevcut paketteki kaplı tabletlerinkullanımına devam edilmelidir. Ek olarak, hormonal olmayan kontrasepsiyon metodu (ritimveya sıcaklık metodu dışındaki) gastrointestinal bozukluğun devam ettiği sürece ve onu takipeden 7 gün boyunca kullanılmalıdır. Eğer bu 7 günlük süre içerisinde paketteki tüm kaplıtabletler biter ise, bir sonraki pakete ara verilmeden başlanmalıdır. Bu durumda çekilmekanamasının ikinci paket bitimine kadar olması beklenmez. Hastada, ikinci paket bitiminitakiben, kaplı tablet kullanılmayan ara dönemde beklenen çekilme kanaması gerçekleşmezse,sonraki pakete geçilmeden önce, gebelik olasılığı ortadan kaldırılmalıdır. Gastrointestinalbozukluğun uzadığı durumlarda, diğer kontrasepsiyon yöntemleri düşünülmelidir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:GYNELLE böbrek yetmezliği olan hastalarda özel olarakaraştırılmamıştır. Mevcut veriler, bu hasta popülasyonunun tedavisinde bir değişiklik önermemektedir. Karaciğer yetmezliği:GYNELLE şiddetli karaciğer hastalıkları olan kadınlardakontrendikedir. Ayrıca Bkz. Bölüm 4.3. Pediyatrik popülasyon:GYNELLE yalnızca menarştan sonra endikedir.Geriyatrik popülasyon:4.3. KontrendikasyonlarÖstrojen/progesteron kombinasyonları içeren preparatlar aşağıdaki koşulların varlığında kullanılmamalıdır ve kullanımları sırasında bunlardan herhangi biri ortaya çıkacak olursa,tedavi hemen kesilmelidir. Diğer hormonal kontraseptiflerle eşzamanlı kullanım (Bkz. Bölüm 4.1) Geçmişte veya devam etmekte olan venöz tromboz (derin venöz tromboz, pulmonerembolizm) Geçmişte veya devam etmekte olan arteriyel tromboz (örn. miyokard enfarktüsü) ya da önbelirtileri (örn. anjina pektoris ve geçici iskemik atak) Serebrovasküler kaza bulgusu veya öyküsü Venöz veya arteriyel trombozla ilgili şiddeti veya birden fazla risk faktörünün varlığı (Bkz.Bölüm 4.4), örneğin; Vasküler semptomların eşlik ettiği diyabet Şiddetli hipertansiyon Şiddetli dislipoproteinemi Aktifleşmiş protein (APC) direnci, antitrombin-III eksikliği, protein C eksikliği, protein Seksikliği, hiperhomosisteinemi ve antifosfolipid antikorları (antikardiyolipin antikorları,lupus antikoagülanı) gibi venöz veya arteriyel trombozla ilgili kalıtsal veya edinilmişyatkınlık Fokal nörolojik belirtili migren öyküsü Karaciğer fonksiyon değerleri normale dönmediği sürece aktif viral hepatit ve şiddetlisiroz gibi şiddetli karaciğer hastalığı varlığı veya öyküsü Karaciğer tümörü varlığı veya öyküsü (iyi veya kötü huylu) Devam eden meme kanseri veya meme kanseri öyküsü Bilinen gebelik varlığı veya gebelik şüphesi Laktasyon (Bkz. Bölüm 4.6 Gebelik ve laktasyon) Etkin ya da yardımcı maddelerden herhangi birine karşı aşırı duyarlılık. GYNELLE erkeklerde kullanılmaz. 3/174.4. Özel kullanım uyarıları ve önlemleriTıbbi MuayeneOral kontraseptif kullanmaya başlamadan önce (ve sonrasında düzenli aralıklarla) her bir kadının ve ailesinin tıbbi öyküsü değerlendirilmelidir. Fizik muayene bu şekilde ve bu ürünleilgili kontrendikasyonlar (Bkz. Bölüm 4.3) ile uyarılar (Bkz. Bölüm 4.4) doğrultusundayönlendirilmelidir. Bu değerlendirmelerin içeriği ve sıklığı ilgili kılavuzlar doğrultusundaolmalı ve kadına özgü şekilde uyarlanmalı, ancak kan basıncı ölçümünü içermeli, doktorungerekli görmesi halinde meme, batın ve pelvik incelemelerinin yanı sıra servikal sitolojideğerlendirilmelidir. Tedaviye başlanmadan önce gebelik olasılığı dışlanmalıdır. Tanı konulmamış vajinal kanamanın altında yatan şüpheli nedenler araştırılmalıdır. Uyarılar GYNELLE, aylık döngünün 21 günü süresince kullanılmak üzere progesteron olarak siproteron asetat, östrojen olarak etinilestradiol içermektedir. KOK benzeri bir bileşimesahiptir. Kullanım süresi Semptomların hafiflemesine kadar geçen süre en az üç aydır. Tedaviyi sürdürme ihtiyacı, tedavi eden hekim tarafından düzenli olarak değerlendirilmelidir. (Bkz. Bölüm 4.2). Kadınlara GYNELLE'in HIV enfeksiyonlarına (AIDS) ve diğer cinsel yolla bulaşan hastalıklara karşı koruma sağlamadığı söylenmelidir. Sıkı tıbbi gözetim gerektiren durumlarAşağıdaki durum/risk faktörlerinden mevcut olması halinde, hastaya özgü olası risklere karşın GYNELLE kullanımına ilişkin fayda tartışılmalı ve GYNELLE kullanmaya başlamadan öncehastayla kullanım konusu değerlendirilmelidir. Bu durum veya risk faktörlerinin herhangibirinin ilk kez ortaya çıkması, şiddetlenmesi veya alevlenmesi halinde hasta doktoruylairtibata geçmelidir. Doktor da GYNELLE kullanımına devam edilip edilmemesi konusundakarar vermelidir. Hafif vasküler hastalık veya hafif nefropati, retinopati ya da nöropatiyle birlikte diyabet Sistolik kan basıncı >140 ila 159 mm Hg veya diyastolik kan basıncı >90 ila 94 mm Hgolacak şekilde yeterli düzeyde kontrol edilen hipertansiyon (Bkz. Bölüm 4.4GYNELLE'in derhal kesilmesini gerektiren nedenler) Porfiri Klinik depresyon Obezite Migren Kardiyovasküler hastalıklar Kloazma Depresyon veya yukarıda bahsedilen durumların herhangi birine ilişkin öyküsü olan hastalar GYNELLE tedavisi sırasında takip edilmelidir. GYNELLE'in derhal kesilmesini gerektiren nedenlerOral kontrasepsiyonu keserken, gerekli olması halinde kontraseptif korumanın sürdürülmesini sağlamak için hormonal olmayan kontrasepsiyon kullanılmalıdır. 4/171. Migren ağrılarının ilk kez ortaya çıkması veya şiddetlenmesi veya olağan olmayan sıklıktaveya şiddette baş ağrılarının oluşması 2. Ani görme veya duyma bozuklukları veya diğer algısal bozukluklar durumunda 3. Tromboz veya kan pıhtılarına ilişkin ilk belirtiler (örneğin; bacak/bacaklarda şişme veyaolağan olmayan ağrı, nefes alırken hissedilen keskin ağrı veya nedensiz öksürmeler). Göğüste ağrı ve darlık hissi. 4. Elektif büyük operasyonlardan 6 hafta önce (örneğin abdominal veya ortopedik), bacaklaraherhangi bir cerrahi müdahale uygulanması halinde, varislerin medikal tedavisi veya uzunsüreli hareketsizlik durumunda; örneğin kaza veya operasyon sonrası durumlar. Tamameniyileştikten sonraki 2 hafta boyunca ilaca başlanılmamalıdır. Acil cerrahi müdahaleningerektiği durumlarda, genellikle trombotik profilaksi uygulanır; örneğin subkutan heparin. 5. Sarılık, hepatit ve tüm vücudun kaşınması 6. Kan basıncında belirgin artış 7. Şiddetli depresyon atakları 8. Şiddetli üst abdominal ağrı veya karaciğerde büyüme 9. Hormonal kontraseptif kullanımı veya hamilelik sırasında bozulduğu bilinen koşullardabelirgin kötüleşme (Bkz. Bölüm 4.4 'Diğer Durumlar' başlığı altındaki 'Gebelik veya öncekiKOK veya GYNELLE kullanımı sırasında kötüleşen durumlar') 10. Gebelik hemen kesilmesini gerektiren nedenlerden biridir (Bkz. Bölüm 4.6). Dolaşım bozuklukları GYNELLE kullanımı, venöz tromboembolizm (VTE) riskini bu ilacın kullanılmamasıdurumuna kıyasla arttırmaktadır. Artan VTE riskinin en yüksek olduğu dönem GYNELLEkullanımına başlandıktan sonraki bir yıllık dönem veya doğum kontrol hapı kullanımına en azbir ay ara verildikten sonra tedaviye başlanan veya tedavinin değiştirildiği dönemdir. Venöztromboembolizm olgularının %1-2'si ölümcül olabilmektedir. Epidemiyolojik çalışmalar, VTE insidansının GYNELLE kullanan kişilerde levonorgestreliçeren KOK kullanan kişilerden 1,5 ila 2 kat yüksek olduğunu vedesogestrel/gestoden/drospirenon içeren KOK'lara ilişkin riske benzer olabileceğinigöstermiştir. GYNELLE kullananlar arasında polikistik over sendromuyla ilişkili durumda olduğu gibikardiyovasküler riskin doğuştan artmış olduğu hastalar olabilir. Epidemiyolojik çalışmalar hormonal kontraseptif kullanımını arteriyel tromboembolizm(miyokard enfarktüsü, geçici iskemik atak) riskindeki artışla da ilişkilendirmiştir. Son derece nadir olmakla birlikte, hormonal kontraseptif kullananlarda diğer kandamarlarında (örn. Hepatik, mezenterik, renal, serebral veya retinal ven ve arterlerde)tromboz geliştiği bildirilmiştir. Venöz veya arteriyel tromboz ya da serebrovasküler kaza semptomları arasında; tek taraflıolağan dışı bacak ağrısı/ bacakta şişme; göğüste ani ve şiddetli ağrı (sol kola yayılıpyayılmasına bakılmaksızın); ani soluksuzluk; aniden başlayan öksürük; herhangi bir olağandışı, şiddetli, uzun süreli baş ağrısı; ani kısmi veya tam görme kaybı; diplopi; geveleyerekkonuşma veya afazi; vertigo; fokal nöbetlerde birlikte veya nöbet olmaksızın bayılma; anidenbaşlayan, vücudun bir tarafını veya tamamını etkileyen güçsüzlük ya da belirgin uyuşukluk;motor bozukluklar; 'akut' abdomen yer alabilir. Venöz tromboembolik olay riski aşağıdaki durumlarda artmaktadır: - Artan yaş; - Sigara kullanımı (risk özellikle 35 yaş üzerindeki kadınlarda tiryakilikle ve yaşınilerlemesiyle daha da artmaktadır). 35 yaş üzerinde olup GYNELLE kullanmak isteyenkadınlarda kesinlikle sigara içmemeleri önerilmelidir; 5/17- Pozitif aile öyküsü (kardeş veya ebeveynde nispeten genç yaşta venöz tromboembolizmgelişmesi). Kalıtsal yatkınlıktan şüphelenilmesi halinde, kadının herhangi bir hormonalkontraseptif kullanımıyla ilgili karar vermeden önce bir uzmana sevk edilmesi gerekmektedir; - Uzun süreli hareketsizlik, majör ameliyat, herhangi bir bacak ameliyatı veya majör travma.Bu durumlarda kullanımının bırakılması (elektif ameliyat durumunda en az dört haftaönceden) ve hareketin tamamen kazanılmasından sonraki iki haftaya kadar tekrarbaşlanılmaması önerilebilir. GYNELLE kullanımının kesilmemiş olduğu durumlardaantitrombotik tedavi düşünülmelidir. - Obezite (vücut kitle indeksinin 30 kg/m2 'den fazla olması). Venöz tromboembolizmde yüzeysel tromboflebit ve variköz venlerin olası rolü konusunda herhangi bir görüş birliği yoktur. Arteriyel tromboembolik komplikasyon veya serebrovasküler kaza riski aşağıdakilerleartmaktadır: - Artan yaş; - Sigara kullanımı (risk özellikle 35 yaş üzerindeki kadınlarda tiryakilikle ve yaşınilerlemesiyle daha da artmaktadır) 35 yaş üzerinde olup GYNELLE kullanmak isteyenkadınlarda kesinlikle sigara içmemeleri önerilmelidir; - Dislipoproteinemi; - Obezite (vücut kitle indeksinin 30 kg/m2 'den fazla olması); - Hipertansiyon; - Migren; - Valvüler kalp hastalığı; - Atriyal fibrilasyon; - Pozitif aile öyküsü (kardeş veya ebeveynde nispeten genç yaşta arteriyel tromboz gelişmişolması) Kalıtsal yatkınlıktan şüphelenilmesi halinde, kadının herhangi bir hormonalkontraseptif kullanımıyla ilgili karar vermeden önce bir uzmana sevk edilmesi gerekmektedir. Dolaşımla ilgili advers olaylarla ilişkilendirilmiş olan diğer tıbbi durumlar arasındadiyabet, sistemik lupus eritematozus, hemolitik üremik sendrom, kronik inflamatuvarbağırsak hastalığı (örn. Crohn hastalığı veya ülseratif kolit) ve orak hücreli anemi vardır. Lohusalık döneminde tromboembolizm riskinin arttığı mutlaka dikkate alınmalıdır('Hamilelik ve Emzirme' ile ilgili bilgi için Bkz. Bölüm 4.6). GYNELLE kullanımı sırasında migrenin sıklık veya şiddetinde artış olması(serebrovasküler olaya ilişkin ön belirti olabilir) GYNELLE kullanımın derhal kesilmesinigerektirebilir. GYNELLE kullanan kadınların olası tromboz semptomlarıyla karşılaşmaları halindedoktorlarıyla irtibata geçmeleri gerektiği özellikle vurgulanmalıdır. Trombozdanşüphelenilmesi veya doğrulanması halinde, GYNELLE kullanımı kesilmelidir.Antikoagülan tedavinin (kumarinler) teratojenisitesi nedeniyle uygun kontrasepsiyonabaşlanmalıdır. Dolaşım olaylarını etkileyen diğer faktörler Akne veya orta derecede şiddetli hirsutizme yönelik tedavi olarak GYNELLE kullanan hastalar genellikle polikistik over sendromu gibi kardiyovasküler riskin doğuştan artmışolduğu bireylerdir. Venöz veya arteriyel trombozla ilgili kalıtsal veya edinilmiş yatkınlık göstergesi olabilen biyokimyasal faktörler arasında Aktifleşmiş Protein C (APC) direnci, hiperhomosisteinemi,antitrombin-III eksikliği, protein C eksikliği, protein S eksikliği, antifosfolipid antikorları(antikardiyolipin antikorları, lupus antikoagülanı) yer almaktadır. 6/17Risk/fayda değerlendirmesi yaparken, doktor bir duruma yönelik yeterli tedavinin ilişkili tromboz riskini azaltabileceğini ve gebelikle ilişkili riskin KOK veya GYNELLE kullanımıile ilişkili riskten daha yüksek olduğunu hesaba katmalıdır. TümörlerDiğer birçok steroidlerde olduğu gibi, GYNELLE'in de çok yüksek dozda verilmesiyle, sıçan karaciğerinde karsinom dahil tümör insidansında artışa neden olduğu bulunmuştur. Bu ilginininsanlarla ilişkisi bilinmemektedir. Birçok epidemiyolojik çalışma KOK kullanan kadınlarda over, endometrium, serviks ve meme kanseri riskiyle ilgili bilgi sağlamıştır. Kanıtlar yüksek dozda KOK'ların over veendometrium kanseri bakımından önemli oranda koruma sağladığını açıkça ortayakoymaktadır. Bununla birlikte, düşük doz KOK'ların veya GYNELLE'in aynı düzeydekoruyucu etki sağlayıp sağlamadığı net değildir. Meme kanseri 54 epidemiyolojik çalışmanın meta analizleri sonucu, halen KOK kullanan kadınlarda tanı konan meme kanseri rölatif riskinde (RR=1,24) hafif artış olduğunu göstermektedir. Gözlenenartmış risk örneğin, KOK kullananlarda meme kanserinin daha erken tanısına, KOK'larınbiyolojik etkilerine veya bu ikisinin kombinasyonuna bağlı olabilir. Halen KOK kullananveya son on yıl içinde KOK kullanmış kadınlarda tanısı konan ek meme kanserleri, KOKkullanmamış kadınlara oranla daha çok memede lokalize olmaktadır. Meme kanseri 40 yaşın altındaki kadınlarda, KOK kullanmış olsun ya da olmasın seyrek görülür. Arka plandaki riskler yaşla birlikte artarken halen KOK kullanan veya KOKkullanmış kadınlardaki meme kanseri tanılarındaki artış, tüm meme kanseri riski ilekarşılaştırıldığında düşüktür. (Bkz. grafik). KOK kullanıcılarında meme kanseri için en önemli risk faktörü kadının KOK'u bırakma yaşıdır; bırakma yaşı daha büyük kadınlarda, daha fazla meme kanseri tanısı konmaktadır.Kullanım süresi daha az önemlidir ve aşırı risk KOK kullanmayı bıraktıktan sonra 10 yılboyunca kaybolur, öyle ki 10 yıl boyunca da aşırı görülmez. Meme kanseri riskindeki olası artış KOK kullanan kadınlara anlatılmalı, kombine oral kontraseptiflerin diğer kanser riski oluşumlarına (over ve endometrium kanseri) karşı önemlikoruma sağlıyor olması göz önüne alınarak yarar ve risk değerlendirilmelidir. Hiç KOK kullanmamış olan 10.000 kadında meme kanseri tanısı alanların sayısına kıyasla 5 yıllık KOK kullanımı ve kullanım sonrası 10 yıla kadar olan süre içinde meme kanseri tanısıalan 10.000 kadına ilişkin tahmini kümülatif sayı: 7/17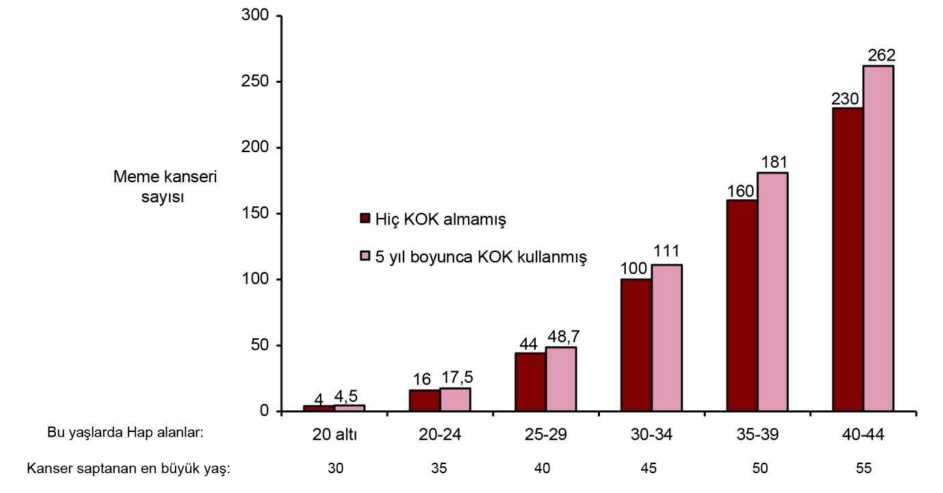
Serviks kanseri Serviks kanseriyle ilgili en önemli risk faktörü kalıcı HPV enfeksiyonudur. Bazı epidemiyolojik çalışmalar uzun süreli KOK kullanımının bu risk artışını daha daartırabileceğini göstermiş olmakla birlikte, bu bulgunun etki karışımı yapan faktörlere, örn.servikal tarama ve bariyer kontraseptif kullanımı dahil cinsel davranışa ne ölçüdeatfedilebileceği tartışmalı bir konudur. Karaciğer kanseri Seyrek olguda benign ve daha seyrek olguda malign olmak üzere izole olgularda yaşamı tehdit eden intraabdominal kanamaya neden olan karaciğer tümörleri GYNELLE'debulunanlar gibi hormonal maddelerin kullanımından sonra gözlenmiştir. Üst abdomendeşiddetli şikayetler, karaciğer büyümesi veya intraabdominal kanama belirtileri meydanagelirse, ayırıcı tanı karaciğer tümörünü de içermelidir. Diğer durumlar GYNELLE kullanımı sırasında birtakım kronik hastalıkların zaman zaman kötüleşmesi olasılığı göz ardı edilemez. Bilinen hiperlipidemiler Hipertrigliseridemi veya ilgili aile öyküsü bulunan kadınlarda KOK ya da GYNELLE kullanımı sırasında pankreatit bakımından risk artışı olabilir. Hiperlipidemisi olan kadınlar arteriyel hastalık bakımından artmış risk altındadır (Bkz. Bölüm 4.4 'Dolaşım bozuklukları). Bununla birlikte, KOK veya GYNELLE kullanan kadınlardarutin tarama yapılması uygun değildir. Kan basıncı Hipertansiyon inme ve miyokard enfarktüsüyle ilgili bir risk faktörüdür (Bkz. Bölüm 4.4 'Arteriyel tromboembolik durumlar'). KOK veya GYNELLE gibi östrojen/progesteronkombinasyonları kullanan birçok kadında kan basıncında hafif artış bildirilmiş olmasınakarşın, klinik açıdan anlamlı artış nadiren gözlenmektedir. Bununla birlikte, GYNELLEkullanımı sırasında kalıcı hipertansiyon gelişmesi halinde, antihipertansif tedavi komplikeolmayan hastalar için 160/100 mm Hg düzeyinde, hedef organ hasarı, tanı almışkardiyovasküler hastalık, diyabet ya da kardiyovasküler risk faktörlerinde artış olanlarda ise 8/17140/90 mm Hg düzeyinde başlatılmalıdır. GYNELLE kullanımına devam edilip edilmemesi konusu daha düşük KB düzeylerinde kararlaştırılmalıdır ve alternatif kontrasepsiyon tavsiyeedilmelidir. Gebelikle veya önceki KOK veya GYNELLE kullanımı ile kötüleşen durumlar: Aşağıdaki durumların hem gebelik hem de bir KOK veya GYNELLE gibi östrojen/progesteron kombinasyonunun kullanımı ile meydana geldiği veya kötüleştiğibildirilmiştir. Aşağıdakilerin herhangi birinin kullanım sırasında meydana gelmesi halinde,GYNELLE bırakılmalıdır: Kolestaz ile ilişkili sarılık ve/veya kaşıntı KOK'lar veya GYNELLE safra kesesi taşı oluşumu riskini artırabilir veya mevcuthastalığı kötüleştirebilir. Sistemik lupus eritematozus Herpes gestationis Otoskleroza bağlı işitme kaybı Orak hücre hastalığı Renal disfonksiyon Herediter anjiyoödem Tek bir kadında gebelik sırasında veya önceki KOK ya da GYNELLE kullanımı sırasında kötüleşme gösterdiği bildirilen her türlü diğer durum. Karaciğer fonksiyonu bozuklukları Karaciğer fonksiyonlarının akut veya kronik bozuklukları, karaciğer fonksiyonu belirteçleri normale dönene dek KOK veya GYNELLE kullanımına ara verilmesini gerektirebilir. Diyabet (vasküler tutulum olmayan) Vasküler hastalığı olmayan, insüline bağlı diyabetik hastalar GYNELLE kullanabilir. Ancak tüm diyabetli hastaların arteriyel hastalık bakımından artmış risk altında olduğu unutulmamalıve KOK veya GYNELLE reçete edilirken bu durum dikkate alınmalıdır. Mevcut vaskülerhastalığı olan diyabetli hastaların GYNELLE kullanması kontrendikedir (Bkz. Bölüm 4.3). KOK'lar veya GYNELLE gibi östrojen/progesteron kombinasyonları periferik insülin direnci ve glukoz toleransı üzerinde etki gösterebilmekle birlikte, düşük doz KOK (0,05 mgetinilestradiolden az) kullanan diyabetli hastalarda terapötik kürün değiştirilmesiyle ilgilikanıt bulunmamaktadır. Bununla birlikte, diyabetli kadınlar KOK veya GYNELLE kullanımısırasında dikkatle izlenmelidir. Kloazma Zaman zaman, özellikle kloazma gravidarum öyküsü olan kadınlarda, kloazma ortaya çıkabilmektedir. Kloazma yatkınlığı olan kadınlar GYNELLE kullanırken güneş veyaultraviyole radyasyon maruziyetinden kaçınmalıdır. Menstrual değişiklikler Menstrual akışın azalması: Bu durum olağan dışı değildir ve bazı hastalarda olması beklenir. Elbette önceden şiddetli periyod geçirenlerde bu durum yararlı olabilir. Menstruasyon atlaması: Bazen çekilme kanaması hiç olmaz. Kaplı tabletler doğru olarak alındıysa hamilelik muhtemel değildir. Çekilme kanamasında aksama kaplı tablete ara verilendönemde gerçekleşirse, gebelik olasılığı diğer pakete başlanmadan önce ortadankaldırılmalıdır. 9/17İntermenstrual kanama: Düzensiz kanama (lekelenme veya ara kanama) özellikle kullanımın ilk aylarında ortaya çıkabilir. Bu nedenle, düzensiz kanamaların oluşumu ancak yaklaşık üçdöngü süren adaptasyon döneminden sonra önem kazanmaktadır. Önceden düzenli olandöngüler sonrasında kanama düzensizlikleri ortaya çıktığı veya var olan düzensizlikler devamettiği takdirde, hormonal olmayan nedenler değerlendirilmeli ve malignite veya gebeliğindışlanması için uygun tanı amaçlı yöntemler kullanılmalıdır. Buna kürtaj da dahildir. Bazı kadınlarda GYNELLE kesildikten sonra amenore veya oligomenore (özellikle önceden bu tip sorunları olanlarda) gelişebilir. Kadınlar bu olasılık konusunda bilgilendirilmelidir. Laktoz: GYNELLE, laktoz içermektedir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktaz yetmezliği ya da glukoz galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamasıgerekir. Sukroz: GYNELLE, sukroz içermektedir. Nadir kalıtımsal fruktoz intoleransı, glukoz-galaktoz malabsorpsiyon veya sukraz-izomaltaz yetmezliği problemi olan hastaların bu ilacıkullanmamaları gerekir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriEtkileşimler Karaciğer enzimi indükleyiciler Hepatik enzimleri (özellikle sitokrom P450 3A4) indükleyen ilaçlar kontraseptif steroidlerin metabolizmasını artırdığından ara kanama ve gebeliğe yol açabilir. Aşağıdaki durumların KOK'lar ve GYNELLE gibi östrojen/progesteron kombinasyonları ile klinik açıdan önemli etkileşimler sergilediği gösterilmiştir: Antiretroviral ajanlar Ritonavir Nelfinavir Nevirapin Antikonvülzanlar Barbitüratlar (fenobarbiton dahil) Primidon Fenitoin Karbamazepin Okskarbazepin Topiramat Antibiyotikler/antifungaller Griseofulvin Rifampisin Bitkisel ilaçlar Sarı kantaron otu (Hypericum perforatum) 10/17Karaciğer enzimi indükleyicileri ile etkileşimlerin yönetilmesi Mikrozomal enzimleri uyaran ilaçlarla etkileşim gelişebilir, bu etkileşimler cinsiyet hormonu klerensinde artışa neden olabilir, bu durum da kanama ve/veya kontraseptif başarısızlıklasonuçlanabilir. Bu ilaçlardan herhangi biriyle kısa süreli tedavi alan kadınların geçici olarak KOK'a ilave olarak bir bariyer yöntemi kullanmaları veya diğer bir kontrasepsiyon yöntemi seçmelerigerekmektedir. Bariyer yöntemi, eşzamanlı ilaç tedavisi ve bunu takip eden 28 gün süresincekullanılmalıdır. Bariyer yönteminin kullanıldığı dönem bir paketin içeriğini geçecek olursa,kaplı tablet alınmayan herhangi bir ara verilmeksizin sonraki kutuya başlanmalıdır. Budurumda, ikinci kutunun sonuna kadar geri çekilme kanaması beklenmemelidir. Hastadaikinci kutunun bitiminden sonraki kaplı tablet kullanılmayan aralıkta geri çekilme kanamasıolmadığı takdirde, sıradaki kutuya devam edilmeden önce gebelik olasılığı dışlanmalıdır. Hepatik enzim indükleyicilerle uzun süreli tedavi gören kadınlarda farklı bir kontrasepsiyon yöntemi kullanılmalıdır. GYNELLE klerensini artıran maddeler (enzimlerin uyarılmasıyla GYNELLE etkililiğinin azalması), örn.: Fenitoin, barbitüratlar, primidon, karbamazepin, rifampisin ve muhtemelenokskarbazepin, topiramat, felbamat, griseofulvin ve sarı kantaron içeren ürünler. GYNELLE klerensi üzerine değişken etkilere sahip maddeler; örneğin: GYNELLE ile birlikte uygulandığında birçok HIV/HCV proteaz inhibitörü ve nükleozid olmayan ters transkriptaz inhibitörleri plazma östrojen veya progesteron konsantrasyonlarınıazaltabilmekte ya da artırabilmektedir. Bu değişiklikler bazı olgularda klinik açıdan anlamlıolabilir. Diğer ilaçlar üzerine etkiler Oral kontraseptifler ve GYNELLE gibi östrojen/progesteron kombinasyonları diğer bazı ilaçların metabolizmasını etkileyebilir. Bunun sonucu olarak, plazma ve dokukonsantrasyonları artabilmekte (örn. siklosporin) veya azalabilmektedir (örn. lamotrijin). Not: Olası etkileşimlerin tanımlanması için eşzamanlı ilaçların reçeteleme bilgilerine bakılmalıdır. Laboratuvar testleri Oral kontraseptif kullanımı karaciğer, tiroid, adrenal ve renal fonksiyonlara ilişkin biyokimyasal parametreleri, plazma taşıyıcı protein ve lipid/lipoprotein fraksiyonu düzeyleri,karbonhidrat metabolizması parametreleri ve pıhtılaşma ile fibrinoliz parametreleri gibi bazılaboratuvar testlerinin bulgularını etkileyebilir. Dolayısıyla, laboratuvar personeli laboratuvartestleri talep edildiğinde oral kontraseptif kullanımı konusunda bilgilendirilmelidir. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:GYNELLE böbrek yetmezliği olan hastalarda özel olarakaraştırılmamıştır. Mevcut veriler, bu hasta popülasyonunun tedavisinde bir değişiklik önermemektedir. Karaciğer yetmezliği:GYNELLE şiddetli karaciğer hastalıkları olan kadınlardakontrendikedir. Ayrıca Bkz. Bölüm 4.3. Pediyatrik popülasyon:GYNELLE yalnızca menarştan sonra endikedir.11/17Geriyatrik popülasyon:4.6. Gebelik ve laktasyonGenel tavsiye:Gebelik kategorisi: X'dir. Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon):GYNELLE kontraseptif gibi etki gösterdiğinden, kullanıldığı sürece fertiliteyi engeller. Gebelik dönemi:Gebelik süresince GYNELLE'in kullanımı kontrendikedir. GYNELLE kullanımı sırasında gebelik oluşursa kullanım derhal kesilmelidir. Laktasyon dönemi:GYNELLE kullanımı laktasyon süresince de kontrendikedir. Laktasyon döneminde GYNELLE kullanımı üretilen süt hacminde azalmaya ve sütün bileşiminde değişime nedenolabilir. Etkin maddelerin eser miktarları anne sütüne geçer. Bu miktarlar özellikle doğumdansonraki ilk 6 haftada çocuğu etkileyebilir. Emziren annelere çocuklarını sütten kesene kadarGYNELLE almamaları söylenmelidir. Üreme yeteneği / Fertilite:Hayvan çalışmalarında, dış genital farklılıkların oluştuğu embriyogenez fazında siproteron asetat kullanılması durumunda erkek fetusta feminizasyona neden olabileceği görülmüştür.Her ne kadar bu sonuçların insanlara uyması beklenmese de, hamileliğin 45. gününden sonrakadınlara GYNELLE verilmesinin erkek fetüsün feminizasyonuna neden olabileceği olasılığıdikkate alınmalıdır. Buradan çıkan sonuç GYNELLE ile tedavi için gebelik, mutlakkontrendikasyon sebebidir ve tedaviye başlanmadan önce mutlaka ekarte edilmelidir. 4.7. Araç ve makine kullanımı üzerindeki etkilerBilinmemektedir. 4.8. İstenmeyen etkilerAdvers reaksiyonlar, aşağıda sistem-organ sınıfı (MedDRA) ve sıklık derecesine göre listelenmektedir. Sıklık dereceleri şu şekilde tanımlanmaktadır: Çok yaygın (>1/10); yaygın(>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000);çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor). Bağışıklık sistemi hastalıklarıSeyrek: Aşırı duyarlılık Kalıtsal anjiyoödem alevlenmesi* Metabolizma ve beslenme hastalıklarıYaygın olmayan: Sıvı tutulumu Hipertrigliseridemi* Psikiyatrik hastalıklarYaygın: Depresif duygu durumu, duygu durum değişiklikleri Yaygın olmayan: Libido azalmasıSeyrek: Libido artışı Sinir sistemi hastalıkları12/17Yaygın: Baş ağrısı Yaygın olmayan: MigrenKorea alevlenmesi* Göz hastalıklarıSeyrek: Kontakt lense toleranssızlık Vasküler hastalıklarıSeyrek: Tromboembolizm Gastrointestinal hastalıklarYaygın: Bulantı, karın ağrısı Yaygın olmayan: Kusma, diyareCrohn hastalığı*, ülseratif kolit* Hepato-bilier hastalıklarıKaraciğer fonksiyonunda bozulmalar* Deri ve deri altı doku hastalıklarıYaygın olmayan: Döküntü, ürtiker Kloazma* AraştırmalarYaygın: Kiloda artış Seyrek: Kiloda azalma Üreme sistemi ve meme hastalıklarıYaygın: Meme ağrısı, meme hassasiyeti Yaygın olmayan: Memede hipertrofiSeyrek: Vajinal akıntı, memede akıntıAzalmış menstrüasyon kanaması*, lekelenme*, ani kanama* ve atlanan çekilme kanaması*, hap sonrası amenore* * Pazarlama sonrası bildirilen advers olaylar GYNELLE kullanan hastalarda pazarlama sonrası şiddetli depresyon bildirimleri (çok seyrek intihar düşüncesi veya davranışı raporları dahil) yapılmıştır. Bununla birlikte, GYNELLE ileklinik depresyon ilişkisi henüz belirlenmemiştir. GYNELLE kullanan tüm kadınlarda tromboembolizm riski artmaktadır (Bkz. Bölüm 4.4). GYNELLE gibi östrojen/ progesteron kombinasyonları kullanan kadınlarda, Bölüm 4.4. Özel kullanım uyarıları ve önlemleri kısmında tartışılan aşağıdaki ciddi advers olaylarbildirilmiştir: Venöz tromboembolik bozukluklar Arteriyel tromboembolik bozukluklar İnmeler (örn., geçici iskemik atak, iskemik inme, hemorajik inme) Hipertansiyon Karaciğer tümörleri (iyi veya kötü huylu) Meme kanseri tanı sıklığı GYNELLE gibi östrojen/progesteron kombinasyonları kullananlarda çok hafif düzeyde artmıştır. Meme kanseri 40 yaşın altındaki kadınlarda nadir 13/17görüldüğünden bu artış genel meme kanseri riskiyle ilişkili olarak küçüktür. GYNELLE gibi östrojen/progesteron kombinasyonları kullanımıyla neden sonuç ilişkisi bilinmemektedir.Daha ayrıntılı bilgi için Bkz. Bölüm 4.3 ve 4.4. Gebelik veya geçmiş KOK veya GYNELLE kullanımı ile kötüleştiği bildirilen durumlarKolestaz ile ilişkili sarılık ve/veya kaşıntı; safra kesesi taşı oluşumu; sistemik lupus eritematozus; herpes gestationis; otoskleroza bağlı işitme kaybı; orak hücre hastalığı; renaldisfonksiyon; kalıtsal anjiyoödem; porfiri; serviks kanseri. KOK veya GYNELLE kullanan kadınlarda glukoz toleransında değişimler veya periferik insülin direnci üzerine etki bildirilmiştir (Bkz. Bölüm 4.4). Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr;eposta: [email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99). 4.9. Doz aşımı ve tedavisiDoz aşımı bulantı, kusma ve kadınlarda, çekilme kanamalarına neden olabilir. Spesifik bir antidotu yoktur ve semptomatik tedavi uygulanmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Östroj enler ve Antiandrojenler ATC Kodu: G03HB01 GYNELLE androjen reseptörlerini bloke eder. Ayrıca androjen sentezini, hem hipotalamohipofiz-over sistemindeki negatif geri besleme etkisiyle; hem de androjen sentezenzimlerinin inhibisyonuyla azaltır. GYNELLE oral kontraseptif etkiye de sahip olmakla beraber, kadınlarda yalnız kontrasepsiyon amacıyla kullanılmamalı; androjene bağlı cilt bozukluklarının tanımlandığıtedavi gerektiren durumlar için saklanmalıdır. 5.2. Farmakokinetik özelliklerGenel özelliklerSiproteron asetatEmilim:Oral uygulanmasını takiben siproteron asetat geniş bir doz aralığında tamamen emilir. GYNELLE'in alımını takiben 1,6 saat sonra 15 ng siproteron asetat/ml'lik doruk serumkonsantrasyonuna ulaşır. Siproteron asetatın mutlak biyoyararlanımı neredeyse tamdır (dozun%88'i). GYNELLE ile ilgili rölatif siproteron asetat biyoyararlanımı sulu mikrokristalinsüspansiyonu ile karşılaştırıldığında %109'dur. Dağılım:Siproteron asetat hemen hemen tamamen serum albuminine bağlanır. Toplam serum ilaç konsantrasyonlarının sadece % 3,5-4,0'ü serbest olarak bulunur. Proteine bağlanma spesifikolmadığı için, seks hormonu bağlayıcı globulin (SHBG) seviyesindeki değişiklikler siproteronasetatın farmakokinetiğini etkilemez. 14/17Biyotransformasyon:Plazmadan siproteron asetatın toplam klerensi 3,6 ml/dak/kg olarak belirlenmiştir. Siproteron asetat hidroksilasyonlar ve konjügasyonlar da dahil olduğu çeşitli yollarla metabolize olur.İnsan plazmasındaki ana metabolit 15 B -hidroksi türevidir. Eliminasyon:Siproteron asetat serum seviyeleri 0,8 saat ve 2,3 gün yarı ömür ile karakterize, iki fazlı düşüş gösterir. Alınan dozun bir kısmı safra sıvısıyla değişmeden atılır. Büyük bölümü isemetabolitler halinde 3:7 oranında idrar ve safra yoluyla atılır. Böbrek ve safra atılımı 1,9 günyarılanma ömrü ile ilerlemektedir. Plazma metabolitleri benzer oranla (yarılanma ömrü 1,7gün) atılır. Doğrusallık / Doğrusal olmayan durum:Plazmadan (serum) terminal dispozisyon fazının uzun yarılanma ömrü ve bir tedavi döngüsünce biriken günlük alınan siproteron asetat miktarlar göze alındığında, serumda ilaçmaksimum oranları 1.ve 3. tedavi dönemlerinin sonunda sırasıyla 15 ng/ml'den, (l.gün) 21ng/ml ve 24 ng/ml'ye yükselir. Zamana karşı konsantrasyon altındaki alan profili 2,2 kat(l.döngü sonunda) ve 2,4 kat (3. döngü sonunda) artmıştır. Kararlı durum şartları 16 günsonra yakalanmıştır. Uzun dönemli tedavide, siproteron asetat tedavi döngüsü boyunca faktör2 ile birikir. EtinilestradiolEmilim:Oral uygulanan etinilestradiol hızla ve tamamen emilir. GYNELLE alımını takiben 1,7 saatte, yaklaşık 80 pg/ml olan doruk ilaç serum düzeylerine erişilir. Plazmadan terminal dispozisyonfazının yarılanma ömrüne ve günlük alım miktarı göze alınınca, kararlı haldeki plazmaseviyelerine 3-4 gün içinde ulaşılır ve tek bir doz ile kıyaslandığında %30-40 daha yüksektir.Etinilestradiolün rölatif biyoyararlanımı (referans:sulu mikrokristalin süspansiyonu) neredeyse tamdır. Etinilestradiolün sistemik biyoyararlanımı diğer ilaçlarca her iki tarafa da yönlendirilebilir. Bununla beraber C vitamininin yüksek dozlarıyla etkileşimi yoktur. Dağılım:Etinilestradiol için görünür dağılım hacmi yaklaşık 5 l/kg ve plazmadan metabolik klerens oranı yaklaşık 5 ml/dk/kg olarak tayin edilmiştir. Etinilestradiol serum albuminine yüksek oranda fakat non-spesifik olarak bağlanır. İlaç düzeyinin %2'si serbest olarak bulunur. Biyotransformasyon:Plazmadan metabolik klerens oranı yaklaşık 5 ml/dk/kg olarak belirlenmiştir. Emilim ve karaciğerden ilk geçiş esnasında etinilestradiol metabolize olur, bu da azalmış mutlak vedeğişken oral biyoyararlanıma neden olur. Eliminasyon:Etinilestradiol plazma değerleri yarılanma ömürleri 1-2 saat ve 20 saat olarak karakterize, iki fazlı düşüş gösterir. Analitik sebeplerden ötürü bu parametreler, yalnızca yüksek dozlar içinhesaplanabilir. Etinilestradiolün metabolitleri yaklaşık 1 gün yarılanma ömrüyle 4:6 oranındaidrar ve safra yoluyla atılır. 15/17Doğrusallık / Doğrusal olmayan durum:Etinilestradiol SHBG ve globulin bağlayan kortikosteroidin (CBG) karaciğerde sentezini devamlı kullanıldığı sürece indükler. Bununla birlikte, SHBG indüksiyon boyutu, birlikteuygulanan progestinin kimyasal yapısına ve dozuna bağlıdır. GYNELLE tedavisi sırasında,serumdaki SHBG konsantrasyonları yaklaşık 100 nmol/l'den 300 nmol/l'ye ve serumdakiCBG konsantrasyonları yaklaşık 50 g/ml'den 95 g/ml'ye artmıştır. 5.3. Klinik öncesi güvenlilik verileriKÜB'ün diğer ilgili bölümlerine dahil edilmemiş olan ve ilacı reçeteleyen kişi açısından önemli herhangi bir klinik öncesi veri bulunmamaktadır. 6. FARMASÖTİK ÖZELLİKLERİ6.1. Yardımcı maddelerin listesiLaktoz monohidrat (inek sütü kaynaklı) Mısır nişastası Povidon K25Talk Magnezyum stearat Sukroz Kalsiyum karbonat Titanyum dioksit (E171) Povidon K90 Polietilen glikol 6000Gliserol %85Demir oksit (E172) Montan glikol vaksı 6.2. GeçimsizliklerYoktur. 6.3. Raf ömrü36 ay. 6.4. Saklamaya yönelik özel tedbirler25 °C altındaki oda sıcaklığında saklayınız. 6.5. Ambalajın niteliği ve içeriğiPVC-Alüminyum blisterde (I ve II iklim kuşağı için) 21 kaplı tablet içeren ambalajda. 6.6. Tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller, Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğine uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİZentiva Sağlık Ürünleri San. ve Tic. A.Ş. Büyükdere Cad. No:193 Levent 34394 Şişli-İstanbulTel : (0212) 339 39 00Faks: (0212) 339 11 99 16/178. RUHSAT NUMARASI(LARI)128/41 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsatlandırma tarihi: 08.07.2009 10. KÜB'ÜN YENİLENME TARİHİ13.01.2016 17/17 |
İlaç BilgileriGynelle 2 Mg/0,035 Mg Kaplı TabletEtken Maddesi: Siproteron Asetat - Etinilestradiol Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.