Melanda 5 Mg/basiş Oral Çözelti Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIMELANDA® 5 mg/basış oral çözelti 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:Pompaya her bir basışta 0,5 ml (0,5 g)'sinde; 5 mg memantin hidroklorür (4,16 mg memantine eşdeğer) içeren çözelti akar. Memantin hidroklorür (4,16 mg memantine eşdeğer) 5 mg Yardımcı maddeler:Her bir gram çözelti, Sorbitol (E420) Solüsyon, %70 78 mg/g Yardımcı maddelerin tam listesi için 6.1'e bakınız. 3. FARMASÖTİK FORMOral çözelti Renksiz, berrak ve kokusuz çözelti 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlarıOrta ve şiddetli evre Alzheimer hastalığı tedavisinde kullanılır. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Tedavi, Alzheimer hastalığı tanı ve tedavisinde deneyimli bir hekim tarafından başlatılmalı ve kontrol edilmelidir. Tedaviye sadece, hastanın ilaç almasını düzenli olarak izleyecek birbakıcının varlığında başlanmalıdır. Tanı, güncel rehberler doğrultusunda yapılmalıdır.Memantinin tolere edilmesi ve dozlaması, tercihen tedavi başlangıcından sonraki üç ay içindedüzenli aralıklarla değerlendirilmelidir. Sonrasında, memantinin sağladığı klinik yarar vehastanın tedaviye toleransı güncel klinik rehberler doğrultusunda düzenli olarakdeğerlendirilmelidir. Terapötik fayda olumlu olduğu ve hasta memantini iyi tolere ettiğisürece, idame tedavisine devam edebilir. Terapötik etkinin artık olmadığına dair bir kanıtvarlığında veya hasta tedaviyi tolere etmiyorsa memantinin bırakılması düşünülmelidir. Yetişkinler:Doz titrasyonu adreS1ndöngf^ıeriıi*aksfffiümeiğanlükadözieğüwdeD20mmğ^iEiaiMtfenmeyen£eikF¥rskinpâza^^A^in,idame dozuna ilk üç hafta boyunca, haftada 5 mg'lik artışlarla şu şekilde ulaşılmalıdır: 1/11 1. hafta (gün 1-7): Hasta 7 gün boyunca, günde bir basışa eşit olan 0.5 ml çözelti (5 mg) almalıdır. 2. hafta (gün 8-14): Hasta 7 gün boyunca, günde iki basışa eşit olan 1.0 ml çözelti (10 mg) almalıdır. 3. hafta (gün 15-21): Hasta 7 gün boyunca günde üç basışa eşit olan 1.5 ml çözelti (15 mg) almalıdır. 4. haftadan itibaren: Hasta günde dört basışa eşit olan 2.0 ml çözelti (20 mg) almalıdır. İdame dozu: Önerilen idame dozu günde 20 mg'dır . Uygulama şekli:MELANDA® günde bir defa ve her gün aynı saatte alınmalıdır. Yemeklerle veya ayrı olarak alınabilir. Çözelti şişeden veya pompadan direkt olarak ağıza dökülmemeli vepompalanmamalıdır. Çözelti, pompa kullanılarak, bir bardak suya konularak dozlanmalıdır. Ürünün hazırlanması ve kullanımına ilişkin detaylı bilgi için bkz. 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler. Özel popülasyonlara ilişkin ek bilgiler:Böbrek yetmezliği:Hafif şiddette böbrek yetmezliği olan hastalarda (kreatinin klerensi 5080 ml/dak) doz ayarlaması gerekmez. Orta şiddette böbrek yetmezliği olan hastalarda (kreatinin klerensi 30-49 ml/dak) günlük doz 10 mg (iki basışa eşit olan 1 ml çözelti)olmalıdır. Tedavinin en az 7 günü boyunca iyi tolere edilirse, standart titrasyon programıuygulanmak koşuluyla, günlük doz, 20 mg düzeyine arttırılabilir. Ağır böbrek yetmezliğiolan hastalar (kreatinin klerensi 5-29 ml/dak) için günlük doz 10 mg (iki basışa eşit olan 1 mlçözelti) olmalıdır.Karaciğer yetmezliği:Hafif veya orta şiddette karaciğer yetmezliği olan hastalarda (Child-Pugh A ve Child-Pugh B) doz ayarlamasına gerek yoktur. Ağır karaciğer yetmezliği olan hastalarda memantin kullanımı hakkında veri bulunmamaktadır. Ağır karaciğer yetmezliğiolan hastalarda MELANDA® kullanılması önerilmez.Pediyatrik popülasyon:Memantinin çocuklar ve adolesanlar üzerindeki güvenlilik ve etkililiği saptanmamıştır. Bu nedenle 18 yaşından küçük çocuklarda kullanılması önerilmez.Geriyatrik popülasyon:4.3. KontrendikasyonlarEtkin madde veya yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olan hastalarda kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriadresindEpilepsisisbiseemişfcndtrkftnvHrsiyianyflyıküsüAaeMaoeeİiip^ye leğttmhjf^JlftgtâiatâaliRiatli olunmalıdır. 2/11 Amantadin, ketamin veya dekstrometorfan gibi NMDA-antagonistleri ile birlikte kullanımından kaçınılmalıdır. Bu bileşikler memantin ile aynı reseptör sistemine etki edip,advers etkilerin (özellikle santral sinir sistemi ile ilişkili olanlar) daha sık ya da daha kuvvetligörülmesine sebep olabilir (bkz. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşimşekilleri).İdrar pH'sını yükselten faktörler var ise (bkz. 5.2 Eliminasyon)Proteus bactericCnın neden olduğu ciddi üriner sistemenfeksiyonları ile de yükselebilir.Birçok klinik çalışmada yakın tarihte geçirilmiş miyokard enfarktüsü, kompanse edilmemiş konjestif kalp yetmezliği (New York Kalp Cemiyeti (NYHA) endeks III-IV) veya kontrolaltında olmayan hipertansiyonlu hastalar çalışma dışı bırakılmıştır. Sonuç olarak, sınırlı verimevcut olduğundan bu durumdaki hastalar yakın gözlem altında bulundurulmalıdır. Bu tıbbi ürün sorbitol içerir. Nadir kalıtımsal fruktoz intolerans problemi olan hastaların bu ilacı kullanmamaları gerekir. 4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriMemantinin farmakolojik etkileri ve etki mekanizması nedeni ile aşağıdaki etkileşmeler oluşabilir: Memantinin etki şekli sebebiyle; L-dopa, dopaminerjik agonistler ve antikolinerjiklerinetkileri, memantin gibi NMDA-antagonistleri ile birlikte kullanıldığında artabilir.Barbitüratların ve nöroleptiklerin etkilerini azaltabilir. Memantinin antispazmodik ajanlar,dantrolen veya baklofen ile birlikte kullanımı; etkilerini modifiye edebilir ve doz ayarlamasıgerektirebilir. Farmakotoksik psikoz riski nedeni ile memantinin amantadin ile birlikte kullanımındankaçınılmalıdır. Her iki madde de NMDA-antagonistidir. Aynı yaklaşım ketamin vedekstrometorfan için de geçerli olabilir (bkz. 4.4 Özel kullanım uyarıları ve önlemleri).Memantin ve fenitoinin kombine kullanımının olası riskine ilişkin yayınlanmış bir tane vakaraporu bulunmaktadır. Amantadin ile aynı renal katyonik taşıyıcı sistemini kullanan simetidin, ranitidin,prokainamid, kinidin, kinin ve nikotin de muhtemel olarak memantin ile etkileşip, plazmadüzeyinde artış riski oluşturabilir. Memantin, hidroklorotiyazid (HCT) veya HCT'li herhangi bir kombinasyon ile birliktekullanılırsa, HCT serum seviyesinde azalma muhtemeldir. Pazarlama sonrası deneyimlerde varfarin ile birlikte memantin kullanan hastalarda INR(Uluslararası normalize edilmiş oran) artışı olan izole durumlar rapor edilmiştir. Nedensel birilişki kurulmamış olsa da oral antikoagülanlarla birlikte tedavi edilen hastalar için protrombinzamanının veya INR'nin yakından izlenmesi tavsiye edilmektedir. Karbonik anhidraz inhibitörleri ve sodyum bikarbonat ile kullanımında klerens düşebilir. Sağlıklı genç gönüllülerde yürütülen tek-doz farmakokinetik çalışmalarında memantin ile adresindgTi^a^ffleskoimiffl eik°ffliinâsysonyayvey&okd°fiezfipA^iaâSâsAndam^fllaİ^Y3gtr56ilaçzfiikilftşimi
gözlenmemiştir. 3/11 Sağlıklı genç gönüllülerde yürütülen bir klinik çalışmada, memantinin galantamin farmakokinetiği üzerinde hiçbir anlamlı etkisi gözlenmemiştir. Memantin; CYP1A2, 2A6, 2C9, 2D6, 2E1, 3A, flavin içeren monoksijenaz, epoksit hidrolaz veya sülfasyonu in vitroÖzel popülasyonlara ilişkin ek bilgiler:Etkileşim çalışması yapılmamıştır. Pediyatrik popülasyon:Etkileşim çalışması yapılmamıştır. 4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi C dir. Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Veri mevcut değildir. Gebelik dönemiMemantinin gebelikte kullanımına ilişkin klinik bilgi mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik /ve-veya/embriyonal/fetal gelişim/ve-veya/doğum/ve-veya/doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir ( bkz.5.3 Klinik öncesi güvenlilik verileri)İnsanlara yönelik potansiyel riski bilinmemektedir. Memantin gerekli olmadıkça gebelik döneminde kullanılmamalıdır. Laktasyon dönemiMemantinin insan sütüne geçişine ilişkin bilgi yoktur. Ancak, maddenin lipofilitesi nedeni ile bunun olması muhtemeldir. Memantin kullanan kadınlar emzirmemelidir. Üreme yeteneği/FertiliteHayvan çalışmaları, insanlardakine eşit veya az daha yüksek maruziyet düzeylerinde rahim içi büyümede azalma oluşturduğuna işaret etmektedir (bkz. 5.3 Klinik öncesi güvenlilikverileri).4.7. Araç ve makine kullanma yeteneği üzerindeki etkilerOrta ve şiddetli Alzheimer hastalığı genellikle araba kullanma performansının veya makine kullanma yeteneğinin azalmasına neden olur. Buna ilave olarak, memantinin araba ve makinekullanma yeteneğine az veya orta derecede etkisi vardır. Bu nedenle ayaktan tedavi görenhastaların dikkati olmaları konusunda uyarılmaları gerekmektedir. 4.8. İstenmeyen etkilerBubeigeHMfyort&kVeişMdelpudemaffistaiyapÖanavenmemantinkiileuteddVi s&dügn t1784nV®nplaSebö ile adresinden l^ntrol edilebilir. GûvenlLelektronik imza aslı ile aynıdır. Dokümanın doarulama.kodu : lZmxXaklUS.HY3ZW56M0F.yZl AxZl Axtedavi edilen 1595 hastayı kapsayan klinik çalışmalarda memantin ile görülen advers olayların toplam insidans oranı plasebo ile görülenlerden farklılık göstermemiştir; advers 4/11 olaylar genellikle hafif ve orta şiddettedir. Memantin grubunda plasebo grubundan daha yüksek insidans ile en sık oluşan advers olaylar: sersemlik hali (sırasıyla %6.3-%5.6), başağrısı (%5.2-%3.9), kabızlık (%4.6-%2.6), uyuklama hali (%3.4-%2.2) ve hipertansiyon(%4.1-%2.8). Aşağıdaki tabloda listelenen advers ilaç reaksiyonları memantinin klinik çalışmalarından ve tıbbın hizmetine sunumundan itibaren toplanmıştır. Her sıklık grubunda istenmeyen etkilerciddiyetteki azalmaya göre sunulmuştur. Advers etkiler sistem-organ sınıfına göre şu esaslar kullanılarak sıralandırılmaktadır: Çok yaygın (>1/10), yaygın (>1/100 - <1/10), yaygın olmayan (>1/1,000 - <1/100), seyrek(>1/10,000 - <1/,1000), çok seyrek (<1/10,000), bilinmiyor (mevcut veriden tahminedilemeyen).
5/11 Alzheimer hastalığı, depresyon, intihar düşüncesi ve intihar ile ilişkilendirilmiştir. Pazarlama sonrası deneyimlerde memantin ile tedavi edilen hastalarda bu olaylar bildirilmiştir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. ([email protected] Doz aşımı ve tedavisiKlinik çalışmalarda veya pazarlama sonrası aşamalarda elde edilen aşırı doz ile ilgili deneyim sınırlıdır. Semptomlar:Göreceli büyük aşırı dozlar (sırası ile 3 gün süreyle günde 200 mg ve 105 mg) ya sadece yorgunluk, güçsüzlük ve/veya diyare semptomları ile ilişkilendirilmiştir ya dahiçbir semptom görülmemiştir. İlacın 140 mg'ın altında veya bilinmeyen dozda alındığı aşırıdoz vakaları, santral sinir sistemi (konfüzyon, uyuklama, uyku basması, vertigo, ajitasyon,saldırganlık, halüsinasyon ve yürüyüş bozuklukları) ve/veya gastrointestinal (kusma vediyare) kaynaklı semptomlar göstermiştir.En uç doz aşımı vakasında, hasta oral yolla toplam 2000 mg memantin alımından sonra santral sinir sistemi üzerine etkiler ile (10 gün koma ve ardından diplopi ve ajitasyon) hayattakalmıştır. Hasta semptomatik tedavi ve plazmaferez almıştır. Hasta daimi sekel kalmadaniyileşmiştir. Başka bir büyük doz aşımı vakasında da hasta yaşamış ve iyileşmiştir. Hasta oral yolla 400 mg memantin almıştır. Hasta, huzursuzluk, psikoz, görsel halusinasyonlar, prokonvulsiflik,uyuklama hali, stupor ve bilinç kaybı gibi santral sinir sistemi semptomları yaşamıştır. Tedavi:Doz aşımı durumunda, tedavi semptomatik olmalıdır. Zehirlenme veya doz aşımı için spesifik bir antidot mevcut değildir. İlaç maddesini uzaklaştırmak için standard klinikprosedürler, örn. gastrik lavaj, aktif kömür (potansiyel entero-hepatik geri dönüşündurdurulması), idrarın asitleştirilmesi, zorunlu diürez uygun olan şekilde kullanılmalıdır.Genel santral sinir sistemi aşırı uyarılmasına dair belirtiler veya semptomlar varsa, dikkatli semptomatik klinik tedavi düşünülmelidir. 5. FARMAKOLOJIK ÖZELLIKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grubu: Antidemans ilaçları ATC kodu: N06DX01 Özellikle N-metil-D-aspartat (NMDA) reseptörlerindeki glutamaterjik nörotransmisyon fonksiyon bozukluğunun hastalığın ilerlemesine kat , nörodejeneratif demansta semptomların ortaya , çıkması , ve 'arınca elektronik olarak imzalanmıştır..Doküman http://ebs.titck.gov.tr/Basvuru/Llmza/KontroladaabulundttğmaaidaiE g^tâkçeaartanakamtiar mevcuttnEyz ı axz i ax 6/11 Memantin; voltaj-bağımlı, orta afiniteli ve kompetitif olmayan bir N-metil-D-aspartat (NMDA) reseptör antagonistidir. Patolojik olarak yükselmiş, nöron işlev kaybına yolaçabilen, glutamat tonik seviyelerinin etkilerini modüle eder. Klinik çalışmalar:Orta ve şiddetli Alzheimer hastalarında (MMSE-Mini mental durum muayenesi başlangıç toplam skorları 3-14 olan) yapılan bir pivotal monoterapi çalışmasınaayaktan tedavi gören 252 hasta dahil edilmiştir. Çalışma, 6 ayda, memantin tedavisinin,plaseboya kıyasla, yararlı etkileri olduğunu göstermiştir (CIBIC-plus (Klinisyenin görüşmeyedayalı değişim izlenimi): p=0.025; ADCS-ADLsev (Alzheimer Hastalığı İşbirliği Çalışması-Günlük yaşam aktiviteleri): p=0.003; SIB-Şiddetli yıkım ölçeği p=0.002 için gözlemlenenvakaların analizi).Hafif ve orta şiddette Alzheimer hastalığı (MMSE başlangıç toplam skorları 10 - 22 olan) tedavisinde memantin pivotal monoterapi çalışmasına 403 hasta dahil edilmiştir. Memantinile tedavi edilen hastalar, plasebo ile tedavi edilen hastalara göre, şu primer sonlanmanoktaları açısından istatistiksel olarak anlamlı şekilde daha iyi etki göstermiştir: 24. haftada(LOCF-İleri taşınmış son gözlem), ADAS-cog (Alzheimer hastalığı değerlendirme ölçeği)(p=0.003) ve CIBIC-plus (p=0.004). Hafif ve orta şiddetli Alzheimer Hastalığının bir başkamonoterapi çalışmasına toplam 470 hasta (MMSE başlangıç toplam skorları 11 - 23)randomize edilmiştir. Prospektif olarak tanımlanmış primer analizde, 24. haftada primeretkinlik sonlanma noktasında istatistiksel olarak anlam taşıyan bir değere ulaşılmamıştır. Orta ve şiddetli Alzheimer hastalığı (MMSE toplam skorları <20) olan hastalarla yürütülen 6 farklı faz III, plasebo kontrollü, 6 aylık çalışmadaki (monoterapi çalışmaları veasetilkolinesteraz inhibitörlerinin stabil bir dozunu alan hastaların katıldığı çalışmalar dahil)hastaların meta-analizi, memantin tedavisinin, kognitif, global ve fonksiyonel alanlardaistatistiksel olarak anlamlı şekilde daha iyi etki oluşturduğunu göstermiştir. Hastalar bu üçalanda eşzamanlı meydana gelen kötüleşme ile tanımlandığında, sonuçlar, plasebo verilenbirçok hastada bu kötüleşmenin memantin tedavisi gören hastaların iki katı şeklinde ortayaçıkması ile, memantinin kötüye gidişi önleyici etkisinin, istatistiksel olarak anlamlı olduğunugöstermiştir (%21 ve %11, p<0.0001). 5.2 Farmakokinetik özelliklerEmilim:Memantin yaklaşık %100'lük mutlak biyoyararlanıma sahiptir. tmaks değeri 3-8 saattir. Memantin emilimi gıda alımından etkilenmez. Dağılım:Günlük olarak alınan 20 mg dozlar, 70-150 ng/ml (0.5-1 pmol) arasında kişiden kişiye büyük değişim gösteren sabit durum plazma konsantrasyonları ile sonlanmıştır. 5-30 mg'lıkgünlük dozlar alındığında, ortalama beyin omurilik sıvısı (BOS)/serum oranı 0.52 olarakhesaplanmıştır. Dağılım hacmi yaklaşık 10 l/kg'dır. Memantinin % 45'i plazma proteinlerine bağlanır. Biyotransformasyon:
!ZmxXaklUSH Y3Z W56M0FyZ 1 AxZ 1 Ax
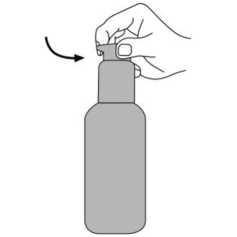
İnsanlarda dolaşımdaki memantinle ilişkili maddelerin % 80'i ana bileşik biçimindedir. BubeigeİnsanJardftkioâRanmetafeoU;tlercNieâr5fldiroetiL-;gludaffitaftkü4anvtp6-hidrfâksitrmiraa»tiaaizamerik adresindkarşimıve 1f-8İt¥OZ0e9,l^Öİmetİİ-ifedamariiaffdlPm doğrulama kodu : 7/11 Bu metabolitlerin hiçbirinin NMDA-antagonisti aktivitesi yoktur. İn vitroçalışmalarda sitokrom P450 enzimlerinin katalizlediği metabolizma tespit edilmemiştir.Oral yoldan alınan 14C-memantin ile yapılan bir çalışmada, %99'dan fazlası renal yoldan olmak üzere dozun ortalama %84'ü 20 gün içerisinde atılmıştır. Eliminasyon:Memantin terminal yarı ömrü (t/) 60-100 saattir. Monoeksponansiyel biçimde elimine olur. Normal böbrek fonksiyonuna sahip gönüllülerde, toplam klerens (Cltot) 170 ml/dak/1.73m2'dir ve toplam renal klerensin bir kısmı tübüler sekresyon ile sağlanır. Renal klerens, muhtemelen katyon nakil proteinleri vasıtasıyla, tübüler reabsorbsiyonu da içerir. Memantinin renal eliminasyon hızı alkali idrar koşullarında 7-9 faktör azaltılabilir (bkz. 4.4 Özel kullanım uyarıları ve önlemleri).İdrar alkalizasyonu, diyetteki köklü değişim(örneğin etoburluktan vejetaryen diyete geçiş gibi) veya alkalizan mide tamponlarının çokmiktarda alınması sonucu oluşabilir.Doğrusallık:Gönüllülerde yapılan çalışmalarda, 10-40 mg'lık dozlarda lineer farmakokinetik gösterdiği saptanmıştır. Farmakokinetik/farmakodinamik ilişkiler:Günde 20 mg memantin dozunda, beyin omurilik sıvısı (BOS) seviyeleri memantinin frontal kortekste 0.5 pmol olan ki değerini (ki = inhibisyon sabiti) karşılamaktadır. 5.3 Klinik öncesi güvenlilik verileriSıçanlarda yapılan kısa dönem çalışmalarında, memantin, benzeri diğer NMDA-antagonistleri gibi, sadece çok yüksek düzeyde serum konsantrasyonlarına neden olan dozlardan sonra, nöronal vakuolizasyon ve nekroz (Olney lezyonları) oluşturmuştur. Ataksive diğer preklinik işaretler, vakuolizasyon ve nekrozdan önce görülmektedir. Kemirgen vekemirgen olmayan deney hayvanlarında uzun süreli yapılan çalışmalarda bu etkilergörülmediğinden, bu bulguların klinik bağlantısı bilinmemektedir. Tekrarlanan doz toksisite çalışmalarında kemirgenlerde ve köpeklerde, oküler değişiklikler gözlemlenmiştir fakat bu durum maymunlarda görülmemiştir. Memantin ile yapılan klinikçalışmalarda, özgün oftalmoskopik incelemeler, herhangi bir oküler değişikliği ortayakoymamıştır. Lizozomlarda memantin birikimine bağlı olarak, pulmoner makrofajlardaki fosfolipidoz, kemirgenlerde gözlemlenmiştir. Bu etki, katyonik amfifilik özellikteki diğer ilaçlarla dagörülmektedir. Bu birikme ile akciğerlerde görülen vakuolizasyon arasında bir ilişki olmasıolasıdır. Etki, kemirgenlerde, sadece yüksek dozlarda görülmektedir. Bu bulguların klinikbağlantısı bilinmemektedir. Memantin ile yapılan standart deneyler sonucu, genotoksisite gözlenmemiştir. Fareler ve sıçanlarda, ömür boyu yapılan çalışmalarda, hiçbir karsinojenite bulgusuna rastlanmamıştır.Memantin, maternal toksik dozlarda dahi, sıçanlarda ve tavşanlarda teratojenik etki adresmdgösterteernişve'üffefkeö^iğe^ifkin h^çbirEaövmnet&ısaptaA,mamfşfelfıusHY3zw56M0F>'ziAxZiAx 8/11 Sıçanlarda, insanlara uygulanan düzeydeki dozlara eşdeğer veya biraz yüksek oranlarda yapılan uygulamalarda, fetal büyümenin azaldığı görülmüştür. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiSorbitol (E420) Solüsyon, %70 Potasyum sorbatSaf su 6.2 GeçimsizliklerYoktur. 6.3 Raf ömrü24 ay Şişe açıldıktan sonra 3 ay içinde tüketilmelidir. 6.4 Saklamaya yönelik özel tedbirler25 °C'nin altındaki oda sıcaklığında saklayınız. Ürün, mutlaka dikey durumda tutulmalı ve taşınmalıdır. 6.5 Ambalajın niteliği ve içeriğiKutuda 50 g ve 100 g çözelti içeren amber renkli cam şişelerde 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler yada atık materyaller 'Tıbbi atıkların kontrolü yönetmeliği' ve 'Ambalaj ve Ambalaj Atıklarının Kontrolü yönetmelikleri'ne uygun olarak imha edilmelidir. Dozlama pompası ile ilacın kullanım: Dozlama pompasının başı iki pozisyonda bulunur ve saat yönünün tersine (açık pozisyon) ve saat yönünde (kilitli pozisyon) çevirmesi kolaydır. 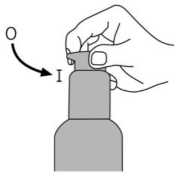 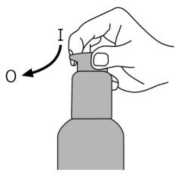 Dozlama pompasının başı kilitli pozisyonda iken aşağı bastırılmamalıdır. Çözelti sadece açık Bozi^yo1ndeiiken^^ffia^tyfittnMey,afömakaiç1^4oz|kp1omfiisıffiiftt^şkdi£ençnhi§§edilknceyekad0r°ı ©kı^nüftdeiyfeklaşıkkgekitedeRbiradönûftkajdiartçevrilmelidiK^Şeıkil 1) w56M0Fyz ı Axz i ax 9/11
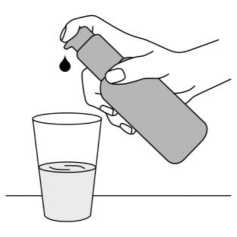
Dozlama pompası bundan sonra kullanıma hazırdır. Dozlama pompasının hazırlanması: İlk defa kullanılacağı zaman, dozlama pompası doğru miktarda çözelti vermez. Bu nedenle şişeyi hafif eğik bir şekilde tutarak, dozlama pompasının başına ardarda beş defa tam olarakbasılarak pompa hazırlanmalıdır (Şekil 2). Şekil 2.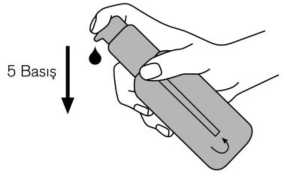 Bu şekilde alınan çözelti kullanılmadan atılır. Daha sonra dozlama pompası tamamen aşağı bastırılır, böylece doğru doz alınır (1 dozlama birimi/bir basma 0.5 mL oral çözeltiyeeşdeğerdir ve yaklaşık 5 mg memantin hidroklorür etkin maddesi içerir; Şekil 3). Şekil 3.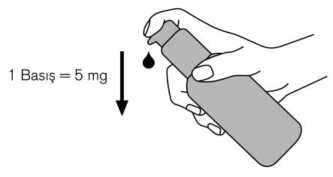 Dozlama pompasının doğru kullanımı: Sişe 45 derecelik bir açı ile elde tutularak kullanılmalıdır. Pompa ağzının altına bir miktar su içeren bir bardak elde tutularak, dozlama pompasının başı kuvvetlice ama sakin ve süreklişekilde (çok yavaş değil) sonuna kadar aşağı doğru bastırılmalıdır (Şekil 4). 10/11
Dozlama pompasının başı daha sonra serbest bırakılabilir ve bir dahaki basış için hazırdır. Dozlama pompası sadece bu ürünün şişesinde bulunan memantin hidroklorür çözeltisi ilekullanılabilir, diğer maddeler ve kaplar için uygun değildir. Eğer pompa kullanım sırasındaanlatılan şekilde çalışmaz ise, hasta doktoruna veya bir eczacıya danışmalıdır. Dozlamapompası kullanıldıktan sonra kilitlenmelidir. 7. RUHSAT SAHİBİALİ RAİF İLAÇ SANAYİ A Ş. Yeşilce Mahallesi Doğa Sokak No:434418 Kağıthane/İstanbul 8. RUHSAT NUMARASI222/40 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 18.12.2009 Ruhsat yenileme tarihi: - 10. KÜB'ÜN YENİLENME TARİHİ11/11 |
İlaç BilgileriMelanda 5 Mg/basiş Oral ÇözeltiEtken Maddesi: Memantin Hidroklorür Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
İlgili İlaçlar |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.