Pralas 2,5 Mg+0,5 Mg/ 2,5 Ml Nebülizasyon Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIPRALAS 2,5 mg+0,5 mg/ 2,5 ml nebülizasyon çözeltisi Steril 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin maddeler:2.5 ml nebülizasyon çözeltisi; 2.5 mg salbutamol'e eşdeğer 3 mg salbutamol sülfat 0,5 mg ipratropium bromür'e eşdeğer 0,52 mg ipratropium bromür monohidrat içerir. Yardımcı madde(ler):Yardımcı maddeler için, bölüm 6.1'e bakınız. 3. FARMASÖTİK FORMTek dozluk flakon / Nebülizasyon için inhalasyon solüsyonu Partikül içermeyen berrak renksiz çözelti 4. KLİNİK ÖZELLİKLER4.1 Terapötik endikasyonlarPRALAS birden fazla bronkodilatöre gerek duyulan hastalarda, obstrüktif havayolu hastalıklarına eşlik eden geri dönüşümlü bronkospazmın tedavisinde endikedir. 4.2 Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Önerilen doz şu şekildedir: Yetişkinler için (12 yaşın üstündeki çocuklar ve yaşlı hastalar dahil)Günde üç ya da dört kez 1 adet tek dozluk flakon. 12 yaşın altındaki çocuklarPRALAS'ın 12 yaş altındaki çocuklarda kullanımına ilişkin deneyim bulunmamaktadır. Uygulama: Tek dozluk birimler koruyucu içermediğinden, flakon açılır açılmaz içindeki ilaç derhal kullanılmalıdır. Mikrobiyal kontaminasyonu önlemek için her uygulamada yeni bir flakonunkullanılması önemlidir. Bir kısmı kullanılmış, açılmış ya da hasarlı tek dozluk birimleratılmalıdır. PRALAS, nebülizatörde diğer ilaçlarla kesinlikle karıştırılmamalıdır. Uygulama şekli:PRALAS sadece inhalasyon için tasarlanmıştır ve uygun bir nebülizatör veya intermitan pozitif basınçlı bir ventilatör ile uygulanabilir. Tek dozluk birimler, oral olarak alınmamalı yada parenteral olarak uygulanmamalıdır. Kullanım talimatı için bölüm 6.6'dan sonraki bölüme bakınız. Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:PRALAS karaciğer ya da böbrek yetmezliği olan hastalarda incelenmemiştir. Bu hasta popülasyonlarında dikkatle kullanılmalıdır. Pediyatrik popülasyon:On iki yaşın altındaki çocuklarda bilgilerin yetersiz olması nedeniyle, PRALAS pediyatrik hastalarda endike değildir. Geriyatrik popülasyon:PRALAS yaşlı kişilerde yukarıda verilen dozlarda kullanılabilir. 4.3 KontrendikasyonlarPRALAS hipertrofik obstrüktif kardiyomiyopatisi ya da taşiaritmisi olan hastalarda kontrendikedir. PRALAS, aynı zamanda, ipratropium bromür, salbutamol sülfat ya da atropinveya türevlerine hipersensitivite öyküsü olan hastalarda da kontrendikedir. 4.4 Özel kullanım uyarıları ve önlemleriSadece inhalasyon içindir. Aşırı duyarlılık reaksiyonları:PRALAS uygulamasından hemen sonra ani aşırı duyarlılık reaksiyonları oluşabilir. Bu reaksiyonlar, seyrek olarak ortaya çıkmış ve ürtiker, anjiyoödem, döküntüler, bronkospazm veorofarenjiyal ödem vakaları şeklinde görülmüştür. Gözle ilgili sorunlarÖlçülü doz şeklindeki aerosolde bulunan ipratropium yanlışlıkla göze sıkıldığında, seyrek olarak, oküler komplikasyonlar (midriyazis, bulanık görme, dar-açılı glokom, göz ağrısı)geliştiği bildirilmiştir. Hastalar PRALAS'ın doğru bir biçimde kullanılması için eğitilmeli ve çözeltinin ya da buharının göze kaçırılmamasına dikkat edilmesi konusunda uyarılmalıdır. Bu durum özellikleglokom eğilimi olan hastalar için önemlidir. Bu hastalar, gözlerini korumaları gerektiğikonusunda özellikle uyarılmalıdır. Göz ağrısı ya da gözde rahatsızlık hissi, bulanık görme,haleler ya da renkli görüntüler görme, konjonktival konjesyondan ve kornea ödeminden ötürüoluşan göz kızarıklığı ile birlikte seyrediyorsa, akut dar açılı glokom belirtisi olabilir. Bu 2 / 13 semptomların herhangi bir kombinasyonu gelişirse, miyotik damlalar ile tedaviye başlanmalı ve derhal bir uzman hekimin görüşü alınmalıdır. Sistemik etkiler:PRALAS aşağıdaki durumlarda, yalnızca dikkatli bir risk/yarar değerlendirilmesi yapıldıktan sonra kullanılmalıdır: - Yeterince kontrol altında olmayan diabetes mellitus, - Yakınlarda geçirilmiş miyokard enfarktüsü ve veya şiddetli organik kalp veya damarhastalıkları, - Hipertiroidizm, - Feokromositoma, - Dar açılı glokom riski, - Prostat hipertrofisi, - Mesane boynu obstrüksiyonu, Kardiyovasküler etkiler:PRALAS de dahil, sempatomimetik ilaçlarla kardiyovasküler etkiler görülebilir Pazarlama sonrası verilerde ve yayınlanmış literatürde seyrek olgular şeklinde, salbutamol ile ilişkilimiyokard iskemisi bilgileri bulunmaktadır. Solunum hastalığı için salbutamol almakta olan vealtta yatan şiddetli kalp hastalığı (örn. iskemik kalp hastalığı, taşiaritmi ya da şiddetli kalpyetmezliği) bulunan hastalar, göğüs ağrısı ya da kalp hastalığında ağırlaşmaya ilişkin başkasemptomlar ortaya çıktığında doktora başvurmaları konusunda uyarılmalıdır. Dispne ve göğüsağrısı gibi semptomlar değerlendirilirken dikkatli olunmalıdır, çünkü bunlar solunum ya dakalp kaynaklı olabilir. Hipokalemi:Beta2-agonist tedavisi, potansiyel olarak ciddi bir hipokalemi ile sonuçlanabilir. Şiddetli havayolu obstrüksiyonunda özellikle dikkatli olunması önerilmektedir, çünkü bu etki ksantintürevleri, steroidler ve diüretikler ile eşzamanlı tedavi sonucunda potansiyalize olabilir.Ayrıca hipoksi, hipokaleminin kalp ritmi üzerindeki etkilerini şiddetlendirebilir (özellikledigoksin kullanan hastalarda). Bu türlü durumlarda serum potasyum düzeylerinin izlenmesiönerilmektedir. Gastrointestinal motilite bozuklukları:Kistik fibrozlu hastalar, gastrointestinal motilite bozukluklarına daha yatkın olabilirler. Solunum sistemi ile ilgili sorunlar (dispne):Hastalar, akut, hızla kötüleşen dispne (solunum zorluğu) durumunda derhal bir doktora başvurmaları gerektiği konusunda uyarılmalıdır. Hastalar ayrıca, alınan yanıtta azalmabelirgin hale geldiğinde doktora başvurmaları gerektiği konusunda da uyarılmalıdır. Diğer inhalasyon tedavilerinde olduğu gibi, paradoksal bronkospazm ortaya çıkabilir ve dozdan hemen sonra hırıltılı solunum ve nefes darlığında artış ile seyredebilir. Paradoksal 3 / 13 bronkospazm hızlı etkili bir inhale bronkodilatöre yanıt verir ve hızla tedavi edilmelidir. Bu durumda, PRALAS kullanımına derhal son verilmeli, hasta değerlendirilmeli ve eğergerekiyorsa, alternatif tedavi uygulanmalıdır. Doping testi:PRALAS kullanımı, klinik dışı madde suistimali için yapılan testlerde (örneğin, atletik performansın yükseltilmesi (doping)), salbutamol nedeniyle pozitif sonuçlara yol açabilir. Laktik asidoz:İntravenöz ve nebülize kısa etkili beta agonistlerin özellikle şiddetli astım veya kronik obstrüktif akciğer hastalığındaki bronkospazmın akut alevlenmesinin tedavisinde yüksekterapötik dozda kullanımına bağlı olarak laktik asidoz bildirilmiştir (bkz bölüm 4.8 ve 4.9). Laktat seviyelerinde artış dispne ve kompensatuvar hiperventilasyona neden olabilir. Bu da astım tedavisinde bir başarısızlık şeklinde yanlış yorumlanabilir ve gerekli olmayan kısa etkilibeta-agonist tedavisi uygulamasına neden olabilir. Bu nedenle hastalar serum laktatseviyelerinde artış ve buna bağlı metabolik asidoz gelişimi açısından takip edilmelidir. 4.5 Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleriPRALAS'ın diğer antikolinerjik ilaçlarla birlikte, kronik kullanımı çalışılmamıştır. Bu nedenle, PRALAS'ın diğer antikolinerjik ilaçlarla birlikte kullanılması önerilmez. Ek olarak verilen beta-agonistlerin, ksantin türevlerinin ve kortikosteroidlerin kullanımı PRALAS'ın etkisini arttırabilir. Diğer beta-mimetiklerin, sistemik olarak absorbe olanantikolinerjikler ve ksantin türevlerinin birlikte kullanımı, yan etkilerin şiddetini arttırabilir.Beta-blokörlerle birlikte kullanımı sırasında, etkide potansiyel olarak ciddi bir azalmagörülebilir. Monoamin oksidaz inhibitörleri veya trisiklik antidepresanlar ile tedavi edilmekte olan hastalarda beta2-adrenerjik agonistler dikkatle uygulanmalıdır, çünkü beta2-adrenerjikagonistlerin etkileri artabilir. Halotan, trikloroetilen ve enfluran gibi halojenli hidrokarbon anestetiklerinin inhalasyonu beta-agonistlerin kardiyovasküler etkilerine karşı duyarlılığı artırabilir. Özel popülasyonlara ilişkin ek bilgiler:Özel veri bulunmamaktadır. Pediyatrik popülasyon:Özel veri bulunmamaktadır. 4.6 Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C 4 / 13 Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlar, tedavi süresince tıbben etkili olduğu kabul edilen doğum kontrol yöntemleri kullanmalıdır. Gebelik dönemiİpratropium bromür ve salbutamolün gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlarda yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir(bkz. Kısım 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Laktasyon dönemiPRALAS, beklenen yararları, yenidoğan üzerindeki risklere üstün gelmediği sürece emziren annelerde kullanılmamalıdır. Üreme yeteneği/FertiliteSalbutamol ve ipratropium bromür kombinasyonu ile insan fertilitesi üzerindeki etkisi konusunda çalışma yürütülmemiştir. İpratropium bromür ve salbutamol ile yapılan kliniköncesi çalışmalarda fertilite üzerinde advers etki görülmemiştir (bkz. Bölüm 5.3). 4.7 Araç ve makine kullanımı üzerindeki etkilerAraba ve makine kullanma becerileri üzerindeki etkileri konusunda çalışma yapılmamıştır. Ancak hastalar, PRALAS tedavisi sırasında baş dönmesi, akomodasyon bozukluğu, midriyazis ve bulanık görme gibi istenmeyen etkiler geçirebilecekleri konusundauyarılmalıdır. Eğer hastalarda yukarıda sözü edilen yan etkiler ortaya çıkarsa, araba kullanma ya da makine işletme gibi tehlike potansiyeli taşıyan işlerden uzak durmalıdırlar. 4.8 İstenmeyen etkilerListelenen istenmeyen etkilerin birçoğu PRALAS'ın antikolinerjik ve beta2- sempatomimetik özelliklerine bağlanabilir. İnhalasyon yoluyla uygulanan bütün ilaçlar gibi, PRALAS lokalirritasyon semptomlarına yol açabilir. Advers ilaç reaksiyonları, klinik araştırmalarda veilacın onayı sonrası kullanım dönemindeki farmakovijilans çalışmalarında elde edilenverilerden tanımlanmıştır. Klinik araştırmalarda en sık bildirilen yan etkiler baş ağrısı, boğazda irritasyon, öksürük, ağız kuruluğu, gastrointestinal motilite bozuklukları (konstipasyon, diyare ve kusma dahil), bulantıve baş dönmesi olmuştur. 3488 hastayı kapsayan klinik araştırmalarda aşağıda belirtilen istenmeyen etkiler bildirilmiştir. 5 / 13 SıklıklarÇok yaygınYaygınYaygın olmayan SeyrekÇok seyrekBilinmiyor >1/100 ilâ <1/10 >1/1.000 ilâ <1/100>1/10.000 ilâ <1/1.000<1/10.000 Eldeki verilerden hareketle tahmin edilemiyor. Bağışıklık sistemi hastalıklarıSeyrek: Anaflaktik reaksiyon, aşırı duyarlılık, dil, dudaklar ve yüzde anjiyoödem Metabolizma ve beslenme hastalıklarıSeyrek: Hipokalemi Bilinmiyor: Laktik asidoz (bkz. Bölüm 4.4) Psikiyatrik hastalıklarYaygın olmayan: Sinirlilik Seyrek: Mental bozukluk Sinir sistemi hastalıklarıYaygın olmayan: Baş dönmesi, baş ağrısı, tremor Göz hastalıklarıSeyrek: Akomodasyon bozukluğu, kornea ödemi, glokom,1 göz ağrısı,1 göz içi basıncında artış,1 midriyazis,1 bulanık görme, konjonktivada hiperemi, haleler görme Kardiyak hastalıklarYaygın olmayan: Palpitasyonlar, taşikardi Seyrek: Aritmi, atriyal fibrilasyon, miyokard iskemisi, supraventriküler taşikardi Solunum, göğüs bozuklukları ve mediyastinal hastalıklarYaygın olmayan: Öksürük, disfoni, boğazda irritasyon Seyrek: Bronkospazm, paradoksalbronkospazm, boğaz kuruluğu, laringospazm, farenjiyal ödem Gastrointestinal hastalıklarYaygın olmayan: Ağız kuruluğu, bulantı Seyrek: Gastrointestinal motilite bozukluğu (örneğin, diyare, konstipasyon, kusma), ağızda ödem, stomatit 6 / 13 Deri ve derialtı dokusu hastalıklarıYaygın olmayan: Deri reaksiyonları Seyrek: Hiperhidroz, döküntü, ürtiker, pirürit Kas-iskelet bozuklukları ve bağ doku ve kemik hastalıklarıSeyrek: Kas spazmları, kaslarda zayıflık, miyalji Böbrek ve idrar yolu hastalıkları. oSeyrek: idrar retansiyonu Genel bozukluklar ve uygulama yerine ilişkin hastalıklarSeyrek: Asteni AraştırmalarYaygın olmayan: Sistolik kan basıncında yükselme Seyrek: Diyastolik kan basıncında düşme 1 Oküler komplikasyonlar aerosol şeklindeki ipratropium bromür tek başına veya bir adrenerjik beta2-agonist ile birlikte göze kaçtığında bildirilmiştir (bkz. bölüm 4.4). 2İnhalasyon yoluyla kullanılan diğer ilaçlarda olduğu gibi, dozun uygulamasından hemen sonra hırıltılı solumada ani artış ve soluk darlığıyla kendisini gösteren paradoksalbronkospazm oluşabilir. Paradoksal bronkospazm hızlı etkili bir inhale bronkodilatöre yanıtverir ve derhal tedavi edilmelidir. PRALAS'a hemen son verilmeli, hasta değerlendirilmeli vegerekiyorsa alternatif tedavi uygulanmalıdır. o .idrar retansiyonu riski, üriner çıkış obstrüksiyonu mevcut bulunan hastalarda artabilir. Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr[email protected];4.9 Doz aşımı ve tedavisiSemptomlaripratropium bromürün doz aşımının akut etkileri, hafif ve geçicidir (ağız kuruluğu, görsel akomodasyon bozuklukları gibi), çünkü inhalasyonla veya oral uygulama sonrası sistemikabsorpsiyonu düşüktür. Bu nedenle, doz aşımından kaynaklanan etkiler muhtemelensalbutamol ile bağıntılı olmalıdır. Salbutamol ile meydana gelen doz aşımının belirtileri arasında şunlar bulunur: taşikardi, palpitasyon, tremor, hipertansiyon, hipokalemi, hipotansiyon, nabız basıncının genişlemesi,aritmiler, anjinal ağrı ve yüz kızarması (flushing). Salbutamol doz aşımı ile metabolik asidozda bildirilmiştir. 7 / 13 Salbutamol doz aşımında tercih edilen antidot, bir kardiyoselektif beta-blokör ajandır. Ancak, bronkospazm öyküsü olan hastalarda bu tür ilaçlar kullanılırken dikkatli olunmalıdır. Kısa etkili beta-agonist tedavisinin yüksek tedavi dozuyla ve doz aşımı ile ilişkili olarak bildirilen laktik asidozun dahil olduğu metabolik asidoz da salbutamolün doz aşımıylagözlenmiştir. Bu nedenle, doz aşımı halinde (özellikle de hırıltılı solunum gibi diğerbronkospazm bulgularının düzelmesine rağmen devam eden ya da kötüleşen taşipne varsa)yükselmiş serum laktat düzeylerinin ve buna bağlı olarak gelişebilecek metabolik asidozuntakibi gerekebilir. 5. FARMAKOLOJİK ÖZELLİKLER5.1 Farmakodinamik özelliklerFarmakoterapötik grup: Adrenerjikler ve diğer obstrüktif havayolu hastalıkları ilaçları ATC kodu: R03AK04 İpratropium bromür, antikolinerjik (parasempatolitik) özellikler taşır. Klinik öncesi çalışmalarda, vagus sinirinden salıverilen nörotransmitter olan asetilkolinin etkileriniantagonize ederek, bu sinir aracılığıyla gerçekleşen refleksleri inhibe etmiştir. İpratropium bromür inhalasyonunu izleyen bronkodilatasyon, esas olarak lokal ve akciğere özgüdür ve sistemik bir etki değildir. Salbutamol, hava yollarındaki düz kaslara etki ederek, gevşemelerine yol açan bir beta2-adrenerjik ajandır. Salbutamol, trakeadan terminal bronşiyollere kadar olan bütün düz kasları gevşetir ve bronkokonstriksiyona yol açan tüm etkilere karşı korunma sağlar. PRALAS, ipratropium bromür ile salbutamol sülfatın eşzamanlı olarak salıverilmesi sonucu akciğerdeki muskarinik ve beta2-adrenerjik reseptörlerin her ikisi üzerinden etki oluşturur vesonuç olarak her bir ajan ile elde edilenden daha üstün bir bronkodilatasyon elde edilmesinisağlar. 5.2 Farmakokinetik özelliklerGenel özelliklerİpratropiumEmilim:Yaklaşık %3-4 olan kümülatif ekskresyon değerine göre (CRE0-24 saat) ipratropium bromürün inhale edilen dozlarının total sistemik biyoyararlanımı %7-9 olarak tahmin edilmektedir. Dağılım:İpratropium bromürün dispozisyonunu tanımlayan kinetik parametreler, iv uygulamadan sonraki plazma konsantrasyonlarından hesaplanmıştır. Plazmada hızlı bir bifazik azalmagözlenmiştir. 8 / 13 Kararlı durumda görünür dağılım hacmi (Vdss) yaklaşık 176 L (~2,4 L/kg)'dır. İlaç, plazma proteinlerine minimal olarak bağlanır (%20'den daha az). Diğer kuaterner amonyumbileşiklerinde olduğu gibi, ipratropium bromür de kan-beyin bariyerini geçemez. Biyotransformasyon:İpratropiumun total klerensi 2,3 L/dk ve renal klerensi de 0,9 L/dk'dır. İnhalasyonla uygulandıktan sonra dozun yaklaşık %87-89'u, muhtemelen asıl olarak karaciğerdeoksidasyon yoluyla metabolize olur. Eliminasyon:İnhalasyonla uygulandıktan sonra ilaçla ilgili radyoaktivitenin %3,2'si (yani ana bileşen ve metabolitleri) idrarla elimine edilir. Bu uygulama yolu için toplam radyoaktivitenin atılımıfeçesle olmuştur. İnhalasyonu takiben ilaçla ilgili radyoaktivitenin eliminasyon yarı ömrü 3,2saattir. Başlıca üriner metabolitleri muskarinik reseptörlere zayıf olarak bağlanır ve etkisizolarak değerlendirilmiştir. Doğrusallık/Doğrusal olmayan durum:Özel veri bulunmamaktadır. SalbutamolEmilim:Salbutamol, gerek inhalasyon gerekse gastrik yolla olan oral uygulamayı takiben hızla ve tamamen absorbe olur ve yaklaşık %50'lik oral biyoyararlanıma sahiptir. 492 pg/ml olanortalama doruk salbutamol konsantrasyonuna, PRALAS inhalasyonundan sonra 3 saat içindeulaşılır. Dağılım:Kinetik parametreler iv uygulamadan sonra plazma konsantrasyonlarından hesaplanmıştır. Görünür dağılım hacmi (Vz) yaklaşık 156 L (~2,5 L/kg)'dir. İlacın sadece %8'i plazmaproteinlerine bağlanır. Salbutamol kan-beyin bariyerini geçerek plazma konsantrasyonlarınınyaklaşık %5'i kadar bir konsantrasyona ulaşır. Biyotransformasyon ve eliminasyon:Tek doz inhalasyon uygulamasını takiben, ağızlıkla alınan tahmini dozun yaklaşık %27'si, 24 saat içinde değişmeden idrarla atılır. Ortalama terminal yarı ömrü yaklaşık 4 saat ve ortalamatotal klerensi 480 ml/dk'dır. Ortalama renal klerensi ise, 291 ml/dk'dır. Salbutamol konjugasyonla salbutamol 4'-O-sülfata metabolize olur. Salbutamolün R(-)-enantiyomeri (levosalbutamol) tercihli olarak metabolize olur ve bu nedenle S(+)-enantiyomerinden daha hızlı biçimde vücuttan temizlenir. İntravenöz uygulamayı takiben üriner atılımı yaklaşık 24 saat sonra tamamlanır. Atılan dozun büyük kısmı ana bileşiktir(64,2) ve %12'si sülfat konjugatı olarak atılır. Oral uygulamadan sonra değişime uğramamışilaç ve sülfat konjugatın idrarla atılan miktarları sırasıyla dozun %31,8'i ve %48,2'sidir. 9 / 13 Doğrusallık/Doğrusal olmayan durum:Özel veri bulunmamaktadır.İpratropium bromür ve salbutamol sülfat kombinasyonunun absorpsiyon özellikleri:5.3 Klinik öncesi güvenlilik verileriİpratropium bromür ve salbutamol sülfatın tek inhalasyon şeklinde uygulama sonrasındaki akut toksisitesi, sıçanlarda ve köpeklerde incelenmiştir. Teknik olarak incelenmesi mümkünen yüksek dozlara kadar (sıçan: 887/5397 mikrogram/kg vücut ağırlığı [ipratropiumbromür/salbutamol], köpek:165/862 mikrogram/kg vücut ağırlığı [ipratropium bromür/salbutamol]) sistemik toksik etki belirtisi bulunmamaktaydı ve bileşik lokal olarak iyi tolere edildi. Tekil maddeler için intravenöz uygulama sonrasında yaklaşık LD50değerlerinin, ipratropium bromürün test edildiği türlere bağlı olarak (fare, sıçan, köpek),ipratropium bromür için 12 ile 20 mg/kg ve salbutamol için 60 ile 70 mg/kg vücut ağırlığıarasında olduğu hesaplanmıştır. İpratropium bromür ve salbutamol kombinasyonu ile sırasıyla sıçanlar ve köpeklerde, 13 haftalık iki inhalasyon toksisitesi çalışması yürütülmüştür. Bu çalışmalarda, kalbin hedeforgan olduğu ortaya çıkmıştır. 31,3/183,4 ile 375,5/2188,4 mikrogram/kg vücut ağırlığı/günipratropium bromür/salbutamol dozlarında, sıçanların kalp ağırlıklarında doza bağlı olmayanbir artış gözlendi, ancak bu saptanabilir herhangi bir histopatolojik değişiklik ile birliktedeğildi. Köpeklerde 32,3/197,6 ile 129,2/790,4 mikrogram/kg vücut ağırlığı/gün ipratropiumbromür/salbutamol dozları, kalp hızlarını hafifçe artırdı ve daha yüksek dozlarda, sol ventrikülpapiller kaslarında, bazen mineralizasyonun eşlik ettiği, histopatolojik olarak saptanabilirsikatrisler ve/veya fibrozis gözlendi. Yukarıda sözü edilen çalışmalarda elde edilen bulgular, salbutamol gibi beta-adrenerjiklerin iyi bilinen etkileri olarak görülmelidir. Aynı zamanda ikinci bileşenin (ipratropium bromür) toksikolojik profili de yıllardır iyi bilinmektedir ve kafada bulunan mukozal membranlarda kuruluk, midriyazis, yalnızcaköpeklerde keratokonjonktivitis sikka (kuru göz), tonüs azalması ve gastrointestinal kanaldamotilitenin inhibisyonu (sıçan) gibi tipik antikolinerjik etkilerdir. İpratropium bromür ve salbutamol kombinasyonunun iki tekil bileşeni için de üreme toksisitesi çalışmaları mevcuttur. Salbutamol farelerde yüksek dozlarda yarık damaklaraneden olmuştu. Bu olay iyi bilinmektedir ve diğer beta-adrenerjik bileşiklerinuygulanmasından sonra da ortaya çıkmaktadır. Günümüzde bu etkinin annedeki kortikosterondüzeyindeki bir artış sebebiyle ortaya çıktığı varsayılmaktadır ve başka türler için önemtaşımayan bir genel stresin sonucu olduğu kabul edilebilir. Ek olarak, salbutamolünteratojenik özelliklere sahip olabileceği yönündeki kuşkuların oluşmasına yol açan preklinik 10 / 13 bulgular, kadınlardaki kullanımını ilgilendiren kısıtlamalarda dikkate alınmış bulunmaktadır. Bu bulguların dışında, salbutamol ve ipratropium bromür ile yapılan çalışmalar, embriyo,fetüs ve yavrularda varsa bile, yalnızca marjinal etkiler ortaya çıkarmıştır ve bu etkileryalnızca maternal toksisite aralığı içinde oluşmuştur. Her iki tekil madde de çok sayıda in-vivo ve in-vitro testlerde incelenmiştir. Ne salbutamol ne de ipratropium bromür, herhangi bir mutajenik özellik belirtisi göstermemiştir. Salbutamol ve ipratropium bromür ayrı ayrı, çeşitli in vivo karsinojenisite çalışmalarında neoplastik özellikleri yönleriyle incelenmişlerdir. Farelerde, ama sıçanlarda ve köpeklerdedeğil, oral salbutamol uygulamasından sonra, insanlarda kullanılan inhalasyon dozlarının 100katından daha yüksek dozlarda, mezovaryum leiomyoması insidansında artış gözlenmiştir.Leiomyoma gelişiminin eş-zamanlı beta-blokör uygulamasıyla engellenebilir özellikte olduğubulunmuştur. Bu bulguların türe özgü olduğu ve klinik önem taşımadıkları ve sonuç olaraksalbutamolün klinik kullanımında herhangi bir kısıtlamaya yol açmayacakları şeklindedeğerlendirme yapılmıştır. İpratropium bromür farelerde ve sıçanlarda oral yoldan verildiğinde, karsinojenik potansiyel ortaya çıkmamıştır. İpratropium bromür ve salbutamol kombinasyonu ya da tekil aktif bileşenlerinin sebep olduğu herhangi bir immünotoksikolojik etkiye ilişkin herhangi bir veri bulunmamıştır. 6. FARMASÖTİK ÖZELLİKLER6.1 Yardımcı maddelerin listesiSodyum klorür Hidroklorik asitEnjeksiyonluk su 6.2 GeçimsizliklerYoktur. 6.3 Raf ömrü24 ay 6.4 Saklamaya yönelik özel tedbirler25oC altındaki oda sıcaklığında saklayınız. Direk güneş ışığından korunmalıdır. Çözeltinin renginde değişiklik varsa kullanılmamalıdır. 6.5 Ambalajın niteliği ve içeriği2.5 ml transparan düşük yoğunluklu polietilen tek-doz flakonlar ve saşe. Bir kutu içinde 2adet saşe ve her saşede 10 adet tek-doz flakon içerecek şekilde kullanıma sunulmaktadır. 11 / 13 6.6 Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerÖzel bir gereklilik yoktur. Kullanılmamış olan ürün ya da atık materyaller, Tıbbi Atıkların Kontrolü ve Ambalaj ve Ambalaj Atıklarının Kontrolü yönetmeliklerine uygun olarak imha edilmelidir. Kullanım TalimatıTek dozluk flakonlar yalnızca, uygun nebülizatör cihazları ile inhalasyon seklinde kullanılmak içindir ve oral yoldan alınmamalı ya da parenteral yoldan uygulanmamalıdır. 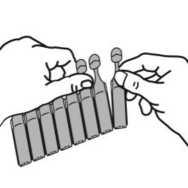 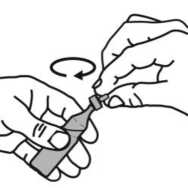 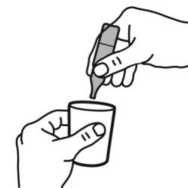 1. Nebülizatörü, imalatçısının ya da hekimintalimatları doğrultusunda kullanımahazırlayınız. 2. Tek dozluk bir flakonu şeritten koparınız. 3. Tek dozluk flakonu, uç kısmını sertçe bükerekaçınız. 4. Tek dozluk flakonun içeriğini, nebülizatörünrezervuarına (depo kısmına) sıkarak boşaltınız. 5. Nebülizatörün parçalarını birleştirip, önerildiğişekilde inhale ediniz. 6. Kullandıktan sonra, rezervuarda kalmışolabilecek solüsyonu atınız ve nebülizatörü,imalatçısının talimatları doğrultusundatemizleyiniz. Tek dozluk flakonlar koruyucu madde içermediğinden, mikroplarla bulaşmayı önlemek amacıyla, flakonun açıldıktan hemen sonra kullanılması ve her uygulamada yeni bir flakonunaçılması önem taşımaktadır. Kısmen kullanılmış, açılmış veya hasar görmüş tek dozlukflakonlar atılmalıdır. PRALAS 2,5 mg+0,5 mg nebülizasyon çözeltisi'nin, aynı nebülizatör içinde diğer ilaçlarla karıştırılmaması özellikle önerilmektedir. 7. RUHSAT SAHİBİDeva Holding A.Ş. Halkalı Merkez Mah. Basın Ekspres Cad. No:1 34303 Küçükçekmece/İSTANBUL Tel:0212 692 92 92 Faks: 0212 697 00 24 12 / 13 8. RUHSAT NUMARASI(LARI)2017/373 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİİlk ruhsat tarihi: 06.06.2017 Ruhsat yenileme tarihi: 10. KÜB'ÜN YENİLENME TARİHİ13 / 13 |
İlaç BilgileriPralas 2,5 Mg+0,5 Mg/ 2,5 Ml NebülizasyonEtken Maddesi: Salbutamol-ipatropium Kullanma talimatı ve kısa ürün bilgileri
Google Reklamları
|
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.