Ventofor İnhaler Kapsül Kısa Ürün BilgisiKISA ÜRÜN BİLGİSİ1. BEŞERİ TIBBİ ÜRÜNÜN ADIVENTOFOR 12 mcg inhaler kapsül 2. KALİTATİF VE KANTİTATİF BİLEŞİMEtkin madde:12 mcg formoterol fumarata eşdeğer 12.5 mcg formoterol fumarat dihidrat Yardımcı maddeler:Yardımcı maddeler için 6.1'e bakınız. 3. FARMASÖTİK FORMİnhalasyon tozu içeren sert kapsüller Renksiz, doğal, transparan, beyaz toz içeren 3 numaralı kapsüller. 4. KLİNİK ÖZELLİKLER4.1. Terapötik endikasyonlar: Astım semptomlarının düzeltilmesi ve kontrol altına alınması amacıyla bir inhalekortikosteroid ile birlikte kullanılır. Astım hastalığının basamaklı tedavisinde 3. basamaktanitibaren (inhaler steroidlerle kontrol altına alınamayan astımlı hastalarda) kullanılır. Orta ve ağır amfizem ve kronik bronşit olgularında uzun etkili P2 agonistler, hemsemptomları kontrol altına almada hem de yaşam kalitesini düzeltmede ve alevlenme sıklığınıazaltmada etkilidir. İnhale alerjenler, soğuk hava ya da egzersizle indüklenen bronkospazm profilaksisi. 4.2. Pozoloji ve uygulama şekliPozoloji/uygulama sıklığı ve süresi:Astım:Yetişkinler: VENTOFOR'un etkin maddesi formoterolün de dahil olduğu uzun etkili beta 2 agonist sınıfı ilaçlar, astımlı hastalarda, yalnızca düzenli ve yeterli dozda inhale kortikosteroid alan hastalardabu tedaviye ek olarak kullanılır. VENTOFOR dozu, hastanın kişisel ihtiyacına göre ayarlanmalıve terapötik amaca ulaşılmasını sağlayan en düşük dozda uygulanmalıdır. Doz, önerilenmaksimum dozu aşacak şekilde artırılmamalıdır. İnhalasyondan 12 saat sonra VENTOFOR, hala önemli derecede bronkodilatör etki gösterdiğinden, çoğu olguda günde iki defa uygulama şeklindeki idame tedavisi, kronikdurumlarla ilişkili gündüz ve gece görülen bronkokonstriksiyonu kontrol altına alır. Düzenli idame tedavisi için, günde iki defa 1 inhaler kapsül (12 mikrogram formoterole eşdeğer) kullanılması önerilir. Daha ciddi vakalarda günde 2 kez 2 inhaler kapsül verilir. Önerilen enyüksek idame dozu günde 48 mikrogramdır. 1/16 Gerekirse belirtilerin hafifletilmesi için önerilen en yüksek günlük doz olan 48 mikrogramı aşmamak kaydıyla her gün 1-2 ilave kapsül kullanılabilir. Ancak haftada iki günden fazla ilavedozlara ihtiyaç olduğu takdirde doktora danışılmalı ve tedavi yeniden değerlendirilmelidir, çünkübu durum hastalığın ağırlaştığının belirtisi olabilir. VENTOFOR, astım ataklarının akutsemptomlarını hafifletmek için kullanılmamalıdır. Akut atak durumunda, kısa etkili bir beta2-agonist kullanılmalıdır (bkz. Bölüm 4.4). Çocuklar (5 yaş ve üzeri): VENTOFOR sadece inhale bir kortikosteroide ilave olarak reçete edilmeli ve kullanılmalıdır. Düzenli idame tedavisi için, günde iki defa 1 inhaler kapsül (12 mikrogram) kullanılmasıönerilir. İnhale kortikosteroid ile uzun etkili beta2 agonistin ayrı kullanılmasının gerekli olduğu durumlar dışında 5-12 yaş arası çocuklarda, inhale kortikosteroid ile uzun etkili beta2 agonist (LABA)içeren bir kombinasyon preparatla tedavi uygulanması tavsiye edilir (bkz. Bölüm 4.4. ve 4.8). Önerilen en yüksek doz günde 24 mikrogramdır. VENTOFOR, bir astım atağının akut semptomlarını hafifletmek için kullanılmamalıdır. Akut atak durumunda, kısa etkili bir beta2-agonist kullanılmalıdır (bkz. Bölüm 4.4). VENTOFOR, 5 yaşın altındaki çocuklarda önerilmez. Egzersizin neden olduğu bronkospazma karşı veya bilinen kaçınılamaz bir allerjen ile temastan önce profilaksi:Yetişkinler: Egzersizden veya allerjenle temastan en az 15 dakika önce 1 inhaler kapsül (12 mikrogram) inhale edilmelidir. Ciddi bronkospazm öyküsü olan hastalarda profilaktik olarak 2 inhaler kapsül(24 mikrogram) gerekli olabilir. Persistan astımı olan hastalarda, egzersizin neden olduğu bronkospazma karşı ya da bilinen kaçınılamaz bir allerjen ile temastan önce VENTOFOR'un kullanılması klinik açıdan endikeolabilir. Ancak astım tedavisi bir inhale kortikosterid de içermelidir. Çocuklar (5 yaş ve üzeri): Egzersizden veya allerjenlerle temastan en az 15 dakika önce 1 inhaler kapsül (12 mikrogram) inhale edilmelidir. VENTOFOR, sadece bir inhale kortikosteroide ek olarak kullanılmalıdır. Persistan astımı olan hastalarda, egzersizin neden olduğu bronkospazma karşı ya da bilinen kaçınılamaz bir allerjen ile temastan önce VENTOFOR'un kullanılması klinik açıdan endikeolabilir. Ancak astım tedavisi bir inhale kortikosterid de içermelidir. Amfızem ve kronik bronşit hastalığı :Düzenli idame tedavisi için, günde iki defa 1 inhaler kapsül (12 mikrogram) kullanılması önerilir. Çocuklar (5 yaş ve üzeri): Uygun değildir. 2/16 Uygulama şekli:Yetişkinlerde ve 5 yaş ve üzerindeki çocuklarda inhalasyonla kullanılır. VENTOFOR inhalasyon tozu kapsülleri, yalnızca VENTOFOR ambalajındaki inhalasyon cihazıyla kullanılmalıdır. İlacın uygun kullanımından emin olmak için doktor veya bir başka sağlık personeli: hastaya inhalasyon cihazının nasıl kullanacağını göstermelidir, kapsüllerin sadece inhalasyon cihazı aracılığıyla inhalasyon yolu ile uygulanması gerektiğive yutulmaması konusunda hastayı uyarmalıdır. Kullanıma ilişkin detaylı bilgi kullanma talimatında mevcuttur. Jelatin kapsülün parçalanabileceğini ve küçük jelatin parçalarının inhalasyondan sonra ağız veya boğaz bölgesine ulaşabileceğini hastaların bilmesi önemlidir. Hastaya jelatininzararsız olduğu, ağızda yumuşayacağı ve yutulabildiği söylenmelidir. Kapsülü bir defadanfazla delmemek suretiyle parçalanma olasılığı asgari düzeye indirilebilir.Kapsüller blister ambalajından kullanımdan hemen önceçıkarılmalıdır.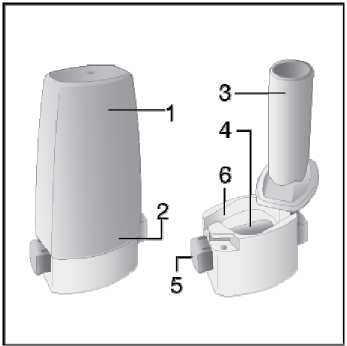 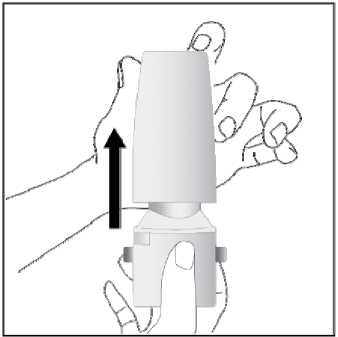 İnhalasyon cihazı aşağıdaki bölümlerden oluşmaktadır: 1. Ağızlığı koruyan kapak 2. İlacın kapsülden düzgün olarak salınmasınısağlayan bir taban. Taban kısmı aşağıdaki kısımlardan oluşur. 3. Ağızlık 4. Kapsül bölmesi 5. Kapsül bölmesinin iki yanında basıldığındaçıkan iğneler aracılığıyla kapsülleri delmeyeyarayan düğmeler (kulakçıkları) 6. Hava geçiş kanalı_1. Kapağı çekip çıkarınız 2.Kapsül bölmesini açınız. İnhalerin tabanını sıkıca tutup, açmak için3/16 ağızlığı üzerinde yer alan ok işareti yönünde döndürünüz. 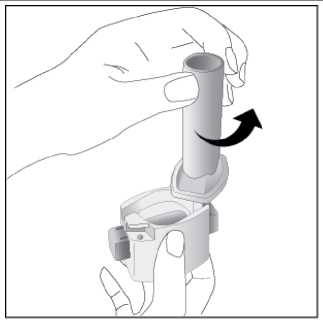 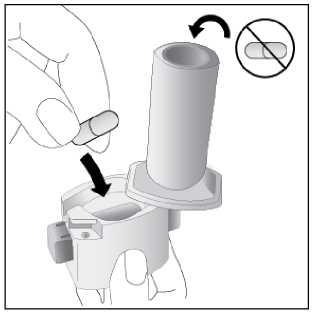 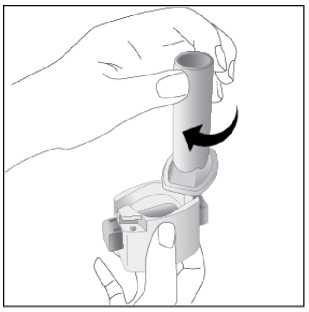 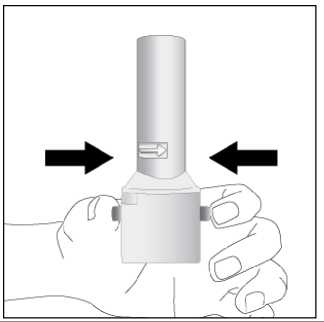 3.Parmaklanmzm tamamen kuru olduğundan emin olunuz. Blisterden bir kapsül çıkarınız ve bu kapsülü cihazın tabanındaki kapsül bölmesine yatıkolarak yerleştiriniz. Kapsülü, kullanmadanhemen önce blisterden çıkarmanız önemlidir. ÖNEMLİ: Kapsülü ağızlığın içerisineyerleştirmeyiniz!4.Tık sesini duyana kadar ağızlığı döndürerek kapsül bölmesini kapayınız. 5. Tozu kapsülden serbestlemek için: Cihazı ağızlık yukarı doğru bakacak şekildedik olarak tutunuz. Kenarlardaki iki kulakçığa (düğmelere) aynıandasadece bir kezsıkıca basarakkapsülü deliniz.Not:için zararlı değildir._4/16 6. Nefesinizi dışarıya olabildiğince veriniz. 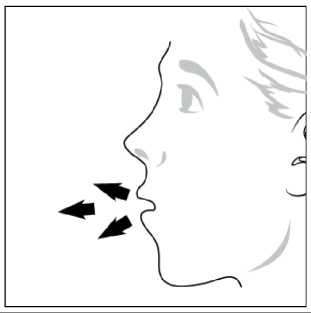 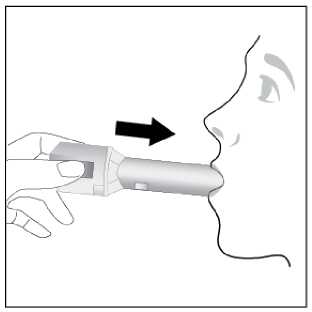  7. İlacı derin bir şekilde hava yollarınıza çekmek için: Ağızlığı ağzınıza yerleştiriniz ve başınızıhafifçe geriye doğru eğiniz. Dudaklarınızla ağızlığın etrafını sıkıcasarınız. Hızlı, duraksamadan ve alabildiğiniz kadarderin bir nefes alınız. Not:Kapsülün, kapsül bölmesinin üzerindeki alanda dönmesine bağlı olarak bir vızıldama sesiduymalısınız. Eğer bu vızıldama sesiniduymazsanız, kapsül bölmesini açınız ve kapsülün,kapsül bölmesinde sıkışıp sıkışmadığını kontrolediniz. Daha sonra 7. basamağı tekrarlayınız.Kapsülü sıkıştığı yerden kurtarmak için düğmeleretekrar BASMAYINIZ._8. Cihazın içerisinden nefes aldıktan sonra,nefesinizi rahatsız olmayacak şekilde tutunuz vecihazı ağızdan çıkarınız. Sonra burnunuzdannefes veriniz. Kapsül bölmesini açınız vekapsülde toz kalıp kalmadığını kontrol ediniz.Eğer kalmış ise 6-8. işlemleri tekrarlayınız 9. Tüm tozu kullandıktan sonra kapsül bölmesiniaçınız (Bkz. basamak 2). Boş kapsülü çıkarınızve içeride kalan tozları temizlemek için kurubir kağıt mendil ya da yumuşak bir fırçakullanınız. Not: İnhalasyon cihazını temizlemek için SU KULLANMAYINIZ. 10. Önce ağızlığı, ardından kapağı kapatınız. 5/16 Özel popülasyonlara ilişkin ek bilgiler:Böbrek/Karaciğer yetmezliği:Formoterolün karaciğer veya böbrek yetmezliği olan hastalardaki kullanımına ilişkin klinik çalışma yapılmamıştır. Ancak, VENTOFOR'un böbrek ve karaciğer yetmezliği olan hastalarda kullanımındadoz ayarlaması gerektiği konusunda teorik bir sebep bulunmamaktadır. Pediyatrik popülasyon:VENTOFOR, 5 yaşından küçük çocuklara tavsiye edilmez. Geriyatrik popülasyon:VENTOFOR, 65 yaş ve üzerindeki hastalarda diğer yetişkinlerle aynı dozlarda kullanılabilir. 4.3. KontrendikasyonlarEtkin madde formoterole ya da içeriğindeki yardımcı maddelerden herhangi birine karşı aşırı duyarlılıkta kontrendikedir. 4.4. Özel kullanım uyarıları ve önlemleriFormoterol; astımlı hastalarda tek başına monoterapi olarak kullanılmamalıdır.VENTOFOR'un etkin maddesi formoterol, uzun etkili P2-adrenerjik agonistler sınıfına dahildir. Uzun etkili diğer bir P2 agonist olan salmeterol ile yapılan bir çalışmada, salmeterol ile tedavi edilen hastalarda plasebo grubu ile karşılaştırıldığında astım nedeniyle ölüm oranının daha yüksek olduğu gözlemiştir (sırasıyla 13/13176 ve 3/13179). Astımla ilişkili ölüm oranınınVENTOFOR ile artıp artmadığına dair yeterli çalışma yürütülmemiştir. Uzun etkili beta agonistpreparatlarına bağlı olarak nadiren, ciddi ve bazen ölümcül olabilen astım ile ilgili solunumproblemleri meydana gelebilir. VENTOFOR başka bir uzun etkili beta2-agonist ile birlikte kullanılmamalıdır. VENTOFOR, astımda ilk tedavi seçeneği olarak kullanılmamalıdır. VENTOFOR, hafif astım hastalığının başlangıç tedavisi olarak önerilmez. Uzun etkili beta agonistler astım semptom kontrolünü sağlayan en kısa süre boyunca kullanılmalı ve astım kontrolüne ulaşıldığında eğer mümkünse kullanımları durdurulmalıdır.Sonrasında hastaların kontrol edici bir tedaviyle idamesi sağlanmalıdır. Antiinflamatuvar tedavi : Astım hastalarını tedavi ederken uzun etkili bir beta2 agonist (LABA) olan VENTOFOR, tek başına bir inhale kortikosteroid ile yeterli düzeyde kontrol edilemeyen ya da hastalığının şiddetibir LABA ve inhale kortikosteroidin her ikisi ile tedavinin başlatılmasını kesin olarak gerektirenhastalarda bir inhale kortikosteroide ilave tedavi olarak kullanılmalıdır. İnhale kortikosteroid ile uzun etkili beta2 agonistin ayrı kullanılmasının gerekli olduğu durumlar dışında 5-12 yaş arası çocuklarda, inhale kortikosteroid ile uzun etkili beta2 agonist (LABA)içeren bir kombinasyon preparatla tedavi uygulanması tavsiye edilir (bkz. Bölüm 4.2. ve 4.8).İnhale kortikosteroide ek olarak uzun etkili beta agonist kullanan pediyatrik ve adolesan 6/16 hastalarda, her iki ilaca uyumu garanti altına almak için, hem inhale kortikosteroid hem de uzun etkili beta agonist içeren bir kombinasyon preparatı kullanılması önerilir. VENTOFOR reçete edildiğinde hastalar aldıkları antiinflamatuvar tedavinin yeterliliği açısından değerlendirilmelidirler. Hastalara, VENTOFOR almaya başladıktan sonra, belirtilerde düzelmeolduğunda bile antiinflamatuvar tedaviye değişiklik yapmaksızın devam etmeleri öğütlenmelidir. Günlük VENTOFOR dozu, önerilen maksimum dozu aşmamalıdır. Astım semptomları kontrol altına alındıktan sonra, VENTOFOR dozunun kademeli olarak azaltılması düşünülmelidir. Tedavinin azaltılması sırasında hastalar yakından izlenmeli veVENTOFOR etkili en düşük dozda kullanılmalıdır. Astım atakları: VENTOFOR ile yapılan klinik çalışmalar, VENTOFOR kullanan hastalarda (özellikle 5-12 yaş arası hastalarda) ciddi astım ataklarının sıklığının plasebo alanlara göre daha yüksek olduğunudüşündürmüştür (bkz. Bölüm 4.8). Bu çalışmalar, ciddi astım alevlenme oranları açısından tedavigrupları arasındaki farkların doğru olarak ölçülmesine imkan vermemektedir. Semptomlar devam ettiği takdirde ya da semptomların kontrol edilebilmesi için gereken VENTOFOR dozlarının sayısı arttığı takdirde, doktorlar böyle bir gelişmenin genellikle altta yatandurumun kötüleştiğini gösteriyor olması nedeniyle kullanılan astım tedavisini yenidendeğerlendirmelidir. Astım alevlenmesi esnasında VENTOFOR tedavisine başlanmamalı ya da doz artırılmamalıdır. Hastalar alevlenme döneminde ise ya da önemli ölçüde veya akut olarak kötüye giden astımşikayetleri varsa, uzun etkili beta agonistlerle tedaviye başlanmamalıdır. VENTOFOR, akut astım semptomlarının rahatlatılması için kullanılmamalıdır. Akut ataklarda kısa etkili bir beta2-agonist kullanılmalıdır. Hastalar, astımları aniden kötüleştiği takdirde tıbbi tedavialmaları gerektiği konusunda bilgilendirilmelidir. Eşlik eden şartlar : VENTOFOR kullanan hastalarda aşağıdaki durumların varlığında, özellikle doz sınırları konusunda olmak üzere, özel dikkat ve denetleme gereklidir: İskemik kalp hastalığı, kardiyak aritmiler (özellikleüçüncü derece atriyoventriküler blok), şiddetli kardiyak dekompansasyon, idiyopatik subvalvüleraortik stenoz, şiddetli hipertansiyon, anevrizma, feokromositoma, hipertrofik obstrüktifkardiyomiyopati, tirotoksikoz, QT aralığında bilinen veya şüphe edilen uzama (QTc > 0.44 saniye;bkz. Bölüm 4.5). Daha önceden kardiyak problemleri bulunan ve teofilin ile formoterol'ü bir arada kullanan hastalarda dikkatli olunmalıdır. VENTOFOR dahil beta2 uyarıcıların hiperglisemik etkileri nedeniyle, diyabetik hastalarda VENTOFOR tedavisi başlatıldığında kan glukoz değerlerinin izlenmesi tavsiye edilir. Hipokalemi : VENTOFOR dahil beta2-agonist tedavisi sonucunda ciddi hipokalemi görülebilir. Hipokalemi, kardiyak aritmilere duyarlılığı artırabilir. Hipoksi ve birlikte uygulanan tedavi hipokalemiyişiddetlendirebileceğinden, şiddetli astımlı hastalarda özel bir dikkat önerilir (bkz. Bölüm 4.5). Böyledurumlarda serum potasyum düzeylerinin izlenmesi tavsiye edilir. 7/16 Paradoksal bronkospazm : Diğer inhalasyon tedavilerinde olduğu gibi paradoksal bronkospazm ihtimali akılda tutulmalıdır. Böyle bir durum görüldüğünde, VENTOFOR tedavisi derhal kesilmeli ve alternatif tedavibaşlatılmalıdır. Formoterol gibi uzun etkili beta2-agonistler kullanılırken, özellikle astım ile ilgili advers olaylar bakımından, bu ilaç başlandıktan sonra ilk üç ay hastalar yakından takip edilmelidir. 4.5. Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleriDiğer beta2-agonistleri gibi VENTOFOR da; kinidin, disopiramid, prokainamid, fenotiyazinler, antihistaminikler, makrolidler, monoamin oksidaz inhibitörleri ve trisiklik antidepre sanlar gibiilaçlarla veya QTc aralığını uzattığı bilinen herhangi bir ilaçla birlikte dikkatli kullanılmalıdır.Çünkü bu ilaçlar, adrenerjik agonistlerin kardiyovasküler sistem üzerindeki etkilerinigüçlendirebilir. QTc-aralığını uzattığı bilinen ilaçlara ventriküler aritmi eşlik etme riski artar(bkz. Bölüm 4.4). Diğer sempatomimetik maddelerin birlikte verilmesi, VENTOFOR'un istenmeyen etkilerini güçlendirebilir. Atomoksetin formoterolden kaynaklanan taşikardiyi artırabilir. Ksantin türevleri, steroidler veya diüretikler ile birlikte tedavi beta2-agonistlerin muhtemel hipokalemik etkisini kuvvetlendirebilir (bkz. Bölüm 4.4). Halojenli hidrokarbonlarla eşzamanlı anestezi alan hastalarda aritmi riski artmaktadır. Beta-adrenerjik blokerler VENTOFOR'un etkisini zayıflatabilirler veya antagonize edebilirler. Bu yüzden VENTOFOR, zorunlu olmadıkça, beta-adrenerjik blokerler (göz damlaları dahil) ilebirlikte verilmemelidir. Formoterol, beta-blokerlerin (betal-selektif) bradikardik etkisini azaltabilir. Antikolinerjik ilaçlar formoterolün bronkodilatör etkisini artırabilir. Özel popülasyonlara ilişkin ek bilgilerÖzel popülasyonlara ilişkin hiçbir klinik etkileşim çalışması yürütülmemiştir. Pediyatrik popülasyon:4.6. Gebelik ve laktasyonGenel tavsiyeGebelik kategorisi: C Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)Çocuk doğurma potansiyeli bulunan kadınlar için VENTOFOR tedavisi sırasında özel bir gereklilik bulunmamaktadır. Eğer gebelik tespit edilirse, devam eden VENTOFOR tedavisininalternatif tedavilere karşı yarar/risk oranı değerlendirilmelidir. 8/16 Gebelik dönemiVENTOFOR, gerekli olmadıkça gebelik döneminde kullanılmamalıdır. VENTOFOR'un gebelik döneminde emniyeti henüz tespit edilmemiştir. Daha güvenli bir alternatif olduğu takdirde gebelik dönemi (özellikle hamileliğin sonunda ve doğum esnasında)süresince kullanımından kaçınılmalıdır. Diğer beta2-adrenerjik uyarıcılar gibi formoterol deuterus düz kası üzerine gevşetici etkisi nedeniyle, doğum sürecini baskılayabilir. Hayvandeneylerinde teratojenik etki görülmemiştir. Oral verildikten sonra formoterol emziren sıçanlarınsütünde tespit edilmiştir. Hamilelikte sadece anneye sağlayacağı yarar, fetusa olabilecek riskten daha fazlaysa kullanılmalıdır. Laktasyon dönemiVENTOFOR'un emzirme döneminde emniyeti henüz tespit edilmemiştir. Ancak, VENTOFOR kullanan anneler emzirmemelidir. Formoterolün insan sütüne geçip geçmediği bilinmemektedir.Etkin madde emziren sıçanların sütünde tespit edilmiştir. Üreme yeteneği/FertiliteBölüm 5.3'e bakınız. 4.7. Araç ve makine kullanımı üzerindeki etkilerBaş dönmesi veya buna benzer yan etkiler gelişen hastalara, araç veya makine kullanmamaları önerilmelidir. 4.8. İstenmeyen etkilerCiddi astım atakları: Formoterol ile uygulanan en az 4 haftalık plasebo-kontrollü klinik çalışmalar, formoterol alan hastalarda ciddi astım ataklarının sıklığının (günde iki kez 10-12 mikrogram için %0.9, günde ikikez 24 mikrogram için %1.9) plasebo alanlardakine (%0.3) göre daha yüksek olduğunudüşündürmüştür (özellikle 5 - 12 yaş arası hastalarda). Astımlı adolesan ve yetişkin hastalardaki deneyimler: ABD'de ruhsatlandırma için yapılan ve 12 yaş ve üstü toplam 1095 hastanın katıldığı 12 haftalık iki önemli kontrollü çalışmada, ciddi astım ataklarının (astımın hastanın hastaneye yatırılmasınıgerektiren akut kötüleşmesi) günde iki kez verilen formoterol 24 mikrogram uygulamasında(9/271, %3.3) günde iki kez verilen formoterol 12 mikrogram uygulamasına (1/275, %0.4),plaseboya (2/277, %0.7) ya da albuterole (2/272, %0.7) göre daha sık ortaya çıktığı gözlenmiştir. Bu gözlemi araştırmak amacıyla daha sonra yapılan ve 2085 hastanın katıldığı bir klinik çalışmada, yüksek ve düşük doz gruplarında astımla ilgili ciddi advers olaylar karşılaştırılmıştır.16 hafta süren bu klinik çalışmada elde edilen sonuçlar, formoterol dozuyla açık bir ilişkigöstermemiştir. Bu çalışmada, ciddi astım ataklarının görüldüğü hastaların yüzde oranınınformoterol'de plaseboya göre biraz yüksek olduğu görülmüştür (üç çift-kör tedavi grubu için:formoterol 24 mikrogram günde iki kez (2/527, %0.4), formoterol 12 mikrogram günde iki kez(3/527, %0.6) ve plasebo (1/514, %0.2) ve açık-etiketli tedavi grubu için: formoterol 12mikrogram günde iki keze ilave olarak ayrıca günde en fazla iki ek doz (1/517, %0.2). 9/16 5 yaş ve üzerindeki astımlı çocuklardaki deneyimler: Günde iki kez verilen formoterol 12 mikrogram dozun günde iki kez verilen formoterol 24 mikrogram doza ve plaseboya göre güvenliliği; günlük bronkodilatör ve antienflamatuvartedaviye ihtiyaç duyan astım hastası 518 çocuğun (5-12 yaş arasındaki) katıldığı 52 haftalık, çokmerkezli, randomize, çift-kör büyük bir çalışmada araştırılmıştır. Günde iki kez formoterol 24mikrogram (11/171, %6.4) ya da günde iki kez formoterol 12 mikrogram alan (8/171, %4.7)çocuklarda görülen ciddi astım ataklarının plasebo alan çocuklardakine (0/176, %0.0) göre dahafazla olduğu görülmüştür. Diğer istenmeyen etkiler: Advers ilaç reaksiyonları, en sık görülen advers reaksiyon ilk sırada olacak şekilde sıklıklarına göre aşağıda sıralanmıştır. Her sıklık grubunda advers reaksiyonlar azalan ciddiyet derecesinegöre sıralanmıştır. Advers ilaç reaksiyonları MedDRA'daki sistem organ sınıflarına görelistelenmektedir. Her bir sistem organ sınıfı içinde advers ilaç reaksiyonları azalan ciddiyetsırasına göre sunulmaktadır: Çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1.000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahminedilemiyor). Bağışıklık sistemi hastalıklarıÇok seyrek: Aşırı duyarlılık (hipotansiyon, ürtiker, anjiyonörotik ödem, kaşıntı, egzantem dahil). Psikiyatrik hastalıklarıYaygın olmayan: Ajitasyon, anksiyete, asabiyet, uykusuzluk. Yaygın olmayan: Baş dönmesi. Çok seyrek: Tat alma duyusu bozuklukları. Sinir sistemi hastalıklarıYaygın: Baş ağrısı, titreme. Kardiyak hastalıklarıYaygın: Palpitasyonlar. Yaygın olmayan: Taşikardi. Çok seyrek: Periferik ödem. Solunum, göğüs bozuklukları ve mediastinal hastalıklarıYaygın olmayan: Paradoksal bronkospazm dahil bronkospazm, boğaz irritasyonu, akut astım alevlenmesi. 10/16 Gastrointestinal hastalıklarıÇok seyrek: Bulantı. Kas-iskelet bozukluklar, bağ doku ve kemik hastalıklarıYaygın olmayan: Kas krampları, miyalji. Pazarlama sonrası spontan bildirimlerden elde edilen istenmeyen etkilerFormoterol ile tedavi edilen hastalarda aşağıdaki pazarlama sonrası advers ilaç reaksiyonları bildirilmiştir. Bu reaksiyonlar büyüklüğü kesin olmayan bir popülasyondan isteğe bağlı olarakbildirilmiş olduğundan, güvenilir bir şekilde sıklığı belirlemek mümkün değildir; dolayısıylabilinmiyor olarak kategorize edilmiştir. Metabolizma ve beslenme hastalıklarıBilinmiyor: Hipokalemi, hiperglisemi. Kardiyak hastalıklarBilinmiyor: Elektrokardiyogramda QT uzaması, anjina pektoris, atriyal fibrilasyon gibi kardiyak aritmiler, ventriküler ekstrasistol, taşiaritmi. Solunum, göğüs bozuklukları ve mediastinal hastalıklarBilinmiyor: Öksürük. Deri ve deri altı doku hastalıklarıBilinmiyor: Deri döküntüsü. AraştırmalarBilinmiyor: Kan basıncında artış (hipertansiyon dahil). Şüpheli advers reaksiyonların raporlanmasıRuhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesineolanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu TürkiyeFarmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr[email protected]; tel: 0 800 314 00 08; faks: 0 312 218 35 99)4.9. Doz aşımı ve tedavisiBelirtiler: VENTOFOR'un aşırı dozuna bağlı olarak beta2-adrenerjik uyarıcıların tipik etkilerinin görülmesi beklenir: bulantı, kusma, baş ağrısı, tremor, sedasyon, palpitasyonlar, taşikardi,ventriküler aritmiler, metabolik asidoz, hipokalemi, hiperglisemi, hipertansiyon. Tedavi: Destekleyici ve semptomatik tedavi uygulanır. Ciddi vakalarda hastalar hastaneye yatırılmalıdır. 11/16 Kardiyoselektif beta-blokerlerin kullanılması düşünülebilir, fakat beta-adrenerjik bloker kullanımı bronkospazma neden olabileceğinden bu tedavi yalnızca doktor gözetimi altında veçok dikkatli uygulanmalıdır. 5. FARMAKOLOJİK ÖZELLİKLER5.1. Farmakodinamik özelliklerFarmakoterapötik grup: Selektif beta 2 adrenoseptör agonisti ATC kodu: R03AC13 Formoterol güçlü, seçici bir beta2-adrenerjik uyarıcıdır. Geri dönüşlü soluk yolu tıkanmaları olan hastalarda bronkodilatör bir etki gösterir. Etkisi çabuk (1-3 dakika içinde) başlar veinhalasyondan 12 saat sonra hala belirgindir. Terapötik dozlarda kardiyovasküler etkileriönemsizdir ve ara sıra görülür. Formoterol, pasif olarak duyarlı hale getirilen insan akciğerlerinden lökotrienlerin ve histaminin salıverilmesini inhibe eder. Hayvanlarda yapılan deneylerde; ödemin ve iltihap hücrelerinintoplanmasının inhibisyonu gibi bazı antiinflamatuvar özellikler gözlenmiştir. Kobay trakeasındaki in vitroçalışmalar; rasemik formoterolün ve bunun (R,R)- ve (S,S)-enantiomerlerinin, ileri derecede selektif beta2-adrenoseptör agonistleri olduklarını göstermiştir. (R,R)-enantiomerden 800-1000 kat daha az potent olan (S,S)-enantiomeri, (R-R)-enantiomerintrakea düz kası üzerindeki aktivitesini etkilemez. Enantiomerlerden herhangi birinin rasemikkarışıma tercih edilmesini gerektirecek herhangi bir farmakolojik neden yoktur.İnsanda inhale edilen alerjenlerin, egzersizin, soğuk hava, histamin veya metakolinin neden olduğu bronkospazmı önlemede formoterol'ün etkili olduğu gösterilmiştir. İnhalasyon cihazı ile günde iki defa 12 mikrogram ve günde iki defa 24 mikrogram dozlarda inhale edilen formoterolün, stabil amfizem ve kronik bronşit hastalığı olan hastalarda hızlı etkiile bronkodilatasyon sağladığı, etkisinin en az 12 saat sürdüğü ve Saint George Solunum YollarıAnketi sonucuna göre yaşam kalitesi açısından kişisel faydayı beraberinde getirdiğigösterilmiştir. 5.2. Farmakokinetik özelliklerGenel özelliklerVENTOFOR'un terapötik doz aralığı günde iki kez 12-24 mikrogramdır. Formoterolün plazma farmakokinetiği verileri sağlıklı gönüllülerde önerilen doz aralığından daha yüksek dozlar veamfizem ve kronik bronşit hastalarında terapötik dozların inhale edilmesi ile derlenmiştir.İdrarda saptanan ve sistemik maruziyetin dolaylı bir göstergesi olarak kullanılan değişimeuğramamış formoterol düzeyleriyle, plazmadaki ilaç farmakokinetiği verileri arasında korelasyonvardır. İdrar ve plazma için hesaplanan eliminasyon yarı ömürleri birbirine yakındır. Emilim:Sağlıklı gönüllülerde formoterol fumaratın 120 mikrogramlık tek bir doz inhalasyonunu takiben, formoterol hızla plazmaya geçerek inhalasyonu izleyen 5 dakika içerisinde, maksimumkonsantrasyon olan 266 pmol/l'ye ulaşmıştır. 12 hafta boyunca günde iki defa 12 veya 24 12/16 mikrogram formoterol fumarat ile tedavi edilen amfizem ve kronik bronşit hastalarında inhalasyondan 10 dakika, 2 saat ve 6 saat sonraki ortalama plazma formoterol konsantrasyonları;sırasıyla 11.5-25.7 ve 23.3-50.3 pmol/l arasında değişmiştir. Formoterolün ve/veya (R,R) ve (S,S) enantiomerlerinin kümülatif üriner itrahını araştıran çalışmalar, dolaşımdaki formoterol miktarının inhale edilen doz ile orantılı olarak arttığınıgöstermiştir (12- 96 mikrogram). 12 hafta süreyle günde 2 defa 12 mikrogram veya 24 mikrogram inhalasyonundan sonra idrarla atılan, değişikliğe uğramamış formoterol düzeyleri, astım hastalarında %63 ve %73 (ilk dozlason doz karşılaştırıldığında), amfizem ve kronik bronşit hastalarında %19 ve %38 arasındadeğişen oranlarda yükselmiştir. Bu veriler, tekrarlanan dozlarda kullanılan formoterolünplazmada sınırlı olarak biriktiği izlenimini vermektedir. Tekrarlayan dozlardan sonraenantiomerlerden birinin, diğerinden daha fazla biriktiğine tanık olunmamıştır. İnhale edilen diğer ilaçlar için bildirildiği üzere inhaler aracılığıyla kullanılan formoterol dozunun çok büyük bölümü yutulmakta ve daha sonra gastrointestinal kanaldan emilmektedir.3H ile işaretlenmiş 80 mikrogram formoterolün, iki gönüllüye oral olarak verilmesinin ardındandozun en az %65'i emilmiştir. Dağılım:Formoterolün plazma proteinlerine bağlanma oranı %61-64'tür. Bunun önemli bir kısmı (%34) insan serum albüminine bağlanır. Terapötik dozlar ile erişilen konsantrasyon aralığındabağlanma yerlerinde doyma olmaz. Biyotransformasyon:Formoterol başlıca metabolizma ile elimine edilir; doğrudan glukuronidasyon biyotransformasyonun ana yoludur. Glukuronidasyonun izlediği O-demetilasyon, diğer birbiyotransformasyon yoludur. Formoterolün sülfat konjügasyonu ve ardından yine sülfatkonjügasyonun gerçekleştiği deformilasyon, minör metabolik yollardır. Formoterolünglukuronidasyonunda (UGT1A1, 1A3, 1A6, 1A7, 1A8, 1A9, 1A10, 2B7 ve 2B15) ve O-demetilasyonunda (CYP2D6, 2C19, 2C9 ve 2A6) çok sayıda izoenzimin katalizör rolünüoynuyor olması; formoterol metabolizmasındaki spesifik bir izoenzimin inhibisyonu üzerindenilaç-ilaç etkileşim potansiyelinin düşük olduğu izlenimini vermektedir. Terapötik dozlarla eldeedilen konsantrasyonlardaki formoterol, sitokrom P450 izoenzimlerini inhibe etmemiştir veyaindüklememiştir. Eliminasyon:12 hafta boyunca günde 2 defa 12 veya 24 mikrogram formoterol fumaratla tedavi edilen astım ve amfizem ve kronik bronşit hastalarında, verilen dozun sırasıyla yaklaşık %10'u ve %7'sideğişikliğe uğramamış olarak idrarda saptanmıştır. İdrardaki, değişikliğe uğramamışformoterolün; 12-120 mikrogram arasında değişen tek dozların verildiği sağlıklı gönüllülerdekive tek ve tekrarlanan dozlar kullanan astım hastalarındaki %40'ının (R-R), %60'ının (S,S)-enantiomeri olduğu görülmüştür. İlaç ve metabolitleri vücuttan tamamen atılırlar; bir oral dozun yaklaşık 2/3'si idrarla ve 1/3'i feçesle atılır. Kandaki formoterolün renal klerensi 150 mL/dakikadır. 13/16 Sağlıklı gönüllülerde 120 mikrogram tek doz formoterol fumarat inhalasyonundan sonra, idrarla atılma oranlarından hesaplanan, plazmadaki eliminasyon yarı-ömrü, formoterolde 10 saat; (R,R)ve (S,S)- enantiomerlerinde ise sırasıyla 13.9 ve 12.3 saat ölçülmüştür. Doğrusallık / Doğrusal olmayan durum:Doğrusallık / doğrusal olmayan durum hakkında mevcut veri bulunmamaktadır. Hastalardaki karakteristik özelliklerKaraciğer/böbrek yetmezliği:Formoterolün karaciğer veya böbrek yetmezliği bulunan hastalardaki farmakokinetiği incelenmemiştir. Pediyatrik popülasyon:5-12 yaş grubundaki astımlı çocuklara 12 hafta boyunca inhalasyon yoluyla günde iki defa 12 veya 24 mikrogram formoterol fumarat verilerek yapılan bir çalışmada; değişime uğramaksızın idrarlaatılan formoterol miktarı, ilk dozdan sonrakine kıyasla %18 ile %84 arasında değişen orandaartmıştır. Çocuklardaki birikim, erişkin hastalardakinden farklı olmamış ve %63 ile %73 arasındadeğişen bir oranda artmıştır (bkz. Emilim). İncelenen çocuklarda verilen formoterol dozununyaklaşık %6'sı, değişmemiş formoterol olarak idrarda bulunmuştur. Geriyatrik popülasyon:Formoterolün yaşlı hastalardaki farmakokinetiği incelenmemiştir. Cinsiyet:Formoterol farmakokinetiği, hastaların kilosuna göre düzeltildikten sonra, erkeklerle kadınlar arasında, istatistik anlama sahip fark göstermemiştir. 5.3. Klinik öncesi güvenlilik verileriMutajenisite: Deneysel bitiş noktaları geniş bir alanı kapsayan mutajenik etki testleri yapılmış; hiç bir in vitroin vivotestte genotoksik etki bulunmamıştır.Karsinojenisite: Sıçanlarda ve farelerde yapılan iki yıllık çalışmalarda, herhangi bir karsinojenik potansiyel görülmemiştir. Çok yüksek dozlarla muamele edilmiş erkek farelerde selim adrenal subkapsülerhücre tümörleri görülme sıklığı hafifçe yüksek bulunmuştur. Ancak bu bulgu, yüksek dozlardadişi genital organındaki selim düz kas tümörlerinin ve her iki cinsiyette görülen karaciğertümörlerinin görülme sıklığında artış şeklinde patolojik değişikliklerin olduğu ikinci bir fareçalışmasında görülmemiştir. Çeşitli doz aralıklarında sıçanlarda yapılan iki çalışmada, mezovariyal leyomiyomlarda artış görülmüştür. Bu selim neoplazmalar sıçanların beta2-adrenerjik ilaçların yüksek dozları ile uzunsüreli tedavisinde genellikle görülürler. Over kistleri ve selim granulosa/tekal hücreli tümörlerdede artış görülmüştür; beta-agonistlerin sıçanlarda overlere, çok muhtemelen kemiricilere hasolan, etkileri olduğu bilinmektedir. Daha yüksek dozların kullanıldığı birinci çalışmada bildirilendiğer birkaç tip tümör, kontrol grubundakilere benzer sıklıkta görülmüş ve daha düşük dozkullanılan çalışmalarda görülmemiştir. 14/16 Tümör sıklıklarının hiçbiri ikinci çalışmada kullanılan en düşük doz (insanlarda formoterolün tavsiye edilen maksimum dozundan beklenenden 10 kat daha yüksek sistemik düzeye yol açanbir doz) da istatistiksel olarak anlamlı bir dereceye yükselmemiştir. Bu bulgulara ve mutajenik potansiyelinin olmamasına dayanarak, formoterolün terapötik dozlarda kullanımının karsinojenik bir riski olmadığı hükmüne varılmıştır. 6. FARMASÖTİK ÖZELLİKLER6.1. Yardımcı maddelerin listesiYarı mikronize laktoz monohidrat (inek sütü) Mikronize laktoz monohidrat (inek sütü) Jelatin (sığır) 6.2. GeçimsizliklerBilinen geçimsizlikleri yoktur. 6.3. Raf ömrü24 ay 6.4. Saklamaya yönelik özel tedbirler25°C'nin altındaki oda sıcaklığında saklanmalıdır. 6.5. Ambalajın niteliği ve içeriğiPVC/PVDC/Al blister içinde 30, 60 inhaler kapsül ve inhalasyon aleti, kullanma talimatı ile birlikte sunulmaktadır. 6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemlerKullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıkları Kontrolü Yönetmeliği'ne uygun olarak imha edilmelidir. 7. RUHSAT SAHİBİBİLİM İLAÇ SAN. ve TİC. AŞ. Kaptanpaşa Mah. Zincirlikuyu Cad. No:184 34440 Beyoğlu-İSTANBULTel: +90 (212) 365 15 00Faks: +90 (212) 276 29 19 8. RUHSAT NUMARASI117/17 9. İLK RUHSAT TARİHİ/RUHSAT YENİLEME TARİHİ15/16 İlk ruhsatlandırma tarihi: 24.12.2004 Ruhsat yenileme tarihi:03.12.2010 10. KÜB'ün YENİLENMME TARİHİ:
16/16 |
Ana Sayfa | Hakkımızda | İlaçlar | İlaç Ara | İlaç Firmaları | Gizlilik | Bize Ulaşın
Telif Hakkı 2008-2026 © İlaç Prospektüsü. Tüm Hakları Saklıdır.Uyarı: Sitemizde yayınladığımız ilaç bilgileri ile doktora danışmadan kesinlikle ilaç kullanmayınız!
Aksi halde doğabilecek sağlık sorunlarından ilacprospektusu.com sorumlu tutulamaz.